브라키테라피
Brachytherapy| 브라키테라피 | |
|---|---|
 화살표는 전립선암 치료에 사용되는 브라키테라피 구슬을 가리킨다. | |
| 기타 이름 | 내부 방사선 치료, 밀봉된 소스 방사선 치료, 큐리테라피, 엔암호테라피 |
| ICD-10-PCS | D?1 |
| ICD-9-CM | 92.27 |
| 메슈 | D001918 |
브라키테라피는 봉인된 방사선원을 치료가 필요한 부위 안이나 옆에 배치하는 방사선 치료의 일종이다.Brachy는 한마디로 그리스어다.브라키테라피는 일반적으로 자궁경부, 전립선, 유방, 식도 및 피부암에 효과적인 치료법으로 사용되며 다른 많은 신체 부위의 종양 치료에도 사용될 수 있다.[1]치료 결과는 브라키테라피의 암치환율이 수술 및 외부 빔 방사선치료(EBRT)에 비견되거나 이러한 기법과 결합하여 사용할 경우 개선된다는 것을 입증했다.[2][3][4]브라키테라피는 단독으로 또는 수술, EBRT, 화학요법과 같은 다른 치료법과 함께 사용될 수 있다.
브라키테라피는 치료용 방사성핵종(방사선)을 인체에 주입해 파괴가 필요한 조직에 화학적으로 국소화하는 봉인되지 않은 선원 방사선치료와 대비된다.또한 고에너지 X선(또는 코발트-60과 같은 방사성 동위원소의 감마선)이 체외에서 나오는 종양을 향하도록 하는 외부 빔 방사선 치료법(EBRT)과도 대비된다.대신 브라키테라피는 암 종양 현장에 직접 단거리 방사선 소스(예를 들어 방사성동위원소, 요오드-125 또는 세슘-131)를 정확하게 배치하는 것을 포함한다.이것들은 보호 캡슐이나 철사로 둘러싸여 있어, 전리방사선이 빠져나와 주변 조직을 치료하고 죽일 수 있게 하지만 방사성 이소토프의 전하가 체액에서 이동하거나 용해되는 것을 막는다.캡슐은 나중에 제거하거나 (일부 방사성 동위원소와 함께) 제자리에 유지될 수 있다.[1]: Ch. 1 [5]
브라키테라피의 특징은 방사선 조사가 방사선원 주변의 매우 국부적인 영역에만 영향을 미친다는 것이다.그러므로 선원에서 멀리 떨어진 건강한 조직의 방사선에 대한 피폭은 감소한다.또한 치료 중 환자가 움직이거나 체내 종양의 움직임이 있는 경우 방사선원은 종양과 관련하여 정확한 위치를 유지한다.이러한 브라키테라피 특성은 EBRT보다 장점을 제공한다 – 종양은 주변 건강한 조직에 불필요한 손상의 확률을 줄이면서 매우 많은 양의 국소 방사선으로 치료될 수 있다.[1]: Ch. 1 [5]
브라키테라피 과정은 다른 방사선 치료 기술에 비해 짧은 시간에 끝낼 수 있다.이것은 암세포가 생존할 기회를 줄여 각 방사선 치료선량 사이의 간격에 따라 분열하고 성장할 수 있는 기회를 감소시킬 수 있다.[5]환자들은 일반적으로 EBRT에 비해 방사선 치료 클리닉을 덜 방문해야 하며 외래 환자로 치료를 받을 수 있다.이것은 많은 환자들이 접근 가능하고 편리하게 치료할 수 있게 해준다.[6][7]이러한 브라키테라피의 특징은 대부분의 환자들이 브라키테라피 시술을 매우 잘 견딜 수 있다는 것을 의미한다.
2013년 세계 브라키테라피 시장은 6억 8천만 달러에 달했고, 이 중 고선량률(HDR)과 LDR 부문이 70%를 차지했다.마이크로스피어와 전자 브라키테라피가 나머지 30%[8]를 차지했다.한 분석은 브라키테라피 시장이 2030년에 24억 달러를 넘어섰으며, 주로 마이크로스피어 시장뿐만 아니라 사용자 친화적인 기술로 전 세계적으로 큰 관심을 얻고 있는 전자 브라키테라피에 의해 연간 8%의 성장세를 보일 수 있다고 예측한다.[9]
의학적 용법
브라키테라피는 자궁경부암, 전립선암, 유방암, 피부암 치료에 흔히 쓰인다.[1]
Brachytherapy는 또한 뇌, 눈, 머리와 목 지역(입술, 입의 바닥, 혀, nasopharynx과 인두 중앙부)[10]호흡기 트랙트(기도와 기관지), 소화관(식도, 담낭, bile-ducts, 직장, 항문)[11]요로(방광, 요도, 음경), 여성 생식 지역(uteru의 종양의 치료에 사용될 수 있다.s, vagina, 외음부),[1] 그리고 부드러운 조직
방사선원을 종양 치료 현장에 정확하게 배치할 수 있기 때문에 브라키테라피는 작은 부위에 많은 양의 방사선을 적용할 수 있다.게다가, 방사선원은 표적 종양에 위치하거나 옆에 위치하기 때문에, 선원은 환자가 움직일 때 또는 신체 내에서 종양의 움직임이 있을 때 종양과 관련하여 그들의 위치를 유지한다.따라서 방사선원은 정확한 표적을 유지한다.이를 통해 임상의는 높은 수준의 선량 적합성을 달성할 수 있다. 즉, 종양 전체가 최적의 수준의 방사선을 공급받도록 보장한다.또한 종양 주위의 건강한 조직, 장기 또는 구조물의 손상 위험을 줄여줌으로써 장기 기능의 치료와 보존 가능성을 높인다.[12]
HDR 브라키테라피를 사용하면 EBRT에 비해 전반적인 치료 시간을 줄일 수 있다.[13][14]브라키테라피를 받는 환자는 일반적으로 EBRT에 비해 방사선 치료를 위한 방문 횟수가 적어야 하며, 전반적인 방사선 치료 계획을 짧은 시간 내에 완료할 수 있다.[15]많은 브라키테라피 시술은 외래환자에 의해 행해진다.이러한 편의성은 방사선 치료법에 접근하고 치료 계획을 준수하기 위해 특히 일을 해야 하는 환자, 고령 환자 또는 치료 센터로부터 어느 정도 거리를 두고 사는 환자에게 적절할 수 있다.치료 시간 단축과 외래 시술도 방사선 치료 클리닉의 효율을 높이는 데 도움이 될 수 있다.[16][17]
브라키테라피는 암이 전이되지 않았다면 암이 작거나 국소적으로 진행된 종양의 경우 암을 치료할 목적으로 사용될 수 있다.적절하게 선택된 경우에서 1차 종양에 대한 브라키테라피는 종종 수술에 대한 비교 가능한 접근방식을 나타내며, 동일한 치료 확률을 달성하고 유사한 부작용을 가지고 있다.[18][19]그러나 국지적으로 발달한 종양에서 수술은 일상적으로 최상의 치료 기회를 제공하지 못할 수 있고 종종 기술적으로 실행이 가능하지 않다.이러한 경우, 브라키테라피를 포함한 방사선치료는 치료의 유일한 기회를 제공한다.[20][21]더 발전된 질병 단계에서는 브라키테라피를 통증 및 출혈로부터 증상 완화를 위한 완화의 치료제로 사용할 수 있다.
종양이 쉽게 접근할 수 없거나 치료 부위에 대한 조사의 최적 분포를 보장하기에 너무 큰 경우, 브라키테라피를 EBRT 및/또는 수술과 같은 다른 치료와 결합할 수 있다.[1]: Ch. 1 화학요법만을 이용한 브라키테라피 치료는 드물다.[22]
자궁경부암
브라키테라피는 초기 또는 국소적으로 국한된 자궁경부암 치료에 일반적으로 사용되며 많은 국가에서 치료의 기준이 된다.[1]: Ch. 14 [23][24][25][26]자궁경부암은 LDR, PDR 또는 HDR 브라키테라피로 치료할 수 있다.[25][27][28]EBRT와 함께 사용되는 브라키테라피는 EBRT 단독보다 더 나은 결과를 제공할 수 있다.[2]브라키테라피의 정밀도를 통해 인접 조직과 장기에 대한 방사선 피폭을 최소화하면서 많은 양의 표적 방사선이 자궁경부로 전달될 수 있다.[24][25][29][30]
질병(질병 없는 생존)과 생존(전체 생존)의 가능성은 DDR, PDR, HDR 치료에서도 비슷하다.[21][31]그러나 HDR 치료의 주요 장점은 투여 시간이[2] 짧고 외래환자에 따라 각 투여량을 전달할 수 있어 많은 환자에게 보다 큰 편의를 제공할 수 있다는 것이다.
연구는 자궁경부의 국소적으로 발달한 암은 외부 빔 방사선치료(EBRT)와 뇌내 브라키테라피(ICBT)의 조합으로 치료되어야 한다는 것을 보여준다.[32]
전립선암
전립선암을 치료하기 위한 브라키테라피는 영구적인 LDR 씨앗 이식 또는 임시 HDR 브라키테라피로 제공될 수 있다.[1]: Ch. 20 [33][34]
영구 종자 이식술은 국소성 종양과 예후가[33][35][36][37] 좋은 환자에게 적합하며 암이 재발하지 않도록 매우 효과적인 치료법으로 판명되었다.[35][38]생존율은 EBRT나 수술(방사성 전립선 절제술)에서 발견되는 것과 비슷하지만 발기부전, 요실금 등 부작용이 적다.[39]시술은 빨리 마칠 수 있고 환자는 보통 치료 당일 귀가 후 1~2일이 지나면 정상 활동으로 복귀할 수 있다.[6]영구적인 종자 삽입술은 종종 전립선 제거술에 비해 덜 침습적인 치료법이다.[6]
일시적인 HDR 브라키테라피는 전립선암 치료에 대한 새로운 접근법이지만, 현재는 종자 이식보다 덜 흔하다.전립선 내 종양의 형태에 부합하는 고선량의 방사선치료를 제공하면서도 주변 조직에 대한 방사선 피폭을 줄이는 대안을 제시해 EBRT('부스트' 치료법) 외에 추가 선량을 제공하는 데 주로 사용된다.[4][34][36][40][41][42]전립선암을 촉진하는 HDR 브라키테라피는 또한 EBRT 코스가 단독으로 사용될 때보다 짧아질 수 있다는 것을 의미한다.[20][40][41][42]
유방암
방사선치료는 자궁내막수술이나 유방절제수술을 받은 여성의 진료기준으로 유방치유치료의 필수요소다.[1]: Ch. 18 [43]브라키테라피는 수술 후, 항암화학요법 전, 또는 만성질환의 경우 완화된 상태로 사용할 수 있다.[44]유방암 치료를 위한 브라키테라피는 보통 HDR 임시 브라키테라피로 이루어진다.수술 후 유방 브라키테라피는 EBRT를 이용한 전체 유방조사(WBI)에 이은 '부스트'로 활용할 수 있다.[43][45]더 최근에는, 브라키테라피 만이 원래 종양을 둘러싸고 있는 가까운 부위로만 방사선을 전달하는 APBI(가속된 부분 유방 조사)를 전달하는데 사용되고 있다.[43][45][46]
유방 브라키테라피의 주요 장점은 건강한 유방 조직과 늑골과 폐와 같은 기저 구조에 방사선을 비축하면서 종양에 고선량의 방사선을 정밀하게 적용할 수 있다는 것이다.[44]APBI는 일반적으로 일주일 동안 완료될 수 있다.[46]치료 센터에 쉽게 접근할 수 없는 노약자 또는 여성이 WBI에 비해 짧은 치료 과정으로 인해 유방치유 치료의 혜택을 받을 수 있도록 하는 데는 브라키테라피 옵션이 특히 중요할 수 있다(1-2개월 동안 더 많은 방문이 필요한 경우가 종종 있다).[7]
유방 브라키테라피를 전달하는데 사용할 수 있는 다섯 가지 방법이 있다.대상 국산화 및 HDR 소스를 위한 유방조영술과 유방조영술 간 요법, 뇌내조영제 유방조영술, 방사선 치료, 영구유방종자 이식 및 비침습적 유방조영술 요법.
중간 유방 브라키테라피
중간 유방 브라키테라피는 유방조직에 여러 개의 유연한 플라스틱 카테터를 임시로 배치하는 것을 포함한다.이것들은 주변 유방조직을 보호하면서 치료 부위에 방사선을 최적으로 조준할 수 있도록 세심하게 배치되어 있다.[7]카테터는 애프터 로더에 연결되어 치료 부위에 계획된 방사선량을 전달한다.중간 유방 브라키테라피는 EBRT 후 "부스트" 또는 APBI로 사용될 수 있다.[45]
수술 중 방사선 치료
수술 중 방사선 치료(IORT)는 종양을 제거하는 수술과 동시에 방사선을 전달한다.[47]종양 제거 후 남은 구멍에 어플리케이터를 놓고 이동형 전자기기가 방사선(X선[47] 또는 전자[48])을 생성해 어플리케이터를 통해 전달한다.방사선이 한꺼번에 전달되고 도포체가 제거된 후 절개를 닫는다.
내과성 유방 브라키테라피
내과성 유방 브라키테라피("풍선 브라키테라피"라고도 한다)는 종양 제거 후 남은 유방 공동에 단일 카테터를 배치하는 것을 포함한다.[7]카테터는 발광절제 또는 수술 후에 배치할 수 있다.[7]카테터를 통해 풍선은 캐비티에서 팽창된다.그런 다음 카테터는 애프터 로더에 연결되며, 이 애프터 로더는 방사선 선량을 카테터를 통해 풍선 안으로 전달한다.현재, 비위생적인 유방 브라키테라피는 일상적으로 APBI에만 사용되고 있다.[49]
또한 간간과 내과적 유방 브라키테라피(예: SABI)의 특징을 결합한 장치도 있다.이러한 기기는 여러 개의 카테터를 사용하지만 유방의 단일 입력 지점을 통해 삽입된다.연구에 따르면 다중 카테터를 사용하면 의사가 방사선을 더 정확하게 조준할 수 있다고 한다.[50][51]
영구유방종자 이식
영구유방종자 이식(PBSI)은 종양 부위를 둘러싸고 있는 유방에 많은 방사성 '씨앗'(작은 알갱이)을 이식하는데, 이는 영구종자 전립선 브라키테라피와 유사하다.[52]씨앗은 1시간에서 2시간 정도 한 번에 이식되며, 그 안에 있는 방사성 물질이 분해됨에 따라 다음 달에 걸쳐 방사선을 방출한다.임플란트로부터 다른 사람(예: 파트너/스푼)으로의 방사선 위험이 연구되었고 안전한 것으로 확인되었다.[52]
뇌종양
수술 표적 방사선 치료(START), 감마 브랜드타일 테라피는 뇌 안에서 사용하도록 특별히 고안된 브라키테라피 임플란트의 일종이다.감마틸은 새로 진단되고 작동 가능한 악성 뇌내 종양(뇌종양)과 뇌막내 종양(메닌기오마스, 전이, 고등급 글리오마, 교모블라스토마스)을 포함한 반복 가능한 뇌내 종양을 치료하기 위해 FDA가 허가한 것이다.[53]
임상 연구에서, 감마타일 테라피테라피는 부작용의 위험이 증가하지 않고 이전 동일 부위 치료와 비교해 국소 종양 조절을 개선했다.[54][55]
식도암
식도암 방사선 치료의 경우, 브라키테라피는 효과적인 치료를 위한 한 가지 선택사항으로, 확정적인 방사선 치료(부스트)[56][57] 또는 완화의 치료를 포함한다.[58][59]최종적인 방사선 치료(부스트)는 투여량을 정확하게 전달할 수 있으며, 이완 치료를 통해 난독증을 완화할 수 있다.직경이 큰 도포기나 풍선형 카테터를 애프터 로더와 함께 사용하여 식도를 확장하고 인근 정상조직의 스페어링으로 종양에 대한 방사선량 전달을 용이하게 한다.[60][61]
EBRT에 따른 브라키테라피나 수술은 식도암 환자만을 위한 수술이나 EBRT보다 생존율과 국소 재발률을 향상시킬 수 있다는 것이 밝혀졌다.[62][58]
피부암
기초 세포암, 편평한 세포암 등 녹지 않는 피부암에 대한 HDR 브라키테라피는 수술에 대한 대체 치료 옵션을 제공한다.이는 특히 코, 귀, 눈꺼풀 또는 입술에 있는 암과 관련이 있으며, 수술로 인해 손상되거나 광범위한 재구성이 필요할 수 있다.[1]: Ch. 28 방사선과 피부 사이의 긴밀한 접촉을 보장하기 위해 다양한 어플리케이터를 사용할 수 있으며, 이는 피부의 곡률에 부합하고 최적의 방사선량 전달을 보장한다.[1]: Ch. 28
HDR과 유사한 장점을 가진 또 다른 종류의 브라키테라피가 제공된다.그것은 기초 세포 또는 편평한 세포암을 치료하기 위해 Rhenium-188의 베타선 방출을 이용한다.방사선원은 병변 바로 위에 있는 얇은 보호 호일에 적용되는 화합물에 둘러싸여 있다.이렇게 하면 방사선원을 복잡한 위치에 적용할 수 있고 건강한 조직에 대한 방사선을 최소화할 수 있다.[63]
피부암에 대한 브라키테라피는 좋은 미용적 결과와 임상적 효과를 제공한다; 최대 5년의 추적 연구를 통해 브라키테라피가 국소 조절 측면에서 매우 효과적이며, EBRT에 필적한다는 것이 밝혀졌다.[64][65][66]치료 시간은 일반적으로 짧아서 환자에게 편의를 제공한다.[67]브라키테라피가 조만간 피부암 치료의 기준이 될 수 있다는 주장이 제기됐다.[67]
혈관
브라키테라피는 혈관에 카테터를 삽입하고 제거하는 관상동맥내 회복술 치료에 사용될 수 있다.[68]ISR(In stent restenosis, ISR) 치료에서 약물 용해 스텐트(DES)가 산내 브라키테라피(ICBT)보다 우수한 것으로 밝혀졌다.그러나 실패한 스텐트 및 정맥 이식에서 지속적인 회복에 대한 혈관 브라키테라피에 대한 관심은 계속되고 있다.또한 말초 혈관조영술 협착증[69] 치료에 사용하기 위해 이 치료법을 조사했으며 심방세동 치료에 고려했다.[70]
부작용
브라키테라피와 관련된 잠재적 급성, 아급성 또는 장기적 부작용의 가능성과 성질은 치료 중인 종양의 위치와 브라키테라피 사용 유형에 따라 달라진다.
급성
브라키테라피와 관련된 급성 부작용으로는 국소적인 멍, 붓기, 출혈, 이식 부위 내 배출 또는 불편함이 있다.이것들은 보통 치료가 끝난 후 며칠 안에 해결된다.[71]환자들은 또한 치료 후 짧은 기간 동안 피로를 느낄 수 있다.[71][72]
자궁경부암이나 전립선암에 대한 브라키테라피 치료는 요로유착, 요실금 또는 고통스러운 배뇨(디뇨리아)와 같은 급성 및 일시적 요로 증상을 유발할 수 있다.[39][73][74]일시적인 장 빈도 증가, 설사, 변비 또는 경미한 직장 출혈도 발생할 수 있다.[39][73][74]급성 및 아급성 부작용은 보통 며칠 또는 몇 주에 걸쳐 해결된다.전립선암에 대한 영구적(씨앗) 브라키테라피의 경우 일부 씨앗이 치료 부위에서 방광이나 요도로 옮겨져 소변으로 전달될 가능성이 작다.
피부암에 대한 브라키테라피 치료는 치료 후 몇 주 안에 치료 부위 주변의 피부 바깥 층이 벗겨지는 결과를 가져올 수 있으며, 일반적으로 5-8주 후에 치유된다.[1]: Ch. 28 암이 입술에 위치하면 브라키테라피로 인해 궤양이 생길 수 있지만 대개 4~6주 후에 완치가 된다.[75]
브라키테라피와 관련된 급성 부작용의 대부분은 약물치료나 식이 변화를 통해 치료할 수 있으며, 치료가 완료되면 대개 시간이 지남에 따라(일반적으로 몇 주간의 문제) 사라진다.HDR 브라키테라피의 급성 부작용은 대체로 EBRT와 유사하다.[72]
장기
소수의 사람들에서, 브라키테라피는 인접한 조직이나 장기의 손상이나 붕괴로 인해 장기적인 부작용을 일으킬 수 있다.장기적 부작용은 대개 자연적으로 온화하거나 보통이다.예를 들어 자궁경부암이나 전립선암에 대한 브라키테라피 치료의 결과로 비뇨기 및 소화기 문제가 지속될 수 있으며, 지속적인 관리가 필요할 수 있다.[39][73][74]
전립선암에 대한 브라키테라피는 약 15-30%의 환자에게 발기부전을 일으킬 수 있다.[1]: Ch. 20 [76]그러나 발기부전의 위험은 나이(나이든 남성이 젊은 남성보다 더 큰 위험)와 관련이 있으며, 또한 브라키테라피를 받기 전의 발기부전 기능 수준과도 관련이 있다.발기부전을 경험한 환자의 경우 비아그라 같은 약물로 성공적으로 치료할 수 있는 경우가 대다수다.[1]: Ch. 20 중요한 것은, 브라키테라피 치료 후 발기부전의 위험은 과격한 전립선 절제술 후보다 적다.[18][73]
유방암이나 피부암에 대한 브라키테라피는 치료 부위 주변에 흉터 조직이 형성되는 원인이 될 수 있다.유방 브라키테라피의 경우 지방산이 유방조직으로 유입되면서 지방 괴사가 발생할 수 있다.이로 인해 유방 조직이 붓고 부드러워질 수 있다.지방 괴사는 양성 질환이며 일반적으로 치료 후 4-12개월 후에 발생하며 환자의 약 2%에 영향을 미친다.[77][78]
주변 안전
환자가 브라키테라피를 받은 뒤 가족이나 친구 주변에 특별한 안전 예방조치가 필요한지 묻는 경우가 많다.임시 브라키테라피를 사용하면 치료 후에도 방사성 물질이 체내에 남아 있지 않다.따라서, 친구나 가족이 가까이 있는 것으로부터 방사능에 노출되는 위험은 없다.[79]
영구 브라키테라피를 사용할 경우 치료 후 저선량 방사능 선원(씨드)이 체내에 남는다. 즉, 방사선 수준은 매우 낮고 시간이 지남에 따라 감소한다.또한, 방사선은 방사성 선원의 몇 밀리미터 이내의 조직(즉 치료 중인 종양)에만 영향을 미친다.예방책으로서, 영구적인 브라키테라피를 받는 일부 사람들은 치료 후에 어린 아이를 낳지 않거나 임산부와 짧은 시간 동안 너무 가까이 지내지 말 것을 권고할 수 있다.방사선 전문의나 간호사는 환자에게 특정 지침을 제공하고 얼마나 오랫동안 주의를 기울여야 하는지 조언할 수 있다.[79]
종류들
(1) 대상 치료 부위에 방사선원을 배치하는 방법, (2) 종양으로 전달되는 방사선량의 비율 또는 '강도' 및 (3) 선량 전달 기간에 따라 다른 유형의 브라키테라피를 정의할 수 있다.
소스 배치
방사능 선원의 배치 측면에서 브라키테라피 치료의 두 가지 주요 유형은 중간 치료와 접촉이다.
간간 브라키테라피의 경우 전립선이나 유방 등 감염부위의 표적조직에 직접 공급원을 배치한다.[1]: Ch. 1
접촉 브라키테라피에는 대상 조직 옆 공간에 방사선원을 배치하는 것이 포함된다.[1]: Ch. 1 이 공간은 자궁경부, 자궁 또는 질과 같은 체강(내과적 브라키테라피), 기관이나 외과와 같은 체강(내과적 브라키테라피) 또는 피부와 같은 외부(표면 브라키테라피)일 수 있다.[1]: Ch. 1 관상동맥내 회복 치료를 위해 혈관 내(혈관내 브라키테라피)에 방사선원을 배치할 수도 있다.[80]
선량률
브라키테라피 선량률은 방사선이 주변 매체에 전달되고 시간당 Grays(Gy/h)로 표현되는 수준 또는 '강도'를 말한다.
저선량(LDR) 브라키테라피는 최대 2 Gy/h의 속도로 방사선을 방출하는−1 방사선원을 이식하는 것을 포함한다.[81] LDR 브라키테라피는 구강암,[10] 후두암,[10] 사르코마암[1]: Ch. 27 , 전립선암[1]: Ch. 20 [82] 등에 흔히 사용된다.
중간 용량 비율(MDR) 브라키테라피는 2 Gy/h−1 ~ 12 Gy/h−1 범위의 중간 용량 전달 비율이 특징이다.[81]
고선량 비율(HDR) 브라키테라피는 선량 전달 속도가 12 Gy·h를−1 초과할 때를 말한다.[81]HDR 브라키테라피의 가장 일반적인 적용은 자궁경부, 식도, 폐, 유방, 전립선의 종양이다.[1]대부분의 HDR 치료는 외래환자로 이루어지지만 치료 부위에 따라 달라진다.[12]
펄스 투약률(PDR) 브라키요법은 일반적으로 시간당 한 번씩 짧은 방사선 펄스를 사용하여 LDR 치료의 전반적인 속도와 효과를 시뮬레이션한다.PDR 브라키테라피에 의해 치료되는 대표적인 종양 부위는 가내암과[1]: Ch. 14 머리암과 목암이다.[10]
선량 전달 기간
대상 영역에 방사선원의 위치는 일시적이거나 영구적일 수 있다.
임시 브라키요법은 철수하기 전에 정해진 기간(일반적으로 분 또는 시간) 동안 방사선원을 배치하는 것을 포함한다.[1]: Ch. 1 구체적인 치료 기간은 필요한 선량 전달 비율, 암의 종류, 크기 및 위치를 포함한 많은 다양한 요인에 따라 달라진다.LDR과 PDR 브라키테라피에서 소스는 일반적으로 제거되기 전까지 24시간 동안 제자리에 있는 반면, HDR 브라키테라피에서는 이 시간이 일반적으로 몇 분이다.[83]
종자 이식이라고도 알려진 영구 브라키테라피는 종양이나 치료 부위에 작은 LDR 방사성 종자나 알갱이(쌀 한 톨 정도 크기)를 넣고 영구적으로 그곳에 남겨 점차 부패하는 것을 포함한다.몇 주 또는 몇 달 동안, 선원에 의해 방출되는 방사선 수준은 거의 0으로 감소할 것이다.비활성 씨앗은 치료 현장에 남아 지속적인 효과가 없다.[76]영구 브라키테라피는 전립선암 치료에 가장 흔히 사용된다.[82]
절차
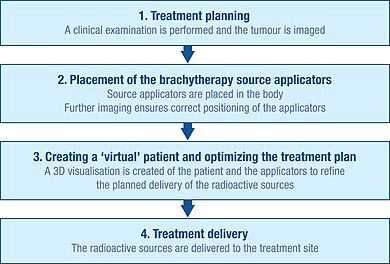
초기계획
브라키테라피 시술을 정확하게 계획하기 위해 종양의 특성을 파악하기 위한 철저한 임상 검사를 실시한다.또한 종양의 모양과 크기, 주변 조직과 장기와의 관계를 시각화하는 데 다양한 영상 촬영 방식을 사용할 수 있다.여기에는 X선 방사선 촬영, 초음파, 컴퓨터 축단층촬영(CT 또는 CAT) 스캔 및 자기공명영상(MRI) 촬영 등이 포함된다.[1]: Ch. 5 이러한 출처의 많은 데이터는 종양과 주변 조직의 3D 시각화를 만드는 데 사용될 수 있다.[1]: Ch. 5
이 정보를 이용하여 방사선원의 최적 분포 계획을 개발할 수 있다.여기에는 치료 현장에 방사선을 전달하는 데 사용되는 소스 캐리어(응용자)를 배치하고 배치해야 하는 방법에 대한 고려가 포함된다.[1]: Ch. 5 도포기는 방사활성화되지 않으며 일반적으로 바늘 또는 플라스틱 카테터다.사용되는 특정 유형의 적용자는 치료 중인 암의 종류와 대상 종양의 특성에 따라 달라진다.[1]: Ch. 5
이 초기 계획은 치료 중 '콜드 스폿'(너무 적은 조사)과 '핫 스폿'(너무 많은 조사)이 각각 치료 실패와 부작용을 초래할 수 있기 때문에 피하도록 돕는다.[29]
삽입
방사성 선원이 종양 부지에 전달되기 전에, 응용 프로그램을 삽입하고 초기 계획에 따라 정확하게 배치해야 한다.
X선, 형광 투시 및 초음파와 같은 영상 기법은 일반적으로 응용 프로그램의 정확한 위치를 안내하고 치료 계획을 더욱 구체화하기 위해 사용된다.[1]: Ch. 5 CAT 스캔과 MRI도 사용할 수 있다.[1]: Ch. 5 일단 어플리케이터를 삽입하면 봉합이나 접착테이프를 이용해 피부에 제자리에 고정시켜 움직이지 않도록 한다.어플리케이터가 올바른 위치에 있는 것으로 확인되면 추가 영상촬영을 수행하여 자세한 치료 계획을 안내할 수 있다.[1]: Ch. 5
가상 환자 생성
응용 프로그램이 설치된 환자의 영상은 치료 계획 소프트웨어로 가져오며 환자는 전용 차폐실로 가져와 치료한다.치료 계획 소프트웨어를 통해 치료 현장의 여러 2D 영상을 3D '가상 환자'로 변환할 수 있으며, 그 안에서 적용자의 위치를 정의할 수 있다.[1]: Ch. 5 이 '가상 환자' 안에 있는 응용 프로그램, 치료 사이트 및 주변 건강한 조직 사이의 공간적 관계는 실제 환자의 관계를 복사한 것이다.
조사 계획 최적화
이식된 조직이나 공동의 적용자 내에서 방사선원의 최적 공간적 및 시간적 분포를 식별하기 위해 치료 계획 소프트웨어를 통해 가상 방사선원을 가상 환자 내에 배치할 수 있다.소프트웨어는 조사 분포의 그래픽 표현을 보여준다.이는 브라키테라피 팀이 선원의 분포를 정교하게 다듬고, 실제 방사선 전달이 시작되기 전에 각 환자의 구조에 최적으로 맞춘 치료 계획을 제공하는 지침 역할을 한다.[84]이 접근법을 '도장'이라고 부르기도 한다.
치료전달
브라키테라피에 사용되는 방사선원은 항상 비방사성 캡슐 안에 들어 있다.소스는 수동으로 전달될 수 있지만, 일반적으로 '애프터로드링'이라고 알려진 기술을 통해 전달된다.
브라키테라피의 수동 전달은 의료진에 대한 방사선 피폭 위험 때문에 몇 가지 LDR 애플리케이션으로 제한된다.[83]
이와는 대조적으로 애프터 로딩은 방사선 선원과 함께 후속적으로 적재되는 치료 현장의 비방사성 어플리케이터의 정확한 위치를 포함한다.수동 애프터 로딩에서 소스는 오퍼레이터에 의해 어플리케이터로 전달된다.
원격 애프터로드 시스템은 방사선원을 차폐된 금고에 안전하게 보호함으로써 의료 전문가에 대한 방사선 피폭으로부터 보호해 준다.응용 프로그램이 환자에게 올바르게 배치되면 일련의 연결 가이드 튜브를 통해 '애프터 로더' 기계(방사선원 포함)에 연결된다.처리 계획은 애프터 로더로 전송되며, 애프터 로더는 가이드 튜브를 따라 출처를 응용 프로그램 내의 사전 지정된 위치로 전달하도록 제어한다.이 과정은 치료실에서 직원이 제거된 후에만 시행된다.선원은 다시 치료 계획에 따라 정해진 시간 동안 제자리에 유지되며, 그 후 튜브를 따라 애프터 로더에 반환된다.
방사성 선원의 전달이 완료되면, 적용자는 신체에서 조심스럽게 제거된다.환자는 일반적으로 브라키테라피 시술에서 빨리 회복되어 외래환자에 의해 수행되는 경우가 많다.[12]
2003년과 2012년 미국 지역사회 병원에서 브라키테라피(내부 방사선 치료)로 입원하는 비율은 45~64세 성인의 연평균 24.4%, 65~84세 성인의 연평균 27.3% 감소했다.브라키테라피는 의료보험과 개인보험이 지불하는 병원 입원 중 가장 큰 변화가 발생한 수술 절차였다.[85]
방사선원
브라키테라피에 일반적으로 사용되는 방사선원([86]방사선원)
| 방사성핵종 | 유형 | 하프라이프 | 에너지 |
|---|---|---|---|
| 세슘-131 131(Cs) | 전자 포획, capture | 9.7일 | 30.4 keV(평균) |
| 세슘-137(137Cs) | β-− 입자, γ-선 | 30.17년 | 0.512, 0.662 MeV γ선 |
| 코발트-60(60Co) | β-− 입자, γ-선 | 5.26년 | 1.17, 1.33 MeV γ-ray |
| 이리듐-192 192(Ir) | γ-rays | 73.8일 | 0.38 MeV(평균) |
| 요오드-125 (125I) | 전자 포획, capture | 59.6일 | 27.4, 31.4 및 35.5 keV |
| 팔라듐-103(103Pd) | 전자 포획, capture | 17.0일 | 21 keV(평균) |
| 루테늄-106 106(Ru) | β-− 입자 | 1.02년 | 3.54 MeV |
| 라듐-226 (226라) | α-입자 | 1599년 |
역사
브라키테라피는 피에르 퀴리가 앙리-알렉산드르 단로스에게 방사능 선원을 종양에 삽입할 수 있다고 제안했던 1901년(1896년 앙리 베크렐의 방사능 발견 이후 짧은 기간)으로 거슬러 올라간다.[87][88]방사능이 종양을 수축시킨 것으로 밝혀졌다.[88]독자적으로, 알렉산더 그레이엄 벨은 또한 이런 방식으로 방사선을 사용할 것을 제안했다.[88]20세기 초에는 단로스에 의해 파리의 퀴리 연구소, 로버트 아베에 의해 뉴욕의 세인트 루크와 메모리얼 병원에서 브라키테라피 적용 기법이 개척되었다.[1]: Ch. 1 [88]
미국 물리학자 윌리엄 듀안은 파리 대학의 라듐 연구실에서 퀴리 연구원과 함께 황산 라듐 용액에서 라돈-222 가스를 추출하는 기술을 개발했다.라듐 1g을 함유한 용액을 '우유'해 각각 약 20밀리그램의 라돈 '씨드'를 만들었다.이러한 "씨앗"은 초기 형태의 가상화폐 치료라는 브라키테라피에 사용하기 위해 파리 전역에 배포되었다.듀앵은 파리에 있는 동안 이 "우유" 기술을 완성했고 그 장치를 "라듐 소"[89]라고 불렀다.
듀안은 1913년 미국으로 돌아와 하버드대 물리학과 조교수와 하버드 암위원회 물리학 연구위원으로 공동 역할을 했다.[90]암 위원회는 1901년에 설립되었고 암 치료에 라듐 방출의 사용을 조사하기 위해 듀아인을 고용했다.[91]1915년에 그는 보스턴 최초의 "라듐 소"를 만들었고 수천 명의 환자들은 그 소에서 생성된 라돈-222로 치료를 받았다.[92]
중간 라듐 요법은 1930년대에 흔했다.[1]: Ch. 1 라돈으로 가득 찬 금 씨앗은 1942년부터[93] 적어도 1958년까지 사용되었다.[94]금 껍질은 감마선을 통과하면서 베타선을 보호하기 위해 1920년경 기노 파이야에 의해 선택되었다.[95]코발트 바늘도 제2차 세계대전 이후 잠깐 사용되었다.[1]: Ch. 1 라돈과 코발트는 이리듐이 눈에 띄기 전에 방사성 탄탈룸과 금으로 대체되었다.[1]: Ch. 1 이리듐은 1958년에 처음 사용되어 오늘날 브라키테라피에 가장 많이 사용되는 인공 공급원이다.[1]: Ch. 1
유럽과 미국에서 브라키테라피에 대한 초기 관심에 이어, 20세기 중반에는 방사능 선원의 수동 적용에 따른 사업자에 대한 방사선 피폭 문제 때문에 사용이 감소했다.[88][96]그러나 차폐된 금고에서 방사선을 전달할 수 있는 원격 애프터로드 시스템의 개발과 1950년대와 1960년대에 새로운 방사능 선원의 사용은 운영자와 환자에 대한 불필요한 방사선 피폭의 위험을 줄였다.[87]이것은 3차원 영상 양식의 최근 진보와 함께, 컴퓨터화된 치료 계획 시스템과 전달 장비는 오늘날 많은 종류의 암에 대한 안전하고 효과적인 치료법을 만들었다.[1]: Ch. 1
"브라크요법"이라는 단어는 그리스어인 ββααςς brachys에서 유래되었는데, 이는 "짧은 거리" 또는 "짧은 길이"라는 뜻이다.
환경위험
브라키테라피 공급원의 작은 크기와 초기 수십 년 동안의 낮은 통제력 때문에, 이들 중 일부는 고아가 되기 위해 환경으로 빠져나갈 위험이 있다.2011년 프라하의 한 놀이터에서 라듐 바늘이 발견돼 1m 떨어진 곳에서 500µSv/h를 방사했다.[97][98][99]
참고 항목
- 외부보 방사선치료
- 전립선 브라키테라피
- 대상 수술 중 방사선 치료
- 봉인되지 않은 소스 방사선 치료
- 핵의학
- 수술 중 방사선 치료
- X선 브라키테라피("전자 브라키테라피"라고도 함)에 문의하십시오.
참조
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj Gerbaulet, Alain; Pötter, Richard; Mazeron, Jean-Jacques; Meertens, Harm; Limbergen, Erik Van, eds. (2002). The GEC ESTRO handbook of brachytherapy. Leuven, Belgium: European Society for Therapeutic Radiology and Oncology. OCLC 52988578.
- ^ a b c Viswanathan AN; et al. (2007). "Gynecologic brachytherapy". In Devlin P (ed.). Brachytherapy: Applications and Techniques. Philadelphia: LWW.
- ^ Kishan, Amar; Cook, Ryan; Ciezki, Jay; et al. (2018). "Radical Prostatectomy, External Beam Radiotherapy, or External Beam Radiotherapy With Brachytherapy Boost and Disease Progression and Mortality in Patients with Gleason Score 9-10 Prostate Cancer". JAMA. 319 (9): 896–905. doi:10.1001/jama.2018.0587. PMC 5885899. PMID 29509865.
- ^ a b Pieters, B. R.; De Back, D. Z.; Koning, C. C. E.; Zwinderman, A. H. (2009). "Comparison of three radiotherapy modalities on biochemical control and overall survival for the treatment of prostate cancer: A systematic review". Radiotherapy and Oncology. 93 (2): 168–173. doi:10.1016/j.radonc.2009.08.033. PMID 19748692.
- ^ a b c Stewart AJ; et al. (2007). "Radiobiological concepts for brachytherapy". In Devlin P (ed.). Brachytherapy. Applications and Techniques. Philadelphia: LWW.
- ^ a b c BMJ Group (June 2009). "Prostate cancer: internal radiotherapy (brachytherapy)". Guardian.co.uk. Archived from the original on April 4, 2009. Retrieved 25 September 2009.
- ^ a b c d e Kelley JR; et al. (2007). "Breast brachytherapy". In Devlin P (ed.). Brachytherapy. Applications and Techniques. Philadelphia: LWW.
- ^ CSIntell. "Brachytherapy Market Recovery to Reach US$ 2.4 Billion".
The global market for brachytherapy reached US$ 680 million in 2013, of which the High-Dose Rate (HDR) and LDR segments accounted for 70%. Microspheres and electronic brachytherapy commanded the remaining 30%.
- ^ CSIntell. "Brachytherapy Market Recovery to Reach US$ 2.4 Billion".
The brachytherapy market is expected to reach over US$ 2.4 billion in 2030, growing by 8% annually, mainly driven by the microspheres market as well as electronic brachytherapy, which is gaining significant interest worldwide as a user-friendly technology.
- ^ a b c d Mazeron, J. J.; Ardiet, J. M.; Haie-Méder, C.; Kovács, G. R.; Levendag, P.; Peiffert, D.; Polo, A.; Rovirosa, A.; Strnad, V. (2009). "GEC-ESTRO recommendations for brachytherapy for head and neck squamous cell carcinomas". Radiotherapy and Oncology. 91 (2): 150–156. doi:10.1016/j.radonc.2009.01.005. PMID 19329209.
- ^ Dvorák; Jandík, P.; Melichar, B.; Jon, B.; Mergancová, J.; Zoul, Z.; Vacek, Z.; Petera, J. (2002). "Intraluminal high dose rate brachytherapy in the treatment of bile duct and gallbladder carcinomas". Hepato-gastroenterology. 49 (46): 916–917. PMID 12143240.
- ^ a b c Nag S. (2004). "High dose rate brachytherapy: its clinical applications and treatment guidelines". Technology in Cancer Research and Treatment. 3 (3): 269–87. doi:10.1177/153303460400300305. PMID 15161320.
- ^ Joseph, K. J.; Alvi, R.; Skarsgard, D.; Tonita, J.; Pervez, N.; Small, C.; Tai, P. (2008). "Analysis of health related quality of life (HRQoL) of patients with clinically localized prostate cancer, one year after treatment with external beam radiotherapy (EBRT) alone versus EBRT and high dose rate brachytherapy (HDRBT)". Radiation Oncology. 3: 20. doi:10.1186/1748-717X-3-20. PMC 2494997. PMID 18627617.
- ^ Holmboe; Concato, J. (2000). "Treatment decisions for localized prostate cancer: asking men what's important". Journal of General Internal Medicine. 15 (10): 694–701. doi:10.1046/j.1525-1497.2000.90842.x. PMC 1495597. PMID 11089712.
- ^ Hoskin P, Coyle C, eds. (2005). Radiotherapy in practice: brachytherapy. New York: Oxford University Press. ISBN 978-0-19-852940-8.
- ^ Guedea, F.; Ventura, M.; Mazeron, J.; Torrecilla, J.; Bilbao, P.; Borràs, J. (2008). "Patterns of Care for Brachytherapy in Europe: Facilities and resources in brachytherapy in the European area". Brachytherapy. 7 (3): 223–230. doi:10.1016/j.brachy.2008.03.001. PMID 18579448.
- ^ Quang TS; et al. (2007). "Technological evolution in the treatment of prostate cancer". Oncology. 21.
- ^ a b Guedea, F.; Ferrer, M.; Pera, J.; Aguiló, F.; Boladeras, A.; Suárez, J. F.; Cunillera, O.; Ferrer, F.; Pardo, Y.; Martínez, E.; Ventura, M. (2009). "Quality of life two years after radical prostatectomy, prostate brachytherapy or external beam radiotherapy for clinically localised prostate cancer: The Catalan Institute of Oncology/Bellvitge Hospital experience". Clinical & Translational Oncology. 11 (7): 470–478. doi:10.1007/s12094-009-0387-x. PMID 19574206. S2CID 22946298.
- ^ Litwin, M. S.; Gore, J. L.; Kwan, L.; Brandeis, J. M.; Lee, S. P.; Withers, H. R.; Reiter, R. E. (2007). "Quality of life after surgery, external beam irradiation, or brachytherapy for early-stage prostate cancer". Cancer. 109 (11): 2239–2247. doi:10.1002/cncr.22676. PMID 17455209.
- ^ a b Pistis, F.; Guedea, F.; Pera, J.; Gutierrez, C.; Ventura, M.; Polo, A.; Martinez, E.; Boladeras, A.; Ferrer, F.; Gabriele, P.; Linares, L. (2009). "External beam radiotherapy plus high-dose-rate brachytherapy for treatment of locally advanced prostate cancer: the initial experience of the Catalan Institute of Oncology". Brachytherapy. 9 (1): 15–22. doi:10.1016/j.brachy.2009.05.001. PMID 19734106.
- ^ a b Lertsanguansinchai, P.; Lertbutsayanukul, C.; Shotelersuk, K.; Khorprasert, C.; Rojpornpradit, P.; Chottetanaprasith, T.; Srisuthep, A.; Suriyapee, S.; Jumpangern, C.; Tresukosol, D.; Charoonsantikul, C. (2004). "Phase III randomized trial comparing LDR and HDR brachytherapy in treatment of cervical carcinoma". International Journal of Radiation Oncology, Biology, Physics. 59 (5): 1424–1431. doi:10.1016/j.ijrobp.2004.01.034. PMID 15275728.
- ^ Roddiger SJ; et al. (2006). "Neoadjuvant interstitial high-dose-rate (HDR) brachytherapy combined with systemic chemotherapy in patients with breast cancer". Strahlenther Onkol. 182 (1): 22–9. doi:10.1007/s00066-006-1454-7. PMID 16404517. S2CID 23210347.
- ^ Gaffney, D.; Du Bois, A.; Narayan, K.; Reed, N.; Toita, T.; Pignata, S.; Blake, P.; Portelance, L.; Sadoyze, A.; Pötter, R.; Colombo, A.; Randall, M.; Mirza, M. R.; Trimble, E. L. (2007). "Practice Patterns of Radiotherapy in Cervical Cancer Among Member Groups of the Gynecologic Cancer Intergroup (GCIG)". International Journal of Radiation Oncology, Biology, Physics. 68 (2): 485–490. doi:10.1016/j.ijrobp.2006.12.013. PMID 17336465.
- ^ a b National Institute for Health and Clinical Excellence (March 2006). "High dose rate brachytherapy for carcinoma of the cervix". NICE. Retrieved 25 September 2009.
- ^ a b c Viswanathan AN; et al. "American Brachytherapy Society cervical cancer brachytherapy task group" (PDF). American Brachytherapy Society. Retrieved 25 September 2009.
- ^ Viswanathan, A. N.; Erickson, B. A. (2009). "Three-Dimensional Imaging in Gynecologic Brachytherapy: A Survey of the American Brachytherapy Society". International Journal of Radiation Oncology, Biology, Physics. 76 (1): 104–109. doi:10.1016/j.ijrobp.2009.01.043. PMID 19619956.
- ^ Haie-meder, C.; Chargari, C.; Rey, A.; Dumas, I.; Morice, P.; Magné, N. (2009). "DVH parameters and outcome for patients with early-stage cervical cancer treated with preoperative MRI-based low dose rate brachytherapy followed by surgery". Radiotherapy and Oncology. 93 (2): 316–321. doi:10.1016/j.radonc.2009.05.004. PMID 19586673.
- ^ Kim, D. H.; Wang-Chesebro, A. .; Weinberg, V. .; Pouliot, J. .; Chen, L. M.; Speight, J. .; Littell, R. .; Hsu, I. C. (2009). "High–Dose Rate Brachytherapy Using Inverse Planning Simulated Annealing for Locoregionally Advanced Cervical Cancer: A Clinical Report with 2-Year Follow-Up". International Journal of Radiation Oncology, Biology, Physics. 75 (5): 1329–1334. doi:10.1016/j.ijrobp.2009.01.002. PMID 19409728.
- ^ a b Potter, R.; Kirisits, C.; Fidarova, E.; Dimopoulos, J.; Berger, D.; Tanderup, K.; Lindegaard, J. (2008). "Present status and future of high-precision image guided adaptive brachytherapy for cervix carcinoma". Acta Oncologica. 47 (7): 1325–1336. doi:10.1080/02841860802282794. PMID 18661430.
- ^ Pötter, R.; Haie-Meder, C.; Van Limbergen, E. V.; Barillot, I.; De Brabandere, M. D.; Dimopoulos, J.; Dumas, I.; Erickson, B.; Lang, S.; Nulens, A.; Petrow, P.; Rownd, J.; Kirisits, C.; Gec Estro Working, G. (2006). "Recommendations from gynaecological (GYN) GEC ESTRO working group (II): Concepts and terms in 3D image-based treatment planning in cervix cancer brachytherapy—3D dose volume parameters and aspects of 3D image-based anatomy, radiation physics, radiobiology". Radiotherapy and Oncology. 78 (1): 67–77. doi:10.1016/j.radonc.2005.11.014. PMID 16403584.
- ^ Hareyama, M. .; Sakata, K. I.; Oouchi, A. .; Nagakura, H. .; Shido, M. .; Someya, M. .; Koito, K. . (2002). "High-dose-rate versus low-dose-rate intracavitary therapy for carcinoma of the uterine cervix". Cancer. 94 (1): 117–124. doi:10.1002/cncr.10207. PMID 11815967.
- ^ Liu, Ruifeng; Wang, XiaoHu; Tian, Jin Hui; Yang, KeHu; Wang, Jun; Jiang, Lei; Hao, Xiang Yong (2014-10-09). "High dose rate versus low dose rate intracavity brachytherapy for locally advanced uterine cervix cancer". Cochrane Database of Systematic Reviews. 2022 (10): CD007563. doi:10.1002/14651858.cd007563.pub3. ISSN 1465-1858. PMC 8734152. PMID 25300170.
- ^ a b Merrick GS; et al. "American Brachytherapy Society prostate low-dose rate task group" (PDF). American Brachytherapy Society. Retrieved 25 September 2009.
- ^ a b Hsu I-C; et al. "American Brachytherapy Society prostate high-dose rate task group" (PDF). American Brachytherapy Society. Retrieved 25 September 2009.
- ^ a b Battermann, J.; Boon, T.; Moerland, M. (2004). "Results of permanent prostate brachytherapy, 13 years of experience at a single institution". Radiotherapy and Oncology. 71 (1): 23–28. doi:10.1016/j.radonc.2004.01.020. PMID 15066292.
- ^ a b Ash D, et al. (2005). "Prostate Cancer". In Hoskin P, Coyle C (eds.). Radiotherpay in practice: brachytherapy. New York: Oxford University Press.
- ^ Morris, W. J.; Keyes, M.; Palma, D.; McKenzie, M.; Spadinger, I.; Agranovich, A.; Pickles, T.; Liu, M.; Kwan, W.; Wu, J.; Lapointe, V.; Berthelet, E.; Pai, H.; Harrison, R.; Kwa, W.; Bucci, J.; Racz, V.; Woods, R. (2009). "Evaluation of Dosimetric Parameters and Disease Response After 125Iodine Transperineal Brachytherapy for Low- and Intermediate-Risk Prostate Cancer". International Journal of Radiation Oncology, Biology, Physics. 73 (5): 1432–1438. doi:10.1016/j.ijrobp.2008.07.042. PMID 19036530.
- ^ Pickles, T.; Keyes, M.; Morris, W. J. (2009). "Brachytherapy or Conformal External Radiotherapy for Prostate Cancer: A Single-Institution Matched-Pair Analysis". International Journal of Radiation Oncology, Biology, Physics. 76 (1): 43–49. doi:10.1016/j.ijrobp.2009.01.081. PMID 19570619.
- ^ a b c d Frank, S.; Pisters, L.; Davis, J.; Lee, A.; Bassett, R.; Kuban, D. (2007). "An Assessment of Quality of Life Following Radical Prostatectomy, High Dose External Beam Radiation Therapy and Brachytherapy Iodine Implantation as Monotherapies for Localized Prostate Cancer". The Journal of Urology. 177 (6): 2151–2156. doi:10.1016/j.juro.2007.01.134. PMID 17509305.
- ^ a b Galalae, R.; Martinez, A.; Mate, T.; Mitchell, C.; Edmundson, G.; Nuernberg, N.; Eulau, S.; Gustafson, G.; Gribble, M.; Kovács, G. (2004). "Long-term outcome by risk factors using conformal high-dose-rate brachytherapy (HDR-BT) boost with or without neoadjuvant androgen suppression for localized prostate cancer". International Journal of Radiation Oncology, Biology, Physics. 58 (4): 1048–1055. doi:10.1016/j.ijrobp.2003.08.003. PMID 15001244.
- ^ a b Hoskin, P. J.; Motohashi, K.; Bownes, P.; Bryant, L.; Ostler, P. (2007). "High dose rate brachytherapy in combination with external beam radiotherapy in the radical treatment of prostate cancer: initial results of a randomised phase three trial". Radiotherapy and Oncology. 84 (2): 114–120. doi:10.1016/j.radonc.2007.04.011. PMID 17531335.
- ^ a b Pisansky, T. M.; Gold, D. G.; Furutani, K. M.; MacDonald, O. K.; McLaren, R. H.; Mynderse, L. A.; Wilson, T. M.; Hebl, J. R.; Choo, R. (2008). "High-dose-rate brachytherapy in the curative treatment of patients with localized prostate cancer". Mayo Clinic Proceedings. 83 (12): 1364–1372. doi:10.4065/83.12.1364. PMID 19046556.
- ^ a b c Keisch; et al. (February 2007). "American Brachytherapy Society breast brachytherapy task group" (PDF). American Brachytherapy Society. Retrieved 25 September 2009.
- ^ a b Hoskin P, et al. (2005). "Breast Brachytherapy". In Hoskin P, Coyle C (eds.). Radiotherapy in practice: brachytherapy. New York: Oxford University Press. ISBN 978-0-19-852940-8.
- ^ a b c Polgár, C.; Major, T. (2009). "Current status and perspectives of brachytherapy for breast cancer". International Journal of Clinical Oncology. 14 (1): 7–24. doi:10.1007/s10147-008-0867-y. PMID 19225919. S2CID 20971836.
- ^ a b Nelson, J. C.; Beitsch, P. D.; Vicini, F. A.; Quiet, C. A.; Garcia, D.; Snider, H. C.; Gittleman, M. A.; Zannis, V. J.; Whitworth, P. W.; Fine, R. E.; Keleher, A. J.; Kuerer, H. M. (2009). "Four-year clinical update from the American Society of Breast Surgeons MammoSite brachytherapy trial". The American Journal of Surgery. 198 (1): 83–91. doi:10.1016/j.amjsurg.2008.09.016. PMID 19268900.
- ^ a b Vaidya, Jayant S. (2009). "APBI with 50 kV Photons: Targeted Intraoperative Radiotherapy (TARGIT)". Accelerated Partial Breast Irradiation. Springer, Berlin, Heidelberg. pp. 327–344. doi:10.1007/978-3-540-88006-6_19. ISBN 9783540880059.
- ^ Orecchia, Roberto; Ivaldi, Giovanni B.; Leonardi, Maria C. (2009). Accelerated Partial Breast Irradiation. Springer, Berlin, Heidelberg. pp. 345–366. doi:10.1007/978-3-540-88006-6_20. ISBN 9783540880059.
- ^ Shah, A. P.; Strauss, J. B.; Kirk, M. C.; Chen, S. S.; Dickler, A. (2010). "A dosimetric analysis comparing electron beam with the MammoSite brachytherapy applicator for intact breast boost". Physica Medica. 26 (2): 80–87. doi:10.1016/j.ejmp.2009.08.004. PMID 19836283.
- ^ Scanderbeg D, Yashar C, White G, Rice R, Pawlicki T (2010). "Evaluation of Three APBI Techniques under NSABP B-39 Guidelines". Journal of Applied Clinical Medical Physics. 11 (1): 274–280. doi:10.1120/jacmp.v11i1.3021. PMC 5719777. PMID 20160680.
- ^ Yashar C, Blair S, Wallace A, Scanderbeg D (2009). "Initial Clinical Experience with the Strut-Adjusted Volume Implant Brachytherapy Applicator for Accelerated Partial Breast Irradiation". Brachytherapy. 8 (4): 367–372. doi:10.1016/j.brachy.2009.03.190. PMID 19744892.
- ^ a b Pignol, Jean-Philippe; Keller, Brian M. (2009). Accelerated Partial Breast Irradiation. Springer, Berlin, Heidelberg. pp. 263–276. doi:10.1007/978-3-540-88006-6_15. ISBN 9783540880059.
- ^ "GammaTile - Isoray Medical Inc. - K180515". 510(k) Premarket Notification. FDA. 23 January 2020. 요약
- ^ "2019 AANS Annual Scientific Meeting in San Diego".
- ^ Brachman, David; Youssef, Emad; Dardis, Christopher; Smith, Kris; Pinnaduwage, Dilini; Nakaji, Peter (2019). "Surgically Targeted Radiation Therapy: Safety Profile of Collagen Tile Brachytherapy in 79 Recurrent, Previously Irradiated Intracranial Neoplasms on a Prospective Clinical Trial". Brachytherapy. 18 (3): S35–S36. doi:10.1016/j.brachy.2019.04.076. S2CID 196511749.
- ^ Folkert, Michael R.; Cohen, Gil'ad N.; Wu, Abraham J.; Gerdes, Hans; Schattner, Mark A.; Markowitz, Arnold J.; Ludwig, Emmy; Ilson, David H.; Bains, Manjit S. (September 2013). "Endoluminal high-dose-rate brachytherapy for early stage and recurrent esophageal cancer in medically inoperable patients". Brachytherapy. 12 (5): 463–470. doi:10.1016/j.brachy.2012.12.001. ISSN 1538-4721. PMID 23434221.
- ^ Hishikawa, Yoshio; Kurisu, Kouichi; Taniguchi, Midori; Kamikonya, Norihiko; Miura, Takashi (October 1991). "High-dose-rate intraluminal brachytherapy (HDRIBT) for esophageal cancer". International Journal of Radiation Oncology, Biology, Physics. 21 (5): 1133–1135. doi:10.1016/0360-3016(91)90267-8. PMID 1938510.
- ^ a b Fuccio, Lorenzo; Mandolesi, Daniele; Farioli, Andrea; Hassan, Cesare; Frazzoni, Leonardo; Guido, Alessandra; de Bortoli, Nicola; Cilla, Savino; Pierantoni, Chiara (March 2017). "Brachytherapy for the palliation of dysphagia owing to esophageal cancer: A systematic review and meta-analysis of prospective studies". Radiotherapy and Oncology. 122 (3): 332–339. doi:10.1016/j.radonc.2016.12.034. PMID 28104297.
- ^ Homs, Marjolein YV; Steyerberg, Ewout W; Eijkenboom, Wilhelmina MH; Tilanus, Hugo W; Stalpers, Lukas JA; Bartelsman, Joep FWM; van Lanschot, Jan JB; Wijrdeman, Harm K; Mulder, Chris JJ (October 2004). "Single-dose brachytherapy versus metal stent placement for the palliation of dysphagia from oesophageal cancer: multicentre randomised trial". The Lancet. 364 (9444): 1497–1504. doi:10.1016/S0140-6736(04)17272-3. PMID 15500894. S2CID 29529166.
- ^ Nonoshita, Takeshi; Sasaki, Tomonari; Hirata, Hideki; Toh, Yasushi; Shioyama, Yoshiyuki; Nakamura, Katsumasa; Honda, Hiroshi (2007-10-26). "High-dose-rate brachytherapy for previously irradiated patients with recurrent esophageal cancer". Radiation Medicine. 25 (8): 373–377. doi:10.1007/s11604-007-0152-4. ISSN 0288-2043. PMID 17952540. S2CID 7294379.
- ^ Akagi, Yukio; Hirokawa, Yutaka; Kagemoto, Masayuki; Matsuura, Kanji; Ito, Atsushi; Fujita, Kazushi; Kenjo, Masahiro; Kiriu, Hiroshi; Ito, Katsuhide (February 1999). "Optimum fractionation for high-dose-rate endoesophageal brachytherapy following external irradiation of early stage esophageal cancer". International Journal of Radiation Oncology, Biology, Physics. 43 (3): 525–530. doi:10.1016/S0360-3016(98)00433-7. PMID 10078632.
- ^ Sai, Heitetsu; Mitsumori, Michihide; Araki, Norio; Mizowaki, Takashi; Nagata, Yasushi; Nishimura, Yasumasa; Hiraoka, Masahiro (August 2005). "Long-term results of definitive radiotherapy for stage I esophageal cancer". International Journal of Radiation Oncology, Biology, Physics. 62 (5): 1339–1344. doi:10.1016/j.ijrobp.2004.12.042. ISSN 0360-3016. PMID 16029790.
- ^ Cipriani, Cesidio; Desantis, Maria; Dahlhoff, Gerhard; Brown, Shannon D.; Wendler, Thomas; Olmeda, Mar; Pietsch, Gunilla; Eberlein, Bernadette (2020-07-22). "Personalized irradiation therapy for NMSC by rhenium-188 skin cancer therapy: a long-term retrospective study". Journal of Dermatological Treatment: 1–7. doi:10.1080/09546634.2020.1793890. ISSN 0954-6634. PMID 32648530.
- ^ Guix; Finestres, F.; Tello, J.; Palma, C.; Martinez, A.; Guix, J.; Guix, R. (2000). "Treatment of skin carcinomas of the face by high-dose-rate brachytherapy and custom-made surface molds". International Journal of Radiation Oncology, Biology, Physics. 47 (1): 95–102. doi:10.1016/S0360-3016(99)00547-7. PMID 10758310.
- ^ Sedda, A. F.; Rossi, G.; Cipriani, C.; Carrozzo, A. M.; Donati, P. (2008). "Dermatological high-dose-rate brachytherapy for the treatment of basal and squamous cell carcinoma" (PDF). Clinical and Experimental Dermatology. 33 (6): 745–749. doi:10.1111/j.1365-2230.2008.02852.x. hdl:2108/59410. PMID 18681873. S2CID 26912830.
- ^ Rio, E.; Bardet, E.; Ferron, C.; Peuvrel, P.; Supiot, S.; Campion, L.; Beauvillain De Montreuil, C.; Mahe, M.; Dreno, B. (2005). "Interstitial brachytherapy of periorificial skin carcinomas of the face: A retrospective study of 97 cases". International Journal of Radiation Oncology, Biology, Physics. 63 (3): 753–757. doi:10.1016/j.ijrobp.2005.03.027. PMID 15927410.
- ^ a b Musmacher J; et al. (2006). "High dose rate brachytherapy with surface applicators: Treatment for nonmelanomatous skin cancer". Journal of Clinical Oncology. 24 (18_suppl): 15543. doi:10.1200/jco.2006.24.18_suppl.15543.
- ^ Members, A. /T. F.; Albertsson, S.; Avilés, P.; Camici, F. F.; Colombo, P. G.; Hamm, A.; Jørgensen, C.; Marco, E.; Nordrehaug, J.; Ruzyllo, W.; Urban, P.; Stone, G. W.; Wijns, W.; Task Force for Percutaneous Coronary Interventions of the European Society of Cardiology (2005). "Guidelines for Percutaneous Coronary Interventions: the Task Force for Percutaneous Coronary Interventions of the European Society of Cardiology". European Heart Journal. 26 (8): 804–847. doi:10.1093/eurheartj/ehi138. PMID 15769784.
- ^ Sidawy; Weiswasser, J.; Waksman, R. (2002). "Peripheral vascular brachytherapy". Journal of Vascular Surgery. 35 (5): 1041–1047. doi:10.1067/mva.2002.123751. PMID 12021726.
- ^ Perez-castellano, N.; Villacastín, J.; Aragoncillo, P.; Fantidis, P.; Sabaté, M.; García-Torrent, M. J.; Prieto, C.; Corral, J. M.; Moreno, J.; Fernández-Ortiz, A.; Vano, E.; MacAya, C. (2006). "Pathological Effects of Pulmonary Vein beta-Radiation in a Swine Model". Journal of Cardiovascular Electrophysiology. 17 (6): 662–669. doi:10.1111/j.1540-8167.2006.00462.x. PMID 16836719. S2CID 22161263.
- ^ a b Macmillan Cancer Support. "Brachytherapy". Archived from the original on October 3, 2009. Retrieved 25 September 2009.
- ^ a b Fieler (1997). "Side effects and quality of life in patients receiving high-dose rate brachytherapy". Oncology Nursing Forum. 24 (3): 545–553. PMID 9127366.
- ^ a b c d Doust; Miller, E.; Duchesne, G.; Kitchener, M.; Weller, D. (2004). "A systematic review of brachytherapy. Is it an effective and safe treatment for localised prostate cancer?". Australian Family Physician. 33 (7): 525–529. PMID 15301172.
- ^ a b c Magné, N.; Mancy, N. C.; Chajon, E.; Duvillard, P.; Pautier, P.; Castaigne, D.; Lhommé, C.; Morice, P.; Haie-Meder, C. (2009). "Patterns of care and outcome in elderly cervical cancer patients: A special focus on brachytherapy". Radiotherapy and Oncology. 91 (2): 197–201. doi:10.1016/j.radonc.2008.08.011. PMID 18954913.
- ^ Casino AR; et al. (2006). "Brachytherapy in lip cancer". Medicina Oral. 11: E223–9.
- ^ a b Moule, R. N.; Hoskin, P. J. (2009). "Non-surgical treatment of localised prostate cancer". Surgical Oncology. 18 (3): 255–267. doi:10.1016/j.suronc.2009.03.006. PMID 19442516.
- ^ Vicini, F.; Beitsch, P. D.; Quiet, C. A.; Keleher, A. J.; Garcia, D.; Snider Jr, H. C.; Gittleman, M. A.; Zannis, V. J.; Kuerer, H. M.; Lyden, M. (2008). "Three-year analysis of treatment efficacy, cosmesis, and toxicity by the American Society of Breast Surgeons MammoSite Breast Brachytherapy Registry Trial in patients treated with accelerated partial breast irradiation (APBI)". Cancer. 112 (4): 758–766. doi:10.1002/cncr.23227. PMID 18181095.
- ^ Department of Human Oncology, University of Wisconsin School of Medicine and Public Health. "Breast brachytherapy". Retrieved 25 September 2009.[데드링크]
- ^ a b "Treatment Types: Brachytherapy". RT Answers. American Society for Radiation Oncology. Retrieved 24 July 2017.[데드링크]
- ^ Giap H, Tripuraneni P (2007). "Vascular brachytherapy". In Devlin P (ed.). Brachytherapy. Applications and Techniques. Philadelphia: LWW.
- ^ a b c Thomadsen BR; et al. (2005). Brachytherapy Physics. Medical Physics Publishing.
- ^ a b Koukourakis G; et al. (2009). "Brachytherapy for prostate cancer: A systematic review". Adv Urol. 26 (1): 63–8. doi:10.1177/000456328902600109. PMID 2735748.
- ^ a b Flynn A, et al. (2005). "Isotopes and delivery systems for brachytherapy". In Hoskin P, Coyle C (eds.). Radiotherapy in practice: brachytherapy. New York: Oxford University Press.
- ^ Trnková P.; Pötter R.; Baltas D.; Karabis A.; Fidarova E.; Dimopoulos J.; Georg D.; Kirisits C. (2009). "New inverse planning technology for image-guided cervical cancer brachytherapy: Description and evaluation within a clinical frame" (PDF). Radiotherapy and Oncology. 93 (2): 331–340. doi:10.1016/j.radonc.2009.10.004. PMID 19846230. Archived from the original (PDF) on 2015-10-17. Retrieved 2010-03-11.
- ^ Fingar KR, Stocks C, Weiss AJ, Steiner CA (December 2014). "Most Frequent Operating Room Procedures Performed in U.S. Hospitals, 2003-2012". HCUP Statistical Brief #186. Rockville, MD: Agency for Healthcare Research and Quality.
- ^ 알렉스 라이더스브라시테라피를 위한 광자 소스. 방사선치료와 브라키테라피, 에드스.이브 르모인, 알레산드라 카너나토 평화안보 시리즈 B: 물리학과 생물물리학.Springer Science & Business Media, 2009 ISBN 9789048130955 페이지 191
- ^ a b Gupta VK. (1995). "Brachytherapy – past, present and future". Journal of Medical Physics. 20: 31–38.
- ^ a b c d e Nag S. "A brief history of brachytherapy". Retrieved 25 September 2009.
- ^ Coursey, Bert M. (2017). "150th Anniversary of the Birth of Marie Curie". Applied Radiation and Isotopes : Including Data, Instrumentation and Methods for Use in Agriculture, Industry and Medicine. National Institute of Standards & Technology. 130: 280–284. doi:10.1016/j.apradiso.2017.10.028. PMID 29079418. Retrieved 13 June 2021.
- ^ Bridgman, P.W. "Biographical Memoir of William Duane 1872-1935" (PDF). www.nasonline.org. National Academy of Sciences. Retrieved 16 June 2021.
- ^ Webster, Edward W. (1993). "The origins of Medical Physics in the USA: William Duane, Ph.D., 1913-1920" (PDF). Medical Physics. 20 (6): 1607–1610. Bibcode:1993MedPh..20.1607W. doi:10.1118/1.597159. PMID 8309432. Retrieved 16 June 2021.
- ^ Brucer, Marshall (November 1993). "William Duane and the radium cow: An American contribution to the emerging atomic age". Medical Physics. 20 (6): 1601–1605. Bibcode:1993MedPh..20.1601B. doi:10.1118/1.596947. PMID 8309431. Retrieved 15 June 2021.
- ^ Goldstein, N. (1975). "Radon seed implants. Residual radioactivity after 33 years". Archives of Dermatology. 111 (6): 757–759. doi:10.1001/archderm.1975.01630180085013. PMID 1137421.
- ^ Winston, P. (June 1958). "Carcinoma of the Trachea Treated by Radon Seed Implantation". The Journal of Laryngology & Otology. 72 (6): 496–499. doi:10.1017/S0022215100054232. PMID 13564019.
- ^ Oak Ridge Associated Universities. "Seeds (ca. 1940s - 1960s)". ORAU Museum of Radiation and Radioactivity. Retrieved 12 October 2021.
- ^ Aronowitz, J. (2008). "The "Golden Age" of prostate brachytherapy: A cautionary tale". Brachytherapy. 7 (1): 55–59. doi:10.1016/j.brachy.2007.12.004. PMID 18299114.
- ^ ""Radioactive" little cylinder found underground in a park in Podolí". iDNES.cz. 29 September 2011. Retrieved 12 November 2012.
- ^ Motl, Luboš. "Why a small cylinder buried in Prague radiates 500 μSv/h?". Retrieved 12 November 2012.
- ^ Falvey, Christian (29 September 2011). "Passerby stumbles upon radioactive playground thanks to wristwatch". Radio Prague. Retrieved 21 November 2012.
외부 링크
| 무료 사전인 Wiktionary에서 브라키테라피를 찾아보십시오. |