세포표면수용체
Cell surface receptor세포 표면 수용체(막 수용체, 막 통과 수용체)는 세포의 혈장 막에 내장된 수용체이다.그들은 세포 외 분자를 받아 세포 신호 전달에 작용한다.그들은 세포와 세포외 공간 사이의 통신을 가능하게 하는 특수 일체형 막 단백질이다.세포외 분자는 호르몬, 신경전달물질, 사이토카인, 성장인자, 세포접착분자 또는 영양소일 수 있다. 세포외 분자는 세포의 신진대사와 활동의 변화를 유도하기 위해 수용체와 반응한다.신호 전달 과정에서 리간드 결합은 세포막을 통한 계단식 화학적 변화에 영향을 미친다.
구조 및 메커니즘
많은 막 수용체는 막 통과 단백질이다.당단백질, 지단백질 [1]등 다양한 종류가 있습니다.수백 개의 다른 수용체들이 알려져 있고 더 많은 수용체들이 아직 [2][3]연구되지 않았다.트랜스막 수용체는 일반적으로 3차(3차원) 구조에 따라 분류된다.3차원 구조가 불분명한 경우에는 막 위상에 따라 분류할 수 있다.가장 단순한 수용체에서는 폴리펩타이드 사슬이 지질 이중층을 한 번 교차하는 반면, G-단백질 결합 수용체와 같은 다른 수용체는 7번 교차한다.각 세포막은 다양한 표면 분포를 가진 여러 종류의 막 수용체를 가질 수 있습니다.또한 단일 수용체는 막의 종류 및 세포 기능에 따라 다른 막 위치에서 다르게 분포될 수 있다.수용체는 균등하게 [4][5]분포하기보다는 막 표면에 모여 있는 경우가 많다.
메커니즘
막 통과 수용체의 작용 메커니즘을 설명하기 위해 두 가지 모델이 제안되었다.
- 디머라이제이션:이합체화 모델은 리간드 결합 전에 수용체가 단량체 형태로 존재함을 시사한다.작용제 결합이 발생하면 단량체가 결합되어 활성 이합체를 형성합니다.
- 회전: 리셉터의 세포외 부분에 대한 리간드 결합은 리셉터의 막 통과 나선 일부의 회전(구성 변화)을 유도한다.이 회전은 수용체의 어떤 부분이 세포 내 쪽에 노출되는지를 변화시키며,[6] 수용체가 세포 내의 다른 단백질과 상호작용하는 방법을 변화시킨다.
도메인
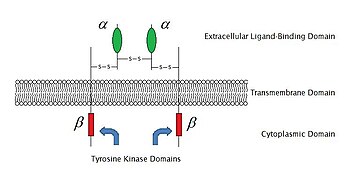
혈장막의 막 통과 수용체는 보통 세 부분으로 나눌 수 있다.
세포외 도메인
세포외 도메인은 세포나 세포기관에서 외부로 나온다.폴리펩타이드 사슬이 이중층을 여러 번 교차할 경우 외부 도메인은 막을 통해 얽힌 루프를 포함한다.정의에 따르면 수용체의 주요 기능은 리간드의 종류를 인식하고 반응하는 것이다.예를 들어 신경전달물질, 호르몬 또는 원자이온은 각각 수용체에 결합된 리간드로 세포외 도메인에 결합할 수 있다.Klotho는 리셉터가 리간드(FGF23)를 인식하도록 영향을 미치는 효소이다.
막 통과 도메인
가장 풍부한 두 종류의 막 통과 수용체는 GPCR과 단일 패스 막 통과 단백질이다.[7][8]니코틴성 아세틸콜린 수용체와 같은 일부 수용체에서는 막 통과 막 도메인이 막 또는 이온 채널 주위에 단백질 기공을 형성한다.적절한 배위자의 결합에 의해 세포외 도메인이 활성화되면 모공은 이온에 접근할 수 있게 되고 이온은 확산된다.다른 수용체에서는 결합 시 막 통과 도메인은 세포 내 조건에 영향을 미치는 구조 변화를 겪는다.7TM 슈퍼패밀리의 멤버와 같은 일부 수용체에서 트랜스막 도메인은 리간드 결합 포켓을 포함한다.
세포내 도메인
수용체의 세포내(또는 세포질) 도메인은 세포 또는 세포소기관 내부와 상호작용하여 신호를 전달합니다.이 상호 작용에는 다음 두 가지 기본 경로가 있습니다.
- 세포 내 도메인은 단백질-단백질 상호작용을 통해 이펙터 단백질과 통신하고, 이펙터 단백질은 신호를 목적지에 전달합니다.
- 효소 결합 수용체를 통해 세포 내 도메인은 효소 활성을 갖는다.종종, 이것은 티로신 키나아제 활성이다.효소 활성은 또한 세포 내 도메인과 관련된 효소 때문일 수 있다.
신호 변환
막 수용체를 통한 신호 전달 과정은 배위자가 막 수용체에 결합하는 외부 반응과 세포 내 [9][10]반응이 트리거되는 내부 반응을 포함한다.
멤브레인 수용체를 통한 신호 전달에는 네 가지 부분이 필요합니다.
- 세포외 시그널링 분자: 세포외 시그널링 분자는 1개의 세포에 의해 생성되며 적어도 인접한 세포로 이동할 수 있다.
- 수용체 단백질: 세포는 세포 표면 수용체 단백질을 가지고 있어야 하며, 이 단백질은 신호 분자에 결합하고 세포 내부로 통신합니다.
- 세포 내 신호 전달 단백질: 이것들은 세포의 세포 기관에 신호를 전달합니다.신호 분자가 수용체 단백질에 결합하면 신호 캐스케이드를 시작하는 세포 내 신호 단백질이 활성화된다.
- 표적단백질: 표적단백질의 구조나 다른 특성은 신호경로가 활성화되고 [10]세포의 행동을 변화시킬 때 변화된다.
멤브레인 수용체는 구조와 기능에 따라 크게 3가지로 나뉜다.이온 채널 연결 수용체효소결합수용체 및 G단백질결합수용체.
- 이온 채널 결합 수용체는 음이온 및 양이온에 대한 이온 채널을 가지며, 다발성 막 통과 단백질의 큰 패밀리를 구성한다.그들은 보통 뉴런과 같은 전기적으로 활성화된 세포에서 발견되는 빠른 신호 전달 이벤트에 참여합니다.그것들은 또한 리간드 게이트 이온 채널이라고 불립니다.이온 채널의 개폐는 신경전달물질에 의해 제어된다.
- 효소 결합 수용체는 효소 자체이거나 관련 효소를 직접 활성화한다.이들은 전형적으로 단일 패스 트랜스막 수용체이며, 수용체의 효소 성분이 세포 내에 보관된다.효소 관련 수용체의 대부분은 단백질 키나아제이거나 단백질 키나아제이다.
- G단백질결합수용체는 7개의 막간나선을 가진 일체형 막단백질이다.이들 수용체는 작용제 결합 시 G단백질을 활성화하고, G단백질은 세포 내 신호전달 경로에 대한 수용체 효과를 매개한다.
이온채널연결수용체
뉴런의 신호 전달 이벤트 동안 신경 전달 물질은 수용체에 결합하고 단백질의 구조를 변화시킨다.이렇게 하면 이온 채널이 열리고 세포 외 이온이 세포 안으로 들어갈 수 있습니다.플라즈마막의 이온투과성을 변화시켜 세포외 화학신호를 세포내 전기신호로 변환하여 세포 들뜸성을 [11]변화시킨다.
아세틸콜린 수용체는 양이온 채널에 연결된 수용체이다.단백질은 알파(α), 베타(β), 감마(β), 델타(δ)의 4개의 서브 유닛으로 구성됩니다.2개의 α 서브유닛이 있으며, 각각 하나의 아세틸콜린 결합 부위가 있다.이 수용체는 세 가지 구성으로 존재할 수 있습니다.폐쇄 및 미사용 상태는 단백질의 네이티브 배치입니다.아세틸콜린의 2분자가 α 서브유닛상의 결합부위에 결합하기 때문에 수용체의 배치가 변화하고 게이트가 열려 많은 이온과 소분자가 들어갈 수 있다.그러나 이 개방 및 점유 상태는 소량 동안만 지속되며 게이트가 닫히면서 폐쇄 및 점유 상태가 됩니다.아세틸콜린의 두 분자는 곧 수용체로부터 분리되어 원래 폐쇄적이고 점유되지 않은 [12][13]상태로 돌아갑니다.
효소결합수용체
2009년 현재 효소 연결 수용체에는 6가지 유형이 알려져 있다.수용체 티로신 키나아제티로신인산화효소 관련 수용체, 수용체 유사 티로신 포스파타아제, 수용체 세린/트레오닌 키나아제, 수용체 관닐릴 사이클라아제 및 히스티딘인산화효소 관련 수용체.수용체 티로신 키나아제들은 가장 많은 모집단과 광범위한 용도를 가지고 있다.이들 분자의 대부분은 표피성장인자(EGF), 혈소판유래성장인자(PDGF), 섬유아세포성장인자(FGF), 간세포성장인자(HGF), 신경성장인자(NGF), 인슐린 등의 호르몬에 대한 수용체이다.이들 수용체의 대부분은 추가적인 신호 전달을 활성화하기 위해 리간드와 결합 후 이량화된다.예를 들어 표피성장인자(EGF) 수용체가 리간드 EGF와 결합하면 두 수용체는 이합체화되어 각 수용체 분자의 효소 부분에서 티로신 잔류물의 인산화 과정을 거친다.이것은 티로신 키나제를 활성화하고 세포 내 반응을 촉진할 것이다.
G단백질결합수용체
G단백질결합수용체는 큰 단백질 계열의 트랜스막수용체를 포함한다.그들은 진핵생물에서만 [14]발견된다.이러한 수용체와 결합하고 활성화하는 리간드는 광감응성 화합물, 냄새, 페로몬, 호르몬 및 신경전달물질을 포함합니다.이것들은 작은 분자에서 펩타이드 그리고 큰 단백질에 이르기까지 크기가 다양합니다.G단백질 결합 수용체는 많은 질병과 관련되어 있으며, 따라서 많은 현대 의약품의 [15]표적이 된다.
G-단백질 결합 수용체와 관련된 두 가지 주요 신호 전달 경로가 있는데, 바로 cAMP 신호 전달 경로와 포스파티딜리노시톨 신호 [16]경로이다.둘 다 G단백질 활성화를 통해 매개된다.G-단백질은 α, β, β로 명명된 세 개의 서브유닛을 가진 삼중성 단백질이다.수용체 활성화에 반응하여 α 서브유닛은 결합 구아노신2인산(GDP)을 방출하고, 구아노신3인산(GTP)에 의해 치환되어 β 서브유닛 및 β 서브유닛에서 분리된다.활성화된 α 서브유닛은 세포 내 시그널링 단백질 또는 표적 기능성 단백질에 직접 영향을 줄 수 있다.
막수용체가 변성 또는 결핍되면 신호전달이 저해되어 질병을 일으킬 수 있다.어떤 질병들은 막수용체 기능의 장애로 인해 발생한다.이것은 수용체 단백질을 암호화하고 조절하는 유전자의 변화를 통한 수용체의 결핍 또는 열화 때문이다.막수용체 TM4SF5는 간세포와 [17]간종의 이동에 영향을 미친다.또한 피질 NMDA 수용체는 막의 유동성에 영향을 미쳐 알츠하이머병으로 [18]변화한다.세포가 비포장 바이러스에 감염되었을 때, 바이러스는 먼저 특정 막 수용체에 결합하고, 그 후 세포막의 세포질 쪽으로 그들 자신 또는 하위 바이러스 성분을 통과시킨다.폴리오 바이러스의 경우, 수용체와의 상호작용이 VP4라고 불리는 비리온 단백질을 방출하는 배열을 일으키는 것으로 체외에서 알려져 있다.VP4의 N 말단은 미리스틸화되어 소수성-산-CH3(CH2)12COOHγ이다.수용체 결합에 의해 유도되는 구조 변화는 VP4에 미리스트산이 부착되고 RNA에 대한 채널이 형성되는 결과를 낳는 것으로 제안되었다.
구조 기반 의약품 설계
X선 결정학, NMR 분광학 등의 방법을 통해 표적 분자의 3D 구조에 대한 정보가 극적으로 증가하였고, 리간드에 대한 구조 정보도 증가하였다.이는 구조 기반 의약품 설계의 빠른 발전을 촉진합니다.이 신약들 중 일부는 막 수용체를 대상으로 한다.구조 기반 의약품 설계에 대한 현재의 접근법은 두 가지 범주로 나눌 수 있다.첫 번째 범주는 주어진 수용체에 대한 리간드를 결정하는 것이다.이것은 보통 데이터베이스 쿼리, 생물물리학적 시뮬레이션 및 화학 라이브러리 구축을 통해 달성된다.각각의 경우 수용체의 결합 포켓에 적합한 잠재적 리간드 분자를 찾기 위해 다수의 잠재적 리간드 분자를 스크리닝한다.이 접근방식은 보통 리간드 기반 약물 설계라고 한다.데이터베이스 검색의 주요 장점은 시간과 전력을 절약하여 새로운 효과적인 화합물을 얻을 수 있다는 것입니다.구조 기반 의약품 설계의 또 다른 접근법은 리셉터 기반 의약품 설계라고 불리는 리간드를 조합적으로 매핑하는 것이다.이 때 작은 조각을 단계적으로 조립함으로써 결합 포켓의 제약 내에서 리간드 분자를 조작한다.이 조각들은 원자이거나 분자일 수 있다.이러한 방법의 주요 장점은 새로운 구조를 [19][20][21]발견할 수 있다는 것이다.
기타 예
- 아드레날린수용체
- 후각 수용체
- 수용체티로신인산화효소
- 표피증식인자수용체
- 인슐린 수용체
- 섬유아세포 성장인자 수용체,
- 고친화성 뉴트로핀 수용체
- 에프린 수용체
- 인테그린
- 저친화성 신경증식인자수용체
- NMDA수용체
- 여러 면역 수용체
「 」를 참조해 주세요.
레퍼런스
- ^ Cuatrecasas P. (1974). "Membrane Receptors". Annual Review of Biochemistry. 43: 169–214. doi:10.1146/annurev.bi.43.070174.001125. PMID 4368906. S2CID 44727052.
- ^ Dautzenberg FM, Hauger RL (February 2002). "The CRF peptide family and their receptors: yet more partners discovered". Trends Pharmacol. Sci. 23 (2): 71–7. doi:10.1016/S0165-6147(02)01946-6. PMID 11830263.
- ^ Rivière S, Challet L, Fluegge D, Spehr M, Rodriguez I (May 2009). "Formyl peptide receptor-like proteins are a novel family of vomeronasal chemosensors". Nature. 459 (7246): 574–7. doi:10.1038/nature08029. PMID 19387439.
- ^ Rothberg K.G.; Ying Y.S.; Kamen B.A.; Anderson R.G. (1990). "Cholesterol controls the clustering of the glycophospholipid-anchored membrane receptor for 5-methyltetrahydrofolate". The Journal of Cell Biology. 111 (6): 2931–2938. doi:10.1083/jcb.111.6.2931. PMC 2116385. PMID 2148564.
- ^ Jacobson C.; Côté P.D.; Rossi S.G.; Rotundo R.L.; Carbonetto S. (2001). "The Dystroglycan Complex Is Necessary for Stabilization of Acetylcholine Receptor Clusters at Neuromuscular Junctions and Formation of the Synaptic Basement Membrane". The Journal of Cell Biology. 152 (3): 435–450. doi:10.1083/jcb.152.3.435. PMC 2195998. PMID 11157973.
- ^ Maruyama, Ichiro N. (2015-09-01). "Activation of transmembrane cell-surface receptors via a common mechanism? The "rotation model"". BioEssays. 37 (9): 959–967. doi:10.1002/bies.201500041. ISSN 1521-1878. PMC 5054922. PMID 26241732.
- ^ 멤브롬 데이터베이스의 단일 패스 트랜스막 수용체 슈퍼 패밀리
- ^ 멤마놈 데이터베이스의 단일 패스 트랜스막 단백질 리간드 및 수용체 조절제 슈퍼 패밀리
- ^ Ullricha A., Schlessingerb J.; Schlessinger, J (1990). "Signal transduction by receptors with tyrosine kinase activity". Cell. 61 (2): 203–212. doi:10.1016/0092-8674(90)90801-K. PMID 2158859.
- ^ a b Kenneth B. Storey (1990). Functional Metabolism. Wiley-IEEE. pp. 87–94. ISBN 978-0-471-41090-4.
- ^ Hille B. (2001). Ion channels of excitable membranes. Sunderland, Mass. ISBN 978-0-87893-321-1.
- ^ Miyazawa A.; Fujiyoshi Y.; Unwin N. (2003). "Structure and gating mechanism of the acetylcholine receptor pore". Nature. 423 (6943): 949–955. doi:10.1038/nature01748. PMID 12827192.
- ^ Akabas M.H.; Stauffer D.A.; Xu M.; Karlin A. (1992). "Acetylcholine receptor channel structure probed in cysteine-substitution mutants". Science. 258 (5080): 307–310. doi:10.1126/science.1384130. PMID 1384130.
- ^ King N, Hittinger CT, Carroll SB (2003). "Evolution of key cell signaling and adhesion protein families predates animal origins". Science. 301 (5631): 361–3. doi:10.1126/science.1083853. PMID 12869759.
- ^ Filmore, David (2004). "It's a GPCR world". Modern Drug Discovery. 2004 (November): 24–28.
- ^ Gilman A.G. (1987). "G Proteins: Transducers of Receptor-Generated Signals". Annual Review of Biochemistry. 56: 615–649. doi:10.1146/annurev.bi.56.070187.003151. PMID 3113327. S2CID 33992382.
- ^ Müller-Pillascha F.; Wallrappa C.; Lachera U.; Friessb H.; Büchlerb M.; Adlera G.; Gress T. M. (1998). "Identification of a new tumour-associated antigen TM4SF5 and its expression in human cancer". Gene. 208 (1): 25–30. doi:10.1016/S0378-1119(97)00633-1. PMID 9479038.
- ^ Scheuer K.; Marasb A.; Gattazb W.F.; Cairnsc N.; Förstlb H.; Müller W.E. (1996). "Cortical NMDA Receptor Properties and Membrane Fluidity Are Altered in Alzheimer's Disease". Dementia. 7 (4): 210–214. doi:10.1159/000106881. PMID 8835885.
- ^ Wang R.; Gao Y.; Lai L. (2000). "LigBuilder: A Multi-Purpose Program for Structure-Based Drug Design". Journal of Molecular Modeling. 6 (7–8): 498–516. doi:10.1007/s0089400060498.
- ^ Schneider G.; Fechner U. (2005). "Computer-based de novo design of drug-like molecules". Nature Reviews Drug Discovery. 4 (8): 649–663. doi:10.1038/nrd1799. PMID 16056391.
- ^ Jorgensen W.L. (2004). "The Many Roles of Computation in Drug Discovery". Science. 303 (5665): 1813–1818. doi:10.1126/science.1096361. PMID 15031495. S2CID 1307935.
외부 링크
- IUPHAR GPCR 데이터베이스
- 미국 국립 의학 도서관(MeSH)의 세포+표면+수용체