수상척추
Dendritic spine| 수상척추 | |
|---|---|
 선조체 중간 가시가 있는 뉴런의 가시가 많은 수상돌기. | |
 흔한 종류의 수상돌기 가시. | |
| 세부 사항 | |
| 식별자 | |
| 라틴어 | 보석 수상돌기 |
| 메쉬 | D049229 |
| TH | H2.00.06.1.00036 |
| 미세해부술의 해부학적 용어 | |
수상척추(또는 척추)는 일반적으로 시냅스에서 단일 축삭으로부터 입력을 받는 뉴런 수상돌기의 작은 막상돌기이다.수상돌기는 시냅스 강도의 저장 장소 역할을 하며 뉴런의 세포체에 전기 신호를 전달하는 데 도움을 줍니다.대부분의 가시들은 구근 모양의 머리와 척추의 머리와 수상돌기의 축을 연결하는 얇은 목을 가지고 있습니다.단일 뉴런의 수상돌기는 수백에서 수천 개의 가시를 포함할 수 있습니다.기억 저장과 시냅스 전달을 위한 해부학적 기질을 제공하는 척추 외에도,[1] 그것들은 뉴런 사이의 가능한 접촉의 수를 증가시키는 역할을 할 수도 있다.또한 뉴런의 활동 변화가 척추 [2]형태학에 긍정적인 영향을 미친다는 것이 제안되었다.
구조.
수상돌기는 0.01 μm에서3 0.8 μm3 범위의 척추 머리 부피로 작습니다. 강한 시냅스 접촉이 있는 척추는 일반적으로 막상 목을 통해 수상돌기에 연결되는 큰 척추 머리를 가지고 있습니다.척추 형상의 가장 주목할 만한 부류는 "얇음", "버티", "머쉬룸", "양각"입니다.전자현미경 검사 연구는 [3]이 범주들 사이에 연속적인 모양이 있다는 것을 보여주었다.가변 척추 형태와 부피는 각 척추 시냅스의 강도 및 성숙도와 상관관계가 있는 것으로 생각된다.
분배
수상돌기는 보통 축삭으로부터 흥분성 입력을 받지만, 때로는 억제성 연결과 흥분성 연결이 같은 척추 머리에 [4]이루어지기도 한다.2015년 [5]Lichtman 연구소에서 입증되었듯이, 수상돌기에 대한 흥분 축삭은 시냅스의 존재를 예측하기에 충분하지 않다.
가시는 신피질의 피라미드 뉴런, 선조체의 중간 가시 뉴런, 그리고 소뇌의 푸르키네 세포를 포함한 대부분의 주요 뉴런의 수상돌기에서 발견됩니다.수상돌기는 최대 5개의 가시/1 μm의 수상돌기의 밀도로 발생한다.해마와 피질 피라미드 뉴런은 다른 뉴런으로부터 수만 개의 흥분성 입력을 균등하게 많은 가시에 받을 수 있는 반면, 푸르키네 뉴런 수상돌기의 가시 수는 훨씬 더 큽니다.
세포골격 및 세포소기관
수상돌기의 세포골격은 시냅스 가소성에 특히 중요하다. 동적 세포골격이 없다면 자극에 반응하여 척추의 부피나 형태를 빠르게 바꿀 수 없을 것이다.이러한 형태의 변화는 척추의 전기적 특성에 영향을 미칠 수 있습니다.수상돌기의 세포골격은 주로 필라멘트 액틴(F-actin)으로 만들어진다.튜브린 모노머와 미세관 관련 단백질(MAPs)이 존재하며, 조직화된 미세관이 존재한다.[6]가시가 주로 액틴의 세포 골격을 가지고 있기 때문에, 이것은 모양과 크기가 매우 역동적일 수 있게 해줍니다.액틴 세포골격은 척추의 형태를 직접 결정하며 액틴 조절기, Rac, RhoA 및 CDC42와 같은 작은 GTPases는 이 세포골격을 빠르게 수정한다.Rac1이 과도하게 활성화되면 수지상 가시가 지속적으로 작아집니다.
전기 생리학적 활성과 수용체에 매개되는 활성 외에도, 척추는 방광 활성으로 보이며 단백질을 번역할 수도 있습니다.매끄러운 소포체(SER)의 쌓인 디스크는 수상돌기로 확인되었다.이 "척추 기구"의 형성은 단백질 시냅토포딘에 의존하며 칼슘 처리에서 중요한 역할을 하는 것으로 여겨진다."부드러운" 소포는 또한 수상돌기의 소포 활동을 지지하는 가시에서 확인되었습니다.가시에 폴리리보솜의 존재는 또한 수상돌기뿐만 아니라 척추 자체에서 단백질 번역 활동을 암시합니다.
형태 형성
수상돌기의 형태 형성은 장기전위화(LTP)[7][8] 유도에 매우 중요하다.척추의 형태학은 구상(G-actin) 또는 필라멘트(F-actin) 형태로 액틴 상태에 따라 달라집니다.GTPases의 Rho 패밀리의 역할과 액틴과 척추 운동성의[9] 안정성에 미치는 영향은 기억력에 중요한 영향을 미친다.수지상 척추가 정보 저장의 기본 단위인 경우, 척추가 자발적으로 확장 및 수축하는 능력이 제한되어야 합니다.그렇지 않으면 정보가 손실될 수 있습니다.GTPases의 Rho 패밀리는 [10]액틴 중합을 자극하는 과정에 상당한 기여를 하고, 이는 척추의 크기와 모양을 증가시킨다.큰 가시는 작은 가시에 비해 안정적이며 추가적인 시냅스 [11]활동에 의해 변형에 저항할 수 있습니다.왜냐하면 그 모양과 수지상 가시의 크기 변화를 흥분성 시냅스 연결의 힘을 가지고 그것의 근본적인 액틴의 액틴 규제의 특정 메커니즘 cytoskeleton,[12]지프니므로 GTPases의 화법 가족에 의존한 관련이 있, de의 형성, 성숙,과 적응력에 필수적이다.ndr학습과 기억력에 영향을 미칩니다.
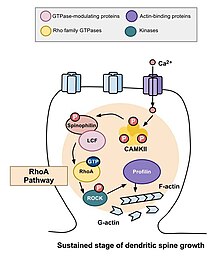
RhoA 경로
척추 형태 형성에 관여하는 주요 Rho GTPases 중 하나는 RhoA이며, RhoA는 또한 세포 분열의 조절과 시기를 조절하는 단백질이다.뉴런의 활성 맥락에서 RhoA는 다음과 같은 방식으로 활성화된다: 일단 칼슘이 NMDA 수용체를 통해 세포에 들어가면, 칼모듈린에 결합하고 CaMKII를 활성화하여 [10]RhoA의 활성화를 이끈다.RhoA 단백질의 활성화는 RhoA 키나제인 ROCK을 활성화하여 LIM 키나제를 자극하고, 이는 다시 단백질 코필린을 억제합니다.코필린의 기능은 세포의 액틴 세포골격을 재구성하는 것이다.즉, 액틴 세그먼트를 탈중합하여 성장 원추의 성장과 [13]축삭의 복구를 억제하는 것이다.
2011년 Murakoshi 등에 의해 수행된 연구는 Rho GTPases RhoA와 Cdc42를 수상돌기 척추 형태 형성에 포함시켰다.두 GTPases는 장기 증강 자극에 의해 야기된 구조적 가소성 동안 쥐 해마의 CA1 영역에 있는 피라미드 뉴런의 단일 수상돌기에서 빠르게 활성화되었다.RhoA와 Cdc42의 동시 활성화로 척추 성장이 5분 동안 최대 300%까지 일시적으로 증가하였고, 이는 30분 [10]동안 작지만 지속적인 성장으로 감소하였다.RhoA의 활성화는 자극을 받는 척추 근방에 확산되었으며, RhoA는 과도기 및 척추 성장의 지속기에도 필요하다고 결정되었다.
Cdc42 경로
Cdc42는 수지상 성장, 분기,[14] 가지 안정성 등 다양한 기능에 관여하고 있습니다.NMDA 수용체를 통한 세포로의 칼슘 유입은 칼모듈린에 결합하고 Ca2+/calmodulin 의존성 단백질 키나아제 II(CaMKII)를 활성화한다.다음으로 CaMKII가 활성화되고 Cdc42가 활성화 됩니다.이후 칼슘 및 CaMKII에 대한 피드백시그널링은 업스트림에 발생하지 않습니다.단량체 강화 녹색 형광 단백질로 태그 부착하면 Cdc42의 활성화가 덴드라이트의 자극 척추만으로 제한됨을 알 수 있다.이는 분자가 가소성 동안 지속적으로 활성화되고 척추 밖으로 확산된 후 즉시 비활성화되기 때문이다.구분된 활동에도 불구하고, Cdc42는 RhoA처럼 자극받은 척추에서 여전히 움직일 수 있습니다.Cdc42는 PAK를 활성화하는데, PAK는 단백질 키나제로서 특이적으로 인산화하여 ADF/코필린을 [15]비활성화시킨다.코필린이 비활성화되면 액틴 중합이 증가하고 척추 부피가 확장됩니다.이러한 척수량 증가를 지속하기 위해서는 Cdc42의 활성화가 필요하다.
구조적 소성 변화 관찰

무라코시, 왕, 야스다(2011)는 단일 수상돌기의 구조적 가소성에 대한 Rho GTPase 활성화의 영향을 조사하여 과도상 및 지속상 [10]간의 차이를 설명했다.
구조적 가소성의 일시적인 변화
단일 수상척추에 2광자 글루탐산염의 저주파열을 적용하면 RhoA와 Cdc42의 신속한 활성화를 유도할 수 있다.다음 2분 동안, 자극받은 척추의 부피는 원래 크기의 300퍼센트까지 확장될 수 있습니다.그러나 척추 형태학의 이러한 변화는 일시적일 뿐이며, 5분 후에 척추의 부피가 감소한다.Rho 억제제인 C3 트랜스페라아제 또는 Rock 억제제인 글리실-H1152의 투여는 척추의 일시적인 확장을 억제하며, 이 과정에서 [10]Rho-Rock 경로의 활성화가 어떤 방식으로든 필요하다는 것을 나타낸다.
구조적 가소성의 지속적인 변화
위에서 설명한 일시적인 변화가 발생한 후 척추의 볼륨이 원래 볼륨의 70~80%까지 증가할 때까지 감소합니다.이러한 구조적 가소성의 지속적인 변화는 약 30분간 지속될 것입니다.다시 한번, C3 트랜스페라아제와 글리실-H1152의 투여는 이러한 성장을 억제했고, 이는 Rho-Rock 경로가 척추 부피의 보다 지속적인 증가를 위해 필요하다는 것을 시사한다.또한 Wasp의 Cdc42 결합 도메인 또는 Pak1 활성화-3(IPA3)을 대상으로 하는 억제제를 투여하면 체적의 지속적인 성장이 감소하여 척수 체적의 증가에도 Cdc42-Pak 경로가 필요하다는 것을 증명한다.이는 구조적 가소성의 지속적인 변화가 메모리의 부호화, 유지보수 및 검색을 위한 메커니즘을 제공할 수 있기 때문에 중요합니다.관찰 결과,[10] 이러한 프로세스에 Rho GTPases가 필요할 수 있습니다.
생리학
수용체 활성
수상돌기는 표면에 있는 글루탐산 수용체(예: AMPA 수용체 및 NMDA 수용체)를 표현한다.BDNF에 대한 TrkB 수용체는 척추 표면에서도 발현되며, 척추 생존에 역할을 하는 것으로 여겨진다.척추 끝에는 "시냅스 후 밀도"(PSD)라고 불리는 전자 밀도 영역이 포함되어 있습니다.PSD는 시냅스 축삭의 활성 영역을 직접 배치하고 척추 막 표면적의 약 10%를 구성합니다; 활성 영역에서 방출된 신경 전달 물질은 척추의 시냅스 후 밀도에서 수용체와 결합합니다.동기 축삭과 수상돌기의 절반은 물리적으로 두 개의 뉴런 사이에 세포 간 접착 접합을 형성하는 칼슘 의존성 카드헤린에 의해 묶여 있습니다.
글루탐산 수용체(GluRs)는 시냅스 후 밀도로 국소화되어 세포골격 요소에 의해 막에 고정된다.일반적으로 혈장막 하부에 연결된 신호 전달 기계 바로 위에 위치하여 GluR에 의해 세포에 전달된 신호가 근처의 신호 전달 요소에 의해 추가로 전파되어 신호 전달 캐스케이드를 활성화할 수 있습니다.GluRs는 인근 신호기 없이는 특정 다운스트림 효과에 영향을 미칠 수 없기 때문에 신호 캐스케이드 활성화를 보장하는 데 있어 신호 요소의 국부화는 특히 중요하다.
글루Rs로부터의 시그널링은 시냅스 후 밀도로 국소화된 단백질, 특히 키나아제들의 풍부한 존재에 의해 매개된다.여기에는 칼슘 의존성 칼모듈린, CaMKII(칼모듈린 의존성 단백질 키나제 II), PKC(단백질 키나제 C), PKA(단백질 키나제 A), 단백질 포스파타아제-1(PP-1) 및 핀티로신 키나제가 포함된다.CaMKII 등의 특정 시그널러는 액티비티에 따라 업 레귤레이션 됩니다.
가시는 생화학적 신호를 구분함으로써 뉴런에 특히 유리하다.이것은 같은 뉴런의 다른 시냅스 상태에 영향을 주지 않고 개별 시냅스 상태의 변화를 부호화하는데 도움을 줄 수 있다.척추 목의 길이와 폭은 구획화 정도에 큰 영향을 미치며, 가느다란 가시가 생화학적으로 가장 고립된 가시입니다.
소성
수상돌기는 매우 "가소성"입니다. 즉, 작은 시간 동안 가시 모양, 부피, 수가 크게 변합니다.가시가 주로 액틴 세포 골격을 가지고 있기 때문에, 그것들은 역동적이고, 대부분의 가시는 액틴 리모델링의 역동성 때문에 몇 초에서 몇 분 안에 모양이 변합니다.게다가, 척추 수는 매우 다양하며 가시가 왔다 갔다 한다; 비록 더 큰 "머쉬룸" 모양의 가시가 가장 안정적이지만, 몇 시간 안에 대뇌 피질의 피라미드 세포에서 10-20%의 가시가 자연적으로 나타나거나 사라질 수 있다.
척추의 유지와 가소성은 활동 의존적이고[16] 활동 의존적이다.BDNF는 부분적으로 척추 [17]수준을 결정하며, 낮은 수준의 AMPA 수용체 활동은 척추 생존을 유지하기 위해 필요하며, NMDA 수용체와 관련된 시냅스 활동은 척추 성장을 촉진합니다.게다가, 2광자 레이저 주사 현미경과 공초점 현미경은 시냅스에 나타나는 자극의 종류에 따라 척추 부피가 변화한다는 것을 보여주었다.
학습과 기억의 중요성
중요성의 증거
척추의 가소성은 동기 부여, 학습,[18][19][20] 기억력과 관련이 있다.특히, 장기 기억은 특정 신경 경로를 강화하기 위해 새로운 수상돌기의 성장(또는 기존의 척추의 확대)에 의해 부분적으로 매개된다.수지상 가시가 입력 [21]활동에 의해 수명이 영향을 받는 플라스틱 구조이기 때문에 척추 역학은 평생 기억의 유지에 중요한 역할을 할 수 있다.
나이 의존적인 척추 회전율 변화는 척추 안정성이 발달 학습에 영향을 미친다는 것을 암시한다.젊은 시절, 수상돌기는 상대적으로 높은 회전율을 보이며 가시의 [1][22][23]순손실을 일으킨다.이러한 높은 척추 회전율은 발달의 중요한 시기를 특징지을 수 있고 청소년기의 학습 능력을 반영할 수 있다. 피질 영역에 따라 발달하는 동안 시냅스 회전의 수준이 달라지며, 특정 뇌 [19][22]영역에 대한 다양한 임계 기간을 반영할 수 있다.하지만 성인이 되면 대부분의 가시가 지속되고 가시의 반감기가 [1]늘어납니다.이러한 안정화는 발달적으로 조절된 척추 제거의 느린 감소로 인해 발생합니다. 이 과정은 [1][22]성숙기에 기억의 안정화의 기반이 될 수 있습니다.
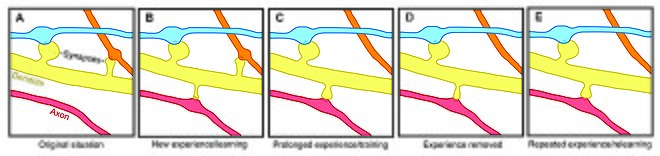
감각 경험이 신경 회로에 어떻게 영향을 미치는지 불분명하지만, 수상 척추 안정성의 경험으로 인한 변화는 또한 장기 기억의 유지와 관련된 메커니즘으로 척추 회전을 지적한다.두 가지 일반 모델은 경험이 구조적 가소성에 미치는 영향을 설명할 수 있다.한편으로 경험과 활동은 학습을 가능하게 하기 위해 의미 있는 정보를 저장하는 관련 시냅스 연결의 이산적 형성을 촉진할 수 있다.한편, 시냅스 접속이 과도하게 형성되어 경험과 활동이 외부 시냅스 [1]접속의 프루닝으로 이어질 수 있다.
모든 연령대의 실험 동물에서 환경적 풍요는 수지상 분지, 척추 밀도, 그리고 전반적인 시냅스 [1]수와 관련이 있다.또한 스킬 트레이닝은 오래된 [18][24]가시를 불안정하게 하면서 새로운 가시를 형성하고 안정화시키는 것으로 나타나 새로운 스킬의 학습은 신경회로의 재배선 과정을 수반한다는 것을 시사한다.척추 리모델링의 정도는 학습의 성공과 관련이 있기 때문에, 이것은 기억 [24]형성에 있어 시냅스 구조적 가소성의 중요한 역할을 시사한다.또한 척추 안정성과 강화의 변화는 빠르게 일어나며 [18][19]훈련 후 몇 시간 이내에 관찰되었습니다.
반대로, 농축과 훈련은 척추 형성과 안정성의 증가와 관련이 있지만, 장기 감각 결핍은 척추 제거[1][22] 속도의 증가로 이어지고 따라서 장기 신경 회로에 영향을 미친다.사춘기 상실 후 감각 경험을 회복하면 척추 제거가 가속화되어 발달 [22]중 척추의 순손실에 경험이 중요한 역할을 한다는 것을 시사한다.또한, 수염 다듬기와 같은 다른 감각 상실 패러다임은 새로운 [25]가시의 안정성을 증가시키는 것으로 나타났습니다.
신경학적 질병과 부상에 대한 연구는 척추 회전의 성격과 중요성을 더욱 명확히 한다.뇌졸중 후 외상 부위 근처에서 구조적 가소성의 현저한 증가가 발생하고 척추 회전의 대조군 비율에서 5 - 8배 증가가 [26]관찰되었다.수상돌기는 허혈 중에 빠르게 분해되고 재조립된다. 뇌졸중과 마찬가지로 생존자들은 수상돌기 척추 [27]교체가 증가했다.알츠하이머병과 지적 장애 사례에서 척추의 순손실이 관찰되는 반면, 코카인과 암페타민 사용은 전전두엽 피질과 [28]핵의 수지상 분기 및 척추 밀도의 증가와 관련이 있다.척추 밀도의 큰 변화가 다양한 뇌 질환에서 발생하기 때문에, 이것은 다양한 병리학적 [28]조건 하에서 불균형에 취약할 수 있는 정상적인 상황에서 척추 역학의 균형 상태를 시사한다.
또한 노화의 결과로 수지상 가시가 손실되었다는 증거가 있다.쥐를 사용한 한 연구는 해마의 척추 밀도의 노화 관련 감소와 해마 학습 [29]및 기억력의 노화 의존성 감소 사이의 상관관계를 지적했다.
중요도 경합
학습과 기억을 매개하는 데 수상 척추 역학의 역할을 제안하는 실험 결과에도 불구하고, 구조적 가소성의 중요성의 정도는 여전히 논란의 여지가 있다.예를 들어, 연구들은 훈련 중에 형성된 척추의 극히 일부만이 실제로 평생 [24]학습에 기여한다고 추정한다.또한, 새로운 척추의 형성은 뇌의 연결에 크게 기여하지 않을 수 있으며, 척추 형성은 척추 [30]머리의 크기 증가와 같은 구조적 가소성의 다른 특성만큼 기억 유지에 많은 영향을 미치지 않을 수 있습니다.
모델링.
이론가들은 수십 년 동안 가시의 잠재적인 전기적 기능에 대해 가설을 세워왔지만, 우리가 가시의 전기적 특성을 조사할 수 없는 것은 최근까지 이론적인 작업이 너무 많이 진척되는 것을 막았다.최근 2광자 글루탐산염의 사용 증가와 함께 영상 기술의 진보로 인해 많은 새로운 발견이 이루어졌습니다; 우리는 이제 척추 [34]두부에 전압 의존적인 나트륨[33],[31][32] 칼륨, 칼슘 채널이 있다고 의심합니다.
케이블 이론은 수동 신경 섬유를 따라 전류의 흐름을 모델링하기 위한 가장 "단순한" 방법 뒤에 있는 이론적 프레임워크를 제공합니다.각 척추는 2개의 구획으로 취급할 수 있습니다.하나는 목을 나타내고 다른 하나는 척추 머리를 나타냅니다.척추 머리를 나타내는 구획에만 활성 특성이 있어야 합니다.
베어와 린젤의 연속체 모형
다수의 척추간 상호작용 분석을 용이하게 하기 위해 Baer & Rinzel은 척추의 분포를 [35]연속체로 취급하는 새로운 케이블 이론을 수립했습니다.이 표현에서 척추두부 전압은 인접한 척추에서 막 전위의 국소 공간 평균입니다.이 조합은 인접한 가시 사이에 직접적인 전기적 결합이 없다는 특징을 유지하며, 수상돌기를 따라 전압이 퍼지는 것이 가시와 상호작용하는 유일한 방법입니다.
스파이크 확산 스파이크 모델
SDS 모델은 전체 Baer 및 Rinzel [36]모델의 계산상 단순한 버전으로 제작되었습니다.분석적으로 다루기 쉽고 가능한 한 적은 자유 매개변수를 가지도록 설계되었으며 척추 목 저항과 같은 가장 중요한 매개변수를 유지하도록 설계되었다.이 모델은 연속체 근사치를 떨어뜨리고 대신 이산 지점에서 흥분성 가시와 결합된 수동 수지상을 사용합니다.척추의 막 역학은 통합 및 화재 과정을 사용하여 모델링됩니다.스파이크 이벤트는 일반적으로 직사각형 함수로 표현되는 파형과 함께 이산적인 방식으로 모델링됩니다.
척추 칼슘 과도 모델링
척추의 칼슘 과도성은 시냅스 [37]가소성의 주요 트리거이다.칼슘에 대한 투과성이 높은 NMDA 수용체는 막 전위가 충분히 탈분극된 경우에만 이온을 전도한다.따라서 시냅스 활동 중에 척추로 들어가는 칼슘의 양은 척추 두부의 탈분극에 따라 달라집니다.칼슘 이미징 실험(2광자 현미경 검사)과 구획 모델링의 증거는 시냅스 [34][38]활동 중에 높은 저항성의 목을 가진 척추가 더 큰 칼슘 과도현상을 경험한다는 것을 보여준다.
발전
수상돌기는 수상돌기 축에서 직접 발생하거나 수상돌기로부터 발달할 수 있다.[39]시냅트 형성 중에 수상돌기는 빠르게 싹트고, 작은 막 오르가넬이 부족한 막돌기를 수축시킨다.최근 I-BAR 단백질 MIM이 개시 [40]과정에 기여하는 것으로 확인되었다.출생 첫 주 동안, 뇌는 필로포디아에 의해 지배되며, 필로포디아는 결국 시냅스를 발달시킨다.하지만, 첫 주 이후, 필로포디아는 가시 돋친 수상돌기뿐만 아니라 가시 돋친 수상돌기에서 튀어나온 작고 뭉툭한 가시로 대체된다.필로포디아가 가시로 발달할 때, 필로포디아는 덴드라이트에 대한 시냅스 전 접촉을 모집하며, 이는 시냅스 전 돌기와의 특별한 시냅스 후 접촉을 처리하기 위한 가시 생성을 장려한다.
그러나 가시는 형성 후에 성숙해야 한다.미성숙한 가시는 신호 전달 능력이 손상되어 전형적으로 "머리"가 없고 목만 있는 반면, 성숙한 가시는 머리와 목을 유지합니다.
임상적 의의
최근 발표된 연구에 따르면 불안 [4]장애의 척추 밀도에 이상이 있는 것으로 나타났다.
ADHD, 알츠하이머, 자폐증, 지적 장애, 연약한 X 증후군과 같은 인지 장애는 수상돌기 척추의 이상, 특히 척추의 수와 [41][42]그 성숙도에서 비롯될 수 있습니다.미성숙한 가시가 시냅스 신호를 손상시키기 때문에 성숙한 가시와 미성숙한 가시의 비율은 신호 전달에 중요합니다.연약한 X 증후군은 피질 수상돌기에 여러 개의 필로포디아를 가진 미성숙한 척추의 과잉으로 특징지어진다.
역사
수상돌기는 19세기 말에 산티아고 라몬 이 카할에 의해 소뇌 [43]뉴런에 대해 처음 기술되었다.Ramon y Cajal은 수상돌기가 뉴런 사이의 접촉 부위의 역할을 할 수 있다고 제안했다.이는 50여 년 뒤 전자현미경의 [44]출현으로 입증됐다.살아있는 조직에 대한 공초점 현미경 검사가 개발되기 전까지는, 일반적으로 배아 발달 중에 가시가 형성되어 출생 후에도 안정된 상태를 유지할 것이라는 것이 인정되었다.이 패러다임에서 시냅스 무게의 변화는 세포 수준에서 기억 과정을 설명하기에 충분한 것으로 간주되었다.그러나 약 10년 전부터 공초점 현미경 검사의 새로운 기술은 수상돌기가 태어난 [45][46][39]후에도 끊임없이 회전하는 운동성이 있고 역동적인 구조라는 것을 증명했다.
레퍼런스
- ^ a b c d e f g Alvarez VA, Sabatini BL (2007). "Anatomical and physiological plasticity of dendritic spines". Annual Review of Neuroscience. 30: 79–97. doi:10.1146/annurev.neuro.30.051606.094222. PMID 17280523.
- ^ Tackenberg C, Ghori A, Brandt R (June 2009). "Thin, stubby or mushroom: spine pathology in Alzheimer's disease". Current Alzheimer Research. 6 (3): 261–8. doi:10.2174/156720509788486554. PMID 19519307.
- ^ Ofer N, Berger DR, Kasthuri N, Lichtman JW, Yuste R (July 2021). "Ultrastructural analysis of dendritic spine necks reveals a continuum of spine morphologies". Developmental Neurobiology. 81 (5): 746–757. doi:10.1002/dneu.22829. PMC 8852350. PMID 33977655. S2CID 234472935.
- ^ a b Evrard MR, Li M, Shen H, Smith SS (October 2021). "Preventing adolescent synaptic pruning in mouse prelimbic cortex via local knockdown of α4βδ GABAA receptors increases anxiety response in adulthood". Scientific Reports. 11 (1): 21059. Bibcode:2021NatSR..1121059E. doi:10.1038/s41598-021-99965-8. PMC 8548505. PMID 34702942.
- ^ Kasthuri N, Hayworth KJ, Berger DR, Schalek RL, Conchello JA, Knowles-Barley S, et al. (July 2015). "Saturated Reconstruction of a Volume of Neocortex". Cell. 162 (3): 648–661. doi:10.1016/j.cell.2015.06.054. PMID 26232230.
- ^ Kapitein LC, Schlager MA, Kuijpers M, Wulf PS, van Spronsen M, MacKintosh FC, Hoogenraad CC (February 2010). "Mixed microtubules steer dynein-driven cargo transport into dendrites". Current Biology. 20 (4): 290–9. doi:10.1016/j.cub.2009.12.052. PMID 20137950. S2CID 12180359.
- ^ Kim CH, Lisman JE (June 1999). "A role of actin filament in synaptic transmission and long-term potentiation". The Journal of Neuroscience. 19 (11): 4314–4324. doi:10.1523/JNEUROSCI.19-11-04314.1999. PMC 6782630. PMID 10341235.
- ^ Krucker T, Siggins GR, Halpain S (June 2000). "Dynamic actin filaments are required for stable long-term potentiation (LTP) in area CA1 of the hippocampus". Proceedings of the National Academy of Sciences of the United States of America. 97 (12): 6856–6861. Bibcode:2000PNAS...97.6856K. doi:10.1073/pnas.100139797. PMC 18765. PMID 10823894.
- ^ Tashiro A, Yuste R (July 2004). "Regulation of dendritic spine motility and stability by Rac1 and Rho kinase: evidence for two forms of spine motility". Molecular and Cellular Neurosciences. 26 (3): 429–440. doi:10.1016/j.mcn.2004.04.001. PMID 15234347. S2CID 21100601.
- ^ a b c d e f Murakoshi H, Wang H, Yasuda R (April 2011). "Local, persistent activation of Rho GTPases during plasticity of single dendritic spines". Nature. 472 (7341): 100–104. Bibcode:2011Natur.472..100M. doi:10.1038/nature09823. PMC 3105377. PMID 21423166.
- ^ Kasai H, Matsuzaki M, Noguchi J, Yasumatsu N, Nakahara H (July 2003). "Structure-stability-function relationships of dendritic spines". Trends in Neurosciences. 26 (7): 360–368. doi:10.1016/S0166-2236(03)00162-0. PMID 12850432. S2CID 18436944.
- ^ Hotulainen P, Hoogenraad CC (May 2010). "Actin in dendritic spines: connecting dynamics to function". The Journal of Cell Biology. 189 (4): 619–629. doi:10.1083/jcb.201003008. PMC 2872912. PMID 20457765.
- ^ Kiss C, Li J, Szeles A, Gizatullin RZ, Kashuba VI, Lushnikova T, et al. (1 January 1997). "Assignment of the ARHA and GPX1 genes to human chromosome bands 3p21.3 by in situ hybridization and with somatic cell hybrids". Cytogenetics and Cell Genetics. 79 (3–4): 228–230. doi:10.1159/000134729. PMID 9605859.
- ^ Scott EK, Reuter JE, Luo L (April 2003). "Small GTPase Cdc42 is required for multiple aspects of dendritic morphogenesis". The Journal of Neuroscience. 23 (8): 3118–3123. doi:10.1523/JNEUROSCI.23-08-03118.2003. PMC 6742332. PMID 12716918.
- ^ Calabrese B, Wilson MS, Halpain S (February 2006). "Development and regulation of dendritic spine synapses". Physiology. 21 (1): 38–47. doi:10.1152/physiol.00042.2005. PMID 16443821.
- ^ De Roo M, Klauser P, Mendez P, Poglia L, Muller D (January 2008). "Activity-dependent PSD formation and stabilization of newly formed spines in hippocampal slice cultures". Cerebral Cortex. 18 (1): 151–161. doi:10.1093/cercor/bhm041. PMID 17517683.
- ^ Kaneko M, Xie Y, An JJ, Stryker MP, Xu B (April 2012). "Dendritic BDNF synthesis is required for late-phase spine maturation and recovery of cortical responses following sensory deprivation". The Journal of Neuroscience. 32 (14): 4790–4802. doi:10.1523/JNEUROSCI.4462-11.2012. PMC 3356781. PMID 22492034.
- ^ a b c Xu T, Yu X, Perlik AJ, Tobin WF, Zweig JA, Tennant K, et al. (December 2009). "Rapid formation and selective stabilization of synapses for enduring motor memories". Nature. 462 (7275): 915–919. Bibcode:2009Natur.462..915X. doi:10.1038/nature08389. PMC 2844762. PMID 19946267.
- ^ a b c Roberts TF, Tschida KA, Klein ME, Mooney R (February 2010). "Rapid spine stabilization and synaptic enhancement at the onset of behavioural learning". Nature. 463 (7283): 948–952. Bibcode:2010Natur.463..948R. doi:10.1038/nature08759. PMC 2918377. PMID 20164928.
- ^ Tschida KA, Mooney R (March 2012). "Deafening drives cell-type-specific changes to dendritic spines in a sensorimotor nucleus important to learned vocalizations". Neuron. 73 (5): 1028–1039. doi:10.1016/j.neuron.2011.12.038. PMC 3299981. PMID 22405211.
- ^ De Roo M, Klauser P, Muller D (September 2008). "LTP promotes a selective long-term stabilization and clustering of dendritic spines". PLOS Biology. 6 (9): e219. doi:10.1371/journal.pbio.0060219. PMC 2531136. PMID 18788894.
- ^ a b c d e Zuo Y, Lin A, Chang P, Gan WB (April 2005). "Development of long-term dendritic spine stability in diverse regions of cerebral cortex". Neuron. 46 (2): 181–189. doi:10.1016/j.neuron.2005.04.001. PMID 15848798. S2CID 16232150.
- ^ Holtmaat AJ, Trachtenberg JT, Wilbrecht L, Shepherd GM, Zhang X, Knott GW, Svoboda K (January 2005). "Transient and persistent dendritic spines in the neocortex in vivo". Neuron. 45 (2): 279–291. doi:10.1016/j.neuron.2005.01.003. PMID 15664179. S2CID 13320649.
- ^ a b c Yang G, Pan F, Gan WB (December 2009). "Stably maintained dendritic spines are associated with lifelong memories". Nature. 462 (7275): 920–924. Bibcode:2009Natur.462..920Y. doi:10.1038/nature08577. PMC 4724802. PMID 19946265.
- ^ Holtmaat A, Wilbrecht L, Knott GW, Welker E, Svoboda K (June 2006). "Experience-dependent and cell-type-specific spine growth in the neocortex". Nature. 441 (7096): 979–983. Bibcode:2006Natur.441..979H. doi:10.1038/nature04783. PMID 16791195. S2CID 4428322.
- ^ Brown CE, Li P, Boyd JD, Delaney KR, Murphy TH (April 2007). "Extensive turnover of dendritic spines and vascular remodeling in cortical tissues recovering from stroke". The Journal of Neuroscience. 27 (15): 4101–4109. doi:10.1523/JNEUROSCI.4295-06.2007. PMC 6672555. PMID 17428988.
- ^ Brown CE, Murphy TH (April 2008). "Livin' on the edge: imaging dendritic spine turnover in the peri-infarct zone during ischemic stroke and recovery". The Neuroscientist. 14 (2): 139–146. doi:10.1177/1073858407309854. PMID 18039977. S2CID 46267737.
- ^ a b Bhatt DH, Zhang S, Gan WB (2009). "Dendritic spine dynamics". Annual Review of Physiology. 71: 261–282. doi:10.1146/annurev.physiol.010908.163140. PMID 19575680.
- ^ von Bohlen und Halbach O, Zacher C, Gass P, Unsicker K (March 2006). "Age-related alterations in hippocampal spines and deficiencies in spatial memory in mice". Journal of Neuroscience Research. 83 (4): 525–531. doi:10.1002/jnr.20759. PMID 16447268. S2CID 30838296.
- ^ Harris KM, Fiala JC, Ostroff L (April 2003). "Structural changes at dendritic spine synapses during long-term potentiation". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 358 (1432): 745–748. doi:10.1098/rstb.2002.1254. PMC 1693146. PMID 12740121.
- ^ Araya R, Nikolenko V, Eisenthal KB, Yuste R (July 2007). "Sodium channels amplify spine potentials". Proceedings of the National Academy of Sciences of the United States of America. 104 (30): 12347–12352. Bibcode:2007PNAS..10412347A. doi:10.1073/pnas.0705282104. PMC 1924793. PMID 17640908.
- ^ Ngo-Anh TJ, Bloodgood BL, Lin M, Sabatini BL, Maylie J, Adelman JP (May 2005). "SK channels and NMDA receptors form a Ca2+-mediated feedback loop in dendritic spines". Nature Neuroscience. 8 (5): 642–649. doi:10.1038/nn1449. PMID 15852011. S2CID 385712.
- ^ Yuste R, Denk W (June 1995). "Dendritic spines as basic functional units of neuronal integration". Nature. 375 (6533): 682–684. Bibcode:1995Natur.375..682Y. doi:10.1038/375682a0. PMID 7791901. S2CID 4271356.
- ^ a b Bywalez WG, Patirniche D, Rupprecht V, Stemmler M, Herz AV, Pálfi D, et al. (February 2015). "Local postsynaptic voltage-gated sodium channel activation in dendritic spines of olfactory bulb granule cells". Neuron. 85 (3): 590–601. doi:10.1016/j.neuron.2014.12.051. PMID 25619656.
- ^ Baer SM, Rinzel J (April 1991). "Propagation of dendritic spikes mediated by excitable spines: a continuum theory". Journal of Neurophysiology. 65 (4): 874–890. doi:10.1152/jn.1991.65.4.874. PMID 2051208.
- ^ Bressloff PC, Coombes S (2000). "Solitary Waves in a Model of Dendritic Cable with Active Spines". SIAM Journal on Applied Mathematics. 61 (2): 432–453. CiteSeerX 10.1.1.104.1307. doi:10.1137/s0036139999356600. JSTOR 3061734.
- ^ Nevian T, Sakmann B (October 2006). "Spine Ca2+ signaling in spike-timing-dependent plasticity". The Journal of Neuroscience. 26 (43): 11001–11013. doi:10.1523/JNEUROSCI.1749-06.2006. PMC 6674669. PMID 17065442.
- ^ Grunditz A, Holbro N, Tian L, Zuo Y, Oertner TG (December 2008). "Spine neck plasticity controls postsynaptic calcium signals through electrical compartmentalization". The Journal of Neuroscience. 28 (50): 13457–13466. doi:10.1523/JNEUROSCI.2702-08.2008. PMC 6671740. PMID 19074019.
- ^ a b Yoshihara Y, De Roo M, Muller D (April 2009). "Dendritic spine formation and stabilization". Current Opinion in Neurobiology. 19 (2): 146–53. doi:10.1016/j.conb.2009.05.013. PMID 19523814. S2CID 5054448.
- ^ Saarikangas J, Kourdougli N, Senju Y, Chazal G, Segerstråle M, Minkeviciene R, et al. (June 2015). "MIM-Induced Membrane Bending Promotes Dendritic Spine Initiation". Developmental Cell. 33 (6): 644–659. doi:10.1016/j.devcel.2015.04.014. PMID 26051541.
- ^ Pelucchi S, Stringhi R, Marcello E (January 2020). "Dendritic Spines in Alzheimer's Disease: How the Actin Cytoskeleton Contributes to Synaptic Failure". International Journal of Molecular Sciences. 21 (3): 908. doi:10.3390/ijms21030908. PMC 7036943. PMID 32019166.
- ^ Penzes P, Cahill ME, Jones KA, VanLeeuwen JE, Woolfrey KM (March 2011). "Dendritic spine pathology in neuropsychiatric disorders". Nature Neuroscience. 14 (3): 285–293. doi:10.1038/nn.2741. PMC 3530413. PMID 21346746.
- ^ Ramón y Cajal S (1888). "Estructura de los centros nerviosos de las aves". Rev. Trim. Histol. Norm. Pat. 1: 1–10.
- ^ Gray EG (June 1959). "Electron microscopy of synaptic contacts on dendrite spines of the cerebral cortex". Nature. 183 (4675): 1592–1593. Bibcode:1959Natur.183.1592G. doi:10.1038/1831592a0. PMID 13666826. S2CID 4258584.
- ^ Dailey ME, Smith SJ (May 1996). "The dynamics of dendritic structure in developing hippocampal slices". The Journal of Neuroscience. 16 (9): 2983–2994. doi:10.1523/JNEUROSCI.16-09-02983.1996. PMC 6579052. PMID 8622128.
- ^ Bonhoeffer T, Yuste R (September 2002). "Spine motility. Phenomenology, mechanisms, and function". Neuron. 35 (6): 1019–1027. doi:10.1016/s0896-6273(02)00906-6. PMID 12354393. S2CID 10183317.
추가 정보
- Levitan IB, Kaczmarek LK (2002). The Neuron: Cell and Molecular Biology (Third ed.). New York: Oxford University Press. ISBN 978-0-19-514522-9.
- Sudhof TC, Stevens CF, Cowan WM (2001). Synapses. Baltimore: The Johns Hopkins University Press. ISBN 978-0-8018-6498-8.
- Kasai H, Matsuzaki M, Noguchi J, Yasumatsu N (October 2002). "[Dendritic spine structures and functions]". Nihon Shinkei Seishin Yakurigaku Zasshi = Japanese Journal of Psychopharmacology. 22 (5): 159–164. PMID 12451686.
- Lieshoff C, Bischof HJ (March 2003). "The dynamics of spine density changes". Behavioural Brain Research. 140 (1–2): 87–95. doi:10.1016/S0166-4328(02)00271-1. PMID 12644282. S2CID 2275781.
- Lynch G, Rex CS, Gall CM (January 2007). "LTP consolidation: substrates, explanatory power, and functional significance". Neuropharmacology. 52 (1): 12–23. doi:10.1016/j.neuropharm.2006.07.027. PMID 16949110. S2CID 22652804.
- Matsuzaki M, Honkura N, Ellis-Davies GC, Kasai H (June 2004). "Structural basis of long-term potentiation in single dendritic spines". Nature. 429 (6993): 761–766. Bibcode:2004Natur.429..761M. doi:10.1038/nature02617. PMC 4158816. PMID 15190253.
- Nimchinsky EA, Sabatini BL, Svoboda K (2002). "Structure and function of dendritic spines". Annual Review of Physiology. 64: 313–353. doi:10.1146/annurev.physiol.64.081501.160008. PMID 11826272.
- Yuste R, Majewska A, Holthoff K (July 2000). "From form to function: calcium compartmentalization in dendritic spines". Nature Neuroscience. 3 (7): 653–659. doi:10.1038/76609. PMID 10862697. S2CID 33466678.