뼈.
Bone| 뼈. | |
|---|---|
 멸종된 코끼리 종의 플레이스토세 빙하기 시대의 뼈 | |
 10,000×배율로 뼈의 전자 현미경을 스캔합니다. | |
| 식별자 | |
| 메쉬 | D001842 |
| TA98 | A02.0.00.000 |
| TA2 | 366, 377 |
| TH | H3.01.00.0.00001 |
| FMA | 5018 |
| 해부학 용어 | |
뼈는 대부분의 척추동물에서 골격의 일부를 구성하는 단단한[1] 기관이다.뼈는 신체의 다양한 다른 장기를 보호하고, 적혈구와 백혈구를 생성하며, 미네랄을 저장하고, 신체에 구조와 지지대를 제공하고, 이동성을 가능하게 한다.뼈는 다양한 모양과 크기로 나타나며 복잡한 내부와 외부 [2]구조를 가지고 있다.가볍지만 튼튼하고 단단하며 다양한 기능을 제공합니다.
뼈 조직(점액 조직)은 셀 수 없는 의미에서 뼈라고도 불리며 특수 결합 조직의 일종인 단단한 조직이다.내부에 벌집모양의 매트릭스가 있어 뼈의 강성을 높여줍니다.뼈 조직은 다른 종류의 뼈 세포로 구성되어 있다.골아세포와 골세포는 뼈의 형성과 광화에 관여하고 골아세포는 뼈 조직의 재흡수에 관여한다.변형된(평탄화된) 골아세포는 뼈 표면에 보호층을 형성하는 라이닝 세포가 됩니다.뼈 조직의 광물화된 매트릭스는 주로 오세인이라고 불리는 콜라겐의 유기 성분과 다양한 소금으로 이루어진 뼈 미네랄의 무기 성분을 가지고 있습니다.골조직은 피질골과 결석골의 두 가지 종류의 미네랄화된 조직이다.뼈에서 발견되는 다른 종류의 조직으로는 골수, 내막, 골막, 신경, 혈관, 연골이 있다.
태어날 때 인간의 몸에는 약 300개의 뼈가 있다; 이 뼈들 중 다수는 발달 과정에서 합쳐지고, 성인에게서 총 206개의 분리된 뼈를 남기며, 수많은 작은 세사모이드 [3][4][5]뼈를 세지 않는다.몸에서 가장 큰 뼈는 대퇴골 또는 허벅지뼈이고, 가장 작은 것은 중이에 있는 등골이다.
그리스어로 뼈를 뜻하는 단어는 στνννννostostostostostostostostostostost(osteon)이다.그래서 골병증과 같은 접두사로 사용하는 많은 용어들이 있다.
구조.
뼈는 균일하게 단단하지 않지만 유연한 매트릭스(약 30%)와 결합 미네랄(약 70%)로 구성되며, 이들은 복잡하게 짜여져 있고 전문화된 뼈 세포 그룹에 의해 끝없이 개조된다.그들의 독특한 구성과 디자인은 뼈를 비교적 단단하고 튼튼하게 만들면서도 가벼운 체중을 유지하게 해준다.
뼈 매트릭스는 90~95%가 탄성 콜라겐 섬유로 이루어져 있는데,[6] 이는 오세인이라고도 하며 나머지는 분쇄된 [7]물질입니다.콜라겐의 탄력성이 골절 [8]저항성을 향상시킵니다.기질은 무기 미네랄 소금인 인산칼슘이 칼슘 하이드록실라파타이트의 한 형태인 뼈 미네랄로 알려진 화학적 배열에 결합함으로써 경화됩니다.뼈를 단단하게 만드는 것은 광물화입니다.
뼈는 골아세포와 골아세포로 알려진 특수 골세포에 의해 일생 동안 활발하게 건설되고 개조됩니다.단일 뼈 내에서 조직은 피질골과 결석골이라고 알려진 두 가지 주요 패턴으로 짜여져 있으며 각각 다른 모양과 특징을 가지고 있습니다.
코텍스
뼈의 단단한 바깥층은 결석골보다 훨씬 밀도가 높아 콤팩트골이라고도 불리는 피질골로 이루어져 있다.그것은 뼈의 단단한 외피를 형성한다.피질골은 부드럽고 하얗고 단단한 외관을 가진 뼈로 성인 [9]골격의 80%를 차지한다.그것은 뼈의 주요 기능을 용이하게 합니다. – 온몸을 지탱하고, 장기를 보호하고, 움직임을 위한 지렛대를 제공하고, 주로 칼슘을 포함한 화학적인 요소들을 저장하고 배출합니다.그것은 여러 개의 미세한 기둥으로 구성되어 있으며, 각각 골격계 또는 하버시안계라고 불린다.각 기둥은 해빙관이라고 불리는 중앙관 주위에 있는 골아세포와 골세포의 여러 층이다.볼크만의 직각의 관은 골격을 서로 연결한다.기둥은 신진대사로 활성화되어 있으며, 뼈가 재흡수되고 골격 내 세포의 특성과 위치가 변화합니다.피질골은 외표면에는 골막, 내표면에는 골막으로 덮여 있다.내막은 피질골과 결석골 [10]사이의 경계선이다.피질골의 주요 해부학적 및 기능적 단위는 골격입니다.
트라베쿨류
사골 또는 해면상 [10]뼈라고도 불리는 해면상 뼈는 골격 뼈의 내부 조직이며 바이오 [11]폼의 물질적 특성을 따르는 개방 세포 다공질 네트워크입니다.결석골은 피질골보다 표면적 대 체적비가 높고 밀도가 낮다.이것은 그것을 더 약하고 유연하게 만든다.표면적이 넓기 때문에 칼슘 이온의 교환과 같은 대사 활동에도 적합합니다.취소골은 일반적으로 긴 뼈의 끝, 관절 근처 그리고 척추 안쪽에서 발견됩니다.결석골은 혈관이 강하고 혈구 생성인 조혈이 발생하는 적혈구 골수를 포함하는 경우가 많다.취소골의 주요 해부학적 및 기능적 단위는 트라베큘라입니다.사시는 대퇴골과 같은 긴 뼈 내에서 뼈에 발생하는 기계적 하중 분포 쪽으로 정렬됩니다.짧은 뼈에 관한 한, 척추 경골에서 [12]삼엽정렬이 연구되었다.내막에 덮여있는 얇은 골아세포는 트라베큘라라고 알려진 [13]불규칙한 공간망을 형성한다.이 공간 안에는 혈소판, 적혈구,[13] 백혈구를 생성하는 골수와 조혈모세포가 있다.사골수는 전체 장기를 가볍게 만들고 혈관과 골수를 위한 공간을 허용하는 막대기와 판 모양의 요소들로 구성된 네트워크로 구성되어 있습니다.사골은 전체 골량의 20%를 차지하지만 치밀골의 [14]표면적은 거의 10배입니다.
cancelous와 trabecular라는 단어는 조직을 형성하는 작은 격자 모양의 단위(trabeculae)를 가리킨다.그것은 크리스토모 [15]마르티네스의 판화에서 처음으로 정확하게 설명되었다.
골수
적골수에서 골수 조직으로도 알려진 골수는 결석 조직을 유지하는 거의 모든 뼈에서 발견될 수 있습니다.신생아의 경우 이러한 뼈는 모두 적골수 또는 조혈수로만 채워지지만, 나이가 들수록 조혈분율이 감소하고 골수지방조직(MAT)이라는 지방분율/황색분율이 증가한다.성인의 붉은 골수는 대퇴골, 갈비뼈, 척추, 골반뼈의 [16]골수에서 주로 발견된다.
셀
뼈는 여러 종류의 세포로 구성된 신진대사 활성 조직이다.이러한 세포에는 뼈 조직의 생성과 광화에 관여하는 골아세포, 뼈 조직의 재흡수에 관여하는 골아세포 및 골아세포가 포함됩니다.골아세포와 골세포는 골생성세포에서 유래하지만 골아세포는 대식세포와 단구 [17]형성을 위해 분화하는 동일한 세포에서 유래한다.뼈의 골수 안에는 조혈모세포도 있다.이 세포들은 백혈구, 적혈구, [18]혈소판을 포함한 다른 세포들을 발생시킨다.
골아세포
골아세포는 단핵을 형성하는 세포이다.그것들은 뼈의 솔기 표면에 위치해 있으며,[19] 뼈가 되기 위해 광물로 변하는 골상질이라고 알려진 단백질 혼합물을 만든다.골상 심은 아직 미네랄화되지 않은 새로 형성된 유기 매트릭스의 좁은 부위로 뼈 표면에 위치해 있습니다.골상체는 주로 I형 콜라겐으로 구성되어 있다.골아세포는 또한 뼈 자체에 작용하기 위해 프로스타글란딘과 같은 호르몬을 생산한다.골아세포는 새로운 뼈를 만들고 복구한다.먼저, 골아세포는 콜라겐 섬유를 올린다.이 콜라겐 섬유는 골아세포 작업의 골격으로 사용됩니다.골아세포는 수산화물과 중탄산 이온에 의해 경화된 인산칼슘을 퇴적시킨다.골아세포에 의해 만들어진 새로운 뼈는 [20]골상골이라고 불린다.일단 골아세포가 활동을 마치면 그것은 실제로 굳어지면 뼈 안에 갇히게 된다.골아세포가 갇히면 골세포로 알려지게 된다.다른 골아세포는 새로운 뼈의 맨 위에 남아서 밑의 뼈를 보호하는 데 사용됩니다. 이것들은 라이닝 [citation needed]세포라고 알려져 있습니다.
골세포
골세포는 중간엽에서 유래한 세포로, 골아세포로 이동해 갇히고 그들 스스로 [10]생성된 골기질로 둘러싸인 골아세포에서 유래한다.광화된 콜라겐 타입 I 매트릭스 내에서 골세포의 세포체가 차지하는 공간은 라쿠나라고 알려진 반면, 골세포 과정은 관상이라고 불리는 채널을 차지한다.골세포의 많은 과정은 아마도 [21]의사소통의 목적으로 골아세포, 골아세포, 골내피세포, 그리고 다른 골세포를 만나기 위해 뻗는다.골세포는 간극 접합을 통해 뼈에 있는 다른 골세포와 접촉을 유지하며, 이는 관상 채널을 통과하는 결합 세포 과정이다.
골아세포
골아세포는 매우 큰 다핵세포로 뼈의 재흡수 과정에 의해 뼈가 파괴되는 원인이 된다.그런 다음 골아세포에 의해 새로운 뼈가 형성된다.뼈는 골아세포의 재흡수에 의해 지속적으로 리모델링되고 [17]골아세포에 의해 생성됩니다.골아세포는 Howship's lacunae(또는 흡수구)라고 불리는 뼈 표면에 위치한 여러 개의 핵을 가진 큰 세포입니다.이 열상은 주변의 뼈 조직이 [22]재흡수된 결과입니다.골세포는 단구줄기세포 계통에서 유래하기 때문에 순환대식세포와 [17]유사한 식세포 형태의 메커니즘을 갖추고 있다.골세포는 성숙하거나 분리된 뼈 표면으로 이동합니다.도착 시 미네랄 [citation needed]기질에 대해 주석산 내성산인산가수분해효소 등의 활성효소가 분비된다.골아세포에 의한 뼈의 재흡수도 칼슘 항상성에 [22]한몫한다.
구성.
뼈는 미네랄화된 유기 매트릭스에 내장된 살아있는 세포(오스트아세포와 골세포)로 구성됩니다.인체 뼈의 1차 무기 성분은 주요 골격 광물인 히드록시아파타이트로 명목상10 Ca(PO4)(6OH)2[23]의 조성을 가지고 있다.이 매트릭스의 유기성분은 주로 I형 콜라겐(인체의 결과로 생성된 물질을 지칭하는 "유기")과 무기성분, 그리고 지배적인 히드록시아파타이트 단계와 함께 소금을 포함한 칼슘과 인산염의 다른 화합물들로 구성됩니다.뼈의 무세포성분의 약 30%는 유기물로 구성되며 질량 기준 약 70%는 무기상에 [24]기인한다.콜라겐 섬유는 뼈에 인장 강도를 부여하고 히드록시아파타이트의 산재 결정은 뼈에 압축 강도를 부여합니다.이러한 효과는 상승 [24]효과가 있습니다.매트릭스의 정확한 구성은 영양과 생물미네랄화로 인해 시간이 지남에 따라 변경될 수 있으며 인산염 대비 칼슘의 비율은 (중량당) 1.3 ~ 2.0 사이로 다양하며 마그네슘, 나트륨, 칼륨, 탄산염 등의 미량 미네랄도 발견된다.[24]
I형 콜라겐은 유기 기질의 90~95%를 구성하며, 나머지 기질은 히알루론산, 콘드로이틴 [24]황산 등의 프로테오글리칸과 오스테오칼신, 오스테오폰틴 또는 뼈 시알로프로틴과 같은 비콜라겐성 단백질로 구성된 분쇄 물질이라고 불리는 균질 액체이다.콜라겐은 뼈의 인장강도를 주는 반복단위로 구성돼 있으며 전단응력을 막아주는 겹침으로 배열돼 있다.그라운드 물질의 기능은 완전히 알려져 [24]있지 않다.콜라겐의 배열에 따라 현미경으로 두 종류의 뼈를 식별할 수 있습니다. 직물과 층상입니다.
직물 뼈는 골아세포가 골상세포를 빠르게 생성할 때 만들어지는데, 처음에는 모든 태아 뼈에서 발생하지만 나중에는 더 탄력적인 층상세포 뼈로 대체된다.성인의 뼈는 골절 후 또는 파제트병에서 만들어진다.직물 뼈는 무작위로 배향된 콜라겐 섬유의 수가 적어 더 약하지만 빠르게 형성된다. 이러한 섬유 기질의 외관을 위해 직물이라고 불린다.그것은 곧 주변 조직에 대한 골세포의 비율이 훨씬 낮은 동심원 시트에서 고도로 조직화된 층상 뼈로 대체된다.임신 [26]3개월 동안 태아에서 사람에게 처음 나타나는 층상골은 더 강하고 같은 층의 다른 섬유와 평행한 많은 콜라겐 섬유로 채워집니다.단면에서 섬유는 합판처럼 서로 반대 방향으로 이어져 비틀림 힘에 저항하는 뼈의 능력을 돕는다.골절 후에, 짜여진 뼈는 처음에 형성되고 "보니 치환"으로 알려진 과정 동안 점차 층상 뼈로 대체된다.직조골에 비해 층상골 형성이 더 느리다.콜라겐 섬유의 질서정연한 퇴적작용으로 골상구형성이 하루 1~2μm로 제한된다.또한 층상골은 콜라겐 섬유를 평행층 또는 동심원층으로 [27]쌓기 위해 비교적 평평한 표면이 필요합니다.
퇴적
뼈의 세포외 기질은 콜라겐과 분쇄 물질을 분비하는 골아세포에 의해 형성된다.이것들은 세포 내에서 콜라겐을 합성하고 나서 콜라겐 섬유를 분비한다.콜라겐 섬유는 급속히 중합되어 콜라겐 가닥을 형성합니다.이 단계에서 그것들은 아직 미네랄화되지 않았으며 "오스테로이드"라고 불린다.칼슘과 인산염이 이들 가닥의 표면에 침전되어 수일에서 수주 이내에 히드록시아파타이트의 [24]결정이 됩니다.
골아세포는 뼈를 광물화하기 위해 알칼리성 인산가수분해효소를 포함한 소포를 분비한다.이것은 인산염기를 분해하고 칼슘 및 인산염 증착을 위한 포시 역할을 합니다.그리고 나서 소포가 파열되어 결정체가 자라나는 중심 역할을 한다.구체적으로는 구상구조와 판구조에서 [28][29]골미네랄을 형성한다.
종류들
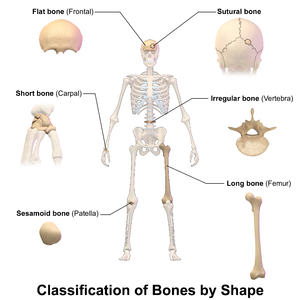
인간의 몸에는 긴 뼈, 짧은 뼈, 평평한 뼈, 불규칙한 뼈, 그리고 세사모이드 [30]뼈의 다섯 종류가 있다.
- 긴 뼈는 폭보다 훨씬 긴 간극인 샤프트와 샤프트의 양 끝에 둥근 머리인 골두부가 특징입니다.그것들은 대부분 골수의 양이 적고, 골수의 양이 적고,[31] 뼈의 끝부분에 스폰지 모양의 취소성 뼈로 이루어져 있습니다.손가락과 발가락의 뼈를 포함한 팔다리의 뼈는 대부분 긴 뼈입니다.손목의 8개 손목뼈, 발목의 7개 관절 관절 관절 관절뼈, 무릎뼈의 세사모이드 뼈는 예외입니다.쇄골과 같이 다른 모양의 축이나 끝을 가진 긴 뼈는 변형된 긴 뼈라고도 불립니다.
- 짧은 뼈는 대략 정육면체 모양이고, 스폰지 같은 내부를 둘러싸고 있는 얇은 뼈 층을 가지고 있다.손목과 발목의 뼈는 짧은 뼈입니다.
- 납작한 뼈는 얇고 일반적으로 구부러져 있으며, 두 개의 평행한 골층이 스폰지 모양의 뼈 층을 사이에 두고 있다.두개골의 대부분은 [32]흉골과 마찬가지로 납작한 뼈이다.
- 세사모이드 뼈는 힘줄에 박힌 뼈다.이들은 힘줄을 관절에서 더 멀리 떨어뜨리는 역할을 하기 때문에 힘줄의 각도가 증가하여 근육의 지렛대가 증가한다.세사모이드 뼈의 예로는 슬개골과 물고기모양이 [33]있다.
- 불규칙한 뼈는 위의 범주에 들어맞지 않는다.그들은 스폰지 같은 내부를 둘러싸고 있는 얇은 층의 촘촘한 뼈로 구성되어 있다.이름에서 알 수 있듯이 모양이 불규칙하고 복잡합니다.종종 이러한 불규칙한 모양은 골화의 많은 중심 혹은 뼈 부비강을 포함하고 있기 때문이다.척추, 골반, 그리고 두개골의 일부 뼈는 불규칙한 뼈이다.예를 들어 체골과 회전골 [34]등이 있다.
용어.
해부학 연구에서 해부학자들은 뼈의 모양, 모양, 기능을 설명하기 위해 많은 해부학적 용어를 사용합니다.뼈의 위치를 설명하는 데 다른 해부학적 용어들도 사용됩니다.다른 해부학적 용어와 마찬가지로, 이들 중 다수는 라틴어와 그리스어에서 유래했다.일부 해부학자들은 여전히 뼈를 언급하기 위해 라틴어를 사용한다.뼈와 관련된 것을 가리키는 "oseous"와 접두사 "osteo-"는 오늘날에도 일반적으로 사용되고 있다.
뼈를 설명하는 데 사용되는 용어의 예로는 무언가가 통과하는 구멍을 설명하는 "공구"라는 용어와 터널 같은 구조를 설명하는 "캐널" 또는 "고기"가 있습니다.뼈에서 튀어나온 돌기는 돌기의 모양과 위치에 따라 "condyle", "crest", "spine", "excence", "tubercle" 또는 "tubercity"를 포함한 여러 용어로 불릴 수 있습니다.일반적으로 긴 뼈는 "머리", "목", "몸통"을 가지고 있다고 합니다.
두 개의 뼈가 결합하면, 그들은 "관절"이라고 한다.만약 두 뼈가 섬유로 연결되어 있고 상대적으로 움직이지 않는다면, 관절은 "술"이라고 불립니다.
발전
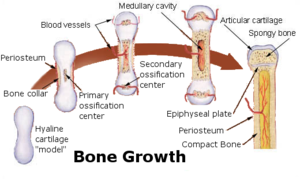
뼈의 형성을 골화라고 한다.태아 발달 단계에서 이것은 두개내 골화와 연골내 [35]골화의 두 가지 과정에 의해 발생한다.내연골 골화는 연골에서 뼈의 형성을 수반하는 반면, 내연골 골화는 연골에서 뼈의 형성을 수반한다.
두개골 내 골화는 주로 두개골의 평평한 뼈와 하악골, 상악골, 쇄골을 형성하는 동안 발생한다. 뼈는 연골보다는 간엽 조직과 같은 결합 조직으로 형성된다.이 공정은 골화중추의 발달, 석회화, 트라베큘라 형성,[36] 골막의 발달 등을 포함한다.
내연골 골화는 긴 뼈와 신체의 다른 대부분의 뼈에서 발생한다; 그것은 연골에서 뼈가 발달하는 것을 포함한다.이 과정은 연골모델의 개발, 그 성장과 발달, 1차 및 2차 골화중추의 개발, 관절연골과 후두엽판의 [37]형성을 포함한다.
내연골 골화는 "1차 골화 중심"이라고 불리는 연골의 점으로부터 시작된다.그들은 대부분 태아 발달 중에 나타나지만, 몇 개의 짧은 뼈는 출생 후에 1차 골화를 시작한다.그들은 긴 뼈, 짧은 뼈 그리고 불규칙한 뼈의 특정 부분의 간극을 형성하는 데 책임이 있다.2차 골화는 출생 후에 일어나며 긴 뼈의 후두골과 불규칙하고 평평한 뼈의 말단을 형성한다.긴 뼈의 골간과 양쪽 골절은 연골의 성장 영역에 의해 분리된다.골격 성숙도(18~25세)에는 모든 연골이 뼈로 대체되어 간엽과 양쪽 후두엽이 융합된다(상피 폐쇄).[38]상지에는 긴 뼈와 견갑골의 간만 골화되어 있다.상완골, 손목뼈, 코라코이드 과정, 견갑골 안쪽 테두리, 그리고 견갑골은 여전히 [39]연골이다.
연골에서 뼈로의 변환에는 다음 단계가 따릅니다.
- 예비 연골 부위야골수강에서 가장 멀리 떨어진 이 부위는 아직 [40]뼈로 변할 기미가 보이지 않는 전형적인 히알린 연골로 구성되어 있다.
- 세포 증식 구역.골수 공동에 조금 더 가까이 있는 연골세포는 증식하여 평평한 [40]열상의 세로 기둥으로 배열된다.
- 세포비대증 구역.다음으로, 연골세포는 분열을 멈추고 태아의 1차 골화 중심에서와 같이 비대해지기 시작합니다.라쿠나에 사이의 매트릭스 벽은 매우 [40]얇아진다.
- 석회화 구역.미네랄은 라쿠나 기둥 사이의 기질에 축적되어 연골을 석회화시킨다.이것들은 뼈의 영구적인 무기질 퇴적물이 아니라 확대된 [40]열관의 파괴로 곧 약화될 연골에 대한 일시적인 지지대일 뿐이다.
- 뼈의 퇴적 부위.각 기둥 안에서 열상 사이의 벽이 무너지고 연골세포가 죽는다.이렇게 하면 각 컬럼이 세로방향 채널로 전환되고 골수강에서 혈관과 골수에 의해 즉시 침입됩니다.골아세포는 이러한 채널의 벽을 따라 일렬로 정렬하여 기질의 동심원 층을 쌓기 시작하는 반면, 골아세포는 일시적으로 석회화된 [40]연골을 녹인다.
기능들
| 뼈의 기능 |
|---|
기계
|
| 합성 |
| 대사 |
뼈에는 다양한 기능이 있습니다.
기계
뼈는 다양한 기계적 기능을 한다.몸 안의 뼈들이 함께 골격을 형성한다.신체를 지탱하기 위한 프레임과 골격근, 힘줄, 인대 및 관절의 부착점을 제공합니다. 골격근, 힘줄, 인대 및 관절은 각각의 신체 부위 또는 전신이 3차원 공간에서 조작될 수 있도록 함께 기능합니다(뼈와 근육의 상호작용은 생체역학에서 연구됩니다).
뼈는 뇌를 보호하는 두개골이나 심장과 폐를 보호하는 갈비뼈와 같은 내부 장기를 보호합니다.뼈의 형성 방식 때문에 뼈는 약 170MPa(1,700kgf/cm2)[8]의 높은 압축 강도, 104~121MPa의 낮은 인장 강도 및 매우 낮은 전단 응력 강도(51.6MPa)[41][42]를 가지고 있습니다.즉, 뼈는 밀어넣기(압축) 스트레스에 잘 저항하고 당기기(텐션) 스트레스에 덜 저항하지만 전단 스트레스(예: 비틀림 하중)에 대해서는 잘 저항하지 못합니다.뼈는 본질적으로 부서지기 쉽지만 뼈는 상당한 탄력을 가지고 있으며 주로 콜라겐에 의해 기여됩니다.
기계적으로, 뼈는 또한 청각에 특별한 역할을 한다.소골은 중이에 있는 세 개의 작은 뼈로 소리 전달에 관여합니다.
합성
뼈의 취소부위에는 골수가 포함되어 있다.골수는 [43]조혈이라고 불리는 과정에서 혈구를 생성한다.골수에서 만들어지는 혈구에는 적혈구, 혈소판,[44] 백혈구가 포함된다.조혈모세포와 같은 전구세포는 유사분열이라고 불리는 과정에서 분열하여 전구세포를 생성한다.이것들은 결국 백혈구를 발생시키는 전구체와 적혈구를 [45]발생시키는 적혈구를 포함한다.체세포 분열에 의해 만들어진 적혈구와 백혈구와 달리, 혈소판은 [46]거핵구라고 불리는 매우 큰 세포에서 떨어진다.이러한 점진적 분화의 과정은 골수 안에서 일어난다.세포가 성숙하면 순환에 들어간다.[47]매일 25억 개 이상의 적혈구와 혈소판, 그리고 500억-1000억 개의 과립구가 이러한 방식으로 [18]생산된다.
골수는 세포를 만들 뿐만 아니라 결함이 있거나 노화된 적혈구가 [18]파괴되는 주요 부위 중 하나이다.
대사
- 미네랄 저장 – 뼈는 신체에 중요한 미네랄, 특히 칼슘과 [48][citation needed][49]인의 저장고 역할을 합니다.
종, 나이, 그리고 뼈의 종류에 의해 결정되는 뼈 세포는 뼈의 15 퍼센트를 차지한다.성장인자 저장—미네랄화된 뼈 매트릭스는 인슐린 유사 성장인자, 변형 성장인자,[50] 뼈 형태 발생 단백질 등과 같은 중요한 성장인자를 저장합니다.
- 지방 저장 – 골수 지방 조직(MAT)은 지방산의 [51]저장 저장 역할을 합니다.
- 산-염기 균형 – 뼈는 알칼리성 [52]염분을 흡수하거나 방출하여 과도한 pH 변화에 대해 혈액을 완충합니다.
- 해독 – 뼈 조직은 또한 혈액에서 중금속과 다른 이물질을 제거하고 다른 조직에 미치는 영향을 줄이면서 중금속과 다른 이물질을 저장할 수 있습니다.이것들은 나중에 서서히 [53]배출될 수 있다.
- 내분비 기관 – 뼈는 신장에 작용하여 인산염 재흡수를 감소시키는 섬유아세포 성장인자 23(FGF-23)을 방출하여 인산염 대사를 제어합니다.뼈 세포는 또한 혈당 조절과 지방 증착에 기여하는 오스테오칼신이라고 불리는 호르몬을 방출합니다.오스테오칼신은 인슐린을 생성하는 세포의 수를 증가시키고 [54]지방의 저장을 감소시키는 것 외에도 인슐린 분비와 민감도를 증가시킨다.
- 칼슘 균형 – 골세포에 의한 뼈 재흡수 과정은 저장된 칼슘을 전신 순환으로 방출하며 칼슘 균형을 조절하는 중요한 과정입니다.골형성은 순환하는 칼슘을 미네랄 형태로 능동적으로 고정시켜 혈류에서 제거하므로 재흡수는 활발하게 칼슘을 풀어 순환하는 칼슘 수치를 증가시킨다.이러한 프로세스는 사이트 고유의 [55]장소에서 동시에 발생합니다.
리모델링
뼈는 리모델링이라고 알려진 과정에서 지속적으로 생성되고 교체됩니다.뼈의 지속적인 회전은 뼈의 형태에 거의 변화가 없는 교체에 이은 재흡수 과정이다.이것은 골아세포와 골아세포를 통해 이루어진다.셀은 다양한 신호에 의해 자극되며, 이를 함께 리모델링 유닛이라고 합니다.성인의 골격 질량의 약 10%가 매년 [56]리모델링됩니다.리모델링의 목적은 칼슘 항상성을 조절하고 일상적인 스트레스로부터 미세하게 손상된 뼈를 복구하고 [57]성장 과정에서 골격을 형성하는 것입니다.체중 부담 운동이나 뼈 치유와 같은 반복적인 스트레스는 최대 스트레스 지점에서 뼈가 두꺼워지는 결과를 초래한다.이것은 [58]뼈가 스트레스를 받으면 작은 전위를 발생시키는 압전 성질의 결과라는 가설이 있다.
골아세포와 골아세포의 작용은 뼈가 만들어지고 파괴되거나 모양이 변하는 속도를 조절하면서 뼈 리모델링 세포의 활동을 촉진하거나 억제하는 많은 화학 효소에 의해 조절됩니다.세포들은 [59][60]또한 서로의 활동을 조절하기 위해 파라크린 신호를 사용한다.예를 들어 골세포가 뼈를 재흡수하는 속도는 칼시토닌과 골단백질에 의해 억제된다.칼시토닌은 갑상선의 부엽세포에 의해 생성되며 골세포의 수용체에 결합하여 골세포의 활동을 직접적으로 억제할 수 있다.골단백질은 골아세포에 의해 분비되며 RANK-L과 결합할 수 있어 골아세포 [61]자극을 억제한다.
골아세포는 또한 골상세포의 분비를 증가시키고 골아세포가 삼투성 [citation needed]조직을 분해하는 능력을 억제함으로써 골량을 증가시키도록 자극될 수 있다.뇌하수체, 갑상선 호르몬 및 성호르몬(에스트로겐 및 안드로겐)에 의한 성장호르몬 분비에 의해 골상세포의 분비가 촉진된다.이 호르몬들은 또한 골단백질 [61]분비를 증가시킨다.골아세포는 또한 골아세포 활성과 전구세포와의 분화를 촉진함으로써 뼈의 재흡수를 촉진하는 다수의 사이토카인을 분비하도록 유도될 수 있다.비타민 D, 부갑상선 호르몬 및 골세포로부터의 자극은 골아세포를 유도하여 RANK-리간드와 인터류킨 6의 분비를 증가시키고, 사이토카인은 골아세포에 의한 뼈의 재흡수를 증가시킨다.이러한 동일한 화합물은 또한 골아세포에 의한 대식세포 콜로니 자극 인자의 분비를 증가시켜 전구세포의 골아세포 분화를 촉진하고 골단백질 [citation needed]분비를 감소시킨다.
용량
골량은 골형성과 골재흡수 속도에 따라 결정됩니다.최근의 연구는 골아세포의 활성을 증가시킴으로써 특정 성장 인자가 국소적으로 뼈 형성을 변화시키는 역할을 할 수 있다는 것을 시사했다.뼈에서 파생된 수많은 성장 인자들이 뼈 배양물을 통해 분리되고 분류되었다.이러한 인자는 인슐린 유사 성장인자 I 및 II, 변형 성장인자 베타, 섬유아세포 성장인자, 혈소판 유래 성장인자 및 골형성 단백질을 [62]포함한다.증거는 뼈 세포가 뼈 매트릭스에서 세포 외 저장을 위한 성장 인자를 생성한다는 것을 암시합니다.뼈 매트릭스에서 이러한 성장 인자의 방출은 골아세포 전구체의 증식을 일으킬 수 있다.기본적으로, 뼈 성장 인자는 국소 뼈 [62]형성의 잠재적 결정 인자로 작용할 수 있습니다.연구에 따르면 폐경 후 골다공증의 취소 골량은 전체 골형성 표면과 표면 재흡수 [63]비율 사이의 관계에 의해 결정될 수 있다.
임상적 의의
관절염, 골절, 감염, 골다공증, 종양을 포함한 많은 질병들이 뼈에 영향을 미칠 수 있다.뼈와 관련된 질환은 관절 류머티즘 전문의, 부러진 뼈를 고치기 위한 수술을 할 수 있는 정형외과 의사 등 다양한 의사들에 의해 관리될 수 있다.재활 전문가와 같은 다른 의사들은 회복에, 방사선 전문의들은 영상 분석 결과에, 병리학자들은 질병의 원인을 조사하는 데, 그리고 가정의사들은 골다공증과 같은 뼈 질환의 합병증을 예방하는 역할을 할 수 있다.
의사가 환자를 진찰하면 병력과 검사를 받게 됩니다.그리고 나서 뼈는 종종 엑스레이라고 불리는 이미지화 된다.여기에는 초음파 X선, CT 스캔, MRI 스캔 및 [64]암을 조사하는 데 사용될 수 있는 Bone 스캔과 같은 기타 영상이 포함될 수 있습니다.자가면역 마커에 대한 혈액 검사와 같은 다른 검사를 하거나 활액 흡입을 [64]할 수 있습니다.
골절
정상 뼈에서 골절은 상당한 힘이 가해지거나 장기간 반복적인 외상이 있을 때 발생한다.골절은 골다공증과 같이 뼈가 약해지거나 뼈의 과도한 리모델링(파제트병 등)이나 [65]암의 성장 부위 등 구조적 문제가 있을 때도 발생할 수 있다.일반적인 골절에는 골다공증과 관련된 손목 골절과 고관절 골절, 고에너지 외상 및 암과 관련된 척추 골절, 그리고 긴 뼈 골절이 포함됩니다.모든 골절이 [65]아픈 것은 아닙니다.심각한 경우 골절의 종류와 위치에 따라 합병증이 플레일 흉부, 구획 증후군 또는 지방 색전증을 포함할 수 있습니다.복합 골절은 피부를 통해 뼈가 침투하는 것을 포함한다.일부 복잡한 골절은 누락된 뼈 부분을 대체하는 뼈 이식 절차를 사용하여 치료할 수 있습니다.
골절과 그 근본 원인은 X-레이, CT 스캔, MRI를 [65]통해 조사할 수 있습니다.골절은 그 위치와 모양으로 설명되며, 골절의 위치에 따라 몇 가지 분류 체계가 존재한다.아이들에게서 흔히 볼 수 있는 긴 뼈 골절은 솔터-해리스 골절이다.[66]골절을 관리하면 통증을 완화하고 골절 부위를 고정시키는 경우가 많습니다.뼈의 치유를 촉진하기 위해서입니다.또한 내부 고정과 같은 외과적 조치를 사용할 수 있습니다.고정화 때문에 골절이 있는 사람들은 종종 [65]재활치료를 받으라는 권고를 받는다.
종양
뼈에 영향을 미칠 수 있는 여러 종류의 종양이 있다; 양성 골종양의 예로는 골종, 골상골종, 골아세포종, 안강종, 골세포종, 그리고 동맥류 [67]골낭종이 있다.
암
암은 뼈 조직에서 발생할 수 있고, 뼈는 또한 다른 암이 [68]전이되는 흔한 장소이다.뼈에서 발생하는 암은 "원발성" 암이라고 불리지만,[68] 그러한 암은 드물다.뼈 내 전이는 "2차" 암이며, 가장 흔한 것은 유방암, 폐암, 전립선암, 갑상선암,[68] 신장암이다.뼈에 영향을 미치는 2차 암은 뼈를 파괴하거나 뼈를 만들 수 있습니다.뼈 안에 있는 골수의 암은 백혈병과 다발성 골수종을 포함한 뼈 조직에도 영향을 미칠 수 있습니다.뼈는 신체의 다른 부분에서도 암의 영향을 받을 수 있다.신체의 다른 부분의 암은 부갑상선 호르몬 또는 부갑상선 호르몬 관련 펩타이드를 방출할 수 있다.이것은 뼈의 재흡수를 증가시키고 뼈 골절로 이어질 수 있다.
암으로 인해 파괴되거나 변형된 뼈 조직은 왜곡되고, 약해지고, 더 쉽게 골절단되기 쉽다.이는 척수의 압박, 골수의 파괴로 멍, 출혈, 면역 억제를 초래할 수 있으며 뼈 통증의 원인 중 하나이다.암이 전이되면 원래 암 부위에 따라 다른 증상이 있을 수 있습니다.일부 뼈암도 느낄 수 있다.
뼈의 암은 그 종류, 단계, 예후, 그리고 그들이 일으키는 증상에 따라 관리된다.뼈의 많은 원발성 암은 방사선 치료를 통해 치료된다.골수암은 화학요법으로 치료될 수 있으며 면역요법과 같은 다른 형태의 표적요법이 [69]사용될 수 있다.개인의 삶의 질을 극대화하는 데 초점을 맞춘 완화치료는 관리에 중요한 역할을 할 수 있으며, 특히 5년 이내에 생존할 가능성이 낮다면 더욱 그렇습니다.
기타 고통스런 상태
- 골수염은 세균 [70]감염으로 인해 골수나 골수에 염증이 생기는 것을 말합니다.
- 골연화증은 심각한 비타민D [71]결핍으로 인한 성인 뼈의 고통스러운 연화증이다.
- 골형성불완전증[72]
- 골연골염이 분리되다[73]
- 강직성 척추염[74]
- 골격성 불소증은 뼈에 불소가 과도하게 축적되어 생기는 뼈 질환이다.골격성 불소증은 뼈와 관절에 손상을 입혀 통증이 [75]심하다.
골다공증
골다공증은 골밀도가 낮아져 [76]골절 가능성이 높아지는 뼈 질환이다.골다공증은 세계보건기구(WHO)에 의해 여성들에게 연령과 성별 일치 평균에 비해 골밀도가 최대 골질량보다 2.5배 낮은 골밀도로 정의된다.이 밀도는 이중 에너지 X선 흡수율 측정(DEXA)을 사용하여 측정되며, "확립 골다공증"이라는 용어는 취약성 [77]골절의 존재를 포함한다.골다공증은 폐경 후 여성들에게서 가장 흔하며, 폐경 전 골다공증이라고 불리지만, 특정한 호르몬 장애와 다른 만성 질환이 있거나 흡연과 약물, 특히 글루코코르티코이드로 [76]인해 남성과 폐경 전 여성들에게서 발병할 수 있다.골다공증은 골절이 [76]발생하기 전까지는 증상이 없다.이러한 이유로 DEXA 스캔은 골다공증에 걸리고 [76]골절 위험이 있는 하나 이상의 위험 인자를 가진 사람들에게 종종 수행됩니다.
골다공증의 가장 중요한 위험 요소 중 하나는 고령이다.골아세포와 골아세포에서 산화 DNA 손상의 축적은 노화와 관련된 골다공증의 [78]핵심인자로 보인다.
골다공증 치료에는 금연, 알코올 섭취 감소, 규칙적인 운동, 건강한 식단 섭취 등의 조언이 포함됩니다.비타민 D와 마찬가지로 칼슘과 미량 미네랄 보충제도 권장될 수 있습니다.약물 사용 시 비스포네이트, 라넬레이트 스트론튬,[79] 호르몬 대체 요법을 포함할 수 있습니다.
골병리학
골병리학은 원래 근골격계와 전반적인 건강 사이의 연관성에 기초해 개발된 의학 사상학파이지만, 지금은 주류 의학과 매우 유사하다.2012년 현재[update], 미국의 77,000명 이상의 의사들이 골병 [80]의과대학에서 훈련을 받고 있다.
골학

뼈와 치아에 대한 연구는 골상학이라고 불린다.인류학, 고고학, 법의학에서 다양한 업무에 자주 사용된다.여기에는 뼈를 채취한 개인의 영양, 건강, 나이 또는 부상 상태 파악이 포함될 수 있습니다.이러한 종류의 연구를 위해 살찐 뼈를 준비하는 것은 침윤 과정을 포함할 수 있다.
전형적으로 인류학자들과 고고학자들은 호모 사피엔스와 호모 네안데르탈렌시스가 만든 뼈 도구를 연구한다.뼈는 발사체 점이나 예술 색소 등 다양한 용도로 사용될 수 있으며 뿔과 같은 외부 뼈로도 만들 수 있습니다.
기타 동물
새의 뼈대는 매우 가볍다.그들의 뼈는 비행을 돕기 위해 더 작고 얇다.포유류 중 박쥐는 골밀도 면에서 조류에 가장 가깝고, 이는 작고 밀집된 뼈가 비행 적응에 따른 것임을 시사한다.많은 새들의 뼈는 속이 [81]비어 있기 때문에 골수가 적다.
새의 부리는 주로 케라틴으로 덮인 하악골의 돌출부로서 뼈로 만들어진다.
주로 피하 조직에서 별도로 형성되는 일부 뼈는 헤드기어(예: 뿔, 뿔, 오시콘의 골핵), 골엽 및 음경/[82]음핵을 포함한다.사슴의 뿔은 뼈로 구성되어 있는데, 이것은 벨벳이 [83]벗겨지면 뼈가 동물의 피부 밖에 있는 특이한 예이다.
멸종된 포식 물고기 던클레오스테우스는 [84][85]턱을 따라 단단하게 드러난 뼈의 날카로운 모서리를 가지고 있었다.
인간의 골격에서 80%인 피질골의 비율은 다른 동물들, 특히 해양 포유류나 바다 거북이나 [87]어룡과 [86]같은 다양한 중생대 해양 파충류에서 훨씬 낮을 수 있습니다.이 비율은 진화에 따라 빠르게 달라질 수 있다; 이것은 종종 초기 고래와 피니피드, 특히 수생 생활로 되돌아가는 초기 단계에서 증가한다.그 후에 그것은 전형적으로 스폰지 같은 뼈를 획득하는 원양 분류군에서는 감소하지만, 얕은 물에서 사는 수생 분류군은 특히 바다 소처럼 느리게 움직이는 경우 매우 두껍고 후두엽성,[88] 골경화성 또는 후두엽성[89] 뼈를 유지할 수 있습니다.어떤 경우에, 해면 같은 뼈를 획득한 해양 분류군도 얕은 물이나 과염수([90][91][92]농도)에서 살도록 적응하게 되면 더 두껍고 단단한 뼈로 되돌아갈 수 있다.
많은 동물들, 특히 초식동물들은 뼈를 먹는 골식증, 즉 골식증을 한다.이는 부족한 인산염을 보충하기 위해 이루어지는 것으로 추정된다.
사람에게 영향을 미치는 많은 뼈 질환들은 다른 척추 동물들에게도 영향을 미친다. 한 가지 장애의 예는 골격 불소화증이다.
사회와 문화
도살된 동물의 뼈는 여러 가지 용도가 있다.선사시대에는 뼈 [93]도구를 만드는 데 사용되었습니다.그것들은 이미 선사시대 미술에서 중요한 뼈 조각에 사용되었고, 현대에는 단추, 구슬, 손잡이, 보빈, 계산 보조 도구, 머리 너트, 주사위, 포커 칩, 집는 막대기, 화살, 스크림쇼, 장식품 등의 공예 재료로도 사용되었다.
뼈 접착제는 오랜 시간 동안 분쇄되거나 금이 간 뼈를 끓인 후 여과 및 증발로 생성되어 생성된 유체를 걸쭉하게 만드는 방법으로 만들 수 있습니다.역사적으로 한 때 중요했던 뼈 접착제와 다른 동물 접착제는 골동품 복원과 같은 몇 가지 특수한 용도만 가지고 있다.젤라틴을 만들기 위해 기본적으로 동일한 공정을 더 정제, 증점 및 건조하는 것이 사용됩니다.
국물은 전통적으로 뼈를 포함한 여러 가지 재료를 오랫동안 끓여 만든다.
골격은 주로 여과 및 검은 색소로 사용되는 다공질, 검은색, 입상 물질로 포유류의 뼈를 태움으로써 만들어집니다.
갑골문자는 고대 중국에서 뼈에 새겨진 글씨를 바탕으로 한 문자 체계입니다.그것의 이름은 주로 소 쇄골이었던 오라클 뼈에서 유래되었다.고대 중국인들(주로 상나라)은 갑골에 질문을 쓰고 뼈를 태웠으며, 뼈가 갈라진 곳이 그 질문에 대한 답이 될 것이다.
누군가에게 뼈를 겨누는 것은 쿠르다이차 같은 호주 원주민들과 같은 일부 문화에서 불운으로 여겨진다.
닭의 소원뼈는 점괘에 사용되었고, 여전히 전통에서 뼈의 양쪽 끝을 잡아당기는 두 사람 중 누가 소원을 빌 수 있는지를 결정하는 데 사용됩니다.
역사를 통틀어 다양한 문화는 인공적인 두개골 변형이라는 관행에 의해 아기의 머리를 형성하는 관습을 채택해 왔다.중국에서 널리 행해진 관습은 발의 정상적인 성장을 제한하기 위한 발 묶기였다.
기타 이미지
「 」를 참조해 주세요.
레퍼런스
- ^ Lee, Cassandra (January 2001). The Bone Organ System: Form and Function. Science Direct. Academic Press. pp. 3–20. doi:10.1016/B978-012470862-4/50002-7. ISBN 9780124708624. Retrieved 30 January 2022.
- ^ de Buffrénil, Vivian; de Ricqlès, Armand J; Zylberberg, Louise; Padian, Kevin; Laurin, Michel; Quilhac, Alexandra (2021). Vertebrate skeletal histology and paleohistology (Firstiton ed.). Boca Raton, FL: CRC Press. pp. xii + 825. ISBN 978-1351189576.
- ^ "How Many Bones Does a Baby Have and Why Do Adults Have Fewer?". Healthline. 26 June 2019. Retrieved 19 July 2021.
- ^ Steele, D. Gentry; Claud A. Bramblett (1988). The Anatomy and Biology of the Human Skeleton. Texas A&M University Press. p. 4. ISBN 978-0-89096-300-5.
- ^ Mammal anatomy : an illustrated guide. New York: Marshall Cavendish. 2010. p. 129. ISBN 9780761478829.
- ^ "ossein". The Free Dictionary.
- ^ Hall, John (2011). Textbook of Medical Physiology (12th ed.). Philadelphia: Elsevier. pp. 957–960. ISBN 978-08089-2400-5.
- ^ a b Schmidt-Nielsen, Knut (1984). Scaling: Why Is Animal Size So Important?. Cambridge: Cambridge University Press. p. 6. ISBN 978-0-521-31987-4.
- ^ "Structure of Bone". flexbooks.ck12.org. CK12-Foundation. Retrieved 28 May 2020.
- ^ a b c Deakin 2006, 192페이지
- ^ Meyers, Marc André; Chen, Po-Yu; Lin, Albert Yu-Min; Seki, Yasuaki (1 January 2008). "Biological materials: Structure and mechanical properties". Progress in Materials Science. 53 (1): 1–206. doi:10.1016/j.pmatsci.2007.05.002. ISSN 0079-6425.
- ^ Gdyczynski, C.M.; Manbachi, A.; et al. (2014). "On estimating the directionality distribution in pedicle trabecular bone from micro-CT images". Physiological Measurement. 35 (12): 2415–2428. Bibcode:2014PhyM...35.2415G. doi:10.1088/0967-3334/35/12/2415. PMID 25391037.
- ^ a b Deakin 2006, 195페이지
- ^ Hall, Susan J. (2007). Basic Biomechanics with OLC (5th ed., Revised. ed.). Burr Ridge: McGraw-Hill Higher Education. p. 88. ISBN 978-0-07-126041-1.
- ^ Gomez, Santiago (February 2002). "Crisóstomo Martinez, 1638–1694: the discoverer of trabecular bone". Endocrine. 17 (1): 3–4. doi:10.1385/ENDO:17:1:03. ISSN 1355-008X. PMID 12014701. S2CID 46340228.
- ^ Barnes-Svarney, Patricia L.; Svarney, Thomas E. (2016). The Handy Anatomy Answer Book : Includes Physiology. Detroit: Visible Ink Press. pp. 90–91. ISBN 9781578595426.
- ^ a b c Deakin 2006, 189페이지
- ^ a b c Deakin 2006, 58페이지
- ^ Deakin 2006, 189-190페이지.
- ^ 워싱턴이요.'오셀'골세포2013년 4월 3일, 워싱턴 대학교, N.D. Web.
- ^ Sims, Natalie A.; Vrahnas, Christina (2014). "Regulation of cortical and trabecular bone mass by communication between osteoblasts, osteocytes and osteoclasts". Archives of Biochemistry and Biophysics. 561: 22–28. doi:10.1016/j.abb.2014.05.015. PMID 24875146.
- ^ a b Deakin 2006, 190페이지
- ^ Hydroxyapatite Disolution Journal of Materials Science & Technology, 38, 148-158 강화
- ^ a b c d e f 2005년 홀 981페이지
- ^ a b Currey, John D. (2002)"골격 조직의 구조", 12-14페이지 "골격: 구조와 역학"프린스턴 대학 출판부프린스턴, 뉴저지 주.ISBN 9781400849505
- ^ Salentijn, L. Biology of Mineralized Tissue: 연골과 뼈, 콜롬비아대학교 치과대학 대학원 치과 강의 시리즈, 2007년
- ^ Royce, Peter M.; Steinmann, Beat (14 April 2003). Connective Tissue and Its Heritable Disorders: Molecular, Genetic, and Medical Aspects. John Wiley & Sons. ISBN 978-0-471-46117-3.
- ^ Bertazzo, S.; Bertran, C. A. (2006). "Morphological and dimensional characteristics of bone mineral crystals". Bioceramics. 309–311 (Pt. 1, 2): 3–10. doi:10.4028/www.scientific.net/kem.309-311.3. S2CID 136883011.
- ^ Bertazzo, S.; Bertran, C.A.; Camilli, J.A. (2006). "Morphological Characterization of Femur and Parietal Bone Mineral of Rats at Different Ages". Key Engineering Materials. 309–311: 11–14. doi:10.4028/www.scientific.net/kem.309-311.11. S2CID 135813389.
- ^ "Types of bone". mananatomy.com. Retrieved 6 February 2016.
- ^ "DoITPoMS – TLP Library Structure of bone and implant materials – Structure and composition of bone". www.doitpoms.ac.uk.
- ^ Bart Clarke (2008), "Normal Bone Anatomy and Physiology", Clinical Journal of the American Society of Nephrology, 3 (Suppl 3): S131–S139, doi:10.2215/CJN.04151206, PMC 3152283, PMID 18988698
- ^ Adriana Jerez; Susana Mangione; Virginia Abdala (2010), "Occurrence and distribution of sesamoid bones in squamates: a comparative approach", Acta Zoologica, 91 (3): 295–305, doi:10.1111/j.1463-6395.2009.00408.x
- ^ Pratt, Rebecca. "Bone as an Organ". AnatomyOne. Amirsys, Inc. Archived from the original on 30 October 2019. Retrieved 28 September 2012.
- ^ OpenStax, 해부학 및 생리학.OpenStax CNX.2016년 2월 26일 http://cnx.org/contents/14fb4ad7-39a1-4eee-ab6e-3ef2482e3e22 @8.24
- ^ "Bone Growth and Development Biology for Majors II". courses.lumenlearning.com. Retrieved 28 May 2020.
- ^ Tortora, Gerard J.; Derrickson, Bryan H. (2018). Principles of Anatomy and Physiology. John Wiley & Sons. ISBN 978-1-119-44445-9.
- ^ "6.4B: Postnatal Bone Growth". Medicine LibreTexts. 19 July 2018. Retrieved 28 May 2020.
- ^ Agur, Anne (2009). Grant's Atlas of Anatomy. Philadelphia: Lippincott, Williams, and Wilkins. p. 598. ISBN 978-0-7817-7055-2.
- ^ a b c d e Saladin, Kenneth (2012). Anatomy and Physiology: The Unity of Form and Function. New York: McGraw-Hill. p. 217. ISBN 978-0-07-337825-1.
- ^ Vincent, Kevin. "Topic 3: Structure and Mechanical Properties of Bone". BENG 112A Biomechanics, Winter Quarter, 2013. Department of Bioengineering, University of California. Archived from the original on 28 May 2018. Retrieved 24 March 2015.
- ^ Turner, C.H.; Wang, T.; Burr, D.B. (2001). "Shear Strength and Fatigue Properties of Human Cortical Bone Determined from Pure Shear Tests". Calcified Tissue International. 69 (6): 373–378. doi:10.1007/s00223-001-1006-1. PMID 11800235. S2CID 30348345.
- ^ Fernández, KS; de Alarcón, PA (December 2013). "Development of the hematopoietic system and disorders of hematopoiesis that present during infancy and early childhood". Pediatric Clinics of North America. 60 (6): 1273–1289. doi:10.1016/j.pcl.2013.08.002. PMID 24237971.
- ^ Deakin 2006, 페이지 60-61.
- ^ Deakin 2006, 페이지 60
- ^ Deakin 2006, 57페이지
- ^ Deakin 2006, 페이지 46
- ^ Doyle, Máire E.; Jan de Beur, Suzanne M. (2008). "The Skeleton: Endocrine Regulator of Phosphate Homeostasis". Current Osteoporosis Reports. 6 (4): 134–141. doi:10.1007/s11914-008-0024-6. PMID 19032923. S2CID 23298442.
- ^ Walker, Kristin. "Bone". Encyclopedia Britannica. Retrieved 5 October 2017.
- ^ Pv, Hauschka; Tl, Chen; Ae, Mavrakos (1988). "Polypeptide Growth Factors in Bone Matrix". Ciba Foundation Symposium. Novartis Foundation Symposia. 136: 207–225. doi:10.1002/9780470513637.ch13. ISBN 9780470513637. PMID 3068010. Retrieved 28 May 2020.
- ^ Styner, Maya; Pagnotti, Gabriel M; McGrath, Cody; Wu, Xin; Sen, Buer; Uzer, Gunes; Xie, Zhihui; Zong, Xiaopeng; Styner, Martin A (1 May 2017). "Exercise Decreases Marrow Adipose Tissue through β-Oxidation in Obese Running Mice". Journal of Bone and Mineral Research. 32 (8): 1692–1702. doi:10.1002/jbmr.3159. ISSN 1523-4681. PMC 5550355. PMID 28436105.
- ^ Fogelman, Ignac; Gnanasegaran, Gopinath; Wall, Hans van der (2013). Radionuclide and Hybrid Bone Imaging. Springer. ISBN 978-3-642-02400-9.
- ^ "Bone". flipper.diff.org. Retrieved 28 May 2020.
- ^ Lee, Na Kyung; et al. (10 August 2007). "Endocrine Regulation of Energy Metabolism by the Skeleton". Cell. 130 (3): 456–469. doi:10.1016/j.cell.2007.05.047. PMC 2013746. PMID 17693256.
- ^ Foundation, CK-12. "Bones". www.ck12.org. Retrieved 29 May 2020.
- ^ Manolagas, SC (April 2000). "Birth and death of bone cells: basic regulatory mechanisms and implications for the pathogenesis and treatment of osteoporosis". Endocrine Reviews. 21 (2): 115–137. doi:10.1210/edrv.21.2.0395. PMID 10782361.
- ^ Hadjidakis DJ, Androulakis II (31 January 2007). "Bone remodeling". Annals of the New York Academy of Sciences. 1092: 385–396. doi:10.1196/annals.1365.035. PMID 17308163. S2CID 39878618. Retrieved 18 May 2020.
- ^ ed, Russell T. Woodburne ..., consulting (1999). Anatomy, physiology, and metabolic disorders (5. print. ed.). Summit, N.J.: Novartis Pharmaceutical Corp. pp. 187–189. ISBN 978-0-914168-88-1.
- ^ Fogelman, Ignac; Gnanasegaran, Gopinath; Wall, Hans van der (2013). Radionuclide and Hybrid Bone Imaging. Springer. ISBN 978-3-642-02400-9.
- ^ "Introduction to cell signaling (article)". Khan Academy. Retrieved 24 December 2020.
- ^ a b Boulpaep, Emile L.; Boron, Walter F. (2005). Medical physiology: a cellular and molecular approach. Philadelphia: Saunders. pp. 1089–1091. ISBN 978-1-4160-2328-9.
- ^ a b Baylink, D. J. (1991). "Bone growth factors". Clinical Orthopaedics and Related Research. 263 (263): 30–48. doi:10.1097/00003086-199102000-00004. PMID 1993386.
- ^ Nordin, BE; Aaron, J; Speed, R; Crilly, RG (8 August 1981). "Bone formation and resorption as the determinants of trabecular bone volume in postmenopausal osteoporosis". Lancet. 2 (8241): 277–279. doi:10.1016/S0140-6736(81)90526-2. PMID 6114324. S2CID 29646037.
- ^ a b Davidson 2010, 페이지 1059–1062.
- ^ a b c d 데이비드슨 2010, 페이지 1068
- ^ Salter RB, Harris WR (1963). "Injuries Involving the Epiphyseal Plate". J Bone Joint Surg Am. 45 (3): 587–622. doi:10.2106/00004623-196345030-00019. S2CID 73292249. Archived from the original on 2 December 2016. Retrieved 2 December 2016.
- ^ "Benign Bone Tumours". Cleveland Clinic. 2017. Retrieved 29 March 2017.
- ^ a b c 데이비드슨 2010, 페이지 1125
- ^ 데이비드슨 2010, 페이지 1032
- ^ "Osteomyelitis". The Lecturio Medical Concept Library. Retrieved 26 August 2021.
- ^ "Osteomalacia and Rickets". The Lecturio Medical Concept Library. Retrieved 26 August 2021.
- ^ "Osteogenesis Imperfecta". The Lecturio Medical Concept Library. Retrieved 26 August 2021.
- ^ "Osteochondritis Dissecans". The Lecturio Medical Concept Library. Retrieved 26 August 2021.
- ^ "Ankylosing Spondylitis". The Lecturio Medical Concept Library. Retrieved 26 August 2021.
- ^ Whitford GM (1994). "Intake and Metabolism of Fluoride". Advances in Dental Research. 8 (1): 5–14. doi:10.1177/08959374940080011001. PMID 7993560. S2CID 21763028.
- ^ a b c d Davidson 2010, 페이지 1116–1121.
- ^ WHO (1994). "Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Report of a WHO Study Group". World Health Organization Technical Report Series. 843: 1–129. PMID 7941614.
- ^ 첸큐, 류케이, 로빈슨 AR 등DNA 손상은 NF-δB 의존 메커니즘을 통해 뼈의 노화를 가속화합니다.J본 광부 규격 2013;28(5):1214-128.doi:10.1002/jbmr.1851
- ^ 데이비드슨 2010, 페이지 1116–1121
- ^ "2012 Osteopathic Medical Profession Report" (PDF). Osteopathic.org. American Osteopathic Organisation. Archived from the original (PDF) on 16 June 2013. Retrieved 26 November 2014.
- ^ Dumont, E. R. (17 March 2010). "Bone density and the lightweight skeletons of birds". Proceedings of the Royal Society B: Biological Sciences. 277 (1691): 2193–2198. doi:10.1098/rspb.2010.0117. PMC 2880151. PMID 20236981.
- ^ Nasoori, A (2020). "Formation, structure, and function of extra‐skeletal bones in mammals". Biological Reviews. 95 (4): 986–1019. doi:10.1111/brv.12597. PMID 32338826. S2CID 216556342.
- ^ Hans J. Rolf; Alfred Enderle (1999). "Hard fallow deer antler: a living bone till antler casting?". The Anatomical Record. 255 (1): 69–77. doi:10.1002/(SICI)1097-0185(19990501)255:1<69::AID-AR8>3.0.CO;2-R. PMID 10321994.
- ^ "Dunkleosteus". American Museum of Natural History.
- ^ "My, What a Big Mouth You Have Cleveland Museum of Natural History".
- ^ de Buffrénil V.; Mazin J.-M. (1990). "Bone histology of the ichthyosaurs: comparative data and functional interpretation". Paleobiology. 16 (4): 435–447. doi:10.1017/S0094837300010174. JSTOR 2400968.
- ^ Laurin, M.; Canoville, A.; Germain, D. (2011). "Bone microanatomy and lifestyle: a descriptive approach". Comptes Rendus Palevol. 10 (5–6): 381–402. doi:10.1016/j.crpv.2011.02.003.
- ^ Houssaye, Alexandra; De Buffrenil, Vivian; Rage, Jean-Claude; Bardet, Nathalie (12 September 2008). "An analysis of vertebral 'pachyostosis' in Carentonosaurus mineaui (Mosasauroidea, Squamata) from the Cenomanian (early Late Cretaceous) of France, with comments on its phylogenetic and functional significance". Journal of Vertebrate Paleontology. 28 (3): 685–691. doi:10.1671/0272-4634(2008)28[685:AAOVPI]2.0.CO;2. ISSN 0272-4634. S2CID 129670238.
- ^ de Buffrénil, Vivian; Canoville, Aurore; D’Anastasio, Ruggero; Domning, Daryl P. (June 2010). "Evolution of Sirenian Pachyosteosclerosis, a Model-case for the Study of Bone Structure in Aquatic Tetrapods". Journal of Mammalian Evolution. 17 (2): 101–120. doi:10.1007/s10914-010-9130-1. S2CID 39169019.
- ^ Dewaele, Leonard; Lambert, Olivier; Laurin, Michel; De Kock, Tim; Louwye, Stephen; de Buffrénil, Vivian (December 2019). "Generalized Osteosclerotic Condition in the Skeleton of Nanophoca vitulinoides, a Dwarf Seal from the Miocene of Belgium". Journal of Mammalian Evolution. 26 (4): 517–543. doi:10.1007/s10914-018-9438-9. S2CID 20885865.
- ^ Dewaele, Leonard; Gol’din, Pavel; Marx, Felix G.; Lambert, Olivier; Laurin, Michel; Obadă, Theodor; Buffrénil, Vivian de (10 January 2022). "Hypersalinity drives convergent bone mass increases in Miocene marine mammals from the Paratethys". Current Biology. 32 (1): 248–255.e2. doi:10.1016/j.cub.2021.10.065. ISSN 0960-9822. PMID 34813730. S2CID 244485732.
- ^ Houssaye, Alexandra (10 January 2022). "Evolution: Back to heavy bones in salty seas". Current Biology. 32 (1): R42–R44. doi:10.1016/j.cub.2021.11.049. PMID 35015995. S2CID 245879886.
- ^ Laszlovszky, J¢zsef; Szab¢, P‚ter (1 January 2003). People and Nature in Historical Perspective. Central European University Press. ISBN 978-963-9241-86-2.
각주
- Katja Hoehn; Marieb, Elaine Nicpon (2007). Human Anatomy & Physiology (7th ed.). San Francisco: Benjamin Cummings. ISBN 978-0-8053-5909-1.
- Bryan H. Derrickson; Tortora, Gerard J. (2005). Principles of anatomy and physiology. New York: Wiley. ISBN 978-0-471-68934-8.
- Davidson, Stanley (2010). Colledge, Nicki R.; Walker, Brian R.; Ralston, Stuart H. (eds.). Davidson's principles and practice of medicine. Illustrated by Robert Britton (21st ed.). Edinburgh: Churchill Livingstone/Elsevier. ISBN 978-0-7020-3085-7.
- Deakin, Barbara Young; et al. (2006). Wheater's functional histology : a text and colour atlas (5th ed.). [Edinburgh?]: Churchill Livingstone/Elsevier. ISBN 978-0-443-068-508. - Philip J.의 그림.
- Hall, Arthur C.; Guyton, John E. (2005). Textbook of medical physiology (11th ed.). Philadelphia: W.B. Saunders. ISBN 978-0-7216-0240-0.
- Anthony, S. Fauci; Harrison, T.R.; et al. (2008). Harrison's principles of internal medicine (17th ed.). New York [etc.]: McGraw-Hill Medical. ISBN 978-0-07-147692-8. – Anthony는 현재 버전을 편집하고 Harrison은 이전 버전을 편집합니다.
외부 링크
- 미국골광물연구학회 교육자원자료(애니메이션 포함)
- 압전 및 골격 재모델링 검토(참조 포함)
- Science Creative Quarterly의 골생물학 기본 개요
- Usha Kini; B. N. Nandeesh (3 January 2013). "Ch 2: Physiology of Bone Formation, Remodeling, and Metabolism" (PDF). In Ignac Fogelman; Gopinath Gnanasegaran; Hans van der Wall (eds.). Radionuclide and hybrid bone imaging. Berlin: Springer. pp. 29–57. ISBN 978-3-642-02399-6. Archived from the original (PDF) on 6 November 2020. Retrieved 28 August 2017.
- 골조직학적 현미경 사진