시상하핵
Subthalamic nucleus| 시상하핵 | |
|---|---|
 | |
 | |
| 세부 사항 | |
| 일부 | 서브탈라무스(물리적으로); 기저신경절(기능적으로) |
| 식별자 | |
| 라틴어 | 시상하핵 |
| 약어 | STN |
| 메쉬 | D020531 |
| 신경명 | 435 |
| NeuroLex ID | nlx_syslog_1010002 |
| TA98 | A14.1.08.702 |
| TA2 | 5709 |
| FMA | 62035 |
| 신경해부술의 해부학적 용어 | |
시상하핵(STN)은 뇌의 작은 렌즈 모양의 핵으로 기능적인 관점에서 기저신경절 시스템의 일부입니다.해부학적으로 볼 때, 그것은 시상하부의 주요 부분입니다.그 이름에서 알 수 있듯이 시상하핵은 시상복부에 위치해 있다.그것은 또한 흑색 실체의 등쪽이고 내부 캡슐의 안쪽이다.그것은 [1]1865년 줄스 버나드 루이스에 의해 처음 기술되었고, 말뭉치 루이시 또는 루이스의 몸이라는 용어는 여전히 가끔 사용된다.
해부학
구조.
시상하핵에서 발견되는 주요 뉴런 유형은 다소 길고 드문드문 가시가 있는 수상돌기를 [2][3]가지고 있다.더 중앙에 위치한 뉴런에서, 수지상 수목은 더 타원형 [4]모양을 가지고 있다.이 나무들(1200 μm, 600 μm, 300 μm)의 크기는 쥐, 고양이, 원숭이, 인간을 포함한 많은 종에서 비슷하지만, 특이하다.하지만, 뉴런의 수는 핵의 외부 치수뿐만 아니라 뇌의 크기에 따라 증가한다.주요 뉴런은 글루탐산염으로 기저신경절계에서 특정한 기능적 위치를 제공한다.인간에게는 국소 회로에 참여하는 소수의 GABAergic intereurons가 있다. 하지만, 치사하 뉴런의 수상돌기는 경계를 피하고 주로 [5]서로 상호작용한다.
시상하핵의 구조는 아직 완전히 밝혀지지 않았지만, 여러 개의 내부 도메인으로 구성되어 있을 것이다.영장류 시상하핵은 종종 세 개의 내부 해부학적 기능 영역으로 나뉜다.하지만, 소위 삼자 모형이라고 불리는 이 모델은 뇌 [6][7]기능에서 시상하핵의 복잡성을 완전히 설명하지 못하기 때문에 논의되어 왔다.
구심 축삭
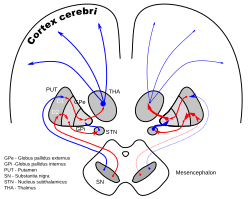
시상하핵은 흔히 말하는 안사렌티큘라리스(Ansa renticularis)를 통해 외부글로부스팔리더스(GPe)[8]로부터 주요 입력을 받지만, 먼저 내측팔리듐과 내측캡슐을 가로지르는 섬유에 의해 방사된다(그림 참조).이 구심성분들은 GABAergic으로 시상하핵의 뉴런을 억제한다.흥분성, 글루탐산성 입력은 대뇌 피질(특히 운동 피질)과 중앙 복합체의 부파시큘리스로부터 옵니다.시상하핵은 신경조절 입력, 특히 흑상체로부터 도파민 작동 축삭을 받는다.[9]그것은 또한 pedunculopontine 핵으로부터 입력을 받는다.
효율적인 타겟
시상하핵 뉴런의 축삭은 등쪽으로 핵을 떠난다.축색돌기는 과식성(자극성입니다.선조체와의 연결(마카크에서 17.3%)을 제외하고, 대부분의 시상하 주요 뉴런은 다치타겟이며 기저 신경절의 [10]다른 핵심 요소들로 향합니다.일부는 축삭을 내측 흑질 및 외측 팔리디움의 내측 및 외측 핵에 수평으로 보낸다(3-표적, 21.3 %).일부는 측벽 및 흑색 실체(2.7%) 또는 측벽 및 내측(48%)을 가진 2-타깃이다.외측 팔리듐의 단일 표적이 적습니다.팔리덤에서 시상하 말단은 팔리달 [10][11]경계에 평행한 띠로 끝난다.이 표적에 도달하는 모든 축삭이 추가되었을 때 시상하핵의 주요 효율은 82.7%에서 분명히 내부글로부스팔리더스(GPI)이다.
일부 연구자들은 축삭 내부 [12]부속물을 보고했습니다.그러나 이에 대한 기능적 증거는 거의 없다.
생리학
시상하핵
첫 번째 세포 내 시상하 뉴런 전기 기록은 래트 슬라이스 [citation needed]준비에서 날카로운 전극을 사용하여 수행되었습니다.이러한 기록에서 세 가지 주요 관찰이 이루어졌으며, 이 세 가지 모두 이후의 치사체 이하의 발화 특성에 대한 보고가 지배적이었다.첫 번째 관찰은 전류 주입이나 시냅스 자극이 없을 때 대부분의 세포가 자발적으로 발화한다는 것이었다.두 번째 관찰은 이 세포들이 매우 높은 주파수로 순간적으로 발사될 수 있다는 것입니다.세 번째 관찰은 세포가 –65mV 이하로 과분극된 후 일시적으로 탈분극되었을 때의 비선형 행동에 관한 것이다.그런 다음 전압 게이트 칼슘 및 나트륨 전류를 통해 활동 전위의 폭발을 일으킬 수 있습니다.
최근의 몇몇 연구들은 치사하 뉴런의 자율적인 페이스메이킹 능력에 초점을 맞추고 있다.이러한 세포는 영장류에서 80-90Hz의 속도로 자발적인 활동 전위를 발생시킬 수 있기 때문에 종종 "빠른 스피킹 페이스메이커"[13]라고 불립니다.
발진 및 동기 활동은[14][15] 파킨슨병의 기초가 되는 주요 병리인 흑색 파스 콤팩트에서의 도파민 작동성 세포의 상실을 특징으로 하는 환자와 동물 모델로부터 기록된 치사하 뉴런의 전형적인 방전 패턴일 가능성이 높다.
라테오팔리도-치탈라믹계
강한 상호 연결은 시상하핵과 글로부스 팔리두스의 외부 세그먼트를 연결합니다.둘 다 빠른 페이스메이커다.함께, 그들은 동시에 터지는 "기저 [16]신경절의 중심 심장 박동 조절기"를 구성하는 것으로 생각됩니다.
시상하핵과 측벽의 연결은 또한 이미터/수신 요소 사이의 감소가 가장 강한 기저 신경절 시스템의 연결이다.체적 측면에서 인간의 경우 외측 팔리듐은 808mm², 치상하핵은 158mm†[17]에 불과하다.이것은 뉴런의 수로 환산하면 지도의 정밀도가 떨어지면서 강한 압박을 나타냅니다.
외측 팔리디움에서 나온 축삭은 [18]선조체로 간다.내측 팔리듐의 활동은 외측 팔리듐과 시상하핵으로부터의 [19]선호에 의해 영향을 받는다.그물코도 [11]마찬가지야시상하핵은 축삭을 다른 조절기, 즉 pedunculo-pontine complex (id)로 보냅니다.
라토팔리도-아프탈라믹 시스템은 파킨슨병에서 [20]볼 수 있는 활동 패턴의 생성에 중요한 역할을 하는 것으로 생각된다.
병태생리학
DBS라고 불리는 STN의 만성 자극은 파킨슨병 환자들을 치료하는데 사용된다.가장 먼저 자극되는 것은 시상하부 뉴런의 활동을 수정하는 구심 축삭의 종말 수목화이다.그러나 마우스 [21]시상편에서 자극이 아데노신의 전구물질인 아데노신 삼인산(ATP)을 방출하는 것으로 나타났다.이어서 아데노신 A1 수용체 활성화는 시상에서의 흥분성 전달을 억제하여 시상하핵의 절제를 모방한다.
당뇨병, 고혈압 또는 흡연 병력이 있는 환자에게서 일반적으로 작은 혈관 뇌졸중을 통해 발생할 수 있는 시상하핵의 일방적인 파괴 또는 파괴는 반신경을 일으킨다.
STN의 의심되는 기능 중 하나가 충동 제어이기 때문에, 이 지역의 기능 장애는 강박성 [22]장애와 관련이 있다.STN을 인위적으로 자극하는 것은 심각한 충동적인 행동을 교정하는데 어느 정도 가능성을 보여주었고 나중에 이 [23]장애의 대체 치료법으로 사용될 수 있다.
기능.
STN의 기능은 알려져 있지 않지만, 현재 이론에 따르면 STN은 작용 선택을 수행할 수 있는 기저 신경절 제어 시스템의 구성 요소로 간주됩니다.이것은 운동 제어의 이른바 "하이퍼 다이렉트 패스"를 실행하는 것으로 생각되며, 이는 기저 신경절의 다른 곳에서 구현되는 직접 및 간접 경로와 대조된다.STN 기능 장애는 또한 똑같이 보람 있는 [24]두 가지 자극을 받은 개인에서 충동성을 증가시키는 것으로 나타났다.
연구 결과 시상하부는 추체외부 중심인 것으로 나타났다.그것은 근육 반응을 억제하고, 손상은 반신반구증(팔과 다리가 몸의 [25]한쪽으로 심하게 흔들리는 것)을 초래할 수 있습니다.
STN의 생리적인 역할은 오랫동안 그 병적인 역할에 가려져 왔다.그러나 최근 STN의 생리학에 대한 연구는 STN이 이동, 균형 및 운동 조정을 포함한 의도된 움직임을 달성하기 위해 필요하다는 것을 발견하게 되었다.이것은 실제로 진행 중인 운동 작업을 중단하거나 중단하는 것과 관련이 있습니다.더욱이 STN 들뜸은 일반적으로 운동 활동의 현저한 감소와 상관관계가 있는 반면, STN 억제는 이동을 [26][27][28]증가시켰다.
기타 이미지
「 」를 참조해 주세요.
레퍼런스
- ^ Luys JB (1865). Recherches sur le système cérébro-spinal, sa structure, ses fonctions et ses maladies (in French). Paris: Baillière.
- ^ Afsharpour S (June 1985). "Light microscopic analysis of Golgi-impregnated rat subthalamic neurons". The Journal of Comparative Neurology. 236 (1): 1–13. doi:10.1002/cne.902360102. PMID 4056088.
- ^ Rafols JA, Fox CA (July 1976). "The neurons in the primate subthalamic nucleus: a Golgi and electron microscopic study". The Journal of Comparative Neurology. 168 (1): 75–111. doi:10.1002/cne.901680105. PMID 819471.
- ^ Yelnik J, Percheron G (1979). "Subthalamic neurons in primates: a quantitative and comparative analysis". Neuroscience. 4 (11): 1717–43. doi:10.1016/0306-4522(79)90030-7. PMID 117397.
- ^ Lévesque JC, Parent A (May 2005). "GABAergic interneurons in human subthalamic nucleus". Movement Disorders. 20 (5): 574–84. doi:10.1002/mds.20374. PMID 15645534.
- ^ Alkemade, Anneke; Forstmann, Birte U. (July 2014). "Do we need to revise the tripartite subdivision hypothesis of the human subthalamic nucleus (STN)?". NeuroImage. 95: 326–329. doi:10.1016/j.neuroimage.2014.03.010.
- ^ Lambert, Christian; Zrinzo, Ludvic; Nagy, Zoltan; Lutti, Antoine; Hariz, Marwan; Foltynie, Thomas; Draganski, Bogdan; Ashburner, John; Frackowiak, Richard (March 2012). "Confirmation of functional zones within the human subthalamic nucleus: Patterns of connectivity and sub-parcellation using diffusion weighted imaging". NeuroImage. 60 (1): 83–94. doi:10.1016/j.neuroimage.2011.11.082. PMC 3315017. PMID 22173294.
- ^ Canteras NS, Shammah-Lagnado SJ, Silva BA, Ricardo JA (April 1990). "Afferent connections of the subthalamic nucleus: a combined retrograde and anterograde horseradish peroxidase study in the rat". Brain Research. 513 (1): 43–59. doi:10.1016/0006-8993(90)91087-W. PMID 2350684.
- ^ Cragg SJ, Baufreton J, Xue Y, Bolam JP, Bevan MD (October 2004). "Synaptic release of dopamine in the subthalamic nucleus". The European Journal of Neuroscience. 20 (7): 1788–802. doi:10.1111/j.1460-9568.2004.03629.x. PMID 15380000.
- ^ a b Nauta HJ, Cole M (July 1978). "Efferent projections of the subthalamic nucleus: an autoradiographic study in monkey and cat". The Journal of Comparative Neurology. 180 (1): 1–16. doi:10.1002/cne.901800102. PMID 418083.
- ^ a b Smith Y, Hazrati LN, Parent A (April 1990). "Efferent projections of the subthalamic nucleus in the squirrel monkey as studied by the PHA-L anterograde tracing method". The Journal of Comparative Neurology. 294 (2): 306–23. doi:10.1002/cne.902940213. PMID 2332533.
- ^ Kita H, Chang HT, Kitai ST (April 1983). "The morphology of intracellularly labeled rat subthalamic neurons: a light microscopic analysis". The Journal of Comparative Neurology. 215 (3): 245–57. doi:10.1002/cne.902150302. PMID 6304154.
- ^ Surmeier DJ, Mercer JN, Chan CS (June 2005). "Autonomous pacemakers in the basal ganglia: who needs excitatory synapses anyway?". Current Opinion in Neurobiology. 15 (3): 312–8. doi:10.1016/j.conb.2005.05.007. PMID 15916893.
- ^ Levy R, Hutchison WD, Lozano AM, Dostrovsky JO (October 2000). "High-frequency synchronization of neuronal activity in the subthalamic nucleus of parkinsonian patients with limb tremor". The Journal of Neuroscience. 20 (20): 7766–75. doi:10.1523/JNEUROSCI.20-20-07766.2000. PMC 6772896. PMID 11027240.
- ^ Lintas A, Silkis IG, Albéri L, Villa AE (January 2012). "Dopamine deficiency increases synchronized activity in the rat subthalamic nucleus" (PDF). Brain Research. 1434 (3): 142–51. doi:10.1016/j.brainres.2011.09.005. PMID 21959175.
- ^ Plenz D, Kital ST (August 1999). "A basal ganglia pacemaker formed by the subthalamic nucleus and external globus pallidus". Nature. 400 (6745): 677–82. doi:10.1038/23281. PMID 10458164.
- ^ Yelnik J (2002). "Functional anatomy of the basal ganglia". Movement Disorders. 17 Suppl 3 (Suppl. 3): S15-21. doi:10.1002/mds.10138. PMID 11948751.
- ^ Sato F, Lavallée P, Lévesque M, Parent A (January 2000). "Single-axon tracing study of neurons of the external segment of the globus pallidus in primate". The Journal of Comparative Neurology. 417 (1): 17–31. doi:10.1002/(SICI)1096-9861(20000131)417:1<17::AID-CNE2>3.0.CO;2-I. PMID 10660885.
- ^ Smith Y, Wichmann T, DeLong MR (May 1994). "Synaptic innervation of neurones in the internal pallidal segment by the subthalamic nucleus and the external pallidum in monkeys". The Journal of Comparative Neurology. 343 (2): 297–318. doi:10.1002/cne.903430209. PMID 8027445.
- ^ Bevan MD, Magill PJ, Terman D, Bolam JP, Wilson CJ (October 2002). "Move to the rhythm: oscillations in the subthalamic nucleus-external globus pallidus network". Trends in Neurosciences. 25 (10): 525–31. doi:10.1016/S0166-2236(02)02235-X. PMID 12220881.
- ^ Bekar L, Libionka W, Tian GF, Xu Q, Torres A, Wang X, et al. (January 2008). "Adenosine is crucial for deep brain stimulation-mediated attenuation of tremor". Nature Medicine. 14 (1): 75–80. doi:10.1038/nm1693. PMID 18157140.
- ^ Carter R. The Human Brain Book. pp. 58, 233.
- ^ Mallet L, Polosan M, Jaafari N, Baup N, Welter ML, Fontaine D, et al. (November 2008). "Subthalamic nucleus stimulation in severe obsessive-compulsive disorder". The New England Journal of Medicine. 359 (20): 2121–34. doi:10.1056/NEJMoa0708514. PMID 19005196.
- ^ Frank MJ, Samanta J, Moustafa AA, Sherman SJ (November 2007). "Hold your horses: impulsivity, deep brain stimulation, and medication in parkinsonism". Science. 318 (5854): 1309–12. doi:10.1126/science.1146157. PMID 17962524.
- ^ Bruce H. Robinson (2007). Biomedicine - A textbook for Practitioners of Acupuncture & Oriental Medicine. Blue Poppy Press. p. 126. ISBN 978-1-891845-38-3. LCCN 2006940894.
- ^ Aron AR, Behrens TE, Smith S, Frank MJ, Poldrack RA (April 2007). "Triangulating a cognitive control network using diffusion-weighted magnetic resonance imaging (MRI) and functional MRI". The Journal of Neuroscience. 27 (14): 3743–52. doi:10.1523/JNEUROSCI.0519-07.2007. PMC 6672420. PMID 17409238.
- ^ Fife KH, Gutierrez-Reed NA, Zell V, Bailly J, Lewis CM, Aron AR, Hnasko TS (July 2017). Uchida N (ed.). "Causal role for the subthalamic nucleus in interrupting behavior". eLife. 6: e27689. doi:10.7554/eLife.27689. PMC 5526663. PMID 28742497.
- ^ Guillaumin A, Serra GP, Georges F, Wallén-Mackenzie Å (March 2021). "Experimental investigation into the role of the subthalamic nucleus (STN) in motor control using optogenetics in mice". Brain Research. 1755: 147226. doi:10.1016/j.brainres.2020.147226. PMID 33358727.




