유방촬영술
Mammography| 유방촬영술 | |
|---|---|
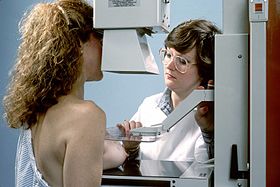 유방촬영술 | |
| 기타이름 | 마스토그래피 |
| ICD-10-PCS | BH0 |
| ICD-9-CM | 87.37 |
| MeSH | D008327 |
| OPS-301 코드 | 3–10 |
| 메드라인플러스 | 003380 |
유방조영술(mastography: DICOM modality = MG라고도 함)은 진단 및 선별을 위해 인간의 유방을 검사하기 위해 저에너지 X선(보통 약 30kVp)을 사용하는 과정입니다. 유방 촬영의 목표는 일반적으로 특징적인 종괴나 미세 석회화의 검출을 통해 유방암을 조기에 발견하는 것입니다.
모든 X선과 마찬가지로 유방촬영술도 이미지를 만들기 위해 이온화 방사선의 선량을 사용합니다. 그런 다음 이 이미지에서 이상 소견이 있는지 분석합니다. 일반적으로 뼈의 방사선 촬영에 사용되는 것보다 낮은 에너지의 X선(K-shell X선 에너지 17.5 및 19.6 keV)과 Rh(20.2 및 22.7 keV)를 사용합니다. 유방 촬영은 사용 가능한 장비 및/또는 검사 목적에 따라 2D 또는 3D(단층촬영)일 수 있습니다. 초음파, 도관조영술, 양전자방출 유방조영술(PEM), 자기공명영상(MRI) 등이 유방조영술의 부속품입니다. 초음파는 일반적으로 유방촬영에서 발견된 종괴 또는 유방촬영에서 볼 수 있거나 볼 수 없는 종괴에 대한 추가 평가에 사용됩니다. 일부 기관에서는 여전히 유방촬영 검사가 진단되지 않을 때 혈액 유두 배출 평가를 위해 덕트그램을 사용합니다. MRI는 고위험 환자의 선별, 의심스러운 소견이나 증상에 대한 추가 평가, 알려진 유방암 환자의 수술 전 평가에 유용할 수 있으며, 수술 접근 방식을 변경할 수 있는 추가 병변(예: 유방 보존 덩어리 절제술에서 유방 절제술)을 감지하기 위해 유용할 수 있습니다.
미국 예방 서비스 태스크 포스(Task Force)는 평균적인 여성의 경우 50세에서 74세 사이의 매 2년마다 (2016년) 유방 촬영을 권장하며, "유방 촬영 검사의 이점은 50세에서 74세 사이의 여성에게 적어도 적당한 양만큼 해를 끼치고 60대 여성에게 가장 크다"고 결론지었습니다.[1] 미국 방사선 대학과 미국 암 학회는 40세부터 매년 유방 촬영 검사를 할 것을 권장합니다.[2] 캐나다 예방 건강 관리 태스크 포스(2012)와 유럽 암 관측소(2011)는 50세에서 69세 사이의 매 2년에서 3년마다 유방 촬영을 권장합니다.[3][4] 이러한 태스크포스 보고서들은 불필요한 수술과 불안 외에도 방사선에 의해 유발되는 유방암의 작지만 상당한 증가가 더 자주 발생하는 유방암의 위험성을 지적하고 있습니다.[5][6] 또한 유방확대, 유방절제술, 유방축소술 등 유방수술을 받는 환자에서는 유방촬영술을 빈도를 높여 시행해서는 안 됩니다.[7] Cochrane Collaboration(2013)은 10년 후에 적절한 무작위 추출을 실시한 실험에서 유방암을 포함한 전체 암 사망률에 대한 유방촬영 검사의 효과가 발견되지 않았다고 결론지었습니다. 이 코크란 리뷰의 저자들은 이렇게 썼습니다: "만약 우리가 검진을 통해 유방암 사망률이 15% 감소하고, 과잉 진단과 과잉 치료가 30%라고 가정한다면, 10년 동안 검진을 위해 초대된 2,000명의 여성들 중 한 명은 유방암으로 사망하는 것을 피할 수 있고, 10명의 건강한 여성들은 사망하지 않을 것이라는 것을 의미합니다. 검진이 없었다면 진단을 받지 못했을 사람은 불필요한 치료를 받게 됩니다. 게다가, 200명 이상의 여성들은 잘못된 긍정적인 결과로 인해 수년간 불안과 불확실성을 포함한 중요한 심리적 고통을 겪을 것입니다." 저자들은 모든 연령대에서 보편적 유방촬영 검사를 권장해야 하는지 여부를 다시 평가할 때가 왔다고 결론지었습니다.[8] 그들은 보편적인 심사가 합리적이지 않을 수 있다고 말합니다.[9] Nordic Cochrane Collection은 2012년에 연구를 업데이트하고 진단과 치료의 발전으로 인해 오늘날 유방촬영 검사의 효과가 감소하여 "더 이상 효과가 없다"고 말했습니다. 그들은 어느 연령대의 유방암 검진을 위해 "따라서 더 이상 참석하는 것은 타당하지 않은 것 같다"고 결론짓고, 인터넷상에서 오해의 소지가 있는 정보에 대해 경고합니다.[9]
유방촬영술은 위음성(암 누락) 비율이 최소 10%입니다. 이것은 부분적으로 암을 가리는 조밀한 조직과 정상 조직의 모습과 크게 겹치는 유방 사진에 암이 나타나는 것 때문입니다. 조직적인 심사를 받은 국가의 프로그램에 대한 메타 분석 검토 결과 52%의 과잉 진단 비율이 발견되었습니다.[9]
역사
이온화 방사선을 유도하는 의료 시술로 유방촬영술의 기원은 1895년 빌헬름 뢴트겐의 X선 발견으로 거슬러 올라갈 수 있습니다.
1913년 독일의 외과의사 알버트 살로몬은 유방 X선을 실제 제거된 조직과 비교하여 3,000개의 유방 절제술에 대한 유방 촬영 연구를 수행했으며, 구체적으로 미세 석회화를 관찰했습니다.[10][11] 그렇게 함으로써, 그는 X선 이미지에서 유방의 암성 종양과 비암성 종양 사이의 차이를 확인할 수 있었습니다.[11] 살로몬의 유방 사진은 종양의 확산과 그 경계에 대한 상당한 정보를 제공했습니다.[12]
1930년, 미국의 의사이자 방사선학자인 스태퍼드 L. 워렌(Stafford L. Warren)은 임신과 유방염으로 인한 유방 조직의 변화를 추적하기 위해 입체 X선 영상을 제작한 연구인 [13]"A Roentgenology Study of the Breast"를 출판했습니다.[14][15] 이후 수술을 받은 119명의 여성에게서 그는 58건 중 54건에서 유방암을 정확하게 발견했습니다.[14]
일찍이 1937년에 Jacob Gershon-Cohen은 생존율을 향상시키기 위해 초기 단계에서 유방암 진단을 위한 형태의 유방촬영술을 개발했습니다.[16] 1950년대 초, 우루과이의 방사선학자 라울 레보르네는 더 나은 화질의 영상을 만들기 위해 유방압박술을 개발했고, 양성과 악성 미세 석회화의 차이점을 설명했습니다.[17] 1956년, Gershon-Cohen은 Albert Einstein Medical Center에서 1,000명이 넘는 무증상 여성을 대상으로 그의 스크리닝 기법에 대한 임상 추적을 실시했고,[16] 같은 해, 텍사스 대학교 M.D. Anderson Cancer Center의 Robert Egan은 낮은 kVp 기술과 높은 mA 및 단일 에멀젼 필름을 결합하여 유방 촬영을 스크리닝하는 방법을 고안했습니다. 그는 1959년에 논문에 이러한 결과를 발표했고, 그 후 1964년에 맘모그래피라는 책에서 속설화했습니다.[18] 알려진 바와 같이, "이건 기술"은 의사들이 유방 조직에서 석회화를 감지할 수 있게 해주었습니다;[19] 1,000명의 환자들 중 조직검사에서 확인된 245개의 유방암 중에서, 이건과 그의 동료들은 그의 방법을 사용하여 238명의 환자를 확인할 수 있었습니다. 그 중 19명은 신체 검사에서 유방 병리가 발견되지 않은 환자였습니다.
유방촬영술이 사망률 및 치료에 미치는 영향을 입증한 1966년 연구 이후 임상적으로 확산된 스크리닝 기법으로서 유방촬영술의 사용. 뉴욕에 기반을 둔 이 연구는 유방촬영 검사의 대규모 무작위 대조 시험으로는 처음이었습니다.[20][21]
절차.


시술 중에는 전용 유방 촬영 장치를 사용하여 유방을 압박합니다. 평행판 압축은 X선이 투과해야 하는 조직의 두께를 줄여 영상의 질을 높여주기 위해 유방 조직의 두께를 고르게 하여 산란된 방사선의 양을 줄여주고(영상의 질을 떨어뜨려) 필요한 방사선량을 줄여주며 유방을 가만히 잡아주는(움직임 방지) 기능을 합니다. 유방 촬영을 스크리닝할 때 유방의 머리에서 발(두개, CC) 보기와 각진 측면 보기(중측 경사, MLO) 영상이 모두 촬영됩니다. 진단 유방조영술에는 이러한 보기와 특정 문제 영역의 기하학적 확대 보기 및 스폿 압축 보기를 포함한 기타 보기가 포함될 수 있습니다.[citation needed] 데오도란트[citation needed], 활석 분말[22], 로션 등이 엑스레이에 칼슘 반점으로 나타날 수 있어 여성들은 시험 당일 바르는 것이 권장되지 않습니다. 유방촬영 검사에는 유방촬영 검사와 진단 유방촬영 검사의 두 가지 유형이 있습니다. 4개의 표준 X선 영상으로 구성된 유방 촬영 검사는 증상이 없는 환자에게 매년 수행됩니다. 진단 유방조영술은 유방 증상(촉각성 혹, 유방 통증, 피부 변화, 유두 변화 또는 유두 배출 등)이 있는 환자를 대상으로 하며, 양성 소견일 가능성이 있는 환자(코드화된 BI-RADS 3)에 대한 후속 조치로 또는 검진 유방조영술에서 볼 수 있는 이상 소견에 대한 추가 평가를 위해 예약됩니다. 유방암의 개인 및/또는 가족력이 있는 환자에게도 진단 유방조영술을 시행할 수 있습니다. 유방 보형물 및 기타 안정적인 양성 수술 이력이 있는 환자는 일반적으로 진단 유방 사진이 필요하지 않습니다.
몇 년 전까지만 해도 유방 촬영은 일반적으로 스크린 필름 카세트로 수행되었습니다. 오늘날, 유방 촬영은 디지털 유방 촬영 또는 FFDM(Full Field Digital Mammography)으로 알려진 디지털 디텍터로 전환되고 있습니다. 최초의 FFDM 시스템은 2000년 미국 FDA의 승인을 받았습니다. 이러한 진행은 일반적인 영상의학과보다 몇 년 늦게 일어나고 있습니다. 이는 다음과 같은 몇 가지 요인 때문입니다.
- 유방 촬영술의 공간 해상도 요구가 높아짐
- 장비 비용이 크게 증가함
- FDA는 디지털 유방 촬영 장비가 유방암을 발견하는 데 있어 용량을 늘리거나 추가 평가를 위해 회수되는 여성의 수를 늘리지 않고 최소한 스크린 필름 유방 촬영만큼 우수하다는 것을 보여준다고 우려했습니다.
2010년 3월 1일 현재 미국과 그 영토에 있는 시설의 62%가 적어도 하나의 FFDM 장치를 가지고 있습니다.[23] (FDA는 이 수치에 컴퓨터 방사선 촬영 장치를 포함합니다.)[24]
3D 유방촬영술(3D mammography)로 알려진 Tomosynthesis는 2008년 임상시험에 처음 도입되었으며 2015년부터 미국에서 메디케어 승인을 받았습니다. 2023년 현재 3D 유방촬영술은 미국에서 널리 이용 가능하게 되었으며 2D 유방촬영술에 비해 민감도와 특이도가 향상된 것으로 나타났습니다.
맘모그램은 한 명(단독) 또는 두 명(단독)의 훈련된 전문가에 의해 관찰됩니다:[25] 이러한 영화 판독기는 일반적으로 방사선사이지만 방사선사, 방사선 치료사 또는 유방 임상의(유방 질환을 전문으로 하는 비방사선 의사)일 수도 있습니다.[26] 영국에서는 표준 관행이지만 미국에서는 덜 일반적인 이중 판독은 시술의 민감도와 특수성을 크게 향상시킵니다.[25] 임상 결정 지원 시스템은 디지털 유방 촬영(또는 아날로그 유방 촬영의[27] 디지털 이미지)과 함께 사용될 수 있지만, 연구에 따르면 이러한 접근 방식이 성능을 크게 향상시키거나 약간의 개선만 제공하지는 않습니다.[25][28]
디지털.
디지털 맘모그래피는 유방암 검진을 돕기 위해 X선 필름 대신 디지털 수용체와 컴퓨터를 사용하는 특수 형태의 맘모그래피입니다.[29] 전기 신호는 컴퓨터 화면에서 읽을 수 있으므로 영상을 더 많이 조작하여 방사선사가 결과를 더 명확하게 볼 수 있습니다.[29][30] 디지털 유방 촬영은 유방 생검을 위한 "스팟 뷰",[31] 또는 스크리닝을 위한 "풀 필드"(FFDM)일 수 있습니다.[29]
디지털 유방 촬영술은 정위 조직 검사에도 사용됩니다. 유방 생검은 초음파 또는 자기 공명 영상(MRI)과 같은 다른 양식을 사용하여 수행할 수도 있습니다.
방사선[32] 전문의들은 좀 더 현저한 개선을 기대했지만, 디지털 유방 촬영술의 효과는 2004년 기존의 X선 방법과 유사한 것으로 밝혀졌지만, 이 기술을 사용하면 방사선이 감소하고 재검사 횟수가 줄어들 수 있습니다.[29] 특히, 유방암 여성의 4분의 3 이상을 대표하는 폐경 후 여성들에게는 필름보다 더 나은 성과를 거두지 못합니다.[33] 미국 예방 서비스 태스크 포스(Task Force)는 디지털 유방 촬영을 권장하거나 반대할 만한 증거가 부족하다고 결론 내렸습니다.[34]
디지털 맘모그래피는 허블 우주 망원경을 위해 개발된 기술을 활용한 나사의 스핀오프입니다.[35] 2007년 기준으로 미국 선별검사소의 약 8%가 디지털 유방촬영술을 사용하고 있습니다. 전 세계적으로 후지필름사의 시스템이 가장 널리 사용되고 있습니다.[citation needed] 미국에서 GE의 디지털 이미징 장치는 일반적으로 필름 기반 이미징 시스템보다 훨씬 많은 30만~50만 달러의 비용이 듭니다.[33] GE가 가격이 저렴한 후지 시스템과 경쟁하기 시작하면서 비용이 감소할 수 있습니다.[33]
3D 유방촬영술
3차원 유방촬영술(Digital Breast Tomosynthesis, DBT), 단층촬영술(Tomosynthesis), 3D 유방촬영술(3D breast imaging)은 X선을 이용하여 유방의 3차원 영상을 만들어내는 유방촬영술입니다. 일반적인 유방 촬영과 함께 사용하면 더 많은 양성 검사 결과가 나옵니다.[36] 비용 효율성은 2016년 기준으로 불분명합니다.[37] 또 다른 우려 사항은 방사선 피폭량이 두 배 이상 증가한다는 것입니다.[38]
광자 계수
광자 계수 유방 촬영술은 2003년에 상업적으로 도입되었으며 기존의 방법에 비해 환자에게 X선 선량을 약 40% 감소시키면서도 이미지 품질은 동등 이상으로 유지하는 것으로 나타났습니다.[39] 이 기술은 이후 영상 품질을 더욱 향상시키고, 서로 다른 조직 유형을 구별하며,[40] 유방 밀도를 측정할 수 있는 가능성으로 스펙트럼 이미징을 가능하게 하기 위해 개발되었습니다.[41][42]
갈락토그래피
갈락토그래피(galactography) 또는 유방관조영술(breast ductography)은 현재 우유관을 시각화하는 데 사용되는 드물게 사용되는 유방조영술 유형입니다. 유방 촬영 자체에 앞서 방사선 불투과성 물질을 덕트 시스템에 주입합니다. 이 테스트는 유두 배출이 있을 때 표시됩니다.
채점
유방촬영 결과는 종종 "BI-RADS 점수"라고 불리는 BI-RADS 평가 범주로 표현됩니다. 범주의 범위는 0(불완전)에서 6(알려진 조직검사 – 입증된 악성)까지입니다. 영국에서 유방촬영술은 1-5(1 = 정상, 2 = 양성, 3 = 불확정, 4 = 악성 의심, 5 = 악성)의 척도로 점수가 매겨집니다. 유전적 위험을 고려하면 요인이 유방암 위험 예측을 향상시킨다는 증거가 있습니다.[43]
"Work-up" 프로세스
지난 몇 년 동안, "워크업" 과정은 매우 공식화되었습니다. 일반적으로 필요한 경우 선별 유방 촬영, 진단 유방 촬영 및 조직 검사로 구성되며, 종종 정위 코어 조직 검사 또는 초음파 유도 코어 조직 검사를 통해 수행됩니다. 유방 X선 검사 후 일부 여성의 경우 유방 X선 검사에서 얻을 수 있는 정보만으로는 해결할 수 없는 문제가 발생할 수 있습니다. 그런 다음 "진단 유방조영술"을 위해 다시 호출됩니다. 이 문구는 본질적으로 문제를 해결하는 유방 X선 사진을 의미합니다. 이 시간 동안 방사선사는 방사선사가 촬영한 각 추가 필름을 모니터링합니다. 소견의 특성에 따라 초음파도 종종 사용될 수 있습니다.[44]
일반적으로 특이한 외모의 원인은 양성으로 밝혀집니다. 충분한 확실성을 가지고 원인을 양성으로 판단할 수 없는 경우 조직검사를 권장할 수 있습니다. 조직검사 절차는 병리학자가 정확한 이상 원인을 알아내기 위해 현미경으로 검사할 수 있도록 현장에서 실제 조직을 얻는 데 사용됩니다. 과거에는 국소 또는 전신 마취하에 수술에서 생검이 가장 많이 이루어졌습니다. 이제 대부분은 문제가 되는 부위가 생검 부위인지 확인하기 위해 초음파 또는 유방 촬영 가이드와 함께 바늘을 사용하여 수행됩니다. 이러한 핵심 생체검사는 경미한 치과 시술 시 투여되는 것과 유사한 국소 마취만 필요합니다.[45]
혜택들
유방 촬영술은 암이 가장 치료 가능할 때 조기에 발견할 수 있고 덜 침습적으로 치료할 수 있습니다(따라서 삶의 질을 유지하는 데 도움이 됩니다).
국립암연구소 자료에 따르면 1980년대 중반 유방암 검진이 보편화된 이후 지난 50년간 변하지 않았던 미국의 유방암 사망률은 30%를 훨씬 넘게 떨어졌습니다.[46] 유방암 검진 프로그램이 더 체계화된 덴마크나 스웨덴 같은 유럽 국가에서는 지난 20년간 유방암 사망률이 거의 절반으로 줄었습니다.[as of?]
Cancer Epidemology, Biomarkers & Prevention에 발표된 연구에 따르면 유방 촬영 검사는 유방암으로 사망할 위험을 거의 절반으로 줄였습니다.[47] 최근 암(Cancer)지에 발표된 연구에 따르면 하버드 주요 교습 병원에서 40대 유방암으로 사망한 여성의 70% 이상이 검진을 받지 않은 여성의 20%에 속했습니다.[48] 어떤 과학적[citation needed] 연구들은 40세에 시작하는 검사로 가장 많은 생명을 구한다는 것을 보여주었습니다.
영국의학저널(British Medical Journal)의 최근 연구에 따르면 유방암을 조기에 발견하면 유방암 생존율이 크게 향상됩니다.[49]
무작위 시험에서 유방암 사망률을 감소시키는 유방촬영 검사의 이점은 유방암 검진 프로그램의 시행 후 오랜 기간 동안 수행된 관찰 연구에서 발견되지 않습니다(예: Blyer et al.[50] 이러한 불일치는 유방조영술로 인한 암으로 설명될 수 있습니다.[51]
언제부터 스크리닝을 시작해야 하는지
2014년 국립보건원의 감시, 역학 및 최종 결과 프로그램은 다른 연령대의 여성 1000명을 기준으로 유방암 발생률을 보고했습니다.[52] 40-44세 그룹에서 발병률은 1.5, 45-49세 그룹에서 발병률은 2.3이었습니다.[52] 고연령층에서는 50-54세 그룹에서 2.7명, 55-59세 그룹에서 3.2명의 발병률을 보였습니다.[52] 40세에서 50세 사이의 검진은 다소 논란의 여지가 있지만, 증거의 우세는 조기 발견 측면에서 이점이 있음을 나타냅니다. 현재, 미국 암 학회, 미국 산부인과 학회 (ACOG), 미국 방사선 대학, 그리고 유방 영상 학회는 40세부터 매년 유방 X선 사진을 장려하고 있습니다.[53][54][55]
국립암연구소는 40세에서 49세 사이의 여성들에게 매 1년에서 2년마다 유방촬영술을 권장하고 있습니다.[56] 이와는 대조적으로, 대규모 내과 그룹인 미국 의사 대학은 최근 40세에서 49세 사이의 여성을 대상으로 한 1년에 한 번씩 실시하는 도매 검진과는 대조적으로 개별화된 검진 계획을 장려하고 있습니다.[57] 2009년, 미국 예방 서비스 태스크 포스는 40세에서 49세 사이의 여성에 대한 검진은 개인의 위험 요소에 근거해야 하며, 이 연령대에서는 검진이 일상적이어서는 안 된다고 권고했습니다.[34] 그들의 보고서는 50세 이전에 검사를 받는 것의 이점이 위험보다 크지 않다고 말합니다.[58]
40세에 심사를 시작합니다.
유방암 6명 중 1명은 40대 여성에게 발생합니다. 40세 여성의 유방암 10년 위험은 69명 중 1명이며 나이가 들수록 증가합니다. 유방촬영술로 절약되는 모든 생명의 40%는 40대 여성입니다.
스크리닝 유방 촬영술은 40-84세 여성의 연간 스크리닝으로부터 39.6%의 사망률 감소로 가장 큰 이점을 보여줍니다. 이 선별 요법은 사망률이 23.2% 감소한 50-74세 여성의 (USPSTF 권장 요법) 2년마다 검사하는 것보다 71% 더 많은 생명을 구합니다.[59] 여성들은 40세 이후에 유방암으로 사망할 확률을 높이고, 궁극적으로 발견되는 모든 진행성 암에 대한 치료는 더 광범위하고 비용이 많이 들 것입니다.
가족력이나 다른 요인으로 인해 유방암 위험이 높은 여성은 40세 이전에 검진을 시작하는 것에 대해 의사와 이야기해야 합니다.
USPTF 권고에 반대하는 주장
유방암 진단을 받은 여성의 약 75%는 유방암 가족력이 없거나 발병 위험이 높은 다른 요인을 가지고 있습니다(따라서 고위험 여성만을 선별하는 것은 대부분의 암을 놓치고 있습니다). 미국 뢴트겐학 저널에 [60]실린 헨드릭과 헬비의 분석에 따르면 USPSTF 유방암 검진 지침이 지켜지면 미국에서 매년 약 6,500명의 여성이 유방암으로 추가로 사망할 것으로 나타났습니다.
역사상 가장 크고 가장 오래 실행된 (Hellquist et al)[61] 유방암 검진 연구(Tabar et al)[62]는 정기적인 유방촬영 검진이 40세 이상의 모든 여성(40~49세 여성 포함)에서 유방암 사망률을 약 3분의 1로 줄인다는 사실을 다시 확인했습니다. 그러면 USPSTF 계산이 절반으로 줄어듭니다. 그들은 15%의 사망률 감소를 사용하여 생명을 구하기 위해 몇 명의 여성을 초청해야 하는지 계산했습니다. 현재 29%(또는 그 이상)의 수치가 다시 확인된 상태에서, USPSTF 공식을 사용하여 선별될 수 있는 수는 그들의 추정치의 절반이고 공식에 의해 허용 가능하다고 간주되는 수 이내입니다.
USPSTF 보고서에 따르면 50세 이상 여성의 경우에도 격년으로 유방 X선 사진을 거르면 최대 30%의 암이 사라진다고 합니다. 최근[63] 암(Cancer)지에 발표된 연구에 따르면 하버드 주요 교습 병원에서 40대 유방암으로 사망한 여성의 70% 이상이 검진을 받지 않은 여성의 20%에 속했습니다.
권고를 한 패널에 대한 편견과 경험 부족에 대한 우려가 있습니다. USPSTF에는 유방암 전문가(종양내과 전문의, 방사선 전문의, 유방외과 전문의 또는 방사선 종양 전문의)가 한 명도 포함되거나 참여하지 않았지만, 현재 또는 이전에 건강 보험 업계에 종사한 사람들이 있었습니다(일부에서는 유방 X선 사진 비용을 지불하지 않는 것이 기득권이라고 주장합니다).[citation needed]
유방촬영술에 반대하는 주장

유방조영술을 증상이 없는 건강한 여성의 조기 유방암 발견을 위한 선별 도구로 사용하는 것은 논란의 여지가 있습니다.[64][65][66]
Kein과 Kein은 50세부터 반복적으로 유방촬영을 하면 검진을 받은 여성 1,000명당 15년 동안 약 1.8명의 생명을 구할 수 있다고 밝혔습니다.[67] 이 결과는 진단 오류, 과잉 치료 및 방사선 노출의 부작용에 대해 봐야 합니다.
스크리닝에 대한 코크란 분석은 "스크리닝이 해를 끼치는 것보다 해를 끼치는 것이 더 큰지 확실하지 않다"는 것을 나타냅니다. 이들의 분석에 따르면 여성 2,000명 중 1명은 10년의 검진으로 수명이 연장되고, 건강한 여성 10명은 불필요한 유방암 치료를 받게 됩니다. 또한 200명의 여성들은 잘못된 긍정적인 결과로 인해 상당한 심리적 스트레스를 받게 될 것입니다.[8]
뉴먼은 유방촬영 검사가 전체적으로 사망을 줄이는 것은 아니지만, 암 공포와 불필요한 수술 개입을 가함으로써 상당한 해를 끼친다고 주장합니다.[68] Nordic Cochrane Collection은 유방암 진단과 치료의 발전으로 인해 유방암 검진이 유방암으로 인한 사망을 줄이는 데 더 이상 효과적이지 않을 수 있으며, 따라서 위험이 이익보다 클 수 있기 때문에 더 이상 건강한 여성에게 일상적인 검진을 권장하지 않는다고 지적했습니다.[9]
검진을 받는 1,000명의 미국 여성 중 약 7%가 진단 세션을 위해 다시 호출됩니다(일부 연구에서는 그 수가 10%에서 15%[69]에 더 가까울 것으로 추정합니다). 다시 소집된 분들 중 10% 정도는 조직검사를 의뢰받을 예정입니다. 조직검사에 의뢰된 10% 중 약 3.5%는 암에 걸릴 것이고 6.5%는 그렇지 않을 것입니다. 암에 걸린 3.5% 중 2명 정도는 치료 후 완치되는 조기 암에 걸릴 것입니다.
유방 촬영은 또한 거짓 음성을 생성할 수 있습니다. 유방 촬영으로 놓친 암의 수는 보통 20%[70] 정도입니다. 암을 볼 수 없는 이유로는 관찰자 오류가 있지만, 유방의 다른 치밀한 조직에 의해 암이 가려져 있고, 유방 X선 사진을 후향적으로 검토해도 암을 볼 수 없기 때문인 경우가 더 많습니다. 또한 유방암의 한 형태인 소엽암은 정상적인 유방 조직과 구분할 수 없는 성장 패턴을 가지고 있습니다.
사망률
Cochrane Collaboration은 최고의 품질의 증거가 유방 촬영 검사로 인한 모든 종류의 암으로부터 사망률의 감소 또는 사망률의 감소를 입증하지 못한다고 말합니다.[8]
캐나다 태스크 포스(Canadian Task Force)는 50세에서 69세 사이의 여성의 경우 11년 동안 2~3년에 한 번씩 720명의 여성을 검진하는 것이 유방암으로 인한 사망자 1명을 예방할 수 있다는 것을 발견했습니다. 40세에서 49세 사이의 여성의 경우 유방암으로 인한 단 한 명의 사망을 예방하기 위해 2,100명의 여성이 동일한 빈도와 기간으로 검진을 받아야 합니다.[3]
혹이나 다른 증상이 나타나기 전에 유방암 검진을 통해 유방암이 발견된 여성들은 일반적으로 유방암이 "생명을 구했다"고 추정합니다.[71] 실제로, 이 여성들 중 대다수는 유방 X선 사진으로부터 아무런 실질적인 혜택을 받지 못했습니다. 유방 촬영술로 발견되는 암은 다음과 같은 네 가지 범주가 있습니다.
- 매우 쉽게 치료되는 암은 나중에 발견해도 같은 치료율을 나타냈을 것입니다(여성들은 유방촬영술이 없어도 살았을 것입니다).
- 암은 너무 공격적이어서 조기 발견도 너무 늦어 환자에게 도움이 되지 않습니다(유방촬영으로 발견했음에도 불구하고 사망하는 여성).
- 스스로 물러났거나 성장 속도가 너무 느려서 암이 증상을 일으키기 전에 여성이 다른 원인으로 사망할 수도 있는 암(모그래피 검사 결과 이 부류의 진단과 치료가 과다하게 이루어짐).
- 유방촬영 검사로 발견되고 조기 발견으로 치료 결과가 개선되는 소수의 유방암.
유방촬영 검사로 발견된 유방암의 3~13%만이 이 마지막 범주에 속하게 됩니다. 임상 시험 데이터에 따르면 10년 이상 검진을 받은 건강한 여성 1,000명당 1명의 여성이 이 범주에 속합니다.[71] 유방촬영 검사는 나머지 87%에서 97%의 여성들에게 아무런 이득을 주지 못합니다.[71] 여성이 위의 네 가지 범주 중 하나에 해당할 확률은 연령에 따라 다릅니다.[72][73]
2016년 미국 예방 서비스 태스크 포스(Task Force)의 리뷰에 따르면 유방 촬영술은 다양한 연령대에서 유방암 사망률이 8%-33% 감소하는 것과 관련이 있지만 이러한 감소는 39–49세 및 70–74세 연령대에서 통계적으로 유의하지 않은 것으로 나타났습니다. 같은 검토 결과 50세 이상 여성의 경우 유방촬영술로 진행성 암 위험이 38% 유의하게 감소했지만 39~49세에서는 위험 감소가 유의하지 않은 2%[74]로 나타났습니다. USPSTF는 40세에서 49세 사이의 여성의 유방암을 연구하는 무작위 대조 시험(RCT)의 데이터를 기반으로 그들의 검토를 하였습니다.[52]
사망률 감소에 있어 유방촬영 검사의 효과가 부족한 것은 유방촬영으로 인한 암으로 설명될 수 있습니다.[51]
오탐
모든 검사 절차의 목표는 많은 환자를 검사하고 소수의 환자가 심각한 상태를 가질 가능성이 가장 높다는 것을 발견하는 것입니다. 그런 다음 이 환자들은 더 많은, 일반적으로 더 침습적인 테스트를 위해 의뢰됩니다. 따라서 선별 검사는 확정적인 것이 아니라 유용한 비율의 암을 발견하기에 충분한 민감도를 갖는 것이 목적입니다. 더 높은 민감도의 비용은 질병이 없는 환자에서 의심스러운 결과로 간주될 수 있는 더 많은 수의 결과입니다. 이것은 유방 촬영에 해당합니다. 검진 세션에서 추가 검사를 위해 다시 호출되는 질병이 없는 환자(약 7%)를 "위양성"이라고 부르기도 합니다. 발견된 질병 환자의 수와 다시 선별해야 하는 질병이 없는 환자의 수 사이에는 균형이 있습니다.[citation needed]
연구는[75] 거짓 양성 유방 사진이 여성의 행복과 행동에 영향을 줄 수 있다는 것을 보여줍니다. 거짓 양성 결과를 받은 일부 여성은 일상적인 검진을 위해 돌아오거나 유방 자가 검진을 더 자주 받을 가능성이 있습니다. 하지만, 거짓 양성 결과를 받은 일부 여성들은 수년간 지속될 수 있는 유방암에 걸릴 가능성에 대해 불안하고, 걱정하고,[citation needed] 괴로워합니다.
거짓 양성은 또한 개인과 선별 프로그램 모두에 더 큰 비용을 의미합니다. 추적 검사는 일반적으로 초기 검사보다 훨씬 비용이 많이 들기 때문에 (추적 검사를 받아야 하는) 잘못된 양성이 더 많다는 것은 주어진 돈을 받고 검사를 받는 여성이 더 적을 수 있다는 것을 의미합니다. 따라서 민감도가 증가함에 따라 선별 프로그램은 비용이 더 많이 들거나 더 적은 수의 여성을 선별하는 데 국한됩니다.[citation needed]
과잉진단
유방암 유방암 검진의 중심적인 위해는 암의 병리학적 정의를 충족하지만 증상이나 사망을 유발하기 위해 진행되지 않는 이상을 발견하는 과잉 진단입니다. 다트머스 대학의 연구원인 H. 길버트 웰치 박사는 "화면으로 감지된 유방암과 전립선암 생존자들은 실제로 이 검사에 의해 도움을 받았다기 보다는 과잉 진단되었을 가능성이 더 크다"고 말합니다.[71] 유방 촬영과 관련된 과잉 진단의 추정치는 1%에서 54%[76]까지 다양합니다. 2009년 피터 C. Gotshee와 Karsten Juhl Jörgensen이 문헌을 검토한 결과, 유방 촬영 검사를 제공한 집단에서 검출된 유방암 사례 3건 중 1건이 과다 진단된 것으로 나타났습니다.[77] 이와는 대조적으로, 영국과 암 연구를 위한 국가 암 책임자가 2012년에 소집한 패널은 유방암 검진을 받은 여성 중에서 진단된 유방암 환자 5명 중 1명은 과잉 진단을 받은 것으로 결론지었습니다. 이는 검진에 초대된 여성 1만 명당 129명의 과잉 진단 비율을 의미합니다.[78]
위음성
유방촬영술은 또한 종양을 놓치는 비율, 즉 "위음성"을 가지고 있습니다. 유방 X선 사진을 촬영한 모든 여성에게 유방 절제술을 시행하여 위음성 비율을 확인할 수 없기 때문에 위음성 수에 대한 정확한 데이터를 얻기가 매우 어렵습니다. 거짓 음성 비율의 추정치는 수년 동안 많은 수의 환자를 면밀히 추적하는 데 달려 있습니다. 이것은 많은 여성들이 정기적인 유방 촬영을 위해 돌아오지 않기 때문에 실제로는 암에 걸린 적이 있는지 알 수 없기 때문에 어렵습니다. 그의 책 암의 정치학에서 새뮤얼 S. Epstein은 40세에서 49세 사이의 여성에게서 유방촬영술을 할 때마다 4개의 암 중 1개가 누락된다고 주장합니다. 연구원들은 유방 조직이 젊은 여성들 사이에서 밀도가 높아 종양을 발견하기 어렵다는 것을 발견했습니다. 이러한 이유로 폐경 전 유방촬영술(Prate)에서 위음성이 나타날 가능성이 두 배나 높습니다. 이것이 영국의 검진 프로그램이 50세가 되어서야 여성들에게 유방조영술 검진을 위한 전화를 하기 시작하는 이유입니다.[citation needed]
특히 여성이 매년 유방 X선 사진을 받고 있는 경우 이러한 누락된 암의 중요성은 명확하지 않습니다. 밀접하게 관련된 상황에 대한 연구는 즉시 작용하지 않지만 몇 년 동안 관찰되는 작은 암이 좋은 결과를 가져올 것이라는 것을 보여주었습니다. 3,184명의 여성들이 공식적으로 "양성일 가능성이 있는" 것으로 분류된 유방 사진을 가지고 있었습니다. 이 분류는 명확하게 정상적이지는 않지만 일부 경미한 관심 영역이 있는 환자를 위한 것입니다. 이로 인해 환자가 생체검사를 받는 것이 아니라 3년 동안 매 6개월마다 조기에 유방촬영 검사를 받아 상태에 변화가 있었는지 여부를 확인하게 됩니다. 이 3,184명의 여성 중 17명(0.5%)이 암에 걸렸습니다. 가장 중요한 것은 최종적으로 진단이 내려졌을 때는 모두 초기 단계인 0기나 1기였습니다. 치료 후 5년이 지난 이들 17명의 여성 중 어느 누구도 재발의 증거가 없었습니다. 따라서, 작은 초기 암들은 비록 즉시 작용하지는 않았지만, 여전히 안정적으로 치료 가능했습니다.[79]
방사능
유방 촬영과 관련된 방사선 노출은 선별의 잠재적 위험이며, 젊은 여성들에게 더 큰 것으로 보입니다. 여성이 방사선을 0.25~20 그레이(Gy) 받는 스캔에서 유방암 발병 위험이 더 높습니다.[80] 유방조영술로 인한 방사선 위험에 대한 연구는 40세 이상의 여성의 경우 방사선으로 인한 유방암의 위험이 특히 유방조영술 검사의 잠재적인 이점과 비교할 때 미미하며, 방사선 노출로 인해 손실된 각 생명에 대해 48.5명의 이익 대 위험 비율이 절약된다는 결론을 내렸습니다.[81] 이는 유방암 사망률이 24%[80] 감소하는 것과도 상관관계가 있습니다.
기타위험
보건 전문가 대다수는 35세 이하 무증상 여성의 유방암 발생 위험이 방사선 노출 위험을 보증할 만큼 높지 않다고 입을 모으고 있습니다. 이러한 이유로 35세 미만 여성의 유방 방사선 민감도가 고령 여성보다 더 높을 수 있기 때문에 대부분의 방사선 전문의는 40세 미만 여성의 유방 촬영 검사를 권장하지 않습니다. 그러나 (유전자 검사, 양성 가족력 등으로) 특정 환자에게 암 발생 위험이 상당한 경우, 연령 이전의 유방 촬영이 여전히 중요할 수 있습니다. 종종 방사선사는 초음파 또는 MRI 영상을 사용하여 유방 촬영을 피하려고 합니다.
통증
유방 촬영 시술은 고통스러울 수 있습니다. 보고된 통증률은 6-76%이며, 23-95%는 통증이나 불편함을 경험합니다.[82] 통증을 경험하는 것은 여성들이 검진에 다시 참여하지 않을 때 중요한 예측 요인입니다.[83] 유방 촬영의 통증을 줄이기 위한 입증된 중재는 거의 없지만, 유방 촬영이 일어나기 전에 여성에게 유방 촬영 절차에 대한 정보를 제공하는 것이 경험하는 통증과 불편함을 줄일 수 있다는 증거가 있습니다.[84] 또한 표준화된 압축 수준이 환자의 통증을 줄이는 데 도움이 되는 동시에 최적의 진단 이미지를 생성할 수 있다는 연구 결과가 나왔습니다.[85]
출석
유방암 검진에 얼마나 많은 사람들이 참석하는지에 많은 요인들이 영향을 미칩니다. 예를 들어, 소수 민족 공동체 출신의 사람들은 또한 암 검진에 참석할 가능성이 적습니다. 영국에서는 남아시아 혈통의 여성들이 유방암 검진에 가장 덜 참석하는 것으로 나타났습니다. 다양한 남아시아 공동체에 대한 특정 장벽을 식별하기 위해서는 여전히 연구가 필요합니다. 예를 들어, 영국-파키스탄 여성들은 문화적, 언어적 장벽에 직면했고, 유방 검진이 여성들만의 환경에서 이루어진다는 것을 인지하지 못했다는 연구 결과가 나왔습니다.[86][87][88]
정신 질환이 있는 사람들은 암 검진 예약에 참석할 가능성도 적습니다.[89][90] 북아일랜드에서 정신 건강에 문제가 있는 여성은 그렇지 않은 여성에 비해 유방암 검진에 참석할 가능성이 낮은 것으로 나타났습니다. 결혼 여부와 사회적 박탈감을 고려하더라도 낮은 출석률은 그대로 유지되었습니다.[91][92]
규정
미국의 유방촬영 발견 시설과 그 영토(군사 기지 포함)는 유방촬영 품질 표준법(MQSA)의 적용을 받습니다. 이 법은 FDA 승인 기관을 통해 3년마다 매년 검사와 인증을 받아야 합니다. 검사 또는 인증 과정에서 결함이 발견된 시설은 교정 조치가 확인될 때까지 유방 촬영을 금지하거나, 극단적인 경우 과거 환자에게 검사가 기준에 미달하여 의존해서는 안 된다는 사실을 통지하도록 요구할 수 있습니다.[93]
이때 MQSA는 기존 유방 촬영에만 적용되며 유방 초음파, 정위 유방 생검 또는 유방 MRI와 같은 관련 스캔에는 적용되지 않습니다.
미국의 많은 주에서는 유방 조직 밀도가 높으면 유방 촬영이 정확하지 않다는 것을 알리기 위해 유방 밀도가 높은 여성에게 통지하도록 요구하고 있습니다. 2019년 미국 식품의약국(FDA)은 의사들이 유방조영술 외에 다른 영상 검사가 필요할 수 있음을 이 여성들에게 알리도록 하는 규정을 제안했습니다.[94]
대체검사방법
유방 촬영을 원하지 않는 환자에게는 MRI와 유방 컴퓨터 단층 촬영(유방 CT라고도 함)을 통해 통증 없는 대안을 제공합니다. 각각의 방법이 적합한지 여부는 임상 사진에 따라 다르며 의사가 결정합니다.[citation needed]
참고 항목
참고문헌
- ^ "Breast Cancer: Screening". United States Preventive Services Task Force. Archived from the original on 2016-01-15.
- ^ "Breast Cancer Early Detection". cancer.org. 2013-09-17. Archived from the original on 10 August 2014. Retrieved 29 July 2014.
- ^ a b Tonelli M, Connor Gorber S, Joffres M, Dickinson J, Singh H, Lewin G, et al. (Canadian Task Force on Preventive Health Care) (November 2011). "Recommendations on screening for breast cancer in average-risk women aged 40–74 years". CMAJ. 183 (17): 1991–2001. doi:10.1503/cmaj.110334. PMC 3225421. PMID 22106103.
- ^ "Cancer screening: Breast". European Cancer Observatory. Archived from the original on 2012-02-11.
- ^ "Final Recommendation Statement: Breast Cancer: Screening". US Preventive Services Task Force. January 2016. Archived from the original on 13 May 2017. Retrieved 31 May 2017.
- ^ Friedenson B (March 2000). "Is mammography indicated for women with defective BRCA genes? Implications of recent scientific advances for the diagnosis, treatment, and prevention of hereditary breast cancer". MedGenMed. 2 (1): E9. PMID 11104455. Archived from the original on 2001-11-21.
- ^ American Society of Plastic Surgeons (24 April 2014), "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, American Society of Plastic Surgeons, archived from the original on 19 July 2014, retrieved 25 July 2014
- ^ a b c Gøtzsche PC, Jørgensen KJ (June 2013). "Screening for breast cancer with mammography". The Cochrane Database of Systematic Reviews. 2013 (6): CD001877. doi:10.1002/14651858.CD001877.pub5. PMC 6464778. PMID 23737396.
- ^ a b c d "Mammography-leaflet; Screening for breast cancer with mammography" (PDF). Archived from the original (PDF) on 2012-09-05. Retrieved 2012-06-24.
- ^ Nass SJ, Henderson IC, et al. (Institute of Medicine (U.S.). Committee on Technologies for the Early Detection of Breast Cancer) (2001). Mammography and beyond: developing technologies for the early detection of breast cancer. National Academies Press. ISBN 978-0-309-07283-0.
- ^ a b Ingram A. "Breast Cancer Pioneer - Was the First Person to Use X-rays to Study Breast Cancer". Science Heroes. Archived from the original on February 15, 2020. Retrieved March 22, 2011.
- ^ Thomas A (2005). Classic papers in modern diagnostic radiology. Berlin: Springer. p. 540. ISBN 3-540-21927-7.
- ^ Warren SL (1930). "A Roentgenologic Study of the Breast". The American Journal of Roentgenology and Radium Therapy. 24: 113–124.
- ^ a b Gold 2005, p. 3 CITEREFGold (
- ^ "History of Cancer Detection 1851–1995". Emory University. Retrieved March 12, 2011.
- ^ a b 가드너, 커스틴 E. 조기 발견: 20세기 미국의 여성, 암, 인식 캠페인. U of North Carolina, 2006 p.179
- ^ Gold RH, Bassett LW, Widoff BE (November 1990). "Highlights from the history of mammography". Radiographics. 10 (6): 1111–1131. doi:10.1148/radiographics.10.6.2259767. PMID 2259767.
- ^ 메디치 DC, 마르텔 C. 의료 보건 물리학. 건강물리학회 2006 여름학교. 의학 물리학 출판사. ISBN 1930524315 pp.25
- ^ Skloot R (April 2001). "Taboo Organ" (PDF). University of Pittsburgh School of Medicine. 3 (2). Archived (PDF) from the original on 2016-03-03.
- ^ Lerner BH (2003). ""To see today with the eyes of tomorrow": A history of screening mammography". Canadian Bulletin of Medical History. 20 (2): 299–321. doi:10.3138/cbmh.20.2.299. PMID 14723235. S2CID 2080082.
- ^ Shapiro S, Strax P, Venet L (February 1966). "Evaluation of periodic breast cancer screening with mammography. Methodology and early observations". JAMA. 195 (9): 731–738. doi:10.1001/jama.1966.03100090065016. PMID 5951878.
- ^ "Clinical Artefacts" (PDF). International Atomic Energy Agency (IAEA). Archived from the original (PDF) on 29 August 2017. Retrieved 8 March 2022.
- ^ "Mammography Quality Scorecard". U.S. Food and Drug Administration. March 1, 2010. Archived from the original on 2007-04-03. Retrieved March 31, 2010.
- ^ "Mammography Frequently Asked Questions". American College of Radiology. January 8, 2007. Archived from the original on 2007-09-28. Retrieved April 9, 2007.
- ^ a b c Taylor P, Potts HW (April 2008). "Computer aids and human second reading as interventions in screening mammography: two systematic reviews to compare effects on cancer detection and recall rate" (PDF). European Journal of Cancer. 44 (6): 798–807. doi:10.1016/j.ejca.2008.02.016. PMID 18353630.
- ^ Taylor P, Champness J, Given-Wilson R, Johnston K, Potts H (February 2005). "Impact of computer-aided detection prompts on the sensitivity and specificity of screening mammography". Health Technology Assessment. 9 (6): iii, 1-iii, 58. doi:10.3310/hta9060. PMID 15717938.
- ^ Taylor CG, Champness J, Reddy M, Taylor P, Potts HW, Given-Wilson R (September 2003). "Reproducibility of prompts in computer-aided detection (CAD) of breast cancer". Clinical Radiology. 58 (9): 733–738. doi:10.1016/S0009-9260(03)00231-9. PMID 12943648.
- ^ Gilbert FJ, Astley SM, Gillan MG, Agbaje OF, Wallis MG, James J, et al. (October 2008). "Single reading with computer-aided detection for screening mammography". The New England Journal of Medicine. 359 (16): 1675–1684. doi:10.1056/nejmoa0803545. PMID 18832239.
- ^ a b c d "Digital Mammography – Mammography – Imaginis – The Women's Health & Wellness Resource Network". www.imaginis.com. Archived from the original on 30 January 2012. Retrieved 4 May 2018.
- ^ (ACR), Radiological Society of North America (RSNA) and American College of Radiology. "Mammography (Mammogram)". radiologyinfo.org. Archived from the original on 25 January 2018. Retrieved 4 May 2018.
- ^ "How To Perform An Ultrasound-Guided Breast Biopsy". www.theradiologyblog.com. Archived from the original on 18 February 2018. Retrieved 4 May 2018.
- ^ "Radiology – Weill Cornell Medicine". weillcornell.org. Archived from the original on 22 December 2017. Retrieved 4 May 2018.
- ^ a b c Sulik G (2010). Pink Ribbon Blues: How Breast Cancer Culture Undermines Women's Health. New York: Oxford University Press. pp. 193–195. ISBN 978-0-19-974045-1. OCLC 535493589.
- ^ a b "USPSTF recommendations on Screening for Breast Cancer". Archived from the original on 2013-01-02. Retrieved 2010-09-13.
- ^ "NASA Spinoffs" (PDF). National Aeronautics and Space Administration. Archived (PDF) from the original on 2010-11-25. Retrieved 2010-12-20.
- ^ Hodgson R, Heywang-Köbrunner SH, Harvey SC, Edwards M, Shaikh J, Arber M, Glanville J (June 2016). "Systematic review of 3D mammography for breast cancer screening". Breast. 27: 52–61. doi:10.1016/j.breast.2016.01.002. PMID 27212700.
- ^ Gilbert FJ, Tucker L, Young KC (February 2016). "Digital breast tomosynthesis (DBT): a review of the evidence for use as a screening tool". Clinical Radiology. 71 (2): 141–150. doi:10.1016/j.crad.2015.11.008. PMID 26707815.
- ^ Melnikow J, Fenton JJ, Whitlock EP, Miglioretti DL, Weyrich MS, Thompson JH, Shah K (February 2016). "Supplemental Screening for Breast Cancer in Women With Dense Breasts: A Systematic Review for the U.S. Preventive Services Task Force". Annals of Internal Medicine. 164 (4): 268–278. doi:10.7326/M15-1789. PMC 5100826. PMID 26757021.
- ^ Weigel S, Berkemeyer S, Girnus R, Sommer A, Lenzen H, Heindel W (May 2014). "Digital mammography screening with photon-counting technique: can a high diagnostic performance be realized at low mean glandular dose?". Radiology. 271 (2): 345–355. doi:10.1148/radiol.13131181. PMID 24495234.
- ^ Fredenberg E, Willsher P, Moa E, Dance DR, Young KC, Wallis MG (November 2018). "Measurement of breast-tissue x-ray attenuation by spectral imaging: fresh and fixed normal and malignant tissue". Physics in Medicine and Biology. 63 (23): 235003. arXiv:2101.02755. Bibcode:2018PMB....63w5003F. doi:10.1088/1361-6560/aaea83. PMID 30465547. S2CID 53717425.
- ^ Johansson H, von Tiedemann M, Erhard K, Heese H, Ding H, Molloi S, Fredenberg E (July 2017). "Breast-density measurement using photon-counting spectral mammography". Medical Physics. 44 (7): 3579–3593. Bibcode:2017MedPh..44.3579J. doi:10.1002/mp.12279. PMC 9560776. PMID 28421611.
- ^ Ding H, Molloi S (August 2012). "Quantification of breast density with spectral mammography based on a scanned multi-slit photon-counting detector: a feasibility study". Physics in Medicine and Biology. 57 (15): 4719–4738. Bibcode:2012PMB....57.4719D. doi:10.1088/0031-9155/57/15/4719. PMC 3478949. PMID 22771941.
- ^ Liu J, Page D, Nassif H, Shavlik J, Peissig P, McCarty C, et al. (2013). "Genetic variants improve breast cancer risk prediction on mammograms". AMIA ... Annual Symposium Proceedings. AMIA Symposium. 2013: 876–885. PMC 3900221. PMID 24551380.
- ^ Lord SJ, Lei W, Craft P, Cawson JN, Morris I, Walleser S, et al. (September 2007). "A systematic review of the effectiveness of magnetic resonance imaging (MRI) as an addition to mammography and ultrasound in screening young women at high risk of breast cancer". European Journal of Cancer. 43 (13): 1905–1917. doi:10.1016/j.ejca.2007.06.007. PMID 17681781.
- ^ Dahlstrom JE, Jain S, Sutton T, Sutton S (May 1996). "Diagnostic accuracy of stereotactic core biopsy in a mammographic breast cancer screening programme". Histopathology. 28 (5): 421–427. doi:10.1046/j.1365-2559.1996.332376.x. PMID 8735717. S2CID 7707679.
- ^ "Cancer of the Breast (Female) - Cancer Stat Facts". National Cancer Institute: Surveillance, Epidemiology, and End Results Program.
- ^ (오토 외)
- ^ Webb, Matthew L.; Cady, Blake; Michaelson, James S.; Bush, Devon M.; Calvillo, Katherina Zabicki; Kopans, Daniel B.; Smith, Barbara L. (2014). "A failure analysis of invasive breast cancer: Most deaths from disease occur in women not regularly screened". Cancer. 120 (18): 2839–2846. doi:10.1002/cncr.28199. PMID 24018987. S2CID 19236625.
- ^ Saadatmand, S.; Bretveld, R.; Siesling, S.; Tilanus-Linthorst, M. M. (2015). "Influence of tumour stage at breast cancer detection on survival in modern times: Population based study in 173,797 patients". BMJ (Clinical Research Ed.). 351: h4901. doi:10.1136/bmj.h4901. PMC 4595560. PMID 26442924.
- ^ Bleyer A, Baines C, Miller AB (April 2016). "Impact of screening mammography on breast cancer mortality". Int J Cancer. 138 (8): 2003–2012. doi:10.1002/ijc.29925. PMID 26562826. S2CID 9538123.
- ^ a b Corcos D, Bleyer A (January 2020). "Epidemiologic Signatures in Cancer". The New England Journal of Medicine. 382 (1): 96. doi:10.1056/NEJMc1914747. PMID 31875513. S2CID 209481963.
- ^ a b c d Ray, Kimberly M.; Joe, Bonnie N.; Freimanis, Rita I.; Sickles, Edward A.; Hendrick, R. Edward (2018). "Screening Mammography in Women 40–49 Years Old: Current Evidence". American Journal of Roentgenology. 210 (2): 264–270. doi:10.2214/AJR.17.18707. ISSN 0361-803X. PMID 29064760.
- ^ "American Cancer Society Guidelines for the Early Detection of Cancer". Archived from the original on 2011-06-13. Retrieved 2011-06-16.
- ^ Lee CH, Dershaw DD, Kopans D, Evans P, Monsees B, Monticciolo D, et al. (January 2010). "Breast cancer screening with imaging: recommendations from the Society of Breast Imaging and the ACR on the use of mammography, breast MRI, breast ultrasound, and other technologies for the detection of clinically occult breast cancer". Journal of the American College of Radiology. 7 (1): 18–27. doi:10.1016/j.jacr.2009.09.022. PMID 20129267. S2CID 31652981.
- ^ "Annual Mammograms Now Recommended for Women Beginning at Age 40". American Congress of Obstetricians and Gynecologists. Archived from the original on 2013-09-04. Retrieved 2013-09-11.
- ^ "Screening Mammograms: Questions and Answers". National Cancer Institute. May 2006. Archived from the original on 2007-04-15. Retrieved April 9, 2007.
- ^ Qaseem A, Snow V, Sherif K, Aronson M, Weiss KB, Owens DK (April 2007). "Screening mammography for women 40 to 49 years of age: a clinical practice guideline from the American College of Physicians". Annals of Internal Medicine. 146 (7): 511–515. doi:10.7326/0003-4819-146-7-200704030-00007. PMID 17404353. S2CID 9396768.
- ^ Sammons MB (November 2009). "New Mammogram Guidelines Spark Controversy". AOL Health. Archived from the original on 2009-11-22. Retrieved July 16, 2018.
- ^ Hendrick, R. Edward; Helvie, Mark A. (2011-02-01). "United States Preventive Services Task Force Screening Mammography Recommendations: Science Ignored". American Journal of Roentgenology. 196 (2): W112–W116. doi:10.2214/AJR.10.5609. ISSN 0361-803X. PMID 21257850.
- ^ Hendrick, R. Edward; Helvie, Mark A. (2011-02-01). "United States Preventive Services Task Force Screening Mammography Recommendations: Science Ignored". American Journal of Roentgenology. 196 (2): W112–W116. doi:10.2214/AJR.10.5609. ISSN 0361-803X. PMID 21257850.
- ^ Hellquist, B. N.; Duffy, S. W.; Abdsaleh, S.; Björneld, L.; Bordás, P.; Tabár, L.; Viták, B.; Zackrisson, S.; Nyström, L.; Jonsson, H. (2011). "Hellquist et al". Cancer. 117 (4): 714–722. doi:10.1002/cncr.25650. PMID 20882563. S2CID 42253031.
- ^ "Tabar et al". Radiology.
- ^ Webb, Matthew L.; Cady, Blake; Michaelson, James S.; Bush, Devon M.; Calvillo, Katherina Zabicki; Kopans, Daniel B.; Smith, Barbara L. (2014). "A failure analysis of invasive breast cancer: Most deaths from disease occur in women not regularly screened". Cancer. 120 (18): 2839–2846. doi:10.1002/cncr.28199. PMID 24018987. S2CID 19236625.
- ^ Biller-Andorno N, Jüni P (May 2014). "Abolishing mammography screening programs? A view from the Swiss Medical Board" (PDF). The New England Journal of Medicine. 370 (21): 1965–1967. doi:10.1056/NEJMp1401875. PMID 24738641.
- ^ Kolata G (11 February 2014). "Vast Study Casts Doubts on Value of Mammograms". The New York Times. Archived from the original on 30 May 2014. Retrieved 28 May 2014.
- ^ Pace LE, Keating NL (April 2014). "A systematic assessment of benefits and risks to guide breast cancer screening decisions". JAMA. 311 (13): 1327–1335. doi:10.1001/jama.2014.1398. PMID 24691608.
- ^ Mulcahy N (April 2, 2009). "Screening Mammography Benefits and Harms in Spotlight Again". Medscape. Archived from the original on April 13, 2015.
- ^ Newman DH (2008). Hippocrates' Shadow. Scibner. p. 193. ISBN 978-1-4165-5153-9.
- ^ Herdman R, Norton L, et al. (Institute of Medicine (US) Committee on New Approaches to Early Detection and Diagnosis of Breast Cancer) (4 May 2018). "Wrap-Up Session". National Academies Press (US). Archived from the original on 4 May 2018. Retrieved 4 May 2018 – via www.ncbi.nlm.nih.gov.
- ^ "Mammograms". National Cancer Institute. Archived from the original on 2014-12-17.
- ^ a b c d Welch HG, Frankel BA (December 12, 2011). "Likelihood that a woman with screen-detected breast cancer has had her "life saved" by that screening". Archives of Internal Medicine. 171 (22): 2043–2046. doi:10.1001/archinternmed.2011.476. PMID 22025097.
• 요약 표시: - ^ Nassif H, Page D, Ayvaci M, Shavlik J, Burnside ES (2010). "Uncovering age-specific invasive and DCIS breast cancer rules using inductive logic programming". Proceedings of the ACM international conference on Health informatics - IHI '10. pp. 76–82. doi:10.1145/1882992.1883005. ISBN 978-1-4503-0030-8. S2CID 2112731.
- ^ Ayvaci MU, Alagoz O, Chhatwal J, Munoz del Rio A, Sickles EA, Nassif H, et al. (August 2014). "Predicting invasive breast cancer versus DCIS in different age groups". BMC Cancer. 14 (1): 584. doi:10.1186/1471-2407-14-584. PMC 4138370. PMID 25112586.
- ^ Nelson HD, Fu R, Cantor A, Pappas M, Daeges M, Humphrey L (February 2016). "Effectiveness of Breast Cancer Screening: Systematic Review and Meta-analysis to Update the 2009 U.S. Preventive Services Task Force Recommendation". Annals of Internal Medicine. 164 (4): 244–255. doi:10.7326/M15-0969. PMID 26756588.
- ^ Brewer NT, Salz T, Lillie SE (April 2007). "Systematic review: the long-term effects of false-positive mammograms". Annals of Internal Medicine. 146 (7): 502–510. doi:10.7326/0003-4819-146-7-200704030-00006. PMID 17404352. S2CID 22260624.
- ^ de Gelder R, Heijnsdijk EA, van Ravesteyn NT, Fracheboud J, Draisma G, de Koning HJ (27 June 2011). "Interpreting overdiagnosis estimates in population-based mammography screening". Epidemiologic Reviews. 33 (1): 111–121. doi:10.1093/epirev/mxr009. PMC 3132806. PMID 21709144.
- ^ Jørgensen KJ, Gøtzsche PC (July 2009). "Overdiagnosis in publicly organised mammography screening programmes: systematic review of incidence trends". BMJ. 339: b2587. doi:10.1136/bmj.b2587. PMC 2714679. PMID 19589821.
- ^ Independent UK Panel on Breast Cancer Screening (November 2012). "The benefits and harms of breast cancer screening: an independent review". Lancet. 380 (9855): 1778–1786. doi:10.1016/S0140-6736(12)61611-0. PMID 23117178. S2CID 6857671.
- ^ Sickles EA (May 1991). "Periodic mammographic follow-up of probably benign lesions: results in 3,184 consecutive cases". Radiology. 179 (2): 463–468. doi:10.1148/radiology.179.2.2014293. PMID 2014293.
- ^ a b Feig, Stephen A.; Hendrick, R. Edward (1997–2001). "Radiation Risk From Screening Mammography of Women Aged 40-49 Years". JNCI Monographs. 1997 (22): 119–124. doi:10.1093/jncimono/1997.22.119. ISSN 1745-6614. PMID 9709287.
- ^ Feig SA, Hendrick RE (1997). "Radiation risk from screening mammography of women aged 40–49 years". Journal of the National Cancer Institute. Monographs. 1997 (22): 119–124. doi:10.1093/jncimono/1997.22.119. PMID 9709287.
- ^ Armstrong K, Moye E, Williams S, Berlin JA, Reynolds EE (April 2007). "Screening mammography in women 40 to 49 years of age: a systematic review for the American College of Physicians". Annals of Internal Medicine. 146 (7): 516–526. doi:10.7326/0003-4819-146-7-200704030-00008. PMID 17404354. S2CID 35208653.
- ^ Whelehan P, Evans A, Wells M, Macgillivray S (August 2013). "The effect of mammography pain on repeat participation in breast cancer screening: a systematic review". Breast. 22 (4): 389–394. doi:10.1016/j.breast.2013.03.003. PMID 23541681.
- ^ Miller D, Livingstone V, Herbison P (January 2008). "Interventions for relieving the pain and discomfort of screening mammography". The Cochrane Database of Systematic Reviews. 2009 (1): CD002942. doi:10.1002/14651858.cd002942.pub2. PMC 8989268. PMID 18254010.
- ^ Serwan E, Matthews D, Davies J, Chau M (September 2020). "Mammographic compression practices of force- and pressure-standardisation protocol: A scoping review". Journal of Medical Radiation Sciences. 67 (3): 233–242. doi:10.1002/jmrs.400. PMC 7476195. PMID 32420700.
- ^ "Cultural and language barriers need to be addressed for British-Pakistani women to benefit fully from breast screening". NIHR Evidence (Plain English summary). National Institute for Health and Care Research. 2020-09-15. doi:10.3310/alert_41135. S2CID 241324844.
- ^ Woof, Victoria G; Ruane, Helen; Ulph, Fiona; French, David P; Qureshi, Nadeem; Khan, Nasaim; Evans, D Gareth; Donnelly, Louise S (2019-12-02). "Engagement barriers and service inequities in the NHS Breast Screening Programme: Views from British-Pakistani women". Journal of Medical Screening. 27 (3): 130–137. doi:10.1177/0969141319887405. ISSN 0969-1413. PMC 7645618. PMID 31791172.
- ^ Woof, Victoria G.; Ruane, Helen; French, David P.; Ulph, Fiona; Qureshi, Nadeem; Khan, Nasaim; Evans, D. Gareth; Donnelly, Louise S. (2020-05-20). "The introduction of risk stratified screening into the NHS breast screening Programme: views from British-Pakistani women". BMC Cancer. 20 (1): 452. doi:10.1186/s12885-020-06959-2. ISSN 1471-2407. PMC 7240981. PMID 32434564.
- ^ "Cancer screening across the world is failing people with mental illness". NIHR Evidence (Plain English summary). National Institute for Health and Care Research. 2020-05-19. doi:10.3310/alert_40317. S2CID 243581455.
- ^ Solmi, Marco; Firth, Joseph; Miola, Alessandro; Fornaro, Michele; Frison, Elisabetta; Fusar-Poli, Paolo; Dragioti, Elena; Shin, Jae Il; Carvalho, Andrè F; Stubbs, Brendon; Koyanagi, Ai (28 November 2019). "Disparities in cancer screening in people with mental illness across the world versus the general population: prevalence and comparative meta-analysis including 4 717 839 people". The Lancet Psychiatry. 7 (1): 52–63. doi:10.1016/S2215-0366(19)30414-6. PMID 31787585. S2CID 208535709.
- ^ "Breast cancer screening: women with poor mental health are less likely to attend appointments". NIHR Evidence (Plain English summary). National Institute for Health and Care Research. 2021-06-21. doi:10.3310/alert_46400. S2CID 241919707.
- ^ Ross, Emma; Maguire, Aideen; Donnelly, Michael; Mairs, Adrian; Hall, Clare; O'Reilly, Dermot (2020-06-01). "Does poor mental health explain socio-demographic gradients in breast cancer screening uptake? A population-based study". European Journal of Public Health. 30 (3): 538–543. doi:10.1093/eurpub/ckz220. ISSN 1101-1262. PMID 31834366.
- ^ Center for Devices and Radiological Health. "Facility Certification and Inspection (MQSA) – Mammography Safety Notifications". www.fda.gov. Retrieved 2019-04-18.
- ^ LaVito A (2019-03-27). "FDA proposes rule to notify women with dense breasts about increased cancer risk and imprecise mammograms". CNBC. Retrieved 2019-03-27.
더보기
- Reynolds H (2012). The Big Squeeze: A Social and Political History of the Controversial Mammogram. Ithaca: ILR Press/Cornell University Press. p. 128. ISBN 978-0-8014-5093-8.
외부 링크
| 라이브러리 리소스 정보 유방촬영술 |


