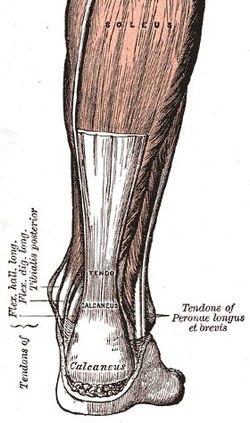
힘줄
Tendon| 힘줄 | |
|---|---|
 | |
 | |
| 세부 사항 | |
| 식별자 | |
| 라틴어 | 텐도 |
| 메쉬 | D013710 |
| TH | H3.03.00.00020 |
| FMA | 9721 |
| 해부학 용어 | |
힘줄 또는 힘줄은 근육과 뼈를 연결하는 고밀도 섬유 결합조직의 견고하고 고강도 밴드입니다.상당한 양의 긴장을 견뎌내는 능력을 희생하지 않고 근육 수축의 기계적 힘을 골격 시스템에 효율적으로 전달할 수 있습니다.
힘줄은 인대와 비슷하다; 둘 다 콜라겐으로 이루어져 있다.인대는 하나의 뼈를 다른 뼈와 연결하는 반면 힘줄은 근육과 뼈를 연결합니다.
구조.
조직학적으로 힘줄은 조밀한 규칙적인 결합 조직으로 구성되어 있다.힘줄의 주요 세포 구성 요소는 힘줄 세포라고 불리는 특별한 섬유아세포입니다.10구들은 촘촘하게 채워진 콜라겐 섬유에 풍부한 힘줄의 세포외 기질을 합성한다.콜라겐 섬유는 서로 평행하며 힘줄 파시클을 형성합니다.각각의 파시클은 얇은 콜라겐 섬유와[1][2] 탄성 [3]섬유로 이루어진 섬세하고 느슨한 결합 조직인 내막에 의해 결합됩니다.파시클 그룹은 고밀도 불규칙 결합조직의 피복인 에피테논에 의해 경계된다.힘줄 전체가 근막으로 둘러싸여 있다.근막과 힘줄 조직 사이의 공간은 지방 유륜 [4]조직인 파라테논으로 채워져 있다.정상적인 건강한 힘줄은 샤피의 섬유에 의해 뼈에 고정된다.
세포외 매트릭스
총 질량의 30-45%를 차지하는 정상 힘줄의 건조 질량은 다음과 같이 구성됩니다.
- 콜라겐 60~85%
- 60~80% 콜라겐 I
- 0~10% 콜라겐 III
- 콜라겐 2 % IV
- 소량의 콜라겐 V, VI 및 기타
- 다음을 포함한 15~40% 비연속 세포외 매트릭스 구성 요소:
I형 콜라겐이 힘줄의 콜라겐의 대부분을 차지하고 있지만, 많은 작은 콜라겐들이 적절한 힘줄의 발달과 기능에 중요한 역할을 합니다.여기에는 연골부의 II형 콜라겐, 혈관벽의 레티쿨린 섬유의 III형 콜라겐, IX형 콜라겐, 모세혈관의 기저막의 IV형 콜라겐, 혈관벽의 V형 콜라겐, [5][9]뼈와의 경계면 부근의 미네랄화 섬유사원의 X형 콜라겐이 포함됩니다.
초미세구조 및 콜라겐 합성
콜라겐 섬유는 거시응집체로 합쳐진다.프로콜라겐 N단백질 및 C단백질 분해효소에 의해 분해된 세포에서 분비된 후 트로포콜라겐 분자는 자발적으로 불용성 섬유화된다.콜라겐 분자는 길이 약 300nm, 폭 1~2nm이며 형성되는 섬유소의 직경은 50~500nm이다.힘줄에서 섬유섬유는 더 모여 파시클을 형성한다. 파시클은 길이 약 10mm, 직경 50–300μm,[10] 직경 100–500μm의 힘줄 섬유로 형성된다.
힘줄의 콜라겐은 데코신을 포함한 프로테오글리칸(특히 결합조직에 존재하는 글리코사미노글리칸 그룹에 결합된 단백질로 구성된 화합물) 성분과 함께 유지되며, 힘줄의 압축 영역에서는 특정 [11]위치에서 콜라겐 섬유와 결합할 수 있는 아그레칸이 포함된다.프로테오글리칸은 콜라겐 섬유와 결합되어 있으며, 글리코사미노글리칸(GAG) 측쇄는 섬유소의 표면과 여러 가지 상호작용을 하며, 이는 프로테오글리칸이 구조적으로 섬유소의 상호 [12]연결에서 중요하다는 것을 보여준다.힘줄의 주요 GAG 구성 요소는 피부암 황산염과 콘드로이틴 황산염으로, 콜라겐과 결합하고 힘줄 발달 과정에서 섬유 조립 과정에 관여합니다.데마난 황산은 섬유소 사이의 결합을 형성하는 데 책임이 있는 것으로 생각되며 콘드로이틴 황산은 섬유소 사이의 부피를 차지하는 데 더 관여하여 섬유소를 분리시키고 [13]변형에 견디는 데 도움을 주는 것으로 생각됩니다.데코린 골재의 황산피부 측쇄는 용액에 포함되어 있으며, 이 작용은 콜라겐 섬유의 조립에 도움이 될 수 있습니다.데커린 분자가 콜라겐 섬유에 결합할 때, 그들의 피부 황산염 사슬은 연장되고 분리된 섬유에 결합되는 데커린 위의 다른 피부 황산염 사슬과 결합할 수 있으며, 따라서 섬유간 브릿지를 만들고 결국 섬유소의 [14]평행 정렬을 야기합니다.
십구
10구들은 콜라겐 분자를 생성하는데, 콜라겐 분자는 끝에서 끝까지 그리고 옆으로 모여 콜라겐 섬유를 생성한다.섬유다발은 가늘고 긴 10구 사이에 밀착된 섬유로 구성되어 있다.힘줄에는 콜라겐과 관련된 세포 과정의 3차원 네트워크가 있다.셀은 갭 접합을 통해 서로 통신하며, 이 신호는 셀에게 기계적 [15]부하를 감지하고 응답할 수 있는 능력을 제공합니다.이러한 의사소통은 기본적으로 두 가지 단백질에 의해 일어난다: 세포 과정이 만나는 곳에 존재하는 connexin 43과 세포체 connexin 32는 과정이 [16]만나는 곳에만 나타난다.
혈관은 콜라겐 섬유와 평행하게 달리는 내막 내에서 시각화할 수 있으며, 간혹 분기 횡단 문합이 있을 수 있다.
내부 힘줄 부피는 신경섬유가 없는 것으로 생각되지만 에피테논과 파라테논은 신경 말단을 포함하고 골지 힘줄 장기는 힘줄과 근육 사이의 근연 접합부에 존재한다.
힘줄의 길이는 모든 주요 집단과 사람에 따라 다르다.실제로 힘줄 길이는 실제 및 잠재적 근육 크기와 관련된 결정적 요소이다.예를 들어, 다른 모든 관련 생물학적 요인이 동일하다면, 힘줄이 짧고 이두근 근육이 긴 사람은 힘줄이 길고 근육이 짧은 사람보다 근육량의 잠재력이 더 클 것이다.성공적인 보디빌더들은 일반적으로 힘줄이 짧아질 것이다.반대로 달리기나 점프 등의 동작을 잘하는 스포츠에서는 아킬레스건이 평균보다 길고 종아리 [17]근육이 짧은 것이 좋다.
힘줄 길이는 유전적 성향에 따라 결정되며, 외상에 의해 단축될 수 있는 근육과 달리 환경에 따라 증가하거나 감소하는 것으로는 나타나지 않았다. 불균형, 회복과 [18]스트레칭의 부족에 의해 단축될 수 있다.게다가 힘줄은 근육들이 손목 [16]터널처럼 공간이 중요한 지역을 통과하면서 활발하게 움직이는 부위에서 최적의 거리에 있도록 한다.
기능들
전통적으로 힘줄은 근육 자체뿐만 아니라 뼈와도 연결되어 힘을 전달하는 기능을 하는 메커니즘으로 여겨져 왔다.이 연결을 통해 힘줄은 이동 중에 수동적으로 힘을 조절하여 활성 작업 없이 추가적인 안정성을 제공합니다.하지만, 지난 20년 동안, 많은 연구가 일부 힘줄의 탄력적인 특성과 스프링의 기능을 하는 능력에 초점을 맞췄다.모든 힘줄이 동일한 기능적 역할을 수행할 필요가 있는 것은 아니며, 글씨를 쓸 때 손가락(위치 힘줄)과 같이 주로 사지를 배치하고 다른 힘줄은 보다 효율적인 이동을 위해 스프링 역할을 한다(에너지 저장 힘줄).[19]에너지 저장 힘줄은 높은 효율로 에너지를 저장하고 회수할 수 있습니다.예를 들어, 사람의 보폭에서, 아킬레스건은 발목 관절이 등뼈에 닿을 때 늘어난다.보폭의 마지막 부분 동안, 발바닥이 구부러지면서(발가락을 아래로 향하면서) 저장된 탄성 에너지가 방출됩니다.또한 힘줄이 늘어나기 때문에 근육은 길이의 변화가 적거나 전혀 없이 기능할 수 있어 근육이 더 많은 힘을 발생시킬 수 있다.
힘줄의 기계적 특성은 콜라겐 섬유 직경과 방향에 따라 달라집니다.콜라겐 섬유는 서로 평행하고 촘촘히 채워져 있지만, 수 마이크로미터의 [20]눈금으로 평면의 기복 또는 크림프(crimp)로 인해 물결처럼 보입니다.힘줄에서 콜라겐 섬유는 아미노산 배열의 특정 위치에 히드록시프롤린 및 프롤린 잔류물이 없기 때문에 어느 정도 유연성이 있으며, 이로 인해 삼중나선의 굴곡 또는 내부 루프와 같은 다른 형태를 형성할 수 있으며 크림프가 [21]발생한다.콜라겐 섬유에 있는 크림프(crimp)를 통해 힘줄에 약간의 유연성과 낮은 압축 강성이 부여됩니다.또한 힘줄은 다수의 부분적으로 독립된 섬유소 및 파시클로 이루어진 다가닥 구조이기 때문에 단일 막대로 동작하지 않으며 [22]이 특성도 유연성에 기여한다.
힘줄의 프로테오글리칸 성분 또한 기계적 특성에 중요하다.콜라겐 섬유는 힘줄이 인장 응력에 저항할 수 있도록 하는 반면, 프로테오글리칸은 힘줄이 압축 응력에 저항할 수 있도록 해줍니다.이 분자들은 매우 친수성이어서 많은 양의 물을 흡수할 수 있고 따라서 높은 팽창 비율을 가지고 있습니다.이들은 섬유에 비공유적으로 결합되어 있기 때문에 섬유 사이의 브릿지가 끊어지고 재형성될 수 있도록 가역적으로 결합 및 분리될 수 있습니다.이 과정은 [23]장력 하에서 섬유소가 늘어나거나 직경이 감소하도록 하는 데 관여할 수 있다.그러나 프로테오글리칸은 힘줄의 인장 특성에도 역할을 할 수 있다.힘줄의 구조는 일련의 계층적 레벨로 구축된 섬유 복합 재료입니다.각 계층 수준에서 콜라겐 단위는 콜라겐 가교 또는 프로테오글리칸 중 하나에 의해 결합되어 [24]인장하중에 대한 내성이 높은 구조를 형성한다.콜라겐 섬유만의 신장 및 변형은 동일한 응력 하에서 전체 힘줄의 총 신장 및 변형보다 훨씬 낮은 것으로 나타나 프로테오글리칸이 풍부한 매트릭스도 변형을 겪어야 하며 매트릭스의 경직은 높은 변형률로 [25]발생한다.이러한 비콜라겐 매트릭스의 변형은 힘줄 계층의 모든 수준에서 발생하며, 이 매트릭스의 조직과 구조를 조절함으로써 다른 힘줄에 의해 요구되는 다양한 기계적 특성을 달성할 [26]수 있다.에너지 저장 힘줄은 필요한 높은 변형률 특성을 가능하게 하기 위해 파시클 사이에서 상당한 양의 슬라이딩을 사용하는 것으로 나타났으며, 위치 힘줄은 콜라겐 섬유와 섬유 [27]사이에서 슬라이딩에 더 많이 의존합니다.그러나 최근 데이터에 따르면 에너지 저장 힘줄에는 본질적으로 꼬여 있거나 나선형인 파시클도 포함될 수 있다. 이는 이러한 [28]힘줄에 필요한 스프링과 같은 행동을 제공하는 데 매우 유익한 배열이다.
메카닉스
힘줄은 점탄성 구조이며, 이는 그들이 탄성과 점성을 모두 보인다는 것을 의미합니다.힘줄은 늘어나면 전형적인 "부드러운 조직" 행동을 보인다.힘-연장 또는 응력-변형 곡선은 크림프 구조가 곧고 콜라겐 섬유가 힘줄 섬유에서 음의 포아송 비율을 나타내면서 매우 낮은 강성 영역에서 시작합니다.보다 최근에 생체 내(MRI를 통해) 및 생체 외(다양한 사체 힘줄 조직의 기계적 테스트를 통해) 수행된 테스트에서 건강한 힘줄은 길이에 따라 최대 2%까지 늘렸을 때 일부 평면에서 비등방성이 높으며, 정상적인 운동 [29]범위 내에서 음의 포아송 비율(auxetic)을 나타낸다.이 '토우' 영역 이후에는 구조가 상당히 단단해지고, 붕괴되기 시작할 때까지 선형 응력-변형 곡선이 생깁니다.힘줄의 기계적 특성은 힘줄의 기능적 요구 사항과 일치하기 때문에 매우 다양하다.에너지를 저장하는 힘줄은 더 탄력적이거나 덜 단단해서 에너지를 더 쉽게 저장할 수 있는 경향이 있는 반면, 더 단단한 위치 힘줄은 약간 점탄성이 더 높고 덜 탄력적이기 때문에 더 세밀하게 움직임을 제어할 수 있습니다.일반적인 에너지 저장 힘줄은 약 12-15%의 변형률과 100-150MPa 영역의 응력에서 기능하지 않지만, 일부 힘줄은 이보다 확장이 더 용이하지만, 예를 들어,[30] 달리기를 할 때 20% 이상 늘어나는 말의 표면 디지털 굴곡부위가 있다.위치 힘줄은 6-8%의 낮은 균주에서는 실패할 수 있지만 700-1000MPa의 [31]영역에서는 모듈리를 가질 수 있습니다.
여러 연구에서 힘줄은 뼈와 마찬가지로 성장과 리모델링 과정을 통해 기계적 하중의 변화에 반응한다는 것이 입증되었습니다.특히 쥐에게 아킬레스건을 사용하지 않으면 [32]힘줄을 구성하는 콜라겐 섬유 다발의 평균 두께가 감소하는 것으로 나타났다.사람의 경우, 실험 대상자가 회복 [33]운동을 수행해야 할 때에도, 시뮬레이션된 미세 중력 환경에 노출되는 실험에서 힘줄 강성이 유의하게 감소하는 것을 발견했다.이러한 효과는 병상에 누워 있는 환자의 치료에서부터 우주 비행사를 위한 보다 효과적인 운동 설계에 이르기까지 다양한 분야에 영향을 미칩니다.
힐링
발의 힘줄은 매우 복잡하고 복잡하다.따라서 힘줄이 부러진 후 회복되는 과정은 길고 고통스럽다.부상 후 48시간 이내에 치료를 받지 못하는 대부분의 사람들은 심각한 붓기, 통증, 그리고 부상이 발생한 곳의 타는 듯한 느낌에 시달릴 것이다.
힘줄은 매트릭스 회전을 겪을 수 없고 10구도 회복할 수 없다고 여겨졌다.그러나, 그 후 사람의 일생 동안, 매트릭스 메탈로프로테아제(MMPs)와 같은 효소뿐만 아니라 매트릭스 성분을 능동적으로 합성하는 힘줄의 10구들이 매트릭스를 [34]분해할 수 있다는 것이 밝혀졌다.힘줄은 10구 및 그 주변의 세포외 기질에 의해 제어되는 과정에서 상처를 치유하고 회복할 수 있다.
힘줄 치유의 세 가지 주요 단계는 염증, 복구 또는 증식, 리모델링이며, 이것은 더 나아가 결합과 성숙으로 나눌 수 있다.이러한 단계는 서로 겹칠 수 있습니다.제1단계에서는 적혈구와 함께 호중구 등의 염증세포를 손상부위로 모집한다.단구 및 대식세포는 최초 24시간 이내에 모집되며, 손상 부위의 괴사물질의 식세포증이 발생한다.혈관활성인자 및 화학작용인자 방출 후 혈관신생과 10구 증식이 개시된다.그리고 나서 10구들이 그 부위로 이동하여 콜라겐 [35][36]III를 합성하기 시작한다.며칠 후, 복구 또는 증식 단계가 시작됩니다.이 단계에서 10구들은 부상 부위에서 다량의 콜라겐과 프로테오글리칸의 합성에 관여하며 GAG와 물의 수치가 높다.[37]약 6주 후, 리모델링 단계가 시작됩니다.이 단계의 첫 번째 단계는 통합으로, 부상 후 약 6주에서 10주 동안 지속됩니다.이 사이 콜라겐 I의 생성 증가에 의해 조직이 섬유화 되어 기계적 [36]응력 방향으로 섬유화됨에 따라 콜라겐과 GAG의 합성이 저하되고 세포성도 저하된다.최종 성숙 단계는 10주 후에 이루어지며, 이 기간 동안 콜라겐 섬유 가교량이 증가하여 조직이 더 단단해집니다.1년 정도 지나면 서서히 섬유질에서 흉터 모양으로 [37]변하게 됩니다.
MMP(Matrix Metaloproteinase)는 힘줄 손상 후 치유 과정 동안 ECM의 분해 및 리모델링에 매우 중요한 역할을 합니다.MMP-1, MMP-2, MMP-8, MMP-13, MMP-14를 포함한 특정 MMP는 콜라게나아제 활성을 가지며, 이는 다른 많은 효소들과 달리 콜라겐I 섬유를 분해할 수 있음을 의미한다.변성 콜라겐의 존재와 함께 MMP-1에 의한 콜라겐 섬유소의 분해는 힘줄 ECM의 약화 및 [38]또 다른 파열 가능성을 증가시키는 것으로 생각되는 요인이다.반복적인 기계적 부하 또는 부상에 반응하여 사이토카인은 십구(tenocyte)에 의해 방출될 수 있으며 MMP의 방출을 유도하여 ECM의 열화를 초래하고 반복적인 부상 및 만성 건병증으로 [36]이어질 수 있습니다.
다양한 다른 분자들이 힘줄 복구와 재생에 관여한다.힘줄 치료 중에 유의하게 상향 조절되고 활성화된 것으로 나타난 다섯 가지 성장 인자가 있다: 인슐린 유사 성장 인자 1(IGF-I), 혈소판 유래 성장 인자(PDGF), 혈관 내피 성장 인자(VEGF), 기본 섬유아세포 성장 인자(BFGF) 및 변환 성장 인자 베타(β-GF)[37]이다.이러한 성장 인자는 모두 치유 과정에서 서로 다른 역할을 합니다.IGF-1은 염증 첫 단계에서 콜라겐과 프로테오글리칸 생성을 증가시키고, 부상 후 초기 단계에서 PDGF가 존재하며, DNA 합성 및 힘줄 세포의 [37]증식과 함께 다른 성장 인자의 합성을 촉진한다.TGF-β의 3가지 동질 형태(TGF-β1, TGF-β2, TGF-β3)는 상처 치유와 흉터 [39]형성에 역할을 하는 것으로 알려져 있다.VEGF고 내피 세포 확산과 이동을 유도하기 위해 혈관 신생을 촉진하였고, VEGF mRNA힘줄 부상 현장에서 콜라겐과 함께 표현할 것을 보여 줘 알려졌다 나는 mRNA.[40]뼈 형성 TGF-β의 뼈와 연골 형성뿐만 아니라 조직 diffe하도록 유도할 수 있(BMP상품)은 하위 그룹 상과 단백질.콩팥특히 BMP-12는 힘줄 조직의 형성과 분화에 영향을 미치고 섬유발생을 촉진하는 것으로 나타났다.
활동이 치유에 미치는 영향
동물 모델에서, 힘줄 손상과 치유에 대한 활동 수준의 기계적 변형 효과를 조사하기 위해 광범위한 연구가 수행되었습니다.스트레칭은 초기 염증 단계에서 치료를 방해할 수 있지만, 급성 부상 후 약 1주일 후 힘줄의 조절된 움직임은 10구별 콜라겐 합성을 촉진하는 데 도움이 될 수 있으며, 이로 인해 치유된 힘줄의 인장 강도와 직경이 증가하며 힘줄보다 유착이 적은 것으로 나타났다.고정화 되어 있다.만성 힘줄 부상의 경우, 기계적 하중은 또한 섬유아세포의 증식과 콜라겐 합성을 촉진하고 콜라겐 재배열을 촉진하는 것으로 나타났으며, 이 모든 것은 복구와 리모델링을 [37]촉진한다.운동과 활동이 힘줄 치유에 도움이 된다는 이론을 더욱 뒷받침하기 위해, 부상 후 힘줄의 고정화는 종종 치유에 부정적인 영향을 미치는 것으로 나타났다.토끼의 경우 고정화된 콜라겐 파시클은 인장 강도가 저하되고, 고정화되면 힘줄의 수분,[35] 프로테오글리칸, 콜라겐 가교량도 감소한다.
유전자 발현, 단백질 합성 및 세포 표현형을 변화시키고 최종적으로 힘줄 구조의 변화를 일으키는 기계적 힘에 대한 10구 반응의 이유로 여러 가지 기계적 전달 메커니즘이 제시되었다.주요 인자는 액틴 세포골격에 영향을 미칠 수 있고 따라서 세포 형태, 운동성 및 기능에 영향을 미칠 수 있는 세포외 기질의 기계적 변형이다.기계적 힘은 초점 접착 부위, 인테그린 및 세포 세포 접합에 의해 전달될 수 있습니다.액틴 세포골격의 변화는 세포와 매트릭스 사이의 "외부"와 "내부" 신호를 매개하는 인테그린을 활성화할 수 있습니다.세포내 시그널링 캐스케이드를 유도하는 G단백질도 중요할 수 있으며 칼슘, 나트륨, 칼륨 등의 이온이 세포 [37]내로 들어오도록 신장함으로써 이온 채널을 활성화한다.
사회와 문화
Sinew는 산업화 이전 시대에 견고하고 내구성이 뛰어난 섬유로 널리 사용되었습니다.특정 용도에는 봉제용 실 사용, 화살에 깃털 부착(플렛치 참조), 공구 블레이드를 축에 묶는 등이 있습니다.서바이벌 가이드에서도 트랩이나 생활 구조물에 강한 끈을 만들 수 있는 소재로 추천되고 있습니다.힘줄은 이러한 목적을 위해 유용하게 기능하기 위해 특정한 방법으로 치료되어야 한다.이누이트와 다른 극지방 사람들은 생태 서식지에 적합한 섬유원이 없기 때문에 모든 국내의 목적을 위한 유일한 끈으로 사인줄을 사용했다.특정 사인류의 탄성 특성은 유라시아 스텝 유목민과 아메리카 원주민들이 선호하는 복합 굴곡 활에도 사용되었다.최초의 돌 던지기 포는 또한 힘줄의 탄성 특성을 사용했다.
Sinew는 다음과 같은 세 가지 이유로 우수한 코드 소재를 만듭니다.매우 강하고 천연 접착제를 함유하고 있으며, 건조함에 따라 줄어들기 때문에 매듭이 필요 없습니다.
요리의 용도
힘줄(특히 쇠고기 힘줄)은 일부 아시아 요리의 음식으로 사용된다.인기 있는 요리 중 하나는 힘줄을 마늘에 재운 수안바오니우진입니다.베트남 국수 요리 phở에서도 가끔 볼 수 있다.
임상적 의의
부상
힘줄은 많은 종류의 부상을 입기 쉽다.과도한 사용으로 인한 건병이나 힘줄 손상에는 다양한 형태가 있다.이러한 유형의 부상은 일반적으로 염증, 변성 또는 힘줄의 약화를 초래하며, 이는 결국 힘줄 [35]파열로 이어질 수 있다.건병증은 힘줄 세포외 매트릭스(ECM)와 관련된 여러 요인에 의해 발생할 수 있으며, 증상 및 조직병리학이 종종 유사하기 때문에 분류가 어려웠다.
건병증의 첫 번째 범주는 부전염으로, 건과 그 칼집 사이에 위치한 부전 시트의 염증을 말한다.건염은 세포 수준에서 힘줄에 대한 비염증성 손상을 말한다.열화는 콜라겐, 세포, 힘줄의 혈관 성분의 손상으로 인해 발생하며 [41]파열로 이어지는 것으로 알려져 있다.자발적 파열을 거친 힘줄의 관찰 결과, 원형 10구, 다른 세포 이상,[35] 혈관의 침윤과 함께 올바른 평행 방향이 아니거나 길이나 직경이 균일하지 않은 콜라겐 섬유의 존재가 확인되었다.파열로 이어지지 않은 다른 형태의 건염도 [36]섬유소 사이의 글리코사미노글리칸의 양과 함께 콜라겐 섬유소의 변성, 방향감퇴 및 얇아짐을 보여 왔다.세 번째는 건염이 있는 부전염으로 부전염과 건변성의 조합이 모두 존재한다.마지막은 건염으로 힘줄에 염증이 생기거나 혈관 [5]장애가 생기면서 퇴화된다.
건병증은 나이, 체중, 영양을 포함한 몇 가지 본질적인 요인에 의해 발생할 수 있다.외인성 요인은 종종 스포츠와 관련이 있으며 과도한 힘이나 하중, 열악한 훈련 기술 및 환경 [34]조건을 포함합니다.
기타 동물
몇몇 유기체, 특히 [42]조류와 조류 공룡에서는 [43]힘줄의 일부가 골화 될 수 있다.이 과정에서 골세포가 힘줄에 침투해 슬개골과 같은 세사모이드 뼈에서처럼 뼈를 눕힌다.조류에서 힘줄 골화는 주로 뒷다리에서 일어나는 반면, 조류 공룡에서, 골화된 축근 힘줄은 아마도 지탱을 위해 꼬리의 신경과 혈흔을 따라 격자 구조를 형성합니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Dorlands 의학사전, 602쪽
- ^ Caldini, E. G.; Caldini, N.; De-Pasquale, V.; Strocchi, R.; Guizzardi, S.; Ruggeri, A.; Montes, G. S. (1990). "Distribution of elastic system fibres in the rat tail tendon and its associated sheaths". Cells Tissues Organs. 139 (4): 341–348. doi:10.1159/000147022. PMID 1706129.
- ^ Grant, T. M.; Thompson, M. S.; Urban, J.; Yu, J. (2013). "Elastic fibres are broadly distributed in tendon and highly localized around tenocytes". Journal of Anatomy. 222 (6): 573–579. doi:10.1111/joa.12048. PMC 3666236. PMID 23587025.
- ^ Dorlands Medical Dorlands 의학사전1382 페이지
- ^ a b c Jozsa, L. 및 Kannus, P., Human Tendons:해부학, 생리학, 병리학.휴먼 키네틱스:샴페인, IL, 1997년
- ^ Lin, T. W.; Cardenas, L.; Soslowsky, L. J. (2004). "Biomechanics of tendon injury and repair". Journal of Biomechanics. 37 (6): 865–877. doi:10.1016/j.jbiomech.2003.11.005. PMID 15111074.
- ^ Kjær, Michael (April 2004). "Role of Extracellular Matrix in Adaptation of Tendon and Skeletal Muscle to Mechanical Loading". Physiological Reviews. 84 (2): 649–698. doi:10.1152/physrev.00031.2003. ISSN 0031-9333. PMID 15044685.
- ^ Taye, Nandaraj; Karoulias, Stylianos Z.; Hubmacher, Dirk (January 2020). "The "other" 15–40%: The Role of Non‐Collagenous Extracellular Matrix Proteins and Minor Collagens in Tendon". Journal of Orthopaedic Research. 38 (1): 23–35. doi:10.1002/jor.24440. ISSN 0736-0266. PMC 6917864. PMID 31410892.
- ^ Fukuta, S.; Oyama, M.; Kavalkovich, K.; Fu, F. H.; Niyibizi, C. (1998). "Identification of types II, IX and X collagens at the insertion site of the bovine achilles tendon". Matrix Biology. 17 (1): 65–73. doi:10.1016/S0945-053X(98)90125-1. PMID 9628253.
- ^ Fratzl, P. (2009). "Cellulose and collagen: from fibres to tissues". Current Opinion in Colloid & Interface Science. 8 (1): 32–39. doi:10.1016/S1359-0294(03)00011-6.
- ^ Zhang, G. E., Y.; Chervoneva, I.; Robinson, P. S.; Beason, D. P.; Carine, E. T.; Soslowsky, L. J.; Iozzo, R. V.; Birk, D. E. (2006). "Decorin regulates assembly of collagen fibrils and acquisition of biomechanical properties during tendon development". Journal of Cellular Biochemistry. 98 (6): 1436–1449. doi:10.1002/jcb.20776. PMID 16518859. S2CID 39384363.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Raspanti, M.; Congiu, T.; Guizzardi, S. (2002). "Structural Aspects of the Extracellular Matrix of the Tendon : An Atomic Force and Scanning Electron Microscopy Study". Archives of Histology and Cytology. 65 (1): 37–43. doi:10.1679/aohc.65.37. PMID 12002609.
- ^ Scott, J. E. O., C. R.; Hughes, E. W. (1981). "Proteoglycan-collagen arrangements in developing rat tail tendon. An electron microscopical and biochemical investigation". Biochemical Journal. 195 (3): 573–581. doi:10.1042/bj1950573. PMC 1162928. PMID 6459082.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Scott, J. E. (2003). "Elasticity in extracellular matrix 'shape modules' of tendon, cartilage, etc. A sliding proteoglycan-filament model". Journal of Physiology. 553 (2): 335–343. doi:10.1113/jphysiol.2003.050179. PMC 2343561. PMID 12923209.
- ^ McNeilly, C. M.; Banes, A. J.; Benjamin, M.; Ralphs, J. R. (1996). "Tendon cells in vivo form a three dimensional network of cell processes linked by gap junctions". Journal of Anatomy. 189 (Pt 3): 593–600. PMC 1167702. PMID 8982835.
- ^ a b Benjamin, M., Tendons and ligaments - an overview (PDF), vol. 1, p. 10
- ^ "Having a short Achilles tendon may be an athlete's Achilles heel". Retrieved 2007-10-26.
- ^ Young, Michael. "A Review on Postural Realignment and its Muscular and Neural Components" (PDF). Archived from the original (PDF) on 2019-04-06. Retrieved 2010-06-23.
- ^ Thorpe C.T., Birch H.L., Clegg P.D., Screen H.R.C. (2013).힘줄 기능에서 비콜라겐 매트릭스의 역할.내부 J ExpPathol. 94; 4: 248-59.
- ^ Hulmes, D. J. S. (2002). "Building Collagen Molecules, Fibrils, and Suprafibrillar Structures". Journal of Structural Biology. 137 (1–2): 2–10. doi:10.1006/jsbi.2002.4450. PMID 12064927.
- ^ Silver, F. H.; Freeman, J. W.; Seehra, G. P. (2003). "Collagen self-assembly and the development of tendon mechanical properties". Journal of Biomechanics. 36 (10): 1529–1553. doi:10.1016/S0021-9290(03)00135-0. PMID 14499302.
- ^ Ker, R. F. (2002). "The implications of the adaptable fatigue quality of tendons for their construction, repair and function". Comparative Biochemistry and Physiology A. 133 (4): 987–1000. doi:10.1016/S1095-6433(02)00171-X. PMID 12485688.
- ^ 크립, A.M.; 스콧, J.E. (1995년)인장 스트레스에 대한 힘줄 반응 - 응력 힘줄에서 콜라겐-프로테오글리칸 상호작용의 초미세 구조 연구, 1995; 케임브리지 Univ Press.pp 423-428.
- ^ Screen H.R., Lee D.A., Bader D.L., Shelton J.C. (2004). "An investigation into the effects of the hierarchical structure of tendon fascicles on micromechanical properties". Proc Inst Mech Eng H. 218 (2): 109–119. doi:10.1243/095441104322984004. PMID 15116898. S2CID 46256718.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Puxkandl, R.; Zizak, I.; Paris, O.; Keckes, J.; Tesch, W.; Bernstorff, S.; Purslow, P.; Fratzl, P. (2002). "Viscoelastic properties of collagen: synchrotron radiation investigations and structural model". Philosophical Transactions of the Royal Society B. 357 (1418): 191–197. doi:10.1098/rstb.2001.1033. PMC 1692933. PMID 11911776.
- ^ Gupta H.S., Seto J., Krauss S., Boescke P. & Screen H.R.C. (2010).건 콜라겐 내 점탄성 변형 메커니즘의 현장 다단계 분석.J. Structure. Biol. 169 (2): 183-191.
- ^ Thorpe C.T; Udeze C.P; Birch H.L.; Clegg P.D.; Screen H.R.C. (2012). "Specialisation of tendon mechanical properties results from inter-fascicular differences". Journal of the Royal Society Interface. 9 (76): 3108–3117. doi:10.1098/rsif.2012.0362. PMC 3479922. PMID 22764132.
- ^ Thorpe C.T.; Klemt C; Riley G.P.; Birch H.L.; Clegg P.D.; Screen H.R.C. (2013). "Helical sub-structures in energy-storing tendons provide a possible mechanism for efficient energy storage and return". Acta Biomater. 9 (8): 7948–56. doi:10.1016/j.actbio.2013.05.004. PMID 23669621.
- ^ Gatt R, Vella Wood M, Gatt A, Zarb F, Formosa C, Azzopardi KM, Casha A, Agius TP, Schembri-Wismayer P, Attard L, Chockalingam N, Grima JN (2015). "Negative Poisson's ratios in tendons: An unexpected mechanical response" (PDF). Acta Biomater. 24: 201–208. doi:10.1016/j.actbio.2015.06.018. PMID 26102335.
- ^ Batson EL, Paramour RJ, Smith TJ, Birch HL, Patterson-Kane JC, Goodship AE. (2003)Equine Vet J. volume=35호=3페이지=314-8.말굽힘 및 신근 힘줄의 재료 특성 및 매트릭스 구성은 기능에 따라 결정됩니까?
- ^ ScreenH.R.C., 태너, K.E. (2012년)생물 복합 재료의 구조와 생체역학.인: 컴포지트 백과사전 제2판.Nicolais & Borzacchieello.펍. 존 와일리 & 선스, 주식회사ISBN 978-0-470-12828-2(2928-39페이지)
- ^ Nakagawa, Y. (1989). "Effect of disuse on the ultra structure of the Achilles tendon in rats". European Journal of Applied Physiology. 59 (3): 239–242. doi:10.1007/bf02386194. PMID 2583169. S2CID 20626078.
- ^ Reeves, N. D. (2005). "Influence of 90-day simulated micro-gravity on human tendon mechanical properties and the effect of restiveness countermeasures". Journal of Applied Physiology. 98 (6): 2278–2286. doi:10.1152/japplphysiol.01266.2004. hdl:11379/25397. PMID 15705722.
- ^ a b Riley, G. (2004). "The pathogenesis of tendinopathy. A molecular perspective" (PDF). Rheumatology. 43 (2): 131–142. doi:10.1093/rheumatology/keg448. PMID 12867575.
- ^ a b c d Sharma, P. M., N. (2006). "Biology of tendon injury: healing, modeling and remodeling". Journal of Musculoskeletal and Neuronal Interactions. 6 (2): 181–190. PMID 16849830.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ a b c d Sharma, P.; Maffulli, N. (2005). "Tendon injury and tendinopathy: Healing and repair". Journal of Bone and Joint Surgery. American Volume. 87A (1): 187–202. doi:10.2106/JBJS.D.01850. PMID 15634833. S2CID 1111422.
- ^ a b c d e f Wang, J. H. C. (2006). "Mechanobiology of tendon". Journal of Biomechanics. 39 (9): 1563–1582. doi:10.1016/j.jbiomech.2005.05.011. PMID 16000201.
- ^ Riley, G. P.; Curry, V.; DeGroot, J.; van El, B.; Verzijl, N.; Hazleman, B. L.; Bank, R. A. (2002). "Matrix metalloproteinase activities and their relationship with collagen remodelling in tendon pathology". Matrix Biology. 21 (2): 185–195. doi:10.1016/S0945-053X(01)00196-2. PMID 11852234.
- ^ Moulin, V.; Tam, B. Y. Y.; Castilloux, G.; Auger, F. A.; O'Connor-McCourt, M. D.; Philip, A.; Germain, L. (2001). "Fetal and adult human skin fibroblasts display intrinsic differences in contractile capacity". Journal of Cellular Physiology. 188 (2): 211–222. doi:10.1002/jcp.1110. PMID 11424088. S2CID 22026692.
- ^ Boyer, M. I. W., J. T.; Lou, J.; Manske, P. R.; Gelberman, R. H.; Cai, S. R. (2001). "Quantitative variation in vascular endothelial growth factor mRNA expression during early flexor tendon healing: an investigation in a canine model". Journal of Orthopaedic Research. 19 (5): 869–872. doi:10.1016/S0736-0266(01)00017-1. PMID 11562135. S2CID 20903366.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Astrom, M.; Rausing, A. (1995). "Chronic Achilles Tendinopathy - A survey of Surgical and Histopathologic findings". Clinical Orthopaedics and Related Research. 316 (316): 151–164. doi:10.1097/00003086-199507000-00021. PMID 7634699. S2CID 25486134.
- ^ Berge, James C. Vanden; Storer, Robert W. (1995). "Intratendinous ossification in birds: A review". Journal of Morphology. 226 (1): 47–77. doi:10.1002/jmor.1052260105. PMID 29865323. S2CID 46926646.
- ^ Organ, Chris L. (2006). "Biomechanics of ossified tendons in ornithopod dinosaurs". Paleobiology. 32 (4): 652–665. doi:10.1666/05039.1. S2CID 86568665.