세포생물학
Cell biology| 시리즈의 일부 |
| 생물학 |
|---|
구조체, 기능, 그리고 세포들의 행동을 연구하고 생물학 세포 생물학(또한 세포 생물학 또는 cytology)가지입니다.[1][2]모든 살아 있는 유기체들은 세포로 만들어져 있다.삶의 산과 유기체들 기능하는 책임이 있는 세포는 기본 단위이다.세포와 기능적 구조 단위의 세포 생물학에 대한 연구입니다.세포 생물학과 세포 신진대사, 세포 통신, 세포 주기, 생화학, 세포 구성의 연구 포함할 수 있는 많은 subtopics 둘 다와 진핵 세포 원핵 세포를 포함한다.세포 연구는 여러 현미경 검사 기술, 세포 배양 및 세포 분화를 사용하여 수행됩니다.이것들은 세포가 어떻게 기능하는지에 관한 발견과 연구를 가능하게 하고 현재 사용되고 있으며, 궁극적으로 더 큰 유기체를 이해하는 데 대한 통찰력을 준다.세포의 성분과 세포가 어떻게 작용하는지를 아는 것은 모든 생물과학의 기본이며 암이나 다른 질병과 같은 생물의학 분야에서의 연구에 필수적입니다.세포 생물학 연구는 유전학, 분자 유전학, 분자 생물학, 의학 미생물학, 면역학, 세포 화학과 같은 다른 분야와 상호 연관되어 있다.
역사
세포는 복합 현미경의 발명으로 17세기 유럽에서 처음 발견되었다.1665년, 로버트 후크는 코르크 조각을 보고 세포와 [3][4]같은 구조를 관찰한 후 모든 살아있는 유기체의 구성 요소를 "세포"라고 불렀지만, 세포는 죽었고 세포의 실제적인 전체 구성 요소에 아무런 징후를 주지 않았다.몇 년 후인 1674년, Anton Van Leeuwenhoek은 조류에 대한 그의 검사에서 살아있는 세포를 최초로 분석했다.이 모든 것은 모든 생물은 세포로 이루어져 있고 세포는 유기체의 기능적이고 구조적인 단위라는 세포 이론보다 앞선다.이것은 결국 1838년 식물과학자 마티아스[4] 슐라이덴과 동물과학자 테오도르 슈반에 의해 각각 식물과 동물조직의 살아있는 세포를 관찰한 결과입니다.[5]19년 후, 루돌프 비르초우는 세포 이론에 더 많은 기여를 했고, 모든 세포는 기존의 [5]세포 분열에서 나온다고 덧붙였다.바이러스는 세포생물학에서는 고려되지 않는다 – 살아있는 세포의 특성이 결여되어 있고 대신 바이러스학의 [6]미생물학 하위 클래스에서 연구된다.
기술
세포생물학 연구는 인체 해부학과 생리학에 대한 추가 연구와 약물 치료를 위해 생체 밖에서 세포를 배양하고 조작하는 다양한 방법을 연구합니다.세포를 연구하는 기술은 발전해 왔다.현미경의 발달로 인해, 기술과 기술은 과학자들이 세포의 구조와 기능에 대해 더 잘 이해할 수 있게 해주었다.세포생물학을 연구하기 위해 일반적으로 사용되는 많은 기술은 [7]다음과 같습니다.
- 세포 배양:특정 유형의 셀을 대량으로 특정 [8]셀을 효율적으로 연구할 수 있도록 미디어에서 빠르게 성장하는 셀을 활용합니다.세포 배양은 세포와 분자 생물학에서 사용되는 주요 도구 중 하나로, 세포의 정상적인 생리학 및 생화학(예: 대사 연구, 노화), 세포에 대한 약물과 독성 화합물의 영향, 그리고 돌연변이 유발과 발암을 연구하기 위한 우수한 모델 시스템을 제공합니다.또한 약물 선별 및 개발, 생물학적 화합물(예: 백신, 치료용 단백질)의 대규모 제조에도 사용된다.
- 형광 현미경 검사:GFP와 같은 형광 마커는 세포의 특정 구성 요소에 라벨을 붙이기 위해 사용됩니다.그 후 형광마커를 들뜨게 하기 위해 일정한 광파장을 사용하여 [8]시각화할 수 있다.
- 위상 대비 현미경 검사:빛의 광학적 측면을 사용하여 고체, 액체 및 기상의 변화를 밝기 [8]차이로 나타냅니다.
- 공초점 현미경: 형광 현미경과 초점을 맞추고 스냅 촬영 인스턴스를 촬영하여 3D [8]이미지를 형성합니다.
- 투과 전자 현미경 검사:금속 염색과 전자가 전지를 통과하는 과정이 포함되며, 전자는 금속과 상호작용할 때 편향됩니다.이는 궁극적으로 [8]연구 대상 컴포넌트의 이미지를 형성합니다.
- 세포 측정:셀은 빔을 사용하여 여러 측면에 따라 셀을 분산시키는 기계에 배치되므로 크기와 함량에 따라 셀을 분리할 수 있습니다.세포는 또한 GFP-형광으로 태그가 붙을 수 있으며 그러한 방법으로 분리될 수도 있다.[9]
- 셀 분류:이 과정에서는 고온 또는 음파를 사용하여 세포를 분해한 후 원심분리하여 세포 일부를 [8]분리하여 개별적으로 연구할 수 있도록 해야 합니다.
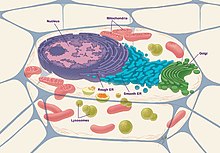
cell
세포에는 원핵세포와 진핵세포의 두 가지 기본적인 분류가 있다.원핵세포는 세포핵이나 다른 막결합 소립자의 [10]부재에 의해 진핵세포와 구별된다.원핵세포는 진핵세포보다 훨씬 작아서 [11]생명체의 가장 작은 형태이다.원핵세포는 박테리아와 고세균을 포함하며, 밀폐된 세포핵이 없다.진핵세포는 식물, 동물, 곰팡이, 그리고 원생동물에서 발견됩니다.지름이 10~100μm이고 DNA는 막 결합 핵 안에 포함되어 있다.진핵생물은 진핵생물을 포함하는 유기체이다.네 개의 진핵 생물 왕국은 애니멀리아, 식물, 곰팡이, 그리고 프로티스타입니다.[citation needed]
둘 다 2분열을 통해 번식합니다.가장 두드러진 종류인 박테리아는 비록 대부분이 구형이나 막대 모양이지만 여러 가지 다른 모양을 가지고 있다.세균은 세포벽 조성에 따라 그램 양성 또는 그램 음성으로 분류할 수 있다.그램 양성균은 그램 음성균보다 펩티도글리칸 층이 두껍다.세균의 구조적 특징은 세포의 이동을 [12]돕는 편모세포, RNA를 [12]단백질로 변환하기 위한 리보솜, 그리고 모든 유전 물질을 원형 [12]구조로 유지하는 핵소체를 포함한다.원핵세포가 생존할 수 있도록 하는 많은 과정이 있다.원핵생물에서 mRNA 합성은 RNA 중합효소를 모집하는 2개의 컨센서스 배열로 이루어진 DNA 템플릿 상의 프로모터 배열로 개시된다.원핵 중합효소는 4개의 단백질 서브유닛의 핵심 효소와 개시만을 보조하는 γ 단백질로 구성되어 있다.예를 들어, 포합이라고 불리는 과정에서, 불임 인자는 박테리아가 F 인자가 없는 다른 박테리아에게 DNA를 전달할 수 있게 하는 필러스를 보유하게 하고, 특정 [13]환경에서 생존할 수 있도록 저항의 투과율을 허용한다.
와
의
진핵세포는 다음과 같은 세포소기관으로 구성되어 있다.
- 핵:세포의 핵은 염색체 형태로 구성된 모든 DNA를 포함하는 게놈과 세포의 유전 정보 저장 역할을 한다.그것은 핵 외피로 둘러싸여 있는데,[14] 핵 외피에는 핵 내부와 핵 외부 사이에 단백질을 운반할 수 있는 핵 기공이 포함되어 있습니다.이곳은 DNA의 복제와 RNA로의 전사가 이루어지는 장소이기도 하며, 그 후 RNA를 수정하여 세포로 운반하여 [15]단백질로 변환한다.
- 뉴클레오러스:이 구조는 핵 안에 있으며, 대개 밀도가 높고 모양이 구형입니다.리보솜 조립에 필요한 리보솜 RNA(rRNA) 합성의 현장이다.
- 소포체(ER): 이것은 골지 [16]기구에 단백질을 합성, 저장 및 분비하는 기능을 합니다.구조적으로, 소포체는 세포 전체에서 발견되고 핵에 연결된 막의 네트워크이다.세포막은 세포마다 조금씩 다르며 세포의 기능이 [17]ER의 크기와 구조를 결정합니다.
- 미토콘드리아:일반적으로 세포의 강자로 알려진 것은 이중막 세포소기관이다.[18]이것은 세포 내에서 에너지 또는 ATP의 생산을 위해 기능합니다.구체적으로는 NADH와 FADH의 생성을 위한 Krebs cycle 또는 TCA cycle이 발생하는 곳이다.그 후 이들 생성물은 [19]전자전달사슬(ETC) 내에서 사용되며 ATP의 최종 생산을 위해 산화적 인산화된다.
- 골지 장치:이것은 단백질을 더 처리하고 포장하고 그들의 목적지로 분비하는 기능을 한다.그 단백질들은 골지 기구가 그것을 인식하고 올바른 곳으로 향하게 하는 신호 시퀀스를 포함하고 있다.골지장치는 당단백질과 [20]당지질도 생산한다.
- 리소좀:리소좀은 세포 외부나 오래된 장기에서 가져온 물질을 분해하는 기능을 한다.이것은 다양한 분자를 분해하는 많은 산성 가수분해효소, 단백질분해효소, 핵산분해효소, 그리고 리파아제를 포함합니다.오토파지는 리소좀을 통해 분해되는 과정으로, ER에서 소포가 싹을 틔워 물질을 흡수하고 리소좀과 결합시켜 물질이 [21]분해되도록 하는 과정이다.
- 리보솜:RNA를 단백질로 변환하는 기능을 합니다.그것은 단백질 [22]합성의 장소 역할을 한다.
- 세포골격:세포골격은 세포질의 형태와 일반적인 조직을 유지하는데 도움을 주는 구조이다.그것은 세포 내에 세포 조직을 고정시키고 세포의 구조와 안정성을 구성합니다.세포골격은 단백질 필라멘트의 세 가지 주요 유형으로 구성되어 있습니다: 액틴 필라멘트, 중간 필라멘트, 그리고 미세관. 그것들은 함께 고정되고 다양한 보조 [23]단백질에 의해 세포 내 기관과 혈장 막과 연결됩니다.
- 세포막:세포막은 인지질 이중층으로 묘사될 수 있으며 지질과 [12]단백질로 구성되어 있다.이중층 내부는 소수성이기 때문에 분자가 세포 내 반응에 참여하기 위해서는 삼투압, 확산, 농도 구배, 막 [24]채널을 통해 이 막층을 통과할 수 있어야 한다.
- 중심:세포 분열 시 염색체를 분리하는 데 사용되는 방추 섬유를 생성하는 기능.
진핵세포는 또한 다음과 같은 분자 성분으로 구성될 수 있다.
세포대사
세포대사는 세포의 에너지 생산과 생존을 위해 필요하며 많은 경로를 포함한다.세포호흡의 경우 포도당을 이용할 수 있게 되면 해당과정이 세포의 세포 내에서 일어나 피루브산을 생성한다.피루브산은 다효소 복합체를 이용한 탈탄산화 과정을 거쳐 아세틸 coA를 형성하고, 아세틸 coA는 TCA 회로에서 쉽게 사용되어 NADH와2 FADH를 생성할 수 있다.이러한 생성물은 궁극적으로 내부 미토콘드리아 막을 가로질러 양성자 구배를 형성하기 위해 전자전달망에 관여한다.이 구배는 산화적 [26]인산화 동안 ATP와 H2O의 생산을 촉진할 수 있다.식물 세포의 신진대사는 궁극적으로 포도당 분자를 생성하기 때문에 단순히 호흡의 정반대인 광합성을 포함한다.
셀 시그널링
세포 신호 또는 세포 통신은 세포 조절과 세포들이 환경으로부터 정보를 처리하고 그에 따라 반응하는 데 중요하다.시그널링은 직접 세포 접촉 또는 내분비, 파라크린 및 자동분비 시그널링을 통해 발생할 수 있습니다.직접 세포-세포 접촉은 세포의 수용체가 다른 세포의 막에 부착된 분자와 결합할 때 일어난다.내분비 신호는 혈류로 분비되는 분자를 통해 발생한다.파라크린 시그널링은, 2개의 세포간에 확산하는 분자를 사용해 통신합니다.오토크린은 표면에 있는 수용체에 결합하는 분자를 분비함으로써 자신에게 신호를 보내는 세포이다.커뮤니케이션의 형태는 다음과 같습니다.
- 이온 채널: 전압 또는 리간드 게이트 이온 채널 등 다양한 유형이 있을 수 있습니다.그것들은 분자와 이온의 유출과 유입을 허용한다.
- G-단백질결합수용체(GPCR): 7개의 막 통과 도메인을 포함하는 것으로 널리 알려져 있다.리간드는 세포외 도메인에 결합하고 리간드가 결합하면 구아닌 교환 인자가 GDP를 GTP로 변환하고 G-α 서브유닛을 활성화하는 신호를 보냅니다.G-α는 궁극적으로 cAMP, Ip3, DAG, 칼슘과 같은 2차 메신저를 생성하는 아데닐 사이클라아제 또는 포스포리파아제 C와 같은 다른 단백질을 목표로 할 수 있습니다.이러한 보조 메신저는 신호를 증폭하는 기능을 하며 이온 채널이나 다른 효소를 목표로 할 수 있습니다.신호의 증폭의 한 예는 조절 서브유닛을 제거하고 촉매 서브유닛을 해제함으로써 PKA에 대한 cAMP 결합 및 활성화이다.촉매 서브유닛은 유전자 활동을 억제하거나 활성화하기 위해 핵으로 들어가 [26]다른 단백질을 인산화하도록 유도하는 핵 국재화 시퀀스를 가지고 있다.
- 수용체 티로신 키나아제: 성장 인자와 결합하여 단백질 세포 내 부분의 티로신이 교차 인산화되도록 더욱 촉진합니다.인산화 티로신은 Ras의 활성화와 MAP 키나제 [27]경로의 개입을 허용하는 SH2 도메인을 포함하는 단백질의 착지 패드가 된다.
성장과 발전
진핵세포주기
세포는 모든 유기체의 기초이며 생명의 기본 단위이다.세포의 성장과 발달은 숙주의 유지와 유기체의 생존에 필수적이다.이 과정을 위해, 세포는 세포 성장, DNA 복제, 세포 분열, 재생, 그리고 세포 사멸을 수반하는 세포 주기와 발달 단계를 거친다.
셀 사이클은 G1, S, G2, M의 4가지 단계로 구분됩니다.세포 성장 단계인 G 단계는 사이클의 약 95%를 차지합니다.세포의 증식은 조상들에 의해 유발된다.모든 세포는 동일한 형태로 시작되며 기본적으로 모든 종류의 세포가 될 수 있습니다.유도와 같은 세포 시그널링은 가까운 세포에 영향을 미쳐 세포 유형을 결정할 수 있습니다.게다가, 이것은 같은 유형의 세포들이 집적되어 조직을 형성하고, 그 다음 장기, 그리고 궁극적으로 시스템을 형성할 수 있게 한다.G1, G2, S상(DNA 리플리케이션, 손상 및 복구)은 사이클의 상간 부분으로 간주되며, M상(미토시스)은 사이클의 세포 분열 부분으로 간주됩니다.유사분열은 각각 전상, 중기, 과민기, 말단기, 사이토키네시스를 포함한 여러 단계로 구성된다.체세포 분열의 궁극적인 결과는 두 개의 동일한 딸세포가 형성되는 것이다.
세포주기는 세포주기 체크포인트에서 사이클린, 사이클린 의존성 키나제 및 p53과 같은 일련의 신호인자와 복합체에 의해 조절된다.세포가 성장 과정을 마치고 손상되거나 변형된 것으로 밝혀지면, 생물체의 [28]생존에 대한 위협을 제거하기 위해 세포사멸 또는 괴사에 의해 세포사멸을 겪는다.
세포 사망률, 세포 계통 불멸
각 현생 세포의 조상은 아마도 생명의 기원에 이르기까지 30억 년 이상 끊기지 않은 혈통으로 거슬러 올라갑니다.실제로 불멸의 세포가 아니라 다세대 세포 계통이다.[29]세포 계통의 불멸은 세포 분열 전위의 유지에 달려 있다.이 잠재력은 세포 손상, 신경 세포에서 일어나는 말단 분화 또는 발달 중 프로그램된 세포사망(아포토시스)으로 인해 특정 혈통에서 상실될 수 있습니다.연속 세대에 걸친 세포 분열 전위의 유지는 세포 손상, 특히 DNA 손상의 회피와 정확한 복구에 달려 있다.성 유기체에서 생식선의 연속성은 DNA 손상을 피하고 발생하는 DNA 손상을 복구하는 과정의 효과에 달려 있다.원핵생물뿐만 아니라 진핵생물에서의 성적 과정은 상동 재조합에 [29][30]의해 생식줄의 DNA 손상을 효과적으로 복구할 수 있는 기회를 제공한다.
셀 사이클 단계
세포주기는 세포가 발달하고 분열하면서 겪는 4단계 과정이다.Gap 1(G1), 합성(S), Gap 2(G2) 및 유사분열(M)을 포함한다.셀은 사이클이 완료된 후 G1에서 사이클을 재시작하거나 사이클을 G0으로 남깁니다.셀은 G0에서 단말의 분화를 통해 진행될 수 있습니다.
중간상(interphase)은 하나의 유사분열과 다음 유사분열 사이에 발생하는 세포주기의 상으로 G1, S, G2를 포함한다.
G1 단계
세포의 크기가 커진다.
셀의 내용이 복제됩니다.
S상
DNA 복제
이 세포는 46개의 염색체(23쌍)를 각각 복제한다.
G2 단계
세포가 증식합니다.
세포 분열에 대비하여 세포 기관과 단백질이 형성된다.
M상
유사분열 후 사이토키네시스 발생(세포분리)
동일한 두 개의 딸세포의 형성
G0 단계
이 세포들은 G1을 떠나 휴식 단계인 G0으로 들어간다.G0의 셀은 [31]분열을 적극적으로 준비하지 않고 제 역할을 하고 있습니다.
병리학
세포 수준에서 질병을 연구하고 진단하는 과학 분야를 세포병리학이라고 한다.세포병리학은 조직 전체를 연구하는 조직병리학 병리학과 대조적으로 일반적으로 유리 세포나 조직 조각의 샘플에 사용된다.세포병리학은 흔히 광범위한 신체 부위와 관련된 질병을 조사하는데 사용되며, 종종 암의 진단에 도움을 줄 뿐만 아니라 일부 감염성 질병과 다른 염증 조건의 진단에도 사용된다.예를 들어, 세포병리학의 일반적인 적용은 자궁경부암을 발견하기 위해 사용되는 선별검사인 Pap 도말과 자궁경부암을 [32]유발할 수 있는 전암성 자궁경부병변이다.
세포주기 체크포인트 및 DNA 손상 복구 시스템
세포 주기는 세포 분열을 초래하는 많은 질서 있는 연속된 단계로 구성됩니다.마지막 단계가 끝날 때까지 세포가 다음 단계를 시작하지 않는다는 사실은 세포 주기 조절의 중요한 요소입니다.세포주기 체크포인트는 정확한 세포주기 및 분열을 위한 우수한 모니터링 전략을 구성하는 특성입니다.cdks, 연관된 사이클린 대응물, 단백질 키나아제, 그리고 포스파타아제들은 한 단계에서 다른 [33]단계로 세포 성장과 분열을 조절합니다.세포주기는 Cdks의 시간적 활성화에 의해 제어되며, Cdks는 사이클린 파트너 상호작용, 특정 단백질 키나제에 의한 인산화 및 Cdc25 계열 포스파타아제에 의한 탈인산화로 제어된다.DNA 손상에 대한 반응으로, 세포의 DNA 복구 반응은 체크포인트 결합, 조절, DNA의 복구 메커니즘, 세포 주기 변화, 그리고 세포 자멸로 이어지는 일련의 신호 경로입니다.DNA 손상을[34] 감지하는 과정뿐만 아니라 수많은 생화학적 구조들은 DNA 복구 체크포인트를 유도하는 ATM과 ATR이다.
세포주기는 세포소기관들이 복제되고 이어서 정확하게 딸세포로 분리되는 일련의 활동이다.셀 사이클 중에 발생하는 주요 이벤트가 있습니다.세포주기에서 일어나는 과정은 세포발달, 복제, 염색체 분리를 포함한다.세포 주기 검사점은 세포 주기의 무결성, 정확성 및 연대를 추적하는 감시 시스템입니다.각 체크포인트는 대체 셀 사이클 엔드포인트 역할을 하며, 여기서 셀의 파라미터가 검사되고 바람직한 특성이 충족될 때만 셀 사이클이 다른 단계를 통해 진행됩니다.세포 주기의 목표는 각 유기체의 DNA를 정밀하게 복사하고 그 후에 세포와 그 구성 요소를 두 개의 새로운 세포 사이에 균등하게 나누는 것이다.진핵생물에는 4가지 주요 단계가 있다.G1에서 세포는 보통 활성화되고 빠르게 성장하는 반면, G2에서는 단백질 분자가 분리될 준비가 되는 동안 세포 성장이 계속된다.이것은 휴면기가 아니다; 세포들이 질량을 늘리고, 성장인자 수용체를 통합하고, 복제된 게놈을 만들고, 염색체 분리를 준비하는 때이다.DNA 복제는 S상으로도 알려진 진핵생물에서 별도의 합성으로 제한됩니다.M기로도 알려진 유사분열 동안,[35] 염색체의 분리가 일어난다.DNA는 다른 모든 분자와 마찬가지로 광범위한 화학반응을 일으킬 수 있다.반면 DNA 배열의 수정은 DNA가 세포 게놈의 영구적인 복제 역할을 하기 때문에 RNA나 단백질과 같은 다른 세포 구성 요소의 수정보다 상당히 큰 영향을 미친다.DNA 복제 중에 잘못된 뉴클레오티드가 통합되면 돌연변이가 발생할 수 있다.DNA 손상의 대부분은 결함이 있는 염기를 제거한 다음 절제된 영역을 다시 동기화함으로써 고정됩니다.한편, 일부 DNA 병변은 손상을 되돌림으로써 개선될 수 있으며, 이것은 일반적인 유형의 DNA 손상에 대처하는 더 효과적인 방법일 수 있다.DNA손상 단지 약간의 형태는 이 패션에, 피리미딘 dimers 자외선(자외선)빛 메틸 또는 에틸 단체의 푸린 링 O6 위치에 있는 삽입에 의해 변함으로써 발생하는 등을 수선하고 있다.[36]
미토콘드리아 막역학
미토콘드리아는 세포의 항상성과 신진대사를 유지하는데 필수적인 ATP를 효과적으로 생산하는 능력 때문에 세포의 "강자"로 흔히 불린다.게다가, 연구원들은 세포자멸과 같은 세포 기능 조절을 위한 중요한 플랫폼인 미토콘드리아에 의한 세포 신호 전달 경로의 발견으로 인해 세포 생물학에서 미토콘드리아의 중요성에 대해 더 많은 지식을 얻었다.생리적 적응성은 초미세 구조막 리모델링뿐만 아니라 내막 융합과 단편화(분리)를 포함한 미토콘드리아 막 역학으로 알려진 일련의 메커니즘을 통해 세포 미토콘드리아 채널의 지속적인 재구성과 강하게 연관되어 있다.결과적으로, 미토콘드리아 역학은 신진대사뿐만 아니라 세포 만능 줄기세포, 증식, 성숙, 노화, 사망률 같은 복잡한 세포 신호 전달 과정을 조절하고 자주 안무한다.미토콘드리아 장치의 상호 간에, 번역 후 수선과 투과 성막 접촉 사이트는 둘 다 잠재력 substantially,[35]미토콘드리아는 두개의 막:내부 mitochon에 의해 포장되어 있는 미토콘드리아 막 역학에 영향을 미치는 다양한 노선에서 신호를 연결하는 미토콘드리아와 다른 구조의 개발이다.dri각각 독특한 기능과 구조를 가진 알 막(IMM)과 외측 미토콘드리아 막(OMM)으로 세포 강국 및 신호 전달 기관으로서의 이중적 역할과 유사하다.미토콘드리아 내막은 미토콘드리아 내강을 OMM과 평행하게 흐르는 내측 경계막과 표면적 확대의 여지를 주고 미토콘드리아 호흡기를 수용하는 깊이 뒤틀린 다핵침입의 두 부분으로 나눈다.반면에 외부 미토콘드리아 막은 부드럽고 투과성이 있다.따라서 그것은 세포 신호 경로가 모여 해독되고 미토콘드리아로 운반되는 기초 역할을 한다.또한 OMM은 소포체(ER), 리소좀, 엔도솜 및 혈장막과 같은 다른 세포소기관에 접속한다.미토콘드리아는 세포 생물학에서 광범위한 역할을 하는데, 이것은 그들의 형태학적 다양성에 반영된다.미토콘드리아 연구가 시작된 이래로, 미토콘드리아는 세포에 따라, 세포 주기 동안, 그리고 신진대사 또는 세포 단서에 반응하여, 일반적인 형태와 초구조 형태 모두 큰 차이를 보이는 다양한 형태를 가질 수 있다는 것이 잘 문서화되어 왔다.미토콘드리아는 독립적인 세포소기관 또는 더 큰 시스템의 일부로 존재할 수 있다; 그들은 또한 세포의 국부적인 에너지 요구 사항을 충족시키기 위해 조절된 미토콘드리아 수송과 배치를 통해 세포에 불균등하게 분포될 수 있다.미토콘드리아 역학은 미토콘드리아의 형태와 세포하 [35]분포를 포함한 적응적이고 가변적인 측면을 말한다.
오토파지
자가 분해는 성장과 식생활 스트레스에 대한 반응 중에 에너지원을 조절하는 자기 분해 메커니즘이다.자가파지는 또한 스스로 깨끗하게 하고, 응집된 단백질을 제거하며, 미토콘드리아와 소포체 등 손상된 구조를 청소하고 세포 내 감염을 근절한다.또한 자가파지는 세포 내에서 항바이러스 및 항균 역할을 하며 바이러스 및 세균 오염에 대한 특이하고 적응적인 면역 반응의 시작에 관여한다.어떤 바이러스들은 자가파지를 막는 독성 단백질을 포함하고 있는 반면, 다른 바이러스들은 세포 내 발달이나 세포 [37]분열을 위해 자가파지 요소를 이용한다.매크로 오토파지, 마이크로 오토파지, 샤페론 매개 오토파지 세 가지 기본 타입의 오토파지입니다.매크로 오토파지가 트리거되면, 배제막은 세포질의 일부를 포함하고, 독특한 이중막 소기관인 오토파고솜을 생성한다.오토파고솜은 리소좀과 결합하여 오토리소좀을 만들고 리소좀 효소는 성분을 분해합니다.마이크로 오토파지에서 리소좀 또는 액포올은 리소좀막을 침윤 또는 돌출시켜 세포질 또는 세포소기관을 둘러싸도록 함으로써 세포질의 일부를 흡수한다.샤페론 매개 오토파지(CMA) 단백질 품질 보증은 스트레스 환경에서 산화 및 변경된 단백질을 소화시키고 단백질 [38]변성을 통해 아미노산을 공급합니다.자가 분해는 펩타이드, 지방, 탄수화물 및 기타 세포 구조에 대한 1차 고유 분해 시스템이다.생리학적으로나 스트레스가 많은 상황에서, 이 세포 진행은 올바른 세포 균형을 유지하는 데 필수적입니다.자가파지의 불안정성은 세포 건전성 조절에 관여하기 때문에 염증, 생화학적 장애, 노화, 신경변성 등 다양한 질병 증상으로 이어진다.자가이염색체 네트워크의 수정은 많은 신경 및 근육 질환의 전형적인 특징이다.결과적으로, 자동 파지는 다양한 장애의 예방과 치료를 위한 잠재적인 전략으로 확인되었다.이러한 장애의 대부분은 식사 중에 폴리페놀을 섭취함으로써 예방되거나 개선된다.그 결과, 자동 파지 기구를 변경할 수 있는 천연 화합물이 잠재적인 치료 [39]옵션으로 간주된다.핵형성이라고 알려진 이중막(식세포)의 생성은 거시 자동식세포의 첫 번째 단계이다.식세포 접근법은 세포막, 골지 기구, 소포체 및 미토콘드리아에서 나오는 조절 불량 폴리펩타이드 또는 결함이 있는 소기관임을 나타낸다.자기식세포의 종말과 함께 식세포의 확대는 종말을 고한다.오토파고좀은 리소좀 소포와 결합하여 캡슐화된 물질을 분해하는 오토리소좀을 형성하는데, 이것을 [40]식세포증이라고 한다.
저명한 세포생물학자
「 」를 참조해 주세요.
메모들
- ^ Alberts, Bruce; Johnson, Alexander D.; Morgan, David; Raff, Martin; Roberts, Keith; Walter, Peter (2015). "Cells and genomes". Molecular Biology of the Cell (6th ed.). New York, NY: Garland Science. pp. 1–42. ISBN 978-0815344322.
- ^ Bisceglia, Nick. "Cell Biology". Scitable. www.nature.com.
- ^ Hooke, Robert (September 1665). Micrographia.
- ^ a b Chubb, Gilbert Charles (1911). . In Chisholm, Hugh (ed.). Encyclopædia Britannica. Vol. 7 (11th ed.). Cambridge University Press. p. 710.
- ^ a b Gupta, P. (1 December 2005). Cell and Molecular Biology. Rastogi Publications. p. 11. ISBN 978-8171338177.
- ^ Paez-Espino D, Eloe-Fadrosh EA, Pavlopoulos GA, Thomas AD, Huntemann M, Mikhailova N, Rubin E, Ivanova NN, Kyrpides NC (August 2016). "Uncovering Earth's virome". Nature. 536 (7617): 425–30. Bibcode:2016Natur.536..425P. doi:10.1038/nature19094. PMID 27533034. S2CID 4466854.
- ^ Lavanya, P. (1 December 2005). Cell and Molecular Biology. Rastogi Publications. p. 11. ISBN 978-8171338177.
- ^ a b c d e f Cooper, Geoffrey M. (2000). "Tools of Cell Biology". The Cell: A Molecular Approach. 2nd Edition.
- ^ McKinnon, Katherine M. (21 February 2018). "Flow Cytometry: An Overview". Current Protocols in Immunology. 120: 5.1.1–5.1.11. doi:10.1002/cpim.40. ISSN 1934-3671. PMC 5939936. PMID 29512141.
- ^ Doble, Mukesh; Gummadi, Sathyanarayana N. (5 August 2010). Biochemical Engineering. New Delhi: Prentice-Hall of India Pvt.Ltd. ISBN 978-8120330528.
- ^ Kaneshiro, Edna (2 May 2001). Cell Physiology Sourcebook: A Molecular Approach (3rd ed.). Academic Press. ISBN 978-0123877383.
- ^ a b c d Nelson, Daniel (22 June 2018). "The Difference Between Eukaryotic And Prokaryotic Cells". Science Trends. doi:10.31988/scitrends.20655. S2CID 91382191.
- ^ Griffiths, Anthony J.F.; Miller, Jeffrey H.; Suzuki, David T.; Lewontin, Richard C.; Gelbart, William M. (2000). "Bacterial conjugation". An Introduction to Genetic Analysis. 7th Edition.
- ^ De Rooij, Johan (25 June 2019). "F1000Prime recommendation of Force Triggers YAP Nuclear Entry by Regulating Transport across Nuclear Pores". doi:10.3410/f.732079699.793561846. S2CID 198355737.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ "Nucleus". Genome.gov. Retrieved 27 September 2021.
- ^ "Endoplasmic Reticulum (Rough and Smooth) British Society for Cell Biology". Retrieved 6 October 2019.
- ^ Studios, Andrew Rader. "Biology4Kids.com: Cell Structure: Endoplasmic Reticulum". www.biology4kids.com. Retrieved 27 September 2021.
- ^ "Powerhouse of the cell has self-preservation mechanism". EurekAlert!. Retrieved 27 September 2021.
- ^ Pelley, John W. (2007), "Citric Acid Cycle, Electron Transport Chain, and Oxidative Phosphorylation", Elsevier's Integrated Biochemistry, Elsevier, pp. 55–63, doi:10.1016/b978-0-323-03410-4.50013-4, ISBN 9780323034104
- ^ Cooper, Geoffrey M. (2000). "The Golgi Apparatus". The Cell: A Molecular Approach. 2nd Edition.
- ^ Verity, M A. Lysosomes: some pathologic implications. OCLC 679070471.
- ^ "Ribosome cytology". Encyclopedia Britannica. Retrieved 27 September 2021.
- ^ The CELL A MOLEQULAR APPROACH. Geoffrey M Cooper. 2000.
- ^ Cooper, Geoffrey M. (2000). "Transport of Small Molecules". The Cell: A Molecular Approach. 2nd Edition.
- ^ "What Are the Main Functions of Cilia & Flagella?". Sciencing. Retrieved 23 November 2020.
- ^ a b Ahmad, Maria; Kahwaji, Chadi I. (2019), "Biochemistry, Electron Transport Chain", StatPearls, StatPearls Publishing, PMID 30252361, retrieved 20 October 2019
- ^ Schlessinger, Joseph (October 2000). "Cell Signaling by Receptor Tyrosine Kinases". Cell. 103 (2): 211–225. doi:10.1016/s0092-8674(00)00114-8. ISSN 0092-8674. PMID 11057895. S2CID 11465988.
- ^ Shackelford, R E; Kaufmann, W K; Paules, R S (February 1999). "Cell cycle control, checkpoint mechanisms, and genotoxic stress". Environmental Health Perspectives. 107 (suppl 1): 5–24. doi:10.1289/ehp.99107s15. ISSN 0091-6765. PMC 1566366. PMID 10229703.
- ^ a b 번스타인 C, 번스타인 H, 페인 C세포불멸성: 세포분열전위 유지.Prog Mol Subcell Biol.2000;24:23-50.doi:10.1007/978-3-662-06227-2_2.PMID 10547857.
- ^ Avise JC.전망:노화, 성 생식, DNA 수복의 진화생물학.진화.1993년 10월 47일:1293-1301.doi:10.1558-5646.1993.tb02155.x.PMID 2856487.
- ^ "The Cell Cycle - Phases - Mitosis - Regulation". TeachMePhysiology. Retrieved 7 October 2021.
- ^ "What is Pathology?". News-Medical.net. 13 May 2010. Retrieved 21 September 2021.
- ^ Nurse, Paul (7 January 2000). "A Long Twentieth Century of the Cell Cycle and Beyond". Cell. 100 (1): 71–78. doi:10.1016/S0092-8674(00)81684-0. ISSN 0092-8674. PMID 10647932. S2CID 16366539.
- ^ Cimprich, Karlene A.; Cortez, David (August 2008). "ATR: an essential regulator of genome integrity". Nature Reviews Molecular Cell Biology. 9 (8): 616–627. doi:10.1038/nrm2450. ISSN 1471-0080. PMC 2663384. PMID 18594563.
- ^ a b c Giacomello, Marta; Pyakurel, Aswin; Glytsou, Christina; Scorrano, Luca (18 February 2020). "The cell biology of mitochondrial membrane dynamics". Nature Reviews Molecular Cell Biology. 21 (4): 204–224. doi:10.1038/s41580-020-0210-7. ISSN 1471-0072. PMID 32071438. S2CID 211170966.
- ^ You, Zhongsheng; Bailis, Julie M. (July 2010). "DNA damage and decisions: CtIP coordinates DNA repair and cell cycle checkpoints". Trends in Cell Biology. 20 (7): 402–409. doi:10.1016/j.tcb.2010.04.002. ISSN 0962-8924. PMC 5640159. PMID 20444606.
- ^ Glick, Danielle; Barth, Sandra; Macleod, Kay F. (3 February 2010). "Autophagy: cellular and molecular mechanisms". The Journal of Pathology. 221 (1): 3–12. doi:10.1002/path.2697. ISSN 0022-3417. PMC 2990190. PMID 20225336.
- ^ Yoshii, Saori R.; Mizushima, Noboru (28 August 2017). "Monitoring and Measuring Autophagy". International Journal of Molecular Sciences. 18 (9): 1865. doi:10.3390/ijms18091865. ISSN 1422-0067. PMC 5618514. PMID 28846632.
- ^ Perrone, Lorena; Squillaro, Tiziana; Napolitano, Filomena; Terracciano, Chiara; Sampaolo, Simone; Melone, Mariarosa Anna Beatrice (13 August 2019). "The Autophagy Signaling Pathway: A Potential Multifunctional Therapeutic Target of Curcumin in Neurological and Neuromuscular Diseases". Nutrients. 11 (8): 1881. doi:10.3390/nu11081881. ISSN 2072-6643. PMC 6723827. PMID 31412596.
- ^ Levine, Beth; Kroemer, Guido (11 January 2008). "Autophagy in the Pathogenesis of Disease". Cell. 132 (1): 27–42. doi:10.1016/j.cell.2007.12.018. ISSN 0092-8674. PMC 2696814. PMID 18191218.
레퍼런스
- Penner-Hahn, 제임스 E.(2013년)."2장.단일 세포에서 금속 검출 요소 기술.제4절.'엑스 레이 촬영 Fluorescence".바니에서 루시아(교육.).Metallomics와 Cell.금속 이온은 생명 과학에.Vol12.스프링거.를 대신하여 서명함. 15–40. doi:10.1007/978-94-007-5561-1_2.아이 에스비엔 978-94-007-5560-4.PMID 23595669.electronic-book 아이 에스비엔 978-94-007-5561-1 ISSN 1559-0836electronic-ISSN 1868-0402.
- 세포 및 분자생물학(Karp 5th Ed, ISBN 0-471-46580-1)
 이 문서에는 NCBI 문서의 퍼블릭 도메인 자료가 포함되어 있습니다.
이 문서에는 NCBI 문서의 퍼블릭 도메인 자료가 포함되어 있습니다.
외부 링크
| 라이브러리 리소스 정보 세포생물학 |