확산 MRI
Diffusion MRI| 확산 MRI | |
|---|---|
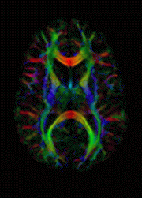 DTI 컬러 맵 | |
| 메슈 | D038524 |
확산가중 자기공명영상(DWI 또는 DW-MRI)은 MR 영상의 대비를 생성하기 위해 물 분자의 확산을 이용하는 결과 데이터로부터 영상을 생성하는 소프트웨어뿐만 아니라 특정 MRI 시퀀스를 사용하는 것이다.[1][2][3] 그것은 생물학적 조직, 생체내 및 비침습적으로 주로 물을 포함한 분자의 확산 과정을 매핑할 수 있게 한다. 조직 내 분자 확산은 무작위가 아니라 고분자, 섬유, 막과 같은 많은 장애물과의 상호작용을 반영한다. 따라서 물 분자 확산 패턴은 정상적이거나 병든 상태의 조직 구조에 대한 미시적인 세부사항을 드러낼 수 있다. 특별한 종류의 DWI, 확산 텐서 이미징(DTI)은 뇌의 백색 물질 트랙토그래피 지도를 만드는데 광범위하게 사용되어 왔다.
소개
확산가중영상(DWI)에서 각 영상요소(복셀)의 강도는 해당 위치의 물 확산 속도에 대한 최선의 추정치를 반영한다. 물의 이동성은 열적 동요에 의해 주도되고 세포 환경에 크게 의존하기 때문에, DWI의 이면에 있는 가설은 발견이 (조기) 병리학적 변화를 나타낼 수 있다는 것이다. 예를 들어, DWI는 T1이나 T2 이완률과 같은 전통적인 MRI 측정보다 뇌졸중 후 초기 변화에 더 민감하다. 확산의 변형인 확산 스펙트럼 영상(직접 대치 품목)[4]은 커넥톰 데이터 세트를 파생에 사용되었습니다;직접 대치 품목은diffusion-weighted 영상의 확산 방향 섬유 지대 건넘으로 야기된intra-voxel heterogeneities는 것은 매우 민감한 변형이며, 따라서 축삭 궤도의 다른 d보다 더 정확한 매핑을 허용하는 영상 가중만약핵융합 영상 [5]접근법
확산가중 영상은 뇌의 혈관 뇌졸중을 진단하는 데 매우 유용하다. 또한 이러한 종류의 질병의 '금본기준'으로 양전자 방출 단층촬영을 대체하는 것이 심각한 후보인 비소세포 폐암의 발생에도 점점 더 많이 사용된다. 확산 텐서 이미징은 다른 신체조직의 연구뿐만 아니라 뇌의 백질 질환을 연구하기 위해 개발되고 있다(아래 참조). DWI는 관심 조직이 대뇌피질 및 주요 뇌핵의 회백질, 또는 신체의 등방성 물 이동에 의해 지배되는 경우에 가장 적용되며, 여기서 어떤 축을 따라 측정했을 때 확산 속도가 같아 보인다. 그러나 DWI는 T1과 T2 이완에도 민감하게 반응한다. 영상 대조에 대한 확산 및 이완 효과를 결합하기 위해 확산 계수의 정량적 영상 또는 보다 정확하게 겉보기 확산 계수(ADC)를 얻을 수 있다. ADC 개념은 확산 과정이 생물조직에서 복잡하고 여러 가지 다른 메커니즘을 반영한다는 사실을 고려하기 위해 도입되었다.[6]
확산 텐서 이미징(DTI)은 뇌의 백색 물질 신경 도끼나 심장의 근육 섬유와 같은 조직이 일부 결정의 음이소트로피와 유사한 내부 섬유 구조를 가질 때 중요하다. 그러면 물은 내부 구조물에 맞춰 정렬된 방향으로 더 빠르게 확산되며(축 확산), 선호하는 방향에 수직으로 이동할수록 더 느리게 확산된다(방사선 확산). 이는 또한 관찰자가 바라보는 방향에 따라 측정된 확산 속도가 달라진다는 것을 의미한다.
확산 기반 스펙트럼 이미징(DBSI)은 DTI 신호를 이산 비등방성 확산 텐서 및 등방성 확산 텐서 스펙트럼으로 더욱 분리해 아복셀 셀룰러 구조를 더 잘 구별한다. 예를 들어, 비등방성 확산 텐셔너는 축섬유와 상관관계가 있는 반면, 낮은 등방성 확산 텐셔너는 세포와 상관관계가 있고 높은 등방성 확산 텐셔너는 더 큰 구조물(예: 루멘 또는 뇌심실)과 상관관계가 있다.
전통적으로 확산가중영상(DWI)에서는 세 가지 구배 방향이 적용되는데, 이는 부종의 투입 측정인 확산 텐서 또는 '평균 확산도'의 흔적을 추정하기에 충분하다. 임상적으로 미량 가중 영상은 저산소 부종의 조기 발견(몇 분 이내)에 의해 뇌의 혈관 뇌졸중을 진단하는 데 매우 유용한 것으로 입증되었다.[7]
DTI 스캔 확장은 확산 텐서 계산에 충분한 6개 이상의 구배 방향에 기초한 3D 또는 다차원 벡터 알고리즘을 사용하여 데이터로부터 신경 궤도 방향 정보를 도출한다. 확산 텐서 모델은 각 영상 복셀 내에서 확산의 동질성과 선형성을 가정하여 확산 과정의 다소 단순한 모델이다.[7] 확산 텐서로부터, 분수 음이소트로피(FA)와 같은 확산 음이소트로피 측정치를 계산할 수 있다. 게다가 확산 텐서의 주요 방향은 뇌의 백색 물질 연결을 유추하는 데 사용될 수 있다(즉, 트랙터그래피, 뇌의 어느 부분이 다른 부분과 연결되어 있는지 알아보려는 노력).
최근에는 확산 텐서 모델의 약점을 극복하는 것을 목표로 하는 확산 과정의 보다 발전된 모델이 제안되고 있다. 그 중에서도 q-space 이미징과 일반화 확산 텐서 이미징이 포함된다.
메커니즘
확산 영상촬영은 분자 확산의 국소적 특성으로 감작된 생물조직의 생체내 자기공명영상(MRI)을 생성하는 MRI 방법, 일반적으로 물(MR 분광 접근법을 사용하여 다른 모이에티도 조사할 수 있다)이다.[9] MRI는 분자의 움직임에 민감하게 만들 수 있다. 정기적인 MRI 획득은 특정 피험자의 임상적으로 관련되는 특징들 사이의 대비를 생성하기 위해 물속의 양성자들의 행동을 이용한다. MRI의 다재다능한 특성은 미세한 수준의 조직 구조와 관련된 대비를 만들어 낼 수 있는 능력 때문이다. 일반적인 가중치 영상에서 샘플의 물 분자는 강한 자기장의 부과로 흥분한다. 이로 인해 물 분자의 많은 양성자가 동시에 전처리되어 MRI에서 신호를 생성하게 되는데, T 가중치 영상에서는 물 양성자 간의 일치성이나 동기성의 상실을 측정하여 대비를 생성한다. 물이 자유롭게 넘어질 수 있는 환경에 있을 때, 휴식은 더 오래 걸리는 경향이 있다. 특정 임상 상황에서 이것은 병리학 영역과 주변의 건강한 조직 사이에 대비를 일으킬 수 있다.
MRI 영상을 확산에 감작하기 위해 자기장 강도(B1)는 펄스장 구배에 의해 선형적으로 변화한다. 전극은 자석 강도에 비례하기 때문에 양성자는 다른 속도로 전극을 시작하여 위상의 분산과 신호 손실을 초래한다. 또 다른 구배 펄스는 동일한 크기에서 적용되지만 스핀을 리포커스하거나 다시 소거하는 방향은 반대다. 펄스 간 시간 간격 동안 이동한 양성자에 대해서는 재결합이 완벽하지 않으며, MRI 기계로 측정한 신호가 감소한다. 이 "장 구배 펄스" 방법은 처음에 Stejskal과 Tanner가 NMR을 위해 고안한 것으로, 다음[10] 방정식을 통해 발생하는 확산 양과 관련된 펄스 구배 적용으로 인한 신호 감소를 유도하였다.
여기서 은 확산 가중이 없는 신호 강도, 은 경사가 있는 신호, 은 자력비, 은 경사가 있는 펄스 강도, 은 펄스의 지속시간이다.se, 은 두 펄스 사이의 시간이며, 으로 D{\}은 확산 효율적이다.
Stejskal 및 Tan에 따르면 확산 영상을 얻기 위해 이러한 신호 감쇠를 국소화하려면 MRI에 사용되는 펄스 자기장 그라데이션 펄스(신호의 위치화에 따라 발생하지만 이러한 그라데이션 펄스가 너무 약해 확산 관련 감쇠가 생성되지 않는다)와 추가적인 "모션 프로빙" 그라데이션 펄스를 결합해야 한다.괴짜 같은 방법 이 조합은 모든 구배 펄스 사이에 교차 단자가 발생하므로 사소한 것이 아니다. 그러면 Stejskal과 Tanner에 의해 설정된 방정식이 부정확해지고 MRI 시퀀스에 존재하는 모든 구배 펄스와 이들의 상호작용을 통합하여 분석적이든 수치적이든 신호 감쇠가 계산되어야 한다. 결과는 MRI 시퀀스에 존재하는 많은 펄스를 고려할 때 매우 빠르게 복잡해지고, 단순화로서 르비한은 신호 감쇠가 단순히 다음과 같이 되도록 "b 인자"(취득 파라미터에만 의존함)로 모든 그라데이션 항을 수집할 것을 제안했다.[1]
또한 확산 계수 D을를) 겉보기 확산 계수 D 로 대체하여 확산 과정이 조직에서 자유롭지 않지만 여러 메커니즘에 의해 방해되고 변조됨(폐쇄 공간에서의 제한, 장애물 주위의 고문도 등)과 인의 다른 원천을 나타낸다.작은 혈관의 혈류나 심실의 뇌척수액과 같은 트라복셀 일관성 없는 운동(IVIM)도 신호 감쇠에 기여한다. 마지막에 영상은 확산 프로세스에 의해 "가중치"된다. 그러한 확산 가중 영상(DWI)에서 신호는 확산 속도가 빠를수록 더 감쇠되고 b 계수는 더 크다. 그러나 그러한 확산가중 영상은 여전히 T1과 T2 이완도 대비에 민감하여 때때로 혼란스러울 수 있다. b 의 b {\} 2{\}}인 최소 2개의 다른 값을 가진 영상을 수집하여 "순수" 확산 맵(또는 ADC가 유일한 대비원인 ADC 지도)을 계산할 수 있다.
이러한 ADC 개념은 특히 임상적 용도에 있어 극히 성공적이었지만, 최근에는 생물학적 조직 내 보다 포괄적인 확산 모델이 도입되어 도전을 받고 있다. 이 모델들은 조직 내 확산이 자유롭지 않기 때문에 필요하게 되었다. 이 조건에서 ADC는 위의 방정식에서 예상한 바와 같이 ln(S/So)의 플롯이 b 요인과 선형적이지 않기 때문에 b 값(더 큰 b 값을 사용할 때 ADC가 감소하는 것처럼 보인다)의 선택에 의존하는 것처럼 보인다. ADC는 조직 미세구조의 변화에 매우 민감하기 때문에 자유확산행동으로부터의 이러한 편차가 확산 MRI를 매우 성공적으로 만드는 것이다. 반면, 조직 내 모델 확산은 매우 복잡해지고 있다. 가장 인기 있는 모델로는 느린 교환이나 중간 교환 시 2개의 워터풀의 존재를 가정하는 비덱스포넨셜 모델과 반드시 2개의 풀의 존재를 필요로 하지 [13][14][15]않는 누적 팽창(Curtosis라고도 함) 모델이 있다.
확산 모델
농도' {\과 flux J 의 농도를 고려할 때 Fick의 첫 번째 법칙은 flux와 농도 gradient 사이의 관계를 제공한다
여기서 D는 확산 계수다. 그런 다음 질량의 보존에 따라 연속성 방정식은 농도의 시간 파생물과 플럭스의 분산을 연관시킨다.
자기화 역학
확산이 존재하지 않는 상황에서 시간에 따른 핵자석화의 변화는 고전적인 Bloch 방정식에 의해 주어진다.
그것은 전치, T2 이완, T1 이완의 조건을 가지고 있다.
1956년, H.C. 토레이는 자기화를 위한 Bloch 방정식이 확산의 추가에 따라 어떻게 변화할지 수학적으로 보여주었다.[16] 토레이는 확산 용어와 공간적으로 변화하는 경사의 적용을 포함하도록 Bloch의 가로 자기화에 대한 원래 설명을 수정했다. 자기화 이(가) 벡터이기 때문에 각 차원마다 하나씩 3개의 확산 방정식이 있다. Bloch-Torrey 방정식은 다음과 같다.
여기서 → 은(는) 이제 확산 텐셔너가 된다.
확산이 등방성인 가장 단순한 경우 확산 텐서는 ID의 배수다.
그러면 Bloch-Torrey 방정식이 해결책을 가지고 있을 것이다.
지수 용어는 감쇠 로 지칭된다 비등방성 확산은 측정할 것이 겉보기 확산 계수(ADC)라는 점을 제외하고 확산 텐서에도 유사한 솔루션을 가질 것이다. 일반적으로 감쇠는 다음과 같다.
여기서 용어는 G G 를 구배열 필드를 포함한다
그레이스케일
DWI 영상의 표준 그레이스케일은 증가된 확산 제한을 더 밝게 나타내기 위한 것이다.[17]
ADC 이미지
외관확산계수(ADC) 영상 또는 ADC맵은 기존 DWI에 내재된 T2 가중치를 제거함으로써 기존 DWI보다 더 구체적으로 확산을 보여주는 MRI 영상이다.[18] [19]ADC 영상촬영은 DWI 가중치가 다른 여러 종래의 DWI 영상을 획득하여 그렇게 하고 신호의 변화는 확산 속도에 비례한다. DWI 영상에 비해 ADC 영상의 표준 그레이스케일은 더 어두운 만큼 더 작은 규모의 확산 정도를 나타내기 위한 것이다.[17]
뇌경색은 확산 제한으로 이어지며, 따라서 다양한 DWI 가중치를 가진 영상의 차이는 경색 부위에서 신호가 낮은 ADC 영상으로 이어진다.[18] ADC 감소는 뇌경색 후 몇 분 후에 감지될 수 있다.[20] 기존 DWI에서 경색 조직의 높은 신호는 부분 T2 가중치의 결과물이다.[21]
확산 텐서 이미징
확산 텐서 영상(DTI)은 단면 영상에서 픽셀에 대비나 색상을 할당하기 위한 목적으로만 이 데이터를 사용하는 대신 신경관 영상을 생성하기 위해 조직 내 물의 제한된 확산 측정을 가능하게 하는 자기공명영상 기법이다. 또한 전립선과 같은 다른 조직뿐만 아니라 심장 근육을 포함한 근육에 대한 유용한 구조적 정보를 제공한다.[22]
DTI에서 각 복셀에는 하나 이상의 매개변수 쌍이 있는데, 확산 속도와 선호되는 확산 방향(3차원 공간 측면에서 설명됨)이 해당 매개변수에 유효하다. 단일 DTI 영상의 각 복셀의 특성은 일반적으로 6개 이상의 서로 다른 확산 가중 수집에서 벡터 또는 텐서 산술에 의해 계산되며, 각각은 확산 감작 그라데이션의 다른 방향을 사용하여 얻는다. 어떤 방법에서는, 각각 완전한 이미지를 구성하는 수백 개의 측정이 단일 결과 계산된 영상 데이터 세트를 생성하기 위해 이루어진다. DTI 복셀의 높은 정보 함량은 뇌의 미묘한 병리학에 극도로 민감하게 만든다. 게다가 방향 정보를 더 높은 수준의 구조에서 이용하여 뇌를 통해 신경계를 선택하고 따를 수 있는데, 이는 트랙토그래피라고 불리는 과정이다.[23]
이미지 획득 프로세스에 대한 보다 정확한 설명은 물 분자가 확산되는 국소 미세 구조뿐만 아니라 강도(b-값)와 소위 자기 확산 경사의 방향에 따라 각 위치의 이미지 강도가 감쇠된다는 것이다. 이미지가 지정된 위치에 더 감쇠될수록 확산 구배 방향으로 더 큰 확산이 발생한다. 조직의 전체 확산 프로파일을 측정하기 위해서는 MR 스캔을 반복하여 각 스캔에 대해 확산 경사도의 다른 방향(그리고 가능한 강도)을 적용해야 한다.
수학적 기초—텐더
확산 MRI는 텐서라고 알려진 기하학적 양의 수학과 물리적 해석에 의존한다. 대칭행렬의 개념에 근거한, 일반적인 수학적 개념의 특별한 경우만이 이미징과 관련이 있다.[notes 1] 확산 그 자체는 시차적인 것이지만, 많은 경우에 목적은 실제로 세포당 뇌의 확산을 연구하려고 하는 것이 아니라, 단지 축의 방향과 음이소트로피의 크기나 정도를 알아내기 위한 목적으로 백색 물질에서의 확산 비등분포를 이용하려고 하는 것이다. 텐서들은 물질이나 조직에서 실제적인 물리적 존재를 가지고 있기 때문에 이를 설명하는 데 사용되는 좌표계가 회전할 때 움직이지 않는다. 텐서(2위)의 가능한 표현은 수없이 많지만, 이 가운데서도 확산과 물리적 관련성이 있고, MRI에서 확산 비이소트로피 영상 개발에서 역사적 의의 때문에 타원체에 초점을 맞춘다.
다음 행렬은 확산 텐서의 구성요소를 나타낸다.
같은 수의 행렬은 타원의 모양과 방향을 설명하기 위해 동시에 두 번째 용도를 가질 수 있고, 같은 수의 행렬은 아래에서 설명하는 것과 같이 행렬 수학이 고유 벡터와 고유값을 분류하기 위해 세 번째 방법으로 동시에 사용될 수 있다.
물리 텐서
물리 과학에 있어서 텐서라는 개념은 물리적인 성질의 양을 설명하려는 시도에서 발전했다. 이들이 처음 적용한 속성은 온도 등 단일 숫자로 설명할 수 있는 속성이었다. 이런 식으로 설명할 수 있는 성질을 스칼라라고 하는데, 이러한 성질을 0순위의 텐서 또는 0순서의 텐서라고 할 수 있다. 텐서는 또한 기계적 힘과 같이 방향성이 있는 양을 설명하는 데 사용될 수 있다. 이러한 수량은 규모와 방향 모두의 규격이 필요하며, 벡터로 표현되는 경우가 많다. 3차원 벡터는 x, y, z축에 투영하는 세 가지 요소로 설명할 수 있다. 이러한 종류의 벡터는 1순위 텐서 또는 1순위 텐서라고 할 수 있다.
텐서(tensor)는 종종 두 벡터 사이의 관계를 결정하는 물리적 또는 생물물리학적 특성이다. 어떤 물체에 힘이 가해지면, 움직임이 일어날 수 있다. 움직임이 단일 방향에 있는 경우, 변환은 벡터(등급 1의 텐서)를 사용하여 설명할 수 있다. 그러나 조직에서 확산은 시간이 지남에 따라 여러 방향으로 진행되는 궤도를 따라 물 분자의 이동으로 이어져 카르트 축에 복잡한 투영으로 이어진다. 이 패턴은 동일한 조건과 힘을 동일한 방법으로 동일한 조직에 가하면 재현할 수 있다. 만약 확산을 제약하는 조직의 내부 비등방성 조직이 있다면, 이 사실은 확산의 패턴에 반영될 것이다. 물 분자의 확산을 일으키는 추진력의 특성과 조직 내에서의 그 움직임의 결과적 패턴 사이의 관계는 텐서(tensor)로 설명할 수 있다. 이 물리적 특성의 분자 변위 수집은 각각 축 xx, yy, zz, xy, yx, xz, zz, zy의 한 쌍과 연관된 9개의 성분으로 설명할 수 있다.[24] 이것들은 이 섹션의 시작 부분에 있는 것과 유사한 행렬로 쓰여질 수 있다.
백색 물질의 비등방성 매체의 점원으로부터의 확산은 유사한 방식으로 작용한다. Stejskal Tanner 확산 경사로의 첫 번째 펄스는 일부 물 분자를 효과적으로 표시하며 두 번째 펄스는 확산으로 인한 변위를 효과적으로 보여준다. 적용된 각 구배 방향은 구배 방향을 따라 이동을 측정한다. 6개 이상의 그라데이션은 대각선 위와 아래(빨간색 첨자) 대칭이라고 가정하여 행렬을 채우는 데 필요한 모든 측정을 얻기 위해 합산된다.
1848년 앙리 후레우 데 세나르몽은[25] 왁스로 코팅한 광택 있는 수정 표면에 가열된 점을 도포했다. "등방성" 구조를 가진 어떤 물질에서는, 녹는 고리가 원 모양으로 표면을 가로질러 퍼져나가곤 했다. 비등방성 결정에서 스프레드는 타원의 형태를 취했다. 3차원에서 이 스프레드는 타원형이다. 1850년대에 아돌프 픽이 보여주었듯이 확산은 열의 전달에서 보이는 것과 같은 많은 패턴을 보여준다.
타원체 수학
이때 타원체의 수학을 고려하는 것이 도움이 된다. 타원체는 도끼2 + by2 + cz2 = 1이라는 공식으로 설명할 수 있다. 이 방정식은 4중 표면을 설명한다. a, b, c의 상대적 값은 사분위가 타원체 또는 하이퍼볼로이드를 설명하는지 여부를 결정한다.
밝혀진 바와 같이, 다음과2 같이 세 가지 성분을 더 추가할 수 있다: 축 + by2 + cz2 + dyz + ezx + fxy = 1. a, b, c, d, e, f의 많은 조합은 여전히 타원체를 설명하지만, 추가 성분(d, e, f)은 데카르트 좌표계의 직교 축에 상대적인 타원체의 회전을 설명한다. 이 6개의 변수는 이 조의 시작 부분에서 정의한 텐서 행렬과 유사한 행렬로 나타낼 수 있다(확산이 대칭적이므로, 그렇다면 우리는 9개의 성분 대신 6개만 있으면 된다-행렬의 대각선 원소 아래의 성분은 대각선 위의 성분과 동일하다). 이것은 2차 텐서 행렬의 성분이 타원체로 표현될 수 있다고 명시되었을 때 의미하는 것이다. 4차 타원체의 6개 항의 확산 값이 행렬에 배치되면 직교 격자로부터 타원체를 생성한다. 상대적인 음이소트로피가 높으면 그것의 모양은 더 길어질 것이다.
타원체/텐서가 행렬로 표현될 때, 우리는 표준 행렬 수학 및 선형 대수로부터 유용한 기법, 즉 행렬을 "대각화"하는 기법을 적용할 수 있다. 이것은 이미징에서 두 가지 중요한 의미를 갖는다. 그 아이디어는 모양은 같지만 크기와 방향이 다른 등가 타원체 두 개가 있다는 것이다. 첫 번째는 측정된 확산 타원체가 액손에 의해 결정되는 각도에 앉아 있고, 두 번째 타원체는 세 개의 카르테시안 축과 완벽하게 정렬되어 있다. "대각형화"라는 용어는 왼쪽 상단에서 오른쪽 하단으로 대각선을 따라 행렬의 세 가지 구성요소(이 조의 시작 부분에 빨간색 첨자가 있는 구성요소)를 가리킨다. 변수 도끼2, by2, cz는2 대각선(빨간색 첨자)을 따라 있지만 변수 d, e, f는 "오프 대각선"이다. 그러면 우리가 우리의 매트릭스를 다시 쓰고 그것을 단위 길이의 세 개의 다른 벡터로 곱한 새로운 매트릭스로 대체하는 벡터 처리 단계를 하는 것이 가능해진다(길이=1.0). 이 행렬은 대각선화되어 있는데, 이는 비대각선 구성 요소가 모두 0이기 때문이다. 이 등가 위치에 도달하기 위해 필요한 회전 각도는 이제 세 벡터에 나타나며 각 벡터의 x, y, z 성분으로 판독할 수 있다. 이 세 벡터는 "유전자 벡터" 또는 특성 벡터라고 불린다. 그것들은 원래 타원체의 방향 정보를 포함하고 있다. 타원체의 세 축은 현재 좌표계의 주요 직교 축을 바로 따라 있어서 우리는 그들의 길이를 쉽게 유추할 수 있다. 이러한 길이는 고유값 또는 특성 값이다.
행렬의 대각화는 두 번째 행렬과 함께 곱한 다음 두 번째 행렬의 역행렬로 곱할 수 있는 행렬을 발견함으로써 이루어진다. 여기서 세 개의 대각선(xx, yy, zz) 성분은 그 안에 숫자가 들어 있지만 다른 대각선 성분(xy, yz, zx)은 0인 새로운 행렬이다. 두 번째 행렬은 고유 벡터 정보를 제공한다.
비등도 및 확산도 측정
오늘날 임상 신경학에서는 다양한 뇌 병리학을 음이소트로피와 확산성의 특정 측정치를 살펴봄으로써 가장 잘 발견할 수 있다. 확산의 근본적인 물리적 과정은 물 분자 집단이 중심점에서 밖으로 이동하게 하고, 매질이 비등방성인 경우 타원체 표면에 점차 도달하게 한다(등방성 매체의 경우 구의 표면이 될 것이다). 타원형 형식주의는 텐서 데이터를 구성하는 수학적인 방법으로도 기능한다. 타원형 텐서의 측정은 조직의 각 복셀에서 확산 과정에 대한 정보를 수집하기 위해 소급 분석을 추가로 허용한다.[26]
뇌척수액과 같은 등방성 매체에서는 확산으로 물 분자가 움직이며 모든 방향에서 동일한 속도로 움직인다. 확산 그라데이션의 자세한 효과를 파악함으로써 우리는 MRI 복셀의 신호 감쇠를 확산의 수치인 확산 계수 D로 변환할 수 있는 공식을 생성할 수 있다. 세포막이나 미세관 등 각종 장벽과 제한요인이 자유확산을 방해할 때, 우리는 측정이 국소적 효과를 모두 놓치고 감쇠율을 모두 브라운 운동만으로 인한 것으로 취급하기 때문에 '유래확산계수', 즉 ADC를 측정하고 있다. 비등방성 조직의 ADC는 측정 방향에 따라 달라진다. 확산은 액손의 길이를 따라 빠르게(병렬) 확산되며 액손의 수직으로 천천히 확산된다.
복셀을 6개 이상의 방향에서 측정하고 T2 및 T1 효과로 인한 감쇠에 대해 보정했으면 계산된 타원형 텐서로부터 정보를 사용하여 복셀에서 일어나는 일을 설명할 수 있다. 데카르트 그리드에서 각도에 앉은 타원체를 고려할 경우 세 개의 축에 대한 타원 투영을 고려할 수 있다. 세 개의 투영은 세 개의 축 ADCx, ADCy, ADCz 각각을 따라 ADC를 제공할 수 있다. 이것은 복셀의 평균 확산성을 묘사하는 아이디어로 이어진다. 복셀의 평균 확산성은 단순하게 될 것이다.
우리는 등방성 확산 계수가 평균화된 비등방성 확산 계수임을 나타내기 위해 i 첨자를 사용한다.
타원체 자체는 주요한 긴 축과 그것의 폭과 깊이를 설명하는 두 개의 작은 축을 가지고 있다. 이 세 가지 모두 서로 수직이며 타원체의 중심점을 교차한다. 우리는 이 설정에서 축을 고유 벡터라고 부르고 그 길이의 측정치를 고유값이라고 부른다. 길이는 그리스 문자 λ으로 상징된다. 액손 방향을 따라 가리키는 긴 축은 λ이고1 작은 두 축은 길이 λ과2 λ을3 가진다. DTI 텐서 타원체 설정에서, 우리는 타원체의 세 가지 일차 축을 따라 각각의 확산성의 척도로 볼 수 있다. 이것은 축에 투영된 것이었기 때문에 ADC와는 조금 다른데, 반면 λ은 우리가 계산한 타원체의 실제 측정값이다.
주축을 따라 확산도인 λ을1 종방향 확산도 또는 축방향 확산도 또는 평행확산도 λ이라고도∥ 한다. 역사적으로 이것은 리차드가 1991년 벡터 길이로 원래 측정했던 것과 가장 가깝다.[27] 두 개의 작은 축의 확산도를 평균하여 방사형 확산도를 측정한다.
이 양은 막과 기타 효과로 인한 제한의 정도를 평가하는 것으로 일부 신경학적 조건에서 퇴행성 병리학의 민감한 척도로 판명된다.[28] 확산도(ivity 라고도 할 수 있다.
총 확산성을 요약하는 또 다른 일반적인 측정은 추적이다. 이 측정치는 세 개의 고유값을 합한 것이다.
여기서 은(는) 고유값 1 \{3을 대각 행렬이다.
이 합을 3으로 나누면 평균적인 차이점이 있다.
그 이후 ADC와i 동일하다.
여기서 은 고유 벡터의 행렬이고 은 확산 텐서입니다. 확산의 양을 설명하는 것 외에도 복셀에서 음이소트로피의 상대적인 정도를 설명하는 것이 종종 중요하다. 한 극단에서는 등방성 확산의 구체일 것이고, 다른 극단에서는 매우 얇은 프로이트 스피로이드 모양의 시가나 연필이 될 것이다. 타원체의 가장 긴 축을 가장 짧은 축 = (λ1/λ3)으로 나누어 가장 간단한 척도를 구한다. 그러나 이는 측정 소음에 매우 취약하다는 것을 입증하기 때문에, 소음을 최소화하면서 측정치를 포착하기 위해 점점 더 복잡한 조치를 개발하였다. 이러한 계산에서 중요한 요소는 확산도 차이의 제곱합 = (λ1 - λ2)2 + (λ1 - λ3)2 + (λ - λ) + (λ2 - λ3)2이다. 우리는 가장 큰 성분에 의해 지배되는 일종의 가중 평균을 얻기 위해 제곱합의 제곱근을 사용한다. 한 가지 목표는 복셀이 구형일 경우 숫자 0에 가깝게 유지하되, 길이가 길어질 경우 숫자 1에 가깝게 유지하는 것이다. 이는 확산도 차이의 제곱합(SRSS)의 제곱근인 부분 음이소트로피 또는 FA로 이어지고, 확산도의 SRSS로 나눈다. 두 번째와 세 번째 축이 주 축에 비해 작을 때 분자의 숫자는 분모에 있는 숫자와 거의 같다. / 2 를 곱하여 FA의 최대값이 1이 되도록 한다 FA의 전체 공식은 다음과 같다.
분수 음이소트로피는 확산 타원체의 "모양"에 따라 선형, 평면, 구형 측정으로도 분리할 수 있다.[29][30] 예를 들어, "시거" 모양의 프로이트 타원체는 강한 선형 음이소트로피를 나타내며, "비행접시" 또는 말살된 스피로드는 평면에서의 확산을 나타내며, 구체는 모든 방향에서 등방성 확산을 나타낸다.[31] 확산 벡터의 고유값을 2 3 { { { { { { { { { { { \ \ \lambda { { \{3 0로 정렬하면 다음과 같이 측정값을 계산할 수 있다.
선형 케이스의 경우 ≫ {\ _{
케이스의 경우, 1 2 3
구면 케이스의 경우, {\ _{
각 척도는 0과 1 사이에 있고 합쳐서 합치다. 구면 사례로부터의 편차를 설명하기 위해 추가적인 음이소트로피 측정을 사용할 수 있다.
사용된 음이소트로피의 다른 지표들이 있는데, 여기에는 상대적 음이소트로피(RA)가 포함된다.
및 볼륨 비율(VR):
적용들
이 섹션은 검증을 위해 추가 인용구가 필요하다. (2013년 12월)(이과 시기 |
전통적인 DTI가 가장 많이 적용되는 것은 급성 뇌허혈이다. DWI는 뇌경색에서 허혈성 괴사를 세포독성 부종의 형태로 직접 시각화하여 동맥 폐색 후 몇 분 이내에 높은 DWI 신호로 나타난다.[32][33] 관류 MRI가 경색된 코어와 인양 가능한 페넘브라를 모두 검출하면 DWI와 관류 MRI로 정량화할 수 있다.[34]
DWI의 또 다른 적용 분야는 종양학이다. 종양은 많은 경우에 세포가 높아서 물의 확산이 제한되어 DWI에서 비교적 높은 신호 강도로 나타난다.[35] DWI는 종양을 검출하고 스테이지하는 데 사용되며, 또한 시간이 지남에 따라 치료에 대한 종양 반응을 감시하는 데도 사용된다. 또한 DWI는 'Diffusion-weighted all-body [36]imaging with background body signal suppression'(DWIBS)이라는 기법을 사용하여 전신을 시각화하기 위해 수집할 수 있다. 확산촉진영상(DKI) 등 좀 더 전문화된 확산 MRI 기법도 항암화학요법에 대한 암 환자의 반응을 예측하는 것으로 나타났다.[37]
주된 적용은 백색 물질의 영상촬영에 있으며, 그 곳에서 분지의 위치, 방향 및 음이소트로피를 측정할 수 있다. 병렬 묶음으로 된 액손과 그 몰린 피복의 구조는 물 분자의 주된 방향을 따라 우선적으로 확산을 촉진한다. 이러한 우선 지향적인 확산을 비등방성 확산이라고 한다.

이 성질의 영상촬영은 확산 MRI의 확장이다. 일련의 확산 경사도(즉, MRI 자석의 자기장 변화)를 적용하여 최소한 3개의 방향 벡터를 결정할 수 있다면(다른 경사도 6개의 다른 경사도 최소값이며 추가 경사도 사용으로 "비대각" 정보의 정확도가 향상됨) 가능하다. 각 복셀에 대해 3차원 확산 형태를 설명하는 텐서(즉, 대칭 양정확정 3×3 행렬)를 계산한다. 섬유 방향은 텐서의 주요 고유 벡터로 표시된다. 이 벡터는 색상으로 코딩될 수 있으며, 트랙의 위치와 방향(좌우, 우우, 우우, 우우, 우우, 우후두의 경우 파랑, 전방-후두부의 경우 녹색)의 카토그래피를 산출할 수 있다.[38] 밝기는 주어진 복셀에서 음이소트로피의 정도를 스칼라 측정인 분수 음이소트로피에 의해 가중된다. 평균 확산도(MD) 또는 추적은 복셀 내의 총 확산에 대한 스칼라 측도다. 이러한 조치는 다른 형태의 임상 MRI에 나타나지 않는 백색 물질 병변을 국소화하는 데 임상적으로 일반적으로 사용된다.[39]
뇌에서 응용 프로그램:
- 외상 등 백색 물질 병변의 트랙별 국산화 및 확산 외상성 뇌손상의 심각도 정의. 백질 트레이(적외선, 편향)와 관련된 종양의 국산화(localization)는 가장 중요한 초기 적용 분야 중 하나이다. 뇌종양의 일부 유형에 대한 수술 계획에서 수술은 코티코스피탈과 종양의 근접성과 상대적 위치를 알면 도움이 된다.
- 확산 텐서 영상 데이터는 백질 내 트랙토그래피 수행에 사용할 수 있다. 섬유 추적 알고리즘은 전체 길이를 따라 섬유질을 추적하는 데 사용될 수 있다(예: 운동 피질에서 척수와 말초 신경으로 운동 정보가 전달되는 코티코스피탈 트랙). 트랙토그래피는 노화와 같은 백색 물질의 결손을 측정하는 데 유용한 도구다. 섬유 방향과 강도에 대한 그것의 추정은 점점 더 정확해지고, 인지 신경 과학과 신경 생물학 분야에서 광범위한 잠재적 시사점을 가지고 있다.
- 개발, 병리학, 퇴화에 있어 백질 평가를 위한 DTI의 사용은 2005년 이후 2,500개가 넘는 연구 간행물의 초점이 되어 왔다. 그것은 알츠하이머병과 다른 종류의 치매를 구별하는데 큰 도움이 될 것을 약속한다. 뇌 연구에 응용되는 것은 코넥토믹스뿐만 아니라 생체내 신경망의 조사도 포함한다.
주변 신경에 대한 적용:
- Brachial plexus: DTI는 (여기서 척수 및 쇄골 플렉서스의 트랙토그램과 3D 4k 재건술에 나타난 바와 같이) 정상적인 신경과[40] 외상적으로 손상된 신경 뿌리를 구별할 수 있다.[41]
- 큐비탈 터널 증후군: DTI(FA 및 RD)에서 도출된 측정기준은 팔꿈치[42] 척골신경이 압박된 성인들과 무증상 성인을 구별할 수 있다.
- 손목터널증후군: DTI(하위 FA 및 MD)에서 도출된 측정기준으로 건강한 성인과 손목터널증후군을[43] 가진 성인을 구별할 수 있다.
리서치즈
DTI 기반 트랙터그래피 개발 초기에 다수의 연구자가 확산 텐서 모델의 결함을 지적했다. 텐서 분석은 복셀을 통해 이동하는 모든 액손들이 정확히 같은 방향으로 이동하는 것처럼 각 이미징 복셀에 하나의 타원체가 있다고 가정한다.[44] 이것은 종종 사실이지만, 표준 해상도 뇌 영상에 있는 복셀의 30% 이상에서, 서로를 통과하는 서로 다른 방향으로 이동하는 적어도 두 개의 다른 신경 세포가 있다고 추정할 수 있다. 고전적인 확산 타원체 텐서 모델에서, 교차로의 정보는 단지 주어진 복셀에서 소음 또는 설명되지 않은 감소된 음이소트로피로 나타난다. 데이비드 터치는 이 문제에 대한 해결책을 가장 먼저 설명한 사람들 중 한 명이었다.[45][46] 그 아이디어는 개념적으로 각각의 이미지 복셀 주위에 일종의 지오데틱 돔을 배치함으로써 가장 잘 이해된다. 이 이코사면체는 복셀을 통해 많은 수의 고르게 간격을 두고 구배 궤도를 통과할 수 있는 수학적 근거를 제공한다. 이는 각각 이코사면체의 수표 중 하나와 일치한다. 기본적으로 우리는 이제 복셀을 다수의 다른 방향(일반적으로 40개 이상)에서 들여다볼 것이다. 우리는 "n-tuple" 테셀레이션을 사용하여 원래 아이코사슬론(20면)에 더 균일하게 간격을 두고 있는 유인물을 추가하는데, 이는 수십 년 전 엷은 자석학 연구에서도 선례가 있었던 아이디어다.[47] 우리는 단지 어떤 방향의 선들이 최대 비등방성 확산 대책을 세우는지 알고 싶을 뿐이다. 하나의 트랙이 있다면, 반대 방향을 가리키는 두 개의 맥시마가 있을 것이다. 복셀에 두 개의 곡선이 교차하면 두 쌍의 막시마 등이 있을 것이다. 우리는 여전히 최대치마를 사용하여 동일한 복셀에서 여러 개의 다른 텐서 타원체로 포장할 그라데이션 그룹을 선택하거나, 보다 복잡한 상위 텐서 분석을 사용할 수도 있고,[48] 또는 맥시마를 선택하고 트랙토그래피 작업을 계속하는 진정한 "모델 프리" 분석을 할 수도 있다.
트랙토그래피 Q-Ball 방법은 데이비드 터치가 텐서 모델에 대한 수학적 대안을 제시하는 구현이다.[49] 확산 비등변성 데이터를 텐서 그룹으로 강제하는 대신, 수학은 확률 분포와 거의 100년 전에 개발된 전형적인 기하 단층 촬영과 벡터 수학인 펑크 라돈 변환을 모두 배치한다.[50]
요약
DTI의 경우 일반적으로 선형대수학, 행렬수학, 벡터수학을 사용하여 텐서 데이터의 분석을 처리하는 것이 가능하다.
텐서 속성의 완전한 집합이 관심의 대상이 되는 경우도 있지만, 트랙터그래픽의 경우 대개 1차축이나 벡터의 크기와 방향만 알면 된다. 이 1차 축(길이 가장 큰 축)은 가장 큰 고유값이며 그 방향은 일치하는 고유 벡터로 인코딩된다. 가장 큰 고유값이 주된 축 방향과 일치하여 트랙토그래피를 달성한다고 가정하므로 하나의 축만 필요하다.
참고 항목
주석
참조
- ^ a b Le Bihan, D; E. Breton (1985). "Imagerie de diffusion in-vivo par résonance magnétique nucléaire". C R Acad Sci. 301 (15): 1109–1112.
- ^ Merboldt, K; Hanicke, W; Frahm, J (1985). "Self-diffusion NMR imaging using stimulated echoes". Journal of Magnetic Resonance. 64 (3): 479–486. Bibcode:1985JMagR..64..479M. doi:10.1016/0022-2364(85)90111-8.
- ^ Taylor, D G; Bushell, M C (1985). "The spatial mapping of translational diffusion coefficients by the NMR imaging technique". Physics in Medicine and Biology. 30 (4): 345–349. Bibcode:1985PMB....30..345T. doi:10.1088/0031-9155/30/4/009. PMID 4001161.
- ^ Wedeen, Van J.; Hagmann, Patric; Tseng, Wen-Yih Isaac; Reese, Timothy G.; Weisskoff, Robert M. (2005). "Mapping complex tissue architecture with diffusion spectrum magnetic resonance imaging". Magnetic Resonance in Medicine. 54 (6): 1377–86. doi:10.1002/mrm.20642. PMID 16247738. S2CID 8586494.
- ^ Wedeen, V.J.; Wang, R.P.; Schmahmann, J.D.; Benner, T.; Tseng, W.Y.I.; Dai, G.; Pandya, D.N.; Hagmann, P.; D'arceuil, H. (2008). "Diffusion spectrum magnetic resonance imaging (DSI) tractography of crossing fibers". NeuroImage. 41 (4): 1267–77. doi:10.1016/j.neuroimage.2008.03.036. PMID 18495497. S2CID 2660208.
- ^ Le Bihan, D; Breton, E; Lallemand, D; Grenier, P; Cabanis, E; Laval-Jeantet, M (1986). "MR imaging of intravoxel incoherent motions: application to diffusion and perfusion in neurologic disorders". Radiology. 161 (2): 401–7. doi:10.1148/radiology.161.2.3763909. PMID 3763909.
- ^ a b Zhang, Yudong; Wang, Shuihua; Wu, Lenan; Huo, Yuankai (Jan 2011). "Multi-channel diffusion tensor image registration via adaptive chaotic PSO". Journal of Computers. 6 (4): 825–829. doi:10.4304/jcp.6.4.825-829.
- ^ King, MD; Houseman, J; Roussel, SA; van Bruggen, N; Williams, SR; Gadian, DG (1994). "q-Space imaging of the brain". Magn Reson Med. 32 (6): 707–13. doi:10.1002/mrm.1910320605. PMID 7869892. S2CID 19766099.
- ^ Posse, S; Cuenod, CA; Le Bihan, D (1993). "Human brain: proton diffusion MR spectroscopy". Radiology. 188 (3): 719–25. doi:10.1148/radiology.188.3.8351339. PMID 8351339.
- ^ Stejskal, E. O.; Tanner, J. E. (1 January 1965). "Spin Diffusion Measurements: Spin Echoes in the Presence of a Time-Dependent Field Gradient". The Journal of Chemical Physics. 42 (1): 288. Bibcode:1965JChPh..42..288S. doi:10.1063/1.1695690.
- ^ Niendorf T, Dijkhuizen RM, Norris DG, van Lookeren Campagne M, Nicolay K (1996). "Biexponential Diffusion Attenuation in Various States of Brain Tissue : Implications for Diffusion-Weighted Imaging". Magnetic Resonance in Medicine. 36 (6): 847–857. doi:10.1002/mrm.1910360607. PMID 8946350. S2CID 25910939.
- ^ Karger, J; Pfeifer, H; Heink, W (1988). Principles and application of self-diffusion measurements by nuclear magnetic resonance. Advances in Magnetic Resonance. Advances in Magnetic and Optical Resonance. Vol. 12. pp. 1–89. doi:10.1016/b978-0-12-025512-2.50004-x. ISBN 9780120255122.
- ^ Liu, C; Bammer, R; Moseley, ME (2003). "Generalized Diffusion Tensor Imaging (GDTI): A Method for Characterizing and Imaging Diffusion Anisotropy Caused by Non-Gaussian Diffusion". Israel Journal of Chemistry. 43 (1–2): 145–54. doi:10.1560/HB5H-6XBR-1AW1-LNX9.
- ^ Chabert, S; Mecca, CC; Le Bihan D (2004). "Relevance of the information about the diffusion distribution in invo given by kurtosis in q-space imaging". Proceedings, 12th ISMRM Annual Meeting, (Kyoto): 1238.
- ^ Jensen, JH; Helpern, JA; Ramani, A; Lu, H; Kaczynski, K (2005). "Diffusional kurtosis imaging: the quantification of non-gaussian water diffusion by means of magnetic resonance imaging". Magnetic Resonance in Medicine. 53 (6): 1432–40. doi:10.1002/mrm.20508. PMID 15906300. S2CID 11865594.
- ^ Torrey, H. C. (1956). "Bloch Equations with Diffusion Terms". Physical Review. 104 (3): 563–565. Bibcode:1956PhRv..104..563T. doi:10.1103/PhysRev.104.563.
- ^ a b "Restricted Diffusion". mriquestions.com/. Retrieved 2018-03-15.
- ^ a b Mark Hammer. "MRI Physics: Diffusion-Weighted Imaging". XRayPhysics. Retrieved 2017-10-15.
- ^ "Apparent Diffusion Coefficient - an overview ScienceDirect Topics". www.sciencedirect.com. Retrieved 2021-04-02.
- ^ An, H.; Ford, A. L.; Vo, K.; Powers, W. J.; Lee, J.-M.; Lin, W. (2011). "Signal Evolution and Infarction Risk for Apparent Diffusion Coefficient Lesions in Acute Ischemic Stroke Are Both Time- and Perfusion-Dependent". Stroke. 42 (5): 1276–1281. doi:10.1161/STROKEAHA.110.610501. ISSN 0039-2499. PMC 3384724. PMID 21454821.
- ^ Sandeep Bhuta. "Diffusion weighted MRI in acute stroke". Radiopaedia. Retrieved 2017-10-15.
- ^ Manenti; Carlani, M; Mancino, S; Colangelo, V; Di Roma, M; Squillaci, E; Simonetti, G (2007). "Diffusion tensor magnetic resonance imaging of prostate cancer" (PDF). Investigative Radiology. 42 (6): 412–9. doi:10.1097/01.rli.0000264059.46444.bf. hdl:2108/34611. PMID 17507813. S2CID 14173858.
- ^ Basser, P. J.; Pajevic, S.; Pierpaoli, C.; Duda, J.; Aldroubi, A. (2000-10-01). "In vivo fiber tractography using DT-MRI data". Magnetic Resonance in Medicine. 44 (4): 625–632. doi:10.1002/1522-2594(200010)44:4<625::AID-MRM17>3.0.CO;2-O. ISSN 0740-3194. PMID 11025519.
- ^ Nye JF (1957). "Physical Properties of Crystals: Their Representations by Tensors and Matrices". Oxford University Press.
{{cite journal}}: Cite 저널은 필요로 한다.journal=(도움말) - ^ de Sénarmont HH (1848). "Mémoire sur la conductibilité des substances cristalisées pour la chaleur". Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences. 25: 459–461.
- ^ Le Bihan, D; Mangin JF; Poupon C; Clark CA; Pappata S; Molko N (2001). "Diffusion Tensor Imaging: Concepts and Applications". JMRI. 66 (13): 534–546.
- ^ Richards TL, Heide AC, 츠루다 JS, Alvord EC: 실험 알레르기 뇌동염에서 확산 영상의 벡터 분석. 베를린의 의학 자기공명학회에서 발표, SMRM Procedures 11:412, 1992 (abstr)
- ^ Vaillancourt DE, Spraker MB, Prodoehl J, et al. (2009). "High-resolution diffusion tensor imaging in the substantia nigra of de novo Parkinson disease". Neurology. 72 (16): 1378–1384. doi:10.1212/01.wnl.0000340982.01727.6e. PMC 2677508. PMID 19129507.
- ^ Westin CF, Peled S, Gudbjartsson H, Kikinis R, Jolesz FA. 텐서 기반 분석을 통한 MRI의 기하학적 확산 측정. ISMRM '97년에. 1997;1742년 캐나다 밴쿠버
- ^ 웨스틴 CF, 마이어 SE, 마마타 H, 나바비 A, 졸레스 FA, 키키니스 R. 확산 텐서 MRI의 처리 및 시각화. 의료 영상 분석 2002;6(2):93-108.
- ^ Andrew L. Alexander (2008). "Diffusion Tensor Imaging of the Brain". Neurotherapeutics. 4 (3): 316–29. doi:10.1016/j.nurt.2007.05.011. PMC 2041910. PMID 17599699.
- ^ Grand, S.; Tahon, F.; Attye, A.; Lefournier, V.; Le Bas, J.-F.; Krainik, A. (2013). "Perfusion imaging in brain disease". Diagnostic and Interventional Imaging. 94 (12): 1241–1257. doi:10.1016/j.diii.2013.06.009. ISSN 2211-5684. PMID 23876408.
- ^ Yuranga Weerakkody; Frank Gaillard; et al. "Ischaemic stroke". Radiopaedia. Retrieved 2017-10-15.
- ^ Chen, Feng (2012). "Magnetic resonance diffusion-perfusion mismatch in acute ischemic stroke: An update". World Journal of Radiology. 4 (3): 63–74. doi:10.4329/wjr.v4.i3.63. ISSN 1949-8470. PMC 3314930. PMID 22468186.
- ^ Koh, Dow-Mu; Collins, David J. (June 2007). "Diffusion-Weighted MRI in the Body: Applications and Challenges in Oncology". American Journal of Roentgenology. 188 (6): 1622–1635. doi:10.2214/AJR.06.1403. ISSN 0361-803X. PMID 17515386.
- ^ Takahara, Taro; Kwee, Thomas C. (2010), "Diffusion-Weighted Whole-Body Imaging with Background Body Signal Suppression (DWIBS)", Medical Radiology, Springer Berlin Heidelberg, pp. 227–252, doi:10.1007/978-3-540-78576-7_14, ISBN 9783540785750
- ^ Deen, SS; Priest, AN; McLean, MA; Gill, AB; Brodie, C; Crawford, R; Latimer, J; Baldwin, P; Earl, HM; Parkinson, C; Smith, S; Hodgkin, C; Patterson, I; Addley, H; Freeman, S; Moyle, P; Jimenez-Linan, M; Graves, MJ; Sala, E; Brenton, JD; Gallagher, FA (24 July 2019). "Diffusion kurtosis MRI as a predictive biomarker of response to neoadjuvant chemotherapy in high grade serous ovarian cancer". Scientific Reports. 9 (1): 10742. Bibcode:2019NatSR...910742D. doi:10.1038/s41598-019-47195-4. PMC 6656714. PMID 31341212.
- ^ Makris, N.; Worth, A. J.; Sorensen, A. G.; Papadimitriou, G. M.; Wu, O.; Reese, T. G.; Wedeen, V. J.; Davis, T. L.; Stakes, J. W. (1997-12-01). "Morphometry of in vivo human white matter association pathways with diffusion-weighted magnetic resonance imaging". Annals of Neurology. 42 (6): 951–962. doi:10.1002/ana.410420617. ISSN 0364-5134. PMID 9403488. S2CID 18718789.
- ^ Edward Soll (2015). "DTI (Quantitative), a new and advanced MRI procedure for evaluation of Concussions".
- ^ Wade, Ryckie G.; Whittam, Alexander; Teh, Irvin; Andersson, Gustav; Yeh, Fang-Cheng; Wiberg, Mikael; Bourke, Grainne (9 October 2020). "Diffusion tensor imaging of the roots of the brachial plexus: a systematic review and meta-analysis of normative values". Clinical and Translational Imaging. 8 (6): 419–431. doi:10.1007/s40336-020-00393-x. PMC 7708343. PMID 33282795.
- ^ Wade, Ryckie G.; Tanner, Steven F.; Teh, Irvin; Ridgway, John P.; Shelley, David; Chaka, Brian; Rankine, James J.; Andersson, Gustav; Wiberg, Mikael; Bourke, Grainne (16 April 2020). "Diffusion Tensor Imaging for Diagnosing Root Avulsions in Traumatic Adult Brachial Plexus Injuries: A Proof-of-Concept Study". Frontiers in Surgery. 7: 19. doi:10.3389/fsurg.2020.00019. PMC 7177010. PMID 32373625.
- ^ Breitenseher, Julia B.; Kranz, Gottfried; Hold, Alina; Berzaczy, Dominik; Nemec, Stefan F.; Sycha, Thomas; Weber, Michael; Prayer, Daniela; Kasprian, Gregor (July 2015). "MR neurography of ulnar nerve entrapment at the cubital tunnel: a diffusion tensor imaging study". European Radiology. 25 (7): 1911–1918. doi:10.1007/s00330-015-3613-7. PMID 25680717. S2CID 26019318.
- ^ Liu, C.; Li, H.W.; Wang, L.; Zhu, L.; Jiang, X.F.; Yang, M.J.; Li, B.; Zhang, C.; Yang, H.F.; Xu, X.X. (December 2018). "Optimal parameters and location for diffusion tensor imaging in the diagnosis of carpal tunnel syndrome: a meta-analysis". Clinical Radiology. 73 (12): 1058.e11–1058.e19. doi:10.1016/j.crad.2018.08.015. PMID 30314809.
- ^ Tuch DS (2004). "Q-Ball Imaging". Magn. Reson. Med. 52 (6): 1358–1372. doi:10.1002/mrm.20279. PMID 15562495. S2CID 1368461.
- ^ Tuch DS, Weisskoff RM, Belliveau JW, Wedeen VJ (1999). "High angular resolution diffusion imaging of the human brain". Proceedings of the 7th Annual Meeting of the ISMRM, Philadelphia.
- ^ Tuch DS, Reese TG, Wiegell MR, et al. (2002). "High angular resolution diffusion imaging reveals intravoxel white matter fiber heterogeneity". Magn. Reson. Med. 48 (4): 577–582. doi:10.1002/mrm.10268. PMID 12353272. S2CID 2048187.
- ^ Hext GR (1963). "The estimation of second-order tensors with related tests and designs". Biometrika. 50 (3–4): 353–373. doi:10.1093/biomet/50.3-4.353.
- ^ Basser PJ, Pajevic S (2007). "Spectral decomposition of a 4th-order covariance tensor: applications to diffusion tensor MRI". Signal Processing. 87 (2): 220–236. CiteSeerX 10.1.1.104.9041. doi:10.1016/j.sigpro.2006.02.050.
- ^ Tuch DS (2004). "Q-Ball imaging". Magn. Reson. Med. 52 (6): 1358–1372. doi:10.1002/mrm.20279. PMID 15562495. S2CID 1368461.
- ^ Funk P (1919). "Uber eine geometrische Anwendung der Abelschen Integralgleichnung". Math. Ann. 77: 129–135. doi:10.1007/BF01456824. S2CID 121103537.
외부 링크
| 위키미디어 커먼스는 확산 자기공명영상 관련 매체를 보유하고 있다. |


![\frac{S(TE)}{S_0} = \exp \left[ -\gamma^2 G^2\delta^2 \left( \Delta-\frac{\delta}{3}\right)D \right]](https://wikimedia.org/api/rest_v1/media/math/render/svg/355575bbfbd0924e1f733841cfe4a022aafba8e0)
 확산 가중이 없는 신호 강도,
확산 가중이 없는 신호 강도,  경사가 있는 신호,
경사가 있는 신호, 
 경사가 있는 펄스 강도,
경사가 있는 펄스 강도,  펄스의 지속시간이다.se,
펄스의 지속시간이다.se,  두 펄스 사이의 시간이며,
두 펄스 사이의 시간이며, 




![\mathrm{ADC}(x,y,z)= \ln [S_2(x,y,z)/S_1(x,y,z)]/(b_1-b_2)](https://wikimedia.org/api/rest_v1/media/math/render/svg/c9abbc60b76bb6bec8785ad650ea4693ee645b4e)
 flux J
flux J 






 (는) 이제 확산 텐셔너가 된다.
(는) 이제 확산 텐셔너가 된다. 




















 고유 벡터의 행렬이고
고유 벡터의 행렬이고 
![{\displaystyle \mathrm {FA} ={\frac {\sqrt {3((\lambda _{1}-\operatorname {E} [\lambda ])^{2}+(\lambda _{2}-\operatorname {E} [\lambda ])^{2}+(\lambda _{3}-\operatorname {E} [\lambda ])^{2})}}{\sqrt {2(\lambda _{1}^{2}+\lambda _{2}^{2}+\lambda _{3}^{2})}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a6b99560a24b2b57e604ec988e52d9c379b10219)



