디에틸에테르
Diethyl ether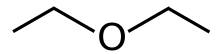 | |
 | |
| 이름 | |
|---|---|
| 우선 IUPAC 이름 에톡시에탄 | |
| 기타 이름 디에틸에테르, 데테르, 에틸에테르, 에틸옥시드, 3-옥사펜탄, 에톡시에탄, 디에틸옥시드, 용매에테르, 황산에테르, 유리산에테르, 유리산에테르, 유리올의 단유 | |
| 식별자 | |
3D 모델(JSmol) | |
| 1696894 | |
| 체비 | |
| 첸블 | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.000.425 |
| EC 번호 |
|
| 25444 | |
| 케그 | |
PubChem CID | |
| RTECS 번호 |
|
| 유니 | |
| UN 번호 | 1155 |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| C4H10O | |
| 몰 질량 | 74.123 g/g−1/g |
| 외모 | 무색 액체 |
| 냄새 | 건조하고 럼주 같은 달콤한 냄새[1] |
| 밀도 | 0.7134 g/cm3, 액체 |
| 녹는점 | -116.3°C(-177.3°F, 156.8K) |
| 비등점 | 34.6°C(94.3°F, 307.8K)[4] |
| 6.05g/100mL[2] | |
| 로그 P | 0.98[3] |
| 증기압 | 20°C에서 440mmHg(20°[1]C에서 58.66kPa) |
자화율(δ) | - 55.1 · 10−6 cm3 / 세로 |
굴절률(nD) | 1.353 (20 °C) |
| 점성 | 0.224 cP(25 °C) |
| 구조. | |
| 1.15 D(가스) | |
| 열화학 | |
열용량 (C) | 172.5 J/mol·K |
표준 어금니 엔트로피 (S | 253.5 J/mol·K |
표준 엔탈피/ 형성 (δHf⦵298) | - 271.2 ± 1.9 kJ/mol |
표준 엔탈피/ 연소 (δHc⦵298) | - 2732.1 ± 1.9 kJ/mol |
| 약리학 | |
| N01AA01(WHO) | |
| 위험 요소 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 요소 | 가연성이 매우 높고 피부에 유해하며 공기와[1] 빛에서 폭발성 과산화물로 분해됩니다. |
| GHS 라벨링: | |
  | |
| 위험. | |
| H224, H302, H336 | |
| P210, , , , , , , , , , , , , , , , , , , | |
| NFPA 704(파이어 다이아몬드) | |
| 플래시 포인트 | -45 °C (-49 °F, 228 [7]K) |
| 160°C(320°F, 433K)[7] | |
| 폭발 한계 | 1.9~48.0%[5] |
| 치사량 또는 농도(LD, LC): | |
LC50(중간 농도) | 73,000ppm (rat, 2시간) 6500ppm (표준, 1.65시간)[6] |
LCLo(최저 공개) | 106,000ppm (표준) 76,000ppm (개)[6] |
| NIOSH(미국 건강 노출 제한): | |
PEL(허용) | TWA 400ppm (1,200mg/m3)[1] |
REL(권장) | 확립된[1] REL 없음 |
IDLH(즉시 위험) | 1900ppm[1] |
| 안전 데이터 시트(SDS) | 외부 MSDS |
| 관련 화합물 | |
관련 이더넷 | 디메틸 에테르 메톡시프로판 |
관련 화합물 | 황화 디에틸 부타놀(이성체) |
| 보충 데이터 페이지 | |
| 디에틸에테르(데이터 페이지) | |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
디에틸에테르 또는 간단히 에테르(Ether)는 식(CH
2
5)
2O)을 가진 에테르급 유기 화합물이며 EtO로
2 약칭되기도 한다.무색, 휘발성, 달콤한 냄새("이탈 냄새")로 매우 가연성이 높은 액체입니다.일반적으로 실험실에서 용매로 사용되며 일부 엔진의 시동 오일로 사용됩니다.할로탄과 같은 불연성 약물이 개발되기 전까지는 전신 마취제로 사용되었다.그것은 취기를 유발하는 오락약으로 사용되어 왔다.
생산.
디에틸에테르 대부분은 에틸렌의 기상 수화 작용으로 에탄올을 만드는 부산물로 생산된다.이 과정은 고체 지지 인산 촉매를 사용하며 필요에 따라 [8]더 많은 에테르를 생성하도록 조정할 수 있습니다.일부 알루미나 촉매에 대한 에탄올의 기상 탈수는 [9]최대 95%의 디에틸 에테르 수율을 제공할 수 있습니다.
디에틸에테르를 산 에테르 [10]합성에 의해 실험실 및 산업 규모로 제조할 수 있다.에탄올은 강한 산(일반적으로 황산, HSO24)과 혼합됩니다.이 산은 수성 환경에서 수소 이온인3+ HO를 생성하는 해리성 물질입니다.수소 이온은 에탄올의 전기 음성 산소 원자를 양성자로 만들어 에탄올 분자에 양전하를 제공합니다.
- CHHOH32 + HO3+ → CHHOH32 + 2 + HO2
양성자화된(친전자성) 에탄올 분자로부터 물 분자를 치환하여 하이드로늄 이온을 개질하여 디에틸 에테르를 생성한다.
- CHHOH32+2 + CHHOH32 → HO3+ + CHCHOCH3223
제거 생성물(에틸렌)이 반응의 산물이 되지 않도록 하려면 150 °C 미만의 온도에서 이 반응을 수행해야 합니다.고온에서는 에탄올이 탈수되어 에틸렌이 형성됩니다.디에틸에테르를 만드는 반응은 가역적이기 때문에 결국 반응물과 생성물 사이의 평형을 이룬다.에테르를 잘 산출하려면 르 샤틀리에의 [citation needed]원리를 이용하여 에테르를 에탄올로 되돌리기 전에 반응 혼합물에서 증류시켜야 합니다.
에테르 제조에 사용할 수 있는 또 다른 반응은 윌리엄슨 에테르 합성이다.윌리엄슨 에테르 합성에서는 알콕시드(사용되는 알코올 중 알칼리 금속을 용해하여 생성됨)가 알킬 [citation needed]할로겐화물에 친핵 치환을 실시한다.
사용하다
셀룰로오스 아세테이트와 [8]같은 셀룰로오스 플라스틱의 생산에서 용매로서 특히 중요합니다.
연료
디에틸 에테르에는 85~96의 높은 세탄수가 있으며 휘발성이 높고 섬광점이 낮기 때문에 가솔린 및 디젤[11] 엔진용 석유 증류액과 함께 시동 유체로 사용됩니다.Ether 시동 오일은 영하 온도에서 엔진을 냉간 시동하는 데 도움이 되기 때문에 추운 기후의 국가에서 판매 및 사용됩니다.같은 이유로 카뷰레드 압축 점화 모델 엔진의 연료 혼합물의 구성 요소로도 사용됩니다.이런 식으로 디에틸에테르와 그 전구체 중 하나인 [citation needed]에탄올은 매우 유사하다.
화학
디에틸에테르(Dietyl ether)는 요오드, 페놀, 트리메틸알루미늄과 같은 다양한 루이스산과 반응하는 경질 Lewis 염기이며 ECW 모델의 기본 매개변수는 EB = 1.80, CB = 1.63이다.디에틸에테르란 일반적인 실험실용 비프로톤 용매입니다.물(25°C에서[2] 6.05g/100ml)에서 용해도 제한이 있으며, 25°[12]C에서 1.5g/100g(1.0g/100ml)의 물을 녹인다.이는 높은 휘발성과 함께 액체 추출 시 비극성 용매로 사용하기에 이상적입니다.디에틸에테르층은 물보다 밀도가 낮기 때문에 수용액과 함께 사용하면 맨 위에 놓인다.또한 유기 금속 시약과 관련된 다른 반응과 더불어 그리냐르 반응의 일반적인 용매이기도 합니다.이는 불법물질 제조에 적용되기 때문에 아세톤, 톨루엔, [13]황산 등의 물질뿐만 아니라 마약 및 향정신성물질의 불법거래방지 협약에 따른 표 II 전구물질에 등재되어 있다.
마취
William T. G. Morton은 1846년 10월 16일 매사추세츠 주 보스턴의 Ether 돔에서 열린 에테르 마취의 공개 시연에 참여했습니다.그러나 크로포드 윌리엄슨 롱은 1842년 3월 30일 조지아 주 공무원들에게 수술용 전신마취제로 개인적으로 사용한 것으로 알려졌으며 롱은 보스턴 시위 [14][15][16]전 6차례에 걸쳐 에테르를 수술용 마취제로 사용한 사실을 공개적으로 입증했다.영국 의사들은 1840년 초에 에테르가 아편과 [17]함께 널리 처방된 마취 성질을 알고 있었다.디에틸 에테르는 에테르의 보다 유리한 치료 지수, 즉 유효 용량과 잠재적으로 독성 [18]용량 간의 차이가 크기 때문에 클로로포름의 전신 마취제 사용을 대체했다.
디에틸에테르는 심근을 수축시키지 않고 오히려 교감신경계를 자극하여 고혈압과 빈맥을 일으킨다.바로수용체 [19]반사를 유지하므로 충격 환자에게 안전하게 사용됩니다.심근 우울증과 호흡 구동에 미치는 영향이 미미할 뿐 아니라 저렴한 비용과 높은 치료 지수로 인해 개발도상국에서 [20]지속적으로 사용할 수 있습니다.디에틸에테르를 클로로포름과 같은 다른 마취제와 혼합하여 C.E. 혼합물을 만들거나 클로로포름과 알코올을 혼합하여 A.C.E. 혼합물을 만들 수도 있습니다.21세기에는 에테르를 거의 사용하지 않는다.인화성 에테르 사용은 불소화 탄화수소 마취제로 대체되었다.할로탄은 이러한 마취제가 최초로 개발되었으며 현재 사용되는 이소플루란, 데스플루란 및 세보플루란과 같은 흡입 마취제는 할로겐화 [21]에테르이다.디에틸에테르에는 마취 후 메스꺼움과 구토와 같은 바람직하지 않은 부작용이 있는 것으로 밝혀졌다.현대 마취제는 이러한 [14]부작용을 줄여준다.
2005년 이전에는 [22][23]마취제로 사용되는 세계보건기구의 필수 의약품 목록에 있었다.
약
에테르는 한때 의약품에 사용되었다.알코올과 에테르의 혼합물, 디에틸 에테르의 한 부분과 에탄올의 세 부분은 "에테르의 스피릿", 호프만의 아노다인 또는 호프만의 드롭스로 알려져 있습니다.전 6월 1917,[24]에 대한 연구 윌리엄 프록터, 주니어가 미국 저널 약국의 이른 시간에서 1852년으로 출판되다는 공식 속으로 국제 조제서 사이에는 차이가 상업적 제조 업체들 사이에서 발견될 것으로 나타났다 미국에서는 이 혼합물은 약국방에서 어떤 점에서와 H에서 제거되었다쉬는인간의 독창적인 [25]요리법그것은 또한 비강에 [26]링거를 주입하여 딸꾹질을 치료하는데도 사용된다.
레크리에이션
에테르의 마취와 중독 효과는 그것을 오락약으로 만들었다.디에틸에테르 마취제는 오랜 레크리에이션 사용 역사를 가진 흡입제이다.한 가지 단점은 특히 산소와 함께 가연성이 높다는 것입니다.한 가지 장점은 치료용량과 독성량 사이의 명확한 여유입니다. 이는 혈액에 용해된 에테르가 위험한 수준에 도달하기 전에 의식을 잃을 수 있다는 것을 의미합니다.에테르는 강하고 진한 냄새로 호흡기 점막에 자극을 주고 호흡이 불편하며 과다 복용 시 침, 구토, 기침 또는 경련을 일으킨다.공기 중 3~5%의 농도에서는 체중과 신체 상태에 따라 약 15~20ml의 에테르를 흡입하면 마취 효과가 서서히 달성될 수 있다.에테르는 블랙아웃 [citation needed]전에 매우 긴 들뜸 단계를 일으킨다.
에테르를 레크리에이션적으로 사용하는 것은 19세기에 에테르 플레이라고 불리는 파티에서도 일어났는데, 이 파티에서는 손님들이 치료적인 양의 디에틸 에테르나 아산화질소를 흡입하도록 장려되어 들뜬 상태를 만들어냈다.롱은 동료 치과의사 호레이스 웰스, 윌리엄 에드워드 클라크, 윌리엄 T. G. 모튼과 함께 이러한 모임에서 사람들은 종종 경미한 부상을 경험하지만, 부상에 대한 반응이나 일어난 일에 대한 기억을 보이지 않는 것으로 나타나 에테르의 마취 [27]효과를 보여주었다.
19세기와 20세기 초에 에테르 음주는 폴란드 [28]농부들 사이에서 유행했다.그것은 렘코들 [29]사이에서 전통적이고 여전히 비교적 인기 있는 레크리에이션 약물이다.보통 우유, 설탕물 또는 오렌지 주스를 샷 글라스에 부어서 소량(크로프카 또는 "도트")으로 소비합니다.약물로써, 그것은 때때로 [30][medical citation needed]에테로마니아라고 불리는 심리적 의존을 일으키는 것으로 알려져 왔다.
대사
디에틸에테르를 [31]대사하기 위해 시토크롬 P450 효소를 제안한다.
디에틸에테르는 알코올 탈수소효소를 억제하여 [32]에탄올의 신진대사를 느리게 한다.또한 산화대사를 필요로 하는 다른 약물의 대사도 억제한다.예를 들어 디아제팜은 간 산화를 필요로 하지만 산화대사물 옥사제팜은 그렇지 않다.[33]
안전성과 안정성
디에틸에테르(Dietyl Ether)는 가연성이 매우 높으며 폭발성 증기/[34]공기 혼합물을 형성할
에테르는 공기보다 무겁기 때문에 지상으로 낮게 모을 수 있으며 증기는 점화원까지 상당한 거리를 이동할 수 있습니다.에테르는 가연성이 높기 때문에 점화 시 불꽃이 필요하지 않지만, 불꽃에 노출되면 발화됩니다.가능한 다른 점화원에는 스위치 또는 [34]콘센트에 의해 생성된 열판, 증기 파이프, 히터 및 전기 아크가 포함되지만 이에 한정되지 않습니다.에테르를 한 용기에서 다른 용기로 주입할 때 축적될 수 있는 정전기에 의해 증기가 점화될 수도 있습니다.디에틸 에테르의 자동 점화 온도는 160°C(320°F)입니다.공기 중의 디에틸 에테르 확산은 9.18 × 10−62 m/s(298 K, 101.325 kPa)[citation needed]이다.
에테르는 빛과 공기에 민감하여 폭발성 [34]과산화물을 생성하는 경향이 있습니다.에테르 과산화물은 에테르보다 끓는점이 높으며 건조 [34]시 접촉 폭발물이다.상업용 디에틸에테르에는 일반적으로 미량의 항산화제 부틸화 히드록시톨루엔(BHT)이 공급되어 과산화물의 형성을 감소시킨다.수산화나트륨 이상의 저장은 중간 에테르 하이드로페록시드를 침전시킨다.물과 과산화물은 나트륨과 벤조페논에서 증류하거나 활성 알루미나 [35]기둥을 통해 제거할 수 있습니다.
역사
이 화합물은 8세기[36] 자비르 이븐 헤이얀이나 1275년 [36][37]라몬 룰에 의해 합성되었을 수 있다.1540년 발레리우스 코르두스에 의해 합성되었는데, 그는 그것을 "독성의 달콤한 기름"이라고 불렀다.-이 이름은 에탄올과 황산의 혼합물을 증류하여 얻은 사실을 반영하며, 그 약효에 [36]대해 언급했다.동시에 파라셀수스는 [36]개에서 분자의 진통제 특성을 발견했다.에테르라는 이름은 August Sigmund Frobenius에 [38]의해 1729년에 붙여졌다.
약 1800년에 그 생각이 반증되기 전까지 그것은 유황 화합물로 여겨졌다.[39]
레퍼런스
- ^ a b c d e f NIOSH Pocket Guide to Chemical Hazards. "#0277". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b Merck Index, 제10판, Martha Windholz, 편집자, Merck & Co, Inc, Rahway, NJ, 1983, 551페이지
- ^ "Diethyl ether_msds".
- ^ "Diethyl ether". ChemSpider. Retrieved 19 January 2017.
- ^ Carl L. Yaws, Chemical Properties Handbook, 뉴욕 맥그로힐, 1999, 567페이지
- ^ a b "Ethyl ether". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b "Ethyl Ether MSDS". J.T. Baker. Archived from the original on 2012-03-28. Retrieved 2010-06-24.
- ^ a b "Ethers, by Lawrence Karas and W. J. Piel". Kirk‑Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. 2004.
- ^ Ethyl Ether, Chem. Economics Handbook. Menlo Park, Calif: SRI International. 1991.
- ^ Cohen, Julius Berend (1920). A Class-book of Organic Chemistry, Volume 1. London: Macmillan and Co. p. 39.
the structure of ethyl alcohol cohen julius diethyl ether.
- ^ "Extra Strength Starting Fluid: How it Works". Valvovine. Archived from the original on 2007-09-27. Retrieved 2007-09-05.
- ^ H. H. Rowley; Wm. R. Reed (1951). "Solubility of Water in Diethyl Ether at 25 °". J. Am. Chem. Soc. 73 (6): 2960. doi:10.1021/ja01150a531.
- ^ Microsoft Word – RedListE2007.doc 2008년 2월 27일 Wayback Machine에서 아카이브 완료
- ^ a b 힐, 존 W.와 콜브, 도리스 K.시대변화를 위한 화학: 제10판, 페이지 257프렌티스 홀어퍼 새들 리버, 뉴저지 주2004.
- ^ Madden, M. Leslie (May 14, 2004). "Crawford Long (1815–1878)". New Georgia Encyclopedia. University of Georgia Press. Retrieved February 13, 2015.
- ^ "Crawford W. Long". Doctors' Day. Southern Medical Association. Archived from the original on February 13, 2015. Retrieved February 13, 2015.
- ^ 노스캐롤라이나주, Grattan. "자궁 출혈 치료"지방의학 및 외과 저널.제1권 제6호(1840년 11월 7일), 페이지 107
- ^ Calderone, F.A. (1935). "Studies on Ether Dosage After Pre-Anesthetic Medication with Narcotics (Barbiturates, Magnesium Sulphate and Morphine)" (PDF). Journal of Pharmacology and Experimental Therapeutics. 55 (1): 24–39.
- ^ "Ether effects". 31 October 2010.
- ^ "Ether and its effects in Anesthesia". 2010-10-31.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ 모건, G. 에드워드 주니어 등(2002).임상 마취학 제3판뉴욕: 맥그로힐 3페이지
- ^ "Essential Medicines WHO Model List (revised April 2003)" (PDF). apps.who.int (13th ed.). Geneva, Switzerland: World Health Organization. April 2003. Retrieved 6 September 2017.
- ^ "Essential Medicines WHO Model List (revised March 2005)" (PDF). apps.who.int (14th ed.). Geneva, Switzerland: World Health Organization. March 2005. Archived from the original (PDF) on 5 August 2005. Retrieved 6 September 2017.
- ^ 국립약사, 제47권, 1917년 6월, 220페이지
- ^ Procter, Jr., William (1852). "On Hoffman's Anodyne Liquor". American Journal of Pharmacy. 28.
- ^ ncbi, 비강에 에테르를 주입하여 딸꾹질을 치료합니다.
- ^ "How Ether Went From a Recreational 'Frolic' Drug to the First Surgery Anesthetic". Smithsonian Magazine. Retrieved 2020-10-11.
- ^ Zandberg, Adrian (2010). "Short Article "Villages … Reek of Ether Vapours": Ether Drinking in Silesia before 1939". Medical History. 54 (3): 387–396. doi:10.1017/s002572730000466x. PMC 2890321. PMID 20592886.
- ^ Kaszycki, Nestor (2006-08-30). "Łemkowska Watra w Żdyni 2006 – pilnowanie ognia pamięci". Histmag.org – historia od podszewki (in Polish). Kraków, Poland: i-Press. Retrieved 2009-11-25.
Dawniej eteru używało się w lecznictwie do narkozy, ponieważ ma właściwości halucynogenne, a już kilka kropel inhalacji wystarczyło do silnego znieczulenia pacjenta. Jednak eter, jak każda ciecz, może teoretycznie być napojem. Łemkowie tę teorię praktykują. Mimo to, nazywanie skroplonego eteru – "kropki" – ich "napojem narodowym" byłoby przesadą. Chociaż stanowi to pewną część mitu "bycia Łemkiem".
- ^ Krenz, Sonia; Zimmermann, Grégoire; Kolly, Stéphane; Zullino, Daniele Fabio (August 2003). "Ether: a forgotten addiction". Addiction. 98 (8): 1167–1168. doi:10.1046/j.1360-0443.2003.00439.x. PMID 12873252.
- ^ 109. 아플라톡신 생합성에 차단된 아스페르길루스 플라부스 돌연변이주 241은 아플라톡신 전사물이 축적되지 않는다.매튜 P. 브라운과 게리 A.Payne, North Carolina State University, Raleigh, NC 27695, fgsc.net
- ^ P. T. Normann; A. Ripel; J. Morland (1987). "Diethyl Ether Inhibits Ethanol Metabolism in Vivo by Interaction with Alcohol Dehydrogenase". Alcoholism: Clinical and Experimental Research. 11 (2): 163–166. doi:10.1111/j.1530-0277.1987.tb01282.x. PMID 3296835.
- ^ Larry K. Keefer; William A. Garland; Neil F. Oldfield; James E. Swagzdis; Bruce A. Mico (1985). "Inhibition of N-Nitrosodimethylamine Metabolism in Rats by Ether Anesthesia" (PDF). Cancer Research. 45 (11 Pt 1): 5457–60. PMID 4053020.
- ^ a b c d "Archived copy" (PDF). Archived from the original (PDF) on 2014-11-13. Retrieved 2014-02-15.
{{cite web}}: CS1 maint: 제목으로 아카이브된 복사(링크) - ^ W. L. F. Armarego; C. L. L. Chai (2003). Purification of laboratory chemicals. Boston: Butterworth-Heinemann. ISBN 978-0-7506-7571-0.
- ^ a b c d Toski, Judith A; Bacon, Douglas R; Calverley, Rod K (2001). The history of Anesthesiology. In: Barash, Paul G; Cullen, Bruce F; Stoelting, Robert K. Clinical Anesthesia (4 ed.). Lippincott Williams & Wilkins. p. 3. ISBN 978-0-7817-2268-1.
- ^ Hademenos, George J.; Murphree, Shaun; Zahler, Kathy; Warner, Jennifer M. (2008-11-12). McGraw-Hill's PCAT. McGraw-Hill. p. 39. ISBN 978-0-07-160045-3. Retrieved 2011-05-25.
- ^ "VIII. An account of a spiritus vini æthereus, together with several experiments tried therewith". Philosophical Transactions of the Royal Society of London. 36 (413): 283–289. 1730. doi:10.1098/rstl.1729.0045. S2CID 186207852.
- ^ Chisholm, Hugh, ed. (1911). . Encyclopædia Britannica. Vol. 9 (11th ed.). Cambridge University Press. p. 806.
외부 링크
- 1818년 마이클 패러데이의 마취제로서의 에테르 발표
- 디에틸에테르 증기압, 액체밀도, 동적 액체점도, 표면장력 계산, ddbonline.ddbst.de
- CDC – NIOSH Pocket Guide to Chemical Hazards(NIOSH의 화학적 위험에 대한 포켓 가이드)




