하이드로늄
Hydronium| | |||
| | |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름 옥소늄 | |||
| 기타 이름 하이드로늄 이온 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐스파이더 | |||
| 141 | |||
PubChem CID | |||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| H3O+ | |||
| 몰 질량 | 19.02g/표준 | ||
| 산도(pKa) | 0 | ||
| 켤레 기저 | 물. | ||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
화학에서, 하이드로늄은 물의 양성자화에 의해 생성되는 옥소늄 이온의 일종인 수성 양이온3+ HO의 일반적인 이름입니다.용액의 아레니우스산 분자가 주변의 물 분자(HO2)에 양성자(양성 수소 이온, H+)를 내놓기 때문에 아레니우스산이 물에 용해될 때 존재하는 양이온으로 종종 보입니다.사실, 산은 이온화되기 위해 물 분자 하나 이상으로 둘러싸여 있어야 하며, 수성+ H와 켤레 염기를 생성한다.수성 양성자에 대한 세 가지 주요 구조가 실험적인 지지를 얻었다.사수화물인 고유3+ 양이온 HO(HO2),3 대칭 이수화물인 준델 양이온+ H(HO2)2 및 확장 준델 양이온인 스토야노프 양이온(Hoyan cation)은 잘 정의된 적외선 스펙트럼의+ 스펙트럼 분석 증거인 H(HO2)(2HO2)4[1][2]를 압도적으로 지지한다.이러한 이유로 가능하면 하이드로늄 [2]이온 대신 기호+ H(aq)를 사용해야 한다고 제안되어 왔다.
pH와의 관계
하이드로늄 또는+ H 이온의 농도는 다음과 같이 용액의 pH를 결정한다.
여기서 M = mol/L.수산화 이온 농도는 용액의 pOH를 유사하게 결정한다.순수한 물의 분자는 다음과 같은 평형 상태에서 수용성 양성자와 수산화 이온으로 자동 분해됩니다.
- HO2 oh− OH(aq) + H+(aq)
순수한 물에는 수산화물과+ H이온이 같기 때문에 중성용액이다.25°C(77°F)에서 순수한 물은 pH가 7이고 pOH가 7입니다(이는 온도 변화에 따라 달라집니다: 물의 자가 이온화 참조).pH값이 7 미만이면 산성용액을,[7] pH값이 7 미만이면 염기성용액을 나타낸다.
명명법
IUPAC 유기화학 명명법에 따르면 하이드로늄 이온은 옥소늄으로 [8]언급되어야 한다.하이드록소늄은 그것을 식별하기 위해 모호하지 않게 사용될 수도 있다.
옥소늄 이온은 3가 산소 양이온을 가진 이온이다.예를 들어 양성자화된 수산기는 옥소늄 이온이지만 하이드로늄 [citation needed]이온은 아니다.
구조.
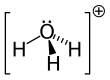
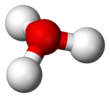
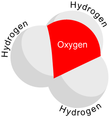
O와 N은 전자 수가 같기 때문에+ HO는3+ 암모니아와 등전자적입니다.위 그림에서 보듯이, HO는 산소3+ 원자가 정점에 있는 삼각추체 분자 형상을 가지고 있습니다.H-O-H 결합 각도는 약 113°[9]이며 질량 중심은 산소 원자에 매우 가깝습니다.피라미드의 기초는 세 개의 동일한 수소 원자로 이루어져 있기 때문에, HO3+ 분자의 대칭적인 꼭대기 구성은 C 점 그룹에3v 속합니다.이러한 대칭성과 쌍극자 모멘트를 가지고 있기 때문에 회전 선택 규칙은 δJ = ±1, δK = 0이다.전이 쌍극자는 c축을 따라 존재하며, 음전하가 산소 원자 근처에 위치하기 때문에 쌍극자 모멘트는 베이스 [citation needed]평면에 수직인 정점을 가리킵니다.
산과 산도
수화 양성자는 매우 산성이다. 25°C에서 pK는a 약 [10]0이다.pKaaq(HO3+)에 대해 일반적으로 주어지는 값은 0 또는 -1.74입니다.전자는 희석액(이 경우 물)의 용매 활성도가 1이라는 관례를 사용하는 반면, 후자는 순수액 55.5M의 물 농도 값을 사용하는데, 실버스타인은 후자의 값이 열역학적으로 지탱할 [11]수 없는 것으로 나타났다.이 불일치는 물에서 HO의3+ pK를a 정의하려면 HO가 용질과2 용매로서 동시에 작용해야 한다는 애매함에서 비롯됩니다.IUPAC는 이 애매함을 해소하는 pK의a 공식적인 정의를 내리지 않았습니다.Burgot은 HO(aq) + HO2(l) ho2 HO(aq) + HO(aq)는3+ 단순히 열역학적으로 명확한 과정이 아니라고 주장해왔다3+.pKaaq(HO3+)의 추정치를 위해 Burgot은 측정된 값 pKaEtOH(HO3+) = 0.3, 에탄올 내 HO의3+ pK를a 취하여 상관식aaq pKaEtOH = pK – 1.0(± 0.3)을 적용하여 에탄올a pK를 수성 값으로 변환하여 pKaaq (73+–HO)의 값을 얻을 것을 제안한다.한편, 실버스타인은 발린저와 롱의 실험 결과가 수성 [14]양성자에 대해 0.0의 pKa를 지지한다는 것을 보여주었다.Neils와 Schaertel은 0.0의 pKa에 대한 추가 인수를 제공한다.
수성 양성자는 물에 존재할 수 있는 가장 산성이 높은 종이다(용해하기에 충분한 물을 가정할 때). 더 강한 산은 이온화되어 수화 양성자를 생성한다.H(aq)의+ 산도는 물 속 산의 강도를 판단하는 데 사용되는 암묵적 표준이다. 강한 산이 H(aq)보다+ 더 나은 양성자 공여자여야 한다. 그렇지 않으면 산의 상당 부분이 비이온화 상태(즉, 약한 산)에서 존재할 것이기 때문이다.물의 자기해리로 인한 중성용액의 H(aq)와는 달리+ 산성용액의 H(aq)는 용해된+ [citation needed]산의 강도에 비례하여 오래 지속되고 농축된다.
pH는 원래 수용액의 [16]수소 이온 농도를 측정하는 것으로 생각되었다.거의 모든 자유 양성자는 빠르게 수화된다. 따라서 수용액의 산도는 H(aq)의+ 농도로 보다 정확하게 특징지어진다.산촉매 반응과 같은 유기합성에서 하이드로늄 이온(HO3+)은 H이온과+ 교환가능하게 사용되는데, H이온 중 하나를 선택하는 [citation needed]것은 반응 메커니즘에 큰 영향을 미치지 않는다.
용매이션
연구자들은 아직 물에 있는 하이드로늄 이온의 용매화를 완전히 특징짓지 못했는데, 부분적으로 용매화의 많은 다른 의미들이 존재하기 때문이다.응고점 강하 연구는 냉수 중의 평균 수화 이온이3+ 약 HO2(6[17]HO)라고 판정했다.평균적으로 각 하이드로늄 이온은 다른 용질 [citation needed]분자를 용해시킬 수 없는 6개의 물 분자에 의해 용해된다.
일부 수화 작용 구조물은 H3O+(H2O)20 마술 이온 번호 체계(수화 작용 구조물은 물 속 분자들의 비교와 관련된에 관련된 증가 안정성 때문에라고 불리는 마법 숫자는 용어 마법 숫자의 이 유사한 사용 원자 물리학의로 –) dodecahedral 안에 있는 옥소늄 있을 만큼 크다. cage.[18]그러나 최근 ab initio 방법 분자역학 시뮬레이션에서는 평균적으로 수화 양성자가 HO([19]HO2)20 클러스터의 표면에 존재하는3+ 것으로 나타났다.또한, 이러한 시뮬레이션의 몇 가지 상이한 특성은 실험 [citation needed]결과에 대한 대안적 해석을 제안하는 실험 특징과 일치한다.
다른 두 가지 잘 알려진 구조는 준델 양이온과 아이겐 양이온이다.Igen 용매화 구조는 HO+49 복합체의 중심에 하이드로늄 이온을 가지고 있으며, 하이드로늄은 세 개의 인접한 물 [20]분자에 강하게 수소 결합되어 있다.준델5 HO+2 복합체에서 양성자는 대칭 수소 [21]결합에서 두 물 분자에 의해 동등하게 공유된다.최근의 연구는 이 두 복합체가 보다 일반적인 수소 결합 네트워크 [22]결함에서 이상적인 구조를 나타낸다는 것을 보여준다.
액상에서 하이드로늄 이온 모노머의 분리는 비수성 저구핵성 초산 용액(HFSbFSO−52)에서 달성되었다.이온은 고해상도 O 핵자기 [23]공명을 특징으로 했다.
액체 protonated water[24]에 방 온도에서 히드로늄 이온. 양이온과 양성자를하여 구조 분자 동력을 이용하여 공부 주변의 enthalpies고 다양한 수소 결합의 자유 에너지의 2007년 계산은 옥소늄 이온 주변의 hydrogen-bonds 3물 ligands와 첫번째 용해에서 형성된 보여 주었다. shel하이드로늄의 l)은 벌크수에 비해 상당히 [citation needed]강합니다.
Stoyanov는 양성자가 HO+6 이온으로13 존재하는 적외선 분광법에 기초하여 새로운 모델을 제안했다.따라서 양전하는 6개의 물 [25]분자에 걸쳐 비국재화된다.
고체 하이드로늄염
많은 강한 산의 경우 비교적 안정적인 하이드로늄 소금 결정을 형성할 수 있습니다.이 소금들은 때때로 산성 일수화물이라고 불린다.원칙적으로 이온화 정수가 109 이상인 산은 이를 할 수 있다.일반적으로 이온화 상수가 10 미만인9 산은 안정적인3+ HO염을 형성할 수 없다.예를 들어 질산은 이온화 상수가 10이고1.4 물과 모든 비율로 혼합된 것은 상온에서 액체이다.단, 과염소산은 이온화 상수가 10이며10, 액체 무수 과염소산과 물을 1:1 몰비로 조합하면 반응하여 고형 과염소산히드로늄(HO3+·ClO-4)[citation needed]이 된다.
하이드로늄 이온은 또한 카르보란 초산 H11(CBH3(5CH6)[26]Br)와 안정적인 화합물을 형성한다. X선 결정학은 각 양성자가 평균 320pm 간격으로 브롬 원자와 상호작용하는 하이드로늄 이온에 대한 C 대칭을 보여준다3v.[HO3][H(CBHCl1111)]염도 벤젠에 용해된다.벤젠 용액에서 성장한 결정에서 용매는 공결정화되어 음이온에서 HO·(3CH66) 양이온이3 완전히 분리된다.양이온에서 3개의 벤젠 분자는 수소 원자와 pi-cation 상호작용을 형성하는 하이드로늄을 둘러싸고 있다.염소에서의 음이온과 산소에서의 양이온의 가장 가까운(비결합) 접근은 348 pm이다.
HCl·2의 HO+2 이온과5 같이 알려진 하이드로늄 이온의 예도 많이 있습니다.HBr2·4에서 발견되는7 HO, HO+3 및9 HO+4 이온H2O.[27]
성간3+ HO
하이드로늄은 성간 매체에 풍부한 분자 이온으로 [30]혜성의 플라즈마 꼬리뿐만 아니라 확산되고 밀도가[29] 높은 분자 구름에서[28] 발견됩니다.하이드로늄 관측의 성간 출처에는 궁수자리 B2, 오리온 OMC-1, 오리온 BN 영역이 포함됩니다.IRC2, 오리온 KL, 헤일-밥 혜성.
성간 하이드로늄은 우주 [31]방사선에 의해 H가2 H+2로 이온화되면서 시작된 일련의 반응에 의해 형성된다.HO는3+ 해리성 재조합 반응을 통해 OH 또는2 HO 중 하나를− 생성할 수 있으며, 이는 밀도가 [32]높은 구름의 낮은 온도(10K 이상)에서도 매우 빠르게 발생합니다.이것은 하이드로늄이 성간 이온 중성 [citation needed]화학에서 매우 중요한 역할을 하도록 이끈다.
천문학자들은 다양한 성간 기후에서 물이 얼마나 풍부한지를 알아내는 데 특히 관심이 있는데, 이는 물이 [33]복사 과정을 통해 고밀도 분자 가스를 냉각시키는 데 중요한 역할을 하기 때문이다.그러나 HO는 지상2 [34]관측에 유리한 전환이 많지 않다.HDO(물의[35] 중수소화 버전)의 관측을 HO의 풍부성 추정에2 사용할 수 있지만, HDO2 대 HO의 비율은 [34]매우 정확하게 알려져 있지 않다.
반면, 하이드로늄은 여러 가지 변화가 있어 [34]다양한 상황에서 검출과 식별이 용이합니다.이 정보는 다양한3+ HO 해리성 재조합[32] 반응의 분기 비율에 대한 실험실 측정과 함께 사용되어 이들 [36][37]종을 직접 관찰하지 않고도 비교적 정확한− OH 및2 HO 풍부성을 제공한다.
성간 화학
앞서 언급한 바와 같이 HO는3+ 확산성 및 밀도 높은 분자 구름에서 모두 발견된다.HO를 포함한3+ 현재 이용 가능한 모든 특성 반응에 대응하는 반응 속도 상수(α, β, δ)를 적용함으로써 이들 반응 각각에 대해 k(T)를 계산할 수 있다.이들 k(T)에 제품의 상대적인 함량을 곱함으로써 소정의 온도에서 각 반응에 대한 상대속도(cm3/s)를 구할 수 있다.이러한 상대 비율은 절대 비율에 [H]2[38]를2 곱하여 만들 수 있습니다.고밀도 구름의 경우 T = 10 K, 확산 구름의 경우 T = 50 K를 가정하면, 그 결과는 대부분의 지배적인 형성 및 파괴 메커니즘이 두 경우에서 동일함을 나타낸다.이러한 계산에 사용된 상대적 풍부성은 밀도 높은 분자 구름인 TMC-1에 해당하므로 계산된 상대적 속도는 T = 10 K에서 더 정확할 것으로 예상된다.가장 빠른 3가지 형성 및 파괴 메커니즘과 그 상대 속도를 아래 표에 나타냅니다.이 6가지 반응의 속도는 이러한 [30]조건에서 하이드로늄 이온의 화학 상호작용의 약 99%를 구성한다는 점에 유의하십시오.아래 표의 세 가지 파괴 메커니즘은 모두 해리성 재조합 [citation needed]반응으로 분류된다.
| 반응 | 유형 | 상대속도(cm3/s) | |
|---|---|---|---|
| 10K로 | 50K로 | ||
| H2 + HO2+ → HO3+ + H | 형성 | 2.97×10−22 | 2.97×10−22 |
| HO2 + HCO+ → CO + HO3+ | 형성 | 4.52×10−23 | 4.52×10−23 |
| H+3 + HO2 → HO3+ + H2 | 형성 | 3.75×10−23 | 3.75×10−23 |
| HO3+ + e− → OH + H + H | 파괴 | 2.27×10−22 | 1.02×10−22 |
| HO3+ + e− → HO2 + H | 파괴 | 9.52×10−23 | 4.26×10−23 |
| HO3+ + e− → OH + H2 | 파괴 | 5.31×10−23 | 2.37×10−23 |
또한 위의 표의 생성 반응의 상대 속도는 두 온도에서 주어진 반응에 대해 동일하다는 점도 주목할 필요가 있습니다.이는 β 상수와 β 상수가 0인 반응 속도 상수로 인해 [citation needed]온도와 무관한 k = α가 된다.
이 세 가지 반응 모두 HO 또는 OH를2 생성하므로, 이러한 결과는 상대적인 함량과 HO의3+ 함량 사이의 강한 연관성을 강화합니다.이 여섯 가지 반응의 속도는 이러한 [citation needed]조건 하에서 하이드로늄 이온의 화학 작용의 약 99%를 차지할 정도로 높습니다.
천문학적 검출
1973년 초, 그리고 첫 번째 성간 발견이 있기 전에, 성간 매체의 화학 모델은 하이드로늄이 풍부한 분자 이온이며 이온 중성 [39]화학에서 중요한 역할을 한다고 예측했습니다.하지만, 천문학적인 탐사가 진행되기 전에 기체 단계에서 하이드로늄의 분광학적 특징을 결정하는 문제가 여전히 존재했는데, 이 문제는 이 시점에서는 알려지지 않았다.이러한 특성에 대한 첫 번째 연구는 1977년에 [40]이루어졌으며, 그 후 다른 고해상도 분광기 실험이 이어졌다.실험실에서 여러 개의 선이 확인되자 1986년 [29][34]두 그룹에 의해 HO의3+ 첫 번째 성간 검출이 거의 동시에 이루어졌다.1986년 6월에 발표된 첫 번째 보고서는 OMC-1과 Sgr B2의 307192.41MHz에서 J = 1−
1 - 2+
1 전이가vt
K 관측되었다고 보고했다.8월에 출판된 두 번째 기사는 오리온-KL [citation needed]성운으로 향하는 동일한 전이를 관찰했다고 보고했다.
이러한 첫 번째 검출은 다수의 추가3+ HO 전환에 대한 관찰에 이어 이루어졌습니다.각 후속 전이 검출의 첫 번째 관찰 결과는 아래에 시간 순서대로 제시되어 있습니다.
1991년에는 OMC-1과 Sgr B2에서 [41]364797.427MHz에서 3 - 2−
2 전이가+
2 관찰되었다.1년 후, 396272.412MHz에서 3−
0 - 2의+
0 전이가 여러 지역에서 관측되었으며, 그 중 가장 선명한 것은 W3 IRS [37]5 구름이었다.
69.524µm(4.3121THz)의 최초의 원적외선−
3 4 - 3+
3 전이는 1996년 오리온 BN-IRC2 [42]근처에서 이루어졌다.2001년 Sgr B2의 원적외선에서는 HO in의3+ 세 가지 추가 전이가 관찰되었다. 즉−
1, 100+
1.577 µm(2.98073 THz), 181−
1.054 µm(1.65582 THz), 100−
0.869 µm(2.2197THz)[43]에서 2-1 전이가+
1+
0 관찰되었다.
「 」를 참조해 주세요.
레퍼런스
- ^ Reed, C.A. (2013). "Myths about the proton. The nature of H+ in condensed media". Acc. Chem. Res. 46 (11): 2567–2575. doi:10.1021/ar400064q. PMC 3833890. PMID 23875729.
- ^ a b Silverstein, Todd P. (2014). "The aqueous proton is hydrated by more than one water molecule: Is the hydronium ion a useful conceit?". J. Chem. Educ. 91 (4): 608–610. Bibcode:2014JChEd..91..608S. doi:10.1021/ed400559t.
- ^ Thamer, M.; DeMarco, L.; Ramesha, K.; Mandel, A.; Tokmakoff, A. (2015). "Ultrafast 2D IR spectroscopy of the excess proton in liquid water". Science. 350 (6256): 78–82. Bibcode:2015Sci...350...78T. doi:10.1126/science.aab3908. PMID 26430117. S2CID 27074374.
- ^ Daly Jr., C.A.; Streacker, L.M.; Sun, Y.; Pattenaude, S.R.; Hassanali, A.A.; Petersen, P.B.; et al. (2017). "Decomposition of the experimental Raman and IR spectra of acidic water into proton, special pair, and counterion contributions". J. Phys. Chem. Lett. 8 (21): 5246–5252. doi:10.1021/acs.jpclett.7b02435. PMID 28976760.
- ^ Dahms, F.; Fingerhut, B.P.; Nibbering, E.T.; Pines, E.; Elsaesser, T. (2017). "Large-amplitude transfer motion of hydrated excess protons mapped by ultrafast 2D IR spectroscopy". Science. 357 (6350): 491–495. Bibcode:2017Sci...357..491D. doi:10.1126/science.aan5144. PMID 28705988. S2CID 40492001.
- ^ Fournier, J.A.; Carpenter, W.B.; Lewis, N.H.; Tokmakoff, A. (2018). "Broadband 2D IR spectroscopy reveals dominant asymmetric H5O2+ proton hydration structures in acid solutions". Nature Chemistry. 10 (9): 932–937. Bibcode:2018NatCh..10..932F. doi:10.1038/s41557-018-0091-y. OSTI 1480907. PMID 30061612. S2CID 51882732.
- ^ "pH and Water". United States Geological Survey. Retrieved 9 November 2021.
- ^ "Table 17 Mononuclear parent onium ions". IUPAC.
- ^ Tang, Jian; Oka, Takeshi (1999). "Infrared spectroscopy of H3O+: the v1 fundamental band". Journal of Molecular Spectroscopy. 196 (1): 120–130. Bibcode:1999JMoSp.196..120T. doi:10.1006/jmsp.1999.7844. PMID 10361062.
- ^ Meister, Erich; Willeke, Martin; Angst, Werner; Togni, Antonio; Walde, Peter (2014). "Confusing Quantitative Descriptions of Brønsted-Lowry Acid-Base Equilibria in Chemistry Textbooks – A Critical Review and Clarifications for Chemical Educators". Helv. Chim. Acta. 97 (1): 1–31. doi:10.1002/hlca.201300321.
- ^ Silverstein, T.P.; Heller, S.T. (2017). "pKa Values in the Undergraduate Curriculum: What Is the Real pKa of Water?". J. Chem. Educ. 94 (6): 690–695. doi:10.1021/acs.jchemed.6b00623.
- ^ Burgot, Jean-Louis (1998). "PerspectiveNew point of view on the meaning and on the values of Ka○(H3O+, H2O) and Kb○(H2O, OH−) pairs in water". The Analyst. 123 (2): 409–410. doi:10.1039/a705491b.
- ^ Ballinger, P.; Long, F.A. (1960). "Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds". J. Am. Chem. Soc. 82 (4): 795–798. doi:10.1021/ja01489a008.
- ^ Silverstein, T.P. (2014). "The aqueous proton is hydrated by more than one water molecule: Is the hydronium ion a useful conceit?". J. Chem. Educ. 91 (4): 608–610. doi:10.1021/ed400559t.
- ^ "What is the pKa of Water". University of California, Davis. 2015-08-09.
- ^ Sorensen, S. P. L. (1909). "Ueber die Messung und die Bedeutung der Wasserstoffionenkonzentration bei enzymatischen Prozessen". Biochemische Zeitschrift (in German). 21: 131–304.
- ^ Zavitsas, A. A. (2001). "Properties of water solutions of electrolytes and nonelectrolytes". The Journal of Physical Chemistry B. 105 (32): 7805–7815. doi:10.1021/jp011053l.
- ^ Hulthe, G.; Stenhagen, G.; Wennerström, O.; Ottosson, C-H. (1997). "Water cluster studied by electrospray mass spectrometry". Journal of Chromatography A. 512: 155–165. doi:10.1016/S0021-9673(97)00486-X.
- ^ Iyengar, S. S.; Petersen, M. K.; Burnham, C. J.; Day, T. J. F.; Voth, G. A.; Voth, G. A. (2005). "The Properties of Ion-Water Clusters. I. The Protonated 21-Water Cluster" (PDF). The Journal of Chemical Physics. 123 (8): 084309. Bibcode:2005JChPh.123h4309I. doi:10.1063/1.2007628. PMID 16164293.
- ^ Zundel, G.; Metzger, H. (1968). "Energiebänder der tunnelnden Überschuß-Protonen in flüssigen Säuren. Eine IR-spektroskopische Untersuchung der Natur der Gruppierungen H502+". Zeitschrift für Physikalische Chemie. 58 (5_6): 225–245. doi:10.1524/zpch.1968.58.5_6.225. S2CID 101048854.
- ^ Wicke, E.; Eigen, M.; Ackermann, Th (1954). "Über den Zustand des Protons (Hydroniumions) in wäßriger Lösung". Zeitschrift für Physikalische Chemie. 1 (5_6): 340–364. doi:10.1524/zpch.1954.1.5_6.340.
- ^ Marx, D.; Tuckerman, M. E.; Hutter, J.; Parrinello, M. (1999). "The nature of the hydrated excess proton in water". Nature. 397 (6720): 601–604. Bibcode:1999Natur.397..601M. doi:10.1038/17579. S2CID 204991299.
- ^ Mateescu, G. D.; Benedikt, G. M. (1979). "Water and related systems. 1. The hydronium ion (H3O+). Preparation and characterization by high resolution oxygen-17 nuclear magnetic resonance". Journal of the American Chemical Society. 101 (14): 3959–3960. doi:10.1021/ja00508a040.
- ^ Markovitch, O.; Agmon, N. (2007). "Structure and Energetics of the Hydronium Hydration Shells" (PDF). The Journal of Physical Chemistry A. 111 (12): 2253–6. Bibcode:2007JPCA..111.2253M. CiteSeerX 10.1.1.76.9448. doi:10.1021/jp068960g. PMID 17388314.
- ^ Stoyanov, Evgenii S.; Stoyanova, Irina V.; Reed, Christopher A. (January 15, 2010). "The Structure of the Hydrogen Ion (H+
aq) in Water". Journal of the American Chemical Society. 132 (5): 1484–1485. doi:10.1021/ja9101826. PMC 2946644. PMID 20078058. - ^ Stoyanov, Evgenii S.; Kim, Kee-Chan; Reed, Christopher A. (2006). "The Nature of the H3O+ Hydronium Ion in Benzene and Chlorinated Hydrocarbon Solvents. Conditions of Existence and Reinterpretation of Infrared Data". Journal of the American Chemical Society. 128 (6): 1948–58. doi:10.1021/ja0551335. PMID 16464096.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Faure, A.; Tennyson, J. (2003). "Rate coefficients for electron-impact rotational excitation of H3+ and H3O+". Monthly Notices of the Royal Astronomical Society. 340 (2): 468–472. Bibcode:2003MNRAS.340..468F. doi:10.1046/j.1365-8711.2003.06306.x.
- ^ a b Hollis, J. M.; Churchwell, E. B.; Herbst, E.; De Lucia, F. C. (1986). "An interstellar line coincident with the P(2,l) transition of hydronium (H3O+)". Nature. 322 (6079): 524–526. Bibcode:1986Natur.322..524H. doi:10.1038/322524a0. S2CID 4346975.
- ^ a b Rauer, H (1997). "Ion composition and solar wind interaction: Observations of comet C/1995 O1 (Hale-Bopp)". Earth, Moon, and Planets. 79: 161–178. Bibcode:1997EM&P...79..161R. doi:10.1023/A:1006285300913. S2CID 119953549.
- ^ Vejby‐Christensen, L.; Andersen, L. H.; Heber, O.; Kella, D.; Pedersen, H. B.; Schmidt, H. T.; Zajfman, D. (1997). "Complete Branching Ratios for the Dissociative Recombination of H2O+, H3O+, and CH3+". The Astrophysical Journal. 483 (1): 531–540. Bibcode:1997ApJ...483..531V. doi:10.1086/304242.
- ^ a b Neau, A.; Al Khalili, A.; Rosén, S.; Le Padellec, A.; Derkatch, A. M.; Shi, W.; Vikor, L.; Larsson, M.; Semaniak, J.; Thomas, R.; Någård, M. B.; Andersson, K.; Danared, H.; Af Ugglas, M. (2000). "Dissociative recombination of D3O+ and H3O+: Absolute cross sections and branching ratios". The Journal of Chemical Physics. 113 (5): 1762. Bibcode:2000JChPh.113.1762N. doi:10.1063/1.481979.
- ^ Neufeld, D. A.; Lepp, S.; Melnick, G. J. (1995). "Thermal Balance in Dense Molecular Clouds: Radiative Cooling Rates and Emission-Line Luminosities". The Astrophysical Journal Supplement Series. 100: 132. Bibcode:1995ApJS..100..132N. doi:10.1086/192211.
- ^ a b c d Wootten, A.; Boulanger, F.; Bogey, M.; Combes, F.; Encrenaz, P. J.; Gerin, M.; Ziurys, L. (1986). "A search for interstellar H3O+". Astronomy and Astrophysics. 166: L15–8. Bibcode:1986A&A...166L..15W. PMID 11542067.
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "중수".doi:10.1351/goldbook.H02758
- ^ Herbst, E.; Green, S.; Thaddeus, P.; Klemperer, W. (1977). "Indirect observation of unobservable interstellar molecules". The Astrophysical Journal. 215: 503–510. Bibcode:1977ApJ...215..503H. doi:10.1086/155381. hdl:2060/19770013020.
- ^ a b Phillips, T. G.; Van Dishoeck, E. F.; Keene, J. (1992). "Interstellar H3O+ and its Relation to the O2 and H2O- Abundances" (PDF). The Astrophysical Journal. 399: 533. Bibcode:1992ApJ...399..533P. doi:10.1086/171945. hdl:1887/2260.
- ^ "H3O+ formation reactions". The UMIST Database for Astrochemistry.
- ^ Herbst, E.; Klemperer, W. (1973). "The formation and depletion of molecules in dense interstellar clouds". The Astrophysical Journal. 185: 505. Bibcode:1973ApJ...185..505H. doi:10.1086/152436.
- ^ Schwarz, H.A. (1977). "Gas phase infrared spectra of oxonium hydrate ions from 2 to 5 μm". Journal of Chemical Physics. 67 (12): 5525. Bibcode:1977JChPh..67.5525S. doi:10.1063/1.434748.
- ^ Wootten, A.; Turner, B. E.; Mangum, J. G.; Bogey, M.; Boulanger, F.; Combes, F.; Encrenaz, P. J.; Gerin, M. (1991). "Detection of interstellar H3O+ – A confirming line". The Astrophysical Journal. 380: L79. Bibcode:1991ApJ...380L..79W. doi:10.1086/186178.
- ^ Timmermann, R.; Nikola, T.; Poglitsch, A.; Geis, N.; Stacey, G. J.; Townes, C. H. (1996). "Possible discovery of the 70 µm {H3O+} 4−
3 − 3+
3 transition in Orion BN-IRc2". The Astrophysical Journal. 463 (2): L109. Bibcode:1996ApJ...463L.109T. doi:10.1086/310055. - ^ Goicoechea, J. R.; Cernicharo, J. (2001). "Far-infrared detection of H3O+ in Sagittarius B2". The Astrophysical Journal. 554 (2): L213. Bibcode:2001ApJ...554L.213G. doi:10.1086/321712.
![{\displaystyle {\ce {pH}}=-\log([{\ce {H3O+}}]/{\ce {M}})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2221d064a7b1ed88c4f53ef6de62ba8d08d6a7dc)




