부스피론
Buspirone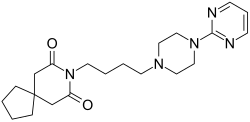 | |
| 임상 데이터 | |
|---|---|
| 발음 | /'bju'sp'ro'n/(BEW-spi-rohn) |
| 상호 | 버스파르, 나만스핀 |
| 기타 이름 | MJ 9022-1[1] |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a688005 |
| 임신 카테고리 |
|
| 루트 행정부. | 입으로 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 | |
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 3.9%[2] |
| 단백질 결합 | 86~95%[3] |
| 대사 | 간(CYP3A4 [7][8]경유) |
| 대사물 | 5-OH-부스피론, 6-OH-부스피론, 8-OH-부스피론, |
| 반감기 제거 | 2.5시간[7] |
| 배설물 | 소변: 29~63%[3] 대변: 18~38%[3] |
| 식별자 | |
| |
| CAS 번호 |
|
| PubChem CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.048.232 |
| 화학 및 물리 데이터 | |
| 공식 | C21H31N5O2 |
| 몰 질량 | 385.165g/140g/140−1 |
| 3D 모델(JSmol) | |
| |
| |
| (표준) | |
Buspar라는 상표명으로 판매되는 Buspirone은 주로 불안장애,[9][10] 특히 일반화된 불안장애를 치료하는데 사용되는 약이다.단기간에 사용할 [11]수 있는 이점이 있습니다.경구 복용으로 효과가 [9][10]나타나기까지 최대 4주 정도 걸릴 수 있습니다.
버스피론의 일반적인 부작용으로는 메스꺼움, 두통, 어지럼증, [9][11]집중력 저하 등이 있다.심각한 부작용에는 환각, 세로토닌 증후군, [11]발작 등이 포함될 수 있다.임신 중 사용은 안전한 것으로 보이지만 연구가 잘 이루어지지 않고 있으며, 모유 수유 중 사용은 [11][12]권장되지 않습니다.세로토닌 5-HT1A 수용체 작용제입니다.[2]
Buspirone은 1968년에 처음 만들어졌고 [9][10]1986년 미국에서 의료용으로 승인되었다.제네릭 [11]의약품으로 구입할 수 있습니다.2019년에는 미국에서 가장 많이 처방된 약으로 약 900만 건 이상의 [13][14]처방을 받았다.
의료 용도
불안.
버스피론은 불안장애나 [15][16][17][18][19]불안증상의 단기 및 장기 치료에 사용된다.그것은 알프라졸람과 같은 약물을 [10]중독시키는 수용체를 활성화시키지 않기 때문에 벤조디아제핀보다 일반적으로 선호된다.
부스피론은 즉각적인 항불안 효과가 없으므로 작용 시작이 지연되며, 완전한 임상 효과가 [20]나타나려면 2-4주가 걸릴 수 있다.이 약물은 디아제팜, 알프라졸람, 로라제팜,[2] 클로라제페이트를 포함한 벤조디아제핀에 대한 일반화 불안장애(GAD) 치료에 유사한 효과가 있는 것으로 나타났다.부시피론은 선택적 세로토닌 재흡수 억제제([2][22]SSRI)의 부속물로서 사회공포증 치료에 유용할 수 있다는 일부 제한된 증거가 있지만 [21]GAD 이외의 다른 불안장애 치료에 효과적이지 않은 것으로 알려져 있다.
기타 용도
성적 기능 장애
버스피론 자체가 여성의 [23]저활동성 성욕 장애 치료에 유용할 수 있다는 몇 가지 증거가 있다.
여러가지 종류의
부스피론은 벤조디아제핀 금단, 바르비투르산 금단, 알코올 금단/[24]섬유의 치료제로는 효과가 없다.
SSRI 및 파록세틴 및 벤라팍신 같은 SNRI 항우울제는 (비록 흔하지는 않지만) 턱 통증/좌경련 가역 증후군을 일으킬 수 있으며, 부스피론은 SSRI/SNRI 유도 턱 [25][26]결림에 대한 멍 치료에서 성공적인 것으로 보인다.
금지 사항
Buspirone에는 다음과 같은 [27][28]금기가 있습니다.
부작용
버스피론과 관련된 알려진 부작용으로는 어지럼증, 두통, 메스꺼움, 이명, 그리고 감각 [2]등이 있다.부스피론은 비교적 잘 견디며 진정, 인지 및 정신운동 장애, 근육 이완, 신체적 의존 또는 항경련 [2]효과와 관련이 없습니다.게다가, 버스피론은 행복감을[20] 유발하지 않고 [16]남용되는 약물이 아니다.운동장애, 아카티시아, 미오클로누스, 파킨슨병, 그리고 디스토니아는 부스피론과 [29]관련이 있는 것으로 보고되었다.부스피론에 [9]의한 운동장애나 다른 운동장애의 위험이 있는지는 불분명하다.
과다 복용
부스피론은 단일 약물 과다 복용의 경우 비교적 양성인 것으로 보이지만, 이 주제에 대한 명확한 데이터는 [30]없는 것으로 보인다.한 임상 시험에서, 버스피론은 건강한 남성 지원자들에게 하루 375mg의 용량으로 투여되었고 메스꺼움, 구토, 어지럼증, 졸음, 미오병, 위통 [15][16][18]등의 부작용을 일으켰다.초기 임상시험에서 부스피론은 하루 2,400mg의 높은 용량으로 투여되었으며, 아카티시증, 떨림 및 근육 경직이 [31]관찰되었다.250mg과 최대 300mg의 부스피론을 의도적으로 과다 복용하면 [31]약 50%의 개인에서 졸음이 온다.알프라졸람, 딜티아젬, 알코올, [31]코카인과 450mg의 부스피론 혼합으로 한 명의 사망자가 보고되었다.
상호 작용
부스피론은 체외에서 [8]CYP3A4 효소에 의해 대사되는 것으로 나타났다.이 발견은 [27]버스피론과 시토크롬 P450 3A4(CYP3A4)의 이들 억제제 또는 유도제 사이에서 관찰된 생체 내 상호작용과 일치한다.
- 이트라코나졸:부스피론의 혈장 수준 증가
- 리팜피신:부스피론의 혈장 수치 감소
- 네파조돈:부스피론의 혈장 수치 증가
- 할로페리돌:부스피론의 혈장 수치 증가
- 카르바마제핀:부스피론의 혈장 수치 감소
- 자몽: 부스피론의 [32]혈장 수치를 크게 높입니다.자몽-약물 상호작용을 참조하십시오.
- 플루복사민:부스피론의 [33]혈장 농도를 적당히 높인다.
모노아민산화효소억제제(MAOI)[27]를 복용하는 환자에게 부스피론을 투여했을 때 혈압이 상승한 것으로 보고되었다.
약리학
약역학
| 위치 | Ki(nM) | 종. | 참조 |
|---|---|---|---|
| 5-HT1A | 3.98–214 21(표준) | 인간 | [34][35] |
| 5-HT1B | 100,000 이상 | 쥐. | [36] |
| 5-HT1D | 22,000–42,700 | 인간 | [37][38] |
| 5-HT2A | 138 759–1,300 | 인간 쥐. | [39] [36][39] |
| 5-HT2B | 214 | 인간 | [39] |
| 5-HT2C | 490 1,100–6,026 | 인간 쥐/돼지 | [39] [36][39] |
| 5-HT3 | 10,000 이상 | 쥐. | [40][41] |
| 5-HT4 | 10,000 이상 | 쥐. | [41] |
| 5-HT6 | 398 | 마우스 | [42] |
| 5-HT7 | 375–381 840 | 쥐. 인간 | [43][44] [45] |
| α1 | 1,000 | 쥐. | [36] |
| α2 | 6,000 | 쥐. | [46] |
| α2A | 7.3 (1-PP) | 인간 | [36] |
| β | 8,800 | 쥐. | [36] |
| D1. | 33,000 | 쥐. | [36] |
| D2. | 484 240 | 인간 쥐. | [47] [36] |
| D3. | 98 | 인간 | [47] |
| D4. | 29 | 인간 | [47] |
| mACh | 38,000 | 쥐. | [36] |
| 가바A (BDZ ) | 100,000 이상 | 쥐. | [36] |
| 값은 K(nM)입니다i.값이 작을수록 약물이 사이트에 강하게 결합됩니다. | |||
부스피론은 높은 [2][36]친화력을 가진 세로토닌1A 5-HT 수용체의 작용제 역할을 한다.억제성 자가수용체인 시냅스 전 5-HT1A 수용체와 시냅스 후 5-HT1A [2]수용체의 부분작용제이다.부시피론의 주효과는 시냅스 전 5-HT1A 수용체와의 상호작용을 통해 매개되며, 따라서 세로토닌을 생성하는 [2]뉴런의 발화를 감소시키는 것으로 생각된다.부스피론은 또한 세로토닌 5-HT2A, 5-HT2B, 5-HT2C,[34] 5-HT6 및 5-HT7 수용체에 대한 친화력이 낮다.
부스피론은 세로토닌 수용체에 결합할 뿐만 아니라 [2][36]친화력이 약한 도파민2 D 수용체의 길항제이다.억제성 시냅스2 전 D 자가수용체를 우선적으로 차단하고,[2] 더 높은2 용량에서만 시냅스 후 D 수용체를 길들인다.이에 따라 저용량에서는 부스피론이 니그로스트라이어탈 경로에서 도파민 작동성 신경 전달을 증가시키는 반면, 고용량에서는2 시냅스 후 D 수용체가 차단되고, [2]동물에서는 특히 강직증은 아니지만 저활성 및 고정관념 감소와 같은 항파민 작용 효과가 관찰된다.부스피론은 또한 유사한 길항제인3 도파민4 [47]D 및 D 수용체에 훨씬 더 높은 친화력으로 결합하는 것으로 밝혀졌다.
부스피론의 주요 대사물인 1-(2-피리미디닐) 피페라진(1-PP)은 부스피론 자체보다 높은 순환 수준에서 발생하며 강력한 α-아드레날린2 수용체 [46][48][49]길항제 역할을 하는 것으로 알려져 있다.이 대사물은 동물에서 [48][50]부스피론과 함께 관찰되는 노르아드레날린 활성 및 도파민 활성 증가를 일으킬 수 있다.또한 1-PP는 부스피론의 [50]항우울제 효과에 중요한 역할을 할 수 있다.부스피론은 또한 α-아드레날린1 수용체에 [36][51]대해 매우 약하고 아마도 임상적으로 중요하지 않은 친화력을 가지고 있다.그러나 부스피론은 "조직 의존적 및 종 의존적 방법"[51]으로 발현되는 α-아드레날린1 수용체에서 "중요하고 선택적 내인성 효과"를 보인 것으로 보고되었다.
벤조디아제핀과 달리 부스피론은 GABAA 수용체 [2][52]복합체와 상호작용하지 않는다.
약동학
부스피론은 광범위한 퍼스트패스 [2]대사로 인해 정맥주사에 비해 3.9%의 낮은 경구 생체이용률을 보인다.섭취 후 혈장 수치에 도달하는 시간은 0.9-1.5시간입니다.[2]14개 연구를 검토한 결과 평균 말기 반감기는 2시간에서 11시간 사이였고, 한 연구는 심지어 33시간의 [4]말기 반감기를 보고하기도 했지만, 그것은 2.[2]8시간의 제거 반감기를 가지고 있는 것으로 보고되었다.부스피론은 주로 CYP3A4에 의해 대사되며, 이 효소의 억제제 및 유도제와의 현저한 약물 상호작용이 [7][8]관찰되었다.부스피론의 주요 대사물로는 5-히드록시부스피론, 6-히드록시부스피론, 8-히드록시부스피론,[4][5][6] 1-PP 등이 있으며, 6-히드록시부스피론은 부스피론의 주요 간 대사물로서 사람에 [5]대한 경구 투여 후 혈장 수치가 부스피론보다 40배 이상 높은 것으로 확인되었다.대사물은 부스피론과 유사한 5-HT1A 수용체(Ki = 25nM)의 고친화성 부분작용제이며,[5] 생체1A 내 5-HT 수용체 점유율을 보였다.따라서 부스피론의 [5]치료효과에 중요한 역할을 할 가능성이 있으며 1-PP는 부스피론 자체보다 높은 수준으로 순환되며 부스피론의 [48][50]임상효과에도 마찬가지로 중요한 역할을 할 수 있다.
화학
부스피론은 아자피론의 화학 등급에 속하며 아자피로데칸디온과 피리미디닐피페라진 성분이 부틸 체인으로 연결되어 있습니다.
아날로그
부스피론의 구조적 유사성은 게피론, 입사피론, 페르오스피론,[55] 탄도스피론과 같은 다른 아자피론을 포함한다.
합성
1-(2-피리미딜) 피페라진(1)과 3-클로로-1-시아노프로판(2, 4-클로로부티로니트릴)의 알킬화는 라니켈 촉매에 대한 수소화에 의해 또는 LAH에 의해 환원되는 3이 된다.이전 단계에서 생성된 1° 아민(4)은 3,3-테트라메틸렌글루타르산 무수물(5, 8-옥사스피로[4.5]데칸-7,9-디온)과 반응하여 부스피론(6)을 생성한다.
역사
Buspirone은 1968년[21] Mead Johnson 팀에 의해 처음 합성되었지만 [58][56][59]1980년까지 특허를 받지 못했다.처음에는 D 수용체에2 작용하는 항정신병 약물로서 개발되었으나 정신질환 치료에 효과가 없는 것으로 판명되었고,[2] 그 후 항정신병제로 사용되었다.1986년 Bristol-Myers Squibb는 [21][60]GAD 치료에서 부시피론에 대한 FDA 승인을 받았습니다.2001년에 특허가 만료되어 현재는 버스피론이 제네릭 의약품으로 판매되고 있습니다.
사회와 문화
일반명
Buspirone은 Buspirone의 , , , 그리고 입니다. 반면 buspirone 염산염은 , , , ,[1][61][62][63] 그리고 입니다.
브랜드명
Buspirone은 [61][63]주로 Buspar라는 브랜드로 판매되었다.Buspar는 현재 미국 연방 [64]의약청에 의해 단종 목록에 올라 있다.2010년, 미국 FDA는 시민 청원에 대응하여 Buspar가 안전 또는 [65]효과적 이유로 판매에서 철수하지 않았다고 결정했다.
2019년 부족
미국은 웨스트버지니아주 모간타운에 있는 마일란 제약 공장의 생산 중단으로 2019년 [66]부스피론 부족 사태를 겪었다.
조사.
일부 잠정적인 연구는 뇌손상에 [2]따른 우울증과 행동 장애의 치료와 같은 다른 용도를 뒷받침한다.
레퍼런스
- ^ a b Elks J (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 192–. ISBN 978-1-4757-2085-3.
- ^ a b c d e f g h i j k l m n o p q r Loane C, Politis M (June 2012). "Buspirone: what is it all about?". Brain Research. 1461: 111–8. doi:10.1016/j.brainres.2012.04.032. PMID 22608068. S2CID 11734819.
- ^ a b c "buspirone (Rx) - BuSpar, Buspirex, more." Medscape Reference. WebMD. Retrieved 14 November 2013.
- ^ a b c Gammans RE, Mayol RF, LaBudde JA (March 1986). "Metabolism and disposition of buspirone". The American Journal of Medicine. 80 (3B): 41–51. doi:10.1016/0002-9343(86)90331-1. PMID 3515929.
- ^ a b c d e Schatzberg AF, Nemeroff CB (2009). The American Psychiatric Publishing Textbook of Psychopharmacology. American Psychiatric Pub. pp. 490–. ISBN 978-1-58562-309-9.
- ^ a b Wong H, Dockens RC, Pajor L, Yeola S, Grace JE, Stark AD, et al. (August 2007). "6-Hydroxybuspirone is a major active metabolite of buspirone: assessment of pharmacokinetics and 5-hydroxytryptamine1A receptor occupancy in rats". Drug Metabolism and Disposition. 35 (8): 1387–92. doi:10.1124/dmd.107.015768. PMID 17494642. S2CID 25558546.
- ^ a b c Mahmood I, Sahajwalla C (April 1999). "Clinical pharmacokinetics and pharmacodynamics of buspirone, an anxiolytic drug". Clinical Pharmacokinetics. 36 (4): 277–87. doi:10.2165/00003088-199936040-00003. PMID 10320950. S2CID 1102318.
- ^ a b c d Zhu M, Zhao W, Jimenez H, Zhang D, Yeola S, Dai R, et al. (April 2005). "Cytochrome P450 3A-mediated metabolism of buspirone in human liver microsomes". Drug Metabolism and Disposition. 33 (4): 500–7. doi:10.1124/dmd.104.000836. PMID 15640381. S2CID 10142905.
- ^ a b c d e "Buspirone Hydrochloride Monograph for Professionals". Drugs.com. American Society of Health-System Pharmacists. Retrieved 3 March 2019.
- ^ a b c d Wilson, T. K.; Tripp, J. (January 2018). "Buspirone". StatPearls. PMID 30285372.
- ^ a b c d e British national formulary : BNF 76 (76 ed.). Pharmaceutical Press. 2018. p. 338. ISBN 9780857113382.
- ^ "Buspirone Pregnancy and Breastfeeding Warnings". Drugs.com. Retrieved 3 March 2019.
- ^ "The Top 300 of 2019". ClinCalc. Retrieved 16 October 2021.
- ^ "Buspirone - Drug Usage Statistics". ClinCalc. Retrieved 16 October 2021.
- ^ a b "BUSPIRONE HCL (buspirone hydrochloride) tablet [Watson Laboratories, Inc.]". DailyMed. Watson Laboratories, Inc. July 2013. Retrieved 14 November 2013.
- ^ a b c "BUSPAR® (buspirone hydrochloride) Tablets 5 mg & 10 mg PRODUCT INFORMATION" (PDF). TGA eBusiness Services. Aspen Pharma Pty Ltd. January 2010. Retrieved 14 November 2013.
- ^ Rossi S, ed. (2013). Australian Medicines Handbook (2013 ed.). Adelaide: The Australian Medicines Handbook Unit Trust. ISBN 978-0-9805790-9-3.
- ^ a b "Buspirone 10mg Tablets". electronic Medicines Compendium. Actavis UK Ltd. 10 September 2012. Retrieved 14 November 2013.
- ^ Joint Formulary Committee. British National Formulary (BNF). Pharmaceutical Press. p. 224.
- ^ a b Sadock BJ, Sadock VA, Ruiz P (22 September 2014). Kaplan and Sadock's Synopsis of Psychiatry: Behavioral Sciences/Clinical Psychiatry. Wolters Kluwer Health. pp. 3211–. ISBN 978-1-4698-8375-5.
- ^ a b c Howland RH (November 2015). "Buspirone: Back to the Future". Journal of Psychosocial Nursing and Mental Health Services. 53 (11): 21–4. doi:10.3928/02793695-20151022-01. PMID 26535760.
- ^ Masdrakis VG, Turic D, Baldwin DS (2013). "Pharmacological treatment of social anxiety disorder". Anxiety Disorders. Modern Trends in Pharmacopsychiatry. Vol. 29. pp. 144–53. doi:10.1159/000351960. ISBN 978-3-318-02463-0. PMID 25225024.
- ^ Goldstein I, Kim NN, Clayton AH, DeRogatis LR, Giraldi A, Parish SJ, et al. (January 2017). "Hypoactive Sexual Desire Disorder: International Society for the Study of Women's Sexual Health (ISSWSH) Expert Consensus Panel Review". Mayo Clinic Proceedings. 92 (1): 114–128. doi:10.1016/j.mayocp.2016.09.018. PMID 27916394.
- ^ Sontheimer DL, Ables AZ (March 2001). "Is imipramine or buspirone treatment effective in patients wishing to discontinue long-term benzodiazepine use?". The Journal of Family Practice. 50 (3): 203. PMID 11252203.
- ^ Garrett AR, Hawley JS (April 2018). "SSRI-associated bruxism: A systematic review of published case reports". Neurology. Clinical Practice. 8 (2): 135–141. doi:10.1212/CPJ.0000000000000433. PMC 5914744. PMID 29708207.
- ^ Prisco V, Iannaccone T, Di Grezia G (1 April 2017). "Use of buspirone in selective serotonin reuptake inhibitor-induced sleep bruxism". European Psychiatry. Abstract of the 25th European Congress of Psychiatry. 41: S855. doi:10.1016/j.eurpsy.2017.01.1701. S2CID 148816505.
- ^ a b c "Buspirone monograph". Drugs.com. Retrieved 27 August 2011.
- ^ Geddes J, Gelder MG, Mayou R (2005). Psychiatry. Oxford [Oxfordshire]: Oxford University Press. p. 237. ISBN 978-0-19-852863-0.
- ^ Rissardo, Jamir Pitton; Caprara, Ana Letícia Fornari (2020). "Buspirone-associated Movement Disorder: A Literature Review". Prague Medical Report. 121 (1): 5–24. doi:10.14712/23362936.2020.1. ISSN 1214-6994. PMID 32191616. S2CID 213191429.
- ^ Fulton B, Brogden RN (1997). "Buspirone". CNS Drugs. 7 (1): 68–88. doi:10.2165/00023210-199707010-00007. ISSN 1172-7047.
- ^ a b c Dart RC (2004). Medical Toxicology. Lippincott Williams & Wilkins. pp. 886–. ISBN 978-0-7817-2845-4.
- ^ Lilja JJ, Kivistö KT, Backman JT, Lamberg TS, Neuvonen PJ (December 1998). "Grapefruit juice substantially increases plasma concentrations of buspirone". Clinical Pharmacology and Therapeutics. 64 (6): 655–60. doi:10.1016/S0009-9236(98)90056-X. PMID 9871430. S2CID 22009095.
- ^ Lamberg TS, Kivistö KT, Laitila J, Mårtensson K, Neuvonen PJ (1998). "The effect of fluvoxamine on the pharmacokinetics and pharmacodynamics of buspirone". European Journal of Clinical Pharmacology. 54 (9–10): 761–6. doi:10.1007/s002280050548. PMID 9923581. S2CID 21939719.
- ^ a b c Roth BL, Driscol J. "PDSP Ki Database". Psychoactive Drug Screening Program (PDSP). University of North Carolina at Chapel Hill and the United States National Institute of Mental Health. Retrieved 14 August 2017.
- ^ Boess FG, Martin IL (1994). "Molecular biology of 5-HT receptors". Neuropharmacology. 33 (3–4): 275–317. doi:10.1016/0028-3908(94)90059-0. PMID 7984267. S2CID 35553281.
- ^ a b c d e f g h i j k l m Hamik A, Oksenberg D, Fischette C, Peroutka SJ (July 1990). "Analysis of tandospirone (SM-3997) interactions with neurotransmitter receptor binding sites". Biological Psychiatry. 28 (2): 99–109. doi:10.1016/0006-3223(90)90627-e. PMID 1974152. S2CID 25608914.
- ^ Peroutka SJ, Switzer JA, Hamik A (1989). "Identification of 5-hydroxytryptamine1D binding sites in human brain membranes". Synapse. 3 (1): 61–6. doi:10.1002/syn.890030109. PMID 2521959. S2CID 23503235.
- ^ Waeber C, Schoeffter P, Palacios JM, Hoyer D (June 1988). "Molecular pharmacology of 5-HT1D recognition sites: radioligand binding studies in human, pig and calf brain membranes". Naunyn-Schmiedeberg's Archives of Pharmacology. 337 (6): 595–601. doi:10.1007/bf00175783. PMID 2975354. S2CID 21344978.
- ^ a b c d e Bonhaus DW, Weinhardt KK, Taylor M, DeSouza A, McNeeley PM, Szczepanski K, et al. (1997). "RS-102221: a novel high affinity and selective, 5-HT2C receptor antagonist". Neuropharmacology. 36 (4–5): 621–9. doi:10.1016/s0028-3908(97)00049-x. PMID 9225287. S2CID 24930608.
- ^ Nelson DR, Thomas DR (May 1989). "[3H]-BRL 43694 (Granisetron), a specific ligand for 5-HT3 binding sites in rat brain cortical membranes". Biochemical Pharmacology. 38 (10): 1693–5. doi:10.1016/0006-2952(89)90319-5. PMID 2543418.
- ^ a b Borsini F, Giraldo E, Monferini E, Antonini G, Parenti M, Bietti G, Donetti A (September 1995). "BIMT 17, a 5-HT2A receptor antagonist and 5-HT1A receptor full agonist in rat cerebral cortex". Naunyn-Schmiedeberg's Archives of Pharmacology. 352 (3): 276–82. doi:10.1007/bf00168557. PMID 8584042. S2CID 19340842.
- ^ Plassat JL, Amlaiky N, Hen R (August 1993). "Molecular cloning of a mammalian serotonin receptor that activates adenylate cyclase". Molecular Pharmacology. 44 (2): 229–36. PMID 8394987.
- ^ Lovenberg TW, Baron BM, de Lecea L, Miller JD, Prosser RA, Rea MA, et al. (September 1993). "A novel adenylyl cyclase-activating serotonin receptor (5-HT7) implicated in the regulation of mammalian circadian rhythms". Neuron. 11 (3): 449–58. doi:10.1016/0896-6273(93)90149-l. PMID 8398139. S2CID 28729004.
- ^ Ruat M, Traiffort E, Leurs R, Tardivel-Lacombe J, Diaz J, Arrang JM, Schwartz JC (September 1993). "Molecular cloning, characterization, and localization of a high-affinity serotonin receptor (5-HT7) activating cAMP formation". Proceedings of the National Academy of Sciences of the United States of America. 90 (18): 8547–51. Bibcode:1993PNAS...90.8547R. doi:10.1073/pnas.90.18.8547. PMC 47394. PMID 8397408.
- ^ Perry CK, Casey AB, Felsing DE, Vemula R, Zaka M, Herrington NB, et al. "Synthesis of novel 5-substituted-2-aminotetralin analogs: 5-HT1A and 5-HT7 G protein-coupled receptor affinity, 3D-QSAR and molecular modeling. Bioorg Med Chem. 2020 Feb".
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ a b Blier P, Curet O, Chaput Y, de Montigny C (July 1991). "Tandospirone and its metabolite, 1-(2-pyrimidinyl)-piperazine--II. Effects of acute administration of 1-PP and long-term administration of tandospirone on noradrenergic neurotransmission". Neuropharmacology. 30 (7): 691–701. doi:10.1016/0028-3908(91)90176-c. PMID 1681447. S2CID 44297577.
- ^ a b c d Bergman J, Roof RA, Furman CA, Conroy JL, Mello NK, Sibley DR, Skolnick P (March 2013). "Modification of cocaine self-administration by buspirone (buspar®): potential involvement of D3 and D4 dopamine receptors". The International Journal of Neuropsychopharmacology. 16 (2): 445–58. doi:10.1017/S1461145712000661. PMC 5100812. PMID 22827916.
- ^ a b c Tunnicliff G (September 1991). "Molecular basis of buspirone's anxiolytic action". Pharmacology & Toxicology. 69 (3): 149–56. doi:10.1111/j.1600-0773.1991.tb01289.x. PMID 1796057.
- ^ Zuideveld KP, Rusiç-Pavletiç J, Maas HJ, Peletier LA, Van der Graaf PH, Danhof M (December 2002). "Pharmacokinetic-pharmacodynamic modeling of buspirone and its metabolite 1-(2-pyrimidinyl)-piperazine in rats". The Journal of Pharmacology and Experimental Therapeutics. 303 (3): 1130–7. doi:10.1124/jpet.102.036798. PMID 12438536. S2CID 14139919.
- ^ a b c Fava M (2007). "The combination of buspirone and bupropion in the treatment of depression". Psychotherapy and Psychosomatics. 76 (5): 311–2. doi:10.1159/000104708. PMID 17700052. S2CID 46284917.
- ^ a b Stern TA, Fava M, Wilens TE, Rosenbaum JF (27 April 2015). Massachusetts General Hospital Psychopharmacology and Neurotherapeutics E-Book. Elsevier Health Sciences. pp. 29–. ISBN 978-0-323-41323-7.
- ^ Nutt DJ, Ballenger JC (15 April 2008). Anxiety Disorders. John Wiley & Sons. pp. 395–. ISBN 978-0-470-98683-7.
- ^ Dockens RC, Salazar DE, Fulmor IE, Wehling M, Arnold ME, Croop R (November 2006). "Pharmacokinetics of a newly identified active metabolite of buspirone after administration of buspirone over its therapeutic dose range". Journal of Clinical Pharmacology. 46 (11): 1308–12. doi:10.1177/0091270006292250. PMID 17050795. S2CID 25050964.
- ^ Jajoo HK, Mayol RF, LaBudde JA, Blair IA (1989). "Metabolism of the antianxiety drug buspirone in human subjects". Drug Metabolism and Disposition. 17 (6): 634–40. PMID 2575499.
- ^ Taylor DP, Moon SL (July 1991). "Buspirone and related compounds as alternative anxiolytics". Neuropeptides. 19 Suppl: 15–9. doi:10.1016/0143-4179(91)90078-w. PMID 1679210. S2CID 13730683.
- ^ a b Allen LE, Ferguson HC, Kissel JW (May 1972). "Psychosedative agents. 2. 8-(4-Substituted 1-piperazinylalkyl)-8-azaspiro(4.5)decane-7,9-diones". Journal of Medicinal Chemistry. 15 (5): 477–9. doi:10.1021/jm00275a009. PMID 5035267.
- ^ DE 2057845, Hua, Wu Yao & Warren, Rayburn James, "Heterocyclische Azaspirodecandione und Verfahren zu herstellung [헤테로사이클릭 Azaspirodecanes and process for the preparations]", 1971-06-09를 브리스톨-meyers Coyers Coyers에 할당했다.
- ^ US4182763, Casten, George P.McKinney, Gordon R. & Newton, Roger E. et al., "Buspirone anti-불안법"은 1980-01-08년 발행되었으며, 미드 존슨사와 브리스톨-마이어스사에 할당되었다.
- ^ US 3907801, Hua, Wu Yao & Warren, Rayburn James, "N-[(4-pyridyl-peperazino)-alkyl]-azaspiroalkanediones", 1975-09-23 발행, 미드 존슨 & Co.에 할당되었습니다.
- ^ 미국 연방 의약국(1986년 9월 9일).승인 Type-1 신규 분자 입력.https://www.accessdata.fda.gov/drugsatfda_docs/nda/pre96/018731Orig1s000rev.pdf
- ^ a b Index Nominum 2000: International Drug Directory. Taylor & Francis. January 2000. pp. 149–. ISBN 978-3-88763-075-1.
- ^ Morton IK, Hall JM (6 December 2012). Concise Dictionary of Pharmacological Agents: Properties and Synonyms. Springer Science & Business Media. pp. 57–. ISBN 978-94-011-4439-1.
- ^ a b "Buspirone".
- ^ "Drugs@FDA: FDA Approved Drug Products". www.accessdata.fda.gov. Retrieved 20 September 2019.
- ^ "Determination That BUSPAR (Buspirone Hydrochloride) Tablets, 10 Milligrams, 15 Milligrams, and 30 Milligrams, Were Not Withdrawn From Sale for Reasons of Safety or Effectiveness". Federal Register. 19 October 2010. Retrieved 20 September 2019.
- ^ Rabin RC (1 February 2019). "Shortage of Anxiety Drug Leaves Patients Scrambling". The New York Times. ISSN 0362-4331. Retrieved 20 September 2019.
외부 링크
 Wikimedia Commons의 Buspirone 관련 미디어
Wikimedia Commons의 Buspirone 관련 미디어- "Buspirone". Drug Information Portal. U.S. National Library of Medicine.





