노르에스티스토론
Norethisterone | |
 | |
| 임상 데이터 | |
|---|---|
| 상호 | 단독: 아이게스틴, 카밀라, 헤더, Micronor, Primolut N, 기타, 로스트린, 로스트린, 마이크로게스틴, 모디콘, 노리닐, 오르토-노붐, 기타, 액티브라, 액티블라, 에스타리스, 클리오게스트, 네코네, 노베임, 노베임 |
| 기타 이름 | NET, 노르에틴드론, NSC-9564, LG-202, 에티닐노르테스토스테론, 노르프레그네니놀론,안히드록시 노르프로게스테론, 에티닐에스테론, 17α-에티닐-19-노르스테론, 17α-에티닐스트라-4-en-17β-ol-3-One, 17α-히드록시-19-노르프레곤-4-en-20-yn-3-One |
| AHFS/Drugs.com | 국제 의약품명 |
| Medline Plus | a604034 |
| 라이선스 데이터 | |
| 루트 행정부. | 경구주사(와 같이) |
| 약물 클래스 | 프로게스토겐(의약품), 프로게스틴 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 |
|
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 47~73%(평균 64%)[1][2] |
| 단백질 결합 | 97%:[3] 알부민: 61%;[3] SHBG: 36 %[3] |
| 대사 | 주로 CYP3A4(간),[4] 5α-/5β-환원효소, 3β-HSD/ 및 아로마타아제 |
| 반감기 제거 | 5.2~12.8시간(평균 8.0시간)[1] |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.000.619 |
| 화학 및 물리 데이터 | |
| 공식 | C20H26O2 |
| 몰 질량 | 298.426 g/120−1 |
| 3D 모델(JSmol) | |
| 녹는점 | 203 ~ 204 °C (397 ~399 °F) |
| |
| |
| (표준) | |
노르에틴드론으로도 알려져 많은 브랜드로 판매되고 있는 노르에스티론은 피임약, 갱년기 호르몬 치료, 산부인과 [3][5]질환 치료에 사용되는 프로게스틴 약물이다.이 약은 저용량 및 고용량 제제와 단독 및 [5][6]에스트로겐과 조합하여 사용할 수 있습니다.구강 또는 노르에스티론 에난트산염으로 [3][5][7]근육에 주입하여 사용한다.
노르에스티론의 부작용으로는 생리불순, 두통, 메스꺼움, 유방 압통, 기분 변화, 여드름, 머리카락 성장 [8][9]증가 등이 있다.노르에스테론은 프로게스틴 또는 합성 프로게스토겐으로 프로게스테론과 [3][5]같은 프로게스테론의 생물학적 표적인 프로게스테론 수용체의 작용제이다.그것은 주로 높은 용량으로 안드로겐과 에스트로겐의 활동이 약하고 다른 중요한 호르몬 [3][10]활동은 없습니다.
노르에스티스테론은 1951년에 발견되었고 가장 [11][12][13]먼저 개발된 프로게스틴 중 하나였다.1957년 의료용으로 처음 도입됐고 1963년 [13][14]피임약으로 사용하기 위해 에스트로겐과 함께 도입됐다.그것은 때때로 "1세대"[15][16] 프로게스틴이라고 불립니다.데소게스트렐과 함께,[17][18] 그것은 산아제한을 위한 프로게스토겐만의 "미니 알약"으로 널리 이용 가능한 유일한 프로게스틴 중 하나이다.노르에스티론은 [19]전 세계적으로 널리 판매되고 있다.제네릭 [20]의약품으로 구입할 수 있습니다.2019년에는 미국에서 143번째로 많이 처방된 의약품으로 400만 건 이상의 [21][22]처방을 받았다.그것은 세계보건기구의 필수 [23]의약품 목록에 있다.
의료 용도
노르에스티스테론은 에스트로겐(일반적으로 에티닐에스트라디올)과 결합하여 호르몬 피임약으로 사용되며 프로게스토겐 전용 알약에서만 사용됩니다.
노르에스티론의 또 다른 의학적인 용도는 자궁내막증과 관련된 통증을 완화시키는 것이다.실제로 자궁내막증 관련 골반통으로 의료 또는 외과 치료를 받은 환자의 50%가 프로게스틴 치료를 받은 경험이 있다.이는 노르에스티론이 분비기 동안 자궁내막 증식을 유도하여 자궁내막 통증 불만을 완화시키는 것으로 나타났기 때문일 수 있다.노르에스티론이 자궁내막통을 감소시키기 위해 작용하는 또 다른 방법은 배란 억제를 통해서이다.자궁내막증의 통증과 불편함은 [24]배란기에 더 심하다.
| 구성. | 양 | 브랜드명 | 사용하다 |
|---|---|---|---|
| NET만 | 낮음(예: 0.35mg) | 복수[a] | 프로게스토겐 전용 경구 피임약 |
| NET 또는 NETA만 | 고(예: 5mg, 10mg) | 복수[b] | 부인과 장애 및 기타 용도 |
| NETE만 | 주입(예: 200mg) | 복수[c] | 프로게스토겐 전용 주사 피임약 |
| 에티닐에스트라디올을 함유한 NET 또는 NETA | 낮음(예: 0.4mg, 0.5mg, 0.75mg, 1mg, 1.5mg) | 복수[d] | 복합 경구 피임약 |
| 메스트라놀을 사용한 NET | 낮음(예: 1mg, 2mg) | 복수[e] | 복합 경구 피임약 |
| 에스트라디올을 포함한 NETA | 낮음(예: 0.1mg, 0.5mg) | 복수[f] | 복합 갱년기 호르몬 요법 |
| 에스트라디올 발레이트 NETE | 주입(예: 50mg) | 복수[g] | 복합 주사 피임약 |
| 약어: NET = Norethisterone.NETA = Norethisterone 아세트산염.NETE = 노르에스티론 에난트산염. 출처:[25][26][27][28] 주의:
| |||
금지 사항
고선량(10mg/일) 노르에스티론은 간정맥 폐색성 질환과 관련이 있으며, 이 부작용으로 인해 노르에스티론은 [29]: 217 [30]이식 후 생존기간이 상당히 낮기 때문에 동종 골수이식 환자에게 투여해서는 안 된다.
부작용
피임 및 호르몬 대체 용량(0.35~1mg/일)에서 노르에스티론은 기본적으로 프로제제제닉 부작용만 가지고 있다.피임이나 폐경호르몬 치료용 노르에스테론의 임상연구는 대부분 에스트로겐과 결합돼 있어 어떤 부작용이 노르에스테론에 의한 것인지, 어떤 부작용이 에스트로겐에 의한 것인지 판단하기 어렵다.단, 장기피임약으로 사용되는 노르에스티론의 근육내 투여 프로드러그인 NETE는 에스트로겐 없이 사용되므로 그 효과와 내성을 이해하는 측면에서 노르에스티론의 대용품으로 사용할 수 있다.임상연구에서 NETE의 가장 일반적인 부작용은 장기출혈이나 반점,[29]: 253 무월경 등 생리장애였다.다른 부작용으로는 주기적인 복부 팽만감과 유방 압통이 있는데, 이 두 가지 모두 수분 유지에 의한 것으로 생각되며 이뇨제로 [29]: 253 완화될 수 있다.체중 증가와의 연관성은 없었고 혈압, 혈액 응고, 포도당 내성이 [29]: 253 모두 정상으로 유지되었다.그러나 콜레스테롤의 감소가 [29]: 253 관찰되었다.
예를 들어 산부인과 질환 치료에 사용되는 고용량(하루 5~60mg)에서 노르에스티론은 항당향성 효과로 인해 저고나디즘을 일으킬 수 있으며 에스트로겐성 및 약한 안드로겐성 부작용을 일으킬 수 있다.
NETA의 고용량(1일 10mg)은 간 [31][32][33]효소의 현저한 상승을 포함한 이상 간 기능 테스트와 관련이 있다.이러한 간 효소에는 젖산탈수소효소와 글루탐산피루브산트랜스아미나아제가 [33]포함되어 있었다.이들은 임상적 [33]관련성이 없는 것으로 설명되었지만 NETA와 관련된 상승된 간 효소는 남성 호르몬 [31][32]피임을 위한 추가적인 개발을 방해했을 수 있다.
남성 호르몬
약한 안드로겐 활동 때문에, 노르에스티론은 높은 용량([9]예: 하루에 10-40mg)에서 일부 여성들에게 여드름, 다모증, 약간의 중증도의 음성 변화와 같은 안드로겐 부작용을 일으킬 수 있습니다.그러나 [10]이는 노르에스티론 및 EE를 함유한 복합 경구 피임약의 경우 두드러지게 해당되지 않는다.이러한 제제는 에스트로겐과 함께 노르에스티론(0.35~1mg/일)[10]의 저용량을 포함하고 있으며 실제로 여드름 [34][35]증상의 개선과 관련이 있다.이에 따라 실제로 [34][35]미국 여성 여드름 치료에 대한 승인을 받았습니다.여드름 증상의 개선은 성호르몬 결합 글로불린(SHBG) 수치가 2~3배 증가하고 이에 따라 EE에 의해 유발되는 유리 테스토스테론 수치가 감소하기 때문인 것으로 여겨지며,[36] 이는 몸 안의 안드로겐 시그널링의 전반적인 감소를 초래한다.
피지선은 안드로겐에 매우 민감하며 크기와 활동은 안드로겐 [37]효과의 잠재적 지표이다.20mg/일 노르에스티론 또는 NETA의 고용량은 피지선을 유의하게 자극하는 것으로 확인되었으며, 각각 5mg/일 및 2.5mg/일 노르에스티론 및 NETA의 저용량은 피지 생성을 유의하게 자극하지 않아 유의한 안드로겐성이 [37]결여된 것으로 간주되었다.반대로 노르에스티론 0.5~3mg/일의 투여량은 용량 의존적으로 SHBG 수치를 감소시키는 것으로 밝혀졌으며, 이는 안드로겐성의 [38]또 다른 매우 민감한 지표이다.
임산부의 유산을 방지하기 위해 장기간(4-35주) 동안 투여된 노르에스티론(하루 10-40mg/mg)의 높은 경구 투여량에 대한 대규모 임상 연구에서 여성의 5.5%가 가벼운 음성 변화(호기성 여드름), 다모증과 같은 가벼운 안드로겐 부작용을 경험했으며 여성 i의 18.3%가 그러한 부작용을 경험했다고 밝혔다.산모에게서 태어난 Nfants는 대부분의 경우 [9]생식기의 남성화를 약간만 보여주었다.모성 안드로겐 증상은 15주 또는 [9]그 이상 동안 노르에스티스테론 1회 복용량을 받은 여성들에게 가장 자주 발생했다.생식기의 남성화를 경험한 여성 영아에서, 86.7%의 경우 유일한 징후는 다양했지만,[9] 거의 항상 음핵이 약간 확대되었다.영향을 받은 나머지 13.3%의 경우, 현저한 음핵 확대와 음순 주름의 부분 융접이 발생했다.[9]이러한 경우에 사용된 투여량은 하루에 20~[9]40mg이었다.
여성의 NETA의 높은 용량으로 인한 남성화에 관한 편집자에게 보낸 편지에서, 한 의사는 그들이 "신생화의 가장 가벼운 증거"를 관찰하지 못했고 그들이 하루에 30에서 60mg의 암으로 치료했던 유방암을 가진 55명의 여성들에게 "분명히 발모증이나 어떠한 목소리 변화도 없었다"고 표현했다.최장 [39]6개월 동안 울부짖다
고용량 노르에스티론은 심각한 지적 장애를 가진 여성들이 자신의 [40][41]월경을 감당할 수 없는 경우에 월경을 억제하기 위해 사용되어 왔다.2개월에서 30개월 동안 5mg/일 노르에스티론 치료 여성 118명을 대상으로 한 연구에서 이 약은 여성의 86%에서 무월경 생성에 효과적이었으며 나머지 14%[40]에서는 획기적인 출혈이 발생했다.체중 증가, 다모증, 여드름, 두통, 메스꺼움, 구토를 포함한 부작용은 모두 발병률이 증가하지 않는 것으로 나타났으며 "교란시키는 부작용"은 어느 [40][41]여성에게도 나타나지 않았다.132명의 여성을 대상으로 1일 5mg의 노르에스티론을 조사한 또 다른 연구에서도 안드로겐 부작용에 [42]대한 언급은 없었다.이러한 연구결과는 노르에스티론과의 안드로겐 부작용의 위험이 거의 또는 전혀 없음을 시사한다.[40][41]자궁내막증 증상을 억제하기 위해 치료 기간 13개월 동안 5~15mg/일 NETA로 치료한 194명의 여성을 대상으로 한 연구에서 환자의 55.2%에서 부작용이 관찰되지 않았고, 16.1%에서 체중이 증가했으며, 9.9%에서 여드름, 8.9%에서 기분 저하, 8.3%에서 발작, 두 여성에서 목소리가 심해졌다(1.0%).[43]
에스트로겐성
노르에스티스테론은 약한 에스트로겐성(EE로의 전환을 통해)이며, 이러한 이유로 여성의 유방 확대와 남성의 여성 여성 여성부인과 같은 에스트로겐성 부작용의 높은 비율과 관련이 있는 것으로 발견되었으며, 또한 폐경 [44]후 여성의 갱년기 증상 개선과 관련이 있다.NETA(및 확장 노르에스티론)의 매우 높은 용량(예: 40mg/일), EE의 높은 용량(50μg/일 이상)과 유사한 정맥 혈전 색전증(VTE)의 위험 증가 및 심지어 20MG의 순혈전 색전증(NETA)의 위험이 증가할 수 있다고 제안되었다.약 20~30μg/일의 연못 대 EE 선량은 특정 여성에서 [45][46]위험 증가와 연관될 수 있다.또한 연구에 따르면 에티닐에스트라디올과 노르에스티스테론은 노르에스티스테론의 선량이 [47]1mg일 때보다 3~4mg일 때 응고 인자에 더 큰 영향을 미치는 것으로 나타났다.이는 더 많은 양의 노르에스티스테론에 [47]의해 생성된 추가적인 에티닐에스트라디올 때문일 수 있다.
과다 복용
심지어 어린 [48]아이들에게도 노르에스티론 과다복용으로 인한 심각한 부작용에 대한 보고는 없었다.따라서, 과다 복용은 보통 [48]치료가 필요하지 않습니다.심각한 부작용 [39]없이 연장된 치료 기간에 대해 60mg/일 노르에스티론(Norethisterone)의 높은 용량에 대한 연구가 이루어졌다.
상호 작용
5α-환원효소는 노르에스티론의 신진대사에 중요한 역할을 하며, 피나스테리드, 두타스테리드 등의 5α-환원효소 억제제는 노르에스티론의 [citation needed]신진대사를 저해할 수 있다.노르에스티론은 CYP3A4에 의한 히드록실화를 통해 부분적으로 대사되며, CYP3A4의 억제제 및 유도제는 노르에스티론의 [4]순환 수준을 유의하게 변화시킬 수 있다.예를 들어 CYP3A4 유도체 리팜피신과 보센탄은 노르에스티론 피폭을 각각 42%, 23% 감소시키고 CYP3A4 유도체 카르바마제핀과 St. 존의 와트는 또한 노르에스티론 [4]클리어런스를 가속시키는 것으로 밝혀졌다.
약리학
약역학
노르에스티론은 강력한 프로게스토겐이며 안드로겐과 [3]에스트로겐이 약하다.즉, 프로게스테론 수용체(PR)의 강력한 작용제이며 안드로겐 수용체(AR)와 에스트로겐 수용체(ER)[3]의 약한 작용제이다.노르에스티스테론은 그 자체가 ER에 대해 미미한 친화력을 가지고 있다; 그것의 에스트로겐 활동은 매우 강력한 [3]에스트로겐인 에티닐에스트라디올(EE)이라는 매우 적은 양의 활성 대사물로부터 형성된다.노르에스티론 및 그 대사물은 글루코콜티코이드 수용체(GR) 및 미네랄콜티코이드 수용체(MR)에 대해 무시할 수 있는 친화력을 가지므로 글루코콜티코이드, 항루코콜티코이드, 미네랄콜티코이드 또는 항미네랄콜티코이드 [3]활성을 가지지 않는다.
| 컴파운드 | 유형a | PR | AR | ER | GR | MR | SHBG | CBG |
|---|---|---|---|---|---|---|---|---|
| 노르에스티스토론 | – | 67–75 | 15 | 0 | 0–1 | 0–3 | 16 | 0 |
| 5α-디히드로노레스티론 | 대사물 | 25 | 27 | 0 | 0 | ? | ? | ? |
| 3α,5α-테트라히드로노레스티론 | 대사물 | 1 | 0 | 0–1 | 0 | ? | ? | ? |
| 3α,5β-테트라히드로노레스티론 | 대사물 | ? | 0 | 0 | ? | ? | ? | ? |
| 3β,5α-테트라히드로노레스티론 | 대사물 | 1 | 0 | 0–8 | 0 | ? | ? | ? |
| 에티닐에스트라디올 | 대사물 | 15–25 | 1–3 | 112 | 1–3 | 0 | 0.18 | 0 |
| 아세트산노레티스테론 | 프로드러그 | 20 | 5 | 1 | 0 | 0 | ? | ? |
| 에난트산노레티스테론 | 프로드러그 | ? | ? | ? | ? | ? | ? | ? |
| 노레티노드렐 | 프로드러그 | 6 | 0 | 2 | 0 | 0 | 0 | 0 |
| 어원노디올 | 프로드러그 | 1 | 0 | 11–18 | 0 | ? | ? | ? |
| 어원디올디아세테이트 | 프로드러그 | 1 | 0 | 0 | 0 | 0 | ? | ? |
| 린에스트레놀 | 프로드러그 | 1 | 1 | 3 | 0 | 0 | ? | ? |
| 주의: 값은 백분율(%)입니다.참조 리간드(100%)는 의 경우 프로메게스톤, 의 경우 메트리볼론, 의 경우 에스트라디올, 의 경우 덱사메타손, 의 경우 알도스테론, 의 경우 디히드로테스토스테론, 의 경우 코르티솔이었다. 각주: = 활성/비활성 대사물, 프로드러그 또는 노르에스테론은 모두 해당되지 않았다.출처:"템플릿"을 참조해 주세요. | ||||||||
프로게스토겐 활성
노르에스티론은 프로게스테론의 약 150% 친화력으로 [3]PR에 결합하는 강력한 프로게스테론이다.반면 모화합물인 테스토스테론, 난드로론(19-노르테스토스테론) 및 에티스테론(17α-에티닐테스토스테론)은 [49]PR에 대한 프로게스테론의 상대적 결합 친화성의 2%, 22% 및 44%를 가진다.노르에스티론과는 달리, 주요 활성대사물인 5α-디히드로노레티스테론(5α-DHNET)은 5α-환원효소를 통해 형질전환에 의해 형성되며,[3] 프로게스테론의 25%에서만 PR에 대한 친화력이 크게 감소하지만 프로게스테론 및 현저한 항프로게스테론 [50]활성을 모두 가지고 있는 것으로 밝혀졌다.노르에스티스테론은 자궁내막변환과 같은 자궁내막과 질에 유사한 변화를 일으키며, 프로게스테론과 비교하여 여성에게서 유사한 항나트륨,[51][49][52] 배란억제 및 발열성을 보인다.
안드로겐 활성
노르에스티론은 AR에 대한 동화 안드로겐성 스테로이드(AAS) 메트리볼론(R-1881)의 친화력의 약 15%를 가지며, 이에 따라 안드로겐성이 [3]약하다.노르에스티론과는 대조적으로 노르에스티론의 주요 대사물인 5α-DHNET은 AR에 대한 친화력이 높아 메트리볼론의 [3]친화력이 약 27%이다.그러나 5α-DHNET은 노르에스티론보다 AR에 대한 친화력이 높지만, 설치류 바이오아세이에서 [53][54]노르에스티론보다 유의미하게 감소하여 안드로겐 효력이 거의 없어졌다.에티스테론(17α-에티닐테스토스테론)과 그 5α 환원 대사물에 대해서도 유사한 발견이 관찰된 반면, 5α 감소는 설치류 바이오아세이에서 [54]테스토스테론과 난드로론(19-노르테스토스테론)의 AR 친화력과 안드로겐 효력을 모두 높였다.이와 같이 C17α 위치에 있는 노르에스티스테론의 에티닐기는 5α [54]환원 시 안드로겐성의 손실을 일으키는 것으로 보인다.
노르에스티론(0.5~3mg/일)은 안드로겐의 공통 특성으로 간 SHBG [38]생성의 AR 매개 억제 때문에 순환 SHBG 수치를 용량 의존적으로 감소시키는 것으로 확인되었다.또한 에스트로겐 활성도 있어 에스트로겐은 SHBG 간 생성 및 순환 수준을 증가시키는 것으로 알려져 있기 때문에 노르에스티론의 안드로겐 활성은 에스트로겐 활성보다 높은 것으로 보인다.[38]
노르에스티론은 순환 [3]중인 SHBG에 상당한 범위(36%)까지 결합되어 있다.Norethisterone은 [55]내인성 안드로겐 및 에스트로겐보다 SHBG에 대한 친화력은 낮지만 SHBG에서 테스토스테론을 치환하여 유리 테스토스테론 수치를 증가시킬 수 있으며, 이러한 작용은 안드로겐 효과가 [56]약해지는 원인이 될 수 있다.
에스트로겐 활성
노르에스티론은 에스트라디올의 [57]상대적 결합 친화성의 0.07%와 0.01%로 ERs, ERα 및 ERβ에 결합한다.이러한 매우 낮은 상대적 친화성으로 인해, 임상 [3]농도에서 ER의 배위자로서 본질적으로 비활성화됩니다.단, 노르에스티스테론은 아로마타아제 기질로 간에서 소량(0.35%)의 강력한 에스트로겐 에티닐에스트라디올(EE)로 전환되며, 이러한 이유로 대부분의 프로게스틴과 달리 노르에스티스테론은 에스트로겐 [3]활성이 있다.그러나 경구피임약에 사용되는 노르에스티론(0.5~1mg)의 전형적인 투여량은 EE의 수치가 낮으며 임상적 [3]관련성이 없는 것으로 알려져 있다.반대로 산부인과 질환 치료에 사용되는 노르에스티론 5mg과 10mg의 선량은 0.7%와 1.0%의 비율로 변환되어 각각 [1][3]30μg과 60μg의 EE 용량에 해당하는 EE 수치를 생성한다.노르에스티론 0.5mg과 1mg에 의해 형성된 EE의 수치는 EE의 2μg 용량과 10μg 용량에 해당하는 [1]높은 용량에 기초하여 추정되었다.고용량에서 노르에스티론은 [58]EE로의 신진대사로 인한 정맥혈전 색전증의 위험을 증가시킬 수 있다.
신경스테로이드 활성
프로게스테론 및 테스토스테론과 마찬가지로 노르에스티론은 3,5-테트라히드로 대사된다.[59]이들 노르에스티론의 대사물이 각각 알로프크린놀론 및 3α-안드로스타니올과 같은 프로게스테론 및 테스토스테론의 3,5-테트라히드로 대사물과 유사하게 GABAA 수용체와 상호작용하는지 여부는 연구되지 않은 것으로 보여 [59]명확화가 필요한 주제이다.
스테로이드 생성 억제
노르에스티론은 0.1μM, 1μM에서 각각 [3]4.4%, 20.1% 억제되어 5α-환원효소 억제제로 알려져 있다.그러나 치료용 노르에스티론의 농도는 낮은 나노몰 범위에 있으므로 이 작용은 일반적인 용량에서 [3]임상적으로 관련이 없을 수 있다.
노르에스티론 및 주요 활성대사물 5α-DHNET은 불가역성 아로마타아제 억제제(각각 [60]K = 1.7μM, 9.0μM)로i 작용하는 것으로 확인되었다.그러나 5α-환원효소의 경우와 마찬가지로, 필요한 농도는 임상적으로 일반적인 [3]용량에서 관련되기에는 너무 높을 수 있다.5α-DHNET은 특히 아로마타아제 억제에서 선택적인 것으로 평가되었으며 콜레스테롤 측쇄분해효소(P450scc), 17α-히드록실라아제/17,20-리아제,[60] 21-히드록실라아제 또는 11β-히드록실라아제에는 영향을 미치지 않는다.노르에스티론과는 달리 5α-DHNET은 방향족화되지 않기 때문에 ER 양성 유방암 [60]치료의 잠재적 치료제로 제안되어 왔다.
기타 액티비티
Norethisterone은 CYP2C9 및 CYP3A4(각각 IC = 46μM 및 51μM50)의 매우 약한 억제제이지만, 이러한 작용은 치료용 순환 수준(나노몰 범위 내에 있음)을 훨씬 상회하는 매우 높은 농도의 Norethisterone을 요구하므로 임상적으로 관련이 [3]없을 수 있다.
노르에스티론 및 그 5α 환원 대사물의 일부는 성 스테로이드 수용체와 무관한 동물에서 혈관확장 효과를 발생시키는 것으로 밝혀졌으며,[61] 따라서 메커니즘상 비게놈으로 보인다.
노르에스티론은 체외에서 MCF-7 유방암 세포의 증식을 자극하며, 이는 기존의 PR과는 무관하며 대신 프로게스테론 수용체막 성분-1(PGRMC1)[62]을 통해 매개된다.프로게스테론은 [62]중성적으로 작용하는 반면, 이 분석에서 다른 프로게스틴은 유사하게 작용한다.이러한 발견이 임상 [63]연구에서 프로게스테론과 프로게스틴에서 관찰되는 유방암의 다른 위험을 설명할 수 있을지는 불분명하다.
항나토픽 효과
노르에스티스테론은 프로게스토겐 활성에 의해 시상하부-하수체-성선축(HPG축)을 억제하여 항원내방성 [3][49]효과를 가진다.높은 용량에서 노르에스티론의 에스트로겐 활성은 또한 항당향성 [64]효과에 기여할 것으로 예상된다.노르에스티스테론은 항당향성 효과로 성선호르몬 생성을 억제하고 여성의 배란을 억제하며 남성의 [3][49][65]정자 형성을 억제한다.
여성의 [3][66][67]경우 구강 노르에스티론 및 구강 NETA의 배란 억제 용량은 약 0.5mg/일이다.그러나 일부 상반된 데이터가 존재하며,[68] 이는 배란을 완전히 억제하기 위해 더 높은 선량이 필요할 수 있음을 시사한다.근육내 주입 200mg NETE는 [69][70][71][72]배란을 방지하고 여성의 에스트라디올, 프로게스테론, 황체화호르몬(LH) 및 모낭자극호르몬(FSH) 수치를 억제하는 것으로 밝혀졌다.
남성에서 20~50mg/일 용량을 사용하는 구강 노르에스티스테론에 대한 초기 연구에서는 17-케토스테로이드 배설 억제, 에티닐에스트라디올로의 전환으로 인한 에스트로겐 배설 증가, 정자 형성 억제, 성욕 및 발기 기능 억제, 그리고 유골 [73][74][75][44][76]발생률을 관찰했다.남성에게 하루에 25mg/dL의 경구 노르에스티스테론을 3주 동안 투여하면 테스토스테론 수치가 4~5일 이내에 100~200ng/dL까지 약 70% 억제되고 짧은 기간 [77][78]동안 성욕이나 발기 기능에 영향을 미치지 않는 것으로 보고되었다.
200mg의 NETE를 단독으로 또는 2mg의 에스트라디올 발레이트와 함께 근육내 주입하는 것은 [65][79][80]남성에서 최대 1개월 동안 고나도트로핀과 테스토스테론 수치를 빠르고, 강하고, 지속적으로 감소시키는 것으로 밝혀졌다.3주에 한 번씩 200mg의 NETE를 근육 내에 주사하는 것도 남성의 [73][81]정자 형성을 억제하는 것으로 밝혀졌다.
약동학
흡수.
노르에스티론의 경구 생체 이용률은 47~73%이며, 평균 경구 생체 이용률은 64%[1][2]이다.미세화는 장내 흡수를 증가시키고 장내 [3][83]신진대사를 감소시킴으로써 노르에스티론의 경구 생체 가용성을 크게 향상시키는 것으로 밝혀졌다.노르에스티론 2mg 경구 투여 시 약물의 순환 최고치는 12ng/mL(40nmol/L)인 반면, 에스트라디올 2mg과 조합한 1mg 경구 투여 시 노르에스티론 8.5ng/mL(29nmol/L)의 최대치는 1시간 투여 [3]후 나타났다.
분배
노르에스티론의 혈장 단백질 결합은 97%[3]이다.61%는 알부민에, 36%는 SHBG에 [3]결합되어 있습니다.
대사
Noretisterone의 제거 반감기는 5.2~12.8시간이며, 평균 제거 반감기는 8.0시간의 [1]제거 반감기를 가지고 있다.노르에스티스테론의 신진대사는 테스토스테론(및 난드로론)의 신진대사와 매우 유사하며, 주로 δ4 이중결합을 5α- 및 5β-디히드로노레스티론으로 환원하고, 이어서 C3 케토기를 3,5-테트라히드로노레스테론의 [3]4가지 이성질체로 환원한다.이러한 변형은 간과 뇌하수체, 자궁, 전립선, 질 및 [93]유방과 같은 간외 조직 모두에서 5α- 및 5β-환원효소 및 3α- 및 3β-히드록시스테로이드 탈수소효소에 의해 촉매된다.ER에 유의한 친화력을 가지며 어느 정도 에스트로겐성이 있는 3α, 5α, 3β, 5α-테트라히드로노레스테론을 제외하고 노르에스테론의 3,5-테트라히드로 대사물은 성 스테로이드 수용체(특히 PR, AR 및 ER)[94][95][96]에 대한 친화력 측면에서 비활성이다.소량의 노르에스티론도 방향분해효소에 의해 [1][3][45]EE로 변환된다.노르에스티론은 주로 CYP3A4에 [4]의해 히드록실화를 통해 간에서 대사된다.노르에스티스테론 및 그 대사물의 일부 결합(글루쿠론화 및 황화 포함)은 C17α에서 [3]에티닐기에 의한 입체 [93][97]장애에도 불구하고 발생한다.노르에스티스테론의 에티닐기는 모든 [3]대사물의 약 90%에 보존된다.
노르에스티론은 경구 섭취 시 프로게스테론만큼 빠르게 대사되지 않기 때문에 프로게스테론 자체와는 반대로 피임약에 사용된다.프로게스테론은 경구 섭취 시 위장관과 간에서 빠르게 대사되어 많은 다른 대사물로 분해됩니다.반면, 노르에스티론은 빠르게 대사되지 않아 노르에스티론이 더 많은 양으로 존재하여 프로게스테론 수용체 결합 부위에서 [3]더 효과적으로 경쟁할 수 있다.
소거
노르에스티론은 소변에서 33~81%,[98] 대변에서 35~43%가 제거된다.
화학
17α-에티닐-19-노르테스토스테론 또는 17α-에티닐스트라-4-en-17β-ol-3-one이라고도 알려진 노르에스티스테론은 합성 에스트란 스테로이드이며 테스토스테론의 [99][27]유도체이다.특히 C17α 위치에서 에티닐기가 첨가되고 C19 위치에서 메틸기가 제거된 테스토스테론의 유도체이며, 따라서 에티스테론(17α-에티닐테스토스테론)과 난드로론(19-노르테스토스테론)[99][27]의 결합 유도체이다.이러한 변형은 안드로겐/[100]아나볼릭 활성뿐만 아니라 프로게스토겐 활성과 경구 생체 가용성의 증가를 초래한다.
파생상품
노르에스티스테론(NET)은 19-노르테스토스테론 [101]유도체로 알려진 대부분의 프로게스틴을 포함하는 많은 프로게스틴 그룹의 모화합물이다.이 그룹은 화학 구조에 따라 에스트라네(노레티스테론의 유도체)와 고난(18-메틸고난 또는 13β-에틸에스트라네; 레보노르제스트렐의 유도체)로 나뉘며, 다음과 같은 [102]시판 의약품들을 포함한다.
|
|
이들 중 일부는 NETA, NETE, 어원노디올 디아세테이트, 린에스트레놀 및 퀸게스타놀 [103][104][105]아세테이트를 포함한 노르에스티스테론의 프로드러그 역할을 한다.노레티노드렐은 또한 [3][1]노레티스테론의 프로드러그일 수 있다.NETA는 노르에스티론과 유사하게 입으로 복용하는 반면,[10] NETE는 근육에 주입하여 투여한다.
비17α-에틸화
19-노르테스토스테론(19-NT) 프로게스틴은 기술적으로 노르에스티론 유도체는 아니지만(C17α 에티닐기를 가지지 않기 때문에) 여전히 밀접한 관련이 있다(C17α 및/또는 C16β 위치의 다른 치환과 함께) 다음과 같은 [99][27]시판 의약품은 포함한다.
- C17α 비닐(에테닐) 유도체 노르게스테론(17α-비닐-γ-19-NT5(10)) 및 노르비니스테론(17α-비닐-19-NT)
- C17α 알릴 유도체 알릴에스트레놀(3-데케토-17α-알릴-19-NT) 및 알트레노게스트(17α-알릴-γ-19-NT9,11)
- C17α 알킬 유도체 노르메탄드론(17α-메틸-19-NT)
- C17α 시아노메틸 유도체 디에노게스트(17α-시아노메틸-γ-19-NT9)
- C16β에틸유도체 옥센돌론(16β-에틸-19-NT)
노르에탄드로론과 에틸에스트레놀과 같은 19-노르테스토스테론 계열의 많은 아나볼릭 스테로이드도 강력한 프로게스토겐이지만, 결코 그렇게 시판되지 않았습니다.
합성
노르에스티론의 화학 합성물이 발표되었다.[99][82]
합성 1
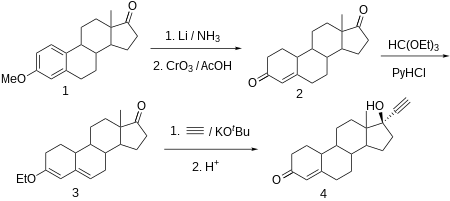
에스트라디올 3-메틸에테르(1, EME)는 난드로론 합성의 첫 단계에서도 마찬가지로 부분적으로 1.5-디엔(2)으로 환원된다.그런 다음 오페나우어 산화는 C17β 하이드록실기를 케톤 기능성(3)으로 변환한다.그런 다음 금속 아세틸라이드와 반응하여 해당 C17α 에티닐 화합물(4)을 만든다.가벼운 조건에서 에놀에테르를 가수분해하면 (5),[106] 노레티노드렐로 보인다. (레드니커는 그의 책에서 "에트노드렐"이라고 언급하지만, 어원노드렐은 염소 원자가 붙어 있다), 구강 활성 프로게스틴이다.이것은 시판되는 최초의 경구 피임약(즉, Enovid)의 프로게스토겐 성분이다.에틸에놀에테르를 강산으로 처리하면 노르에스티론(6)[11]이 된다.
실제로 이들 및 기타 모든 조합 경구 피임약은 1~2% EE 또는 메스트라놀과 경구 프로게스틴의 혼합물이다.피임 효과를 위한 프로게스틴 외에 에스트로겐의 필요성을 발견한 것은 2의 초기 단계에서 소량의 감소되지 않은 EME(1)가 존재하기 때문이라고 추측되어 왔다.이는 산화 및 에틸화를 거치면 당연히 메스트라놀(3)로 이어진다.어쨌든, 혼합물에 에스트로겐의 존재에 대한 필요성은 이제 실험적으로 잘 입증되었다.
합성 2
에스트라-4-ene-3,17-디온(볼란디온)에서 노르에스티스톤을 제조하고, 액체 암모니아 중 에스트론의 3-O-메틸에테르와 리튬의 방향족 영역을 부분적으로 환원하여 합성하고, 동시에 C17α의 케토기를 수산기로 환원하여 아세트산 삼산화물에 의해 다시 산화한다.이어서 C3에서 C4-C5 올레핀과 카르보닐기를 오르토포름산 에틸을 사용하여 디에놀에틸에테르로 변환한다.얻은 제품은 tert-butoxide 칼륨의 존재 하에서 아세틸렌에 의해 에틸화된다.생성된 O-칼륨 유도체를 염산염으로 가수분해하여 에놀에테르도 가수분해하여 나머지 이중결합을 시프트시킨 후 원하는 노르에스티론을 얻는다.
역사
노르에스티론은 1951년 [11]멕시코시티 신텍스에서 루이스 미라몬테스, 칼 제라시, 조지 로젠크란츠에 의해 처음으로 합성됐다.에스티스테론에서 유래한 것으로 프로게스토겐보다 [citation needed]약 20배 높은 효력을 가진 것으로 밝혀졌다.노르에스티스테론은 합성된 최초의 고활성 경구 프로게스토겐으로 프로게스테론(1934), 에티스테론(1938), 19-노르프로게스테론(1944) 및 17α-메틸프로게스테론(1949), 난드롤론(1950)에 의해 선행되었다.이 약은 [14]1957년 미국에서 놀루틴으로 소개되었다.[12][13]이후 노르테스티론은 메스트라놀과 결합해 1963년 미국에서 Ortho-Novum으로 판매됐다.1960년 노르티노드렐에 이어 두 번째로 경구피임약에 사용된 [13]프로게스틴이다.1964년 노르에스티스테론을 메스트라놀 또는 EE와 함께 함유한 추가 피임제(예: 놀레스트린과 노리닐)가 미국에서 [13]판매되었다.
사회와 문화
일반명
Norethisterone은 약물의 및이며, Norethindrone은 [99][27]약물의 입니다.
브랜드명
NETA와 NETE를 포함한 Norethisterone(NET)은 [27][19]전 세계에서 많은 브랜드명으로 판매되고 있습니다.
유용성
미국
Norethisterone은 이전에 미국에서 Norlutin이라는 상표명으로 5mg의 알약으로만 제공되었지만, 이 제제는 [26]이 나라에서 중단되었습니다.그러나 NETA는 미국에서 [26]Aygestin이라는 상표명으로 5mg 정제에서만 사용할 수 있습니다.그것은 미국에서 [26]이용 가능한 유일한 비침습 프로게스토겐 전용 의약품 중 하나이다.다른 물질로는 프로게스테론, 메드록시프로게스테론 아세테이트, 메게스트롤 아세테이트 및 히드록시프로게스테론 카프로에이트가 있으며 비정형제 다나졸도 [26]있다.
노르에스티론이나 NETA는 미국에서도 [26]피임약으로 구입할 수 있다.Norethisterone은 단독으로(Camila, Erin, Heather, Micronor, Nor-QD, 기타 브랜드명) 및 EE(Norinyl, Ortho-Novum, 기타) 또는 메스트라놀(Norinyl, Ortho-Novum, 기타)과 함께만 사용 가능하지만, NETA는 EElstrin과 함께 사용 가능합니다.NETE는 미국에서는 [26][112][113]어떤 형태로도 이용할 수 없습니다.
조사.
노르에스티스테론은 NETA와 NETE로 남성 호르몬 피임약으로 남성 [114][115]테스토스테론과 조합하여 사용되기 위해 연구되어 왔다.
근육 내 주입을 위한 장기 작용 노르에스티론 미세구는 피임 [116]시 잠재적 사용을 위해 연구되어 왔다.
레퍼런스
- ^ a b c d e f g h Stanczyk FZ (September 2002). "Pharmacokinetics and potency of progestins used for hormone replacement therapy and contraception". Reviews in Endocrine & Metabolic Disorders. 3 (3): 211–24. doi:10.1023/A:1020072325818. PMID 12215716. S2CID 27018468.
- ^ a b Fotherby K (August 1996). "Bioavailability of orally administered sex steroids used in oral contraception and hormone replacement therapy". Contraception. 54 (2): 59–69. doi:10.1016/0010-7824(96)00136-9. PMID 8842581.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an Kuhl H (August 2005). "Pharmacology of estrogens and progestogens: influence of different routes of administration" (PDF). Climacteric. 8 Suppl 1: 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ a b c d Korhonen T, Turpeinen M, Tolonen A, Laine K, Pelkonen O (May 2008). "Identification of the human cytochrome P450 enzymes involved in the in vitro biotransformation of lynestrenol and norethindrone". The Journal of Steroid Biochemistry and Molecular Biology. 110 (1–2): 56–66. doi:10.1016/j.jsbmb.2007.09.025. PMID 18356043. S2CID 10809537.
- ^ a b c d Taitel HF, Kafrissen ME (1995). "Norethindrone--a review of therapeutic applications". International Journal of Fertility and Menopausal Studies. 40 (4): 207–23. PMID 8520623.
- ^ Kathryn Rhodes Alden; Deitra Leonard Lowdermilk; Mary Catherine Cashion; Shannon E. Perry (27 December 2013). Maternity and Women's Health Care - E-Book. Elsevier Health Sciences. pp. 135–. ISBN 978-0-323-29368-6.
- ^ a b Kuhl H (September 1990). "Pharmacokinetics of oestrogens and progestogens". Maturitas. 12 (3): 171–97. doi:10.1016/0378-5122(90)90003-o. PMID 2170822.
- ^ https://www.accessdata.fda.gov/drugsatfda_docs/label/2007/018405s023lbl.pdf[베어 URL PDF]
- ^ a b c d e f g Jacobson BD (October 1962). "Hazards of norethindrone therapy during pregnancy". American Journal of Obstetrics and Gynecology. 84 (7): 962–8. doi:10.1016/0002-9378(62)90075-3. PMID 14450719.
- ^ a b c d IARC Working Group on the Evaluation of Carcinogenic Risks to Humans; World Health Organization; International Agency for Research on Cancer (2007). Combined Estrogen-progestogen Contraceptives and Combined Estrogen-progestogen Menopausal Therapy. World Health Organization. pp. 417–. ISBN 978-92-832-1291-1.
Norethisterone and its acetate and enanthate esters are progestogens that have weak estrogenic and androgenic properties.
- ^ a b c d Djerassi, Carl; Miramontes, L.; Rosenkranz, G.; Sondheimer, Franz (1954). "Steroids. LIV.1Synthesis of 19-Nov-17α-ethynyltestosterone and 19-Nor-17α-methyltestosterone2". Journal of the American Chemical Society. 76 (16): 4092–4094. doi:10.1021/ja01645a010. ISSN 0002-7863.
- ^ a b Donna Shoupe (7 November 2007). The Handbook of Contraception: A Guide for Practical Management. Springer Science & Business Media. pp. 15–. ISBN 978-1-59745-150-5.
- ^ a b c d e Lara Marks (2010). Sexual Chemistry: A History of the Contraceptive Pill. Yale University Press. pp. 74, 76. ISBN 978-0-300-16791-7.
- ^ a b William Andrew Publishing (22 October 2013). Pharmaceutical Manufacturing Encyclopedia, 3rd Edition. Elsevier. pp. 2935–. ISBN 978-0-8155-1856-3.
- ^ Robert Anthony Hatcher; Anita L. Nelson, M.D. (2007). Contraceptive Technology. Ardent Media. pp. 195–. ISBN 978-1-59708-001-9.
- ^ Sulochana Gunasheela (14 March 2011). Practical Management of Gynecological Problems. JP Medical Ltd. pp. 31–. ISBN 978-93-5025-240-6.
- ^ Grimes DA, Lopez LM, O'Brien PA, Raymond EG (November 2013). "Progestin-only pills for contraception". The Cochrane Database of Systematic Reviews (11): CD007541. doi:10.1002/14651858.CD007541.pub3. PMID 24226383.
- ^ Hussain SF (February 2004). "Progestogen-only pills and high blood pressure: is there an association? A literature review". Contraception. 69 (2): 89–97. doi:10.1016/j.contraception.2003.09.002. PMID 14759612.
- ^ a b "Norethisterone".
- ^ "Generic Aygestin Availability".
- ^ "The Top 300 of 2019". ClinCalc. Retrieved 16 October 2021.
- ^ "Norethindrone - Drug Usage Statistics". ClinCalc. Retrieved 16 October 2021.
- ^ World Health Organization (2021). World Health Organization model list of essential medicines: 22nd list (2021). Geneva: World Health Organization. hdl:10665/345533. WHO/MHP/HPS/EML/2021.02.
- ^ Kim JJ, Kurita T, Bulun SE (February 2013). "Progesterone action in endometrial cancer, endometriosis, uterine fibroids, and breast cancer". Endocrine Reviews. 34 (1): 130–62. doi:10.1210/er.2012-1043. PMC 3565104. PMID 23303565.
- ^ https://www.drugs.com/international/norethisterone.html
- ^ a b c d e f g h "Drugs@FDA: FDA Approved Drug Products". United States Food and Drug Administration. Retrieved 27 November 2016.
- ^ a b c d e f Index Nominum 2000: International Drug Directory. Taylor & Francis. January 2000. pp. 749–. ISBN 978-3-88763-075-1.
- ^ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans; International Agency for Research on Cancer (1 January 1999). Hormonal Contraception and Post-menopausal Hormonal Therapy (PDF). IARC. p. 65. ISBN 978-92-832-1272-0.
- ^ a b c d e Jeffrey K. Aronson (21 February 2009). Meyler's Side Effects of Endocrine and Metabolic Drugs. Elsevier. pp. 217, 253, 275. ISBN 978-0-08-093292-7.
- ^ Hägglund H, Remberger M, Klaesson S, Lönnqvist B, Ljungman P, Ringdén O (December 1998). "Norethisterone treatment, a major risk-factor for veno-occlusive disease in the liver after allogeneic bone marrow transplantation". Blood. 92 (12): 4568–72. doi:10.1182/blood.V92.12.4568. PMID 9845522.
- ^ a b Cornia PB, Anawalt BD (November 2004). "Male hormonal contraception". Expert Opinion on Emerging Drugs. 9 (2): 335–44. doi:10.1517/14728214.9.2.335. PMID 15571489. S2CID 26886374.
- ^ a b Cornia, Paul B; Anawalt, Bradley D (2005). "Male hormonal contraceptives: a potentially patentable and profitable product". Expert Opinion on Therapeutic Patents. 15 (12): 1727–1737. doi:10.1517/13543776.15.12.1727. ISSN 1354-3776. S2CID 83941717.
- ^ a b c Kamischke A, Heuermann T, Krüger K, von Eckardstein S, Schellschmidt I, Rübig A, Nieschlag E (February 2002). "An effective hormonal male contraceptive using testosterone undecanoate with oral or injectable norethisterone preparations". The Journal of Clinical Endocrinology and Metabolism. 87 (2): 530–9. doi:10.1210/jcem.87.2.8218. PMID 11836281.
- ^ a b Junkins-Hopkins JM (March 2010). "Hormone therapy for acne". Journal of the American Academy of Dermatology. 62 (3): 486–8. doi:10.1016/j.jaad.2009.12.002. PMID 20159314.
- ^ a b Arowojolu AO, Gallo MF, Lopez LM, Grimes DA (July 2012). Arowojolu AO (ed.). "Combined oral contraceptive pills for treatment of acne". The Cochrane Database of Systematic Reviews (7): CD004425. doi:10.1002/14651858.CD004425.pub6. PMID 22786490.
- ^ van Vloten WA, Sigurdsson V (2004). "Selecting an oral contraceptive agent for the treatment of acne in women". American Journal of Clinical Dermatology. 5 (6): 435–41. doi:10.2165/00128071-200405060-00008. PMID 15663340. S2CID 9947402.
- ^ a b Pochi PE, Strauss JS (December 1965). "Lack of androgen effect on human sebaceous glands with low-dosage norethindrone". American Journal of Obstetrics and Gynecology. 93 (7): 1002–4. doi:10.1016/0002-9378(65)90162-6. PMID 5843402.
- ^ a b c d Kuhnz W, Heuner A, Hümpel M, Seifert W, Michaelis K (December 1997). "In vivo conversion of norethisterone and norethisterone acetate to ethinyl etradiol in postmenopausal women". Contraception. 56 (6): 379–85. doi:10.1016/s0010-7824(97)00174-1. PMID 9494772.
- ^ a b Curwen, S. (1962). "Virilization with Norethisterone". BMJ. 1 (5289): 1415. doi:10.1136/bmj.1.5289.1415-a. ISSN 0959-8138. PMC 1958463.
- ^ a b c d Roxburgh DR, West MJ (August 1973). "The use of norethisterone to suppress menstruation in the intellectually severely retarded woman". The Medical Journal of Australia. 2 (7): 310–3. doi:10.5694/j.1326-5377.1973.tb128175.x. PMID 4746398. S2CID 204094551.
- ^ a b c Roxburgh DR, West MJ (August 1973). "The use of norethisterone to suppress menstruation in the intellectually severely retarded woman". The Medical Journal of Australia. 2 (7): 310–3. doi:10.1097/00006254-197408000-00021. PMID 4746398.
- ^ Board JA (April 1965). "Clinical Evaluation of the Oral Contraceptive Use of Norethindrone 5 Mg. Plus Mestranol 0.075 Mg". Canadian Medical Association Journal. 92: 814–7. PMC 1927985. PMID 14272499.
- ^ Kaser DJ, Missmer SA, Berry KF, Laufer MR (April 2012). "Use of norethindrone acetate alone for postoperative suppression of endometriosis symptoms". Journal of Pediatric and Adolescent Gynecology. 25 (2): 105–108. doi:10.1016/j.jpag.2011.09.013. PMID 22154396.
- ^ a b Paulsen CA, Leach RB, Lanman J, Goldston N, Maddock WO, Heller CG (October 1962). "Inherent estrogenicity of norethindrone and norethynodrel: comparison with other synthetic progestins and progesterone". The Journal of Clinical Endocrinology and Metabolism. 22 (10): 1033–9. doi:10.1210/jcem-22-10-1033. PMID 13942007.
- ^ a b Chu MC, Zhang X, Gentzschein E, Stanczyk FZ, Lobo RA (June 2007). "Formation of ethinyl estradiol in women during treatment with norethindrone acetate". The Journal of Clinical Endocrinology and Metabolism. 92 (6): 2205–7. doi:10.1210/jc.2007-0044. PMID 17341557.
- ^ Anne Connolly; Amanda Britton (31 March 2017). Women's Health in Primary Care. Cambridge University Press. pp. 153–. ISBN 978-1-108-16595-2.
- ^ a b Farris M, Bastianelli C, Rosato E, Brosens I, Benagiano G (October 2017). "Pharmacodynamics of combined estrogen-progestin oral contraceptives: 2. effects on hemostasis". Expert Review of Clinical Pharmacology. 10 (10): 1129–1144. doi:10.1080/17512433.2017.1356718. PMID 28712325. S2CID 205931204.
- ^ a b https://www.accessdata.fda.gov/drugsatfda_docs/label/2014/016954s106lbl.pdf[베어 URL PDF]
- ^ a b c d e Kuhl H (2011). "Pharmacology of Progestogens" (PDF). J Reproduktionsmed Endokrinol. 8 (1): 157–177.
- ^ Chu YH, Li QA, Zhao ZF, Zhou YP, Cao DC (June 1985). "[Antiprogestational action of 5 alpha-dihydronorethisterone]". Zhongguo Yao Li Xue Bao = Acta Pharmacologica Sinica (in Chinese). 6 (2): 125–9. PMID 2934946.
- ^ Linda E. McCuistion; Joyce LeFever Kee; Evelyn R. Hayes (25 March 2014). Pharmacology: A Patient-Centered Nursing Process Approach. Elsevier Health Sciences. pp. 846–. ISBN 978-0-323-29348-8.
- ^ Greenblatt RB (July 1956). "The progestational activity of 17-alpha-ethinyl-19-nortestosterone". The Journal of Clinical Endocrinology and Metabolism. 16 (7): 869–75. doi:10.1210/jcem-16-7-869. PMID 13332050.
- ^ Fragkaki AG, Angelis YS, Koupparis M, Tsantili-Kakoulidou A, Kokotos G, Georgakopoulos C (February 2009). "Structural characteristics of anabolic androgenic steroids contributing to binding to the androgen receptor and to their anabolic and androgenic activities. Applied modifications in the steroidal structure". Steroids. 74 (2): 172–97. doi:10.1016/j.steroids.2008.10.016. PMID 19028512. S2CID 41356223.
Many synthetic steroids with high myotrophic activity exhibit myotrophic–androgenic dissociation, since, due to changes introduced in the structure of ring A, they will probably not be substrates for the 5α-reductases [85]. 5α-Reduction does not always amplify the androgenic potency in spite of high RBA of androgens to the AR. This is the case for norethisterone (Fig. 1, 34), a synthetic 19-nor-17α-ethynyl testosterone derivative, which also undergoes enzyme-mediated 5α-reduction and exerts potent androgenic effects in target organs. 5α-Reduced norethisterone displays a higher AR binding but shows a significantly lower androgenic potency than unchanged norethisterone [102,103].
- ^ a b c Lemus AE, Enríquez J, García GA, Grillasca I, Pérez-Palacios G (January 1997). "5alpha-reduction of norethisterone enhances its binding affinity for androgen receptors but diminishes its androgenic potency". The Journal of Steroid Biochemistry and Molecular Biology. 60 (1–2): 121–9. doi:10.1016/s0960-0760(96)00172-0. PMID 9182866. S2CID 33771349.
- ^ Marcus Filshie; John Guillebaud (22 October 2013). Contraception: Science and Practice. Elsevier Science. pp. 26–. ISBN 978-1-4831-6366-6.
Norethisterone binds to SHBG with less affinity than endogenous androgens and oestrogens [...]
- ^ Ricardo Azziz (8 November 2007). Androgen Excess Disorders in Women. Springer Science & Business Media. pp. 124–. ISBN 978-1-59745-179-6.
- ^ Kuiper GG, Carlsson B, Grandien K, Enmark E, Häggblad J, Nilsson S, Gustafsson JA (March 1997). "Comparison of the ligand binding specificity and transcript tissue distribution of estrogen receptors alpha and beta". Endocrinology. 138 (3): 863–70. doi:10.1210/endo.138.3.4979. PMID 9048584.
- ^ Wiegratz I, Kuhl H (September 2006). "Metabolic and clinical effects of progestogens". The European Journal of Contraception & Reproductive Health Care. 11 (3): 153–61. doi:10.1080/13625180600772741. PMID 17056444. S2CID 27088428.
- ^ a b Giatti S, Melcangi RC, Pesaresi M (August 2016). "The other side of progestins: effects in the brain". Journal of Molecular Endocrinology. 57 (2): R109-26. doi:10.1530/JME-16-0061. PMID 27339142.
- ^ a b c Yamamoto T, Tamura T, Kitawaki J, Osawa Y, Okada H (June 1994). "Suicide inactivation of aromatase in human placenta and uterine leiomyoma by 5 alpha-dihydronorethindrone, a metabolite of norethindrone, and its effect on steroid-producing enzymes". European Journal of Endocrinology. 130 (6): 634–40. doi:10.1530/eje.0.1300634. PMID 8205267.
- ^ Perusquía M, Villalón CM, Navarrete E, García GA, Pérez-Palacios G, Lemus AE (August 2003). "Vasodilating effect of norethisterone and its 5 alpha metabolites: a novel nongenomic action". European Journal of Pharmacology. 475 (1–3): 161–9. doi:10.1016/s0014-2999(03)02106-x. PMID 12954372.
- ^ a b Neubauer H, Ma Q, Zhou J, Yu Q, Ruan X, Seeger H, et al. (October 2013). "Possible role of PGRMC1 in breast cancer development". Climacteric. 16 (5): 509–13. doi:10.3109/13697137.2013.800038. PMID 23758160. S2CID 29808177.
- ^ Trabert B, Sherman ME, Kannan N, Stanczyk FZ (April 2020). "Progesterone and Breast Cancer". Endocrine Reviews. 41 (2): 320–344. doi:10.1210/endrev/bnz001. PMC 7156851. PMID 31512725.
- ^ Anderson RA, Baird DT (December 2002). "Male contraception" (PDF). Endocrine Reviews. 23 (6): 735–62. doi:10.1210/er.2002-0002. PMID 12466187.
- ^ a b Kamischke A, Nieschlag E (January 2004). "Progress towards hormonal male contraception". Trends in Pharmacological Sciences. 25 (1): 49–57. doi:10.1016/j.tips.2003.11.009. PMID 14723979.
- ^ Rudel HW (September 1968). "Pharmacology of oral contraceptives". Clinical Obstetrics and Gynecology. 11 (3): 632–44. doi:10.1097/00003081-196811030-00002. PMID 4878826.
- ^ Stanczyk FZ (November 2003). "All progestins are not created equal". Steroids. 68 (10–13): 879–90. doi:10.1016/j.steroids.2003.08.003. PMID 14667980. S2CID 44601264.
- ^ Endrikat J, Gerlinger C, Richard S, Rosenbaum P, Düsterberg B (December 2011). "Ovulation inhibition doses of progestins: a systematic review of the available literature and of marketed preparations worldwide". Contraception. 84 (6): 549–57. doi:10.1016/j.contraception.2011.04.009. PMID 22078182.
- ^ Shoupe, Donna (1993). "Injectable Contraceptives and Contraceptive Vaginal Rings". Clinical Perspectives in Obstetrics and Gynecology: 144–157. doi:10.1007/978-1-4612-2730-4_13. ISBN 978-1-4612-7645-6. ISSN 0178-0328.
- ^ Weiner E, Johansson ED (April 1975). "Plasma levels of norethindrone after i.m. injection of 200 mg norethindrone enanthate". Contraception. 11 (4): 419–25. doi:10.1016/0010-7824(75)90004-9. PMID 1122756.
- ^ Fotherby K, Howard G, Shrimanker K, Elder M, Bye PG (December 1977). "Effect of norethisterone oenanthate on serum gonadotrophin levels". Contraception. 16 (6): 591–604. doi:10.1016/0010-7824(77)90060-9. PMID 606499.
- ^ Goebelsmann U, Stanczyk FZ, Brenner PF, Goebelsmann AE, Gentzschein EK, Mishell DR (March 1979). "Serum norethindrone (NET) concentrations following intramuscular NET enanthate injection. Effect upon serum LH, FSH, estradiol and progesterone". Contraception. 19 (3): 283–313. doi:10.1016/0010-7824(79)90022-2. PMID 572279.
- ^ a b Neumann F, Diallo FA, Hasan SH, Schenck B, Traore I (1976). "The influence of pharmaceutical compounds on male fertility". Andrologia. 8 (3): 203–35. doi:10.1111/j.1439-0272.1976.tb02137.x. PMID 793446. S2CID 24859886.
- ^ Heller CG, Laidlaw WM, Harvey HT, Nelson WO (July 1958). "Effects of progestational compounds on the reproductive processes of the human male". Annals of the New York Academy of Sciences. 71 (5): 649–65. doi:10.1111/j.1749-6632.1958.tb54641.x. PMID 13583821. S2CID 32637425.
- ^ Heller CG, Moore DJ, Paulsen CA, Nelson WO, Laidlaw WM (December 1959). "Effects of progesterone and synthetic progestins on the reproductive physiology of normal men". Federation Proceedings. 18: 1057–65. PMID 14400846.
- ^ Paulsen CA (March 1965). "Progestin Metabolism: Special Reference to Estrogenic Pathways". Metabolism. 14 (3): SUPPL:313–9. doi:10.1016/0026-0495(65)90018-1. PMID 14261416.
- ^ Moudgal NR, Suresh R (1995). "Some thoughts on development of chemically based male contraceptives" (PDF). Current Science (Bangalore). 68 (4): 470–474. ISSN 0011-3891.
- ^ Johonsson, Elof D.B.; Nygren, Karl-Gosta (1973). "Depression of plasma testosterone levels in men with norethindrone". Contraception. 8 (3): 219–226. doi:10.1016/0010-7824(73)90032-2. ISSN 0010-7824.
- ^ Amory, John K. (2003). "Androgens and Male Contraception". Androgens in Health and Disease: 405–417. doi:10.1007/978-1-59259-388-0_21. ISBN 978-1-61737-314-5.
- ^ Kamischke A, Diebäcker J, Nieschlag E (September 2000). "Potential of norethisterone enanthate for male contraception: pharmacokinetics and suppression of pituitary and gonadal function". Clinical Endocrinology. 53 (3): 351–8. doi:10.1046/j.1365-2265.2000.01097.x. PMID 10971453. S2CID 70515136.
- ^ Petry, R.; Mauss, J.; Senge, Th.; Rausch-stroomann, J.-G. (1970). "Über den Einfluß von Cyproteronacetat, Norethisteronönanthat und Gestonoroncapronat auf die Hypophysen-Gonadenachse beim Mann" [Influence of Cyproterone-acetate, Norethisterone-enanthate and Gestonorone-capronate on the Hypophyseal-Gonadal-Axis in the Male]. Endokrinologie der Entwicklung und Reifung: 428–430. doi:10.1007/978-3-642-80591-2_118.
- ^ a b Die Gestagene. Springer-Verlag. 27 November 2013. pp. 13–14, 283–284. ISBN 978-3-642-99941-3.
- ^ Saperstein S, Edgren RA, Jung D, Mroszczak EJ, Lee GJ, Dorr A, Pritchard R, Kushinsky S, Fong JC, Combs DL (December 1989). "Pharmacokinetics of norethindrone: effect of particle size". Contraception. 40 (6): 731–40. doi:10.1016/0010-7824(89)90075-9. PMID 2620531.
- ^ Friedrich C, Berse M, Klein S, Rohde B, Höchel J (June 2018). "In Vivo Formation of Ethinylestradiol After Intramuscular Administration of Norethisterone Enantate". Journal of Clinical Pharmacology. 58 (6): 781–789. doi:10.1002/jcph.1079. PMID 29522253. S2CID 3813229.
- ^ J. H. H. Thijssen (September 1972). "Metabolism of Orally Active Synthetic Progestational Compounds". In M. Tausk (ed.). Pharmacology of the Endocrine System and Related Drugs: Progesterone, Progestational Drugs and Antifertility Agents. Vol. II. Pergamon Press. pp. 217–273. ISBN 978-0080168128. OCLC 278011135.
- ^ Okada, Hiroji (2010). "Receptors and Mechanism Action of Synthetic Progestogens". Asia-Oceania Journal of Obstetrics and Gynaecology. 7 (1): 15–27. doi:10.1111/j.1447-0756.1981.tb00511.x. ISSN 0389-2328.
- ^ Briggs, M. H. (1980). "Comparative Pharmacodynamics and Pharmacokinetics of Contraceptive Steroids in Animals and Man: A Selective Review". Clinical Pharmacology & Therapeutics. pp. 493–518. doi:10.1007/978-1-349-05952-2_57. ISBN 978-1-349-05954-6.
- ^ Thomas, John A.; Keenan, Edward J. (1986). "Progestins and Oral Contraceptives". Principles of Endocrine Pharmacology. pp. 167–196. doi:10.1007/978-1-4684-5036-1_8. ISBN 978-1-4684-5036-1.
- ^ Orme ML, Back DJ, Breckenridge AM (1983). "Clinical pharmacokinetics of oral contraceptive steroids". Clin Pharmacokinet. 8 (2): 95–136. doi:10.2165/00003088-198308020-00001. PMID 6342899. S2CID 43298472.
- ^ Fotherby K (1974). "Metabolism of synthetic steroids by animals and man". Acta Endocrinol Suppl (Copenh). 185: 119–47. doi:10.1530/acta.0.075s119. PMID 4206183.
- ^ Kuhl H, Wiegratz I (August 2007). "Can 19-nortestosterone derivatives be aromatized in the liver of adult humans? Are there clinical implications?". Climacteric. 10 (4): 344–53. doi:10.1080/13697130701380434. PMID 17653961. S2CID 20759583.
- ^ Stanczyk, Frank Z.; Roy, Subir (1990). "Metabolism of levonorgestrel, norethindrone, and structurally related contraceptive steroids". Contraception. 42 (1): 67–96. doi:10.1016/0010-7824(90)90093-B. ISSN 0010-7824. PMID 2143719.
- ^ a b Schoonen WG, Deckers GH, de Gooijer ME, de Ries R, Kloosterboer HJ (November 2000). "Hormonal properties of norethisterone, 7alpha-methyl-norethisterone and their derivatives". The Journal of Steroid Biochemistry and Molecular Biology. 74 (4): 213–22. doi:10.1016/s0960-0760(00)00125-4. PMID 11162927. S2CID 19797254.
[...] several mono- and disulphated as well as mono- and diglucuronidated metabolites of NET have been detected in urine from NET treated women [16,17]. In unconjugated form these NET (or MeNET) metabolites are represented by 5α- and 5β-reduced NET (5α-NET or 5β-NET) and by 3α- and 3β-hydrogenated 5α-NET and 5β-NET, leading to 3α,5α-NET, 3β,5α-NET, 3α,5β-NET and 3β,5β-NET or their corresponding MeNET metabolites (Figs. 1 and 2). These steroid conversions of NET or MeNET may take place in the liver, but also in the pituitary, endometrium, prostate, vagina and breast. The enzymes involved in these metabolic processes are 5α- and 5β-reductase as well as 3α- and 3β-hydroxysteroid dehydrogenase (HSD).
- ^ Chávez BA, Vilchis F, Pérez AE, García GA, Grillasca I, Pérez-Palacios G (January 1985). "Stereospecificity of the intracellular binding of norethisterone and its A-ring reduced metabolites". Journal of Steroid Biochemistry. 22 (1): 121–6. doi:10.1016/0022-4731(85)90151-7. PMID 3871879.
- ^ Garza-Flores J, Vilchis F, García GA, Menjívar M, Pérez-Palacios G (June 1986). "A-ring reduction enhances the antigonadotropic potency of norethisterone". Acta Endocrinologica. 112 (2): 278–83. doi:10.1530/acta.0.1120278. PMID 3090814.
- ^ Lemus AE, Enríquez J, Hernández A, Santillán R, Pérez-Palacios G (February 2009). "Bioconversion of norethisterone, a progesterone receptor agonist into estrogen receptor agonists in osteoblastic cells". The Journal of Endocrinology. 200 (2): 199–206. doi:10.1677/JOE-08-0166. PMID 19008332.
- ^ Scarsi KK, Darin KM, Chappell CA, Nitz SM, Lamorde M (November 2016). "Drug-Drug Interactions, Effectiveness, and Safety of Hormonal Contraceptives in Women Living with HIV". Drug Safety. 39 (11): 1053–1072. doi:10.1007/s40264-016-0452-7. PMC 5048570. PMID 27562873.
- ^ Leslie J. DeGroot (2001). Endocrinology. W.B. Saunders Co. p. 2617. ISBN 978-0-7216-7843-6.
- ^ a b c d e Elks J (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 886–. ISBN 978-1-4757-2085-3.
- ^ Chwalisz K, Surrey E, Stanczyk FZ (June 2012). "The hormonal profile of norethindrone acetate: rationale for add-back therapy with gonadotropin-releasing hormone agonists in women with endometriosis". Reproductive Sciences. 19 (6): 563–71. doi:10.1177/1933719112438061. PMID 22457429. S2CID 2882899.
- ^ Donna Shoupe; Florence P. Haseltine (6 December 2012). Contraception. Springer Science & Business Media. pp. 112–. ISBN 978-1-4612-2730-4.
- ^ Kenneth J. Ryan (1999). Kistner's Gynecology and Women's Health. Mosby. p. 292. ISBN 978-0-323-00201-1.
- ^ Hammerstein J (December 1990). "Prodrugs: advantage or disadvantage?". American Journal of Obstetrics and Gynecology. 163 (6 Pt 2): 2198–203. doi:10.1016/0002-9378(90)90561-K. PMID 2256526.
- ^ Edelman AB, Cherala G, Stanczyk FZ (October 2010). "Metabolism and pharmacokinetics of contraceptive steroids in obese women: a review". Contraception. 82 (4): 314–23. doi:10.1016/j.contraception.2010.04.016. PMID 20851224.
- ^ Raynaud JP, Ojasoo T (November 1986). "The design and use of sex-steroid antagonists". Journal of Steroid Biochemistry. 25 (5B): 811–33. doi:10.1016/0022-4731(86)90313-4. PMID 3543501.
Similar androgenic potential is inherent to norethisterone and its prodrugs (norethisterone acetate, ethynodiol diacetate, lynestrenol, norethynodrel, quingestanol [acetate]).
- ^ a b 프랭크 B.Colton, 미국 특허 2,655,518(1952년 Searle & Co.)
- ^ Ringold, H. J.; Rosenkranz, G.; Sondheimer, F. (1956). "Steroids. LXXX.11-Methyl-19-nortestosterone and 1-Methyl-17α-ethinyl-19-nortestosterone". Journal of the American Chemical Society. 78 (11): 2477–2479. doi:10.1021/ja01592a037.
- ^ Ueberwasser, H.; Heusler, K.; Kalvoda, J.; Meystre, C.; Wieland, P.; Anner, G.; Wettstein, A. (1963). "19-Norsteroide II. Ein einfaches Herstellungsverfahren für 19-Norandrostan-Derivate. über Steroide, 193. Mitteilung". Helvetica Chimica Acta. 46: 344–352. doi:10.1002/hlca.19630460135.
- ^ Onken D, Heublein D (January 1970). "[Ethinylated steroids]". Die Pharmazie. 25 (1): 3–9. PMID 4914401.
- ^ 미국 특허 2,744,122
- ^ 미국 특허 2,774,777
- ^ Vern L. Bullough (2001). Encyclopedia of Birth Control. ABC-CLIO. pp. 145–. ISBN 978-1-57607-181-6.
- ^ Ellen H. Moskowitz; Bruce Jennings (13 September 1996). Coerced Contraception?: Moral and Policy Challenges of Long Acting Birth Control. Georgetown University Press. pp. 40–. ISBN 978-1-58901-807-5.
- ^ Nieschlag E (November 2010). "Clinical trials in male hormonal contraception" (PDF). Contraception. 82 (5): 457–70. doi:10.1016/j.contraception.2010.03.020. PMID 20933120.
- ^ Nieschlag, Eberhard; Behre, Hermann M.; Nieschlag, Eberhard; Behre, Hermann M.; Nieschlag, Susan (2012). Nieschlag, Eberhard; Behre, Hermann M; Nieschlag, Susan (eds.). "The essential role of testosterone in hormonal male contraception". Testosterone: 470–493. doi:10.1017/CBO9781139003353.023. ISBN 9781139003353.
- ^ Benagiano G, Primiero FM (June 1983). "Long acting contraceptives. Present status". Drugs. 25 (6): 570–609. doi:10.2165/00003495-198325060-00003. PMID 6223801. S2CID 45898359.
추가 정보
- Brogden RN, Speight TM, Avery GS (1973). "Progestagen-only oral contraceptives: a preliminary report of the action and clinical use of norgestrel and norethisterone". Drugs. 6 (3): 169–81. doi:10.2165/00003495-197306030-00004. PMID 4130566. S2CID 42295736.
- "Norethisterone and norethisterone acetate". IARC Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Humans. 21: 441–60. December 1979. PMID 120838.
- Stanczyk FZ, Roy S (July 1990). "Metabolism of levonorgestrel, norethindrone, and structurally related contraceptive steroids". Contraception. 42 (1): 67–96. doi:10.1016/0010-7824(90)90093-b. PMID 2143719.
- Wiseman LR, McTavish D (March 1994). "Transdermal estradiol/norethisterone. A review of its pharmacological properties and clinical use in postmenopausal women". Drugs & Aging. 4 (3): 238–56. doi:10.2165/00002512-199404030-00006. PMID 8199397. S2CID 68007924.
- Taitel HF, Kafrissen ME (1995). "Norethindrone--a review of therapeutic applications". International Journal of Fertility and Menopausal Studies. 40 (4): 207–23. PMID 8520623.
- Maier WE, Herman JR (August 2001). "Pharmacology and toxicology of ethinyl estradiol and norethindrone acetate in experimental animals". Regulatory Toxicology and Pharmacology. 34 (1): 53–61. doi:10.1006/rtph.2001.1483. PMID 11502156.
- Riis BJ, Lehmann HJ, Christiansen C (October 2002). "Norethisterone acetate in combination with estrogen: effects on the skeleton and other organs. A review". American Journal of Obstetrics and Gynecology. 187 (4): 1101–16. doi:10.1067/mob.2002.122852. PMID 12389012.
- Draper BH, Morroni C, Hoffman M, Smit J, Beksinska M, Hapgood J, Van der Merwe L (July 2006). "Depot medroxyprogesterone versus norethisterone oenanthate for long-acting progestogenic contraception". The Cochrane Database of Systematic Reviews (3): CD005214. doi:10.1002/14651858.CD005214.pub2. PMID 16856087.
- Kuhl H, Wiegratz I (August 2007). "Can 19-nortestosterone derivatives be aromatized in the liver of adult humans? Are there clinical implications?". Climacteric. 10 (4): 344–53. doi:10.1080/13697130701380434. PMID 17653961. S2CID 20759583.
- Casey CL, Murray CA (2008). "HT update: spotlight on estradiol/norethindrone acetate combination therapy". Clinical Interventions in Aging. 3 (1): 9–16. doi:10.2147/cia.s1663. PMC 2544373. PMID 18488874.
- Paulen ME, Curtis KM (October 2009). "When can a woman have repeat progestogen-only injectables--depot medroxyprogesterone acetate or norethisterone enantate?". Contraception. 80 (4): 391–408. doi:10.1016/j.contraception.2009.03.023. PMID 19751863.
- Chwalisz K, Surrey E, Stanczyk FZ (June 2012). "The hormonal profile of norethindrone acetate: rationale for add-back therapy with gonadotropin-releasing hormone agonists in women with endometriosis". Reproductive Sciences. 19 (6): 563–71. doi:10.1177/1933719112438061. PMID 22457429. S2CID 2882899.
외부 링크
- "Norethindrone". Drug Information Portal. U.S. National Library of Medicine.

![Norethisterone and ethinylestradiol levels over 24 hours after a single oral dose of 10 mg NETA in postmenopausal women.[38]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e5/Norethisterone_and_ethinylestradiol_levels_after_a_single_oral_dose_of_10_mg_norethisterone_acetate_in_postmenopausal_women.png/450px-Norethisterone_and_ethinylestradiol_levels_after_a_single_oral_dose_of_10_mg_norethisterone_acetate_in_postmenopausal_women.png)
![Norethisterone and ethinylestradiol levels over 8 weeks after a single intramuscular injection of 200 mg NETE in premenopausal women.[84]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Norethisterone_and_ethinylestradiol_levels_after_a_single_intramuscular_injection_of_200_mg_norethisterone_enanthate_in_premenopausal_women.png/450px-Norethisterone_and_ethinylestradiol_levels_after_a_single_intramuscular_injection_of_200_mg_norethisterone_enanthate_in_premenopausal_women.png)