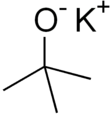테르트부산화칼륨
Potassium tert-butoxide| | |||
 | |||
| 이름 | |||
|---|---|---|---|
| 선호 IUPAC 이름 테르트부산화칼륨 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 켐스파이더 | |||
| ECHA InfoCard | 100.011.583 | ||
펍켐 CID | |||
| 유니 | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| C4H9KO | |||
| 어금질량 | 112.21 g mol−1 | ||
| 외관 | 실체가 있는 | ||
| 녹는점 | 256°C(493°F, 529K) | ||
| 디에틸에테르 내 용해성 | 4.34 g/100 g(25-26 °C)[1] | ||
| 헥산에서의 용해성 | 0.27 g/100 g(25-26 °C)[1] | ||
| 톨루엔의 용해성 | 2.27 g/100 g(25-26 °C)[1] | ||
| THF의 용해성 | 25.00 g/100 g(25-26 °C)[1] | ||
| 위험 | |||
| GHS 라벨 표시:[2] | |||
  | |||
| 위험 | |||
| H228, H252, H314 | |||
| P405 | |||
| 안전 데이터 시트(SDS) | 옥스퍼드 MSDS | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
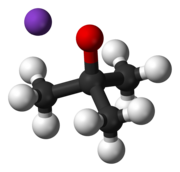
테르트부토산화칼륨은+ K(CH3)3CO라는− 공식을 가진 화학 화합물이다. 이 무색 고체는 강한 염기(pKa of conjate acid, 17세 전후)로 유기합성에 유용하다. 사철 큐방형 성단으로 존재한다. 화학 문헌에 흔히 t-부토화칼륨으로 쓰여진다. 화합물은 흔히 소금으로 묘사되며, 그런 작용을 하는 경우가 많지만 용액에서는 이온화되지 않는다.
준비
t-부토화칼륨은 용액으로서나 고체로 상업적으로 구할 수 있지만, 샘플이 너무 민감하고 오래된 샘플은 종종 품질이 좋지 않기 때문에 실험실에서 사용하는 자리에서 생성되는 경우가 많다. 건조한 테르트부틸알코올과 칼륨 금속의 반응에 의해 준비된다.[3] 고체는 이러한 용액을 증발시킨 후 고체를 가열함으로써 얻는다. 고체는 220 °C와 1 mmHg에서 승화시켜 정제할 수 있다. 승화는 140 °C와 0.01 hPa에서도 일어날 수 있다. 테르트-부탄올산칼륨은 '붕괴'하는 경향이 있어 승화 과정에서 부품을 위로 던질 수 있으므로 원료를 유리모양으로 덮는 것이 좋다. 불활성 승화 장치를 이용한 무수 제거가 특히 유리하다.
구조
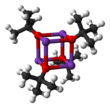
-20°C에서 [tBuOK·tBu]로 테트라하이드로푸란/펜탄의 테르트-산화칼륨 결정체수소 결합으로 연결된 무한 1차원 체인으로 구성된 OH].∞ [tBuOK·tBu]의 승화OH]∞는 큐바인 같은 구조를 채택한 테트라머[tBuOK]4를 제공한다. THF와 디에틸에테르와 같은 마일드 루이스의 기본 용제는 고체, 용액, 심지어 가스 단계에서도 지속되는 사선 구조를 분해하지 않는다.[4]
적용들
테르트 부토화수소 종은 유기화학에서 강력한 비핵세포 기반으로서 그 자체가 유용하다.[5] 아미드 염기(예: 리튬 이소프로필아미드)만큼 강하지는 않지만 수산화칼륨보다 강하다. 그것의 견고한 부피는 윌리엄슨 에테르 합성이나 S2N 반응과 같은 핵포화성 첨가물에 그룹이 참여하는 것을 억제한다. t-부토산화칼륨에 의해 감압되는 기질에는 단자 아세틸렌과 활성 메틸렌 화합물이 포함된다. 탈수반응에 유용하다.
테르트-부토산화칼륨은 수산화질소와 헤테로사이클릭 화합물의 반응을 촉진하여 실릴 유도체를 제공하고 H를2 방출한다.[6]
수정
이 시약의 반응성에 영향을 미치는 많은 수정 사항이 보고되었다. 화합물은 복잡한 클러스터 구조(인접된 사진은 단순화된 만화)를 채택하고 있으며, 클러스터를 수정하는 첨가제는 시약의 반응성에 영향을 미친다. 예를 들어 DMF, DMSO, 헥사메틸인스포라미드(HMPA), 18크라운-6은 칼륨 중심과 상호작용을 하여 부토산화물의 기본성을 향상시킨다. 알카산화물과 알킬 리튬 화합물이 혼합된 슐로저의 베이스는 연관성이 있지만 강한 베이스다.[5]
반응
테르트-부토산화칼륨은 클로로포름과 반응하여 디클로로카르베인을 생성하며,[7] 그 반응은 발화를 초래할 수 있다.[8] 테르트-부토산화칼륨은 디클로로메탄에 절대 첨가되어서는 안 된다.[9]
베이스로 테르트부토산화칼륨은 베타프로톤을 추출해 제거반응을 통해 호프만 제품을 형성할 수 있다. 이 반응은 결과 알켄, 특히 역화학반응의 추가반응을 설정할 수 있기 때문에 합성가치가 높다.
관련 화합물
참조
- ^ a b c d Caine D. (2006). "Potassiumtert-Butoxide". Potassium tert-Butoxide. e-EROS Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rp198.pub2. ISBN 0471936235.
- ^ 2021-12-22일 접속한 산업안전보건연구소의 게스티스 물질 데이터베이스에 있는 테르트-산화칼륨 기록.
- ^ William S. Johnson and William P. Schneider (1963). "β-Carbethoxy-γ,γ-diphenylvinylacetic acid". Organic Syntheses.; Collective Volume, vol. 4, p. 132
- ^ Chisholm, Malcolm H.; Drake, Simon R.; Naiini, Ahmad A.; Streib, William E. (1991). "Synthesis and X-ray crystal structures of the one-dimensional ribbon chains [MOBut·ButOH]∞ and the cubane species [MOBut]4 (M = K and Rb)". Polyhedron. 10 (3): 337–345. doi:10.1016/S0277-5387(00)80154-0.
- ^ a b 2006년 뉴욕 주, 존 와일리 & 선스 시약 백과사전의 Durry Caine "t-Butoxide".doi: 10.1002/047084289X.rp198.pub2. 기사 온라인 게시 날짜: 2006년 9월 15일
- ^ Anton A. Toutov, Wen-Bo Liu, Kerry N. Betz, Alexey Fedorov, Brian Stoltz, Robert H. Grubbs (2015). "Silylation of C–H bonds in aromatic heterocycles by an Earth-abundant metal catalyst" (PDF). Nature. 518 (7537): 80–84. doi:10.1038/nature14126. PMID 25652999. S2CID 3117834.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Brown, William; Foote, Christopher; Iverson, Brent; Anslyn, Eric (2008-01-10). Organic Chemistry. Cengage Learning. ISBN 978-0495388579.
- ^ Margaret-Ann Armour (2016-04-19). Hazardous Laboratory Chemicals Disposal Guide, Third Edition. CRC Press. ISBN 9781420032383.
- ^ Foden, Charles R.; Weddell, Jack L. (1991-12-29). Hazardous Materials: Emergency Action Data. CRC Press. ISBN 9780873715980.