정자 형성
Spermatogenesis| 정자 형성 | |
|---|---|
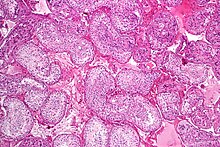
 정자가 성숙하는 정관입니다H&E 염색. | |
 성숙한 인간의 정자 | |
| 식별자 | |
| 메쉬 | D013091 |
| 해부학 용어 | |
정자형성은 고환의 정관 내 생식세포에서 반수체 정자가 발달하는 과정이다.이 과정은 [1]세관의 기저막 근처에 위치한 줄기세포의 유사분열로 시작된다.이 세포들은 정조세포라고 불린다.이 세포들의 유사분열은 두 종류의 세포를 생성한다.A형 세포는 줄기세포를 보충하고 B형 세포는 1차 정자세포로 분화한다.1차 정자세포는 감수분열(Meiotics I)을 2차 정자세포로 나누고, 각 2차 정자세포는 감수분열 II에 의해 2개의 균등한 반수체 정자로 분할한다.정자는 정자 형성의 과정에 의해 정자로 변한다.이것들은 [2]정자 세포로도 알려진 성숙한 정자로 발전한다.따라서 1차 정자세포는 2차 정자세포인 2차 정자세포를 생성하고, 2차 정자세포는 그 세분화에 의해 4개의 정자세포와 4개의 반수세포를 [3]생성한다.
정자는 많은 성생식 유기체의 성숙한 수컷 생식체이다.그러므로 정자 형성은 남성 버전의 배우자 형성이며, 그 중 여성 상당물은 발아형성입니다.포유류에서 그것은 단계적인 방식으로 수컷 고환의 정소관에서 발생한다.정자 형성은 과정이 올바르게 일어나기 위한 최적의 조건에 크게 의존하며, 성적 번식에 필수적이다.DNA 메틸화 및 히스톤 수식은 [4]이 과정의 조절에 관여했다.연령이 증가함에 따라 생성되는 정자의 양에서 약간의 감소를 확인할 수 있지만, 사춘기에 시작하여 보통 죽을 때까지 중단 없이 지속됩니다(남성 불임 참조).
정자 형성은 정관 바닥에서 시작되며, 점차적으로 세포는 튜브로 더 깊숙이 들어가 성숙한 정자가 퇴적되는 내강에 도달할 때까지 그것을 따라 움직인다.분할은 비동기적으로 발생합니다. 튜브를 가로로 절단하면 다양한 성숙 상태를 관찰할 수 있습니다.동시에 생성되는 서로 다른 성숙 상태를 가진 세포군을 [5]정자파라고 한다.
목적
정자 형성은 일반적으로 정자라고 불리지만 더 구체적으로 정자로 알려진 성숙한 남성 생식체를 생산하는데, 이것은 수정 기간 동안 접합체로 알려진 단세포 개체를 생산하기 위해 상대편 여성 생식체인 난모세포를 수정시킬 수 있습니다.이것은 성생식의 주춧돌이며 염색체 정상 접합체를 만들기 위해 정상 염색체 세트의 절반에 기여하는 두 개의 생식체를 포함합니다.
종에 따라 다른 자손의 염색체 수를 보존하기 위해, 각 생식체 중 하나는 다른 신체 세포에 존재하는 통상적인 염색체 수의 반을 가져야 한다.그렇지 않으면, 그 자손은 정상 염색체 수의 두 배를 갖게 되고 심각한 이상을 초래할 수 있다.사람의 경우, 잘못된 정자 형성에 의해 발생하는 염색체 이상은 선천적 결함 및 선천적 결함(다운 증후군, 클라인펠터 증후군)을 초래하며, 대부분의 경우, 발달 중인 태아의 자발적 낙태를 초래한다.
사람의 위치
정자 형성은 남성 생식계의 여러 구조 안에서 일어난다.초기 단계는 고환 내에서 발생하며 발육 중인 배우자가 성숙하여 사정 때까지 저장되는 부고환으로 진행됩니다.고환의 정관(正官)은 이 과정의 시작점이며, 내부 관벽에 인접한 정자줄기세포가 벽에서 시작하여 가장 안쪽 부분, 즉 내강으로 진행되어 미성숙한 [2]정자를 생성하기 위해 구심 방향으로 분열한다.부고환에서 성숙이 일어난다.정자 형성 과정에서 생존 가능한 정자를 생성하기 위해 낮은 온도, 특히 정상 체온 37°C(98.6°F)[6]보다 1°-8°C 낮은 온도가 필요하기 때문에 [Testes/Scrotum] 위치는 특히 중요하다.임상적으로, 운동용 지지대에서와 같이 온도의 작은 변동은 정자의 생존력이나 [7]숫자에 손상을 일으키지 않는다.
지속
인간의 경우, 정자 형성의 전체 과정은 (삼중수소 라벨 생체 검사에 따르면) 74일[8][9], (DNA 시계 측정에 따르면) 약 120일이[10] 걸리는 것으로 다양하게 추정된다.덕트 시스템 운송까지 포함하면 3개월이 걸립니다.고환은 매일 [11]2억에서 3억개의 정자를 생산한다.그러나 이 중 절반에서 1억 개 정도만이 생존 가능한 [12]정자가 된다.
스테이지
정자 형성의 전체 과정은 몇 개의 뚜렷한 단계로 나눌 수 있으며, 각각은 인간의 특정 유형의 세포에 해당된다.다음 표에서 배수성, 복사 번호 및 염색체/염색체 수는 일반적으로 DNA 합성 및 분열 전(해당하는 경우 G1에서) 하나의 세포에 대한 것이다.1차 정자세포는 DNA 합성 후와 분열 전에 정지된다.
| 셀 타입 | 인간의 배수성/배수체 | 인간의 DNA복사번호/염색체 | 셀별 프로세스 입력 |
| 스펠마토고늄(Ad, Ap 및 B형) | 2배체(2N) / 46 | 2C/46 | 정자세포형성(유도증) |
| 일차 정자 세포 | 2배체(2N) / 46 | 4 C / 2 x 46 | 정자형성(Meiosis I) |
| 2차 정자 세포 | 반수체(N) / 23 | 2C/2x23 | 정자형성(meiosis II) |
| 정자 4개 | 반수체(N) / 23 | C / 23 | 정자 형성 |
| 네 가지 기능성 정자 | 반수체(N) / 23 | C / 23 | 정자화 |
정자세포형성
정자세포 형성은 생식세포 형성의 남성 형태이며 유전물질의 정상적인 보체의 절반을 가진 정자세포의 형성을 초래한다.정자세포 형성에 있어서, 정관 기저부에 있는 이배체 정자세포는, 1차 정자세포라고 불리는 두 개의 이배체 중간 세포를 생성하면서, 유사분열한다.각 1차 정자세포는 그 후 정관 내 복관부로 이동해 DNA를 복제한 후 감수분열 I을 거쳐 2개의 반수체 2차 정자세포를 생성한다.이 정자는 나중에 다시 반수체 정자로 분열한다.이 중분류는 부모 염색체의 무작위 포함과 생식체의 유전적 변동을 증가시키는 염색체 교차와 같은 유전적 변이의 원천을 포함한다.DNA 손상 반응(DDR) 기계는 정자 형성에 중요한 역할을 한다.단백질 FMRP는 감수 분열 염색체에 결합하고 정자 [13]형성 중에 DDR 기계의 역학을 조절합니다.FMRP는 DNA 손상을 복구하기 위해 필요한 것으로 보인다.
정조세포에서 정조세포로의 각 세포분열은 불완전하다; 세포질은 동시에 발달할 수 있도록 세포질의 브릿지에 의해 서로 연결되어 있다.모든 정조세포가 정자세포를 생성하기 위해 분열하는 것은 아니다; 그렇지 않으면 정조세포의 공급이 고갈될 것이다.대신, 정조세포는 그들 자신의 [14]복제를 만들기 위해 유사분열하여 정조세포 형성을 촉진하기 위해 정조세포의 지속적인 공급을 보장한다.
정자 형성
정자형성은 2차 정자세포에서 정자를 만드는 것이다.이전에 생성된 2차 정자세포는 감수분열 II로 빠르게 진입하여 분열하여 반수체 정자를 생성한다.이 단계의 간결성은 2차 정자세포가 조직학적 연구에서 거의 보이지 않는다는 것을 의미한다.
정자 형성
정자 형성 동안, 정자는 중심체 중 하나에 미세관을 성장시켜 꼬리를 형성하기 시작하는데, 이것은 기저체로 변한다.이 미세관들은 축삭체를 형성한다.이후 중심체는 중심체 [15]환원 과정에서 변형된다.미토콘드리아는 에너지 공급을 보장하기 위해 축삭 주위에 배치되기 때문에 꼬리의 앞부분이 두꺼워진다.정조세포 DNA도 포장을 거치면서 고도로 응축된다.DNA는 먼저 특정 핵염기성 단백질과 함께 포장되며, 정자신장 동안 프로타민으로 대체된다.결과적으로 촘촘하게 포장된 크로마틴은 전사적으로 비활성화됩니다.골지 기구는 현재 응축된 핵을 둘러싸고 있으며, 아크로솜이 된다.
그리고 나서 숙성은 불필요한 세포질과 세포기질을 제거하는 테스토스테론의 영향 아래에서 이루어집니다.잔류체로 알려진 과도한 세포질은 고환의 주변 세르톨리 세포에 의해 식세포화된다.그 결과로 생긴 정자는 이제 성숙했지만 운동성이 부족하다.성숙한 정자는 정자화라고 불리는 과정에서 보호용 세르톨리 세포에서 정관 내강으로 방출된다.
비운동성 정자는 서톨리 세포에 의해 분비되는 고환액에서 연동수축의 도움을 받아 부고환으로 운반된다.부고환에 있는 동안 정자는 운동성을 얻고 수정이 가능해진다.그러나 남성 생식계의 나머지 부분을 통한 성숙한 정자의 수송은 최근 획득된 정자의 운동성이 아닌 근육 수축을 통해 이루어진다.
세르톨리 세포의 역할
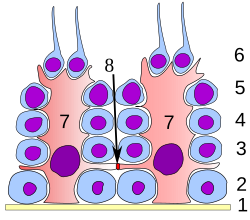
분화의 모든 단계에서, 정자 생성 세포는 발달하는 정자 세포에 구조적이고 대사적인 지원을 제공하는 것으로 생각되는 세르톨리 세포와 밀접하게 접촉한다.단일 세르톨리 세포는 광현미경 수준에서는 세포질 과정을 구별하기 어렵지만 기저막에서 정관 내강까지 뻗어 있다.
서톨리 세포는 정자 형성 동안 많은 기능을 수행하며, 다음과 같은 방식으로 발달하는 배우자를 지원합니다.
- 혈액 고환 장벽을 통해 발달과 성숙에 필요한 환경 유지
- 감수분열을 일으키는 물질 분비
- 지지 고환액 분비
- 발달 중인 배우자에 가까운 곳에 테스토스테론을 농축하는 분비 안드로겐 결합 단백질(ABP)
- 테스토스테론은 생식기관의 유지를 위해 매우 많은 양이 필요하며, ABP는 훨씬 더 높은 수준의 불임을 허용한다.
- 정자 형성의 뇌하수체 제어에 영향을 미치는 호르몬, 특히 폴리펩타이드 호르몬, 인히빈을 분비한다.
- 정자 형성에 의해 남은 식세포 잔존 세포질
- 항뮬러 호르몬 분비는 뮐러[16] 관의 악화를 일으킨다
- 남성의 면역체계로부터 혈액 고환 장벽을 통해 정자 보호
- 정조세포 틈새에 기여하다
세포간 접착 분자인 ICAM-1과 가용성 ICAM-1은 혈액-고환 [17]장벽을 형성하는 단단한 접합부에 길항작용을 한다.ICAM-2 분자는 장벽의 꼭대기 쪽(내강 [17]쪽으로)에서 정자 접착을 조절합니다.
영향 요인
정자 형성 과정은 환경, 특히 호르몬과 온도의 변동에 매우 민감하다.테스토스테론은 이 과정을 유지하기 위해 국소적으로 많이 필요하며, 이는 정관 내에 존재하는 안드로겐 결합 단백질에 의한 테스토스테론의 결합을 통해 달성된다.테스토스테론은 레이디그 세포로도 알려진 간질 세포에 의해 생성되며, 레이디그 세포는 정관 근처에 위치합니다.
정생 상피는 인간과 다른 종들의 높은 온도에 민감하며, 정상 체온만큼 높은 온도의 영향을 받는다.또한 정조세포는 β-폴리머라아제 및 정조세포 재조합 효소가 특정 최적 [18]온도를 필요로 하기 때문에 대부분의 포유동물에서 체온에서 성숙하지 않습니다.결과적으로, 고환은 음낭이라고 불리는 피부 자루 안에 몸 밖으로 배치된다.최적의 온도는 체온보다 2°C(man)(8°C 마우스) 낮게 유지됩니다.이것은 혈류를[19] 조절하고 음낭의 크레마스터릭 근육과 다토스 평활근에 의해 몸의 열을 향하거나 멀어지는 위치에 위치시킴으로써 달성된다.
한 가지 중요한 메커니즘은 고환 동맥과 정맥 혈류 사이의 열 교환이다.특수 해부학적 배열은 내부 정자 동맥을 따라 두 개의 코일 영역으로 구성됩니다.이 해부학적 배열은 고환 동맥과 정맥 혈류 사이의 접촉 시간과 열 교환을 연장하고 개와 램에서 보고된 대동맥과 고환 동맥 혈액 사이의 온도 구배를 부분적으로 설명할 수 있습니다.또한 내부 정자 [clarification needed][20][21]동맥의 코일 길이의 근위 1/3에서 발생하는 펄스 압력 감소.또한 정자성 재조합 효소의 활성이 저하되어 고환 [clarification needed][22]변성의 중요한 요인이 될 것으로 생각됩니다.
식이 결핍증(비타민 B, E, A 등), 동화 스테로이드, 금속(카드뮴, 납), X선 피폭, 다이옥신, 알코올, 전염병 등도 정자 [23]형성 속도에 악영향을 미칠 수 있습니다.또한 수컷 배아주는 산화 스트레스에 의한 DNA 손상에 취약하며, 이 손상은 수정과 [24]임신에 큰 영향을 미칠 수 있다.살충제에 노출되는 것은 또한 정자 [25]형성에 영향을 미친다.
호르몬 제어
정자 형성의 호르몬 제어는 종마다 다르다.인간의 경우 그 메커니즘이 완전히 이해되지는 않지만 시상하부, 뇌하수체 및 레이디지 세포의 상호작용으로 인해 정자 형성이 사춘기에 시작되는 것으로 알려져 있다.뇌하수체를 제거하더라도, 정자 형성은 여전히 모낭 자극 호르몬(FSH)[26]과 테스토스테론에 의해 시작될 수 있다.FSH와 대조적으로 황체화호르몬(LH)은 성선 테스토스테론 [26][27]생성을 유도하는 것 외에 정자 형성에 거의 역할을 하지 않는 것으로 보인다.
FSH는 서톨리 세포에 의한 안드로겐 결합 단백질(ABP)의 생성과 혈액-고환 장벽 형성을 모두 자극한다.ABP는 정자 형성을 시작하고 유지할 수 있을 만큼 높은 수준으로 테스토스테론을 농축하는 데 필수적이다.혈중 테스토스테론 수치는 건강한 남성의 [28][29]5~10배에 걸쳐 차이가 있지만 혈중 농도보다 20~100배 또는 50~200배 높다.FSH는 고환에서 테스토스테론의 분리작용을 시작할 수 있지만, 일단 개발되면 정자 [26]형성을 유지하기 위해 테스토스테론만 필요하다.그러나 FSH의 수치를 높이면 A형 정자세포의 아포토시스를 방지하여 정자생성이 증가한다.인히빈 호르몬은 FSH의 수치를 낮추는 역할을 한다. 설치류 모델에서 연구한 바에 따르면 고나도트로핀(LH와 FSH 모두)은 프로아포토시스 신호를 억제함으로써 정자 형성의 과정을 지원하므로 정자 세포 생존을 [30]촉진한다.
세르톨리 세포 자체가 호르몬 생성을 통해 정자 형성의 일부를 매개한다.그들은 에스트라디올과 인히빈 호르몬을 생산할 수 있다.레이디그 세포는 또한 그들의 주요 생산물인 테스토스테론 외에도 에스트라디올을 생산할 수 있다.에스트로겐은 동물의 [31][32]정자 형성에 필수적인 것으로 밝혀졌다.그러나 에스트로겐 불감증 증후군(ERα 결함)을 가진 남성은 비록 비정상적으로 낮은 정자 생존력에도 불구하고 정상적인 정자 수를 가진 정자를 생산했다. 불임 상태인지 아닌지는 불분명하다.[33]너무 높은 에스트로겐 수치는 고나도트로핀 분비의 억제와 자궁 내 테스토스테론 [34]생성에 의해 정자 형성에 해로울 수 있다.프로락틴은 또한 정자 [27]형성에 중요한 것으로 보인다.
장애
정자 형성 장애는 정자 농도가[35] 낮은 정액으로 남성 불임에서 흔히 발견되는 과혈증을 일으킬 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ de Kretser, D. M.; Loveland, K. L.; Meinhardt, A.; Simorangkir, D.; Wreford, N. (1998-04-01). "Spermatogenesis". Human Reproduction. 13 (suppl_1): 1–8. doi:10.1093/humrep/13.suppl_1.1. ISSN 0268-1161. PMID 9663765.
- ^ a b Sharma S, Hanukoglu A, Hanukoglu I (2018). "Localization of epithelial sodium channel (ENaC) and CFTR in the germinal epithelium of the testis, Sertoli cells, and spermatozoa". Journal of Molecular Histology. 49 (2): 195–208. doi:10.1007/s10735-018-9759-2. PMID 29453757. S2CID 3761720.
- ^ "The Spermatozoön, in Gray's Anatomy". Retrieved 2010-10-07.
- ^ Song, Ning; Liu, Jie; An, Shucai; Nishino, Tomoya; Hishikawa, Yoshitaka; Koji, Takehiko (2011). "Immunohistochemical Analysis of Histone H3 Modifications in Germ Cells during Mouse Spermatogenesis". Acta Histochemica et Cytochemica. 44 (4): 183–90. doi:10.1267/ahc.11027. PMC 3168764. PMID 21927517.
- ^ Schulze, W. (24 April 2009). "Evidence of a Wave of Spermatogenesis in Human Testis". Andrologia. 14 (2): 200–207. doi:10.1111/j.1439-0272.1982.tb03124.x. PMID 7103139. S2CID 42304875.
- ^ '음낭'브리태니커 백과사전.브리태니커 백과사전 온라인.브리태니커 백과사전, 2015.Web. 2015년 1월 14일 <http://www.britannica.com/EBchecked/topic/530078/scrotum>
- ^ Wang C, McDonald V, Leung A, Superlano L, Berman N, Hull L, Swerdloff RS (1997). "Effect of increased scrotal temperature on sperm production in normal men". Fertil. Steril. 68 (2): 334–9. doi:10.1016/s0015-0282(97)81525-7. PMID 9240266.
- ^ Heller CG, Clermont Y (1964). "Kinetics of the germinal epithelium in man". Recent Prog Horm Res. 20: 545–571. PMID 14285045.
- ^ Amann RP (2008). "The cycle of the seminiferous epithelium in humans: a need to revisit?". J Androl. 29 (5): 469–487. doi:10.2164/jandrol.107.004655. PMID 18497337.
- ^ Forster P, Hohoff C, Dunkelmann B, Schürenkamp M, Pfeiffer H, Neuhuber F, Brinkmann B (2015). "Elevated germline mutation rate in teenage fathers". Proc R Soc B. 282 (1803): 20142898. doi:10.1098/rspb.2014.2898. PMC 4345458. PMID 25694621.
- ^ Padubidri, VG; Daftary, SN, eds. (2011). Shaw's Textbook of Gynaecology (15th ed.). p. 201. ISBN 978-81-312-2548-6.
- ^ Johnson L, Petty CS, Neaves WB (1983). "Further quantification of human spermatogenesis: germ cell loss during postprophase of meiosis and its relationship to daily sperm production". Biol. Reprod. 29 (1): 207–15. doi:10.1095/biolreprod29.1.207. PMID 6615966.
- ^ Alpatov R, Lesch BJ, Nakamoto-Kinoshita M, Blanco A, Chen S, Stützer A, Armache KJ, Simon MD, Xu C, Ali M, Murn J, Prisic S, Kutateladze TG, Vakoc CR, Min J, Kingston RE, Fischle W, Warren ST, Page DC, Shi Y (May 2014). "A chromatin-dependent role of the fragile X mental retardation protein FMRP in the DNA damage response". Cell. 157 (4): 869–81. doi:10.1016/j.cell.2014.03.040. PMC 4038154. PMID 24813610.
- ^ Fishelson, Lev; Gon, Ofer; Holdengreber, Vered; Delarea, Yakob (2007). "Comparative spermatogenesis, spermatocytogenesis, and spermato-zeugmata formation in males of viviparous species of clinid fishes (Teleostei: Clinidae, Blennioidei)". The Anatomical Record. 290 (3): 311–23. doi:10.1002/ar.20412. PMID 17525946. S2CID 25069965.
- ^ 성 생식 중 비정형 중심축 Tomer Avidor-Reiss*, Atul Khire, Emily L.Fishman and Kyung H. Jo Curr Biol. 2015년 11월 16일;25(22):2956-63.doi:10.1016/j.cub.2015.09.045.Epub 2015년 10월 17일 http://journal.frontiersin.org/article/10.3389/fcell.2015.00021/full
- ^ Hadley, Mac E.; Levine, Jon E. (2007). Endocrinology (6th ed.). Upper Saddle River, NJ: Prentice Hall. p. 369. ISBN 978-0-13-187606-4.
- ^ a b Xiao, X.; Mruk, D. D.; Cheng, C. Y. (2013). "Intercellular adhesion molecules (ICAMs) and spermatogenesis". Human Reproduction Update. 19 (2): 167–86. doi:10.1093/humupd/dms049. PMC 3576004. PMID 23287428.
- ^ "Spermatogenesis". Spermatogenesis. Retrieved 12 January 2022.
- ^ Harrison, RG; Weiner, JS (1949). "Vascular patterns of the mammalian testis and their functional significance". The Journal of Experimental Biology. 26 (3): 304–16, 2 pl. doi:10.1242/jeb.26.3.304. PMID 15407652.
- ^ Wallach, Edward E.; Kandeel, Fouad R.; Swerdloff, Ronald S. (1 January 1988). "Role of temperature in regulation of spermatogenesis and the use of heating as a method for contraception". Fertility and Sterility. 49 (1): 1–23. doi:10.1016/S0015-0282(16)59640-X. PMID 3275550.
- ^ Cameron, R. D. A.; Blackshaw, A. W. (1 May 1980). "The effect of elevated ambient temperature on spermatogenesis in the boar". Reproduction. 59 (1): 173–179. doi:10.1530/jrf.0.0590173. PMID 7401033.
- ^ Hotta, Yasuo; Fujisawa, Masato; Tabata, Satoshi; Stern, Herbert; Yoshida, Shonen (1 September 1988). "The effect of temperature on recombination activity in testes of rodents". Experimental Cell Research. 178 (1): 163–168. doi:10.1016/0014-4827(88)90387-4. PMID 2900772.
- ^ Jenardhanan, Pranitha; Panneerselvam, Manivel; Mathur, Premendu P. (2016-11-01). "Effect of environmental contaminants on spermatogenesis". Seminars in Cell & Developmental Biology. Molecular Mechanisms in Spermatogenesis. 59: 126–140. doi:10.1016/j.semcdb.2016.03.024. ISSN 1084-9521.
- ^ Lewis, S. E. M.; Aitken, R. J. (24 May 2005). "DNA damage to spermatozoa has impacts on fertilization and pregnancy". Cell and Tissue Research. 322 (1): 33–41. doi:10.1007/s00441-005-1097-5. PMID 15912407. S2CID 27592293.
- ^ Mehrpour, Omid; Karrari, Parissa; Zamani, Nasim; Tsatsakis, Aristides M.; Abdollahi, Mohammad (October 2014). "Occupational exposure to pesticides and consequences on male semen and fertility: A review". Toxicology Letters. 230 (2): 146–156. doi:10.1016/j.toxlet.2014.01.029. PMID 24487096.
- ^ a b c William J. Kraemer; A. D. Rogol (15 April 2008). The Encyclopaedia of Sports Medicine: An IOC Medical Commission Publication, The Endocrine System in Sports and Exercise. John Wiley & Sons. pp. 286–. ISBN 978-0-470-75780-2.
- ^ a b Fody EP, Walker EM (1985). "Effects of drugs on the male and female reproductive systems". Ann. Clin. Lab. Sci. 15 (6): 451–8. PMID 4062226.
- ^ Wolf-Bernhard Schill; Frank H. Comhaire; Timothy B. Hargreave (26 August 2006). Andrology for the Clinician. Springer Science & Business Media. pp. 76–. ISBN 978-3-540-33713-3.
- ^ Eberhard Nieschlag; Hermann M. Behre; Susan Nieschlag (26 July 2012). Testosterone: Action, Deficiency, Substitution. Cambridge University Press. pp. 130–. ISBN 978-1-107-01290-5.
- ^ Pareek, Tej K.; Joshi, Ayesha R.; Sanyal, Amartya; Dighe, Rajan R. (2007). "Insights into male germ cell apoptosis due to depletion of gonadotropins caused by GnRH antagonists". Apoptosis. 12 (6): 1085–100. doi:10.1007/s10495-006-0039-3. PMID 17268770. S2CID 25378624.
- ^ O'Donnell L, Robertson KM, Jones ME, Simpson ER (2001). "Estrogen and spermatogenesis". Endocr. Rev. 22 (3): 289–318. doi:10.1210/edrv.22.3.0431. PMID 11399746.
- ^ Carreau S, Bouraima-Lelong H, Delalande C (2012). "Role of estrogens in spermatogenesis". Front Biosci. 4: 1–11. doi:10.2741/e356. PMID 22201851.
- ^ Smith, Eric P.; Boyd, Jeff; Frank, Graeme R.; Takahashi, Hiroyuki; Cohen, Robert M.; Specker, Bonny; Williams, Timothy C.; Lubahn, Dennis B.; Korach, Kenneth S. (1994). "Estrogen Resistance Caused by a Mutation in the Estrogen-Receptor Gene in a Man". New England Journal of Medicine. 331 (16): 1056–1061. doi:10.1056/NEJM199410203311604. ISSN 0028-4793. PMID 8090165.
- ^ Edmund S. Sabanegh, Jr. (20 October 2010). Male Infertility: Problems and Solutions. Springer Science & Business Media. pp. 83–. ISBN 978-1-60761-193-6.
- ^ thefreedictionary.com > oligospermia 인용: Dorland's Medical Dictionary for Health Consumer, 2007 by Saunders;Hougton Mifflin Company의 American Heritage Medical Dictionary 2007, 2004, Mosby's Medical Dictionary, 2009, McGraw-Hill Companies의 McGraw-Hill Consecise of Modern Medicine Dicine, 2002
추가 정보
- Okano, Tsukasa; Ishiniwa, Hiroko; Onuma, Manabu; Shindo, Junji; Yokohata, Yasushi; Tamaoki, Masanori (23 March 2016). "Effects of environmental radiation on testes and spermatogenesis in wild large Japanese field mice ( Apodemus speciosus ) from Fukushima". Scientific Reports. 6 (1): 23601. Bibcode:2016NatSR...623601O. doi:10.1038/srep23601. PMC 4804236. PMID 27005329.
- Johnson, L.; Blanchard, T.L.; Varner, D.D.; Scrutchfield, W.L. (November 1997). "Factors affecting spermatogenesis in the stallion". Theriogenology. 48 (7): 1199–1216. doi:10.1016/s0093-691x(97)00353-1. PMID 16728209.
- Bardin, C.W. (1991). "Pituitary-testicular axis". In Yen, S.S.C.; Jaffee, R.B. (eds.). Reproductive Endocrinology (3rd ed.). Philadelphia: WB Saunders. ISBN 0721632068.
- Chambers, Christopher V.; Shafer, Mary-Ann; Adger, Hoover; Ohm-Smith, Marilyn; Millstein, Susan G.; Irwin, Charles E.; Schachter, Julius; Sweet, Richard (February 1987). "Microflora of the urethra in adolescent boys: Relationships to sexual activity and nongonococcal urethritis". The Journal of Pediatrics. 110 (2): 314–321. doi:10.1016/s0022-3476(87)80180-4. PMID 3100755.
- Czyba, J.C.; Girod, C. (1980). "Development of normal testis". In Hafez, E.S.E. (ed.). Descended and Cryptorchid Testis. The Hague: Martinus Nijhoff. ISBN 9024723337.
- Whitmore, Willet F.; Karsh, Lawrence; Gittes, Ruben F. (October 1985). "The Role of Germinal Epithelium and Spermatogenesis in the Privileged Survival of Intratesticular Grafts". Journal of Urology. 134 (4): 782–786. doi:10.1016/s0022-5347(17)47438-6. PMID 2863395.