HU-210
HU-210 | |
 | |
| 임상 데이터 | |
|---|---|
| 기타 이름 | 1,1-디메틸헵틸-11-히드록시-테트라히드로카나비놀 |
| 법적 상태 | |
| 법적 상태 | |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| IUPHAR/BPS | |
| 켐스파이더 | |
| 유니 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| 화학 및 물리 데이터 | |
| 공식 | C25H38O3 |
| 몰 질량 | 386.576 g/120−1 |
| 3D 모델(JSmol) | |
| |
| |
| | |
HU-210은 1988년 히브리대 라파엘 메쿨람이 이끄는 그룹에 의해 (1R,5S)-미르테놀에서[1] 처음 합성된 합성 카나비노이드다.[2][3][4]HU-210은 대마초의 천연 THC보다 100배에서 800배 더 강력하며 작용 기간이 [5]길다.HU-210은 복제된 인간 칸나비노이드 [6]수용체에서 CB1에서 0.061nM, CB2에서 0.52nM의 결합 친화력을 가진다.CB1에서의 Delta-9-THC 40.7nM과 비교됩니다.[7] HU-210은 11-히드록시- δ-테트라히드로카나비놀의8 (–)1,1-디메틸헥틸 유사체이며, 일부 참조에서는 1,1-디메틸헥틸-11-히드록시테트라히드로카나비놀이라고 부른다."HU"의 약자는 히브리 대학을 나타냅니다.
효과와 연구
11-OH-D-THC-DMH의8 (–) 에난티오머인 HU-210은 거의 모든 칸나비노이드 활성을 가지며, HU-211로 알려진 (+) 에난티오머는 칸나비노이드로서 비활성화되어 대신 신경 보호 [8][9]효과를 갖는 NMDA 길항제로서 작용한다.
HU-210은 CB 수용체i/o, G단백질 및 ERK 시그널링의1 순차적 활성화를 통해 배양된 배아 해마 신경줄기와 전구세포의 증식을 촉진하지만 분화는 촉진하지 않는다.이는 또한 항불안제 및 항우울제 [10]효과를 수반하는 신경 성장 증가로 나타났다.
HU-210은 WIN 55,212-2 및 JWH-133과 같은 다른 합성 카나비노이드와 함께 인지 장애 및 신경 마커 상실을 예방할 뿐만 아니라 알츠하이머병과 관련된 아밀로이드 베타 단백질에 의해 야기되는 염증을 예방하는 데 관여한다.이 항염증 작용은 칸나비노이드 수용체의 활성화를 통해 유도되며, 이는 염증을 유발하는 미세글리아 활성화를 방지한다.또한 칸나비노이드는 쥐 [11]모델에서 미세글리아 활성화와 관련된 신경독성을 완전히 제거한다.
HU-210은 천연 THC와 동일한 효과를 가진 강력한 진통제이다.
HU-210의 경구 LD50은 래트 5,000mg/kg, 토끼 [12]14,200mg/kg이다.HU-210은 인간의 [12]최저 치사량(LDLO)이 143mg/kg이다.카페인의 LD50은 kg당 150~200mg으로 추정된다.[13] Delta-8-THC LD50은 확인되지 않았다.1973년 연구에서 원숭이와 개에게 9,000mg/kg의 Delta-8-THC를 투여한 것은 [14][15]치명적이지 않았다.
화학
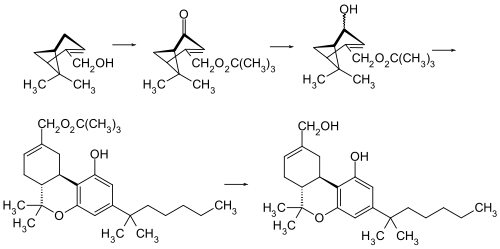
HU-210은 HU-211(덱사나비놀)의 에난티오머이다.HU-210의 원래 합성은 (–)-미르테놀과 1,1-디메틸헵틸레소르시놀(3,5-디히드록시-1-(1,1-디메틸헵틸) 벤졸의 [1]산 촉매 축합에 기초한다.
법적 상태
HU-210은 1961년 유엔 마약단독협약이나 [16]1971년 향정신성 물질협약에 의해 정해진 일정에 포함되지 않았기 때문에 이들 국제 마약단속조약 체결국이 HU-210을 규제할 필요가 없다.
뉴질랜드
2014년 [17]5월 8일 현재 뉴질랜드에서는 HU-210이 금지되어 있다.
미국
HU-210은 미국의 [18]예정된 통제 물질 목록에 없습니다.따라서 미국에서는 연방 수준에서 일정이 잡히지 않았지만, HU-210이 법적으로 델타-8-THC(스케줄 I에서 "테트라히드로카나비놀"로 통제되는 물질 중 하나)의 유사물로 간주될 수 있으므로 판매 또는 소유는 연방 아날로그법에 [19]따라 기소될 수 있다.2009년 DEA(Drug Enforcement Administration, DEA)에 의해 작성 및 발표된 HU-210의 간략한 프로필에는 HU-210이 [20]THC와 유사하기 때문에 규제물질법에 의거한 부칙 I 통제물질이라고 명시되어 있다.이는 DEA가 연방 아날로그법을 HU-210에 적용하는 목적으로 HU-210을 델타-8-THC의 아날로그로 법적으로 간주할 수 있음을 나타낸다.DEA의 주장에 대한 근거에 대한 설명은 제시되지 않았고, 어떠한 언급도 인용되지 않았으며, 결국 DEA의 웹사이트에서 그 주장은 삭제되었다.현재 PDF 형식의 문서 버전(2013년에 업데이트됨)은 DEA 전환 통제국 웹사이트에 [21]있습니다.이와 같은 상세한 설명이나 인용이 결여된 오해의 소지가 있는 최종적인 소리의 문서에서는 다음과 같이 주장됩니다.
HU-210은 CSA에서 제가 통제한 스케줄입니다.
앨라배마 주
HU-210은 [22]앨라배마에 있는 스케줄 I 통제 물질이다.
(4)a) 특정 화학 명칭 또는 성분 내에서 이들 소금, 이성질체 및 이성질체의 염이 존재할 수 있는 경우를 제외하고, 다음과 같은 화학 화합물, 그 소금, 이성질체 및 이성질체의 염을 함유하는 모든 물질, 혼합물 또는 제제인 합성 제어 물질출력:
...
(9) (6aR, 10aR)-9-(히드록시메틸)-6, 6-디메틸-3-(2-메틸록탄-2-일)-6a, 7,10,10a-테트라히드로벤조[c]크로멘-1-ol, 일부 상표 또는 다른 명칭: HU-210
플로리다
HU-210은 스케줄 I 통제 물질로 환각제로 분류되어 면허 [23]없이 플로리다 주에서 구매, 판매 또는 소유하는 것을 불법으로 규정합니다.
(c) 특별히 제외되거나 다른 부칙에 열거되지 않는 한, 광학, 위치 또는 기하학적 이성질체, 호몰로지, 질소-헤테로사이클릭 유사체, 에스테르, 에테르 및 이들의 염, 이성질체 중 하나를 포함하는 물질, 화합물, 혼합물 또는 제제이성질체, 호몰로지, 질소-헤테로사이클릭 유사체, 에스테르 또는 에테르의 염(특정 화학명칭 또는 클래스 기술 내에서 가능한 경우): ...47. HU-210 [(6aR, 10aR)-6-디메틸-3-(히드록시메틸)-2lo]
버몬트 주
2016년 1월 1일 발효된 HU-210은 버몬트주에서 "할루신제닉 약물"[24]로 지정된 규제 약물이다.
"할루시노제닉 의약품(Hallucinogenic Drug)"은 스트라모늄, 메스칼린 또는 페이요테, 리세르그산 디에틸아미드 및 실로시빈을 포함한 본 규칙의 제7절에 명시된 것 및 칸나비스 사티바의 수지 추출물, 또는 이들의 모든 소금, 유도체 또는 화합물 및 기타 혼합물을 의미한다.18 V.S.A.§ 4202에 따라 보건위원회가 채택한 규정에서 환각 유발 효과가 있는 물질.
...
• Cannabimetic Agents는 집합적으로 Cannabinoid 수용체 타입 1(CB1) 또는 Cannabinoid 수용체 타입 2(CB2) 작용제 또는 이러한 화학물질의 소금, 이성질체, 유도체 또는 유사체인 화학물질을 의미한다.구조 클래스는 다음을 포함하지만 이에 한정되지 않습니다.
(a) 페놀 고리의 5위치에 알킬 또는 알케닐에 의한 치환을 수반하는 2-(3-히드록시시시클로헥실) 페놀은 시클로헥실 고리에 치환되었는지 여부에 관계없이 어느 정도까지 치환된다.
(b) 인돌링의 질소 원자에서의 치환을 수반하는 3-(1-나프토일) 인돌 또는 3-(1-나프토일) 인돌링의 치환 유무에 관계없이, 나프토일 또는 나프틸링의 치환 유무를 불문한다.
(c) 피롤 고리의 질소 원자에서의 치환을 수반하는 3-(1-나프토일) 피롤, 피롤 고리의 치환 유무, 나프토일 고리의 치환 유무.
(d) 인덴환의 3위치를 치환한 1-(1-나프틸메틸) 인덴은 인덴환의 추가 치환 여부를 불문하고 나프틸환의 치환 여부를 불문한다.
(e) 인돌 고리의 질소 원자에 치환된 3-페닐아세틸인돌 또는 3-벤조일린돌은 인돌 고리에 치환된 정도에 관계없이, 페닐 고리에 치환된 정도에 관계없이.
(f) 인돌- (2,2,3,3-테트라메틸시클로프로필)메타논은 인돌 고리의 질소 원자에 치환되어 있는지 여부에 관계없이 페닐 고리에 치환되어 있는지 여부에 관계없이 인돌 고리에 치환되어 있다.
(g) 인돌 고리의 질소 원자에 치환을 수반하는 N-아다만틸-인돌-3-카르복사미드, 인돌 고리에 치환되었는지 여부, 페닐 고리에 치환되었는지 여부
(h) (1,3-티아졸-2-일리딘)-2,2,3,3-테트라메틸시클로프로판-1-카르복사미드이며, 티아졸리딘 고리의 임의의 위치에서 치환된다.
...
• HU-210 (6aR, 10aR)-9-(히드록시메틸)-6, 6-디메틸-3- (2-메틸록탄-2-일)-6a, 7,10,10a-테트라히드로벤조[c] 크로멘-1-ol 또는 (6aR,10A-9) 드록시히드록시
기타 HU 카나비노이드
「 」를 참조해 주세요.
레퍼런스
- ^ a b Mechoulam R, Lander N, Zahalka J (January 1990). "Synthesis of the individual, pharmacologically distinct, enantiomers of a tetrahydrocannabinol derivative". Tetrahedron: Asymmetry. 1 (5): 315–318. doi:10.1016/S0957-4166(00)86322-3.
- ^ Mechoulam R, Feigenbaum JJ, Lander N, Segal M, Järbe TU, Hiltunen AJ, Consroe P (September 1988). "Enantiomeric cannabinoids: stereospecificity of psychotropic activity". Experientia. 44 (9): 762–4. doi:10.1007/BF01959156. PMID 3416993. S2CID 19589995.
- ^ Little PJ, Compton DR, Mechoulam R, Martin BR (March 1989). "Stereochemical effects of 11-OH-delta 8-THC-dimethylheptyl in mice and dogs". Pharmacology, Biochemistry, and Behavior. 32 (3): 661–6. doi:10.1016/0091-3057(89)90014-2. PMID 2544901. S2CID 140209484.
- ^ Järbe TU, Hiltunen AJ, Mechoulam R (September 1989). "Stereospecificity of the discriminative stimulus functions of the dimethylheptyl homologs of 11-hydroxy-delta 8-tetrahydrocannabinol in rats and pigeons". The Journal of Pharmacology and Experimental Therapeutics. 250 (3): 1000–5. PMID 2550611.
- ^ Devane WA, Breuer A, Sheskin T, Järbe TU, Eisen MS, Mechoulam R (May 1992). "A novel probe for the cannabinoid receptor". Journal of Medicinal Chemistry. 35 (11): 2065–9. doi:10.1021/jm00089a018. PMID 1317925.
- ^ Stern, E.; Lambert, D. M. (2007). "Medicinal chemistry endeavors around the phytocannabinoids". Chemistry & Biodiversity. 4 (8): 1707–1728. doi:10.1002/cbdv.200790149. PMID 17712816. S2CID 24920412.
- ^ Bow, E. W.; Rimoldi, J. M. (2016). "The Structure–Function Relationships of Classical Cannabinoids: CB1/CB2 Modulation". Perspectives in Medicinal Chemistry. 8: 17–39. doi:10.4137/PMC.S32171. PMC 4927043. PMID 27398024.
- ^ Howlett AC, Champion TM, Wilken GH, Mechoulam R (February 1990). "Stereochemical effects of 11-OH-delta 8-tetrahydrocannabinol-dimethylheptyl to inhibit adenylate cyclase and bind to the cannabinoid receptor". Neuropharmacology. 29 (2): 161–5. doi:10.1016/0028-3908(90)90056-w. PMID 2158635. S2CID 28602221.
- ^ Darlington CL (October 2003). "Dexanabinol: a novel cannabinoid with neuroprotective properties". IDrugs. 6 (10): 976–9. OCLC 112453448. PMID 14534855.
- ^ Jiang W, Zhang Y, Xiao L, Van Cleemput J, Ji SP, Bai G, Zhang X (November 2005). "Cannabinoids promote embryonic and adult hippocampus neurogenesis and produce anxiolytic- and antidepressant-like effects". The Journal of Clinical Investigation. 115 (11): 3104–16. doi:10.1172/JCI25509. PMC 1253627. PMID 16224541.
- ^ Ramírez BG, Blázquez C, Gómez del Pulgar T, Guzmán M, de Ceballos ML (February 2005). "Prevention of Alzheimer's disease pathology by cannabinoids: neuroprotection mediated by blockade of microglial activation". The Journal of Neuroscience. 25 (8): 1904–13. doi:10.1523/JNEUROSCI.4540-04.2005. PMC 6726060. PMID 15728830.
- ^ a b "HU-210" (PDF). Material Safety Data Sheet. Cayman Chemical.
- ^ Peters JM (6 May 1967). "Factors Affecting Caffeine Toxicity: A Review of the Literature". The Journal of Clinical Pharmacology and the Journal of New Drugs. 7 (3): 131–141. doi:10.1002/j.1552-4604.1967.tb00034.x.
- ^ Thompson GR, Rosenkrantz H, Schaeppi UH, Braude MC (July 1973). "Comparison of acute oral toxicity of cannabinoids in rats, dogs and monkeys". Toxicology and Applied Pharmacology. 25 (3): 363–72. doi:10.1016/0041-008X(73)90310-4. PMID 4199474.
- ^ "delta-8-Tetrahydrocannabinol". ChemIDplus. U.S. National Library of Medicine.
- ^ "International Drug Control Conventions". United Nations Office on Drugs and Crime. Archived from the original on 12 January 2018. Retrieved 3 May 2018.
- ^ "Synthetic cannabinoids: What they are". New Zealand Drug Foundation. Archived from the original on 2015-09-21. Retrieved 2015-07-18.
- ^ "PART 1308 - Section 1308.11 Schedule I". Office of Diversion Control. Drug Enforcement Administration, U.S. Department of Justice. Archived from the original on 27 August 2009. Retrieved 3 May 2018.
- ^ "Federal Controlled Substance Analogue Act Summary". Erowid Analog Law Vault. Archived from the original on 17 April 2018. Retrieved 3 May 2018.
- ^ "Spice Cannabinoid - HU-210". Office of Diversion Control. Drug Enforcement Administration, U.S. Department of Justice. Archived from the original on 2012-01-17.
- ^ "HU-210" (PDF). Office of Diversion Control. Drug Enforcement Administration, U.S. Department of Justice. January 2013. Archived from the original (PDF) on 2016-12-28.
6aR,10aR)-9-(hydroxymethyl)-6,6-dimethyl-3-(2-methyloctan-2-yl)-6a,7,10,10a-tetrahydrobenzo[c] chromen-1-ol)] [Purported Ingredient of “Spice”
- ^ "Controlled substances, Schedule I, additional synthetic controlled substances and analogue substances included in, trafficking in controlled substance analogues, requisite weight increased, Secs. 13A-12-231, 20-2-23 am'd". Alabama Senate Bill 333. March 2014. Archived from the original on 4 March 2016. Retrieved 2 February 2017.
- ^ "Chapter 893: Drug Abuse Prevention and Control". The 2020 Florida Statutes. The Florida Legislature. Archived from the original on 14 March 2018. Retrieved 3 May 2018.
- ^ "Chapter 8 – Alcohol and Drug Abuse Subchapter 9: Regulated Drug Rule" (PDF). Code of Vermont Rules. Vermont Department of Health. 15 July 2017. Archived (PDF) from the original on 27 January 2017. Retrieved 3 May 2018.
추가 정보
- Brumfiel G (13 October 2005). "Marijuana may make your brain grow". Nature. doi:10.1038/news051010-12.
- Bush, D. M.; Woodwell, D. A. (16 October 2014). "Update: Drug-Related Emergency Department Visits Involving Synthetic Cannabinoids" (PDF). The CBHSQ Report. Substance Abuse and Mental Health Services Administration, Center for Behavioral Health Statistics and Quality. PMID 27030867.