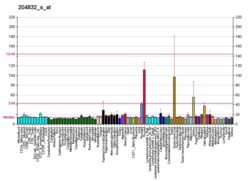
BMPR1A
BMPR1ABMPR1A로도 알려진 IA형 뼈 형태 유발 단백질 수용체는 BMPR1A 유전자에 의해 인간에서 암호화되는 단백질이다.BMPR1A는 CD292(분화 클러스터 292)[5]로도 지정되어 있습니다.
기능.
골형성단백질(BMP) 수용체는 Type I 수용체 BMPR1A(이 단백질)와 BMPR1B 및 Type II 수용체 BMPR2를 포함하는 Transmembrane serine/threonine 키나아제 패밀리이다.이러한 수용체들은 또한 액티빈 수용체, ACVR1 및 ACVR2와 밀접하게 관련되어 있다.이들 수용체의 배위자는 TGF 베타 슈퍼패밀리의 구성원이다.TGF-베타스와 액티빈은 두 가지 다른 유형의 세린(트레오닌) 키나아제 수용체, 즉 약 50-55 kD의 I형 수용체와 약 70-80 kD의 II형 수용체를 가진 헤테로다이머 복합체의 형성을 통해 신호를 전달한다.타입 II 수용체는 타입 I 수용체가 없을 때 리간드를 결합하지만 시그널링을 위해 각각의 타입 I 수용체를 필요로 하는 반면, 타입 I 수용체는 리간드 [5]결합을 위해 각각의 타입 II 수용체를 필요로 한다.
BMP는 WNT 신호를 억제하여 줄기세포 수를 안정적으로 유지합니다.BMPR1A null 마우스는 중배엽 사양 없이 배아 8.0일에 사망하여 위배 [6]조절에 중요한 역할을 하였다.BMPR1A가 아포토시스 및 지방세포 [6]발달에 역할을 한다는 것은 지배적인 음성 BMPR1A 병아리 배아를 사용한 실험에서 입증되었다.BMPR1A의 구성 활성 형태를 사용하여 BMPR1A가 세포 [6]분화에 역할을 하는 것으로 나타났다.BMPR1A 수용체에 의해 전달되는 신호는 골아세포 형성 또는 증식에 필수적이지 않지만 BMPR1A는 골아세포에 [6]의한 세포외 매트릭스 증착에 필요하다.병아리 배아에서, BMPR1A 수용체는 BMPR1B와는 다른 위치인 사지 봉오리 간엽의 낮은 수준에서 발견되며, [7]골형성에서의 다른 역할을 지원한다.
리간드
질병.
BMPR1A, SMAD4, PTEN은 청소년 용종 증후군, 청소년 장 용종증, 카우든병의 원인입니다.
상호 작용
BMPR1A는 다음과 상호작용하는 것으로 나타났습니다.
레퍼런스
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG0000010779 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000021796 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b "Entrez Gene: BMPR1A bone morphogenetic protein receptor, type IA".
- ^ a b c d Mishina Y, Starbuck MW, Gentile MA, Fukuda T, Kasparcova V, Seedor JG, Hanks MC, Amling M, Pinero GJ, Harada S, Behringer RR (2004). "Bone morphogenetic protein type IA receptor signaling regulates postnatal osteoblast function and bone remodeling". J. Biol. Chem. 279 (26): 27560–6. doi:10.1074/jbc.M404222200. PMID 15090551.
- ^ Yoon BS, Ovchinnikov DA, Yoshii I, Mishina Y, Behringer RR, Lyons KM (2005). "Bmpr1a and Bmpr1b have overlapping functions and are essential for chondrogenesis in vivo". Proc. Natl. Acad. Sci. U.S.A. 102 (14): 5062–7. Bibcode:2005PNAS..102.5062Y. doi:10.1073/pnas.0500031102. PMC 555995. PMID 15781876.
- ^ Nickel J, Dreyer MK, Kirsch T, Sebald W (2001). "The crystal structure of the BMP-2:BMPR-IA complex and the generation of BMP-2 antagonists". J Bone Joint Surg Am. 83-A Suppl 1 (Pt 1): S7–14. PMID 11263668.
- ^ Kirsch T, Nickel J, Sebald W (February 2000). "Isolation of recombinant BMP receptor IA ectodomain and its 2:1 complex with BMP-2". FEBS Lett. 468 (2–3): 215–9. doi:10.1016/s0014-5793(00)01214-x. PMID 10692589. S2CID 30068719.
- ^ Kirsch T, Nickel J, Sebald W (July 2000). "BMP-2 antagonists emerge from alterations in the low-affinity binding epitope for receptor BMPR-II". EMBO J. 19 (13): 3314–24. doi:10.1093/emboj/19.13.3314. PMC 313944. PMID 10880444.
- ^ Gilboa L, Nohe A, Geissendörfer T, Sebald W, Henis YI, Knaus P (March 2000). "Bone morphogenetic protein receptor complexes on the surface of live cells: a new oligomerization mode for serine/threonine kinase receptors". Mol. Biol. Cell. 11 (3): 1023–35. doi:10.1091/mbc.11.3.1023. PMC 14828. PMID 10712517.
- ^ Nishanian TG, Waldman T (October 2004). "Interaction of the BMPR-IA tumor suppressor with a developmentally relevant splicing factor". Biochem. Biophys. Res. Commun. 323 (1): 91–7. doi:10.1016/j.bbrc.2004.08.060. PMID 15351706.
- ^ Kurozumi K, Nishita M, Yamaguchi K, Fujita T, Ueno N, Shibuya H (April 1998). "BRAM1, a BMP receptor-associated molecule involved in BMP signalling". Genes Cells. 3 (4): 257–64. doi:10.1046/j.1365-2443.1998.00186.x. PMID 9663660. S2CID 29818690.
추가 정보
- Liu F, Ventura F, Doody J, Massagué J (1995). "Human type II receptor for bone morphogenic proteins (BMPs): extension of the two-kinase receptor model to the BMPs". Mol. Cell. Biol. 15 (7): 3479–86. doi:10.1128/mcb.15.7.3479. PMC 230584. PMID 7791754.
- ten Dijke P, Ichijo H, Franzén P, Schulz P, Saras J, Toyoshima H, Heldin CH, Miyazono K (1993). "Activin receptor-like kinases: a novel subclass of cell-surface receptors with predicted serine/threonine kinase activity". Oncogene. 8 (10): 2879–87. PMID 8397373.
- Ishidou Y, Kitajima I, Obama H, Maruyama I, Murata F, Imamura T, Yamada N, ten Dijke P, Miyazono K, Sakou T (1996). "Enhanced expression of type I receptors for bone morphogenetic proteins during bone formation". J. Bone Miner. Res. 10 (11): 1651–9. doi:10.1002/jbmr.5650101107. PMID 8592941. S2CID 33345688.
- Yamada N, Kato M, ten Dijke P, Yamashita H, Sampath TK, Heldin CH, Miyazono K, Funa K (1996). "Bone morphogenetic protein type IB receptor is progressively expressed in malignant glioma tumours". Br. J. Cancer. 73 (5): 624–9. doi:10.1038/bjc.1996.108. PMC 2074358. PMID 8605097.
- Nishitoh H, Ichijo H, Kimura M, Matsumoto T, Makishima F, Yamaguchi A, Yamashita H, Enomoto S, Miyazono K (1996). "Identification of type I and type II serine/threonine kinase receptors for growth/differentiation factor-5". J. Biol. Chem. 271 (35): 21345–52. doi:10.1074/jbc.271.35.21345. PMID 8702914.
- Wu X, Robinson CE, Fong HW, Gimble JM (1996). "Analysis of the native murine bone morphogenetic protein serine threonine kinase type I receptor (ALK-3)". J. Cell. Physiol. 168 (2): 453–61. doi:10.1002/(SICI)1097-4652(199608)168:2<453::AID-JCP24>3.0.CO;2-2. PMID 8707881.
- Erlacher L, McCartney J, Piek E, ten Dijke P, Yanagishita M, Oppermann H, Luyten FP (1998). "Cartilage-derived morphogenetic proteins and osteogenic protein-1 differentially regulate osteogenesis". J. Bone Miner. Res. 13 (3): 383–92. doi:10.1359/jbmr.1998.13.3.383. PMID 9525338. S2CID 25307046.
- Zhang D, Mehler MF, Song Q, Kessler JA (1998). "Development of bone morphogenetic protein receptors in the nervous system and possible roles in regulating trkC expression". J. Neurosci. 18 (9): 3314–26. doi:10.1523/JNEUROSCI.18-09-03314.1998. PMC 6792660. PMID 9547239.
- Ide H, Saito-Ohara F, Ohnami S, Osada Y, Ikeuchi T, Yoshida T, Terada M (1998). "Assignment of the BMPR1A and BMPR1B genes to human chromosome 10q22.3 and 4q23→q24 byin situ hybridization and radiation hybrid map ping". Cytogenet. Cell Genet. 81 (3–4): 285–6. doi:10.1159/000015048. PMID 9730621. S2CID 46751090.
- Souchelnytskyi S, Nakayama T, Nakao A, Morén A, Heldin CH, Christian JL, ten Dijke P (1998). "Physical and functional interaction of murine and Xenopus Smad7 with bone morphogenetic protein receptors and transforming growth factor-beta receptors". J. Biol. Chem. 273 (39): 25364–70. doi:10.1074/jbc.273.39.25364. PMID 9738003.
- You L, Kruse FE, Pohl J, Völcker HE (1999). "Bone morphogenetic proteins and growth and differentiation factors in the human cornea". Invest. Ophthalmol. Vis. Sci. 40 (2): 296–311. PMID 9950587.
- Aström AK, Jin D, Imamura T, Röijer E, Rosenzweig B, Miyazono K, ten Dijke P, Stenman G (1999). "Chromosomal localization of three human genes encoding bone morphogenetic protein receptors". Mamm. Genome. 10 (3): 299–302. doi:10.1007/s003359900990. PMID 10051328. S2CID 19132542.
- Ebisawa T, Tada K, Kitajima I, Tojo K, Sampath TK, Kawabata M, Miyazono K, Imamura T (2000). "Characterization of bone morphogenetic protein-6 signaling pathways in osteoblast differentiation". J. Cell Sci. 112 (20): 3519–27. doi:10.1242/jcs.112.20.3519. PMID 10504300.
- Kim IY, Lee DH, Ahn HJ, Tokunaga H, Song W, Devereaux LM, Jin D, Sampath TK, Morton RA (2000). "Expression of bone morphogenetic protein receptors type-IA, -IB and -II correlates with tumor grade in human prostate cancer tissues". Cancer Res. 60 (11): 2840–4. PMID 10850425.
- Kirsch T, Sebald W, Dreyer MK (2000). "Crystal structure of the BMP-2-BRIA ectodomain complex". Nat. Struct. Biol. 7 (6): 492–6. doi:10.1038/75903. PMID 10881198. S2CID 19403233.
- Wan M, Shi X, Feng X, Cao X (2001). "Transcriptional mechanisms of bone morphogenetic protein-induced osteoprotegrin gene expression". J. Biol. Chem. 276 (13): 10119–25. doi:10.1074/jbc.M006918200. PMID 11139569.
외부 링크
- 소아용종증후군에 대한 Gen Reviews/NCBI/NIH/UW 엔트리
- BMPR1A+단백질+인간(미국 국립의학도서관 의학 과목 표제(MeSH))
- UCSC Genome Browser의 인간 BMPR1A 게놈 위치 및 BMPR1A 유전자 세부 정보 페이지.