Wnt 시그널링 패스
Wnt signaling pathwayWnt 신호 전달 경로는 세포 표면 수용체를 통해 세포로 신호를 전달하는 단백질로 시작하는 신호 전달 경로의 그룹입니다.Wnt라는 이름은 Wingless와 [1]Int-1이라는 이름으로 만들어진 포트만테오입니다.Wnt 시그널링 패스는, 근처의 세포간 통신(파라크린) 또는 동세포간 통신(오토크린) 중 하나를 사용합니다.그들은 동물에서 매우 진화적으로 보존되어 있는데, 이것은 초파리에서 [2][3]인간에 이르기까지 동물 종에서 유사하다는 것을 의미한다.
표준 Wnt 경로, 비표준 평면 세포 극성 경로 및 비표준 Wnt/칼슘 경로의 세 가지 Wnt 신호 경로가 특징지어졌습니다.세 가지 경로 모두 Wnt-단백질 배위자가 프리즐드 패밀리 수용체에 결합함으로써 활성화되며, 프리즐드 패밀리 수용체는 생체 신호를 세포 내부의 디셸드 단백질로 전달합니다.표준 Wnt 경로는 유전자 전사의 조절로 이어지고 SPATS1 [4]유전자에 의해 부분적으로 부정적으로 조절되는 것으로 생각됩니다.비표준 평면 세포 극성 경로는 세포의 모양을 담당하는 세포 골격을 조절합니다.비표준 Wnt/칼슘 경로는 세포 내부의 칼슘을 조절합니다.
Wnt 시그널링은 처음에 발암에 대한 역할로 확인되었고, 그 후 배아 발달에서의 기능으로 확인되었다.이것이 제어하는 배아 과정에는 체축 패턴 형성, 세포 운명 지정, 세포 증식 및 세포 이동 등이 포함됩니다.이러한 과정은 뼈, 심장, 근육을 포함한 중요한 조직의 적절한 형성에 필요하다.Wnt 경로 단백질의 유전자 돌연변이가 비정상적인 초파리 배아를 만들었을 때 배아 발달에서의 그것의 역할이 발견되었다.이후 연구는 이러한 이상에 책임이 있는 유전자가 쥐의 유방암 발병에도 영향을 미친다는 것을 발견했다.또한 Wnt 시그널링은 성인 골수, 피부 [5]및 장의 조직 재생을 제어합니다.
이 경로의 임상적 중요성은 유방암과 전립선암, 교아종, 제2형 당뇨병 [6][7]등을 포함한 다양한 질병으로 이어지는 돌연변이에 의해 입증되었다.최근 몇 년 동안 연구원들은 질병의 [8]마우스 모델에서 Wnt 경로 억제제의 성공적인 사용을 보고했다.
역사와 어원
Wnt 시그널링의 발견은 암을 유발하는 레트로바이러스에 대한 연구에 의해 영향을 받았다.1982년, Roel Nusse와 Harold Varmus는 어떤 돌연변이 유전자가 유방 종양을 일으킬 수 있는지 보기 위해 쥐의 유전자를 변이시키기 위해 쥐에게 유방 종양 바이러스를 감염시켰다.그들은 그들이 int1([3][9]통합 1)이라고 이름 붙인 새로운 쥐 원형을 확인했습니다.
Int1은 인간과 Drosophila를 포함한 여러 종에 걸쳐 고도로 보존됩니다.D.[3] melanogaster에서의 그것의 존재는 1987년에 연구자들이 드로소필라의 int1 유전자가 윙리스로 알려진 이미 알려져 있고 특징지어진 드로소필라 유전자라는 것을 발견하도록 이끌었다.크리스티아네 뉘슬레인 볼하르드와 에릭 비셰우스의 이전 연구(1995년 노벨 생리의학상 수상)가 배아 발달 중 신체 축 형성에 관여하는 세그먼트 극성 유전자로 Wg의 기능을 이미 확립했기 때문에, 연구원들은 포유류의 int1이 쥐에서 발견되었다고 결정했다.배아 [10]발달에도 관여하고 있습니다.
지속적인 연구는 int1 관련 유전자를 추가로 발견하는 것으로 이어졌다. 그러나 int1과 동일한 방식으로 식별되지 않았기 때문에 int 유전자 명명법은 부적절했다.따라서 int/Wingless 패밀리는 Wnt 패밀리가 되고 int1은 Wnt1이 됩니다.Wnt라는 이름은 int와 Wg의 합성어로 "윙리스 관련 통합 사이트"[3]의 약자입니다.
단백질
Wnt는 길이가 [11]350~400개의 아미노산인 분비된 지질 변성 시그널링 당단백질의 다양한 패밀리로 구성된다.모든 Wnts의 지질변형은 완전히 보존된 단일 세린 [12]잔기의 팔미톨로일화이다.를 Wnt이 항모 단백질 Wntless에(WLS)서 secretion[13]의 원형질 막으로 가고 그것은 Wnt 단백질 수용체 Frizzled[14][15]Wnt 단백질은 또한 위해 적절한 분비음을 확인하는데 함수 탄소 부착되어 당화를 겪게 바인딩 할 수 있이송될 수 있게 제본하기 때문에 필요하다 Palmitoleoylation 필요하다.[16]Wnt 시그널링에서 이들 단백질은 파라크린 [2][7]및 자동분비 경로를 통해 서로 다른 Wnt 경로를 활성화하는 리간드로 작용한다.
이 단백질들은 여러 [3]종에 걸쳐 잘 보존되어 있다.그들은 쥐, 인간, 제노푸스, 제브라피쉬, 드로소필라 그리고 다른 [17]많은 동물들에서 발견될 수 있습니다.
| 종. | Wnt단백질 |
|---|---|
| 호모 사피엔스 | WNT1, WNT2, WNT2B, WNT3, WNT3A, WNT4, WNT5A, WNT5B, WNT6, WNT7A, WNT7B, WNT8A, WNT9A |
| 근육근(H. sapiens와 동일한 단백질) | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt6, Wnt7A, Wnt7B, Wnt8A, Wnt9A, Wnt10B |
| 크세노푸스 | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt7B, Wnt8A, Wnt8B, Wnt10A, Wnt11, Wnt4 |
| 다니오 레리오 | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt6, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt10B, Wnt4, Wnt4, Wnt5A, Wnt5B |
| 드로소필라속 | Wg, DWnt2, DWnt3/5, DWnt4, DWnt6, WntD/DWnt8, DWnt10 |
| 히드라 | hywnt1, hywnt5a, hywnt8, hywnt7, hywnt9/10a, hywnt9/10b, hywnt9/10c, hywnt11, hywnt16 |
| 엘레강스 | mom-2, lin-44, egl-20, cwn-1, cwn-2 [18] |
메커니즘

토대
Wnt 시그널링은 Wnt 단백질이 Frizled (Fz) 패밀리 [19]수용체의 N 말단 세포외 시스테인이 풍부한 도메인에 결합할 때 시작됩니다.이 수용체들은 혈장막을 7번 가로지르며 G-단백질 결합 수용체(GPCR)[20]의 별개의 패밀리를 구성한다.그러나 Wnt 시그널링을 용이하게 하기 위해 Wnt 단백질과 Fz 수용체 간의 상호작용과 함께 공동 수용체가 필요할 수 있다.예를 들어 리포단백질수용체관련단백질(LRP)-5/6, 수용체티로신인산화효소(RTK) 및 ROR2가 [7]있다.수용체가 활성화되면 신호가 세포질에 위치한 인단백질 디셰벨(Dsh)로 보내진다.이 신호는 Fz와 Dsh 사이의 직접적인 상호작용을 통해 전송됩니다.dsh 단백질은 모든 유기체에 존재하며, 모두 고도로 보존된 단백질 도메인인 아미노 말단 DIX 도메인, 중앙 PDZ 도메인 및 카르복시 말단 DEP 도메인을 공유합니다.Dsh 이후 Wnt 신호가 여러 경로로 분기될 수 있고 각 경로가 세 [21]도메인의 다른 조합과 상호작용하기 때문에 이러한 다른 도메인은 중요하다.
표준 및 비표준 경로
가장 잘 특징지어지는 Wnt 신호 경로는 표준 Wnt 경로, 비표준 평면 세포 극성 경로 및 비표준 Wnt/칼슘 경로이다.이름에서 알 수 있듯이, 이러한 경로는 두 가지 범주 중 하나에 속합니다: 표준 또는 비표준.범주의 차이는 표준 경로가 단백질 베타-카테닌(β-카테닌)을 포함하는 반면 비표준 경로는 이와 [19]독립적으로 작동한다는 것이다.
표준 경로
표준 Wnt 경로(또는 Wnt/β-catenin 경로)는 세포질에서 β-카테닌의 축적을 유발하는 Wnt 경로이며, 핵으로의 최종 전이가 TCF/LEF 계열에 속하는 전사 인자의 전사적 공동활성제 역할을 한다.Wnt가 없으면 파괴 복합체는 일반적으로 세포질을 분해하기 때문에 β-카테닌이 세포질에 축적되지 않을 것이다.이 파괴 복합체는 다음과 같은 단백질을 포함한다.액신, 선종성 용종성 대장균(APC), 단백질 포스파타아제 2A(PP2A), 글리코겐 합성효소 키나제 3(GSK3) 및 카세인 키나제 1α(CK1α)[22][23]이다.β-카테닌을 유비퀴티네이션에 표적화함으로써 분해하고, 그 후 프로테아솜으로 보내 [19][24]소화시킨다.단, Wnt가 Fz와 LRP5/6을 바인드하면 파괴 복합기능이 중단됩니다.이는 Wnt가 음의 Wnt 조절기, Axin 및 파괴 복합체의 플라즈마 막으로의 전이를 유발하기 때문이다.파괴복합체 내의 다른 단백질에 의한 인산화는 그 후 액신을 LRP5/6의 세포질 꼬리에 결합시킨다.액신은 탈인산화되어 안정성과 수치가 저하된다.그런 다음 Dsh는 인산화를 통해 활성화되고 DIX 및 PDZ 도메인은 파괴 복합체의 GSK3 활성을 억제한다.이것은 β-catenin이 축적되고 핵에 국소화되며 TCF/LEF(T 세포 인자/림프 강화 인자)[25][24] 전사 인자와 함께 유전자 변환을 통해 세포 반응을 유도할 수 있게 한다.β-catenin은 BCL9, 피그푸스[26], 파라피브로민/하이락스와 [27]같은 다른 전사 공활성제를 모집한다.β-catenin에 의해 조립된 전사 복합체의 복잡성은 새로운 높은 처리량 단백질학 [28]연구 덕분에 나타나기 시작했다.그러나 β-카테닌이 표적 유전자 발현을 어떻게 유도하는지에 대한 통일된 이론은 여전히 누락되어 있으며, 조직 특이적 참여자들은 β-카테닌이 표적 유전자를 [29]정의하는 것을 도울 수 있다.β-카테닌 상호작용 단백질의 확장성은 우리의 이해를 복잡하게 한다: β-카테닌은 Akt에 의해 Ser552에서 직접 인산화될 수 있으며, 이것은 세포-세포 접촉으로부터의 연결을 끊고 세포에 축적된 후에 14-3-3 β-카테닌(pSer552)과 상호작용하고 핵 [30]전이를 강화한다.BCL9과 피그오푸스는 실제로 몇 가지 β-카테닌 비의존적 기능(따라서 Wnt 시그널링 [31][32][33]비의존적 기능)을 가지고 있는 것으로 보고되었다.
비표준 경로
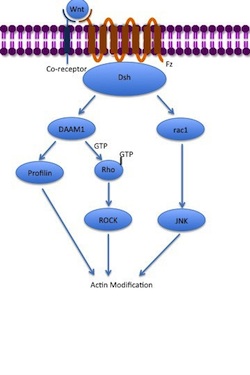
비표준 평면 세포 극성(PCP) 경로는 β-카테닌을 포함하지 않는다.LRP-5/6을 공동 수용체로 사용하지 않으며 NRH1, Ryk, PTK7 또는 ROR2를 사용하는 것으로 생각된다.PCP 경로는 Wnt와 Fz의 결합과 그 공동 수용체를 통해 활성화된다.그런 다음 수용체는 Dsh를 모집하고, Dsh 도메인은 PDZ 및 DIX 도메인을 사용하여 형태형성 1의 디셰벨 관련 활성제(DAAM1)와 복합체를 형성한다.그런 다음 Daam1은 구아닌 교환 인자를 통해 작은 G단백질 Rho를 활성화한다.Rho는 세포골격의 주요 조절제 중 하나인 Rho 관련 키나제(ROCK)를 활성화한다.Dsh는 또한 rac1과 복합체를 형성하고 액틴에 대한 프로파필린 결합을 매개한다.Rac1은 JNK를 활성화하고 액틴 중합으로 이어질 수 있습니다.액틴에 대한 프로필린 결합은 세포골격과 위장의 [7][34]재구성을 초래할 수 있다.
비표준 Wnt/칼슘 경로도 β-카테닌을 포함하지 않는다.그것의 역할은 세포 내 칼슘 수치를 조절하기 위해 소포체(ER)로부터의 칼슘 방출을 조절하는 것을 돕는 것이다.다른 Wnt 경로와 마찬가지로 리간드 결합 시 활성화된 Fz 수용체는 Dsh와 직접 상호작용하여 특정 Dsh-단백질 도메인을 활성화한다.Wnt/calcium 시그널링에 관여하는 도메인은 PDZ [7]도메인과 DEP 도메인입니다.그러나 다른 Wnt 경로와 달리 Fz 수용체는 삼량체 G-단백질과 직접 접촉한다.Dsh와 G-단백질의 이러한 공자극은 PLC 또는 cGMP 특이 PDE의 활성화로 이어질 수 있다.PLC가 활성화되면 플라즈마막 성분 PIP2가 DAG와 IP3로 분해된다.IP3가 ER에 수용체를 결합하면 칼슘이 방출됩니다.칼슘과 DAG의 농도가 증가하면 PKC를 통해 Cdc42를 활성화할 수 있습니다.Cdc42는 복부 패턴의 중요한 조절 장치입니다.칼슘의 증가는 또한 칼시뉴린과 CaMKII를 활성화시킨다.CaMKII는 세포 접착, 이동 및 조직 분리를 [7]조절하는 전사 인자 NFAT의 활성화를 유도한다.칼시뉴린은 표준 Wnt [35]경로에서 TCF/β-카테닌 신호를 방해할 수 있는 TAK1 및 NLK 키나제를 활성화한다.그러나 PDE가 활성화되면 ER로부터의 칼슘 방출이 억제됩니다.PDE는 PKG의 억제를 통해 이를 매개하며, 이후 칼슘 [7]방출 억제를 일으킨다.
통합 Wnt 경로
표준 Wnt 신호 경로와 비표준 Wnt 신호 경로의 이진 구분이 정밀하게 조사되었고 통합된 수렴 Wnt 경로가 [36]제안되었다.이에 대한 몇 가지 증거가 1개의 Wnt 리간드(Wnt5A)[37]에 대해 발견되었다.복수의 Wnt 배위자에 대해 Wnt/Ca2+와 Wnt/β-catenin 시그널링의 통합 활성화를 보여주는 수렴 Wnt 시그널링 경로에 대한 증거가 포유동물 [38]세포주에 기술되었다.
기타 경로
Wnt 시그널링은 그 외의 많은 시그널링 패스도 규제하고 있습니다.그러한 경로 중 하나는 Wnt와 GSK3 사이의 상호작용을 포함한다.세포 성장 중에 Wnt는 β-카테닌이 없는 상태에서 mTOR을 활성화하기 위해 GSK3를 억제할 수 있다.단, Wnt는 Dsh 및 GSK3 [39]상호작용을 통해 상향 조절되는 종양 억제제 TSC2의 활성화를 통해 mTOR의 음성 조절기 역할도 할 수 있다.근생성 동안 Wnt는 PA와 CREB를 사용하여 MyoD와 Myf5 [40]유전자를 활성화한다.또한 Wnt는 축방향 유도 중 뉴런 반발 조절을 위해 Ryk 및 Src와 함께 작용한다.Wnt는 CK1이 Rap1-ATPase의 억제제 역할을 할 때 위조절 중 세포골격을 조절하기 위해 위조절을 조절한다.Wnt가 CDC42 및 JNK 경로와 함께 ROR2를 사용하여 PAPC 발현을 조절하면 위조절의 추가 조절이 달성된다.Dsh는 세포 극성 및 미세관 세포골격 발달을 제어하기 위해 aPKC, Pa3, Par6, LGl과도 상호작용할 수 있다.이러한 경로는 PCP 및 Wnt/Calcium 신호와 관련된 성분과 중복되지만,[7] 서로 다른 반응을 생성하기 때문에 별개의 경로로 간주된다.
규정
적절한 기능을 확보하기 위해 Wnt 시그널링은 시그널링 [41]경로를 따라 여러 지점에서 항상 규제됩니다.예를 들어 Wnt 단백질은 팔미토일화된다.단백질 고슴도치는 이 과정을 매개하는데, 이것은 언제 Wnt 배위자가 완전히 형성되었는지 결정함으로써 언제 Wnt 배위자가 분비되는지 조절하는 것을 돕는다.분비는 GPR177(무농도)와 같은 단백질과 균등성이 중단된 단백질 및 레트로머 [7][24]복합체와 같은 복합체에 의해 더욱 제어된다.
분비 시 리간드는 확산을 억제하는 안정제 Dally 및 glypican 3(GPC3) 등의 단백질의 결합을 통해 리셉터에 도달하는 것을 방지할 수 있다.암세포에서는 헤파란황산사슬과[42][43] GPC3의 코어단백질이[44][45] 모두 Wnt결합과 세포증식을 [46][47]위한 활성화를 조절하는 데 관여한다.Wnt는 IdoA2S 및 GlcNS6S를 포함한 GPC3에서 헤파란황산구조를 인식하며, GlcNS6S3S에서의 3-O황화에 의해 헤파란황산글리피칸에 [48]대한 Wnt의 결합을 강화한다.GPC3의 N-lobe에서 시스테인이 풍부한 도메인이 Wnt와 [45][49]상호작용하는 페닐알라닌-41을 포함한 Wnt결합 소수성 홈을 형성하는 것이 확인되었다.HN3라는 나노바디를 사용하여 Wnt 바인딩 도메인을 차단하면 Wnt 활성화가 [45]억제될 수 있습니다.
Fz 수용체에서는 Wnt 이외의 단백질의 결합에 의해 시그널링을 길들일 수 있다.특정 길항제로는 Dickkopf(Dkk), Wnt 억제인자 1(WIF-1),[50][51] 분비된 프리즈 관련 단백질(SFRP), Cerberus, Frzb, Wise, SOST 및 네이키드 큐티클이 있다.이것들은 Wnt 시그널링의 억제제를 구성한다.하지만, 다른 분자들도 활성제 역할을 한다.노린과 R-스폰딘2는 Wnt 배위자가 없는 상태에서 Wnt 시그널링을 활성화한다.
Wnt 시그널링 패스간의 상호작용에 의해서 Wnt 시그널링도 규제됩니다.앞서 설명한 바와 같이 Wnt/칼슘 경로는 TCF/β-카테닌을 억제하여 표준 Wnt 경로 [7][24]시그널링을 방해할 수 있다.프로스타글란딘 E2는 표준 Wnt 시그널링 경로의 필수 활성제이다.PGE2와 수용체 E2/E4의 상호작용은 cAMP/PKA 매개 인산화로 β-카테닌을 안정화시킨다.PGE2의 합성은 제브라피쉬와 [5]생쥐의 조직 재생과 줄기세포 개체 수 조절과 같은 Wnt 신호 전달 과정에 필요하다.흥미롭게도, 여러 개의 과잉 크기 본질적으로 무질서한 단백질의 구조화되지 않은 영역은 Wnt [52]신호를 조절하는 데 중요한 역할을 한다.
유도 세포 반응
태아의 발달
Wnt 시그널링은 초기 발달에 중요한 역할을 합니다.인간, 개구리, 제브라피쉬, 엘레건, 드로소필라 등을 포함한 척추동물과 무척추동물 모두에서 활동합니다.그것은 드로소필라의 세그먼트 극성에서 처음 발견되었고, 거기서 전방과 후방 극성을 확립하는데 도움을 준다.그것은 다른 개발 과정에 관련되어 있다.Drosophila에서 그것의 기능이 시사하듯이, 그것은 신체 축 형성, 특히 전후 및 도르소프랄 축 형성에 중요한 역할을 한다.폐와 난소와 같은 중요한 장기의 형성을 촉진하기 위해 세포 분화를 유도하는 데 관여합니다.또한 세포 증식과 이동의 적절한 조절을 통해 이러한 조직의 발달을 보장합니다.Wnt 시그널링 기능은 축 패턴화, 세포 운명 지정, 세포 증식 및 세포 [53]이동으로 나눌 수 있습니다.
축 패턴화
초기 배아 발달에서, 1차 신체 축의 형성은 유기체의 전체적인 신체 계획을 수립하는 데 있어 중요한 단계이다.축에는 전후축, 등배축 및 오른쪽-왼쪽 축이 포함됩니다.Wnt 시그널링은 전후방향 및 도르소벤트랄(DV) 축 형성에 관여합니다.전방-후방 발달에서의 Wnt 신호 활동은 포유류, 물고기 및 개구리에서 볼 수 있다.포유동물에서 원시줄기 및 기타 주변조직은 형태소성 화합물인 Wnts, BMPs, FGFs, Nodal 및 레티노인산을 생성하여 후위부위를 확립한다.이 단백질들은 농도 구배를 형성한다.농도가 가장 높은 영역은 후방 영역을 형성하고 농도가 가장 낮은 영역은 전방 영역을 나타낸다.물고기와 개구리에서는 표준 Wnt 시그널링에 의해 생성된 β-카테닌이 조직 중심을 형성하고, BMP와 함께 사후 형성을 유도한다.DV축 형성에 대한 Wnt의 관여는 등부를 형성하는 Spemann 조직체의 형성 활동에서 볼 수 있다.표준 Wnt 시그널링 β-catenin 생성은 쌍둥이 및 시아모아 [36][53]유전자의 활성화를 통해 본 오가나이저의 형성을 유도한다.마찬가지로, 조류 위배에서, 콜러의 낫의 세포는 원시적인 줄무늬가 형성되는 동안 세포의 분화를 가능하게 하는 다른 중배엽 표지자 유전자를 표현합니다.이 [54][55]이동은 FGF에 의해 활성화되는 Wnt 시그널링이 담당합니다.
Wnt 시그널링은 개발 후 특정 신체 부위 및 장기 시스템의 축 형성에 관여합니다.척추동물에서 음파고슴도치(Shh)와 Wnt 형태유전학적 신호구배는 신경관 축방향 패턴 형성 중 중추신경계의 도르소벤트럴 축을 확립한다.Wnt 시그널링이 높으면 배쪽 영역이 확립되고, Shh 시그널링이 높으면 배쪽 [56]영역이 확립됩니다.Wnt는 축삭유도에 관여함으로써 중추신경계의 DV 형성에 관여한다.Wnt 단백질은 척수의 축삭을 전후 [57]방향으로 유도한다.Wnt는 또한 사지 DV축의 형성에 관여한다.특히, Wnt7a는 발달하는 [36][53]사지의 등쪽 패턴을 만드는 데 도움을 줍니다.
발달의 배아 분화파 모델에서 Wnt는 분화할 준비가 된 유능한 세포에서 신호 복합체의 일부로서 중요한 역할을 한다.Wnt는 세포골격의 활성에 반응하여 수축 또는 팽창의 통과 파동에 의해 생성된 초기 변화를 안정화시키고 동시에 개별 세포가 어떤 파동에 참여했는지를 다른 신호 전달 경로의 사용을 통해 핵에 신호를 보낸다.따라서 Wnt 활동은 [58][59]개발 중에 발생하는 기계적 신호를 증폭시킵니다.
셀 운명 사양
세포 운명 지정 또는 세포 분화는 분화되지 않은 세포가 보다 전문화된 세포 유형이 될 수 있는 과정입니다.Wnt 시그널링은 중배엽과 내배엽 전구 세포로의 다능성 줄기세포 [60]분화를 유도한다.이러한 전구 세포는 내피, 심장 및 혈관 평활근 [61]계통과 같은 세포 유형으로 더욱 분화됩니다.WNT 시그널링은 줄기세포로부터 혈액 형성을 유도한다.구체적으로 Wnt3는 조혈전위를 [62]가진 중배엽 기탁세포로 이어진다.Wnt1은 신경 분화에 길항하며 신경줄기세포의 자가 재생의 주요 요인이다.이것은 신경계 세포의 재생을 가능하게 하는데, 이것은 신경줄기세포의 [60]증식을 촉진하는 역할의 추가적인 증거이다.Wnt 시그널링은 생식세포 결정, 내장조직 특정, 모낭 발달, 폐조직 발달, 간신경 파고세포 분화, 네프론 발달, 난소 발달 및 성별 [53]결정에 관여한다.또한 Wnt 시그널링은 심장 형성에 대항하며,[63][64][65] Wnt 억제는 발달 중 심장 조직의 중요한 유도제이며, 다능성 줄기세포로부터 [66][67]심근세포를 생성하기 위해 작은 분자 Wnt 억제제가 일상적으로 사용된다.
세포 증식
다른 유기체의 특정 세포 조직을 형성하기 위해 필요한 세포의 대량 분화를 하기 위해서는 배아 줄기세포의 증식과 성장이 일어나야 한다.이 과정은 핵과 세포질 β-카테닌을 증가시키는 표준 Wnt 시그널링을 통해 매개된다.증가된 β-카테닌은 세포 사이클에서 G1에서 S로의 상 전이를 제어하는 사이클린 D1 및 c-myc와 같은 단백질의 전사 활성화를 시작할 수 있다.S기로의 진입은 DNA 복제를 유발하고 궁극적으로 [68]세포 증식의 원인이 되는 유사분열을 일으킨다.줄기세포가 증식함에 따라 분화도 이루어지기 때문에 이러한 증식 증가는 세포 분화와 직접적으로 짝을 이룬다.이것은 배아 발달 동안 특정 조직 시스템의 전반적인 성장과 발달을 가능하게 한다.이는 Wnt3a가 적혈구 [69]형성에 필요한 조혈모세포의 증식 및 팽창으로 이어지는 순환계와 같은 시스템에서 명백하다.
암 줄기세포의 생화학은 다른 종양세포와 미묘하게 다르다.이러한 소위 Wnt 중독 세포들은 그들의 통제되지 않은 성장, 생존 및 이동을 촉진하기 위해 Wnt 경로의 지속적인 자극에 의해 납치되고 의존합니다.암에서 Wnt 시그널링은 정상 수용체가 신호를 수신하지 않아도 영구적으로 활성화되는 하류 종양유전자와 종양억제 유전자의 돌연변이를 통해 규칙적인 자극으로부터 독립될 수 있다.β-카테닌은 단백질 TCF4와 같은 전사 인자와 결합하고 분자는 필요한 유전자를 활성화한다.LF3는 체외, 세포주 및 마우스 모델에서 이러한 결합을 강하게 억제하고 종양 성장을 감소시킨다.건강한 세포에 영향을 주지 않으면서 복제를 방지하고 마이그레이션 능력을 줄였습니다.치료 후에도 암 줄기세포는 남아있지 않았다.이 발견은 알파스크린과 ELISA [70]기술을 포함한 "합리적인 약물 설계"의 산물이었다.
세포 이행
배아 발달 중의 세포 이동은 신체 축의 확립, 조직 형성, 사지 유도 및 다른 여러 과정을 가능하게 한다.Wnt 시그널링은 특히 컨버전스 익스텐션 중에 이 프로세스를 중개하는 데 도움이 됩니다.Wnt PCP 경로와 표준 Wnt 경로 양쪽에서 시그널링은 위경로 중 적절한 수렴 확장을 위해 필요하다.수렴 확장은 Wnt/칼슘 경로에 의해 더욱 조절되며, 이는 활성화 시 수렴 확장을 차단한다.Wnt 시그널링은 또한 신경아세포, 신경능세포,[71] 근구, 기관세포의 이동행동을 제어함으로써 발달의 후반 단계에서 세포 이동을 유도한다.
Wnt 시그널링은 상피-간막 전이(EMT)로 알려진 또 다른 주요 이행 프로세스에 관여합니다.이 과정은 상피세포가 간엽세포로 변환되어 더 이상 라미닌에 고정되지 않도록 합니다.그것은 세포가 라미닌에서 분리되어 이동할 수 있도록 카드헤린을 하향 조절하는 것을 포함한다.Wnt 시그널링은 특히 유방 [72]발달에서 EMT의 유도체이다.
인슐린 감수성
인슐린은 특정 유기체의 포도당 항상성에 관여하는 펩타이드 호르몬이다.구체적으로는 혈류로부터의 포도당 흡수를 증가시키기 위해 세포막 내 포도당 수송체의 상향 조절을 유도한다.이 과정은 세포의 인슐린 민감도를 높일 수 있는 Wnt/β-catenin 시그널링의 활성화에 의해 부분적으로 매개된다.특히, Wnt10b는 골격근 [73]세포에서 이러한 민감도를 증가시키는 Wnt 단백질이다.
임상적 영향
암
최초 발견 이후 Wnt 시그널링은 암과 관련이 있다.Wnt1이 발견되었을 때, 그것은 유방암에 대한 생쥐 모델에서 원종 유전자로 처음 확인되었다.Wnt1이 Wg의 상동어라는 사실은 그것이 종종 빠른 세포 분열과 이동을 필요로 하는 배아 발달에 관여하고 있다는 것을 보여준다.이러한 과정의 잘못된 조절은 과도한 세포 [3]증식에 의한 종양 발생을 초래할 수 있다.
표준 Wnt 경로 활동은 양성 및 악성 유방 종양 발생에 관여한다.종양 화학에서 Wnt 경로의 역할은 암 유발 세포의 [74]뚜렷한 하위 집단을 유지하는 역할뿐만 아니라 잘 문서화되어 있다.그 존재는 면역 조직 화학적 염색 및 웨스턴 블롯으로 검출할 수 있는 핵 및/또는 세포질 내 β-카테닌의 높은 수치에 의해 밝혀진다.β-카테닌 발현 증가는 유방암 환자의 예후 불량과 관련이 있다.이러한 축적은 β-카테닌의 돌연변이, β-카테닌 파괴 복합체의 결핍, 가장 빈번하게 APC의 구조적으로 무질서한 영역의 돌연변이, Wnt 배위자의 과잉 발현, 억제제 상실 및/또는 조절 경로의 활성 감소(Wnt/calcium 경로 [52][75][76]등)와 같은 요인에 기인할 수 있다.유방암은 EMT에 관여하는 Wnt에 의해 전이될 수 있다. 기초암과 같은 유방암이 폐로 전이되는 것을 살펴본 연구에 따르면 Wnt/β-catenin 시그널링을 억제하면 [77]전이를 억제할 수 있는 EMT를 막을 수 있는 것으로 나타났다.
Wnt 시그널링은 다른 암의 발병과 관련이 있다.β-카테닌을 코드하는 유전자인 CTNNB1 발현 변화는 유방, 대장, 흑색종, 전립선, 폐 및 기타 암에서 측정할 수 있다.Wnt1, Wnt2, Wnt7A와 같은 Wnt 리간드 단백질의 발현 증가는 교아세포종, 식도암, 난소암 발생에서 각각 관찰되었다.적절한 기능이 없을 때 여러 종류의 암을 일으키는 다른 단백질로는 ROR1, ROR2, SFRP4, Wnt5A, WIF1 및 TCF/LEF [78]계열의 단백질이 있다.Wnt 시그널링은 분리된 온/오프 상태를 시사하는 연구로 유방암과 전립선암에서 뼈 전이의 병인에 더욱 관련이 있다.Wnt는 면역 [79]감시를 피하기 위해 휴면기 동안 자가분비 Dkk1에 의해 하향 조절되며 세포 내 Dact1에 [80]의한 전파기 동안에도 하향 조절된다.한편 Wnt는 E-셀렉틴에 의해 [81]초기 성장 단계에서 활성화된다.
PGE2와 Wnt의 연관성은 만성 염증 관련 PGE2의 증가가 다른 조직에서 Wnt 경로의 활성화로 이어져 [5]발암을 유발할 수 있음을 시사한다.
제2형 당뇨병
제2형 당뇨병은 인슐린 분비가 감소하고 말초 인슐린 저항성이 증가하는 흔한 질병이다.그것은 혈당치 상승 또는 고혈당증을 초래하는데, 치료하지 않으면 치명적일 수 있다.Wnt 시그널링은 인슐린 감수성에 관여하기 때문에 경로의 오작동이 수반될 수 있다.예를 들어 Wnt5b의 과잉 발현은 비만과 제2형 당뇨병이 높은 공존성을 [82]가지기 때문에 지방 형성에 대한 역할로 인해 감수성을 증가시킬 수 있다.Wnt 시그널링은 미토콘드리아 생물 형성의 강력한 활성제이다.이는 DNA와 세포 [83]손상을 일으키는 것으로 알려진 활성산소종(ROS)의 생산을 증가시킨다.이 ROS로 인한 손상은 급성 간 인슐린 저항성 또는 손상으로 인한 인슐린 [84]저항성을 유발할 수 있기 때문에 중요합니다.TCF7L2와 같은 Wnt 시그널링 관련 전사 인자의 돌연변이는 [85]감수성 증가와 관련이 있다.
「 」를 참조해 주세요.
- AXIN1
- GSK-3
- 탈모 관리
- 날개 없는 국재 요소 3(WLE3)
- WNT1-유도신호경로단백질1(WISP1)
- WNT1-유도신호경로단백질2(WISP2)
- WNT1-유도신호경로단백질3(WISP3)
레퍼런스
- ^ Nusse R, Brown A, Papkoff J, Scambler P, Shackleford G, McMahon A, et al. (January 1991). "A new nomenclature for int-1 and related genes: the Wnt gene family". Cell. 64 (2): 231. doi:10.1016/0092-8674(91)90633-a. PMID 1846319. S2CID 3189574.
- ^ a b Nusse R, Varmus HE (June 1992). "Wnt genes". Cell. 69 (7): 1073–87. doi:10.1016/0092-8674(92)90630-U. PMID 1617723. S2CID 10422968.
- ^ a b c d e f Nusse R (January 2005). "Wnt signaling in disease and in development". Cell Research. 15 (1): 28–32. doi:10.1038/sj.cr.7290260. PMID 15686623.
- ^ Zhang H, Zhang H, Zhang Y, Ng SS, Ren F, Wang Y, Duan Y, Chen L, Zhai Y, Guo Q, Chang Z (November 2010). "Dishevelled-DEP domain interacting protein (DDIP) inhibits Wnt signaling by promoting TCF4 degradation and disrupting the TCF4/beta-catenin complex". Cellular Signalling. 22 (11): 1753–60. doi:10.1016/j.cellsig.2010.06.016. PMID 20603214.
- ^ a b c Goessling W, North TE, Loewer S, Lord AM, Lee S, Stoick-Cooper CL, Weidinger G, Puder M, Daley GQ, Moon RT, Zon LI (March 2009). "Genetic interaction of PGE2 and Wnt signaling regulates developmental specification of stem cells and regeneration". Cell. 136 (6): 1136–47. doi:10.1016/j.cell.2009.01.015. PMC 2692708. PMID 19303855.
- ^ Logan CY, Nusse R (2004). "The Wnt signaling pathway in development and disease". Annual Review of Cell and Developmental Biology. 20: 781–810. CiteSeerX 10.1.1.322.311. doi:10.1146/annurev.cellbio.20.010403.113126. PMID 15473860.
- ^ a b c d e f g h i j Komiya Y, Habas R (April 2008). "Wnt signal transduction pathways". Organogenesis. 4 (2): 68–75. doi:10.4161/org.4.2.5851. PMC 2634250. PMID 19279717.
- ^ Zimmerli D, Hausmann G, Cantù C, Basler K (December 2017). "Pharmacological interventions in the Wnt pathway: inhibition of Wnt secretion versus disrupting the protein-protein interfaces of nuclear factors". British Journal of Pharmacology. 174 (24): 4600–4610. doi:10.1111/bph.13864. PMC 5727313. PMID 28521071.
- ^ Nusse R, van Ooyen A, Cox D, Fung YK, Varmus H (1984). "Mode of proviral activation of a putative mammary oncogene (int-1) on mouse chromosome 15". Nature. 307 (5947): 131–6. Bibcode:1984Natur.307..131N. doi:10.1038/307131a0. PMID 6318122. S2CID 4261052.
- ^ Klaus A, Birchmeier W (May 2008). "Wnt signalling and its impact on development and cancer". Nature Reviews. Cancer. 8 (5): 387–98. doi:10.1038/nrc2389. PMID 18432252. S2CID 31382024.
- ^ Cadigan KM, Nusse R (December 1997). "Wnt signaling: a common theme in animal development". Genes & Development. 11 (24): 3286–305. doi:10.1101/gad.11.24.3286. PMID 9407023.
- ^ Hannoush RN (October 2015). "Synthetic protein lipidation". Current Opinion in Chemical Biology. 28: 39–46. doi:10.1016/j.cbpa.2015.05.025. PMID 26080277.
- ^ Yu J, Chia J, Canning CA, Jones CM, Bard FA, Virshup DM (May 2014). "WLS retrograde transport to the endoplasmic reticulum during Wnt secretion". Developmental Cell. 29 (3): 277–91. doi:10.1016/j.devcel.2014.03.016. PMID 24768165.
- ^ Janda CY, Waghray D, Levin AM, Thomas C, Garcia KC (July 2012). "Structural basis of Wnt recognition by Frizzled". Science. 337 (6090): 59–64. Bibcode:2012Sci...337...59J. doi:10.1126/science.1222879. PMC 3577348. PMID 22653731.
- ^ Hosseini V, Dani C, Geranmayeh MH, Mohammadzadeh F, Nazari Soltan Ahmad S, Darabi M (June 2019). "Wnt lipidation: Roles in trafficking, modulation, and function". Journal of Cellular Physiology. 234 (6): 8040–8054. doi:10.1002/jcp.27570. PMID 30341908. S2CID 53009014.
- ^ Kurayoshi M, Yamamoto H, Izumi S, Kikuchi A (March 2007). "Post-translational palmitoylation and glycosylation of Wnt-5a are necessary for its signalling". The Biochemical Journal. 402 (3): 515–23. doi:10.1042/BJ20061476. PMC 1863570. PMID 17117926.
- ^ Nusse, Roel. "The Wnt Homepage". Retrieved 15 April 2013.
- ^ Sawa H, Korswagen HC (March 2013). "WNT signaling in C. Elegans". WormBook: 1–30. doi:10.1895/wormbook.1.7.2. PMC 5402212. PMID 25263666.
- ^ a b c Rao TP, Kühl M (June 2010). "An updated overview on Wnt signaling pathways: a prelude for more". Circulation Research. 106 (12): 1798–806. doi:10.1161/CIRCRESAHA.110.219840. PMID 20576942.
- ^ Schulte G, Bryja V (October 2007). "The Frizzled family of unconventional G-protein-coupled receptors". Trends in Pharmacological Sciences. 28 (10): 518–25. doi:10.1016/j.tips.2007.09.001. PMID 17884187.
- ^ Habas R, Dawid IB (February 2005). "Dishevelled and Wnt signaling: is the nucleus the final frontier?". Journal of Biology. 4 (1): 2. doi:10.1186/jbiol22. PMC 551522. PMID 15720723.
- ^ Minde DP, Anvarian Z, Rüdiger SG, Maurice MM (August 2011). "Messing up disorder: how do missense mutations in the tumor suppressor protein APC lead to cancer?". Molecular Cancer. 10: 101. doi:10.1186/1476-4598-10-101. PMC 3170638. PMID 21859464.
- ^ Minde DP, Radli M, Forneris F, Maurice MM, Rüdiger SG (2013). Buckle AM (ed.). "Large extent of disorder in Adenomatous Polyposis Coli offers a strategy to guard Wnt signalling against point mutations". PLOS ONE. 8 (10): e77257. Bibcode:2013PLoSO...877257M. doi:10.1371/journal.pone.0077257. PMC 3793970. PMID 24130866.
- ^ a b c d MacDonald BT, Tamai K, He X (July 2009). "Wnt/beta-catenin signaling: components, mechanisms, and diseases". Developmental Cell. 17 (1): 9–26. doi:10.1016/j.devcel.2009.06.016. PMC 2861485. PMID 19619488.
- ^ Staal FJ, Clevers H (February 2000). "Tcf/Lef transcription factors during T-cell development: unique and overlapping functions". The Hematology Journal. 1 (1): 3–6. doi:10.1038/sj.thj.6200001. PMID 11920163.
- ^ Kramps T, Peter O, Brunner E, Nellen D, Froesch B, Chatterjee S, Murone M, Züllig S, Basler K (April 2002). "Wnt/wingless signaling requires BCL9/legless-mediated recruitment of pygopus to the nuclear beta-catenin-TCF complex" (PDF). Cell. 109 (1): 47–60. doi:10.1016/s0092-8674(02)00679-7. PMID 11955446. S2CID 16720801.
- ^ Mosimann C, Hausmann G, Basler K (April 2006). "Parafibromin/Hyrax activates Wnt/Wg target gene transcription by direct association with beta-catenin/Armadillo". Cell. 125 (2): 327–41. doi:10.1016/j.cell.2006.01.053. PMID 16630820.
- ^ van Tienen LM, Mieszczanek J, Fiedler M, Rutherford TJ, Bienz M (March 2017). "Constitutive scaffolding of multiple Wnt enhanceosome components by Legless/BCL9". eLife. 6: e20882. doi:10.7554/elife.20882. PMC 5352222. PMID 28296634.
- ^ Söderholm, Simon; Cantù, Claudio (21 October 2020). "The WNT/β‐catenin dependent transcription: A tissue‐specific business". WIREs Systems Biology and Medicine. 13 (3): e1511. doi:10.1002/wsbm.1511. PMID 33085215.
- ^ Fang D, Hawke D, Zheng Y, Xia Y, Meisenhelder J, Nika H, Mills GB, Kobayashi R, Hunter T, Lu Z (April 2007). "Phosphorylation of beta-catenin by AKT promotes beta-catenin transcriptional activity". Journal of Biological Chemistry. 282 (15): 11221–9. doi:10.1074/jbc.M611871200. PMC 1850976. PMID 17287208.
- ^ Cantù C, Valenta T, Hausmann G, Vilain N, Aguet M, Basler K (June 2013). "The Pygo2-H3K4me2/3 interaction is dispensable for mouse development and Wnt signaling-dependent transcription". Development. 140 (11): 2377–86. doi:10.1242/dev.093591. PMID 23637336.
- ^ Cantù C, Zimmerli D, Hausmann G, Valenta T, Moor A, Aguet M, Basler K (September 2014). "Pax6-dependent, but β-catenin-independent, function of Bcl9 proteins in mouse lens development". Genes & Development. 28 (17): 1879–84. doi:10.1101/gad.246140.114. PMC 4197948. PMID 25184676.
- ^ Cantù C, Pagella P, Shajiei TD, Zimmerli D, Valenta T, Hausmann G, Basler K, Mitsiadis TA (February 2017). "A cytoplasmic role of Wnt/β-catenin transcriptional cofactors Bcl9, Bcl9l, and Pygopus in tooth enamel formation". Science Signaling. 10 (465): eaah4598. doi:10.1126/scisignal.aah4598. PMID 28174279. S2CID 6845295.
- ^ Gordon MD, Nusse R (August 2006). "Wnt signaling: multiple pathways, multiple receptors, and multiple transcription factors". The Journal of Biological Chemistry. 281 (32): 22429–33. doi:10.1074/jbc.R600015200. PMID 16793760.
- ^ Sugimura R, Li L (December 2010). "Noncanonical Wnt signaling in vertebrate development, stem cells, and diseases". Birth Defects Research. Part C, Embryo Today. 90 (4): 243–56. doi:10.1002/bdrc.20195. PMID 21181886.
- ^ a b c van Amerongen R, Nusse R (October 2009). "Towards an integrated view of Wnt signaling in development". Development. 136 (19): 3205–14. doi:10.1242/dev.033910. PMID 19736321.
- ^ van Amerongen R, Fuerer C, Mizutani M, Nusse R (September 2012). "Wnt5a can both activate and repress Wnt/β-catenin signaling during mouse embryonic development". Developmental Biology. 369 (1): 101–14. doi:10.1016/j.ydbio.2012.06.020. PMC 3435145. PMID 22771246.
- ^ Thrasivoulou C, Millar M, Ahmed A (December 2013). "Activation of intracellular calcium by multiple Wnt ligands and translocation of β-catenin into the nucleus: a convergent model of Wnt/Ca2+ and Wnt/β-catenin pathways". The Journal of Biological Chemistry. 288 (50): 35651–9. doi:10.1074/jbc.M112.437913. PMC 3861617. PMID 24158438.
- ^ Inoki K, Ouyang H, Zhu T, Lindvall C, Wang Y, Zhang X, Yang Q, Bennett C, Harada Y, Stankunas K, Wang CY, He X, MacDougald OA, You M, Williams BO, Guan KL (September 2006). "TSC2 integrates Wnt and energy signals via a coordinated phosphorylation by AMPK and GSK3 to regulate cell growth". Cell. 126 (5): 955–68. doi:10.1016/j.cell.2006.06.055. PMID 16959574. S2CID 16047397.
- ^ Kuroda K, Kuang S, Taketo MM, Rudnicki MA (March 2013). "Canonical Wnt signaling induces BMP-4 to specify slow myofibrogenesis of fetal myoblasts". Skeletal Muscle. 3 (1): 5. doi:10.1186/2044-5040-3-5. PMC 3602004. PMID 23497616.
- ^ Malinauskas T, Jones EY (December 2014). "Extracellular modulators of Wnt signalling". Current Opinion in Structural Biology. 29: 77–84. doi:10.1016/j.sbi.2014.10.003. PMID 25460271.
- ^ Gao W, Kim H, Feng M, Phung Y, Xavier CP, Rubin JS, Ho M (August 2014). "Inactivation of Wnt signaling by a human antibody that recognizes the heparan sulfate chains of glypican-3 for liver cancer therapy". Hepatology. 60 (2): 576–87. doi:10.1002/hep.26996. PMC 4083010. PMID 24492943.
- ^ Gao W, Xu Y, Liu J, Ho M (May 2016). "Epitope mapping by a Wnt-blocking antibody: evidence of the Wnt binding domain in heparan sulfate". Scientific Reports. 6: 26245. Bibcode:2016NatSR...626245G. doi:10.1038/srep26245. PMC 4869111. PMID 27185050.
- ^ Gao W, Tang Z, Zhang YF, Feng M, Qian M, Dimitrov DS, Ho M (March 2015). "Immunotoxin targeting glypican-3 regresses liver cancer via dual inhibition of Wnt signalling and protein synthesis". Nature Communications. 6: 6536. Bibcode:2015NatCo...6.6536G. doi:10.1038/ncomms7536. PMC 4357278. PMID 25758784.
- ^ a b c Li N, Wei L, Liu X, Bai H, Ye Y, Li D, et al. (April 2019). "A Frizzled-Like Cysteine-Rich Domain in Glypican-3 Mediates Wnt Binding and Regulates Hepatocellular Carcinoma Tumor Growth in Mice". Hepatology. 70 (4): 1231–1245. doi:10.1002/hep.30646. PMC 6783318. PMID 30963603.
- ^ Ho M, Kim H (February 2011). "Glypican-3: a new target for cancer immunotherapy". European Journal of Cancer. 47 (3): 333–8. doi:10.1016/j.ejca.2010.10.024. PMC 3031711. PMID 21112773.
- ^ Li N, Gao W, Zhang YF, Ho M (November 2018). "Glypicans as Cancer Therapeutic Targets". Trends in Cancer. 4 (11): 741–754. doi:10.1016/j.trecan.2018.09.004. PMC 6209326. PMID 30352677.
- ^ Gao, Wei; Xu, Yongmei; Liu, Jian; Ho, Mitchell (May 17, 2016). "Epitope mapping by a Wnt-blocking antibody: evidence of the Wnt binding domain in heparan sulfate". Scientific Reports. 6: 26245. Bibcode:2016NatSR...626245G. doi:10.1038/srep26245. ISSN 2045-2322. PMC 4869111. PMID 27185050.
- ^ Kolluri A, Ho M (2019-08-02). "The Role of Glypican-3 in Regulating Wnt, YAP, and Hedgehog in Liver Cancer". Frontiers in Oncology. 9: 708. doi:10.3389/fonc.2019.00708. PMC 6688162. PMID 31428581.
- ^ Malinauskas T, Aricescu AR, Lu W, Siebold C, Jones EY (July 2011). "Modular mechanism of Wnt signaling inhibition by Wnt inhibitory factor 1". Nature Structural & Molecular Biology. 18 (8): 886–93. doi:10.1038/nsmb.2081. PMC 3430870. PMID 21743455.
- ^ Malinauskas T (March 2008). "Docking of fatty acids into the WIF domain of the human Wnt inhibitory factor-1". Lipids. 43 (3): 227–30. doi:10.1007/s11745-007-3144-3. PMID 18256869. S2CID 31357937.
- ^ a b Minde DP, Radli M, Forneris F, Maurice MM, Rüdiger SG (2013). "Large extent of disorder in Adenomatous Polyposis Coli offers a strategy to guard Wnt signalling against point mutations". PLOS ONE. 8 (10): e77257. Bibcode:2013PLoSO...877257M. doi:10.1371/journal.pone.0077257. PMC 3793970. PMID 24130866.
- ^ a b c d Gilbert SF (2010). Developmental biology (9th ed.). Sunderland, Mass.: Sinauer Associates. ISBN 9780878933846.
- ^ Vasiev B, Balter A, Chaplain M, Glazier JA, Weijer CJ (May 2010). "Modeling gastrulation in the chick embryo: formation of the primitive streak". PLOS ONE. 5 (5): e10571. Bibcode:2010PLoSO...510571V. doi:10.1371/journal.pone.0010571. PMC 2868022. PMID 20485500.
- ^ Gilbert SF (2014). "Early Development in Birds". Developmental Biology (10th ed.). Sunderland (MA): Sinauer Associates.
- ^ Ulloa F, Martí E (January 2010). "Wnt won the war: antagonistic role of Wnt over Shh controls dorso-ventral patterning of the vertebrate neural tube". Developmental Dynamics. 239 (1): 69–76. doi:10.1002/dvdy.22058. PMID 19681160.
- ^ Zou Y (September 2004). "Wnt signaling in axon guidance". Trends in Neurosciences. 27 (9): 528–32. doi:10.1016/j.tins.2004.06.015. PMID 15331234. S2CID 15635026.
- ^ Gordon NK, Gordon R (March 2016). "The organelle of differentiation in embryos: the cell state splitter". Theoretical Biology & Medical Modelling. 13: 11. doi:10.1186/s12976-016-0037-2. PMC 4785624. PMID 26965444.
- ^ Gordon N, Gordon, R (2016). Embryogenesis Explained. Singapore: World Scientific Publishing. pp. 580–591. doi:10.1142/8152. ISBN 978-981-4740-69-2.
- ^ a b Nusse R (May 2008). "Wnt signaling and stem cell control". Cell Research. 18 (5): 523–7. doi:10.1038/cr.2008.47. PMID 18392048.
- ^ Bakre MM, Hoi A, Mong JC, Koh YY, Wong KY, Stanton LW (October 2007). "Generation of multipotential mesendodermal progenitors from mouse embryonic stem cells via sustained Wnt pathway activation". The Journal of Biological Chemistry. 282 (43): 31703–12. doi:10.1074/jbc.M704287200. PMID 17711862.
- ^ Woll PS, Morris JK, Painschab MS, Marcus RK, Kohn AD, Biechele TL, Moon RT, Kaufman DS (January 2008). "Wnt signaling promotes hematoendothelial cell development from human embryonic stem cells". Blood. 111 (1): 122–31. doi:10.1182/blood-2007-04-084186. PMC 2200802. PMID 17875805.
- ^ Schneider VA, Mercola M (February 2001). "Wnt antagonism initiates cardiogenesis in Xenopus laevis". Genes & Development. 15 (3): 304–15. doi:10.1101/gad.855601. PMC 312618. PMID 11159911.
- ^ Marvin MJ, Di Rocco G, Gardiner A, Bush SM, Lassar AB (February 2001). "Inhibition of Wnt activity induces heart formation from posterior mesoderm". Genes & Development. 15 (3): 316–27. doi:10.1101/gad.855501. PMC 312622. PMID 11159912.
- ^ Ueno S, Weidinger G, Osugi T, Kohn AD, Golob JL, Pabon L, Reinecke H, Moon RT, Murry CE (June 2007). "Biphasic role for Wnt/beta-catenin signaling in cardiac specification in zebrafish and embryonic stem cells". Proceedings of the National Academy of Sciences of the United States of America. 104 (23): 9685–90. Bibcode:2007PNAS..104.9685U. doi:10.1073/pnas.0702859104. PMC 1876428. PMID 17522258.
- ^ Willems E, Spiering S, Davidovics H, Lanier M, Xia Z, Dawson M, Cashman J, Mercola M (August 2011). "Small-molecule inhibitors of the Wnt pathway potently promote cardiomyocytes from human embryonic stem cell-derived mesoderm". Circulation Research. 109 (4): 360–4. doi:10.1161/CIRCRESAHA.111.249540. PMC 3327303. PMID 21737789.
- ^ Burridge PW, Matsa E, Shukla P, Lin ZC, Churko JM, Ebert AD, Lan F, Diecke S, Huber B, Mordwinkin NM, Plews JR, Abilez OJ, Cui B, Gold JD, Wu JC (August 2014). "Chemically defined generation of human cardiomyocytes". Nature Methods. 11 (8): 855–60. doi:10.1038/nmeth.2999. PMC 4169698. PMID 24930130.
- ^ Kaldis P, Pagano M (December 2009). "Wnt signaling in mitosis". Developmental Cell. 17 (6): 749–50. doi:10.1016/j.devcel.2009.12.001. PMID 20059944.
- ^ Willert K, Jones KA (June 2006). "Wnt signaling: is the party in the nucleus?". Genes & Development. 20 (11): 1394–404. doi:10.1101/gad.1424006. PMID 16751178.
- ^ Hodge, Russ (2016-01-25). "Hacking the programs of cancer stem cells". medicalxpress.com. Medical Express. Retrieved 2016-02-12.
- ^ Schambony A, Wedlich D (2013). Wnt Signaling and Cell Migration. Madame Curie Bioscience Database. Landes Bioscience. Retrieved 7 May 2013.
- ^ Micalizzi DS, Farabaugh SM, Ford HL (June 2010). "Epithelial-mesenchymal transition in cancer: parallels between normal development and tumor progression". Journal of Mammary Gland Biology and Neoplasia. 15 (2): 117–34. doi:10.1007/s10911-010-9178-9. PMC 2886089. PMID 20490631.
- ^ Abiola M, Favier M, Christodoulou-Vafeiadou E, Pichard AL, Martelly I, Guillet-Deniau I (December 2009). "Activation of Wnt/beta-catenin signaling increases insulin sensitivity through a reciprocal regulation of Wnt10b and SREBP-1c in skeletal muscle cells". PLOS ONE. 4 (12): e8509. Bibcode:2009PLoSO...4.8509A. doi:10.1371/journal.pone.0008509. PMC 2794543. PMID 20041157.
- ^ 밀로셰비치, V. 등Wnt/IL-1β/IL-8 자동분비회로는 ABCB5를 유도함으로써 중피종 개시세포의 화학저항을 제어한다.내연 암, https://doi.org/10.1002/ijc.32419
- ^ Howe LR, Brown AM (January 2004). "Wnt signaling and breast cancer". Cancer Biology & Therapy. 3 (1): 36–41. doi:10.4161/cbt.3.1.561. PMID 14739782.
- ^ Taketo MM (April 2004). "Shutting down Wnt signal-activated cancer". Nature Genetics. 36 (4): 320–2. doi:10.1038/ng0404-320. PMID 15054482.
- ^ DiMeo TA, Anderson K, Phadke P, Fan C, Feng C, Perou CM, Naber S, Kuperwasser C (July 2009). "A novel lung metastasis signature links Wnt signaling with cancer cell self-renewal and epithelial-mesenchymal transition in basal-like breast cancer". Cancer Research. 69 (13): 5364–73. doi:10.1158/0008-5472.CAN-08-4135. PMC 2782448. PMID 19549913.
- ^ Anastas JN, Moon RT (January 2013). "WNT signalling pathways as therapeutic targets in cancer". Nature Reviews. Cancer. 13 (1): 11–26. doi:10.1038/nrc3419. PMID 23258168. S2CID 35599667.
- ^ Malladi, Srinivas; Macalinao, Danilo G.; Jin, Xin; He, Lan; Basnet, Harihar; Zou, Yilong; de Stanchina, Elisa; Massagué, Joan (2016-03-24). "Metastatic Latency and Immune Evasion through Autocrine Inhibition of WNT". Cell. 165 (1): 45–60. doi:10.1016/j.cell.2016.02.025. ISSN 1097-4172. PMC 4808520. PMID 27015306.
- ^ Esposito, Mark; Fang, Cao; Cook, Katelyn C.; Park, Nana; Wei, Yong; Spadazzi, Chiara; Bracha, Dan; Gunaratna, Ramesh T.; Laevsky, Gary; DeCoste, Christina J.; Slabodkin, Hannah (March 2021). "TGF-β-induced DACT1 biomolecular condensates repress Wnt signalling to promote bone metastasis". Nature Cell Biology. 23 (3): 257–267. doi:10.1038/s41556-021-00641-w. ISSN 1476-4679. PMC 7970447. PMID 33723425.
- ^ Esposito, Mark; Mondal, Nandini; Greco, Todd M.; Wei, Yong; Spadazzi, Chiara; Lin, Song-Chang; Zheng, Hanqiu; Cheung, Corey; Magnani, John L.; Lin, Sue-Hwa; Cristea, Ileana M. (May 2019). "Bone vascular niche E-selectin induces mesenchymal–epithelial transition and Wnt activation in cancer cells to promote bone metastasis". Nature Cell Biology. 21 (5): 627–639. doi:10.1038/s41556-019-0309-2. ISSN 1476-4679. PMC 6556210. PMID 30988423.
- ^ Welters HJ, Kulkarni RN (December 2008). "Wnt signaling: relevance to beta-cell biology and diabetes". Trends in Endocrinology and Metabolism. 19 (10): 349–55. doi:10.1016/j.tem.2008.08.004. PMID 18926717. S2CID 19299033.
- ^ Yoon JC, Ng A, Kim BH, Bianco A, Xavier RJ, Elledge SJ (July 2010). "Wnt signaling regulates mitochondrial physiology and insulin sensitivity". Genes & Development. 24 (14): 1507–18. doi:10.1101/gad.1924910. PMC 2904941. PMID 20634317.
- ^ Zhai L, Ballinger SW, Messina JL (March 2011). "Role of reactive oxygen species in injury-induced insulin resistance". Molecular Endocrinology. 25 (3): 492–502. doi:10.1210/me.2010-0224. PMC 3045736. PMID 21239612.
- ^ Grant SF, Thorleifsson G, Reynisdottir I, Benediktsson R, Manolescu A, Sainz J, et al. (March 2006). "Variant of transcription factor 7-like 2 (TCF7L2) gene confers risk of type 2 diabetes". Nature Genetics. 38 (3): 320–3. doi:10.1038/ng1732. PMID 16415884. S2CID 28825825.
추가 정보
- Milosevic V, et al. (January 2020). "Wnt/IL-1β/IL-8 autocrine circuitries control chemoresistance in mesothelioma initiating cells by inducing ABCB5". Int. J. Cancer. 146 (1): 192–207. doi:10.1002/ijc.32419. PMID 31107974. S2CID 160014053.
- Dinasarapu AR, Saunders B, Ozerlat I, Azam K, Subramaniam S (June 2011). "Signaling gateway molecule pages--a data model perspective". Bioinformatics. 27 (12): 1736–8. doi:10.1093/bioinformatics/btr190. PMC 3106186. PMID 21505029.