메센키메
Mesenchyme| 메센키메 | |
|---|---|
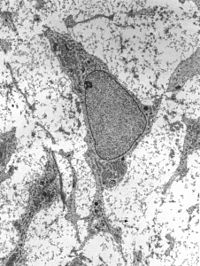 | |
 H&E로 얼룩진 메센키메(점자) | |
| 세부 사항 | |
| 카네기 무대 | 6b |
| 전구체 | 측중간막 |
| 식별자 | |
| TE | E5.16.4.0.3.0.18 |
| 해부학적 용어 | |
메센치메(/ˈmɛsmenkaɪm ˈmiːzən-/)[1]는 느슨하게 조직된 동물[2] 배아 배아 결합조직의 일종으로 혈액과 림프관, 뼈, 근육을 발생시킨다.[3]
척추동물
구조
메센치메는 형태학적으로 망막섬유와 비특이화된 중피줄기세포의 느슨한 골재를 함유한 두드러진 지상 물질 매트릭스가 특징이다.[4] 중피세포는 이동성이 부족한 상피세포와 대조적으로 쉽게 이동할 수 있는데, 상피세포는 촘촘히 붙어 있는 시트로 조직되어 있으며, 비정기적인 기저방향으로 양극화되어 있다.
개발
중생맥은 중생맥에서 유래한다.[5] 메소더름에서 메센치미는 발생학적으로 원시적인 "수프"로 나타난다. 이 "수프"는 중상피 세포와 세러스 액체와 많은 다른 조직 단백질의 조합으로 존재한다. 톱니 액에는 일반적으로 나트륨과 염화물과 같은 많은 톱니 원소가 비축되어 있다. 중핵은 근골격계뿐만 아니라 림프계와 순환계의 조직으로 발달한다. 이 후자의 체계는 뼈, 근육, 연골과 같은 몸 전체의 결합조직으로 특징지어진다. 중피세포의 악성암은 육종의 일종이다.[6][7]
상피에서 중피로의 전이
메센치메의 첫 번째 출현은 상피-메센치메스 전이(EMT) 과정에서 기식 중에 발생한다. 이러한 변화는 상피 캐더린의 상실, 촘촘한 접합, 상피세포의 세포막의 부속 결합을 통해 일어난다.[8] 표면 분자는 내피증을 겪으며 미세관 사이토스켈레톤은 형체를 잃게 되어 중신세포가 세포외 매트릭스(ECM)를 따라 이동할 수 있게 된다. 상피-망상 전환은 조직을 통해 또는 조직을 통해 이동해야 하는 배아세포에서 발생하며,중신피-뇌전환을 통해 2차 에피스를생성시킬 수 있다.늑막 조직 발생학적 중피세포는 피브로블라스트 특이 단백질로도 알려진 [10]S100-A4([9]S100A4)와 상피 캐더린의 하향 조절과 관련된 종양 유전자인 c-Fos를 표현한다.[11][12] 원시적인 줄무늬와 중간조직의 형성은 모두 Wnt/β-catenin 경로에 의존한다.[13] 중피 조직의 특정 표지는 피브로넥틴과 바이트로넥틴과 같은 ECM 인자의 추가 발현을 포함한다.[14]
이식
배아의 EMT를 거치고 메센치메를 형성한 첫 번째 세포는 열대지방의 세포외 세포들이다. 이것들은 정박된 태반의 형성에 기여하기 위해 배반포체의 몸에서 자궁 내막층으로 이동한다.[15]
1차 메센치메
1차 메센치메는 배아 중간막 조직이 최초로 출현하는 것으로, 후각세포에서 EMT로부터 생성된다. 경구에서는 Wnt신호를 통해 원시적인 줄무늬에 의해 유도되며, 미식 과정에서 메센더름(mesendoderm)이라는 임시 조직에서 내측과 중외막을 생성한다.[16]
1차 메센치메의 형성은 WNT3의 표현에 따라 달라진다. 노달(TGF-베타 단백질)과 같은 신호 경로의 다른 결함은 중층 형성에 결함을 초래할 것이다.[8]
원시적인 줄기로 형성된 조직 층은 배아에 함께 침입하고 유도된 중피줄기세포가 침투하여 중피층을 형성하게 된다. 중피 조직은 궁극적으로 신체의 대부분의 결합 조직 층을 형성하기 위해 배아 전체에 걸쳐 계속해서 분화 및/또는 이동한다.[17]
신경 중핵
발생학적 중생학은 특히 일시적이며 이주 후에 곧 구별된다. 신경 중핵은 일차 중핵 형성 직후 형성된다.[18]
ectoderm과 somite-forming morphency 인자의 상호작용은 일부 1차 mesenchyme을 신경 mesenchyme 또는 paraxial mesoderm을 형성하고 somite 형성에 기여하게 한다. 신경 중핵은 곧 ectoderm에 의해 생성된 WNT6의 영향으로 중핵-뇌피전 전이를 거치게 된다.[19] 이들 구조물은 소마이트 조직이 개발 후 연골과 골격근과 같은 구조적 결합 조직을 형성하기 위해 이동함에 따라 2차 EMT를 겪게 될 것이다.[20]
신경 파고 세포(NCC)는 1차 중신호 대신 신경 세포에서 형성되며 신경 파고 세포의 형태 유발 신호에서 형성된다. EMT는 Wnt 신호, Sox 유전자의 영향 및 세포 표면에서 E-cadherin이 손실된 결과로 발생한다. NCC는 N-카데린, 신경세포 접착 분자의 억제를 추가로 요구한다. NCC는 상피 신경세포층에서 배아로 침투하여 여러 개의 말초신경계(PNS) 세포와 멜라노사이트를 형성하기 위해 몸 전체로 이동한다. NCC의 이주는 주로 BMP 신호와 그 억제제인 노긴에 의해 유발된다.[21][22]
무척추동물
포리페라, 신이다리아, 크테노포라와 같은 일부 무척추동물에서 메센치메는 표피와 위내피 사이에 위치한 다양한 세포와 섬유성 혼합물을 가진 젤 매트릭스(메소글레아)로 구성되는 다소 딱딱하지만 느슨하게 조직된 조직을 말한다. 어떤 경우에는, 메소글라이아가 세포가 아닌 경우도 있다.[23]
- 해면체에서는 메소필이라고 한다.[24]
- 디플로블라스(Cnidaria and Ctenophora)에서 메센키메는 완전히 엑토더멀리 파생된다. 이런 종류의 메센치메는 ectomethodermal이라고 불리며, 진정한 메소데르메스로 여겨지지 않는다.
- 삼플라스틱 아켈로메이트(평활벌레 등)에서 실질마(Parenchyma)라는 용어는 중간(misenchymal) 층에 사용되기도 하는데, 이 층에는 밀도층이 ectoderm과 entoderm에서 파생된 조직(진정한 중간 중간)을 포함한다.
cnidarians에서처럼 세포 물질이 희박하거나 빽빽하게 들어차 있을 때, 메센치메는 때때로 편평한 벌레로 콜렌치마 또는 실질마라고 불릴 수 있다.[24] 하이드로조아(Hydrozoa)와 같이 세포 물질이 존재하지 않을 때 그 층을 메소글레아(mesoglea)라고 적절하게 부른다.[24]
일부 식민지 신데르니아에서는 중수체가 식민지의 구성원들 사이에서 지속적으로 위혈관 통로로 뚫린다. 이 일반적인 기초 물질의 전체 행렬을 코엔켄시메라고 부른다.[24]
참조
- ^ "MESENCHYME English Definition and Meaning Lexico.com".
- ^ Sadler, T. W. (2010). Langman's medical embryology (11th ed.). Philadelphia: Lippincott William & Wilkins. p. 70. ISBN 9780781790697.
- ^ "Definition of MESENCHYME". www.merriam-webster.com.
- ^ 중간 조직
- ^ Kierszenbaum, Abraham L.; Tres, Laura (2015). Histology and Cell Biology: An Introduction to Pathology E-Book (4 ed.). Elsevier Health Sciences. p. 123. ISBN 9780323313353.
- ^ Strum, Judy M.; Gartner, Leslie P.; Hiatt, James L. (2007). Cell biology and histology. Hagerstown, MD: Lippincott Williams & Wilkins. p. 83. ISBN 978-0-7817-8577-8.
- ^ Sadler, T.W. (2006). Langman's Medical Embryology. Lippincott Williams & Wilkins. pp. 68–70. ISBN 978-0-7817-9485-5.
- ^ a b Kalluri, Raghu; Weinberg, Robert A. (2009). "The basics of epithelial-mesenchymal transition". Journal of Clinical Investigation. 119 (6): 1420–8. doi:10.1172/JCI39104. PMC 2689101. PMID 19487818.
- ^ "S100A4 - Protein S100-A4 - Homo sapiens (Human) - S100A4 gene & protein". www.uniprot.org.
- ^ Österreicher, Christoph H.; Penz-Österreicher, Melitta; Grivennikov, Sergei I. (2011-01-04). "Fibroblast-specific protein 1 identifies an inflammatory subpopulation of macrophages in the liver". Proceedings of the National Academy of Sciences. 108 (1): 308–313. Bibcode:2011PNAS..108..308O. doi:10.1073/pnas.1017547108. PMC 3017162. PMID 21173249.
- ^ Okada, H; Danoff, T. M.; Kalluri, R; Neilson, E. G. (1997). "Early role of Fsp1 in epithelial-mesenchymal transformation". The American Journal of Physiology. 273 (4 Pt 2): F563–74. doi:10.1152/ajprenal.1997.273.4.F563. PMID 9362334.
- ^ Eger, A; Stockinger, A; Schaffhauser, B; Beug, H; Foisner, R (2000). "Epithelial mesenchymal transition by c-Fos estrogen receptor activation involves nuclear translocation of beta-catenin and upregulation of beta-catenin/lymphoid enhancer binding factor-1 transcriptional activity". The Journal of Cell Biology. 148 (1): 173–88. doi:10.1083/jcb.148.1.173. PMC 3207144. PMID 10629227.
{{cite journal}}:last3=일반 이름 포함(도움말) - ^ Mohamed, O. A.; Clarke, H. J.; Dufort, D (2004). "Beta-catenin signaling marks the prospective site of primitive streak formation in the mouse embryo". Developmental Dynamics. 231 (2): 416–24. doi:10.1002/dvdy.20135. PMID 15366019. S2CID 39908122.
- ^ Thiery, J. P.; Sleeman, J. P. (2006). "Complex networks orchestrate epithelial-mesenchymal transitions". Nature Reviews Molecular Cell Biology. 7 (2): 131–42. doi:10.1038/nrm1835. PMID 16493418. S2CID 8435009.
- ^ Bellairs, R (1986). "The primitive streak". Anatomy and Embryology. 174 (1): 1–14. doi:10.1007/bf00318331. PMID 3518538. S2CID 33629601.
- ^ Hay, E. D. (2005). "The mesenchymal cell, its role in the embryo, and the remarkable signaling mechanisms that create it". Developmental Dynamics. 233 (3): 706–20. doi:10.1002/dvdy.20345. PMID 15937929. S2CID 22368548.
- ^ Mareschi, K; Novara, M; Rustichelli, D; Ferrero, I; Guido, D; Carbone, E; Medico, E; Madon, E; Vercelli, A; Fagioli, F (2006). "Neural differentiation of human mesenchymal stem cells: Evidence for expression of neural markers and eag K+ channel types". Experimental Hematology. 34 (11): 1563–72. doi:10.1016/j.exphem.2006.06.020. PMID 17046576.
- ^ Schmidt, C; Stoeckelhuber, M; McKinnell, I; Putz, R; Christ, B; Patel, K (2004). "Wnt 6 regulates the epithelialisation process of the segmental plate mesoderm leading to somite formation". Developmental Biology. 271 (1): 198–209. doi:10.1016/j.ydbio.2004.03.016. PMID 15196961.
- ^ Stockdale, F. E.; Nikovits Jr, W; Christ, B (2000). "Molecular and cellular biology of avian somite development". Developmental Dynamics. 219 (3): 304–21. doi:10.1002/1097-0177(2000)9999:9999<::AID-DVDY1057>3.0.CO;2-5. PMID 11066088.
- ^ Bronner-Fraser, M (1994). "Neural crest cell formation and migration in the developing embryo". FASEB Journal. 8 (10): 699–706. doi:10.1096/fasebj.8.10.8050668. PMID 8050668. S2CID 12161494.
- ^ Trainor, P. A. (2005). "Specification of neural crest cell formation and migration in mouse embryos". Seminars in Cell & Developmental Biology. 16 (6): 683–93. doi:10.1016/j.semcdb.2005.06.007. PMID 16043371.
- ^ Brusca, R.C.; Brusca, G.J. (2003). Invertebrates (2nd ed.). Sunderland, Massachusetts. p. 101. ISBN 9780878930975.
- ^ a b c d Brusca, R.C.; Brusca, G.J. (2003). Invertebrates (2nd ed.). Sunderland, Massachusetts. p. 220. ISBN 9780878930975.


