MAPK6
MAPK6| MAPK6 | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||
| 별칭 | MAPK6, ERK3, HsT17250, PRKM6, p97MAPK, 미토겐활성 단백질 키나제6 | ||||||||||||||||||||||||
| 외부 ID | OMIM: 602904 MGI: 1354946 호몰로진: 55683 GeneCard: MAPK6 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 직교체 | |||||||||||||||||||||||||
| 종 | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레스 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 위치(UCSC) | Cr 15: 51.95 – 52.07Mb | Cr 9: 75.28 – 75.32Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키다타 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
미토겐 활성 단백질 키나제6는 인간에서 MAPK6 유전자에 의해 암호화된 효소다.[5][6]
이 유전자가 인코딩한 단백질은 Ser/Tr 단백질 키나아제 계열의 일원으로, 미토겐 활성 단백질 키나제(MAP 키나제)와 가장 밀접한 관련이 있다.세포외 신호조절키나제(ERKs)로도 알려진 MAP키나제스는 단백질 인산화 캐스케이드를 통해 활성화되며 복수의 생화학적 신호의 통합점 역할을 한다.이 키나아제는 핵에 국부화되어 있으며, 혈청이나 포볼 에스테르로 치료할 때 섬유블라스트에서 활성화되는 것으로 보고되어 있다.[6]
디스커버리
ERK3/MAPK6는 초기에 탐침 ERK1 유도 탐침을 사용한 호몰로지 검사에 의해 랫드 뇌 cDNA 라이브러리에서 복제되었다.[7]
유전자위치
인간에서 MAPK 6 유전자는 15번 염색체의 원위부 팔(15q21.2)에 위치한다.길이는 47.01kb이며, 중심에서 텔로미어 방향으로 표기된다.그것은 exon2에 위치한 번역 개시 코돈과 함께 6 exon으로 구성되어 있다.[8]
구조
그것은 미토겐 활성화 키나제 계열의 비정형 구성원이다.번역된 단백질의 분자량은 약 100kDa이며, 721개의 아미노산 잔류물로 이루어져 있다.[8][7]N-단말과 확장 C-단말의 대표적인 키나세 도메인을 포함한다.c- 단자의 처음 150개 잔류물은 ERK4 단백질과 50% 유사하다.키나제 영역에서는 ERK4 단백질과 약 70%의 유사성을 보인다.[8][7]인산화 모티브의 활성화 루프에는 인광 수용체 사이트(Ser-Glu-Gly)[7]가 하나만 들어 있다.
구조는 포스포릴레이트 ERK2의 결정구조를 이용한 호몰로지 모델링에 의해 예측된다.모델에 따르면 ERK3/MAPK6 kinase 도메인의 구조는 다른 MAP kinases와 유사하다.모델링된 ERK3/MAPK6 키나제 도메인은 다른 MAP 키나제스와 유사한 위상과 함께 접힐 것으로 예측된다.[7]
표현
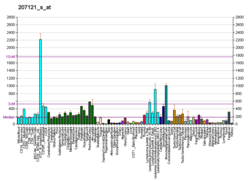
ERK3/MAPK6는 널리 표현된 단백질이지만 골격근과 뇌에서 상당히 높은 양으로 표현된다.세포질 및 세포핵으로 국부화되어 있다.ERK3/MAPK6는 매우 불안정한 단백질로 반수명이 1시간도 채 되지 않는다.그것은 유비퀴틴 매개 단백질 이동 경로에 의해 분해된다.[8]
함수
그것은 신생아 성장과 생존을 위해 매우 중요하다.ERK3/MAPK6은 미세관류 관련 단백질2(MAP2)와 MAPK5로 복합체를 형성하며, 이는 셀 사이클 진입을 매개하는 세린 189 잔류물에서 ERK3/MAPK6를 매개한다.[9]그것은 또한 T-세포 개발의 조절기 역할을 한다.ERK3/MAPK6의 촉매 활성은 흉선 내 T세포의 적절한 분화를 위해 중요한 역할을 한다.긴 c-단자는 흉선 분화를 담당한다.[10]
암에서의 역할
ERK3/MAPK6은 인산염 스테로이드 수용체 공동활성제3(SRC-3)와 상호작용하며, 세린 857에서 과압하면 암이 발생하는 인큐베이터 단백질이다.SRC-3의 인산화 결과 MMP 활성 ERK3 매개 인산염의 상향 조절이 S857에서 필수적이었던 것은 MMP 유전자 발현 및 확산 활동의 상향 조절을 촉진하는 ETS 전사 인자 PEA3와 SRC-3의 상호작용을 위해서였다.[11]
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG000069956 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000042688 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Meloche, Sylvain (2005-04-01). "Erk3". AfCS-Nature Molecule Pages. doi:10.1038/mp.a000876.01. ISSN 1477-5921.
- ^ a b "MAPK6 mitogen-activated protein kinase 6 [Homo sapiens (human)] - Gene - NCBI". www.ncbi.nlm.nih.gov. Retrieved 2018-11-09.
- ^ a b c d e Coulombe P, Meloche S (August 2007). "Atypical mitogen-activated protein kinases: structure, regulation and functions". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1773 (8): 1376–87. doi:10.1016/j.bbamcr.2006.11.001. PMID 17161475.
- ^ a b c d "MAPK6 (mitogen-activated protein kinase 6)". atlasgeneticsoncology.org. Retrieved 2018-11-09.
- ^ "Volume II Accession Number Index", Rodents, Elsevier, 1987, pp. ACCESSION–1–ACCESSION–5, doi:10.1016/b978-0-12-512512-3.50015-8, ISBN 9780125125123
- ^ Marquis M, Daudelin JF, Boulet S, Sirois J, Crain K, Mathien S, Turgeon B, Rousseau J, Meloche S, Labrecque N (September 2014). "The catalytic activity of the mitogen-activated protein kinase extracellular signal-regulated kinase 3 is required to sustain CD4+ CD8+ thymocyte survival". Molecular and Cellular Biology. 34 (18): 3374–87. doi:10.1128/MCB.01701-13. PMC 4135614. PMID 25002529.
- ^ Long W, Foulds CE, Qin J, Liu J, Ding C, Lonard DM, Solis LM, Wistuba II, Qin J, Tsai SY, Tsai MJ, O'Malley BW (May 2012). "ERK3 signals through SRC-3 coactivator to promote human lung cancer cell invasion". The Journal of Clinical Investigation. 122 (5): 1869–80. doi:10.1172/jci61492. PMC 3336992. PMID 22505454.
추가 읽기
- Boulton TG, Nye SH, Robbins DJ, Ip NY, Radziejewska E, Morgenbesser SD, DePinho RA, Panayotatos N, Cobb MH, Yancopoulos GD (May 1991). "ERKs: a family of protein-serine/threonine kinases that are activated and tyrosine phosphorylated in response to insulin and NGF". Cell. 65 (4): 663–75. doi:10.1016/0092-8674(91)90098-J. PMID 2032290.
- Zhu AX, Zhao Y, Moller DE, Flier JS (December 1994). "Cloning and characterization of p97MAPK, a novel human homolog of rat ERK-3". Molecular and Cellular Biology. 14 (12): 8202–11. doi:10.1128/MCB.14.12.8202. PMC 359359. PMID 7969157.
- Cheng M, Boulton TG, Cobb MH (April 1996). "ERK3 is a constitutively nuclear protein kinase". The Journal of Biological Chemistry. 271 (15): 8951–8. doi:10.1074/jbc.271.15.8951. PMID 8621539.
- Sauma S, Friedman E (May 1996). "Increased expression of protein kinase C beta activates ERK3". The Journal of Biological Chemistry. 271 (19): 11422–6. doi:10.1074/jbc.271.19.11422. PMID 8626698.
- Zimmermann J, Lamerant N, Grossenbacher R, Furst P (April 2001). "Proteasome- and p38-dependent regulation of ERK3 expression". The Journal of Biological Chemistry. 276 (14): 10759–66. doi:10.1074/jbc.M008567200. PMID 11148204.
- Robinson MJ, Xu Be BE, Stippec S, Cobb MH (February 2002). "Different domains of the mitogen-activated protein kinases ERK3 and ERK2 direct subcellular localization and upstream specificity in vivo". The Journal of Biological Chemistry. 277 (7): 5094–100. doi:10.1074/jbc.M110935200. PMID 11741894.
- Kinet S, Bernard F, Mongellaz C, Perreau M, Goldman FD, Taylor N (October 2002). "gp120-mediated induction of the MAPK cascade is dependent on the activation state of CD4(+) lymphocytes". Blood. 100 (7): 2546–53. doi:10.1182/blood-2002-03-0819. PMID 12239168.
- Coulombe P, Rodier G, Pelletier S, Pellerin J, Meloche S (July 2003). "Rapid turnover of extracellular signal-regulated kinase 3 by the ubiquitin-proteasome pathway defines a novel paradigm of mitogen-activated protein kinase regulation during cellular differentiation". Molecular and Cellular Biology. 23 (13): 4542–58. doi:10.1128/MCB.23.13.4542-4558.2003. PMC 164847. PMID 12808096.
- Julien C, Coulombe P, Meloche S (October 2003). "Nuclear export of ERK3 by a CRM1-dependent mechanism regulates its inhibitory action on cell cycle progression". The Journal of Biological Chemistry. 278 (43): 42615–24. doi:10.1074/jbc.M302724200. PMID 12915405.
- Rai R, Mahale A, Saranath D (August 2004). "Molecular cloning, isolation and characterisation of ERK3 gene from chewing-tobacco induced oral squamous cell carcinoma". Oral Oncology. 40 (7): 705–12. doi:10.1016/j.oraloncology.2004.01.010. PMID 15172640.
- Coulombe P, Rodier G, Bonneil E, Thibault P, Meloche S (July 2004). "N-Terminal ubiquitination of extracellular signal-regulated kinase 3 and p21 directs their degradation by the proteasome". Molecular and Cellular Biology. 24 (14): 6140–50. doi:10.1128/MCB.24.14.6140-6150.2004. PMC 434260. PMID 15226418.
- Rual JF, Venkatesan K, Hao T, Hirozane-Kishikawa T, Dricot A, Li N, Berriz GF, Gibbons FD, Dreze M, Ayivi-Guedehoussou N, Klitgord N, Simon C, Boxem M, Milstein S, Rosenberg J, Goldberg DS, Zhang LV, Wong SL, Franklin G, Li S, Albala JS, Lim J, Fraughton C, Llamosas E, Cevik S, Bex C, Lamesch P, Sikorski RS, Vandenhaute J, Zoghbi HY, Smolyar A, Bosak S, Sequerra R, Doucette-Stamm L, Cusick ME, Hill DE, Roth FP, Vidal M (October 2005). "Towards a proteome-scale map of the human protein-protein interaction network". Nature. 437 (7062): 1173–8. doi:10.1038/nature04209. PMID 16189514.
- Hoeflich KP, Eby MT, Forrest WF, Gray DC, Tien JY, Stern HM, Murray LJ, Davis DP, Modrusan Z, Seshagiri S (October 2006). "Regulation of ERK3/MAPK6 expression by BRAF". International Journal of Oncology. 29 (4): 839–49. doi:10.3892/ijo.29.4.839. PMID 16964379.