뼈형태생성단백질4
Bone morphogenetic protein 4골형태생성단백질 4는 인체에서 BMP4 유전자에 [4][5]의해 코드되는 단백질이다.BMP4는 14q22-q23 염색체에서 발견된다.
BMP4는 변형성장인자 베타 슈퍼패밀리의 일부인 뼈형태유전성단백질패밀리의 구성원이다.슈퍼패밀리는 성장과 차별화 요소의 큰 패밀리를 포함합니다.BMP4는 진화적으로 매우 보존되어 있습니다.BMP4는 초기 배아 발달에서 복부 주변부, 눈, 심장혈액 및 이소낭에서 [6]발견됩니다.
검출
뼈 형태 유발 단백질은 원래 피부 외 부위에서 생체 내 연골 골형성을 유도하는 탈염된 뼈 추출물에 의해 확인되었다.
기능.
BMP4는 단백질의 TGF-β 슈퍼패밀리에 속하는 폴리펩타이드이다.그것은 다른 뼈 형태 유발 단백질과 마찬가지로 뼈와 연골, 특히 치아와 사지의 발달과 골절 복구에 관여합니다.이 특별한 가족 구성원은 인간의 연골 형성에 중요한 역할을 한다.그것은 근육 발달, 뼈 미네랄화, 요관 발육에 [citation needed]관여하는 것으로 나타났다.
인간배아 발달에서 BMP4는 배아의 조기 분화와 배측축 확립에 필요한 중요한 신호분자이다.BMP4는 노토코드의 등부분에서 분비되며 소닉 헤지호그(노토코드의 복부부분에서 방출됨)와 함께 작용하여 후기 구조의 [citation needed]분화를 위한 등-복부축을 확립한다.
BMP4는 외배엽조직의 [citation needed]분화를 촉진한다.
뼈 형태 형성 단백질은 성체 동물에서 뼈 형성을 촉진하는 것으로 알려져 있다.이것은 골아세포의 관여와 간엽 줄기세포와 [citation needed]같은 줄기세포의 분화를 유도하는 것으로 생각된다.BMP는 태아의 발달에 큰 역할을 하는 것으로 알려져 있다.배아에서 BMP4는 복측중배엽을 유도함으로써 이종족에서 등측복축 형성을 확립하는 데 도움이 된다.생쥐에서는 BMP4의 불활성화 표적이 중배엽 [citation needed]형성을 방해한다.또한 BMP7의 도움을 받아 발달하는 신경관의 등측 복부 패턴을 확립하고 등측 [citation needed]특성을 유도한다.
BMP4는 또한 표피를 유도함으로써 이종족 배아의 신경 분화가 일어나는 정도를 제한한다.그들은 소마이트의 측면 특성을 유도하는 데 도움을 줄 수 있다.소마이트는 [citation needed]팔다리의 근육과 같은 것의 발달을 위해 필요하다.BMP4는 신경능 세포들의 사멸을 유도하면서 발달하는 머리의 패턴 형성을 돕는다; 이것은 [7]후뇌에서 이루어진다.
성인의 경우 BMP4는 뇌의 두 신경유전학적 틈새, 즉 해마의 치상회 및 측심실에 인접한 심실하부(SVZ)에서 평생 발생하는 신경생성(즉, 새로운 뉴런의 생성)에 중요하다.이러한 틈새에서 줄기 세포로부터 새로운 뉴런이 지속적으로 생성된다.실제로 치아의 BMP4는 신경줄기세포를 정지상태로 유지시켜 줄기세포 [8]풀의 고갈을 방지하는 것으로 나타났다.SVZ에서 Smad4를 통한 BMP 매개 시그널링은 성인 신경줄기세포에서 신경생성을 시작하고 올리고덴드로글리제네이션의 [9]대체 운명을 억제하기 위해 필요하다.또한 SVZ BMP4는 Tis21/B 유전자가 존재하는 SVZ 신경구의 말단 분화 결함을 구제하기 때문에 전분화 효과가 있는 것으로 나타났다.TG2(단말기 식별에 필요)가 [10]삭제되었습니다.Tis21은 SVZ에서 [10]BMP4 발현에 대한 양의 조절기입니다.
BMP4는 뼈와 연골대사에 중요하다.BMP4 시그널링은 초기 중배엽과 생식세포의 형성이 확인되었다.사지 싹 조절과 폐,[11] 간, 치아 및 안면 간엽 세포의 발달은 BMP4 시그널링에 기인하는 또 다른 중요한 기능이다.디짓 형성은 다른 BMP 신호와 함께 BMP4의 영향을 받습니다.디지털 간엽은 영역의 아포토시스를 방지하는 [12]BMP4를 나타낸다.치아의 형성은 Msx 1, 2를 유도하는 BMP4 발현에 의존합니다.이러한 전사 인자는 형성되는 치아를 앞니가 되게 한다.
BMP4는 또한 지방조직에서 중요한 역할을 한다: 그것은 백색지방 형성에 필수적이며 지방세포 [13]분화를 촉진한다.또한, 갈색 지방은 UCP1을 유도하는 곳에서 비가온성 [13]열생성과 관련된 경우에도 중요하다.
BMP4 분비는 요관으로 [14]요관 싹을 분화시키는 것을 돕는다.
BMP4는 조직조직을 길들이고 외배엽과 중배엽조직에서 초기에 발현된다.BMP4의 전사는 발달 중인 배아의 등측부 측으로부터의 저해에 의해 복측부 주변부로 제한된다.BMP4는 배-배 축 형성을 안내하는 중배엽의 복측화를 돕는다.Xenopus에서는 BMP4가 혈액과 [15]혈도의 형성을 돕는 것으로 밝혀졌다.
처음에 표피에서 발현되는 BMP4는 신경관 형성 중에 지붕판에서 발견됩니다.BMP 시그널링의 그라데이션은 Sonic Hoghig, Shh, 그라데이션에 반대됩니다.BMP4의 이 표현은 등쪽 [16]뉴런의 패턴을 나타냅니다.
BMP4는 FGF2와 함께 중배엽 계통으로의 줄기세포 분화를 촉진한다.분화 후 BMP4 및 FGF2 처리 세포는 일반적으로 처리되지 않은 줄기세포보다 [17]더 많은 양의 골형성 및 연골형 분화를 생성한다.또한 FGF2와 함께 생쥐와 사람의 [18]만능 줄기세포로부터 전구 갑상선 세포를 생산할 수 있다.
BMP4는 체질성 중배엽에서 [19]연골 형성의 일부로 여겨지는 Msx 유전자 패밀리의 발현을 유도하는 것으로 나타났다.
파라크린 성장인자인 BMP4는 쥐의 난소에서 발견되었다.BMP4는 BMP7과 함께 난소 난포의 조기 발달과 원시에서 1차 난포로의 전이를 조절한다.또한 항체에 의한 BMP4의 억제는 전체 난소 크기를 감소시키는 것으로 나타났다.이러한 결과는 BMP4가 난모세포에서 [11]아포토시스 생존 및 예방에 도움을 줄 수 있음을 나타낸다.
조류에서 BMP4는 다윈 핀치의 부리 크기에 영향을 미치는 것으로 나타났다.낮은 양의 BMP4는 낮은 부리 깊이와 폭과 상관관계가 있다.반대로 BMP4 표현이 높으면 부리의 깊이와 폭이 커집니다.BMP4의 유전자 조절은 새 [20]부리의 자연 도태의 기초를 제공합니다.
단백질 구조
인간 bmp4는 처음에 116잔기의 활성 카르복시 말단 펩타이드를 생성하는 40%잔기 전단백질로서 합성되어 번역 후 분해된다.BMP4는 보존되고 글리코실화된 [21]7개의 잔류물을 가지고 있다.단량체는 이황화 브릿지와 3쌍의 시스테인 아미노산으로 고정됩니다.이러한 구조를 "시스틴 매듭"이라고 합니다.BMP4는, 같은 BMPS 를 사용해 호모디머 또는 헤테로디머를 형성할 수 있습니다.그 예로서 BMP7이 있습니다.호모디머 또는 헤테로디머를 형성하는 이 능력은 bmp4 [22]단독보다 더 큰 골유도 활성을 가질 수 있는 능력을 준다.BMPS가 세포외 매트릭스와 어떻게 상호작용하는지는 아직 많이 알려져 있지 않다.BMP4를 분해하는 경로에 대해서는 잘 알려져 있지 않다.
억제
BMP4 신호의 억제(화음, 노긴 또는 엽리스타틴에 의한)는 외배엽을 신경판으로 분화시킨다.만약 이 세포들이 또한 FGF로부터 신호를 받는다면, 그들은 척수로 분화할 것입니다; FGF가 없을 때 세포들은 뇌 조직이 됩니다.
BMP4 발현의 과잉 발현이 복측화를 초래할 수 있지만 지배적인 음성에 의한 억제는 배아의 완전한 등측화 또는 두 [23]축의 형성을 초래할 수 있다.
BMP4가 불활성화된 쥐는 보통 위경화 중에 죽었다는 점에 유의해야 한다.인간 BMP4의 불활성화도 같은 영향을 미칠 것으로 생각된다.그러나 사람에게 미묘한 돌연변이는 표현형적으로 [citation needed]미묘한 영향을 미칠 수도 있다.
Isoforms
이 유전자의 5' 미번역 영역에서의 대체 스플라이싱이 기술되어 있으며, 3개의 변종이 기술되어 있으며, 모두 동일한 [24]단백질을 코드하고 있다.
분자 메커니즘
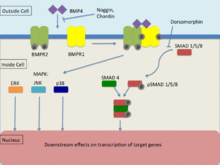
BMP4는 형질전환성장인자β(TGF-β) 패밀리의 일원으로서 BMPR1 및 [25]BMPR2로 알려진 2종류의 세린트레오닌인산화효소 수용체에 결합한다.이러한 수용체를 통한 신호 전달은 표적 유전자의 전사에 영향을 미치기 위해 Smad 및 지도 키나제 경로를 통해 일어난다.신호 전달이 일어나려면 두 수용체가 모두 기능해야 합니다.BMP는 BMPR1 없이 BMPR2에 결합할 수 있지만, 두 수용체의 존재 하에서 친화력은 유의하게 증가한다.BMPR1은 BMPR2를 통해 트랜스인산화되며, BMPR2는 세포 내에서 다운스트림 시그널링을 유도하여 [25]전사에 영향을 미친다.
스마드 신호 경로
TGF-β족 수용체는 가장 일반적으로 Smad 시그널링 경로를 사용하여 [25]신호를 추적한다.Type 2 수용체는 R-Smads(Smad-1, Smad-5, Smad-8)의 인산화를 포함하는 Type 1 수용체를 활성화하는 역할을 한다.인산화 시, 공통 파트너인 Smad(co-Smad)와 함께 R-SMAD 복합체의 형성은 핵으로 이동하는 곳에서 일어난다.이 신호 경로는 도르소모르핀으로 알려진 작은 분자 억제제에 의해 조절되어 R-스마드의 [25]다운스트림 효과를 막습니다.
맵인산화효소(MAPK) 시그널링 경로
미토겐활성단백질키나아제(MAPK)는 MAPKK와 MAPKK가 인산화 및 활성화되어 세포내 반응을 유도하는 MAPK를 [26]인산화 및 활성화하는 신호 캐스케이드를 통해 인산화 과정을 거친다.MAPKKK의 활성화는 주로 GTPase 또는 다른 단백질 키나아제 그룹의 상호작용을 통해 이루어진다.TGF-β 수용체는 ERK, JNK 및 p38의 [26]MAPK 신호 경로를 유도한다.BMP4는 ERK, JNK 및 p38 MAPK 시그널링 패스를 활성화하는 것으로 알려져 있습니다만, Smad [27]시그널링 패스와는 독립적으로 동작하는 것이 판명되어 대부분이 Smad와 함께 액티브합니다.ERK 및 JNK 경로의 활성화는 Smad를 인산화하여 활성화를 조절하는 작용을 한다.이와 더불어 MAPK 경로는 두 신호 경로의 수렴을 유도하는 JNK 또는 p38 기질을 통해 Smad-interacting 전사인자에 직접 영향을 미칠 수 있다.이러한 수렴은 주로 협력적인 행동으로 구성되지만, 때때로 서로 상쇄할 수 있다는 증거가 있습니다.게다가 이러한 신호 경로의 직접 활성화 사이에 존재하는 균형은 TGF-β 유도 세포 반응에 [27]유의한 영향을 미친다.
임상적 의의
BMP4의 발현 증가는 유전성 질환인 Fibrodysplasia Osificans [28]Progressiva를 포함한 다양한 골질환과 관련이 있다.
골형성단백질 4(BMP4) 유전자의 돌연변이가 구순열과 [29]입천장의 병리 형성에 관련될 수 있다는 것을 분열을 수반하는 후보 유전자의 염기서열 분석 연구로부터 강력한 증거가 있다.
눈의 발달
눈은 유기체, 특히 육지 척추동물이 먹이와 장애물을 관찰하는데 필수적입니다; 이것은 그들의 생존에 매우 중요합니다.눈의 형성은 신경외배엽에서 유래한 시신경이나 수정체로부터 시작된다.뼈 형태 유발 단백질은 눈의 수정체 형성을 촉진하는 것으로 알려져 있다.눈의 초기 발달 동안, 시신경 소포의 형성은 시신경 소포에서 강하게 발현되고 주변 간엽과 표면 외배엽에서 약하게 발현되는 마우스와 BMP4에서 필수적이다.광학 소포의 BMP4 농도 구배는 렌즈 유도에 매우 중요합니다.연구원, 후루타 박사와 닥터.호건은 쥐 배아에 레이저 돌연변이를 일으켜 BMP4 호모 접합성 눌 돌연변이를 일으킨다면 이 배아는 수정체가 발달하지 않을 것이라는 것을 알아냈다.그들은 또한 녹색을 나타내는 BMP4 유전자와 수정체 형성에 관여한다고 생각되는 빨간색의 Sox2 유전자의 현장 교배도 실시했다.쥐 배아에서 이 두 가지 교배를 한 후, 그들은 녹색과 빨간색 모두 쥐 배아의 시신경 소포에서 발견된다는 것을 발견했다.이는 BMP4와 Sox2가 광학소포의 적시에 적소에 발현되어 렌즈유도에 필수적인 기능을 가지고 있음을 증명한다.또한 BMP4 균질 돌연변이 배아에 BMP4를 주입함으로써 수정체 형성을 구하는 추적 실험을 실시했다(12).이는 렌즈 형성에 BMP4가 반드시 필요하다는 것을 의미한다.하지만, 연구원들은 또한 변이된 쥐들 중 일부는 구조될 수 없다는 것을 발견했다.그들은 나중에 그 돌연변이들이 BMP4에 의해 활성화되는 Msx2가 부족하다는 것을 발견했다.이들은 BMP4가 광학소포에서 Msx2를 활성화하고 BMP4와 Msx2의 농도 조합을 활성화 Sox2와 함께 활성화하며 Sox2는 렌즈 [30]분화에 필수적이라고 예측했다.
생쥐의 렌즈 섬유 세포에 노긴을 주입하면 세포 내의 BMP4 단백질이 현저하게 감소합니다.이는 노긴이 BMP4 생산을 억제하기에 충분하다는 것을 의미한다.또한, 또 다른 억제 단백질인 Alk6가 BMP4가 Msx2의 활성화를 막아 수정체 [31]분화를 막는 것으로 밝혀졌다.그러나 BMP4의 억제 메커니즘과 Sox2의 하류 조절에 대해서는 아직 알려지지 않은 것이 많다.미래에는, 연구원들이 눈 전체의 발달 경로를 더 완벽하게 알아내는 것을 목표로 하고 있으며, 언젠가는 유전적으로 유발되는 눈병을 치료할 수 있는 방법을 찾을 수 있기를 바라고 있다.
탈모
탈모 또는 탈모증은 모낭 형태와 [32]모낭 순환이 비정상적으로 변화함에 따라 발생한다.모낭의 주기는 성장, 즉 아나겐, 퇴행 또는 카테겐, 그리고 휴식과 [33]텔로겐이다.포유류에서 상호상피와 중간엽 상호작용은 털의 발달을 조절한다.BMP4 및 BMP2와 같은 유전자는 모두 모공의 전구체 내에서 활성화된다.특히 BMP4는 피부 유두에서 발견된다.BMP4는 모발의 발달을 제어하는 신호 네트워크의 일부입니다.생화학 경로의 유도 및 아나겐 모낭의 모공 분화를 조절하기 위한 시그널링에 필요하다.이것은 모발 분화를 조절하는 전사 인자의 발현을 조절함으로써 이루어집니다.그러나 BMP가 유전자 네트워크 내에서 어디에 작용하는지 아직 불분명하다.bmp4의 시그널링은 케라틴 등의 말단 분자의 발현을 잠재적으로 제어할 수 있습니다.다른 규제 기관들도 모낭 발달을 조절하는 것으로 나타났다.HOXC13과 FOXN1은 기능 상실 실험으로 모낭 [34]형성에 방해가 되지 않는 손상된 모공 분화가 나타나기 때문에 중요한 조절제로 여겨진다.
BMP4가 외부광학적으로 발현되면 모낭 외근피복(ORS) 내에서는 세포매트릭스의 증식이 억제된다.BMP4는 또한 모공의 분화에 BMP4가 중요하다는 점에 주목하여 모공 케라틴 유전자 발현을 활성화한다.BMP4의 인히비터인 노긴은 모근의 매트릭스 세포 내에서 발견됩니다.머리카락의 발달에서 고려해야 할 다른 중요한 요소는 Shh(음속 고슴도치),[35] BMP7, BMP2, WNT, β-catenin의 발현이다.
BMP4를 억제하거나 BMP4와 상호작용할 수 있는 다른 유전자는 노긴, 폴리스타틴, 그렘린이며, 이것은 모두 발달하는 [36]모낭에서 발현된다.노긴이 결핍된 생쥐에서는 일반 생쥐보다 모낭이 적고 모낭의 발육이 억제된다.병아리 배아에서 외부 발현된 노긴이 확대된 모낭을 생성하는 것으로 나타났으며, BMP4 [22]시그널링은 인근 세포에서 억제된 플래코드 운명을 보여준다.노긴은 또한 산후 [37]피부의 모발 성장을 유도하기 위해 생체내 실험 중에 나타났다.
BMP4는 아나겐 모낭 내에서 모공 분화를 조절하는 생물학적 경로의 중요한 구성요소이다.발현된 BMP4의 가장 강한 수치는 수질, 모공 세포, 원위 모공 매트릭스 및 큐티클의 잠재적 전구체 내에서 발견됩니다.BMP4가 모발의 발현을 억제하는 두 가지 주요 방법은 모발 매트릭스의 성장인자 발현 제한과 성장과 [35]분화 시그널링 사이의 길항작용이다.
모낭 형성과 모발 성장을 조절하는 경로는 탈모 상태에 대한 치료 방법을 개발하는 데 핵심적입니다.이러한 조건에는 새로운 모낭의 발달, 기존 모낭의 특징의 변화, 기존 모낭의 모발 성장 변화가 포함된다.또한 BMP4 및 BMP4가 작용하는 경로는 [33]탈모 예방을 위한 치료 목표를 제공할 수 있다.
레퍼런스
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000021835 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ van den Wijngaard A, Weghuis DO, Boersma CJ, van Zoelen EJ, Geurts van Kessel A, Olijve W (November 1995). "Fine mapping of the human bone morphogenetic protein-4 gene (BMP4) to chromosome 14q22-q23 by in situ hybridization". Genomics. 27 (3): 559–60. doi:10.1006/geno.1995.1096. hdl:2066/22049. PMID 7558046.
- ^ Oida S, Iimura T, Maruoka Y, Takeda K, Sasaki S (November 1995). "Cloning and sequence of bone morphogenetic protein 4 (BMP-4) from a human placental cDNA library". DNA Seq. 5 (5): 273–5. doi:10.3109/10425179509030980. PMID 7579580.
- ^ Knöchel S, Dillinger K, Köster M, Knöchel W (November 2001). "Structure and expression of Xenopus tropicalis BMP-2 and BMP-4 genes". Mech. Dev. 109 (1): 79–82. doi:10.1016/S0925-4773(01)00506-8. PMID 11677055. S2CID 792305.
- ^ Graham et al., 1994
- ^ Mira H, Andreu Z, Suh H, Lie DC, Jessberger S, Consiglio A, San Emeterio J, Hortigüela R, Marqués-Torrejón MA, Nakashima K, Colak D, Götz M, Fariñas I, Gage FH (2010). "Signaling through BMPR-IA regulates quiescence and long-term activity of neural stem cells in the adult hippocampus". Cell Stem Cell. 7 (1): 78–89. doi:10.1016/j.stem.2010.04.016. PMID 20621052.
- ^ Colak D, Mori T, Brill MS, Pfeifer A, Falk S, Deng C, Monteiro R, Mummery C, Sommer L, Götz M (2008). "Adult neurogenesis requires Smad4-mediated bone morphogenic protein signaling in stem cells". The Journal of Neuroscience. 28 (2): 434–446. doi:10.1523/JNEUROSCI.4374-07.2008. PMC 6670509. PMID 18184786.
- ^ a b Farioli-Vecchioli S, Ceccarelli M, Saraulli D, Micheli L, Cannas S, D'Alessandro F, Scardigli R, Leonardi L, Cinà I, Costanzi M, Mattera A, Cestari V, Tirone F (2014). "Tis21 is required for adult neurogenesis in the subventricular zone and for olfactory behavior regulating cyclins, BMP4, Hes1/5 and Ids". Front Cell Neurosci. 8: 98. doi:10.3389/fncel.2014.00098. PMC 3977348. PMID 24744701.
- ^ a b Nilsson EE, Skinner MK (October 2003). "Bone morphogenetic protein-4 acts as an ovarian follicle survival factor and promotes primordial follicle development". Biol. Reprod. 69 (4): 1265–72. doi:10.1095/biolreprod.103.018671. PMID 12801979. S2CID 2141586.
- ^ Arteaga-Solis E, Gayraud B, Lee SY, Shum L, Sakai L, Ramirez F (July 2001). "Regulation of limb patterning by extracellular microfibrils". J. Cell Biol. 154 (2): 275–81. doi:10.1083/jcb.200105046. PMC 2150751. PMID 11470817.
- ^ a b Blázquez-Medela AM, Jumabay M, Boström KI (May 2019). "Beyond the bone: Bone morphogenetic protein signaling in adipose tissue". Obesity Reviews. 20 (5): 648–658. doi:10.1111/obr.12822. PMC 6447448. PMID 30609449.
- ^ Miyazaki Y, Oshima K, Fogo A, Ichikawa I (March 2003). "Evidence that bone morphogenetic protein 4 has multiple biological functions during kidney and urinary tract development". Kidney Int. 63 (3): 835–44. doi:10.1046/j.1523-1755.2003.00834.x. PMID 12631064.
- ^ Hemmati-Brivanlou A, Thomsen GH (1995). "Ventral mesodermal patterning in Xenopus embryos: expression patterns and activities of BMP-2 and BMP-4". Dev. Genet. 17 (1): 78–89. doi:10.1002/dvg.1020170109. PMID 7554498.
- ^ Selleck MA, García-Castro MI, Artinger KB, Bronner-Fraser M (December 1998). "Effects of Shh and Noggin on neural crest formation demonstrate that BMP is required in the neural tube but not ectoderm". Development. 125 (24): 4919–30. doi:10.1242/dev.125.24.4919. PMID 9811576.
- ^ Lee TJ, Jang J, Kang S, Jin M, Shin H, Kim DW, Kim BS (January 2013). "Enhancement of osteogenic and chondrogenic differentiation of human embryonic stem cells by mesodermal lineage induction with BMP-4 and FGF2 treatment". Biochem. Biophys. Res. Commun. 430 (2): 793–7. doi:10.1016/j.bbrc.2012.11.067. PMID 23206696.
- ^ Kurmann AA, Serra M, Hawkins F, Rankin SA, Mori M, Astapova I, Ullas S, Lin S, Bilodeau M, Rossant J, Jean JC, Ikonomou L, Deterding RR, Shannon JM, Zorn AM, Hollenberg AN, Kotton DN (November 2015). "Regeneration of Thyroid Function by Transplantation of Differentiated Pluripotent Stem Cells". Cell Stem Cell. 17 (5): 527–42. doi:10.1016/j.stem.2015.09.004. PMC 4666682. PMID 26593959.
- ^ Watanabe Y, Le Douarin NM (June 1996). "A role for BMP-4 in the development of subcutaneous cartilage". Mech. Dev. 57 (1): 69–78. doi:10.1016/0925-4773(96)00534-5. PMID 8817454. S2CID 16858412.
- ^ Abzhanov A, Protas M, Grant BR, Grant PR, Tabin CJ (September 2004). "Bmp4 and morphological variation of beaks in Darwin's finches". Science. 305 (5689): 1462–5. Bibcode:2004Sci...305.1462A. doi:10.1126/science.1098095. PMID 15353802. S2CID 17226774.
- ^ Aono A, Hazama M, Notoya K, Taketomi S, Yamasaki H, Tsukuda R, Sasaki S, Fujisawa Y (May 1995). "Potent ectopic bone-inducing activity of bone morphogenetic protein-4/7 heterodimer". Biochem. Biophys. Res. Commun. 210 (3): 670–7. doi:10.1006/bbrc.1995.1712. PMID 7763240.
- ^ a b Botchkarev VA, Botchkareva NV, Roth W, Nakamura M, Chen LH, Herzog W, Lindner G, McMahon JA, Peters C, Lauster R, McMahon AP, Paus R (July 1999). "Noggin is a mesenchymally derived stimulator of hair-follicle induction". Nat. Cell Biol. 1 (3): 158–64. doi:10.1038/11078. PMID 10559902. S2CID 8777441.
- ^ Metz A, Knöchel S, Büchler P, Köster M, Knöchel W (June 1998). "Structural and functional analysis of the BMP-4 promoter in early embryos of Xenopus laevis". Mech. Dev. 74 (1–2): 29–39. doi:10.1016/S0925-4773(98)00059-8. PMID 9651472. S2CID 14496024.
- ^ "Entrez Gene: BMP4 bone morphogenetic protein 4".
- ^ a b c d Miyazono K, Kamiya Y, Morikawa M (January 2010). "Bone morphogenetic protein receptors and signal transduction". J. Biochem. 147 (1): 35–51. doi:10.1093/jb/mvp148. PMID 19762341.
- ^ a b Cell Signaling Technology, Inc. "Mitogen-Activated Protein Kinase Cascades". Retrieved 17 November 2012.
- ^ a b Derynck R, Zhang YE (October 2003). "Smad-dependent and Smad-independent pathways in TGF-beta family signaling". Nature. 425 (6958): 577–84. Bibcode:2003Natur.425..577D. doi:10.1038/nature02006. PMID 14534577. S2CID 4419607.
- ^ Kan L, Hu M, Gomes WA, Kessler JA (October 2004). "Transgenic Mice Overexpressing BMP4 Develop a Fibrodysplasia Ossificans Progressiva (FOP)-Like Phenotype". Am. J. Pathol. 165 (4): 1107–15. doi:10.1016/S0002-9440(10)63372-X. PMC 1618644. PMID 15466378.
- ^ Dixon MJ, Marazita ML, Beaty TH, Murray JC (March 2011). "Cleft lip and palate: understanding genetic and environmental influences". Nat. Rev. Genet. 12 (3): 167–78. doi:10.1038/nrg2933. PMC 3086810. PMID 21331089.
- ^ Furuta Y, Hogan BL (December 1998). "BMP4 is essential for lens induction in the mouse embryo". Genes Dev. 12 (23): 3764–75. doi:10.1101/gad.12.23.3764. PMC 317259. PMID 9851982.
- ^ Faber SC, Robinson ML, Makarenkova HP, Lang RA (August 2002). "Bmp signaling is required for development of primary lens fiber cells". Development. 129 (15): 3727–37. doi:10.1242/dev.129.15.3727. PMID 12117821.
- ^ Cotsarelis G, Millar SE (July 2001). "Towards a molecular understanding of hair loss and its treatment". Trends Mol Med. 7 (7): 293–301. doi:10.1016/S1471-4914(01)02027-5. PMID 11425637.
- ^ a b Millar SE (February 2002). "Molecular mechanisms regulating hair follicle development". J. Invest. Dermatol. 118 (2): 216–25. doi:10.1046/j.0022-202x.2001.01670.x. PMID 11841536.
- ^ Kulessa H, Turk G, Hogan BL (December 2000). "Inhibition of Bmp signaling affects growth and differentiation in the anagen hair follicle". EMBO J. 19 (24): 6664–74. doi:10.1093/emboj/19.24.6664. PMC 305899. PMID 11118201.
- ^ a b Huelsken J, Vogel R, Erdmann B, Cotsarelis G, Birchmeier W (May 2001). "beta-Catenin controls hair follicle morphogenesis and stem cell differentiation in the skin". Cell. 105 (4): 533–45. doi:10.1016/S0092-8674(01)00336-1. PMID 11371349. S2CID 16775006.
- ^ Feijen A, Goumans MJ, van den Eijnden-van Raaij AJ (December 1994). "Expression of activin subunits, activin receptors and follistatin in postimplantation mouse embryos suggests specific developmental functions for different activins". Development. 120 (12): 3621–37. doi:10.1242/dev.120.12.3621. PMID 7821227.
- ^ Botchkarev VA, Botchkareva NV, Nakamura M, Huber O, Funa K, Lauster R, Paus R, Gilchrest BA (October 2001). "Noggin is required for induction of the hair follicle growth phase in postnatal skin". FASEB J. 15 (12): 2205–14. doi:10.1096/fj.01-0207com. PMID 11641247. S2CID 10236217.
추가 정보
- Wozney JM, Rosen V, Celeste AJ, Mitsock LM, Whitters MJ, Kriz RW, Hewick RM, Wang EA (1989). "Novel regulators of bone formation: molecular clones and activities". Science. 242 (4885): 1528–34. doi:10.1126/science.3201241. PMID 3201241.
- Rosenzweig BL, Imamura T, Okadome T, Cox GN, Yamashita H, ten Dijke P, Heldin CH, Miyazono K (1995). "Cloning and characterization of a human type II receptor for bone morphogenetic proteins". Proc. Natl. Acad. Sci. U.S.A. 92 (17): 7632–6. Bibcode:1995PNAS...92.7632R. doi:10.1073/pnas.92.17.7632. PMC 41199. PMID 7644468.
- Nohno T, Ishikawa T, Saito T, Hosokawa K, Noji S, Wolsing DH, Rosenbaum JS (1995). "Identification of a human type II receptor for bone morphogenetic protein-4 that forms differential heteromeric complexes with bone morphogenetic protein type I receptors". J. Biol. Chem. 270 (38): 22522–6. doi:10.1074/jbc.270.38.22522. PMID 7673243.
- Yamaji N, Celeste AJ, Thies RS, Song JJ, Bernier SM, Goltzman D, Lyons KM, Nove J, Rosen V, Wozney JM (1995). "A mammalian serine/threonine kinase receptor specifically binds BMP-2 and BMP-4". Biochem. Biophys. Res. Commun. 205 (3): 1944–51. doi:10.1006/bbrc.1994.2898. PMID 7811286.
- Harris SE, Harris MA, Mahy P, Wozney J, Feng JQ, Mundy GR (1994). "Expression of bone morphogenetic protein messenger RNAs by normal rat and human prostate and prostate cancer cells". Prostate. 24 (4): 204–11. doi:10.1002/pros.2990240406. PMID 8146069. S2CID 21276656.
- van den Wijngaard A, van Kraay M, van Zoelen EJ, Olijve W, Boersma CJ (1996). "Genomic organization of the human bone morphogenetic protein-4 gene: molecular basis for multiple transcripts". Biochem. Biophys. Res. Commun. 219 (3): 789–94. doi:10.1006/bbrc.1996.0312. hdl:2066/23948. PMID 8645259.
- Nishitoh H, Ichijo H, Kimura M, Matsumoto T, Makishima F, Yamaguchi A, Yamashita H, Enomoto S, Miyazono K (1996). "Identification of type I and type II serine/threonine kinase receptors for growth/differentiation factor-5". J. Biol. Chem. 271 (35): 21345–52. doi:10.1074/jbc.271.35.21345. PMID 8702914.
- Bonaldo MF, Lennon G, Soares MB (1997). "Normalization and subtraction: two approaches to facilitate gene discovery". Genome Res. 6 (9): 791–806. doi:10.1101/gr.6.9.791. PMID 8889548.
- Shore EM, Xu M, Shah PB, Janoff HB, Hahn GV, Deardorff MA, Sovinsky L, Spinner NB, Zasloff MA, Wozney JM, Kaplan FS (1998). "The human bone morphogenetic protein 4 (BMP-4) gene: molecular structure and transcriptional regulation". Calcif. Tissue Int. 63 (3): 221–9. doi:10.1007/s002239900518. PMID 9701626. S2CID 8339465.
- Tucker AS, Matthews KL, Sharpe PT (1998). "Transformation of tooth type induced by inhibition of BMP signaling". Science. 282 (5391): 1136–8. Bibcode:1998Sci...282.1136T. doi:10.1126/science.282.5391.1136. PMID 9804553.
- Van den Wijngaard A, Pijpers MA, Joosten PH, Roelofs JM, Van zoelen EJ, Olijve W (1999). "Functional characterization of two promoters in the human bone morphogenetic protein-4 gene". J. Bone Miner. Res. 14 (8): 1432–41. doi:10.1359/jbmr.1999.14.8.1432. PMID 10457277.
- Li W, LoTurco JJ (2000). "Noggin is a negative regulator of neuronal differentiation in developing neocortex". Dev. Neurosci. 22 (1–2): 68–73. doi:10.1159/000017428. PMID 10657699. S2CID 35547875.
- Raatikainen-Ahokas A, Hytönen M, Tenhunen A, Sainio K, Sariola H (2000). "BMP-4 affects the differentiation of metanephric mesenchyme and reveals an early anterior-posterior axis of the embryonic kidney". Dev. Dyn. 217 (2): 146–58. doi:10.1002/(SICI)1097-0177(200002)217:2<146::AID-DVDY2>3.0.CO;2-I. PMID 10706139.
- van den Wijngaard A, Mulder WR, Dijkema R, Boersma CJ, Mosselman S, van Zoelen EJ, Olijve W (2000). "Antiestrogens specifically up-regulate bone morphogenetic protein-4 promoter activity in human osteoblastic cells". Mol. Endocrinol. 14 (5): 623–33. doi:10.1210/mend.14.5.0463. PMID 10809227.
- Ying Y, Liu XM, Marble A, Lawson KA, Zhao GQ (2000). "Requirement of Bmp8b for the generation of primordial germ cells in the mouse". Mol. Endocrinol. 14 (7): 1053–63. doi:10.1210/mend.14.7.0479. PMID 10894154.
- Nakade O, Takahashi K, Takuma T, Aoki T, Kaku T (2001). "Effect of extracellular calcium on the gene expression of bone morphogenetic protein-2 and -4 of normal human bone cells". J. Bone Miner. Metab. 19 (1): 13–9. doi:10.1007/s007740170055. PMID 11156467. S2CID 23873280.
- Hatta T, Konishi H, Katoh E, Natsume T, Ueno N, Kobayashi Y, Yamazaki T (2001). "Identification of the ligand-binding site of the BMP type IA receptor for BMP-4". Biopolymers. 55 (5): 399–406. doi:10.1002/1097-0282(2000)55:5<399::AID-BIP1014>3.0.CO;2-9. PMID 11241215.
- Aoki H, Fujii M, Imamura T, Yagi K, Takehara K, Kato M, Miyazono K (2001). "Synergistic effects of different bone morphogenetic protein type I receptors on alkaline phosphatase induction". J. Cell Sci. 114 (Pt 8): 1483–9. doi:10.1242/jcs.114.8.1483. PMID 11282024.
- Kalinovsky A, Boukhtouche F, Blazeski R, Bornmann C, Suzuki N, Mason CA, Scheiffele P (2011). Polleux F (ed.). "Development of Axon-Target Specificity of Ponto-Cerebellar Afferents". PLOS Biology. 9 (2): e1001013. doi:10.1371/journal.pbio.1001013. PMC 3035609. PMID 21346800.
- Cotsarelis G, Millar SE (July 2001). "Towards a molecular understanding of hair loss and its treatment". Trends Mol Med. 7 (7): 293–301. doi:10.1016/S1471-4914(01)02027-5. PMID 11425637.
- Feijen A, Goumans MJ, van den Eijnden-van Raaij AJ (December 1994). "Expression of activin subunits, activin receptors and follistatin in postimplantation mouse embryos suggests specific developmental functions for different activins". Development. 120 (12): 3621–37. doi:10.1242/dev.120.12.3621. PMID 7821227.
- Graham A, Francis-West P, Brickell P, Lumsden A (December 1994). "The signalling molecule BMP4 mediates apoptosis in the rhombencephalic neural crest". Nature. 372 (6507): 684–6. Bibcode:1994Natur.372..684G. doi:10.1038/372684a0. PMID 7990961. S2CID 4361935.
- Huelsken J, Vogel R, Erdmann B, Cotsarelis G, Birchmeier W (May 2001). "beta-Catenin controls hair follicle morphogenesis and stem cell differentiation in the skin". Cell. 105 (4): 533–45. doi:10.1016/S0092-8674(01)00336-1. PMID 11371349. S2CID 16775006.
- Kulessa H, Turk G, Hogan BL (December 2000). "Inhibition of Bmp signaling affects growth and differentiation in the anagen hair follicle". EMBO J. 19 (24): 6664–74. doi:10.1093/emboj/19.24.6664. PMC 305899. PMID 11118201.
- Leong LM, Brickell PM (December 1996). "Bone morphogenic protein-4". Int. J. Biochem. Cell Biol. 28 (12): 1293–6. doi:10.1016/S1357-2725(96)00075-1. PMID 9022288.
- Liem KF, Tremml G, Roelink H, Jessell TM (September 1995). "Dorsal differentiation of neural plate cells induced by BMP-mediated signals from epidermal ectoderm". Cell. 82 (6): 969–79. doi:10.1016/0092-8674(95)90276-7. PMID 7553857. S2CID 17106597.
- Millar SE (February 2002). "Molecular mechanisms regulating hair follicle development". J. Invest. Dermatol. 118 (2): 216–25. doi:10.1046/j.0022-202x.2001.01670.x. PMID 11841536.
- Pourquié O, Fan CM, Coltey M, Hirsinger E, Watanabe Y, Bréant C, Francis-West P, Brickell P, Tessier-Lavigne M, Le Douarin NM (February 1996). "Lateral and axial signals involved in avian somite patterning: a role for BMP4". Cell. 84 (3): 461–71. doi:10.1016/S0092-8674(00)81291-X. PMID 8608600. S2CID 15824329.
- Wang EA, Israel DI, Kelly S, Luxenberg DP (1993). "Bone morphogenetic protein-2 causes commitment and differentiation in C3H10T1/2 and 3T3 cells". Growth Factors. 9 (1): 57–71. doi:10.3109/08977199308991582. PMID 8347351.
- Winnier G, Blessing M, Labosky PA, Hogan BL (September 1995). "Bone morphogenetic protein-4 is required for mesoderm formation and patterning in the mouse". Genes Dev. 9 (17): 2105–16. doi:10.1101/gad.9.17.2105. PMID 7657163.
외부 링크
- BMPedia - 골형성 단백질 위키[영구 데드링크]
- UCSC Genome Browser에서의 BMP4 인간 유전자 위치.
- UCSC Genome Browser의 BMP4 인간 유전자 상세.