Wee1
Wee1| Wee1 | |||||||
|---|---|---|---|---|---|---|---|
 인간 Wee1의 결정구조 | |||||||
| 식별자 | |||||||
| 기호 | 유사분해억제단백질키나아제 Wee1 | ||||||
| Alt. 기호 | Wee1 이중 특이성 단백질 키나아제 Wee1 | ||||||
| 엔씨비유전자 | 2539123 | ||||||
| 유니프로트 | P07527 | ||||||
| 기타자료 | |||||||
| EC 번호 | 2.7.11.1 | ||||||
| |||||||
Wee1은 핵분열 효모인 정신분열효모체 퐁베(S. 퐁베)에 속하는 단백질 키나제 세르/트르 계열에 속하는 핵키나제다.Wee1은 96 kDa의 분자 질량을 가지며, 세포 주기 진행의 핵심 조절기다.그것은 Cdk1 억제를 통해 유사분열로의 진입을 억제함으로써 세포크기에 영향을 미친다.Wee1은 포유류를 포함한 많은 다른 유기체에서 동음이의어를 가지고 있다.
소개
셀 크기 규제는 셀의 기능을 보장하기 위해 매우 중요하다.영양소, 성장인자, 기능부하 등의 환경적 요인 외에도 세포크기도 세포크기 체크포인트에 의해 제어된다.
Wee1은 이 검문소의 구성요소다.그것은 유사분열로 들어가는 시점을 결정하는 키나아제로서, 따라서 딸세포의 크기에 영향을 미친다.Wee1 기능의 상실은 세포분열이 너무 일찍 일어나기 때문에 일반 딸세포보다 작게 생성될 것이다.
그것의 이름은 스코틀랜드의 방언 단어 wee에서 유래되었는데, 이것은 작다는 것을 의미한다 - 그것의 발견자 폴 간호사는 발견 당시 스코틀랜드의 에든버러 대학에서 일하고 있었다.[1][2]
함수
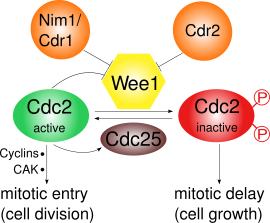
Wee1은 Cdk1을 Tyr15와 Thr14라는 두 개의 서로 다른 사이트에서 인산화하여 억제한다.[3]Cdk1은 다양한 셀 사이클 체크포인트의 사이클에 의존하는 통로에 매우 중요하다.Wee1에 의한 Cdk1 억제가 중요한 체크포인트가 적어도 3개 존재한다.
- G2/M 체크포인트:Wee1 인산염은 Cdk1의 아미노산 Tyr15와 Thr14를 생성하여 Cdk1의 키나아제 활성을 낮게 유지하고 유사분열로 진입하지 못하게 한다; S. 퐁베에서는 세포 성장이 더 일어날 수 있다.Wee1 매개 Cdk1 활성화는 기판 경쟁의 결과 매우 민감하다는 것이 밝혀졌다.[4]유사분열체 진입 중 We1의 활성도는 여러 규제자에 의해 감소되고 따라서 Cdk1 활동이 증가한다.S. Pombe에서는 단백질 키나제인 Pom1이 세포 극지방에 위치한다.이것은 Cdr2가 We1에서 Cdr1까지 억제하는 경로를 활성화한다.Cdk1 자체는 인산화 작용에 의해 We1을 부정적으로 조절하며, 이는 양성 피드백 루프로 이어진다.감소된 Wee1 활동만으로는 유사체 진입에 충분하지 않다: 사이클린의 합성 및 CAK(Cdk 활성키나아제)에 의한 활성인산화도 필요하다.[5]
- 셀 크기 검사점:세포 크기 체크포인트의 존재에 대한 증거가 있는데, 이것은 작은 세포들이 유사분열로 들어가지 못하게 한다.Wee1은 세포 크기와 세포 주기 진행을 조정함으로써 이 체크포인트에서 역할을 한다.[6]
- DNA 손상 검사점:또한 이 체크포인트는 G2/M 전환을 제어한다.S. 퐁베에서 이 체크포인트는 DNA 손상이 있는 세포의 유사분열 입력을 지연시킨다(예를 들어 감마선에 의해 유도됨).G2 단계의 연장은 Wee1에 따라 달라진다. wee1 돌연변이는 감마선 조사 후 G2 단계가 길지 않다.[7]
Wee1 kinase의 후생유전 기능도 보고되었다.Wee1은 히스톤의 전지구적 발현을 조절하는 티로신 37 잔류물에서 인산염 히스톤 H2B에 보였다.[8][9]
호몰로지스
| 인간 WEE1 호몰로고(S. 퐁베) | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호 | WEE1 | ||||||
| 엔씨비유전자 | 7465 | ||||||
| HGNC | 12761 | ||||||
| 오밈 | 193525 | ||||||
| RefSeq | NM_003390 | ||||||
| 유니프로트 | P30291 | ||||||
| 기타자료 | |||||||
| 로커스 | 11번 씨 p15.3-15.1 | ||||||
| |||||||
| 인간 WEE1 호몰로고 2 (S. 퐁베) | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호 | WE2 | ||||||
| 엔씨비유전자 | 494551 | ||||||
| HGNC | 19684 | ||||||
| RefSeq | NM_001105558 | ||||||
| 유니프로트 | P0C1S8 | ||||||
| 기타자료 | |||||||
| 로커스 | 7번 씨 q32-q32 | ||||||
| |||||||
WE1 유전자는 인간에게 알려진 두 가지 동음이의어를 가지고 있다. WE1(WE1A라고도 함)과 WE2(WE1B)이다.해당 단백질은 인간 Cdk1 호몰로뉴 Cdk1에 작용하는 Wee1 유사 단백질 키나아제와 Wee1 유사 단백질 키나아제2이다.
싹이 트는 효모 사카로마이오스 세레비시아이에 있는 Wee1에 대한 호몰로그는 Swe1이라고 불린다.
규정
S. 퐁베에서 Wee1은 인산염이다.
Cdk1과 Cyclin B는 체세포 분열의 진입을 촉진하는 성숙 촉진 인자(MPF)를 구성한다.Wee1을 통한 인산화 작용에 의해 비활성화되고 인산염 Cdc25C에 의해 활성화된다.차례로 Cdc25C는 폴로키나아제에 의해 활성화되고 Chk1에 의해 비활성화된다.[6]따라서 S. 퐁베 Wee1 규제는 주로 극성 키나제, Pom1의 경로, Cdr2와 Cdr1을 통한 인산염의 지배하에 있다.[10][11][12][13]
G2/M 전환에서 Cdk1은 Tyr15의 탈인산화를 통해 Cdc25에 의해 활성화된다.동시에 Wee1은 Nim1/Cdr1에 의해 C-단자 촉매영역에서 인산화를 통해 비활성화된다.[12]또한, 액티브 MPF는 Cdc25를 활성화하고 Wee1을 비활성화함으로써, 비록 이것이 아직 상세하게 이해되지는 않았지만 긍정적인 피드백 루프를 만들어냄으로써 자체적인 활동을 촉진할 것이다.[6]
고농축 진핵생물은 인산화 및 열화를 통해 We1을 조절한다.
높은 진핵생물에서 We1 비활성화는 인산화 및 분해에 의해 발생한다.[14]단백질 복합SCF는[nb 1]β-TrCP1/2 Wee1A의 편재에서 기능하는 E3 편재성 리기아제다.M상 키나아제는 Polo 유사키나아제(Plk1)와 Cdc2 인산화 세린 잔류물 2개를 Wee1A에서 SCF가β-TrCP1/2 인식한다.[15]
S. cerebisiae homologue Swe1
S. 세레비시아에서 사이클린 의존성 키나제 Cdc28(Cdk1 호몰로뉴)은 Swe1(We1 호몰로뉴)에 의해 인산염, Mih1(Cdc25 호몰로뉴)에 의해 탈인산화된다.Nim1/Cdr1 Hsl1의 S. cerebisiae에 있는 Nim1/Cdr1 homologue와 그 관련 키나시스 Gin4, Kcc4와 함께 Swe1을 싹목까지 현지화시킨다.키나아제 Cla4와 Cdc5(폴로키나제 호몰로뉴) 인산염 Swe1을 세포 주기의 다른 단계에서 연관시키는 버드넥.Swe1은 또한 Clb2-Cdc28에 의해 인산염화되는데, 이는 Cdc5에 의한 추가 인산염의 인식 역할을 한다.
S. 세레비시아 단백질 Swe1도 분해에 의해 조절된다.Swe1은 Clb2-Cdc28과 Cdc5에 의해 하이퍼인산화되며, 이는 상위 진핵생물에서와 같이 SCF E3 유비쿼시틴 리게아제 복합체에 의한 편재 및 저하의 신호일 수 있다.[16]
암에서의 역할
또한 유사분열 촉진 인자 MPF는 DNA 손상 유발 사멸을 조절한다.WEE1에 의한 MPF의 부정적인 규제는 이상 유사분열을 유발하며, 따라서 DNA 손상 유발 사멸에 대한 저항성을 유발한다.Kruppel 유사 인자 2(KLF2)는 인간 WEE1을 부정적으로 조절하여 암세포의 DNA 손상 유발 사멸에 대한 민감도를 높인다.[17]
돌연변이 표현형
Wee1은 용량 의존적인 유사분열 억제제 역할을 한다.[18]따라서 Wee1 단백질의 양은 세포의 크기와 상관관계가 있다.
wee1이라고도− 불리는 핵분열 효모 돌연변이 wee1은 야생형 세포보다 훨씬 작은 세포 크기로 갈라진다.Wee1은 체세포 분열의 진입을 억제하기 때문에, 그것의 부재는 이른 단계에서 분열되고 정상 이하의 세포 크기로 이어질 것이다.반대로 Wee1의 발현이 증가하면 유사분열이 지연되고 세포가 큰 크기로 성장한 뒤 분열한다.
참고 항목
메모들
참조
- ^ Nurse P (December 2004). "Wee beasties". Nature. 432 (7017): 557. Bibcode:2004Natur.432..557N. doi:10.1038/432557a. PMID 15577889. S2CID 29840746.
- ^ Nurse P, Thuriaux P (November 1980). "Regulatory genes controlling mitosis in the fission yeast Schizosaccharomyces pombe". Genetics. 96 (3): 627–37. doi:10.1093/genetics/96.3.627. PMC 1214365. PMID 7262540.
- ^ Den Haese GJ, Walworth N, Carr AM, Gould KL (1995). "The Wee1 protein kinase regulates T14 phosphorylation of fission yeast Cdc2". Mol Biol Cell. 6 (4): 371–85. doi:10.1091/mbc.6.4.371. PMC 301198. PMID 7626804.
- ^ Kim, SY; Ferrell JE, Jr (23 March 2007). "Substrate competition as a source of ultrasensitivity in the inactivation of Wee1". Cell. 128 (6): 1133–45. doi:10.1016/j.cell.2007.01.039. PMID 17382882. S2CID 14138576.
- ^ Coleman TR, Dunphy WG (1994). "Cdc2 regulatory factors". Current Opinion in Cell Biology. 6 (6): 877–82. doi:10.1016/0955-0674(94)90060-4. PMID 7880537.
- ^ a b c Kellogg DR (2003). "Wee1-dependent mechanisms required for coordination of cell growth and cell division". J Cell Sci. 116 (24): 4883–90. doi:10.1242/jcs.00908. PMID 14625382.
- ^ Rowley R, Hudson J, Young PG (1992). "The wee1 protein kinase is required for radiation-induced mitotic delay". Nature. 356 (6367): 353–5. Bibcode:1992Natur.356..353R. doi:10.1038/356353a0. PMID 1549179. S2CID 4280074.
- ^ Mahajan K, Fang B, Koomen JM, Mahajan NP (2012). "H2B Tyr37 phosphorylation suppresses expression of replication-dependent core histone genes". Nature Structural & Molecular Biology. 19 (9): 930–7. doi:10.1038/nsmb.2356. PMC 4533924. PMID 22885324.
- ^ Mahajan K, Mahajan NP (2013). "WEE1 tyrosine kinase, a novel epigenetic modifier". Trends Genet. 29 (7): 394–402. doi:10.1016/j.tig.2013.02.003. PMC 3700603. PMID 23537585.
- ^ Boddy MN, Furnari B, Mondesert O, Russell P (May 1998). "Replication checkpoint enforced by kinases Cds1 and Chk1". Science. 280 (5365): 909–12. Bibcode:1998Sci...280..909B. doi:10.1126/science.280.5365.909. PMID 9572736.
- ^ Wu L, Russell P (June 1993). "Nim1 kinase promotes mitosis by inactivating Wee1 tyrosine kinase". Nature. 363 (6431): 738–41. Bibcode:1993Natur.363..738W. doi:10.1038/363738a0. PMID 8515818. S2CID 4320080.
- ^ a b Coleman TR, Tang Z, Dunphy WG (March 1993). "Negative regulation of the wee1 protein kinase by direct action of the nim1/cdr1 mitotic inducer". Cell. 72 (6): 919–29. doi:10.1016/0092-8674(93)90580-J. PMID 7681363. S2CID 42256641.
- ^ Tang Z, Coleman TR, Dunphy WG (September 1993). "Two distinct mechanisms for negative regulation of the Wee1 protein kinase". EMBO J. 12 (9): 3427–36. doi:10.1002/j.1460-2075.1993.tb06017.x. PMC 413619. PMID 7504624.
- ^ Watanabe N, Broome M, Hunter T (May 1995). "Regulation of the human WEE1Hu CDK tyrosine 15-kinase during the cell cycle". EMBO J. 14 (9): 1878–91. doi:10.1002/j.1460-2075.1995.tb07180.x. PMC 398287. PMID 7743995.
- ^ Watanabe N, Arai H, Nishihara Y, et al. (March 2004). "M-phase kinases induce phospho-dependent ubiquitination of somatic Wee1 by SCFbeta-TrCP". Proc. Natl. Acad. Sci. U.S.A. 101 (13): 4419–24. Bibcode:2004PNAS..101.4419W. doi:10.1073/pnas.0307700101. PMC 384762. PMID 15070733.
- ^ Lee KS, Asano S, Park JE, Sakchaisri K, Erikson RL (October 2005). "Monitoring the cell cycle by multi-kinase-dependent regulation of Swe1/Wee1 in budding yeast". Cell Cycle. 4 (10): 1346–9. doi:10.4161/cc.4.10.2049. PMID 16123596.
- ^ Wang F, Zhu Y, Huang Y, et al. (June 2005). "Transcriptional repression of WEE1 by Kruppel-like factor 2 is involved in DNA damage-induced apoptosis". Oncogene. 24 (24): 3875–85. doi:10.1038/sj.onc.1208546. PMID 15735666.
- ^ Russell P, Nurse P (May 1987). "Negative regulation of mitosis by wee1+, a gene encoding a protein kinase homolog". Cell. 49 (4): 559–67. doi:10.1016/0092-8674(87)90458-2. PMID 3032459. S2CID 42801276.