위관
Gastrulation| 위관 | |
|---|---|
 | |
| 식별자 | |
| MeSH | D054262 |
| 해부학 용어 | |
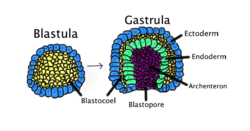
배란은 대부분의 동물의 초기 배아 발달 단계이며, 이 기간 동안 배반포(세포의 한 층의 속이 빈 구) 또는 포유류에서 배반포는 위관으로 알려진 다층 구조로 재구성됩니다.배란 전에, 배아는 연속적인 상피 세포 시트입니다; 배란이 끝날 때까지, 배아는 구별되는 세포 계통을 확립하고, 신체의 기본 축(예: 등-배측, 전-후방)을 설정하고, 예비 [1]내장을 포함한 하나 이상의 세포 유형을 내재화하기 위해 분화를 시작했습니다.
3배아성 유기체에서 위관은 삼엽충입니다.이 세 가지 세균 층은 외배엽(외배엽), 중배엽(중간층), 내배엽(내배엽)[2][3]입니다.크니다리아와 크테노포라와 같은 이배아성 유기체에서, 위관은 외배엽과 내배엽만 가지고 있습니다.두 개의 층은 때때로 하엽세포와 [4]상엽세포라고도 불립니다.해면은 위관 단계를 거치지 않기 때문에 모든 동물 중에서 기초적인 것입니다.
배란은 분열과 배반포, 즉 배반포의 형성 후에 일어납니다.개개의 기관이 새로 형성된 생식기 층 [5]내에서 발달할 때, 위 조절은 기관 형성에 의해 뒤따릅니다.각 층은 발달 중인 배아에서 특정 조직과 기관을 생성합니다.
- 외배엽은 척추동물의 [1]표피, 신경계, 그리고 신경관을 생성합니다.
- 내배엽은 소화기 계통과 호흡기 계통의 상피와 간과 [1]췌장과 같은 소화기 계통과 관련된 기관을 발생시킵니다.
- 중배엽은 근육, 뼈, 결합 조직과 같은 많은 세포 유형을 생성합니다.척추동물에서, 중배엽 유도체는 척삭, 심장, 혈관, 갈비뼈와 척추의 연골, 그리고 [1][6]진피를 포함합니다.
위 조절 후에, 신체의 세포들은 연결된 세포들의 시트로 조직되거나,[3][7] 중간 조직과 같은 고립된 세포들의 그물로 조직됩니다.
비록 배식 패턴이 동물계 전체에 걸쳐 엄청난 변화를 보이지만, 그것들은 배식 [1][8]중에 발생하는 다섯 가지 기본적인 세포 움직임에 의해 통일됩니다.
"가스트룰라"와 "가스트룰라"라는 용어는 에른스트 헤켈이 1872년 그의 저서 "칼슘 스폰지의 [9]생물학"에서 만들었습니다.그 분야의 선구적인 발달 생물학자인 루이스 울퍼트는 "태어나거나, 결혼하거나, 죽음이 아니라, 당신의 [1][10]인생에서 진정으로 가장 중요한 시기인 배란"에 주목한 공로를 인정받았습니다.
모델 시스템
배식은 동물계에 걸쳐 매우 다양하지만 근본적인 유사점이 있습니다.많은 동물들에서 개복식이 연구되었지만, 어떤 모델들은 다른 모델들보다 더 오랫동안 사용되었습니다.게다가, 어미 밖에서 발달하는 동물의 발달을 연구하는 것이 더 쉽습니다.가장 상세하게 위식도가 이해되는 모델 유기체에는 연체동물, 성게, 개구리, 그리고 닭이 포함됩니다.인간 모델 시스템은 위루로이드입니다.
프로토스톰 대 중수소 염색체
프로토스톰과 중수소 스톰의 구별은 입(스톰)이 배반포와 관련하여 발달하는 방향에 기초합니다.프로토스톰은 그리스어로 "첫 번째 입"을 의미하는 프로토스톰에서 유래한 반면, 듀테로스톰의 어원은 "두 번째 입"과 "두 번째 입"[citation needed]을 의미합니다.
중수소 염색체와 프로토스톰의 주요 차이점은 배아 발달에서 발견됩니다.
- 입/아누스
- 클리비지
성게
성게는 [11]19세기부터 발달 생물학에서 중요한 모델 생물이었습니다.그들의 위관은 종종 무척추동물 [12]중수소염의 원형으로 여겨집니다.컴퓨터 시뮬레이션과 함께 한 실험은 성게의 위관 형성에 대한 지식을 얻기 위해 사용되었습니다.최근의 시뮬레이션은 평면 세포 극성이 성게의 [13]위장을 촉진하기에 충분하다는 것을 발견했습니다.
세균층 측정
성게는 매우 정형화된 분열 패턴과 세포 운명을 보여줍니다.모체적으로 축적된 mRNA는 성게 배아의 조직 중심을 형성합니다.표준 Wnt 및 델타-노치 신호는 점진적으로 진행성 내배엽과 중배엽을 [14]분리합니다.
세포 내부화
성게에서 가장 먼저 내부화된 세포는 배반포 단계에서 침투하는 골격 형성 운명을 가진 1차 중간 조직 세포(PMC)입니다.잠재적 내배엽 및 비골격성 중배엽의 내부화인 위관 형성은 그 직후에 최종 대퇴골 길이에 약 30%를 기여하는 식물극 및 기타 세포 재배열과 함께 시작됩니다.내장의 최종 길이는 대퇴골 [15]내의 세포 재배치에 달려 있습니다.
양서류
개구리속 Xenopus는 위식도 [16]연구의 모델 유기체로 사용되어 왔습니다.
대칭 깨짐
정자는 첫 번째 분열을 완료하는 데 필요한 두 개의 유사분열 에스터 중 하나를 제공합니다.정자는 알의 동물의 절반 어디든 들어갈 수 있지만, 정확한 진입점은 세포골격을 구성함으로써 알의 방사상 대칭을 깨뜨릴 것입니다.첫 번째 분열 전에, 난자의 피질은 피질 회전으로 알려진 과정에서 미세소관의 조정된 작용에 의해 내부 세포질에 상대적으로 회전합니다.이 변위는 적도 세포질과 식물 피질에서 모체로 적재된 세포 운명의 결정체를 접촉하게 하고, 이 결정체들이 함께 조직을 구성합니다.따라서 정자 입구의 반대편에 있는 식물 쪽의 영역이 [17]조직자가 될 것입니다.Hans Spemann의 연구실에서 일하는 Hilde Mangold는 배아의 이 특별한 "조직자"가 위의 [18][19][20]순환을 유도하기에 필요하고 충분하다는 것을 증명했습니다.
세균층 측정
내배엽의 사양은 베타카테닌의 핵화로 이어지는 모체 퇴적 결정 인자의 재배열에 따라 달라집니다.중배엽은 추정 내배엽에서 [17]외배엽이 되는 세포로 신호를 보내 유도됩니다.
세포 내부화
배반포의 등쪽 입술은 위를 자극하는 기계적인 원동력입니다.개구리에게서 보이는 첫 번째 흡인의 징후는 [citation needed]등입술입니다.
셀 신호 전달
개구리 Xenopus에서, 그 신호들 중 하나는 [21]레티노산입니다.이 유기체의 RA 신호 전달은 내배엽의 형성에 영향을 미칠 수 있으며 신호 전달의 타이밍에 따라 췌장, 장 또는 호흡 중 어느 쪽인지 운명을 결정할 수 있습니다.Wnt 및 BMP와 같은 다른 신호는 세포 계통 추적기를 [21]활성화함으로써 Xenopus의 호흡 운명에 역할을 합니다.
양귀비속
개요
양막류(렙타일, 조류 및 포유류)에서, 위관행은 대퇴골로 들어가는 입구인 배반포의 생성을 포함합니다.배반포는 배반포 내 공간인 배반포로 들어가는 입구가 아니라 배반포의 기존 표면을 함께 밀어내는 새로운 인포켓을 나타냅니다.양막류에서, 위식도는 다음과 같은 순서로 발생합니다: (1) 배아가 비대칭이 되고, (2) 원시 가닥에서 상피 세포에서 중간엽으로 전이되고, (3) 원시 가닥에서 침입하여 생식 [6]층을 형성합니다.
대칭 깨짐
배자극을 준비하기 위해, 배아는 근위-원위 축과 후위 축 모두를 따라 비대칭이 되어야 합니다.근위-원위축은 배아의 세포가 "난자 실린더"를 형성할 때 형성되는데, 이것은 근위단에 태반과 같은 구조를 발생시키는 배아 외 조직으로 구성되어 있고 원위단에는 외배아 세포가 형성되어 있습니다.BMP, FGF, 노달 및 Wnt를 포함한 많은 신호 경로가 이러한 재구성에 기여합니다.내장 내배엽이 상피세포를 둘러싸고 있습니다.원위 내장 내배엽(DVE)은 배아의 전엽으로 이동하여 전엽 내장 내배엽(AVE)을 형성합니다.이것은 전후 대칭을 깨뜨리고 결절 [6]신호에 의해 조절됩니다.
세균층 측정
원시적인 줄무늬는 위관 형성의 시작에서 형성되고 배아 외 조직과 배아의 뒤쪽 측면에 있는 외배아세포와 [22]침투 부위 사이의 접합부에서 발견됩니다.원시 줄무늬의 형성은 세포 내 콜러 낫의 노달[6] 신호와 태아 외 [22][23]조직의 BMP4 신호에 기여합니다.또한, Cer1 및 Lefty1은 노드 [24]신호에 대항하여 원시적인 줄무늬를 적절한 위치로 제한합니다.원시 줄무늬로 정의된 영역은 원위 [6]팁을 향해 계속 증가합니다.
발달의 초기 단계 동안, 원시적인 줄무늬는 양쪽 대칭을 확립하고, 위식도의 위치를 결정하고, 생식층 [25]형성을 시작하는 구조입니다.줄기를 형성하기 위해 파충류, 조류, 포유류는 중간엽 세포를 예비적인 중간선을 따라 배열하여 첫 번째 배아 축을 설정할 뿐만 아니라, 위와 생식기 층 [26]형성 과정 동안 세포가 침투하고 이동할 장소를 설정합니다.원시적인 줄무늬는 이 중간선을 통해 확장되고,[27] 배아에서 최초의 대칭 파괴 사건이 되고,[28] 위식도의 시작을 나타냅니다.이 과정은 중배엽 및 내배엽 전구세포의 침투와 최종 [27][29]위치로의 이동을 포함하며, 여기서 3개의 [26]생식세포층으로 분화됩니다.세포 접착 및 신호 전달 분자 베타-카테닌의 국소화는 위 조절을 시작하는 데 책임이 있는 조직 영역의 적절한 형성에 중요합니다.
세포 내부화
세포가 상피세포의 상피에서 원시적인 줄무늬를 통해 새로운 층을 형성하기 위해, 세포는 세포-세포 접착과 같은 상피 특성을 잃기 위해 상피에서 중간엽으로의 전이(EMT)를 거쳐야 합니다.FGF 신호 전달은 적절한 EMT를 위해 필요합니다. FGFR1은 E-캐드헤린을 하향 조절하여 세포 접착력을 잃게 하는 SNAI1의 상향 조절에 필요합니다.EMT에 이어, 세포들은 원시적인 줄무늬를 통해 침투하여 퍼져 새로운 층의 세포를 형성하거나 기존의 층을 결합합니다. FGF8은 [24]원시적인 줄무늬로부터 이 분산의 과정에 연루됩니다.
셀 신호 전달
FGF, RA 및 [21]Wnt와 같이 3개의 생식 층의 결정 및 형성에 역할을 하는 특정 신호가 있습니다.쥐와 같은 포유류에서, RA 신호는 폐 형성에 역할을 할 수 있습니다.RA가 충분하지 않으면 폐 생성에 오류가 발생합니다.RA는 또한 이 마우스 [citation needed]모델에서 호흡 능력을 조절합니다.
세포 신호 전달로 인한 위관 자극
위배식이 진행되는 동안, 세포는 외배엽 또는 중배엽으로 분화되고, 그 후 중배엽과 [21]내배엽으로 분리됩니다.결절 신호로 인해 내배엽과 중배엽이 형성됩니다.노달 신호 전달은 TGFβ 계열의 리간드를 사용합니다.이러한 리간드는 막관통 세린/트레오닌 키네이스 수용체를 신호하고, 이것은 Smad2 및 Smad3를 인산화합니다.그러면 이 단백질은 Smad4에 부착되어 중간엽 유전자가 전사되기 시작할 핵으로 재배치될 것입니다.Wnt 경로는 β-카테닌과 함께 결절 신호 전달 및 내배엽 [30]형성에 핵심적인 역할을 합니다.섬유아세포 성장인자(FGF), 표준 Wnt 경로, 뼈 형태유전학적 단백질(BMP), 레티노산(RA)은 모두 [21]내배엽의 형성과 발달에 중요합니다.FGF는 초기 해부학적 발달을 조절하는 호메오박스 유전자를 생산하는 데 중요합니다.BMP 신호 전달은 간에서 역할을 하고 간의 운명을 촉진합니다.또한 RA 신호는 Hoxb1 및 Hoxa5와 같은 호메오박스 유전자를 유도합니다.쥐의 경우, 만약 RA 신호가 부족하면 쥐는 [21]폐를 발달시키지 않을 것입니다.RA 신호는 인두 아치, 전두 및 [21]후두의 장기 형성에 다양한 용도로 사용됩니다.
체외배설
보통 배아줄기세포(ESC) 또는 유도만능줄기세포(iPSC)를 사용하는 2D[31][32][33] 및 3D 세포(Embryonic Organoid) 배양[34][35][36][37] 기술을 사용함에도 불구하고 시험관내 기술을 병행하고 배아의 연구와 보완적으로 사용하여 위배식 과정을 이해하려는 많은 시도가 있었습니다.이는 조직 배양 기반 프로토콜을 사용할 때의 여러 가지 분명한 이점과 관련이 있으며, 그 중 일부는 관련 생체 내 작업 비용을 줄이는 것을 포함합니다(따라서 실험에서 동물의 사용을 줄이고, 대체하고, 정제하는 것; 3Rs).Gastrulation 동안 기술적으로 수행하기 어려울 수 있는 작용제/항작용제를 공간 및 시간적으로[35][36] 구체적인 방식으로 정확하게 적용할 수 있는 능력.하지만, 배양에서의 관찰을 맥락을 위해 배아에서 일어나는 과정과 연관시키는 것은 중요합니다.
이를 설명하기 위해 마우스 ESC의 유도 분화는 원시[31] 줄무늬를 통과하는 상피세포의 많은 특성(예: 일시적인 상피세포 상향 조절 및 상피에서 중간엽으로의 전환과[31] 관련된 세포 변화)을 나타내는 원시 줄무늬와 같은 세포를 생성하는 결과를 초래했습니다.그리고 BMP4로 처리된 미세 패턴에서 배양된 인간 ESC는 인간 [32][33]배아의 배아 층 배열과 유사한 공간적 분화 패턴을 생성할 수 있습니다.마지막으로, 3D 배아체 및 유기체 기반 기술을 사용하여, 쥐 ESC (Embryonic Organoids, 또는 Gastruloids)의 작은 집합체는 대칭 파괴, 유전자 발현의 편광, 위관과 같은 움직임과 같은 초기 포유류 배아 발달의 많은 과정을 보여줄 수 있습니다.축 연장 및 세 개의 배아 축(후방, 측방 및 좌우 축)[34][35][36][38]의 생성.
체외 수정은 실험실에서 발생합니다.체외 수정의 과정은 성숙한 난자가 난소에서 제거되고 정자에 의해 수정되는 배양 배지에 놓이는 것입니다.배양에서 배아는 [39]형성될 것입니다. 수정 후 14일 후에 원시적인 줄무늬가 형성됩니다.원시적인 혈통의 형성은 일부 국가에서 "인간의 개성"[40]으로 알려져 있습니다.이것은 배아가 이제 하나의 존재 그 자체이며, 그 자체의 실체라는 것을 의미합니다.이것을 믿는 국가들은 14일간의 시험관 시험 기간 이후에 인간 배아에 대해 연구하거나 실험하는 것이 불법이라는 14일간의 규칙을 만들었습니다.배아의 첫 14일에 대한 연구가 수행되었지만, 14일 [41]이후에 알려진 연구는 수행되지 않았습니다.이 규칙이 시행되면, 쥐 배아는 14일 후의 발달을 이해하는 데 사용됩니다; 하지만 쥐와 인간 사이에는 발달에 차이가 있습니다.
참고 항목
레퍼런스
메모들
- ^ a b c d e f Gilbert, Scott F.; Michael J. F. Barresi (2016). Developmental biology (Eleventh ed.). Sunderland, Massachusetts. ISBN 978-1-60535-470-5. OCLC 945169933.
- ^ Mundlos 2009: 422페이지
- ^ a b McGeady, 2004: 페이지 34
- ^ Jonathon M.W., Slack (2013). Essential Developmental Biology. West Sussex, UK: Wiley-Blackwell. p. 122. ISBN 978-0-470-92351-1.
- ^ 홀, 1998: 페이지 132-134
- ^ a b c d e 아놀드 & 로빈슨, 2009
- ^ 홀, 1998: 페이지 177
- ^ Gilbert, Scott F. (2000). "Figure 8.6, [Types of cell movements during...]". www.ncbi.nlm.nih.gov. Retrieved 11 May 2022.
- ^ 에레스코프스키 2010: 페이지 236
- ^ Wolpert L (2008) 배아의 승리.택배회사 12페이지 ISBN 9780486469294
- ^ Laubichler, M.D. 및 Davidson, E.H. (2008)."보베리의 오랜 실험: 성게 메로곤과 핵염색체의 발달 역할 확립."발달 생물학. 314 (1):1-11. doi:10.1016/j.ydbio. 2007.11.024.
- ^ McClay, David R.; Gross, J.M.; Range, Ryan; Peterson, R.E.; Bradham, Cynthia (2004). "Chapter 9: Sea Urchin Gastrulation". In Stern, Claudio D. (ed.). Gastrulation: From Cells to Embryos. Cold Spring Harbor Laboratory Press. pp. 123–137. ISBN 978-0879697075.
- ^ Nielsen, Bjarke Frost; Nissen, Silas Boye; Sneppen, Kim; Mathiesen, Joachim; Trusina, Ala (February 21, 2020). "Model to Link Cell Shape and Polarity with Organogenesis". iScience. 23 (2): 100830. Bibcode:2020iSci...23j0830N. doi:10.1016/j.isci.2020.100830. PMC 6994644. PMID 31986479. S2CID 210934521.
- ^ 맥클레이, D.R. 2009.성게의 분열과 위식도: 10.1002/9780470015902.a0001073.pub2
- ^ Hardin J D (1990). "Context-sensitive cell behaviors during gastrulation" (PDF). Semin. Dev. Biol. 1: 335–345.
- ^ Blum, Martin; Beyer, Tina; Weber, Thomas; Vick, Philipp; Andre, Philipp; Bitzer, Eva; Schweickert, Axel (June 2009). "Xenopus , an ideal model system to study vertebrate left-right asymmetry". Developmental Dynamics. 238 (6): 1215–1225. doi:10.1002/dvdy.21855. PMID 19208433. S2CID 39348233. Retrieved 7 February 2023.
- ^ a b Gilbert, Scott F. (2000). "Axis Formation in Amphibians: The Phenomenon of the Organizer, The Progressive Determination of the Amphibian Axes". Developmental Biology. Sinauer Associates.
- ^ Gilbert, Scott F. (2000). "Figure 10.20, [Organization of a secondary axis...]". www.ncbi.nlm.nih.gov. Retrieved 1 June 2020.
- ^ Spemann H., Mangold H. (1924). "Über Induktion von Embryonanlagen durch Implantation artfremder Organisatoren". Roux' Arch. F. Entw. Mech. 100 (3–4): 599–638. doi:10.1007/bf02108133. S2CID 12605303.
- ^ De Robertis Edward (2006). "Spemann's organizer and self-regulation in amphibian embryos". Nature Reviews Molecular Cell Biology. 7 (4): 296–302. doi:10.1038/nrm1855. PMC 2464568. PMID 16482093.
- ^ a b c d e f g Zorn A, Wells J (2009). "Vertebrate Endoderm Development and Organ Formation". Annu Rev Cell Dev Biol. 25: 221–251. doi:10.1146/annurev.cellbio.042308.113344. PMC 2861293. PMID 19575677.
- ^ a b 탐 & 베링거, 1997
- ^ 카탈라, 2005: 페이지 1535
- ^ a b Tam, P.P.; Loebel, D.A (2007). "Gene function in mouse embryogenesis: get set for gastrulation". Nat Rev Genet. 8 (5): 368–81. doi:10.1038/nrg2084. PMID 17387317. S2CID 138874.
- ^ Sheng, Guojun; Arias, Alfonso Martinez; Sutherland, Ann (2021-12-03). "The primitive streak and cellular principles of building an amniote body through gastrulation". Science. 374 (6572): abg1727. doi:10.1126/science.abg1727. PMID 34855481. S2CID 244841366.
- ^ a b Mikawa T, Poh AM, Kelly KA, Ishii Y, Reese DE (2004). "Induction and patterning of the primitive streak, an organizing center of gastrulation in the amniote". Dev Dyn. 229 (3): 422–32. doi:10.1002/dvdy.10458. PMID 14991697. S2CID 758473.
- ^ a b Downs KM. (2009). "The enigmatic primitive streak: prevailing notions and challenges concerning the body axis of mammals". BioEssays. 31 (8): 892–902. doi:10.1002/bies.200900038. PMC 2949267. PMID 19609969.
- ^ Chuai M, Zeng W, Yang X, Boychenko V, Glazier JA, Weijer CJ (2006). "Cell movement during chick primitive streak formation". Dev. Biol. 296 (1): 137–49. doi:10.1016/j.ydbio.2006.04.451. PMC 2556955. PMID 16725136.
- ^ Chuai M, Weijer CJ (2008). The mechanisms underlying primitive streak formation in the chick embryo. Curr Top Dev Biol. Current Topics in Developmental Biology. Vol. 81. pp. 135–56. doi:10.1016/S0070-2153(07)81004-0. ISBN 9780123742537. PMID 18023726.
- ^ Grapin-Botton, A.; Constam, D. (2007). "Evolution of the mechanisms and molecular control of endoderm formation". Mechanisms of Development. 124 (4): 253–78. doi:10.1016/j.mod.2007.01.001. PMID 17307341. S2CID 16552755.
- ^ a b c Turner, David A.; Rué, Pau; Mackenzie, Jonathan P.; Davies, Eleanor; Martinez Arias, Alfonso (2014-01-01). "Brachyury cooperates with Wnt/β-catenin signalling to elicit primitive-streak-like behaviour in differentiating mouse embryonic stem cells". BMC Biology. 12: 63. doi:10.1186/s12915-014-0063-7. ISSN 1741-7007. PMC 4171571. PMID 25115237.
- ^ a b Warmflash, Aryeh; Sorre, Benoit; Etoc, Fred; Siggia, Eric D; Brivanlou, Ali H (2014). "A method to recapitulate early embryonic spatial patterning in human embryonic stem cells". Nature Methods. 11 (8): 847–854. doi:10.1038/nmeth.3016. PMC 4341966. PMID 24973948.
- ^ a b Etoc, Fred; Metzger, Jakob; Ruzo, Albert; Kirst, Christoph; Yoney, Anna; Ozair, M. Zeeshan; Brivanlou, Ali H.; Siggia, Eric D. (2016). "A Balance between Secreted Inhibitors and Edge Sensing Controls Gastruloid Self-Organization". Developmental Cell. 39 (3): 302–315. doi:10.1016/j.devcel.2016.09.016. PMC 5113147. PMID 27746044.
- ^ a b Brink, Susanne C. van den; Baillie-Johnson, Peter; Balayo, Tina; Hadjantonakis, Anna-Katerina; Nowotschin, Sonja; Turner, David A.; Arias, Alfonso Martinez (2014-11-15). "Symmetry breaking, germ layer specification and axial organisation in aggregates of mouse embryonic stem cells". Development. 141 (22): 4231–4242. doi:10.1242/dev.113001. ISSN 0950-1991. PMC 4302915. PMID 25371360.
- ^ a b c Turner, David Andrew; Glodowski, Cherise R.; Luz, Alonso-Crisostomo; Baillie-Johnson, Peter; Hayward, Penny C.; Collignon, Jérôme; Gustavsen, Carsten; Serup, Palle; Schröter, Christian (2016-05-13). "Interactions between Nodal and Wnt signalling Drive Robust Symmetry Breaking and Axial Organisation in Gastruloids (Embryonic Organoids)". bioRxiv 10.1101/051722.
- ^ a b c Turner, David; Alonso-Crisostomo, Luz; Girgin, Mehmet; Baillie-Johnson, Peter; Glodowski, Cherise R.; Hayward, Penelope C.; Collignon, Jérôme; Gustavsen, Carsten; Serup, Palle (2017-01-31). "Gastruloids develop the three body axes in the absence of extraembryonic tissues and spatially localised signalling". bioRxiv 10.1101/104539.
- ^ Beccari, Leonardo; Moris, Naomi; Girgin, Mehmet; Turner, David A.; Baillie-Johnson, Peter; Cossy, Anne-Catherine; Lutolf, Matthias P.; Duboule, Denis; Arias, Alfonso Martinez (October 2018). "Multi-axial self-organization properties of mouse embryonic stem cells into gastruloids". Nature. 562 (7726): 272–276. Bibcode:2018Natur.562..272B. doi:10.1038/s41586-018-0578-0. ISSN 0028-0836. PMID 30283134. S2CID 52915553.
- ^ Turner, David A.; Girgin, Mehmet; Alonso-Crisostomo, Luz; Trivedi, Vikas; Baillie-Johnson, Peter; Glodowski, Cherise R.; Hayward, Penelope C.; Collignon, Jérôme; Gustavsen, Carsten (2017-11-01). "Anteroposterior polarity and elongation in the absence of extra-embryonic tissues and of spatially localised signalling in gastruloids: mammalian embryonic organoids". Development. 144 (21): 3894–3906. doi:10.1242/dev.150391. ISSN 0950-1991. PMC 5702072. PMID 28951435.
- ^ "In vitro fertilization (IVF) - Mayo Clinic". www.mayoclinic.org. Retrieved 2022-04-11.
- ^ Asplund, Kjell (2020). "Use of in vitro fertilization—ethical issues". Upsala Journal of Medical Sciences. 125 (2): 192–199. doi:10.1080/03009734.2019.1684405. ISSN 2000-1967. PMC 7721055. PMID 31686575. S2CID 207896932.
- ^ Davis, Caitlin (2019-03-01). "The Boundaries of Embryo Research: Extending the Fourteen-Day Rule". Journal of Bioethical Inquiry. 16 (1): 133–140. doi:10.1007/s11673-018-09895-w. ISSN 1872-4353. PMID 30635823. S2CID 58643344.
서지학
- Arnold, Sebastian J.; Robertson, Elizabeth J. (2009). "Making a commitment: cell lineage allocation and axis patterning in the early mouse embryo". Nat. Rev. Mol. Cell Biol. 10 (2): 91–103. doi:10.1038/nrm2618. PMID 19129791. S2CID 94174.

- Catala, Martin (2005). "Embryology of the Spine and Spinal Cord". In Tortori-Donati, Paolo; et al. (eds.). Pediatric Neuroradiology: Brain. Springer. ISBN 978-3-540-41077-5.
- Ereskovsky, Alexander V. (2010). The Comparative Embryology of Sponges. Springer. ISBN 978-90-481-8574-0.
- Gilbert, Scott F. (2010). Developmental Biology (Ninth ed.). Sinauer Associates. ISBN 978-0-87893-558-1.
- Hall, Brian Keith (1998). "8.3.3 The gastrula and gastrulation". Evolutionary developmental biology (2nd ed.). The Netherlands: Kluwer Academic Publishers. ISBN 978-0-412-78580-1.
- Harrison, Lionel G. (2011). The Shaping of Life: The Generation of Biological Pattern. Cambridge University Press. ISBN 978-0-521-55350-6.
- McGeady, Thomas A., ed. (2006). "Gastrulation". Veterinary embryology. Wiley-Blackwell. ISBN 978-1-4051-1147-8.
- Mundlos, Stefan (2009). "Gene action: developmental genetics". In Speicher, Michael; et al. (eds.). Vogel and Motulsky's Human Genetics: Problems and Approaches (4th ed.). Springer. doi:10.1007/978-3-540-37654-5. ISBN 978-3-540-37653-8.
- Tam, Patrick P.L.; Behringer, Richard R. (1997). "Mouse gastrulation: the formation of a mammalian body plan". Mech. Dev. 68 (1–2): 3–25. doi:10.1016/S0925-4773(97)00123-8. PMID 9431800. S2CID 14052942.

진일보한 내용
- Baron, Margaret H. (2001). "Embryonic Induction of Mammalian Hematopoiesis and Vasculogenesis". In Zon, Leonard I. (ed.). Hematopoiesis: a developmental approach. Oxford University Press. ISBN 978-0-19-512450-7.
- Cullen, K.E. (2009). "embryology and early animal development". Encyclopedia of life science, Volume 2. Infobase. ISBN 978-0-8160-7008-4.
- Forgács, G.; Newman, Stuart A. (2005). "Cleavage and blastula formation". Biological physics of the developing embryo. Cambridge University Press. Bibcode:2005bpde.book.....F. ISBN 978-0-521-78337-8.
- Forgács, G.; Newman, Stuart A. (2005). "Epithelial morphogenesis: gastrulation and neurulation". Biological physics of the developing embryo. Cambridge University Press. Bibcode:2005bpde.book.....F. ISBN 978-0-521-78337-8.
- Hart, Nathan H.; Fluck, Richard A. (1995). "Epiboly and Gastrulation". In Capco, David (ed.). Cytoskeletal mechanisms during animal development. Academic Press. ISBN 978-0-12-153131-7.
- Knust, Elizabeth (1999). "Gastrulation movements". In Birchmeier, Walter; Birchmeier, Carmen (eds.). Epithelial Morphogenesis in Development and Disease. CRC Press. pp. 152–153. ISBN 978-90-5702-419-1.
- Kunz, Yvette W. (2004). "Gastrulation". Developmental biology of Teleost fishes. Springer. ISBN 978-1-4020-2996-7.
- Nation, James L., ed. (2009). "Gastrulation". Insect physiology and biochemistry. CRC Press. ISBN 978-0-8493-1181-9.
- Ross, Lawrence M.; Lamperti, Edward D., eds. (2006). "Human Ontogeny: Gastrulation, Neurulation, and Somite Formation". Atlas of anatomy: general anatomy and musculoskeletal system. Thieme. ISBN 978-3-13-142081-7.
- Sanes, Dan H. et al. (2006). "Early embryology of metazoans". Development of the nervous system (2nd ed.). Academic Press. pp. 1–2. ISBN 978-0-12-618621-5.
{{cite book}}CS1 유지관리: 작성자 매개변수(링크) 사용 - Stanger, Ben Z.; Melton, Douglas A. (2004). "Development of Endodermal Derivatives in the Lungs, Liver, Pancreas, and Gut". In Epstein, Charles J.; et al. (eds.). Inborn errors of development: the molecular basis of clinical disorders of morphogenesis. Oxford University Press. ISBN 978-0-19-514502-1.
외부 링크
- 웨이백 머신에 보관된 2015-10-20 가스순환 애니메이션.
- Gastrulation의 그림과 영화:클라우디오 스턴이 편집한 세포에서 배아로
- 개구리의 위식도 영상




