섬유아세포증식인자수용체1
Fibroblast growth factor receptor 1염기성 섬유아세포 성장인자 수용체 1, fms 관련 티로신 키나제-2 / 파이퍼 증후군 및 CD331로도 알려진 섬유아세포 성장인자 수용체 1(FGFR1)은 리간드가 섬유아세포 성장인자군의 특정 구성원인 수용체 티로신 키나제이다.FGFR1은 Pfefer [5]증후군 및 클론성 [6]호산구균과 관련이 있는 것으로 나타났다.
진
FGFR1 유전자는 인간 염색체 8의 위치 p11.23(즉, 8p11.23)에 위치하며, 24개의 엑손이 있으며 엑손 8A 또는 8B에서 번갈아 결합되어 두 개의 FGFR1 Iso, FIII에 대해 코드화된 두 개의 mRNA를 생성한다.이들 두 동질체는 조직 분포와 FGF 결합 친화력이 다르지만 FGFR1-IIc는 FGFR1 유전자의 대부분의 기능을 담당하는 것으로 보이는 반면 FGFR1-IIb는 경미하고 다소 중복된 기능적 [7][8]역할만 하는 것으로 보인다.FGFR1 유전자 패밀리에는 FGFR2, FGFR3, FGFR4 및 섬유아세포 성장인자 수용체 유사 1(FGFRL1)의 4가지 다른 구성원이 있습니다.FGFR2-4 유전자와 유사한 FGFR1 유전자는 복제, 다른 유전자와의 융합 및 점 돌연변이의 결과로 인간 암에서 일반적으로 활성화되므로 프로토온코겐으로 [9]분류된다.
단백질
리셉터
FGFR1은 섬유아세포성장인자수용체(FGFR) 계열의 일원으로 FGFR1 외에 FGFR2, FGFR3, FGFR4 및 FGFRL1-4는 티로신 키나아제 활성 세포표면 수용체이다.이들 4개의 수용체를 대표하는 전장은 적절한 리간드를 결합하는 3개의 면역글로불린 유사 도메인, 섬유아세포 성장인자(FGFs), 세포표막을 통과하는 단일 소수성 스트레치 및 세포질 티로신인산화효소 도메인으로 이루어진 세포외 영역으로 구성된다.FGF와 결합하면 이들 수용체는 다른 4개의 FGFR 중 하나와 이합체를 형성한 후 이들의 이합체 파트너에서 주요 티로신 잔기를 교차인산염한다.이러한 새롭게 인산화 된 부위는 세포 분화, 성장, 증식, 장기 생존, 이동 및 다른 기능을 이끄는 세포 신호 경로를 활성화하는 FRS2, PRKCG 및 GRB2와 같은 세포 세포 도킹 단백질과 결합합니다.FGFRL1은 현저한 세포 내 도메인 및 티로신 키나제 활성이 결여되어 있으며, FGF와 [9][10]결합하여 FGF의 작용을 희석시킴으로써 유인체 수용체 역할을 할 수 있다.FGFR 중 하나 또는 여러 FGFR(FGF1에서FGR10으로, FGF16에서FGF23으로)에 바인드 및 액티브하게 하는 기존의 FGR은 18개입니다.이 중 14개는 FGF1에서 FGF6, FGF8, FGF10, FGF17 및 FGF19에서 FG23으로 바인드하여 활성화한다.[11]FGFR1에 결합하는 FGF는 세포표면 헤파란 황산프로테오글리칸 및 FGF19,[11] FGF20 및 FGR23과의 상호작용에 의해 촉진된다.
세포활성화
FGFR1은 적절한 FGF에 결합되었을 때 a) 포스포리파아제 C/PI3K/AKT, b) Ras 서브패밀리/ERK, c) 세포질2+2+ Ca, d) IP3 유도 사육을 포함한 시그널링 경로를 활성화함으로써 세포 반응을 유도한다.활성화된 정확한 경로와 요소는 자극되는 세포 유형과 자극된 세포 미세 환경 및 이전 및 자극의[9][10] 동시 이력과 같은 다른 요인에 따라 달라집니다.
포스포리파아제 C(PLC))의 감마 아이소폼의 활성화(PLCG1 및 PLCG2 참조)는 FGFR1이 세포 자극 경로를 활성화하는 하나의 메커니즘을 보여준다.FGFR1은 적절한 FGF의 결합과 다른 FGFR과의 후속 페어링에 이어 C 말단에서 고도로 보존된 티로신 잔기(Y766)에 의해 그 파트너 FGFGFR1은 그 파트너 FGFR에 의해 인산화된다.이로 인해 바인딩 사이트 또는 "도킹" 사이트가 생성되어 PLC 탠덤nSH2 및 cSH2 도메인을 통해 PLC via를 모집한 후 PLC n를 인산화합니다.인산화됨으로써 PLC is는 자가억제구조에서 해방되어 근방의 포스파티딜리노시톨 4,5-이인산(PIP2)을 이노시톨 1,4,5-트리인산(IP3)과 디아시글리세롤(DAG)의 2차 메신저로 대사하는 데 활성화된다.이러한 2차 전달자는 다른 세포 신호 전달 및 세포 활성화제를 계속 동원합니다: IP3는 세포질2+ Ca와 그에 따라 다양한 Ca 민감2+ 요소를 상승시키는 반면 DAG는 다양한 단백질 키나제 C 동소 [11]형태를 활성화합니다.
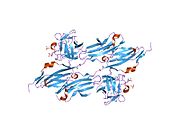
FGFR1 키나제(PDB: 3GQI)와 복합체 PLCγ의 2.5Ω 결정 구조에 대한 최근 간행물은 SH2 도메인에 의한 FGFR1의 PLCγ 채용의 분자 메커니즘을 이해하는 데 새로운 통찰력을 제공한다.오른쪽 끝의 그림 1은 c-SH2 도메인이 빨간색으로, n-SH2 도메인이 파란색으로, 도메인 간 링커가 노란색으로 표시된 PLCγ-FGFR1 키나제 복합체를 나타낸다.이 구조는 각 SH2 도메인에 2개의 α-헬리체와 3개의 역평행β-스트랜드가 있는 전형적인 SH2 도메인을 포함한다.이 복합체에서 FGFR1 키나제 C 말단 꼬리 위의 인산화된 티로신(pY766)은 PLCγ의 nSH2 도메인에 우선적으로 결합한다.FGFR1 키나제에서 티로신 잔기 766의 인산화 작용은 복합체를 안정시키기 위해 n-SH2와 수소 결합을 형성한다.결합 포켓 내의 수소 결합은 PLCγ-FGFR1 키나제 복합체를 안정시키는 데 도움이 된다.그림과 같이 물 분자는 n-SH2와 FGFR1 키나제 복합체의 결합 친화력을 더욱 높이기 위해 아스파라긴 647(N647)과 아스파르트산 768(D768)의 상호작용을 매개한다. (그림 2)활성 키나제 배좌에서 티로신 653과 티로신 654의 인산화 작용은 FGFR1 키나제의 활성화 부분에서 큰 배좌 변화를 일으킨다.트레오닌 658은 비활성 형태(그림 3.)에서 활성화된 FGFR1 키나아제(그림 4.)로 24Ω 이동한다.이동하면 비활성 형태의 닫힌 Configuration이 열려 기판 바인딩이 활성화됩니다.또한 개방 배열을 통해 Mg2+와 AMP-PCP(ATP의 아날로그)의 배위도 가능합니다.또한 활성 형태의 pY653 및 pY654는 SH2 및 FGFR1 키나아제 복합체의 개방 배열을 유지하는 데 도움이 된다.그러나 Y653 및 Y654에서의 인산화 작용이 Y766의 인산화 시 SH2 도메인을 C 말단 꼬리에 모집하는 데 도움이 되는 메커니즘은 여전히 명확하지 않다.그림 5는 FGFR1 키나제의 활성 및 비활성 형태의 중첩 구조를 보여준다.그림 6은 인산화된 티로신 잔기 653 및 654의 점 및 접촉면을 보여준다.녹색 점은 주변 잔류물과 함께 pY653과 pY654 사이의 접촉이 매우 양호함을 나타냅니다.빨간색 스파이크는 액티베이션세그먼트에서 바람직하지 않은 접점을 나타냅니다.이 수치는 Pymol에서 Molprobity 확장을 통해 생성됩니다.
FGFR1의 티로신 키나아제 영역은 주로 하전 아미노산을 통해 PLC primarily의 N-SH2 도메인에 결합한다.N-SH2 도메인상의 아르기닌 잔기(R609)는, FGFR1 도메인상의 아스파르트산 755(D755)에의 소금 브릿지를 형성한다.계면 중앙에 위치한 산염기쌍은 서로 거의 평행하며 매우 양호한 상호작용을 나타낸다.N-SH2 도메인은 N-SH2 도메인과 FGFR1 키나아제 영역 사이에서 일어나는 물 매개 상호작용을 통해 추가적인 극성 접촉을 한다.FGFR1 키나제에서 아르기닌 잔기 609(R609)는 또한 N-SH2 도메인에서 아스파르트산 잔기(D594)에 소금 브릿지를 형성한다.산-염기 쌍은 복합체를 안정화시키는 환원-산화 반응을 수행한다(그림 7).이전의 연구는 이러한 페닐알라닌 또는 발린 아미노산을 돌연변이시킴으로써 n-SH2 도메인과 FGFR1 키나아제 복합체의 결합 친화성을 명확히 하기 위해 이루어졌다.등온적정열량 측정 결과, 티로신 [12]잔기의 인산화에는 영향을 주지 않고 복합체의 결합 친화력이 3~6배 감소하였다.
세포 억제
FGFR1의 FGF 유도 활성화는 또한 발아단백질 SPRY1, SPRY2, SRY3, 및/또는 C-Raf와 상호작용하여 FGROS1 및/또는 TYR1에 의해 활성화된 세포자극을 감소시키거나 억제하는 발아단백질 SPRY4의 활성화를 자극한다.이러한 상호작용은 세포 [11]활성화의 범위를 제한하는 부정적인 피드백 루프 역할을 합니다.
기능.
기능성 Fgfr1 유전자(인간의 FGFR1 유전자의 정통)가 부족하도록 유전적으로 조작된 쥐는 임신 10.5일 전에 자궁에서 죽는다.배아는 중배엽 유래 조직과 근골격계의 발달과 구성에 광범위한 결함을 보인다.Fgfr1 유전자는 배아 구조의 절단 및 근육과 뼈 조직의 형성에 중요하며,[11][13][14] 따라서 사지, 두개골, 외이, 중이, 내이, 신경관, 꼬리, 그리고 하등 척추의 정상적인 형성에 중요한 것으로 보인다.
임상적 의의
선천성 질환
FGFR1 유전자의 유전적 돌연변이는 근골격계의 다양한 선천적 기형과 관련되어 있다.인간 염색체 8p12-p11, FGFR1 아미노산 622(R622X로 표기)에서의 정지 난센스 돌연변이에 대한 아르기닌 및 다른 수많은 상염색체 우성 불활성화 돌연변이는 칼만 증후군 환자의 최대 10%를 차지한다.이 증후군은 무감각증 또는 저감각증, 구개열 및 기타 두개골 안면 결손, 척추측만증과 기타 근골격계 기형을 가진 다양한 비율의 환자들과 관련된 저감각성 저감각증의 한 형태이다.FGFR1의 활성 돌연변이 P232R(단백질의 232번째 아미노산에서의 프롤린 대 아르기닌 치환)은 두개골 시노시스 및 얼굴 중간 기형으로 특징지어지는 질환인 Pfeiffer 증후군의 유형 1 또는 고전적 형태를 담당한다.FGFR1(Y372C)의 372번째 아미노산에서의 티로신-시스테인 치환 돌연변이는 골로폰 이형성의 일부 경우에 책임이 있다.이 돌연변이는 두개골 시노시스, 하악골 예후증, 과망막증, 상완화증, 상완골간 관절융합을 일으킨다.'FGFR1 돌연변이'와 관련된 다른 유전 결함도 마찬가지로 근골격계 기형을 포함한다: 잭슨-바이스 증후군(아미노산 252에서 아르그 치환으로 진행), 안틀리-빅슬러 증후군(아미노산 300(I300T)에서 이소류신-트레오닌), 트리고네팔리(안틀리-빅슬러 증후군과 동일)이다.I300T).[10][11][15]
암
FGFR1 유전자의 발현에 있어서의 체세포 돌연변이와 후생유전적 변화는 다양한 종류의 폐암, 유방암, 혈액학암 및 다른 종류의 암에 기여하는 것으로 생각된다.
폐암
비소세포 폐암(NSCLC) 환자의 9~22%에서 FGFR1 유전자(4부 이상)의 증폭이 나타난다.FGFR1 증폭은 흡연의 이력과 높은 상관관계를 보였으며, 이 병을 앓고 있는 환자 집단에서 단일 가장 큰 예후 인자로 판명되었다.다른 종류의 폐암 환자의 약 1%가 FGFR1에서 [9][10][16][17]증폭을 보인다.
유방암
FGFR1의 증폭은 또한 에스트로겐 수용체 양성 유방암, 특히 유방암의 내강 아형 B형에서 10%까지 발생한다.FGFR1 증폭의 존재는 호르몬 차단 요법에 대한 저항성과 관련이 있으며 이 질환의 나쁜 [9][10]예후 인자로 밝혀졌다.
혈액암
특정 희귀 혈액학적 암에서는 염색체 전이 또는 간질 결실로 인해 FGFR1과 다양한 다른 유전자의 융합이 키메라 FGFR1 융합 단백질을 코드하는 유전자를 생성한다.이들 단백질은 FGFR1 유도 티로신 키나제를 지속적으로 활성화하여 세포 성장과 증식을 지속적으로 자극하였다.이러한 돌연변이는 골수세포주 및/또는 림프세포주의 초기 단계에서 발생하며 순환혈액 호산구수 증가, 골수 호산구수 증가 및/또는 에오신구 침윤을 가진 특정 유형의 혈액학적 악성종양의 발생 및 진행에 기여한다.티슈이러한 신생물들은 처음에는 호산구증, 고페레오시노필리어스, 골수증식성 신생물, 골수성 육종, 림프성 백혈병 또는 비호지킨 림프종으로 간주되었다.호산구와의 관련성, 독특한 유전자 돌연변이, 티로신 키나아제 억제제 치료에 대한 알려진 또는 잠재적 민감성에 기초하여, 그것들은 현재 클로날 호산구균으로 [6]함께 분류되고 있다.이러한 돌연변이는 FGFR1 유전자의 염색체 부위인 8p11(즉, 위치 11의 인간 염색체 8의 짧은 팔[즉 p])과 위치가 17q11(즉, 인간 염색체 17의 긴 팔[q])인 MYO18A와 같은 다른 유전자를 결합함으로써 설명된다.이러한 FGFR1 돌연변이는 FGFR1A의 파트너 유전자의 염색체 위치 및 융합 유전자의 주석과 함께 다음 [18][19][20]표에 제시된다.
| 진 | 궤적 | 표기법 | 유전자 | 궤적 | 표기법 | 진 | 궤적 | 표기법 | 유전자 | 궤적 | 표기법 | 유전자 | 궤적 | 표기법 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| MYO18A | 11년 1월 17일 | t(8;17)(p11;q11) | CPSF6 | 12월 15일 | t(8;12)(p11;q15) | TPR | 1q25 | t(1;8)(q25p11;; | HERV-K | 13년 10월 | t(8;13)(p11-q13) | FGFR1OP2 | 12p11 | t(8;12)(p11;q12) | ||||
| ZMYM2 | 2012년 1월 13일 | t(8;13)(p11;q12) | 커틀 | 7분기 22 | t(7;8)(q22;p11) | SQSTM1 | 5분기 35 | t(5;8)(q35;p11) | RANBP2 | 13년 2분기 | t(2;8)(q13;p11) | LRRFIP1 | 2분기 37 | t(8;2)(p11;q37) | ||||
| CNTRL | 9/33 | t(8;9)(p11;q33) | FGFR1OP | 6분기 27일 | t(6;8)(q27;p11) | BCR | 2011년 2월 22일 | t(8;22)(p11;q11) | NUP98 | 11p15 | t(8;11)(p11-p15) | 미스트3 | 8p11.21 | 복수[21] | ||||
| CEP110 | 16p12 | t(8;16)(p11;p12) |
이러한 암은 때때로 FGFR1 유전자의 염색체 위치에 근거하여 8p11 골수증식증후군으로 불린다.ZMYM2, CNTRL 및 FGFR1OP2와 관련된 트랜슬레이션은 이러한 8p11 신드롬의 가장 일반적인 형태입니다.일반적으로 이들 질환 중 하나를 가진 환자는 평균 44세로 피로감, 식은땀, 체중감소, 발열, 림프절증, 간 및/또는 비장확대를 동반한다.그들은 보통 중간에서 상당히 높은 수준의 혈액과 골수 호산구들과 함께 골수증식증후군의 혈액학적 특징을 증명한다.단, 다음과 같은 유전자를 가진 환자: a) ZMYM2-FGFR1 융합 유전자는 비림프 조직으로 확산되는 T세포 림프종으로 나타나는 경우가 많다. b) FGFR1-BCR 융합 유전자는 일반적으로 만성 골수성 백혈병으로 나타나는 경우, c) CEP110 융합 유전자는 만성 골수성 백혈병 및 백혈병 발병률에 관여할 수 있다.호산구균이 거의 없거나 아예 없는 경우가 많습니다.진단에는 Fluorescence in sit hybridization #FGFR1에 [19][21]대한 탐침 및 분리 탐침 분석을 사용한 기존 세포유전학이 필요합니다.
혈소판유래성장인자수용체 A 또는 혈소판유래성장인자수용체 B융합유전자 등 호산구를 가진 다른 많은 골수성 종양과 달리 일반적으로 FGFR1융합유전자에 의해 발생하는 골수성형증후군은 티로신인산화효소억제제에 대해 공격적이고 신속하게 반응하지 않으며 치료가 필요하다.생존율을 [19][18]높이기 위해 화학요법제와 골수이식제를 함께 투여한다.티로신인산화효소억제제 Ponatinib는 모노 테라피로 사용되었으며 FGFR1-BCR 융합유전자에 의해 [19]야기되는 골수이형성을 치료하기 위해 집중 화학요법과 함께 사용되어 왔다.
인산성 간엽종양
인산성 간엽성 종양은 다양한 양의 석회화 매트릭스와 관련된 명백한 비악성 방추상 세포의 고혈관 증식으로 특징지어지지만, 이러한 종양의 작은 부분 집합은 악성 조직학적 특징을 나타내며 임상적으로 악성적인 방식으로 행동할 수 있다.15명의 환자 중 9명은 q35 [22]위치에 있는 인간 염색체 2에 위치한 FGFR1 유전자와 FN1 유전자 사이에 융합을 일으키는 종양이 있는 것으로 밝혀졌다.FGFR1-FN1 융합 유전자는 인화성 간엽성 [23]종양 환자 39명 중 16명(41%)에서 다시 확인되었다.이 질병에서 (2;8)(35;11) FGFR1-FN1 융합 유전자의 역할은 알려지지 않았다.
횡문근육종
인간 횡문근육종 종양 10개 중 10개와 횡문근육종에서 유래한 인간 세포주 4개 중 4개에서 FGFR1 단백질의 높은 발현이 검출되었다.종양 사례로는 폐포 횡문근육종 6건, 태아 횡문근육종 2건, 다형 횡문근육종 2건이 있었다.횡문근육종은 완전한 분화에 실패한 미숙한 골격근 세포 전구체, 근아세포에서 발생하는 매우 악성적인 암이다.FGFR1 활성화는 분화를 억제하면서 근아세포를 증식시키는 것으로, 이러한 세포에 의한 악성 표현형의 추정을 초래할 수 있는 이중 효과이다.10명의 인간 횡문근육종 종양은 첫 번째 FGFR1 엑손 상류의 CpG 섬의 메틸화 수준이 감소하였다.CpG 섬은 메틸화가 이 침묵을 억제하는 동안 인접 유전자의 발현을 침묵시키는 기능을 한다.FGFR1 상류의 CpG섬의 저메틸화는 적어도 부분적으로 이들 횡문근육종 [24]종양의 FGFR1의 과잉 발현 및 악성 거동에 책임이 있다고 가정된다.또한 횡문근육종 종양의 단일 사례가 13q14에서 발현공증화된 FOXO1 유전자와 8p11에서 FGFR1 유전자, 즉 t(8;13)(p11;q14)에서 발견되었으며,[9][25] 이는 이 융합 유전자에 의한 키메랄 FOXO1-FG의 형성, 증폭 및 악성 활성을 시사한다.
다른 종류의 암
FGFR1 유전자가 발견된 경우 후천성 이상: 방광 전이세포암의 약 14%(거의 모두 증폭), 편평세포 두경부암의 약 10%(80% 증폭, 기타 20% 돌연변이), 자궁내막암의 약 7%(반증폭, 기타 유형의 돌연변이), 전립선암의 약 6%(반증폭)이온은 절반 다른 돌연변이);난소 Papillary 장액성 낭포 선암(거의 모든 확대)의 ~5%;직장암의 ~5%(~60 확대 40% 다른 돌연변이);sarcomas(대부분 확대)의 ~4%;<>Glioblastomas(FGFR1과 TACC1의 퓨전(8p11)유전자의 3%);<, 침샘 암(모든 확대)의 3%;그리고 <2%이다. certai에n 다른 암.[11][26][27]
FGFR 억제제
FGFR 대상 약물은 암세포와 내피세포에 [9]대한 FGFR이 각각 종양유전 및 혈관형성에 관여하기 때문에 직접적 및 간접적 항암 효과를 발휘한다.FGFR 치료제는 FGF가 비침습성, 줄기성 및 세포 생존과 같은 암의 많은 특징에 영향을 미치기 때문에 활성화되어 있다.그러한 약들 중 가장 중요한 것은 길항제이다.수용체의 티로신 키나아제 도메인의 ATP 결합 포켓 사이에 들어가는 작은 분자.FGFR1의 경우 TKI ATP 포켓을 대상으로 수많은 소분자가 승인되었습니다.여기에는 도비티닙과 브리바닙이 포함됩니다.아래 표는 FGFR을 [9]대상으로 하는 소분자 화합물의 IC50(나노몰)을 나타냅니다.
| PD173074 | 도비티닙 | Ki23057 | 렌바티니브 | 브리바니브 | 닌테다니브 | 포나티닙 | MK-2461 | 루시타니브 | AZD4547 |
|---|---|---|---|---|---|---|---|---|---|
| 26 | 8 | NA | 46 | 148 | 69 | 2.2 | 65 | 18 | 0.2 |
유전자 과잉증폭에 의한 유방암 및 폐암의 FGFR1 돌연변이를 각각 [28]도비티닙 및 포나티닙을 이용하여 효과적으로 표적화한다.약물 내성은 FGFR 표적에 대한 약물 개발 분야에서 매우 관련성이 높은 주제이다.FGFR 억제제는 인간 암세포의 파클리탁셀이나 에토포시드와 같은 세포독성 항암제에 대한 종양 감수성의 증가를 가능하게 하고, 그 결과 결함 FGFR [9]활성화에 기초한 항아포토시스 잠재력을 감소시킨다.FGF 시그널링 억제는 혈관 재생을 극적으로 감소시키기 때문에 암의 특징 중 하나인 혈관신생을 방해한다.또한 유방암에 대한 일반적인 VEGFR-2 치료법에 따른 FGF2 상향 조절에 기반하여 자가분비 FGF 시그널링에 의존하는 인간 종양의 종양 부담을 감소시킨다.따라서 FGFR1은 향후 재발의 잠재적 경로를 제거함으로써 암 복제 재발을 차단하는 치료법과 시너지 작용을 할 수 있다.또한 FGF 시그널링 억제는 혈류 [29][30]재작성을 극적으로 감소시킨다.
FGFR 억제제는 EGFR 또는 VEGFR을 대상으로 한 치료 후 FGFR 활성화 소수집단의 클론 진화 때문에 재발된 종양에 효과적일 것으로 예측되어 왔다.FGFR 억제제가 인간 암에서 약물 내성을 극복하는 작용 메커니즘이 여러 개 있기 때문에 FGFR 표적 치료는 난치성 [31]암 치료에 유망한 전략일 수 있다.
AZD4547은 위암 2상 임상시험을 거쳤으며 [32]몇 가지 결과를 보고했다.
루시타니브는 FGFR1과 FGFR2의 억제제로 진행성 고형종양 [33]임상시험을 거쳤다.
FGFR1, FGFR2, FGFR3의 억제제인 도비티닙(TKI258)은 FGFR 증폭 유방암에 [28]대한 임상시험을 실시한 바 있다.
상호 작용
섬유아세포 성장인자 수용체 1은 다음과 상호작용하는 것으로 나타났다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG00007782 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000031565 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Itoh N, Terachi T, Ohta M, Seo MK (June 1990). "The complete amino acid sequence of the shorter form of human basic fibroblast growth factor receptor deduced from its cDNA". Biochemical and Biophysical Research Communications. 169 (2): 680–685. doi:10.1016/0006-291X(90)90384-Y. PMID 2162671.
- ^ a b Gotlib J (November 2015). "World Health Organization-defined eosinophilic disorders: 2015 update on diagnosis, risk stratification, and management". American Journal of Hematology. 90 (11): 1077–1089. doi:10.1002/ajh.24196. PMID 26486351. S2CID 42668440.
- ^ "FGFR1 fibroblast growth factor receptor 1 [Homo sapiens (human)] - Gene - NCBI".
- ^ Gonçalves C, Bastos M, Pignatelli D, Borges T, Aragüés JM, Fonseca F, et al. (November 2015). "Novel FGFR1 mutations in Kallmann syndrome and normosmic idiopathic hypogonadotropic hypogonadism: evidence for the involvement of an alternatively spliced isoform". Fertility and Sterility. 104 (5): 1261–7.e1. doi:10.1016/j.fertnstert.2015.07.1142. hdl:10400.17/2465. PMID 26277103.
- ^ a b c d e f g h i Katoh M, Nakagama H (March 2014). "FGF receptors: cancer biology and therapeutics". Medicinal Research Reviews. 34 (2): 280–300. doi:10.1002/med.21288. PMID 23696246. S2CID 27412585.
- ^ a b c d e Kelleher FC, O'Sullivan H, Smyth E, McDermott R, Viterbo A (October 2013). "Fibroblast growth factor receptors, developmental corruption and malignant disease". Carcinogenesis. 34 (10): 2198–2205. doi:10.1093/carcin/bgt254. PMID 23880303.
- ^ a b c d e f g Helsten T, Schwaederle M, Kurzrock R (September 2015). "Fibroblast growth factor receptor signaling in hereditary and neoplastic disease: biologic and clinical implications". Cancer and Metastasis Reviews. 34 (3): 479–496. doi:10.1007/s10555-015-9579-8. PMC 4573649. PMID 26224133.
- ^ Bae JH, Lew ED, Yuzawa S, Tomé F, Lax I, Schlessinger J (August 2009). "The selectivity of receptor tyrosine kinase signaling is controlled by a secondary SH2 domain binding site". Cell. 138 (3): 514–524. doi:10.1016/j.cell.2009.05.028. PMC 4764080. PMID 19665973.
- ^ Deng C, Bedford M, Li C, Xu X, Yang X, Dunmore J, Leder P (May 1997). "Fibroblast growth factor receptor-1 (FGFR-1) is essential for normal neural tube and limb development". Developmental Biology. 185 (1): 42–54. doi:10.1006/dbio.1997.8553. PMID 9169049.
- ^ Calvert JA, Dedos SG, Hawker K, Fleming M, Lewis MA, Steel KP (June 2011). "A missense mutation in Fgfr1 causes ear and skull defects in hush puppy mice". Mammalian Genome. 22 (5–6): 290–305. doi:10.1007/s00335-011-9324-8. PMC 3099004. PMID 21479780.
- ^ "OMIM Entry - * 136350 - FIBROBLAST GROWTH FACTOR RECEPTOR 1; FGFR1".
- ^ https://pct.mdanderson.org/genes/fgfr1/show[인용필수]
- ^ Kim HR, Kim DJ, Kang DR, Lee JG, Lim SM, Lee CY, et al. (February 2013). "Fibroblast growth factor receptor 1 gene amplification is associated with poor survival and cigarette smoking dosage in patients with resected squamous cell lung cancer". Journal of Clinical Oncology. 31 (6): 731–737. doi:10.1200/JCO.2012.43.8622. PMID 23182986.
- ^ a b Vega F, Medeiros LJ, Bueso-Ramos CE, Arboleda P, Miranda RN (September 2015). "Hematolymphoid neoplasms associated with rearrangements of PDGFRA, PDGFRB, and FGFR1". American Journal of Clinical Pathology. 144 (3): 377–392. doi:10.1309/AJCPMORR5Z2IKCEM. PMID 26276769. S2CID 10435391.
- ^ a b c d Reiter A, Gotlib J (February 2017). "Myeloid neoplasms with eosinophilia". Blood. 129 (6): 704–714. doi:10.1182/blood-2016-10-695973. PMID 28028030.
- ^ Appiah-Kubi K, Lan T, Wang Y, Qian H, Wu M, Yao X, et al. (January 2017). "Platelet-derived growth factor receptors (PDGFRs) fusion genes involvement in hematological malignancies". Critical Reviews in Oncology/Hematology. 109: 20–34. doi:10.1016/j.critrevonc.2016.11.008. PMID 28010895.
- ^ a b Patnaik MM, Gangat N, Knudson RA, Keefe JG, Hanson CA, Pardanani A, et al. (April 2010). "Chromosome 8p11.2 translocations: prevalence, FISH analysis for FGFR1 and MYST3, and clinicopathologic correlates in a consecutive cohort of 13 cases from a single institution". American Journal of Hematology. 85 (4): 238–242. doi:10.1002/ajh.21631. PMID 20143402. S2CID 5256456.
- ^ Lee JC, Jeng YM, Su SY, Wu CT, Tsai KS, Lee CH, et al. (March 2015). "Identification of a novel FN1-FGFR1 genetic fusion as a frequent event in phosphaturic mesenchymal tumour". The Journal of Pathology. 235 (4): 539–545. doi:10.1002/path.4465. PMID 25319834. S2CID 9887919.
- ^ Lee JC, Su SY, Changou CA, Yang RS, Tsai KS, Collins MT, et al. (November 2016). "Characterization of FN1-FGFR1 and novel FN1-FGF1 fusion genes in a large series of phosphaturic mesenchymal tumors". Modern Pathology. 29 (11): 1335–1346. doi:10.1038/modpathol.2016.137. PMID 27443518.
- ^ Goldstein M, Meller I, Orr-Urtreger A (November 2007). "FGFR1 over-expression in primary rhabdomyosarcoma tumors is associated with hypomethylation of a 5' CpG island and abnormal expression of the AKT1, NOG, and BMP4 genes". Genes, Chromosomes & Cancer. 46 (11): 1028–1038. doi:10.1002/gcc.20489. PMID 17696196. S2CID 8865648.
- ^ Liu J, Guzman MA, Pezanowski D, Patel D, Hauptman J, Keisling M, et al. (October 2011). "FOXO1-FGFR1 fusion and amplification in a solid variant of alveolar rhabdomyosarcoma". Modern Pathology. 24 (10): 1327–1335. doi:10.1038/modpathol.2011.98. PMID 21666686.
- ^ Singh D, Chan JM, Zoppoli P, Niola F, Sullivan R, Castano A, et al. (September 2012). "Transforming fusions of FGFR and TACC genes in human glioblastoma". Science. 337 (6099): 1231–1235. Bibcode:2012Sci...337.1231S. doi:10.1126/science.1220834. PMC 3677224. PMID 22837387.
- ^ Ach T, Schwarz-Furlan S, Ach S, Agaimy A, Gerken M, Rohrmeier C, et al. (August 2016). "Genomic aberrations of MDM2, MDM4, FGFR1 and FGFR3 are associated with poor outcome in patients with salivary gland cancer". Journal of Oral Pathology & Medicine. 45 (7): 500–509. doi:10.1111/jop.12394. PMID 26661925.
- ^ a b André F, Bachelot T, Campone M, Dalenc F, Perez-Garcia JM, Hurvitz SA, et al. (July 2013). "Targeting FGFR with dovitinib (TKI258): preclinical and clinical data in breast cancer". Clinical Cancer Research. 19 (13): 3693–3702. doi:10.1158/1078-0432.CCR-13-0190. PMID 23658459.
- ^ Repetto M, Crimini E, Giugliano F, Morganti S, Belli C, Curigliano G (October 2021). "Selective FGFR/FGF pathway inhibitors: inhibition strategies, clinical activities, resistance mutations, and future directions". Expert Review of Clinical Pharmacology. 14 (10): 1233–1252. doi:10.1080/17512433.2021.1947246. PMID 34591728. S2CID 238231910.
- ^ Chioni AM, Grose RP (November 2021). "Biological Significance and Targeting of the FGFR Axis in Cancer". Cancers. 13 (22): 5681. doi:10.3390/cancers13225681. PMC 8616401. PMID 34830836.
- ^ Asai N, Ohkuni Y, Kaneko N, Yamaguchi E, Kubo A (March 2014). "Relapsed small cell lung cancer: treatment options and latest developments". Therapeutic Advances in Medical Oncology. 6 (2): 69–82. doi:10.1177/1758834013517413. PMC 3932054. PMID 24587832.
- ^ 섬유아세포 성장인자 수용체 2(FGFR2) 다종절제술 또는 유전자 증폭(AMP): SHINE 연구로 이전에 처리된 진행 위암(AGC) 환자에서 AZD4547(AZD) 대 Paclitaxel(P)에 대한 무작위화된 개방 라벨 단계 II 연구.
- ^ Soria JC, DeBraud F, Bahleda R, Adamo B, Andre F, Dientsmann R, et al. (November 2014). "Phase I/IIa study evaluating the safety, efficacy, pharmacokinetics, and pharmacodynamics of lucitanib in advanced solid tumors". Annals of Oncology. 25 (11): 2244–2251. doi:10.1093/annonc/mdu390. PMID 25193991.
- ^ Schlessinger J, Plotnikov AN, Ibrahimi OA, Eliseenkova AV, Yeh BK, Yayon A, et al. (September 2000). "Crystal structure of a ternary FGF-FGFR-heparin complex reveals a dual role for heparin in FGFR binding and dimerization". Molecular Cell. 6 (3): 743–750. doi:10.1016/s1097-2765(00)00073-3. PMID 11030354.
- ^ Santos-Ocampo S, Colvin JS, Chellaiah A, Ornitz DM (January 1996). "Expression and biological activity of mouse fibroblast growth factor-9". The Journal of Biological Chemistry. 271 (3): 1726–1731. doi:10.1074/jbc.271.3.1726. PMID 8576175.
- ^ Yan KS, Kuti M, Yan S, Mujtaba S, Farooq A, Goldfarb MP, Zhou MM (May 2002). "FRS2 PTB domain conformation regulates interactions with divergent neurotrophic receptors". The Journal of Biological Chemistry. 277 (19): 17088–17094. doi:10.1074/jbc.M107963200. PMID 11877385.
- ^ Ong SH, Guy GR, Hadari YR, Laks S, Gotoh N, Schlessinger J, Lax I (February 2000). "FRS2 proteins recruit intracellular signaling pathways by binding to diverse targets on fibroblast growth factor and nerve growth factor receptors". Molecular and Cellular Biology. 20 (3): 979–989. doi:10.1128/mcb.20.3.979-989.2000. PMC 85215. PMID 10629055.
- ^ Xu H, Lee KW, Goldfarb M (July 1998). "Novel recognition motif on fibroblast growth factor receptor mediates direct association and activation of SNT adapter proteins". The Journal of Biological Chemistry. 273 (29): 17987–17990. doi:10.1074/jbc.273.29.17987. PMID 9660748.
- ^ Dhalluin C, Yan KS, Plotnikova O, Lee KW, Zeng L, Kuti M, et al. (October 2000). "Structural basis of SNT PTB domain interactions with distinct neurotrophic receptors". Molecular Cell. 6 (4): 921–929. doi:10.1016/S1097-2765(05)00087-0. PMC 5155437. PMID 11090629.
- ^ Urakawa I, Yamazaki Y, Shimada T, Iijima K, Hasegawa H, Okawa K, et al. (December 2006). "Klotho converts canonical FGF receptor into a specific receptor for FGF23". Nature. 444 (7120): 770–774. Bibcode:2006Natur.444..770U. doi:10.1038/nature05315. PMID 17086194. S2CID 4387190.
- ^ Reilly JF, Mickey G, Maher PA (March 2000). "Association of fibroblast growth factor receptor 1 with the adaptor protein Grb14. Characterization of a new receptor binding partner". The Journal of Biological Chemistry. 275 (11): 7771–7778. doi:10.1074/jbc.275.11.7771. PMID 10713090.
- ^ Karlsson T, Songyang Z, Landgren E, Lavergne C, Di Fiore PP, Anafi M, et al. (April 1995). "Molecular interactions of the Src homology 2 domain protein Shb with phosphotyrosine residues, tyrosine kinase receptors and Src homology 3 domain proteins". Oncogene. 10 (8): 1475–1483. PMID 7537362.
추가 정보
- Weiss J, Sos ML, Seidel D, Peifer M, Zander T, Heuckmann JM, et al. (December 2010). "Frequent and focal FGFR1 amplification associates with therapeutically tractable FGFR1 dependency in squamous cell lung cancer". Science Translational Medicine. 2 (62): 62ra93. doi:10.1126/scitranslmed.3001451. PMC 3990281. PMID 21160078.
- Johnson DE, Williams LT (1992). Structural and Functional Diversity in the FGF Receptor Multigene Family. Advances in Cancer Research. Vol. 60. pp. 1–41. doi:10.1016/S0065-230X(08)60821-0. ISBN 978-0-12-006660-5. PMID 8417497.
- Macdonald D, Reiter A, Cross NC (2002). "The 8p11 myeloproliferative syndrome: a distinct clinical entity caused by constitutive activation of FGFR1". Acta Haematologica. 107 (2): 101–107. doi:10.1159/000046639. PMID 11919391. S2CID 9582122.
- Groth C, Lardelli M (2002). "The structure and function of vertebrate fibroblast growth factor receptor 1". The International Journal of Developmental Biology. 46 (4): 393–400. PMID 12141425.
- Wilkie AO (April 2005). "Bad bones, absent smell, selfish testes: the pleiotropic consequences of human FGF receptor mutations". Cytokine & Growth Factor Reviews. 16 (2): 187–203. doi:10.1016/j.cytogfr.2005.03.001. PMID 15863034.
외부 링크
- FGFR 관련 두개신드롬에 대한 GeneReviews/NIH/NCBI/UW 엔트리
- 칼만 증후군에 대한 GeneReviews/NCBI/NIH/UW 엔트리
- FGFR1+단백질+미국국립의학도서관 의학 과목 표제(MeSH)
- 유전학 및 종양학 지도책의 섬유아세포 성장인자 수용체 1
- UCSC Genome Browser에서의 FGFR1 인간 유전자 위치.
- UCSC 게놈 브라우저의 FGFR1 인간 유전자 상세.
- PDBe-KB의 UniProt: P11362(인간 섬유아세포 성장인자 수용체 1)에 있는 PDB의 모든 구조 정보의 개요.
- PDB for UniProt: P16092(마우스 섬유아세포 성장인자 수용체 1)에서 PDBe-KB에 제공되는 모든 구조 정보의 개요.