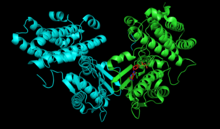
화농산탈수소효소 키나아제
Pyruvate dehydrogenase kinase| 화농산탈수소효소 키나아제 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 세 개의 인산화 부위 주변은 붉은색으로 표시된다. 사이트 1은 왼쪽 하단 모서리에 있고, 사이트 2는 오른쪽 상단, 사이트 3은 오른쪽 하단 모서리에 있다. | |||||||||
| 식별자 | |||||||||
| EC 번호 | 2.7.11.2 | ||||||||
| CAS 번호. | 2620256 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 입력 | ||||||||
| 엑스퍼시 | 나이스자이메 뷰 | ||||||||
| 케그 | KEG 입력 | ||||||||
| 메타사이크 | 대사통로 | ||||||||
| 프리암 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Pyruvate detrogenase kinase (Pyruvate detrogenase complex kinase, PDC kinase, 또는 PDK; EC 2.7.11.2)는 ATP를 이용하여 효소인산 탈수소효소를 불활성화시키는 작용을 하는 키나제 효소다.
따라서 PDK는 첫 번째 성분인 피루베이트 탈수소효소 복합체 규제에 참여한다. PDK와 화농산탈수소효소 복합체는 모두 진핵생물의 미토콘드리아 매트릭스에 위치한다. 이 복합체는 구연산 순환에서 피루바이트(시토솔에서 글리콜리시스 산물)를 아세틸-coA로 변환하는 작용을 하는데, 그 후 미토콘드리아에서 산화하여 에너지를 생산한다. PDK는 이 단지의 활동을 하향 조절함으로써 미토콘드리아 내 피루베이트 산화를 줄이고, 시토솔 내 피루베이트의 젖산염으로의 전환을 증가시킨다.
PDK의 반대 작용, 즉 피루베이트 탈수소효소의 탈인산화 및 활성화는 피루베이트 탈수소효소인산효소라고 하는 인포프로테이트 인산효소에 의해 촉매로 작용한다.
(피루베이트 탈수소효소안 된다 혼동해서는하는 Phosphoinoiside 의존성 키나아제-1과"PDK1"이라고도 키나아제는.)
인산화 부위
PDK는 세린 잔류물을 3개의 가능한 부위에서 화농산탈수소효소에 인산화시킬 수 있다. 현장 2와 3의 인산화 작용이 복합적인 비활성화에 작은 기여만 하는 반면, 현장 1의 인산화 작용은 거의 효소를 완전히 비활성화할 것이라는 일부 증거가 나타났다.[1] 따라서 화농산 탈수소효소 비활성화를 담당하는 것이 현장 1의 인산화다.
이소자메스
인간에게 알려진 PDK의 등소성에는 네 가지가 있다.
네 개의 이소자성 사이의 1차 염기서열은 70%의 아이덴티티로 보존된다. 가장 큰 차이는 N-terminus 근처에서 발생한다.[2]
잔류물은 PDK1이 436개로 가장 많고, 잔류물은 PDK2, PDK3, PDK4가 각각 407개, 406개, 411개다. 이소자임은 각 부위에서 서로 다른 활성도와 인산화율을 가진다. 현장 1에서 가장 빠른 것부터 가장 느린 것 순으로 PDK2 > PDK4 ≈ PDK1 > PDK3. 사이트 2의 경우, PDK3 > PDK4 > PDK2 > PDK1. PDK1만이 인산화 사이트 3을 사용할 수 있다. 그러나 이러한 활동은 pH의 미세한 변화에 민감하므로 PDK isozymes의 미세환경이 반응률을 변화시킬 수 있는 것으로 나타났다.[3][4]
Isozyme 풍부함 또한 조직마다 다른 것으로 나타났다. PDK1은 심장 세포가 풍부하다. PDK3는 고환이 가장 풍부하다. PDK2는 대부분의 조직에 존재하지만 비장과 폐세포가 낮다. PDK4는 주로 골격근과 심장조직에서 발견된다.[5]
메커니즘
화농산탈수소효소는 PDK에 의해 인산염화되면 비활성화된다. 일반적으로, 화농산 탈수소효소의 활성 부위는 수소 결합 네트워크에 의해 지원되고 안정화되고 순서가 정해진 순응 상태에 있다. 그러나 현장 1에서 PDK에 의한 인산염은 인산염 잔류물과 관련된 크기 증가와 음전하 둘 다로 인해 인근의 또 다른 세린 잔류물과 장력 충돌을 일으킨다.[6] 이것은 수소 결합 네트워크를 교란시키고 두 개의 인산화 루프의 순응을 방해한다. 이러한 루프는 환원성 아세틸화 단계를 방지하여 효소의 전반적인 활동을 중단시킨다.[7] 현장 2와 3에서 인산염에 대한 순응적 변화와 비활성화의 메커니즘은 현재로서는 알려져 있지 않다.
규정
Pyruvate 탈수소효소 키나아제는 ATP, NADH, 아세틸-CoA에 의해 활성화된다. ADP, NAD+, CoA-SH 및 피루베이트에 의해 억제된다.[9]
각각의 이소자임은 이러한 각각의 요인에 약간 다르게 반응한다. NADH는 PDK1 활동을 20%, PDK2 활동을 30% 자극한다. 아세틸-CoA를 함유한 NADH는 이들 효소의 활동을 각각 200%, 300%씩 증가시킨다. 유사한 조건에서 PDK3는 NADH에 응답하지 않으며 아세틸-CoA로 NADH에 의해 억제된다. PDK4는 NADH로 활동량이 200% 증가하지만 아세틸-CoA를 추가해도 활동이 더 늘어나지 않는다.[5]
질병 관련성
PDK isoforms는 비만, 당뇨병, 심부전, 암에서 증가된다.[10] 인슐린이 부족하거나 인슐린에 무감각한 세포가 PDK4를 과도하게 압박한다는 연구결과도 있다.[11] 그 결과 글리콜리시스로부터 형성된 화농산염은 산화될 수 없어 혈액 속 포도당을 효율적으로 사용할 수 없어 고혈당증으로 이어진다. 따라서 여러 가지 약물은 제2형 당뇨병을 치료하고자 하는 PDK4를 대상으로 한다.[12]
PDK1은 HIF-1의 존재로 저산소 암세포의 활성도가 높아진 것으로 나타났다. PDK1은 구연산 순환으로부터 피루베이트를 멀리하고 저산소 세포의 생기를 유지한다.[13] 따라서 PDK1은 이러한 암세포의 세포사멸을 예방하기 때문에 PDK1 억제가 항균요법으로 제안되어 왔다.[14] 마찬가지로 PDK3도 대장암 세포라인에서 과다압박된 것으로 나타났다.[15] 제안된 세 가지 억제제는 모두 PDK1에 바인딩되는 AZD7545와 디클로로아세테이트, PDK3에 바인딩되는 라디시콜이다.[16]
PDK3 유전자의 돌연변이는 X연계 Charcot-Marie-Tooth 질병(CMTX6)의 희귀한 원인이다.[17][18]
특히 도베르만 핀처스 개에서 PDK4 유전자의 돌연변이는 확장 심근병증(DCM)과 관련이 있다.[19][20][21]
참조
- ^ Yeaman SJ, Hutcheson ET, Roche TE, Pettit FH, Brown JR, Reed LJ, Watson DC, Dixon GH (June 1978). "Sites of phosphorylation on pyruvate dehydrogenase from bovine kidney and heart". Biochemistry. 17 (12): 2364–70. doi:10.1021/bi00605a017. PMID 678513.
- ^ Popov KM, Kedishvili NY, Zhao Y, Gudi R, Harris RA (November 1994). "Molecular cloning of the p45 subunit of pyruvate dehydrogenase kinase". The Journal of Biological Chemistry. 269 (47): 29720–4. PMID 7961963.
- ^ Korotchkina LG, Patel MS (October 2001). "Site specificity of four pyruvate dehydrogenase kinase isoenzymes toward the three phosphorylation sites of human pyruvate dehydrogenase". The Journal of Biological Chemistry. 276 (40): 37223–9. doi:10.1074/jbc.M103069200. PMID 11486000.
- ^ Kolobova E, Tuganova A, Boulatnikov I, Popov KM (August 2001). "Regulation of pyruvate dehydrogenase activity through phosphorylation at multiple sites". The Biochemical Journal. 358 (Pt 1): 69–77. doi:10.1042/0264-6021:3580069. PMC 1222033. PMID 11485553.
- ^ a b Bowker-Kinley MM, Davis WI, Wu P, Harris RA, Popov KM (January 1998). "Evidence for existence of tissue-specific regulation of the mammalian pyruvate dehydrogenase complex". The Biochemical Journal. 329 (1): 191–6. doi:10.1042/bj3290191. PMC 1219031. PMID 9405293.
- ^ Korotchkina LG, Patel MS (February 2001). "Probing the mechanism of inactivation of human pyruvate dehydrogenase by phosphorylation of three sites". The Journal of Biological Chemistry. 276 (8): 5731–8. doi:10.1074/jbc.M007558200. PMID 11092882.
- ^ Kato M, Wynn RM, Chuang JL, Tso SC, Machius M, Li J, Chuang DT (December 2008). "Structural basis for inactivation of the human pyruvate dehydrogenase complex by phosphorylation: role of disordered phosphorylation loops". Structure. 16 (12): 1849–59. doi:10.1016/j.str.2008.10.010. PMC 2849990. PMID 19081061.
- ^ Roche TE, Reed LJ (August 1974). "Monovalent cation requirement for ADP inhibition of pyruvate dehydrogenase kinase". Biochemical and Biophysical Research Communications. 59 (4): 1341–8. doi:10.1016/0006-291X(74)90461-6. PMID 4370205.
- ^ Sugden MC, Holness MJ (May 2003). "Recent advances in mechanisms regulating glucose oxidation at the level of the pyruvate dehydrogenase complex by PDKs". American Journal of Physiology. Endocrinology and Metabolism. 284 (5): E855-62. doi:10.1152/ajpendo.00526.2002. PMID 12676647.
- ^ Park S, Jeon JH, Lee IK (2018). "Role of the Pyruvate Dehydrogenase Complex in Metabolic Remodeling: Differential Pyruvate Dehydrogenase Complex Functions in Metabolism". Diabetes Medical Journal. 42 (4): 270–281. doi:10.4093/dmj.2018.0101. PMC 6107359. PMID 30136450.
- ^ Majer M, Popov KM, Harris RA, Bogardus C, Prochazka M (October 1998). "Insulin downregulates pyruvate dehydrogenase kinase (PDK) mRNA: potential mechanism contributing to increased lipid oxidation in insulin-resistant subjects". Molecular Genetics and Metabolism. 65 (2): 181–6. doi:10.1006/mgme.1998.2748. PMID 9787110.
- ^ Holness MJ, Sugden MC (December 2003). "Regulation of pyruvate dehydrogenase complex activity by reversible phosphorylation". Biochemical Society Transactions. 31 (Pt 6): 1143–51. doi:10.1042/bst0311143. PMID 14641014.
- ^ Kim JW, Tchernyshyov I, Semenza GL, Dang CV (March 2006). "HIF-1-mediated expression of pyruvate dehydrogenase kinase: a metabolic switch required for cellular adaptation to hypoxia". Cell Metabolism. 3 (3): 177–85. doi:10.1016/j.cmet.2006.02.002. PMID 16517405.
- ^ Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B, Michelakis ED (January 2007). "A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth". Cancer Cell. 11 (1): 37–51. doi:10.1016/j.ccr.2006.10.020. PMID 17222789.
- ^ Lu CW, Lin SC, Chien CW, Lin SC, Lee CT, Lin BW, Lee JC, Tsai SJ (September 2011). "Overexpression of pyruvate dehydrogenase kinase 3 increases drug resistance and early recurrence in colon cancer". The American Journal of Pathology. 179 (3): 1405–14. doi:10.1016/j.ajpath.2011.05.050. PMC 3157210. PMID 21763680.
- ^ Kato M, Li J, Chuang JL, Chuang DT (August 2007). "Distinct structural mechanisms for inhibition of pyruvate dehydrogenase kinase isoforms by AZD7545, dichloroacetate, and radicicol". Structure. 15 (8): 992–1004. doi:10.1016/j.str.2007.07.001. PMC 2871385. PMID 17683942.
- ^ 온라인 멘델리언 인 맨드 인 맨드(OMIM): 샤르코마리투스병, X연계 우성, 6; CMTX6 - 300905
- ^ Kennerson ML, Yiu EM, Chuang DT, Kidambi A, Tso SC, Ly C, Chaudhry R, Drew AP, Rance G, Delatycki MB, Züchner S, Ryan MM, Nicholson GA (April 2013). "A new locus for X-linked dominant Charcot-Marie-Tooth disease (CMTX6) is caused by mutations in the pyruvate dehydrogenase kinase isoenzyme 3 (PDK3) gene". Human Molecular Genetics. 22 (7): 1404–16. doi:10.1093/hmg/dds557. PMC 3596851. PMID 23297365.
- ^ Bolfer L, Estrada AH, Larkin C, Conlon TJ, Lourenco F, Taggart K, et al. (March 2020). "Functional Consequences of PDK4 Deficiency in Doberman Pinscher Fibroblasts". Scientific Reports. 10 (1): 3930. doi:10.1038/s41598-020-60879-6. PMC 7054397. PMID 32127618.
- ^ Taggart K, Estrada A, Thompson P, Lourenco F, Kirmani S, Suzuki-Hatano S, Pacak CA (2017). "PDK4 Deficiency Induces Intrinsic Apoptosis in Response to Starvation in Fibroblasts from Doberman Pinschers with Dilated Cardiomyopathy". BioResearch Open Access. 6 (1): 182–191. doi:10.1089/biores.2017.0023. PMC 5745584. PMID 29285418.
- ^ Meurs KM, Lahmers S, Keene BW, White SN, Oyama MA, Mauceli E, Lindblad-Toh K (August 2012). "A splice site mutation in a gene encoding for PDK4, a mitochondrial protein, is associated with the development of dilated cardiomyopathy in the Doberman pinscher". Human Genetics. 131 (8): 1319–25. doi:10.1007/s00439-012-1158-2. PMID 22447147.
외부 링크
- 미국 국립 의학 도서관의 피루베이트+탈수소효소+키나아제(MesH)
- EC 2.7.11.2