포스파티딜타놀라민
Phosphatidylethanolamine포스파티딜타놀라민(PE)은 생물학적 [1]막에서 발견되는 인지질의 한 종류이다.이들은 디글리세라이드에 시티딘 이인산 에탄올아민을 첨가하여 합성되어 시티딘 일인산을 방출한다.S-아데노실메티오닌은 이어서 포스파티딜에탄올아민의 아민을 메틸화하여 포스파티딜콜린을 생성할 수 있다.
기능.
세포내
포스파티딜타놀아민은 모든 살아있는 세포에서 발견되며, 모든 인지질의 25%를 구성한다.인간의 생리학에서, 그것들은 특히 뇌, 신경, 신경 조직과 같은 신경 조직과 모든 인지질의 [2]45%를 차지하는 척수에서 발견됩니다.
포스파티딜타놀아민은 세포분열 [3]시 세포융합 및 수축고리 분해에 관여한다.또한 포스파티딜타놀라민은 막의 곡률을 조절하는 것으로 생각된다.포스파티딜타놀라민은 여러 생물학적 [2]경로에서 중요한 전구체, 기질 또는 공여체이다.
극성 헤드군으로서 포스파티딜타놀아민은 포스파티딜콜린에 비해 점성이 높은 지질막을 형성한다.예를 들어 디-올레오일-포스파티딜타놀아민의 용해온도는 -16℃, 디-올레오일-포스파티딜콜린의 용해온도는 -20℃이다.지질에 두 개의 팔미토일 사슬이 있을 경우 포스파티딜타놀라민은 63°C에서 녹는 반면 포스파티딜콜린은 이미 41°[4]C에서 녹는다.간단히 말해 용해 온도가 낮을수록 유동성 막이 많아집니다.
인간에게는
인간의 경우, 포스파티딜타놀라민의 신진대사는 심장에서 중요한 것으로 여겨진다.심장으로의 혈류가 제한되면 막전단 사이의 포스파티딜레타놀라민의 비대칭 분포가 흐트러지고 그 결과 막이 흐트러진다.또한 포스파티딜타놀라민은 간에서 리포단백질 분비에 관여한다.골지 기구에서 나오는 초저밀도 리포단백질 분비를 위한 소포는 초저밀도 리포단백질을 [5]포함한 다른 소포에 비해 포스파티딜로라민 농도가 현저히 높기 때문이다.포스파티딜레타놀라민은 또한 단백질이나 핵산의 도움 없이 전염성 프리온을 번식시킬 수 있는 것으로 나타났는데, 이것은 그것의 [6]독특한 특징이다.포스파티딜타놀아민은 또한 프로트롬빈으로부터 [7]트롬빈 형성을 촉매하는 두 단백질인 인자 V와 인자 X에 대한 결합을 촉진함으로써 트롬빈 형성의 속도를 증가시키기 위해 포스파티딜세린과 함께 작용하기 때문에 혈액 응고에 역할을 하는 것으로 생각된다.엔도카나비노이드 아난다미드는 포스파티딜타놀아민으로부터 N-아세틸전달효소 및 포스폴리파아제-D의 [8]2가지 효소의 연속 작용에 의해 합성된다.
세균내
동물에서 포스파티딜콜린이 주요 인지질인 경우, 포스파티딜레타놀라민은 박테리아에서 주요 인지질입니다.세균막에서 포스파티딜타놀라민의 주요 역할 중 하나는 음이온막 인지질에 의해 야기되는 음전하를 확산시키는 것이다.대장균에서 포스파티딜타놀라민은 유당이 세포로 활발하게 침투하는 것을 지원하는 역할을 하며, 다른 수송 시스템에서도 역할을 할 수 있다.포스파티딜타놀라민은 유당투과효소 및 다른 막 단백질의 결합에 역할을 한다.그것은 막 단백질이 3차 구조를 올바르게 접어서 적절하게 기능할 수 있도록 돕는 '보호자' 역할을 한다.포스파티딜타놀라민이 존재하지 않을 때, 수송 단백질은 잘못된 3차 구조를 가지고 있고 올바르게 [9]기능하지 않습니다.
포스파티딜타놀라민은 또한 박테리아 다제 운반체가 적절하게 기능할 수 있도록 하며 운반체가 적절하게 개폐되는 [10]데 필요한 중간체의 형성을 가능하게 한다.
구조.
레시틴으로서 포스파티딜레타놀아민은 에스테르화된 글리세롤과 2가지 지방산과 인산과의 조합으로 이루어진다.인산기는 포스파티딜콜린에서 콜린과 결합되는 반면 포스파티딜레타놀아민에서 에탄올아민과 결합된다.두 지방산은 같거나 다를 수 있으며, 일반적으로 1,2 위치에 있습니다(단, 1,3 위치에 있을 수 있음).
합성
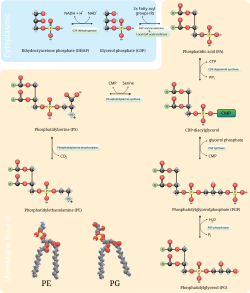
포스파티딜세린 탈탄산화 경로와 시티딘2인산-에탄올아민 경로는 포스파티딜레탄올아민을 합성하는 데 사용된다.포스파티딜세린 탈탄산화효소는 첫 번째 경로에서 포스파티딜세린을 탈탄산시키는 데 사용되는 효소이다.포스파티딜세린 탈탄산화 경로는 미토콘드리아 막에서 포스파티딜레탄올아민의 주요 합성원이다.미토콘드리아 막에서 생성된 포스파티딜레타놀라민은 또한 사용을 위해 세포 전체를 통해 다른 막으로 운반된다.포스파티딜콜린 합성을 미러링하는 공정에서 에탄올아민을 기질로 하여 시티딘2인산-에탄올아민 경로를 통해 포스파티딜레탄올아민을 생성한다.세포질 및 소포체 양쪽에서 일어나는 여러 단계를 통해 합성 경로는 포스파티딜레타놀라민의 [11]최종 산물을 생성한다.포스파티딜레타놀라민은 콩 또는 달걀 레시틴에도 풍부하게 함유되어 있으며 크로마토그래피 분리를 이용하여 상업적으로 생산된다.
규정
포스파티딜세린 탈탄산화 경로를 통한 포스파티딜타놀라민의 합성은 미토콘드리아 내막에서 빠르게 일어난다.단, 포스파티딜세린은 소포체에서 만들어진다.이 때문에, 포스파티딜세린의 소포체에서 미토콘드리아막으로, 그리고 나서 내미토콘드리아막으로의 수송은 이 경로를 통한 합성 속도를 제한한다.이 전달의 메커니즘은 현재 알려져 있지 않지만 이 [12]경로에서 합성 속도의 조절에 역할을 할 수 있다.
음식에서의 존재감, 건강 문제
식품 중의 포스파티딜레타놀라민은 마이야르 [13]반응의 일부로서 포스파티딜레타놀라민과 연결된 아마도리 제품을 형성하기 위해 분해됩니다.이러한 생성물은 막 지질 과산화 작용을 가속화하여 [14]그들과 접촉하는 세포에 산화적 스트레스를 일으킨다.산화 스트레스는 음식 열화와 여러 가지 질병을 일으키는 것으로 알려져 있다.초콜릿, 두유, 영아용 조제 분유, 그리고 다른 가공 식품과 같은 다양한 식품에서 상당한 수준의 아마도리-포스파티딜레탄올라민 제품이 발견되었습니다.아마도리-포스파티딜레탄올아민 제품의 수치는 높은 지질과 설탕 농도를 가진 가공 [13]온도가 높은 식품에서 더 높습니다.추가적인 연구는 아마도리-포스파티딜레타놀라민이 혈관 [15]질환에 영향을 미칠 수 있고, 당뇨병이 [16]암 발병률을 증가시킬 수 있는 메커니즘으로 작용하며, 잠재적으로 다른 질병에도 영향을 미칠 수 있다는 것을 발견했다.아마도리-포스파티딜레타놀라민은 당뇨병 환자에서 건강한 사람보다 혈장 농도가 더 높으며, 이는 당뇨병 발병의 한 역할을 하거나 질병의 [17]산물일 수 있음을 나타낸다.
「 」를 참조해 주세요.
레퍼런스
- ^ Wellner, Niels; Diep, Thi Ai; Janfelt, Christian; Hansen, Harald Severin (2012). "N-acylation of phosphatidylethanolamine and its biological functions in mammals". Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1831 (3): 652–62. doi:10.1016/j.bbalip.2012.08.019. PMID 23000428.
- ^ a b Vance, Jean E.; Tasseva, Guergana (2012). "Formation and function of phosphatidylserine and phosphatidylethanolamine in mammalian cells". Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1831 (3): 543–54. doi:10.1016/j.bbalip.2012.08.016. PMID 22960354.
- ^ Emoto, K.; Kobayashi, T; Yamaji, A; Aizawa, H; Yahara, I; Inoue, K; Umeda, M (1996). "Redistribution of phosphatidylethanolamine at the cleavage furrow of dividing cells during cytokinesis". Proceedings of the National Academy of Sciences. 93 (23): 12867–72. Bibcode:1996PNAS...9312867E. doi:10.1073/pnas.93.23.12867. JSTOR 40713. PMC 24012. PMID 8917511.
- ^ Wan 등의 참조를 참조해 주세요.생화학 47 2008[verification needed]
- ^ Vance, J. E. (2008). "Thematic Review Series: Glycerolipids. Phosphatidylserine and phosphatidylethanolamine in mammalian cells: Two metabolically related aminophospholipids". The Journal of Lipid Research. 49 (7): 1377–87. doi:10.1194/jlr.R700020-JLR200. PMID 18204094.
- ^ Deleault, N. R.; Piro, J. R.; Walsh, D. J.; Wang, F.; Ma, J.; Geoghegan, J. C.; Supattapone, S. (2012). "Isolation of phosphatidylethanolamine as a solitary cofactor for prion formation in the absence of nucleic acids". Proceedings of the National Academy of Sciences. 109 (22): 8546–51. Bibcode:2012PNAS..109.8546D. doi:10.1073/pnas.1204498109. PMC 3365173. PMID 22586108.
- ^ Majumder, R.; Liang, X.; Quinn-Allen, M. A.; Kane, W. H.; Lentz, B. R. (2011). "Modulation of Prothrombinase Assembly and Activity by Phosphatidylethanolamine". Journal of Biological Chemistry. 286 (41): 35535–42. doi:10.1074/jbc.M111.260141. PMC 3195639. PMID 21859710.
- ^ Isidro, F. (2014). "Cannabinoids for treatment of Alzheimer's disease: moving toward the clinic". Frontiers in Pharmacology. 5: 37. doi:10.3389/fphar.2014.00037. PMC 3942876. PMID 24634659.
- ^ Christie, W.W. (April 16, 2012). "Phosphatidylethanolamine and Related Lipids". The AOCS Lipid Library. Archived from the original on August 21, 2012. Retrieved September 3, 2012.
- ^ Gbaguidi, B.; Hakizimana, P.; Vandenbussche, G.; Ruysschaert, J.-M. (2007). "Conformational changes in a bacterial multidrug transporter are phosphatidylethanolamine-dependent". Cellular and Molecular Life Sciences. 64 (12): 1571–82. doi:10.1007/s00018-007-7031-0. PMID 17530171. S2CID 2078590.
- ^ Kelly, Karen (July 28, 2011). "Phospholipid Biosynthesis". The AOCS Lipid Library. Retrieved September 3, 2012.
- ^ Kuge, Osamu; Nishijima, Masahiro (1 April 2003). "Biosynthetic Regulation and Intracellular Transport of phosphatidylserine in Mammalian Cells". The Journal of Biochemistry. 133 (4): 397–403. doi:10.1093/jb/mvg052. PMID 12761285. Archived from the original on 30 January 2021. Retrieved 30 January 2021.
- ^ a b Oak, Jeong-Ho; Nakagawa, Kiyotaka; Miyazawa, Teruo (2002). "UV analysis of Amadori-glycated phosphatidylethanolamine in foods and biological samples". The Journal of Lipid Research. 43 (3): 523–9. doi:10.1016/S0022-2275(20)30158-9. PMID 11893788.
- ^ Oak, Jeong-Ho; Nakagawa, Kiyotaka; Miyazawa, Teruo (2000). "Synthetically prepared Amadori-glycated phosphatidylethanolamine can trigger lipid peroxidation via free radical reactions". FEBS Letters. 481 (1): 26–30. doi:10.1016/S0014-5793(00)01966-9. PMID 10984609. S2CID 23265125.
- ^ Oak, Jeong-Ho; Nakagawa, Kiyotaka; Oikawa, Shinichi; Miyazawa, Teruo (2003). "Amadori-glycated phosphatidylethanolamine induces angiogenic differentiations in cultured human umbilical vein endothelial cells". FEBS Letters. 555 (2): 419–23. doi:10.1016/S0014-5793(03)01237-7. PMID 14644453. S2CID 33974755.
- ^ Eitsuka, Takahiro; Nakagawa, Kiyotaka; Ono, Yuichi; Tatewaki, Naoto; Nishida, Hiroshi; Kurata, Tadao; Shoji, Naoki; Miyazawa, Teruo (2012). "Amadori-glycated phosphatidylethanolamine up-regulates telomerase activity in PANC-1 human pancreatic carcinoma cells". FEBS Letters. 586 (16): 2542–7. doi:10.1016/j.febslet.2012.06.027. PMID 22750441. S2CID 5452160.
- ^ Ariizumi, Ken; Koike, T; Ohara, S; Inomata, Y; Abe, Y; Iijima, K; Imatani, A; Oka, T; Shimosegawa, T (2008). "Incidence of reflux esophagitis and H pylori infection in diabetic patients". World Journal of Gastroenterology. 14 (20): 3212–7. doi:10.3748/wjg.14.3212. PMC 2712855. PMID 18506928.
외부 링크
- 미국 국립 의학 도서관(MeSH)의 포스파티딜레타놀아민
- AOCS 지질 라이브러리의 포스파티딜레타놀라민.