지질 빌라이어
Lipid bilayer
지질빌라이어(또는 인지질빌라이어)는 두 겹의 지질 분자로 이루어진 얇은 극막이다.이 막들은 모든 세포 주위에 연속적인 장벽을 형성하는 평평한 시트들이다.거의 모든 유기체의 세포막과 많은 바이러스는 세포핵을 둘러싸고 있는 핵막과 마찬가지로 지질 빌레이어로 만들어지고 세포 안에 있는 막으로 묶인 오르간젤의 세포막도 만들어진다.지질빌레이어는 이온, 단백질 및 기타 분자가 필요한 곳에 보관하고 있으면 안 되는 영역으로 확산되는 것을 방지하는 장벽이다.지질 빌리버는 대부분의 수용성(수분자) 분자에게 불침투성이기 때문에 폭이 [1]몇 나노미터에 불과하지만 이 역할에 이상적으로 적합하다.빌레이어는 특히 이온에 불침투성이 강해 세포가 이온펌프라는 단백질을 이용해 세포막을 가로질러 이온을 운반해 염분농도와 pH를 조절할 수 있다.
생물학적 빌레이어는 보통 두 개의 지방산 체인으로 구성된 소수성 인산염 머리와 소수성 꼬리를 가진 앰프힐릭 인산염으로 구성된다.특정한 머리 그룹을 가진 인광물질은 빌레이어의 표면 화학작용을 바꿀 수 있으며, 예를 들어 세포막에 있는 다른 분자들의 "앵커"뿐만 아니라 신호의 역할도 할 수 있다.[2]머리와 마찬가지로 지질의 꼬리는 예를 들어 빌레이어의 위상을 결정함으로써 멤브레인 특성에 영향을 줄 수 있다.빌레이어는 낮은 온도에서 고체 젤 위상 상태를 채택할 수 있지만 높은 온도에서 유체 상태로 단계 전환을 겪을 수 있으며, 지질 꼬리의 화학적 특성이 이러한 온도가 어떤 온도에서 발생하는지에 영향을 미친다.빌레이어 내 지질의 포장도 스트레칭과 굽힘에 대한 저항성을 포함한 기계적 특성에 영향을 미친다.이러한 특성들 중 많은 것들이 실험실에서 생산된 인공 "모델" 빌레이어를 사용하여 연구되었다.모델 빌라이어들이 만든 베시클은 또한 약을 전달하기 위해 임상적으로 사용되어 왔다.
생물학적 막의 구조는 일반적으로 빌레이어를 구성하는 인지질 외에도 몇 가지 유형의 분자를 포함한다.동물세포에서 특히 중요한 예로는 콜레스테롤이 있는데, 콜레스테롤은 빌레이어 강화와 투과성 저하에 도움을 준다.콜레스테롤은 또한 특정 적분막 단백질의 활동을 조절하는데 도움을 준다.적분막 단백질은 지질 빌레이어에 통합될 때 기능하며, 환형 지질 껍질의 도움을 받아 지질 빌레이어에 단단히 고정된다.빌레이어들은 세포와 그 구획의 경계를 정의하기 때문에, 이러한 막 단백질은 많은 세포간 및 세포간 신호과정에 관여한다.어떤 종류의 막 단백질이 두 빌레이어를 함께 융합하는 과정에 관여한다.이 융합은 정자에 의한 난자의 수정이나 세포로의 바이러스의 침입 중 아크로솜 반응에서와 같이 두 개의 뚜렷한 구조를 결합할 수 있게 한다.지질 빌리지는 전통 현미경에서 깨지기 쉽고 보이지 않기 때문에 연구해야 할 과제다.빌레이어 실험은 전자현미경이나 원자력현미경처럼 진보된 기술을 필요로 하는 경우가 많다.
구조 및 조직
인산염은 물에 노출되면 수성 꼬리가 시트 중앙을 향하도록 하여 2층 시트로 자체 조립한다.이 배열은 각각 단일 분자층인 두 개의 "잎"을 낳는다.이 빌레이어의 중심은 거의 물을 포함하지 않고 물에 녹는 설탕이나 소금과 같은 분자를 제외한다.조립 과정은 소수성 분자 사이의 상호작용(수소성 효과라고도 한다)에 의해 추진된다.소수성 분자 사이의 상호작용의 증가는 물 분자가 서로 더 자유롭게 결합할 수 있게 하여 시스템의[citation needed] 엔트로피를 증가시킨다.이 복잡한 과정에는 반 데르 발스 힘, 정전기 및 수소 결합과 같은 비균등 상호작용이 포함된다.
단면분석

지질의 빌레이어는 측면 치수에 비해 매우 얇다.일반적인 포유류 세포(지름 약 10마이크로미터)를 수박 크기(약 1ft/30cm)로 확대하면 플라즈마 막을 구성하는 지질 빌레이어는 사무용지 한 장 정도 두께가 될 것이다.두께는 불과 몇 나노미터에 불과하지만 빌레이어는 단면 전체에 걸쳐 몇 개의 뚜렷한 화학적 영역으로 구성되어 있다.이러한 지역과 주변 물과의 상호작용은 지난 수십 년간 X선 반사측정법,[4] 중성자 산란법[5], 핵자기공명법을 통해 특징지어져 왔다.
빌레이어 양쪽에 있는 첫 번째 부위는 친수성 헤드 그룹이다.막의 이 부분은 완전히 수분을 공급하며 일반적으로 두께가 0.8-0.9nm 정도 된다.인산염 빌레이어에서는 인산염 그룹이 소수성 코어 바깥 약 0.5 nm의 이 수화 영역 내에 위치한다.[6]어떤 경우에는 수화 부위가 훨씬 더 확장될 수 있는데, 예를 들어, 머리에 큰 단백질이 있거나 긴 설탕 사슬이 이식된 지질에서 그렇다.자연에서 이러한 변화를 보여주는 일반적인 예로는 박테리아 외막에 있는 리포폴리스 당류 외투를 들 수 있는데,[7] 이것은 탈수증을 예방하기 위해 박테리아 주위에 수분층을 유지하는 것을 돕는다.

수분이 많은 지역 옆에는 부분적으로만 수분이 공급되는 중간 지역이 있다.이 경계층은 약 0.3 nm 두께다.이 짧은 거리 내에, 물 농도는 그룹 쪽의 2M에서 꼬리 쪽(핵심)의 0에 가까운 수준으로 떨어진다.[8][9]빌레이어의 소수성 코어는 일반적으로 3-4 nm 두께이지만, 이 값은 체인 길이와 화학에 따라 다르다.[4][10]코어 두께도 온도에 따라 크게 달라지며, 특히 위상 전환에 가깝다.[11]
비대칭
자연적으로 발생하는 많은 빌레이저에서 내막전단과 외막전단의 구성은 다르다.인간의 적혈구에서 내부(사이토플라즘) 전단은 대부분 인산염(phosphatyltanolamine), 인산염(phosphatidylserine), 인산염(phosphatidylinositol)과 그 인산염 유도체로 구성되어 있다.이와는 대조적으로 외측(외측) 전단은 인산염, 스핑고멜린, 그리고 다양한 글리콜리피드를 기반으로 한다.[12][13][14]어떤 경우에는, 이러한 비대칭은 세포 내에서 지질들이 만들어지는 곳에 기초하여 초기 방향을 반영한다.[15]지질 비대칭의 생물학적 기능은 여러 가지 다른 상황에서 사용되고 있는 것이 분명하지만 불완전하게 이해되고 있다.예를 들어 세포가 세포사멸을 겪을 때 일반적으로 세포질 전단에 국소화된 인산염 세린은 외부 표면으로 전달된다.그곳에서, 그것은 대식세포에 의해 인식되어져 죽어가는 세포를 적극적으로 청소한다.
지질 비대칭은, 적어도 부분적으로는, 대부분의 인지질들이 합성되어 초기에는 내측 모놀레이어에 삽입된다는 사실로부터 발생한다: 외측 모놀레이저를 구성하는 것들은, 그런 다음 전편이라고 불리는 효소의 종류에 의해 내측 모놀레이저로부터 운반된다.[16][17]스핑고멜린과 같은 다른 지질은 외부 전단지에 합성된 것으로 보인다.플립파아제는 지질을 반대 방향으로 전달하는 플로피아제(floppases)와 지질 빌레이어(apoptotic cells)에 걸쳐 지질 분포를 랜덤화하는 스크램블라제(scramlases)를 포함하는 더 큰 지질의 운반 분자의 구성원이다.어쨌든 일단 지질 비대칭이 성립되면 전단 사이에 있는 지질의 자발적인 플립플립이 극히 느리기 때문에 일반적으로는 빨리 소멸되지 않는다.[18]
모델 빌라이어 시스템에서는 실험실에서 이러한 비대칭성을 모방하는 것이 가능하다.비록 이 비대칭이 생성되는 메커니즘은 세포의 그것과 매우 다르지만, 어떤 종류의 매우 작은 인공 방광은 자동적으로 약간 비대칭되게 만들 것이다.[19]Langmuir-Blodgett 증착의[20] 서로 다른 두 개의 모노레이어를 활용하거나 Langmuir-Blodgett과 Vesicle 파열 증착의[21] 조합으로 비대칭 평면 빌레이어를 합성하는 것도 가능하다.이 비대칭성은 시간이 지남에 따라 손실될 수 있다. 왜냐하면 지지되는 빌레이어의 지질은 뒤집히기 쉽다.[22]
위상 및 위상 전환
주어진 온도에서 지질 빌리지는 액체 또는 젤 (고체) 상으로 존재할 수 있다.모든 지질에는 젤에서 액체 단계로 이행(멜트)하는 특성 온도가 있다.두 단계 모두에서 지질 분자는 빌레이어 전체에서 뒤집히는 것을 방지하지만 액체 위상 빌레이어에서는 주어진 지질 분자가 1초에 수백만 번 이웃과 위치를 교환한다.이 무작위 보행 교환은 지질 분산을 가능하게 하여 막의 표면을 떠돌게 한다.[23]액체 위상 빌레이어와 달리, 젤 위 빌레이어의 지질들은 이동성이 적다.
지질 빌리더의 위상 행동은 주로 인접한 지질 분자 사이의 매력적인 반 데르 발 상호 작용의 강도에 의해 결정된다.긴꼬리 지질은 상호작용할 영역을 더 많이 가지고 있어 이 상호작용의 강도를 증가시키고 결과적으로 지질 이동성을 감소시킨다.따라서 주어진 온도에서 짧은꼬리지질은 다른 동일한 긴꼬리지질보다 더 유동적일 것이다.[10]전환 온도는 또한 지질 꼬리의 미숙성의 정도에 의해 영향을 받을 수 있다.불포화 이중 결합은 알칸 체인에 꼬임 현상을 일으켜 지질 패킹을 방해할 수 있다.이러한 혼란은 빌레이어 내에 추가적인 여유 공간을 만들어 인접 체인에 추가적인 유연성을 허용한다.[10]이런 효과의 한 예는 일상생활에서 주목받을 수 있는 것은 포화지방 비율이 높은 버터가 상온에서 고체인 반면, 대부분 불포화 상태인 식물성 기름은 액체인 것이다.
대부분의 자연막은 서로 다른 지질 분자의 복잡한 혼합물이다.일부 성분이 주어진 온도에서 액체인 반면 다른 성분이 젤 단계에 있다면, 두 단계가 바다에 떠 있는 빙산처럼 공간적으로 분리된 지역에서 공존할 수 있다.이 위상 분리는 단백질과 같은 막 구성 요소가 한 위상 또는 다른 위상으로[24] 분할되어 국소적으로 집중되거나 활성화될 수 있기 때문에 생화학 현상에 중요한 역할을 한다.많은 혼합 위상 시스템에서 특히 중요한 요소 중 하나는 콜레스테롤인데, 콜레스테롤은 빌라이어 투과성, 기계적 강도, 생화학적 상호작용을 조절한다.
표면화학
지질 꼬리는 주로 빌라이어 위상 행동을 조절하지만 빌라이어 표면 화학 작용을 결정하는 것은 헤드그룹이다.대부분의 천연 빌레이저는 주로 인산염으로 구성되지만, 스핑올리피드와 콜레스테롤 같은 스테롤도 중요한 성분이다.[25]인산염 중 가장 흔한 종괴는 인산염(PC)으로 대부분의 포유류 세포에서 인산염의 약 절반을 차지한다.[26]PC는 zwitterionic 헤드그룹으로 인산염 그룹에는 음전하가 있고 아민 그룹에는 양전하가 있지만, 이러한 국소전하가 균형을 이루고 있기 때문에 순전하가 없다.
다른 헤드 그룹도 다양한 수준으로 존재하며, 인산염(PS) 인산염(PE)과 인산염(PG)을 포함할 수 있다.이러한 대체 헤드 그룹은 종종 문맥 의존도가 높은 특정 생물학적 기능성을 부여한다.예를 들어 적혈구의 세포외막 표면에 PS가 존재한다는 것은 세포사멸의 표식인 [27]반면 성장판 vesicle에 PS가 존재한다는 것은 히드록사파타이트 결정의 핵화와 그에 따른 골광화를 위해 필요하다.[28][29]PC와 달리, 다른 몇몇 그룹들은 순전하를 가지고 있는데, 이것은 빌레이어와 작은 분자의 정전기 상호작용을 바꿀 수 있다.[30]
생물학적 역할
격납 및 분리
생물학에서 지질 빌레이어의 주된 역할은 수성 구획을 주변으로부터 분리하는 것이다."비자아"에서 "자아"를 묘사하는 어떤 형태의 장벽이 없다면, 유기체나 생명의 개념조차 정의하기 어렵다.이 장벽은 특별히 변형된 지질 단층재를 이용하는 몇 종의 고고자를 제외한 모든 알려진 생명체 형태에서 지질 빌레이어의 형태를 취한다.[7]생물의 첫 번째 형태는 사실상 유일한 생합성 능력을 가진 단순한 지질 vesicle일 수도 있다는 제안까지 나왔다. 더 많은 인산염의 생산이다.[31]지질 빌리더의 분할 능력은 아래 빌레이어를 가로지르는 운송에서 논의한 바와 같이 친수성 빌라이어 코어를 친수성 분자가 쉽게 건널 수 없다는 사실에 기초한다.핵, 미토콘드리아, 엽록체에는 두 개의 지질 빌레이어가 있는 반면, 다른 아세포 구조물은 하나의 지질 빌라이어(플라즈마막, 내포성 망막, 골지 기구, 리소솜 등)로 둘러싸여 있다.오르가넬을 보라.[32]
원핵생물에는 오직 하나의 지질 빌레이어, 즉 세포막(플라즈마막이라고도 한다)만 있다.많은 원핵생물들도 세포벽을 가지고 있지만 세포벽은 지질이 아닌 단백질이나 긴 사슬 탄수화물로 구성되어 있다.이와는 대조적으로 진핵은 핵, 미토콘드리아, 라이소솜, 내포체성 망막 등을 포함한 다양한 종류의 장기를 가지고 있다.이러한 모든 하위 세포 구획은 하나 이상의 지질 빌레이어로 둘러싸여 있으며, 일반적으로 셀에 존재하는 빌레이어 영역의 대부분을 차지한다.예를 들어 간간세포에서 혈장막은 세포의 총 빌레이어 면적의 2%에 불과한 반면, 소포체 망막은 50% 이상, 미토콘드리아는 30% 이상을 함유하고 있다.[33]
신호
아마도 세포 신호의 가장 친숙한 형태는 시냅스 전달인데, 한 뉴런의 끝에 도달한 신경 자극이 신경전달물질의 방출을 통해 인접한 뉴런으로 전달된다.이 전송은 방출되는 신경전달물질에 탑재된 시냅스 vesicle의 작용에 의해 가능하다.이 배실체는 사전 시냅스 단자의 세포막과 융합되어 그 내용물을 세포의 외부에 방출한다.그런 다음 콘텐츠는 시냅스를 통해 시냅스 후 단자로 확산된다.
지질 빌리지는 또한 세포막 단백질의 본거지 역할을 통해 신호 전달에 관여한다.이것은 극도로 광범위하고 중요한 생물분자 종류다.인간 단백질의 3분의 1까지가 막 단백질인 것으로 추정된다.[34]이 단백질들 중 일부는 세포막의 외부와 연결되어 있다.그 예로 CD59 단백질이 있는데, 이것은 세포를 "자기"로 식별하여 면역체계에 의한 파괴를 억제한다.HIV 바이러스는 숙주 막에서 자신의 표면으로 이 단백질들을 이식함으로써 부분적으로 면역체계를 피한다.[33]또는 일부 막 단백질은 빌레이어를 통해 침투하여 개별 신호 이벤트를 세포 외부에서 내부로 전달하는 역할을 한다.이러한 유형의 단백질 중 가장 흔한 종류는 GPCR이다. GPCR은 세포의 주변 감지 능력의 상당 부분을 담당하며, 이러한 중요한 역할 때문에, 모든 현대 약물의 약 40%가 GPCR을 대상으로 한다.[35]
단백질과 용액 매개 공정 외에도 지질 빌리머가 신호에 직접 참여하는 것도 가능하다.이것의 전형적인 예로는 인산염으로 촉발된 파글로시토시스(Phosphidylserine-triggered pagocytosis이다.일반적으로 인산염은 세포막에 비대칭적으로 분포하며 내부에만 존재한다.프로그래밍된 세포가 죽는 동안 스크램블라아제라고 불리는 단백질은 세포외 빌레이어 표면에 인산염질세린을 표시하면서 이 분포를 평준화시킨다.그리고 나서 인산염의 존재는 죽거나 죽어가는 세포를 제거하기 위해 혈소판증을 유발한다.
특성화 방법
지질 빌리지는 너무 얇고 깨지기 쉽기 때문에 연구하기 매우 어려운 구조다.이러한 한계에도 불구하고, 그것의 구조와 기능에 대한 조사가 가능하도록 지난 70년 동안 수십 가지 기술이 개발되었다.
전기적 측정
전기적 측정은 빌레이어의 중요한 기능인 용액 내 이온의 흐름을 분리하고 방지하는 능력을 특징짓는 간단한 방법이다.빌레이어 전체에 전압을 인가하고 결과 전류를 측정함으로써 빌레이어의 저항을 결정한다.소수성 핵은 충전된 종에 대해 불침투성이기 때문에 이 저항은 일반적으로 상당히 높다(10옴-cm82 이상).몇 나노미터 크기의 구멍이라도 있으면 전류가 극적으로 증가한다.[37]이 계통의 민감성은 단이온 채널의 활동까지도 해결할 수 있는 것이다.[38]
형광 현미경

전기적 측정은 현미경 캔으로 영상화하는 것과 같은 실제 그림을 제공하지 않는다.지질 빌리지는 너무 얇기 때문에 전통적인 현미경으로 볼 수 없다.빌레이어를 보기 위해, 연구원들은 종종 형광 현미경을 사용한다.샘플은 한 파장의 빛으로 흥분하고 다른 파장에서 관찰되기 때문에 흥분과 방출 프로필이 일치하는 형광 분자만 볼 수 있다.천연 지질 빌리버는 형광물질이 아니므로 빌라이어 안에서 원하는 분자에 부착하는 염료를 사용한다.분해능은 보통 수백 나노미터로 제한되는데, 이는 일반적인 세포보다 훨씬 작지만 지질 빌레이어의 두께보다 훨씬 크다.
전자 현미경 검사
전자 현미경 검사는 더 높은 해상도의 이미지를 제공한다.전자현미경에서, 집중된 전자 빔은 전통적인 현미경에서처럼 빛의 빔보다 샘플과 상호작용한다.급속 냉동 기법과 함께 전자 현미경 검사는 세포간 및 세포내 이동의 메커니즘을 연구하는데도 사용되어 왔으며, 예를 들어, 세포내 배실체가 시냅스에서 화학적으로 방출되는 수단이라는 것을 입증하는 데에도 사용되었다.[39]
핵자기공명분광기
31P-NMR(핵자기공명) 분광법은 고유 조건의 인광 빌레이저와 생물막 연구에 널리 사용된다.지질의 31P-NMR 스펙트럼의 analysis[40]지질 2중층 포장, 위상 전환(겔 단계, 생리적 액체 결정상, 리플 단계, 비 2중층 단계), 지질 머리 그룹 orientation/dynamics, 순수한 지질 이중층 구조의 탄성 속성 및 단백질과 othe의 바인딩의 결과로에 대해 폭넓은 정보를 제공할 수 있다.rbio분자
원자력 현미경

지질 빌리지를 연구하는 새로운 방법은 원자현미경 검사법이다. 빛이나 입자의 빔을 사용하는 대신에 아주 작은 뾰족한 끝부분은 빌레이어와 물리적으로 접촉하여 그 위를 가로질러 레코드 플레이어의 바늘처럼 움직이면서 표면을 스캔한다.AFM은 자연적인 빌레이저 행동에 필요한 조건인 상온에서 나노미터 분해능으로 영상화할 수 있는 잠재력을 가지고 있기 때문에 유망한 기술이다.이 기능을 활용하여 AFM은 지지 빌레이어의 투과공(구멍)[41] 형성 및 위상 전환 등 동적 빌레이어 거동을 검사하는 데 사용되어 왔다.[42]또 다른 장점은 프로브 팁이 빌레이어 표면과 기계적으로 상호작용하기 때문에 AFM이 지질의 형광이나 동위원소 라벨을 요구하지 않는다는 것이다.이 때문에 같은 스캔은 지질이나 관련 단백질을 모두 이미지화할 수 있으며, 때로는 단분자 분해능으로도 가능하다.[41][43]AFM은 또한 지질 빌리더의 기계적 성질을 조사할 수 있다.[44]
이중 편광 간섭계
지질 빌리버는 빌라이어 면의 굴절률과 수직의 굴절률과 0.1만큼의 굴절률 단위가 다른 높은 수준의 이ireflingence를 나타낸다.이것은 단백질 상호작용의 메커니즘을 이해하기 위해 이중 편광 간섭계를 사용하는 빌레이어의 질서와 붕괴의 정도를 특성화하는 데 사용되어 왔다.
양자 화학 계산
지질 빌리버는 많은 자유도를 가진 복잡한 분자 시스템이다.그러므로 막의 원자론적 시뮬레이션과 특히 그 성질의 초기 계산은 어렵고 계산적으로 비용이 많이 든다.지질막의 쌍극과 4극 모멘트를 추정하기 위해 양자 화학적 계산이 최근 성공적으로 수행되고 있다.[45]
빌레이어 횡단 수송
수동 확산
대부분의 극성 분자는 지질 빌레이어의 탄화수소 코어에 용해도가 낮으며, 그 결과 빌레이어 전체에 걸쳐 투과성 계수가 낮다.이 효과는 중성 극분자보다 투과성 계수가 훨씬 낮은 충전된 종에 특히 두드러진다.[46]음이온은 일반적으로 양이온보다 빌레이어를 통한 확산 속도가 더 높다.[47][48]이온에 비해 물 분자는 삼투성 부기로 증명되듯이 빌레이어를 통한 투과성이 실제로 상대적으로 크다.내부 염분농도가 높은 세포나 vesicle을 염분농도가 낮은 용액에 넣으면 부풀어오르다가 결국 터진다.물이 비교적 쉽게 빌레이어를 통과할 수 있지 않는 한 그러한 결과는 관찰되지 않을 것이다.빌레이어를 통한 물의 비정상적으로 큰 투과성은 여전히 완전히 이해되지 않고 있으며 계속해서 활발한 토론의 대상이 되고 있다.[49]작은 무충전 아폴라 분자는 지질 빌레이저를 통해 확산되며 이온이나 물보다 더 빠른 크기의 많은 순서가 있다.이것은 클로로포름과 에테르와 같은 지방과 유기 용매 모두에 적용된다.그들의 극성격과 상관없이 큰 분자는 작은 분자보다 지질 빌레이어에 더 천천히 확산된다.[50]

이온 펌프 및 채널
두 가지 특별한 등급의 단백질은 자연 이온 채널과 이온 펌프에서 세포막과 하위 세포막에서 발견되는 이온 구배를 다룬다.펌프와 채널 모두 빌레이어를 통과하는 일체형 막단백질이지만 역할은 사뭇 다르다.이온펌프는 외부 에너지원을 활용하여 이온을 농도 구배를 거슬러 화학적 전위가 높은 영역으로 이동시켜 화학적 구배를 형성하고 유지하는 단백질이다.에너지원은 Na-K++ ATPase의 경우와 마찬가지로 ATP가 될 수 있다.또는 에너지원은2+ Ca+/Na 항정신병자처럼 이미 존재하는 또 다른 화학적 구배가 될 수 있다.세포가 양자의 펌핑을 통해 pH를 조절할 수 있는 것은 이온펌프의 작용을 통해서다.
이온 펌프와 대조적으로 이온 채널은 화학적 그라데이션이 아니라 작업을 수행하거나 신호를 보내기 위해 소멸한다.아마도 가장 친숙하고 가장 잘 연구된 예는 뉴런을 따라 작용 전위를 전도할 수 있는 전압 게이트 Na+ 채널일 것이다.모든 이온 펌프에는 일종의 트리거 또는 "게팅" 메커니즘이 있다.이전의 예에서는 전기적 편향이었지만, 다른 채널은 분자 작용제를 결합하거나 근처의 다른 단백질의 순응적 변화를 통해 활성화될 수 있다.[51]
내포증 및 외포증
어떤 분자나 입자는 너무 크거나 너무 친수해서 지질 빌레이어를 통과하지 못한다.다른 분자는 빌레이어를 통과할 수 있지만 채널형 전송이 비실용적일 정도로 많은 수로 빠르게 이동해야 한다.두 경우 모두, 이러한 종류의 화물은 세포막을 가로질러 용두사미의 융화나 싹을 통해 이동할 수 있다.세포 안에서 음낭이 생성되어 혈장막과 결합하여 세포외 공간으로 내용물을 방출할 때 이 과정을 난포증이라고 한다.역방향 과정에서 세포막의 한 영역이 안으로 보조개질 것이고 결국 잘려나가고 세포로 운반하기 위해 세포외 액의 일부를 둘러싸게 된다.내포증과 난포증은 기능하기 위해 매우 다른 분자 기계에 의존하지만, 두 과정은 밀접하게 연결되어 있어서 서로 없이는 작동할 수 없다.이 상호의존성의 주요 메커니즘은 많은 양의 지질 물질과 관련된 것이다.[52]일반적인 세포에서, 전체 혈장 막에 해당하는 빌레이어 영역이 약 30분 후에 내포증/외포증 주기를 통해 이동하게 될 것이다.[53]만약 이 두 과정이 서로 균형을 이루지 못한다면, 세포는 관리할 수 없는 크기로 바깥쪽으로 풍선을 그리거나 짧은 시간 내에 혈장막을 완전히 고갈시킬 것이다.
원핵생물의 외생성:일반적으로 노벨상 수상(년, 2013년) 과정인 막구밀밀거래로 알려진 막구피외세포는 전통적으로 진핵세포의 특권으로 간주된다.[54]이 신화는 사실이 드러나nanovesicles 일반적으로 박테리아 바깥쪽 피막 소포로 알려진, 그람 음성의 미생물에 의해 발매된 호스트나 대상 cells[55]에 분비되지 않은 미생물의 내에 여러 프로세스를 수행하기 위해 세균 신호 분자는 바꾸어 놓다. 숙주 세포 invasion[56]과 microbe-environment에서 깨졌다.teracti일반적으로[57]
전기회전
전기회전은 막 전체에 걸쳐 큰 인공 전기장의 적용에 의해 유발되는 빌라이어 투과성의 급속한 증가다.실험적으로, 전기는 세포에 친수성 분자를 도입하기 위해 사용된다.이것은 특히 DNA와 같은 고도로 충전된 분자들에게 유용한 기술로, 이것은 결코 소수성 빌레이어 코어에 수동적으로 확산되지 않을 것이다.[58]이 때문에, 전기는 세균의 변형뿐만 아니라 전염의 주요 방법 중 하나이다.심지어 낙뢰로 인한 전기회전이 자연 수평 유전자 전달의 메커니즘이 될 수 있다는 제안까지 나왔다.[59]
이러한 투과성의 증가는 주로 이온과 다른 수화 종의 수송에 영향을 미치는데, 이는 메커니즘이 막에 nm 크기의 물을 채운 구멍의 생성임을 나타낸다.비록 전기장과 유전체 파괴는 둘 다 전기장의 적용에서 비롯되지만, 관련된 메커니즘은 근본적으로 다르다.유전체 파괴에서 장벽 물질은 이온화되어 전도성 경로를 생성한다.따라서 물질적 변화는 자연에서 화학적이다.이와는 대조적으로, 전기회전을 하는 동안 지질 분자는 화학적으로 변형된 것이 아니라 단순히 위치를 이동시켜, 물이 차 있을 때 빌레이어를 통과하는 전도성 경로 역할을 하는 모공을 연다.
역학
지질 빌리버는 액체나 고체의 기계적 성질을 가질 수 있을 만큼 충분히 큰 구조물이다.면적 압축 계수 Ka, 벤딩 계수 Kb, 에지 에너지 를 사용하여 이를 설명할 수 있다고체 지방질 빌레이어에도 전단 계수가 있지만, 다른 액체와 마찬가지로 전단 계수는 액체 빌레이어의 경우 0이다.이러한 기계적 성질은 막이 어떻게 기능하는지에 영향을 미친다.K와a K는b 빌레이어에 삽입하는 단백질과 작은 분자의 능력에 영향을 미치며 [60][61]빌레이어의 기계적 성질은 기계적으로 활성화된 이온 채널의 기능을 변화시키는 것으로 나타났다.[62]빌레이어 기계적 특성도 셀이 찢어지지 않고 견딜 수 있는 스트레스의 유형을 결정한다.지질 빌리지는 쉽게 구부러질 수 있지만, 대부분은 파열되기 전에 몇 퍼센트 이상 늘어나지 못한다.[63]
구조와 조직 섹션에서 논의했듯이, 물 속 지질 꼬리의 소수성 인력은 지질 빌레이어를 함께 잡는 일차적인 힘이다.따라서 빌레이어의 탄성 계수는 주로 지질 분자가 분리되었을 때 물에 얼마나 많은 추가 면적이 노출되는가에 의해 결정된다.[64]K는a 삼투압에[65] 따라 강하게 변하지만 꼬리의 길이와 미숙성으로만 약하게 변한다는 연구결과가 나온다는 것은 이와 같은 관련 세력의 이해를 고려하면 놀라운 일이 아니다.[10]관련된 힘이 워낙 작기 때문에 K를a 실험적으로 판단하기는 어렵다.대부분의 기법은 정교한 현미경과 매우 민감한 측정 장비가 필요하다.[44][66]
빌레이어를 늘리기 위해 얼마나 많은 에너지가 필요한지 나타내는 K와a 반대로, 빌레이어를 구부리거나 구부리기 위해 얼마나 많은 에너지가 필요한지를 나타내는 척도가 K이다b.형식적으로 휨 계수는 내적 곡률에서 일부 다른 곡률로 막을 변형시키는데 필요한 에너지로 정의된다.내적 곡면성은 꼬리 그룹의 직경과 헤드 그룹의 직경의 비율로 정의된다.양꼬리 PC 지질의 경우 이 비율이 거의 1이기 때문에 내인 곡률도 거의 0에 가깝다.특정 지질체가 0의 내인성 곡률에 대한 편차가 너무 크면 빌레이어를 형성하지 않고 대신 마이크로셀이나 반전 마이크로셀과 같은 다른 단계를 형성하게 된다.수크로스와 같은 작은 친수성 분자를 갈락톨리피드가 풍부한 태일라코이드 막으로 만든 혼합 지질 성층 리포솜에 첨가하면 빌레이어들이 현미경으로 불안정하게 된다.[67]일반적으로 K는b 실험적으로 측정되는 것이 아니라 세 개의 파라미터가 관련되기 때문에 K와a 빌라이어 두께의 측정으로 계산된다.
은 빌레이어를 찢거나 구멍을 만들어 빌라이어 가장자리를 물에 노출시키는 데 필요한 에너지의 양을 측정한 것이다.이러한 에너지의 근원은 그러한 인터페이스를 만드는 것이 지질학적인 꼬리의 일부를 물에 노출시킨다는 사실이지만, 이러한 경계 지질들의 정확한 방향은 알려져 있지 않다.소수성(꼬리 곧음)과 소수성(머리 둘레가 휘어짐) 모공이 공존할 수 있다는 증거가 있다.[68][69]
퓨전
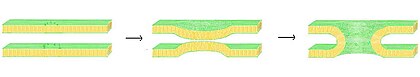
퓨전(Fusion)은 두 개의 지질 빌레이어가 합쳐져 하나의 연결된 구조가 되는 과정이다.이 핵융합이 양쪽 빌라이어 전단을 통해 완전히 진행되면, 물이 채워진 다리가 형성되고 빌라이어가 포함하는 용액이 혼합될 수 있다.또는 각 빌라이어의 전단지 1개만 핵융합 과정에 관여할 경우 빌라이어는 약효가 있다고 한다.핵융합은 진핵세포가 지질빌라이어 막에 의해 광범위하게 하위분열되기 때문에 특히 진핵생물에서 많은 세포과정에 관여한다.정자 활성화에 의한 난자의 외세포증, 수정, 그리고 리소좀으로의 폐생물의 운반은 어떤 형태의 핵융합에 의존하는 많은 진핵 과정들 중 몇 가지다.병원균의 침입도 융합의 지배를 받을 수 있는데, 많은 빌라이어 코팅을 한 바이러스가 숙주세포에 진입하기 위해 전용 핵융합 단백질을 가지고 있기 때문이다.
핵융합 과정에는 네 가지 기본적인 단계가 있다.[26]첫째로, 관련된 세포막은 집적되어야 하고, 몇 나노미터 이내로 서로 접근해야 한다.둘째, 두 빌라이어는 매우 밀접하게 접촉해야 한다(몇 개의 앙스트롬 안에서).일반적으로 존재하는 경계 표면수가 빌레이어를 강하게 밀어내므로 이러한 밀접 접촉에 도달하려면 두 표면이 최소한 부분적으로 탈수되어야 한다.특히 마그네슘과 칼슘과 같은 이온의 존재는 이 단계에 강하게 영향을 미친다.[70][71]체내 칼슘의 중요한 역할 중 하나는 막 융합을 조절하는 것이다.셋째, 불안정은 두 빌라이어 사이의 한 지점에서 형성되어야 하며, 그들의 구조를 국지적으로 왜곡해야 한다.이 왜곡의 정확한 성질은 알려지지 않았다.한 가지 이론은 두 빌라이어 사이에 고도로 구부러진 "stalk"가 형성되어야 한다는 것이다.[72]이 이론의 지지자들은 이것이 왜 고도로 곡선미가 있는 지질인 인산염은 융합을 촉진하는지 설명해 준다고 믿는다.[73]마지막으로 융합의 마지막 단계에서 이 점의 결함은 커지고 두 빌라이어의 구성 요소는 접촉 부위에서 섞여서 분산된다.

생물학적 융합은 거의 항상 막과 관련된 단백질의 작용에 의해 조절되기 때문에 체내 융합을 고려할 때 상황은 더욱 복잡하다.이 단백질들 중 가장 먼저 연구된 것은 바이러스 융합 단백질이었는데, 이 단백질은 밀폐된 바이러스가 숙주 세포에 자신의 유전 물질을 삽입할 수 있게 한다(발굴된 바이러스는 지질 빌레이어로 둘러싸인 바이러스들, 어떤 바이러스는 단백질 코트만 가지고 있다).진핵 세포는 또한 핵융합 단백질을 사용하는데, 그 중 가장 잘 연구된 것이 바로 DOGG이다.올가미 단백질은 모든 세포내 밀매를 지시하는 데 사용된다.수년간의 연구에도 불구하고, 이 단백질 클래스의 기능에 대해서는 아직 많이 알려져 있지 않다.실제로 HIGG가 조기 도킹과 연계돼 있는지, 혈액을 촉진해 융접 과정에 나중에 참여하는지에 대해서는 여전히 활발한 논의가 진행 중이다.[75]
분자와 세포 생물학의 연구에서는 인위적으로 융합을 유도하는 것이 바람직할 때가 많다.폴리에틸렌 글리콜(PEG)을 첨가하면 상당한 집적이나 생화학적 붕괴 없이 핵융합이 일어난다.예를 들어 B세포와 골수종 세포를 융합하는 등 이 절차는 현재 광범위하게 사용되고 있다.[76]이 조합에서 발생하는 "하이브리드종"은 관련된 B세포에 의해 결정되는 원하는 항체를 표현하지만, 흑색종 성분 때문에 불멸한다.핵융합은 또한 전기융합을 통해 인공적으로 유도될 수 있다.이러한 현상은 두 빌라이어 사이의 핵 줄기 성장에 국소 결점 역할을 할 수 있는 전기적 회전 동안에 형성된 정력적으로 활동적인 가장자리에서 기인한다고 생각된다.[77]
모델 시스템
지질 빌레이어는 연구소에서 인공적으로 만들어 연구자들이 자연 빌레이어로 할 수 없는 실험을 할 수 있도록 할 수 있다.그것들은 인공 세포의 경계를 규정하는 합성 생물학 분야에서도 사용될 수 있다.이 합성 시스템은 모델 지질 빌리버라고 불린다.모델 빌레이어에는 여러 가지 유형이 있는데, 각각은 실험적인 장단점을 가지고 있다.그것들은 합성 지질과 천연 지질로 만들어질 수 있다.가장 일반적인 모델 시스템으로는 다음과 같은 것들이 있다.
상업적 응용 프로그램
현재까지 지질빌레이어의 가장 성공적인 상업적 적용은 약물 전달, 특히 암 치료에 지질섬유의 사용이었다.(참고- "리포솜"이라는 용어는 본질적으로 "용기"와 동의어인데 반해, "리포솜"은 구조물의 일반 용어라는 것을 제외하면 "용기"와 같은 것이다.)지질학적 약물 전달의 기본 개념은 이 약이 지질 내부에 용액에 캡슐화되어 환자에게 주입된다는 것이다.이 약물에 탑재된 지오솜은 표적지에서 묶인 뒤 파열될 때까지 시스템을 통해 이동하며 약물을 방출한다.이론적으로, 지질은 거의 모든 친수성 약물을 분리할 수 있고, 특정 조직을 목표로 하기 위해 분자와 접목될 수 있으며, 신체가 지질을 분해하는 생화학적 경로를 가지고 있기 때문에 상대적으로 무독성이 될 수 있기 때문에 이상적인 약물 전달 시스템을 만들어야 한다.[78]
1세대 약물전달 리포좀은 지질 구성이 단순해 몇 가지 한계로 고통을 받았다.혈류 순환이 극도로 제한되어 있었던 것은 신장 개간과 혈소판 감소 때문이다.유동성, 표면 전하 밀도, 표면 수화 등을 조절하기 위해 지질 구성을 미세화함으로써 혈청으로부터 단백질을 덜 흡착하여 면역체계에 의해 쉽게 인식되지 않는 소변기가 생겨났다.[79]이 영역에서 가장 중요한 진전은 폴리에틸렌 글리콜(PEG)을 지질 표면에 접목해 면역이나 신장 제거 없이 장시간 순환하는 '스틸스' 방광체를 만든 것이다.[80]
첫 번째 스텔스 지방질은 수동적으로 종양 조직을 겨냥했다.종양은 빠르고 통제되지 않는 혈관신생을 유발하기 때문에 특히 '누출'을 유발하고 지오솜이 정상 조직보다 훨씬 높은 속도로 혈류를 빠져나갈 수 있게 한다.[81]보다 최근[when?] 들어 특정 세포나 조직 유형에 능동적으로 결합할 수 있다는 희망으로 항체나 기타 분자 표지를 지질 표면에 이식하는 작업이 수행되고 있다.[82]이러한 접근방법의 일부 예는 이미 임상실험에 있다.[83]
지질 빌리더의 또 다른 잠재적인 적용은 바이오센서 분야다.지질빌라이어는 셀 내외부의 장벽이기 때문에 신호 전도가 광범위한 곳이기도 하다.수년간 연구자들은 임상 진단 또는 생물학적 오류 탐지를 위한 빌레이어 기반 장치를 개발하기 위해 이러한 잠재력을 이용하려고 노력해왔다.이 분야에서 진척이 더딘데다 몇몇 기업이 지질을 이용한 자동 탐지 시스템을 개발했지만 여전히 연구계를 대상으로 하고 있다.바인딩키네틱스[84] 연구에 지질빌레이저를 활용할 수 있는 일회용 칩을 제공하는 바이오코어(현 GE헬스케어생명과학)와 자동 패치클램핑 시스템을 개발한 나노온 등이 그것이다.[85]그 밖에 옥스포드 나노랩스의 DNA 염기서열을 위해 지질 빌리더 막 모공을 사용하는 등 보다 이색적인 응용도 추진되고 있다.지금까지 이 기술은 상업적으로 실용성이 입증되지 않았다.
위에서 설명한 지원 지질빌라이어(SLB)는 약물의 투과성을 측정하는 선별 기법으로 상업적 성공을 거두었다.이 병렬 인공 멤브레인 투과성 분석 PAMPA 기법은 Caco-2 배양액,[86][87] 위장관,[88] 혈액-뇌 장벽[89] 및 피부와 높은 상관관계가 있는 것으로 판명된 특정 조제 지질 칵테일 전체에 걸친 투과성을 측정한다.[90]
역사
20세기 초까지 과학자들은 세포가 기름과 같은 얇은 장벽에 둘러싸여 있다고 믿게 되었지만,[91] 이 막의 구조적인 성질은 알려지지 않았다.1925년 두 번의 실험이 이 공백을 메울 수 있는 토대를 마련했다.에리스로시테 용액의 캐패시턴스를 측정함으로써, 휴고 프리케는 세포막 두께가 3.3nm라고 판단했다.[92]
비록 이 실험의 결과는 정확했지만, 프리케는 세포막이 단일 분자층이라는 의미로 데이터를 잘못 해석했다.에버트 고터[93] 박사(1881–1954)와 F.라이덴 대학의 그렌델은 랑무르-블로드게트 수조에 에리스로시테 지질을 모노레이어로 퍼뜨리며 다른 시각에서 이 문제에 접근했다.모노레이어 면적을 세포 표면적에 비교했더니 2대 1의 비율이 나왔다.[94]이후 분석 결과 이 실험에서 몇 가지 오류와 부정확한 가정이 나타났지만, 공교롭게도 이러한 오류는 취소되었고 이 결점 있는 데이터로부터 Gter와 Grendel은 세포막이 지질 빌리머라는 정확한 결론을 이끌어냈다.[26]
이 이론은 1950년대 후반 전자현미경의 사용을 통해 확인되었다.비록 그가 지질 빌레이어[95] J. 데이비드 로버트슨에 대한 최초의 전자 현미경 연구는 발표하지 않았지만, 두 개의 어두운 전자-감지 띠가 두 개의 첨가된 지질 단색체의 두 집단과 관련 단백질이라고 처음으로 주장했다.[96][97]이 작업본체에서 로버트슨은 '단위막'이라는 개념을 내세웠다.빌레이어 구조가 오르가넬 막뿐만 아니라 모든 세포막에 보편적으로 할당된 것은 이번이 처음이었다.
비슷한 시기에 모델막의 발달로 지질빌레이어가 단백질과 독립적으로 존재할 수 있는 안정적인 구조임을 확인했다.뮬러와 루딘은 개구부를 가로지르는 유기 용매의 지질 용액을 "도색"함으로써 인공 빌레이어를 만들 수 있었고, 이것이 구멍에 반응하여 횡방향 유동성, 높은 전기 저항성, 자가 치유력을 보인다는 것을 확인할 수 있었는데,[98] 이 모두가 천연 세포막의 특성이다.몇 년 후, 알렉 뱅햄은 지질 vesicle의 형태로 빌레이어 또한 단순히 건조된 지질 샘플을 물에 노출시킴으로써 형성될 수 있다는 것을 보여주었다.[99]이것은 지질 빌리머가 자체 조립을 통해 자연적으로 형성되며 패턴이 있는 지지 구조를 필요로 하지 않는다는 것을 증명했기 때문에 중요한 진전이었다.
1977년, 쿠니타케와 오카하타가 단일 유기 화합물인 디도데실디메틸아메모늄 브로미드로부터 완전 합성 빌라이어 막이 마련되었다.[100]그것은 빌레이어 막이 반 데르 발스 상호작용에 의해 조립되었다는 것을 분명히 보여준다.
참고 항목
참조
- ^ Andersen, Olaf S.; Koeppe, II, Roger E. (June 2007). "Bilayer Thickness and Membrane Protein Function: An Energetic Perspective". Annual Review of Biophysics and Biomolecular Structure. 36 (1): 107–130. doi:10.1146/annurev.biophys.36.040306.132643. PMID 17263662. S2CID 6521535.
- ^ Divecha, Nullin; Irvine, Robin F (27 January 1995). "Phospholipid signaling". Cell. 80 (2): 269–278. doi:10.1016/0092-8674(95)90409-3. PMID 7834746. S2CID 14120598.
- ^ 마샤히 외수화는 막인산염의 분자와 전자 구조에 강한 영향을 미친다.136, 114709 (2012)"The Journal of Chemical Physics". Archived from the original on 15 May 2016. Retrieved 17 May 2012.
- ^ a b Lewis BA, Engelman DM (May 1983). "Lipid bilayer thickness varies linearly with acyl chain length in fluid phosphatidylcholine vesicles". J. Mol. Biol. 166 (2): 211–7. doi:10.1016/S0022-2836(83)80007-2. PMID 6854644.
- ^ Zaccai G, Blasie JK, Schoenborn BP (January 1975). "Neutron Diffraction Studies on the Location of Water in Lecithin Bilayer Model Membranes". Proc. Natl. Acad. Sci. U.S.A. 72 (1): 376–380. Bibcode:1975PNAS...72..376Z. doi:10.1073/pnas.72.1.376. PMC 432308. PMID 16592215.
- ^ Nagle JF, Tristram-Nagle S (November 2000). "Structure of lipid bilayers". Biochim. Biophys. Acta. 1469 (3): 159–95. doi:10.1016/S0304-4157(00)00016-2. PMC 2747654. PMID 11063882.
- ^ a b Parker J, Madigan MT, Brock TD, Martinko JM (2003). Brock biology of microorganisms (10th ed.). Englewood Cliffs, N.J: Prentice Hall. ISBN 978-0-13-049147-3.
- ^ Marsh D (July 2001). "Polarity and permeation profiles in lipid membranes". Proc. Natl. Acad. Sci. U.S.A. 98 (14): 7777–82. Bibcode:2001PNAS...98.7777M. doi:10.1073/pnas.131023798. PMC 35418. PMID 11438731.
- ^ Marsh D (December 2002). "Membrane water-penetration profiles from spin labels". Eur. Biophys. J. 31 (7): 559–62. doi:10.1007/s00249-002-0245-z. PMID 12602343. S2CID 36212541.
- ^ a b c d Rawicz W, Olbrich KC, McIntosh T, Needham D, Evans E (July 2000). "Effect of chain length and unsaturation on elasticity of lipid bilayers". Biophys. J. 79 (1): 328–39. Bibcode:2000BpJ....79..328R. doi:10.1016/S0006-3495(00)76295-3. PMC 1300937. PMID 10866959.
- ^ Trauble H, Haynes DH (1971). "The volume change in lipid bilayer lamellae at the crystalline-liquid crystalline phase transition". Chem. Phys. Lipids. 7 (4): 324–35. doi:10.1016/0009-3084(71)90010-7.
- ^ Bretscher MS (1 March 1972). "Asymmetrical Lipid Bilayer Structure for Biological Membranes". Nature New Biology. 236 (61): 11–12. doi:10.1038/newbio236011a0. PMID 4502419.
- ^ Verkleij AJ, Zwaal RF, Roelofsen B, Comfurius P, Kastelijn D, van Deenen LL (October 1973). "The asymmetric distribution of phospholipids in the human red cell membrane. A combined study using phospholipases and freeze-etch electron microscopy". Biochim. Biophys. Acta. 323 (2): 178–93. doi:10.1016/0005-2736(73)90143-0. PMID 4356540.
- ^ Coones, R. T.; Green, R. J.; Frazier, R. A. (2021). "Investigating lipid headgroup composition within epithelial membranes: a systematic review". Soft Matter. 17 (28): 6773–6786. Bibcode:2021SMat...17.6773C. doi:10.1039/D1SM00703C. ISSN 1744-683X. PMID 34212942. S2CID 235708094.
- ^ Bell RM, Ballas LM, Coleman RA (1 March 1981). "Lipid topogenesis". J. Lipid Res. 22 (3): 391–403. doi:10.1016/S0022-2275(20)34952-X. PMID 7017050.
- ^ Bretscher MS (August 1973). "Membrane structure: some general principles". Science. 181 (4100): 622–629. Bibcode:1973Sci...181..622B. doi:10.1126/science.181.4100.622. PMID 4724478. S2CID 34501546.
- ^ Rothman JE, Kennedy EP (May 1977). "Rapid transmembrane movement of newly synthesized phospholipids during membrane assembly". Proc. Natl. Acad. Sci. U.S.A. 74 (5): 1821–5. Bibcode:1977PNAS...74.1821R. doi:10.1073/pnas.74.5.1821. PMC 431015. PMID 405668.
- ^ Kornberg RD, McConnell HM (March 1971). "Inside-outside transitions of phospholipids in vesicle membranes". Biochemistry. 10 (7): 1111–20. doi:10.1021/bi00783a003. PMID 4324203.
- ^ Litman BJ (July 1974). "Determination of molecular asymmetry in the phosphatidylethanolamine surface distribution in mixed phospholipid vesicles". Biochemistry. 13 (14): 2844–8. doi:10.1021/bi00711a010. PMID 4407872.
- ^ Crane JM, Kiessling V, Tamm LK (February 2005). "Measuring lipid asymmetry in planar supported bilayers by fluorescence interference contrast microscopy". Langmuir. 21 (4): 1377–88. doi:10.1021/la047654w. PMID 15697284.
- ^ Kalb E, Frey S, Tamm LK (January 1992). "Formation of supported planar bilayers by fusion of vesicles to supported phospholipid monolayers". Biochim. Biophys. Acta. 1103 (2): 307–16. doi:10.1016/0005-2736(92)90101-Q. PMID 1311950.
- ^ Lin WC, Blanchette CD, Ratto TV, Longo ML (January 2006). "Lipid asymmetry in DLPC/DSPC-supported lipid bilayers: a combined AFM and fluorescence microscopy study". Biophys. J. 90 (1): 228–37. Bibcode:2006BpJ....90..228L. doi:10.1529/biophysj.105.067066. PMC 1367021. PMID 16214871.
- ^ Berg, Howard C. (1993). Random walks in biology (Extended Paperback ed.). Princeton, N.J: Princeton University Press. ISBN 978-0-691-00064-0.
- ^ Dietrich C, Volovyk ZN, Levi M, Thompson NL, Jacobson K (September 2001). "Partitioning of Thy-1, GM1, and cross-linked phospholipid analogs into lipid rafts reconstituted in supported model membrane monolayers". Proc. Natl. Acad. Sci. U.S.A. 98 (19): 10642–7. Bibcode:2001PNAS...9810642D. doi:10.1073/pnas.191168698. PMC 58519. PMID 11535814.
- ^ Alberts, Bruce (2017). "Chapter 10: Membrane Structures". Molecular Biology of the Cell. Garland Science. ISBN 9781317563747.
- ^ a b c Yeagle, Philip (1993). The membranes of cells (2nd ed.). Boston: Academic Press. ISBN 978-0-12-769041-4.
- ^ Fadok VA, Bratton DL, Frasch SC, Warner ML, Henson PM (July 1998). "The role of phosphatidylserine in recognition of apoptotic cells by phagocytes". Cell Death Differ. 5 (7): 551–62. doi:10.1038/sj.cdd.4400404. PMID 10200509.
- ^ Anderson HC, Garimella R, Tague SE (January 2005). "The role of matrix vesicles in growth plate development and biomineralization". Front. Biosci. 10 (1–3): 822–37. doi:10.2741/1576. PMID 15569622.
- ^ Eanes ED, Hailer AW (January 1987). "Calcium phosphate precipitation in aqueous suspensions of phosphatidylserine-containing anionic liposomes". Calcif. Tissue Int. 40 (1): 43–8. doi:10.1007/BF02555727. PMID 3103899. S2CID 26435152.
- ^ Kim J, Mosior M, Chung LA, Wu H, McLaughlin S (July 1991). "Binding of peptides with basic residues to membranes containing acidic phospholipids". Biophys. J. 60 (1): 135–48. Bibcode:1991BpJ....60..135K. doi:10.1016/S0006-3495(91)82037-9. PMC 1260045. PMID 1883932.
- ^ Koch AL (1984). "Primeval cells: possible energy-generating and cell-division mechanisms". J. Mol. Evol. 21 (3): 270–7. Bibcode:1985JMolE..21..270K. doi:10.1007/BF02102359. PMID 6242168. S2CID 21635206.
- ^ "5.1 Cell Membrane Structure Life Science University of Tokyo". Archived from the original on 22 February 2014. Retrieved 10 November 2012.
- ^ a b Alberts, Bruce (2002). Molecular biology of the cell (4th ed.). New York: Garland Science. ISBN 978-0-8153-4072-0.
- ^ Martelli PL, Fariselli P, Casadio R (2003). "An ENSEMBLE machine learning approach for the prediction of all-alpha membrane proteins". Bioinformatics. 19 (Suppl 1): i205–11. doi:10.1093/bioinformatics/btg1027. PMID 12855459.
- ^ Filmore D (2004). "It's A GPCR World". Modern Drug Discovery. 11: 24–9.
- ^ Montal M, Mueller P (December 1972). "Formation of bimolecular membranes from lipid monolayers and a study of their electrical properties". Proc. Natl. Acad. Sci. 69 (12): 3561–6. Bibcode:1972PNAS...69.3561M. doi:10.1073/pnas.69.12.3561. PMC 389821. PMID 4509315.
- ^ Melikov KC, Frolov VA, Shcherbakov A, Samsonov AV, Chizmadzhev YA, Chernomordik LV (April 2001). "Voltage-induced nonconductive pre-pores and metastable single pores in unmodified planar lipid bilayer". Biophys. J. 80 (4): 1829–36. Bibcode:2001BpJ....80.1829M. doi:10.1016/S0006-3495(01)76153-X. PMC 1301372. PMID 11259296.
- ^ Neher E, Sakmann B (April 1976). "Single-channel currents recorded from membrane of denervated frog muscle fibres". Nature. 260 (5554): 799–802. Bibcode:1976Natur.260..799N. doi:10.1038/260799a0. PMID 1083489. S2CID 4204985.
- ^ Heuser JE, Reese TS, Dennis MJ, Jan Y, Jan L, Evans L (May 1979). "Synaptic vesicle exocytosis captured by quick freezing and correlated with quantal transmitter release". J. Cell Biol. 81 (2): 275–300. doi:10.1083/jcb.81.2.275. PMC 2110310. PMID 38256.
- ^ Dubinnyi MA, Lesovoy DM, Dubovskii PV, Chupin VV, Arseniev AS (June 2006). "Modeling of 31P-NMR spectra of magnetically oriented phospholipid liposomes: A new analytical solution". Solid State Nucl Magn Reson. 29 (4): 305–311. doi:10.1016/j.ssnmr.2005.10.009. PMID 16298110.[데드링크]
- ^ a b c Roiter, Yuri; Ornatska, Maryna; Rammohan, Aravind R.; Balakrishnan, Jitendra; Heine, David R.; Minko, Sergiy (2008). "Interaction of Nanoparticles with Lipid Membrane". Nano Letters. 8 (3): 941–944. Bibcode:2008NanoL...8..941R. doi:10.1021/nl080080l. PMID 18254602.
- ^ Tokumasu F, Jin AJ, Dvorak JA (2002). "Lipid membrane phase behavior elucidated in real time by controlled environment atomic force microscopy". Journal of Electron Microscopy. 51 (1): 1–9. doi:10.1093/jmicro/51.1.1. PMID 12003236.
- ^ Richter RP, Brisson A (2003). "Characterization of lipid bilayers and protein assemblies supported on rough surfaces by atomic force microscopy". Langmuir. 19 (5): 1632–40. doi:10.1021/la026427w. S2CID 56532332.
- ^ a b Steltenkamp S, Müller MM, Deserno M, Hennesthal C, Steinem C, Janshoff A (July 2006). "Mechanical properties of pore-spanning lipid bilayers probed by atomic force microscopy". Biophys. J. 91 (1): 217–26. Bibcode:2006BpJ....91..217S. doi:10.1529/biophysj.106.081398. PMC 1479081. PMID 16617084.
- ^ Alireza Mashahghi 등, 수화작용은 막인산염의 분자와 전자 구조에 강한 영향을 미친다.J. 켐.물리 136, 114709(2012)
- ^ Chakrabarti AC (1994). "Permeability of membranes to amino acids and modified amino acids: mechanisms involved in translocation". Amino Acids. 6 (3): 213–29. doi:10.1007/BF00813743. PMID 11543596. S2CID 24350029.
- ^ Hauser H, Phillips MC, Stubbs M (October 1972). "Ion permeability of phospholipid bilayers". Nature. 239 (5371): 342–4. Bibcode:1972Natur.239..342H. doi:10.1038/239342a0. PMID 12635233. S2CID 4185197.
- ^ Papahadjopoulos D, Watkins JC (September 1967). "Phospholipid model membranes. II. Permeability properties of hydrated liquid crystals". Biochim. Biophys. Acta. 135 (4): 639–52. doi:10.1016/0005-2736(67)90095-8. PMID 6048247.
- ^ Paula S, Volkov AG, Van Hoek AN, Haines TH, Deamer DW (January 1996). "Permeation of protons, potassium ions, and small polar molecules through phospholipid bilayers as a function of membrane thickness". Biophys. J. 70 (1): 339–48. Bibcode:1996BpJ....70..339P. doi:10.1016/S0006-3495(96)79575-9. PMC 1224932. PMID 8770210.
- ^ Xiang TX, Anderson BD (June 1994). "The relationship between permeant size and permeability in lipid bilayer membranes". J. Membr. Biol. 140 (2): 111–22. doi:10.1007/bf00232899. PMID 7932645. S2CID 20394005.
- ^ Gouaux E, Mackinnon R (December 2005). "Principles of selective ion transport in channels and pumps". Science. 310 (5753): 1461–5. Bibcode:2005Sci...310.1461G. doi:10.1126/science.1113666. PMID 16322449. S2CID 16323721.
- ^ Gundelfinger ED, Kessels MM, Qualmann B (February 2003). "Temporal and spatial coordination of exocytosis and endocytosis". Nat. Rev. Mol. Cell Biol. 4 (2): 127–39. doi:10.1038/nrm1016. PMID 12563290. S2CID 14415959.
- ^ Steinman RM, Brodie SE, Cohn ZA (March 1976). "Membrane flow during pinocytosis. A stereologic analysis". J. Cell Biol. 68 (3): 665–87. doi:10.1083/jcb.68.3.665. PMC 2109655. PMID 1030706.
- ^ 야시로이 R.C. (1999년) '원핵생물의 세포증'과 살모넬라 침공에서 그 역할.ICAR NEWS - 과학기술 뉴스레터, (10월-12월) 5권(4), 18.https://www.researchgate.net/publication/230822402_'Exocytosis_in_prokaryotes'_and_its_role_in_Salmonella_invasion?ev=prf_pub페이지
- ^ 야쉬로이 R C(1993) 살모넬라균 3,10:r:- 유기체의 표면 섬유와 베실체에 대한 전자 현미경 연구.Anim Sci 63의 Ind Jl, 99-1998.https://www.researchgate.net/publication/230817087_Electron_microscope_studies_of_surface_pilli_and_vesicles_of_Salmonella_310r-_organisms?ev=prf_pub
- ^ 야쉬로이 R.C. (1998) 원핵생물에서 배실체 외세포 분열의 발견과 살모넬라 침공에서 그것의 역할.Current Science, vol. 75(10), 페이지 1062-1066.https://www.researchgate.net/publication/230793568_Discovery_of_vesicular_exocytosis_in_prokaryotes_and_its_role_in_Salmonella_invasion?ev=prf_pub
- ^ YashRoy RC (1998). "Exocytosis from gram negative bacteria for Salmonella invasion of chicken ileal epithelium". Indian Journal of Poultry Science. 33 (2): 119–123.
- ^ Neumann E, Schaefer-Ridder M, Wang Y, Hofschneider PH (1982). "Gene transfer into mouse lyoma cells by electroporation in high electric fields". EMBO J. 1 (7): 841–5. doi:10.1002/j.1460-2075.1982.tb01257.x. PMC 553119. PMID 6329708.
- ^ Demanèche S, Bertolla F, Buret F, et al. (August 2001). "Laboratory-scale evidence for lightning-mediated gene transfer in soil". Appl. Environ. Microbiol. 67 (8): 3440–4. Bibcode:2001ApEnM..67.3440D. doi:10.1128/AEM.67.8.3440-3444.2001. PMC 93040. PMID 11472916.
- ^ Garcia ML (July 2004). "Ion channels: gate expectations". Nature. 430 (6996): 153–5. Bibcode:2004Natur.430..153G. doi:10.1038/430153a. PMID 15241399. S2CID 4427370.
- ^ McIntosh TJ, Simon SA (2006). "Roles of Bilayer Material Properties in Function and Distribution of Membrane Proteins". Annu. Rev. Biophys. Biomol. Struct. 35 (1): 177–98. doi:10.1146/annurev.biophys.35.040405.102022. PMID 16689633.
- ^ Suchyna TM, Tape SE, Koeppe RE, Andersen OS, Sachs F, Gottlieb PA (July 2004). "Bilayer-dependent inhibition of mechanosensitive channels by neuroactive peptide enantiomers". Nature. 430 (6996): 235–40. Bibcode:2004Natur.430..235S. doi:10.1038/nature02743. PMID 15241420. S2CID 4401688.
- ^ Hallett FR, Marsh J, Nickel BG, Wood JM (February 1993). "Mechanical properties of vesicles. II. A model for osmotic swelling and lysis". Biophys. J. 64 (2): 435–42. Bibcode:1993BpJ....64..435H. doi:10.1016/S0006-3495(93)81384-5. PMC 1262346. PMID 8457669.
- ^ Boal, David H. (2001). Mechanics of the cell. Cambridge, UK: Cambridge University Press. ISBN 978-0-521-79681-1.
- ^ Rutkowski CA, Williams LM, Haines TH, Cummins HZ (June 1991). "The elasticity of synthetic phospholipid vesicles obtained by photon correlation spectroscopy". Biochemistry. 30 (23): 5688–96. doi:10.1021/bi00237a008. PMID 2043611.
- ^ Evans E, Heinrich V, Ludwig F, Rawicz W (October 2003). "Dynamic tension spectroscopy and strength of biomembranes". Biophys. J. 85 (4): 2342–50. Bibcode:2003BpJ....85.2342E. doi:10.1016/S0006-3495(03)74658-X. PMC 1303459. PMID 14507698.
- ^ YashRoy R.C. (1994) 수크로스에 의한 태라코이드 막 지질의 항성 분산의 불안정화.Biochimica et Bioophysica Acta, 1212, 페이지 129-109.https://www.researchgate.net/publication/15042978_Destabilisation_of_lamellar_dispersion_of_thylakoid_membrane_lipids_by_sucrose?ev=prf_pub
- ^ Weaver JC, Chizmadzhev YA (1996). "Theory of electroporation: A review". Bioelectrochemistry and Bioenergetics. 41 (2): 135–60. doi:10.1016/S0302-4598(96)05062-3.
- ^ Zeidi, Mahdi; Kim, Chun IL (2018). "The effects of intra-membrane viscosity on lipid membrane morphology: complete analytical solution". Scientific Reports. 8 (1): 12845. Bibcode:2018NatSR...812845Z. doi:10.1038/s41598-018-31251-6. ISSN 2045-2322. PMC 6110749. PMID 30150612.
- ^ Papahadjopoulos D, Nir S, Düzgünes N (April 1990). "Molecular mechanisms of calcium-induced membrane fusion". J. Bioenerg. Biomembr. 22 (2): 157–79. doi:10.1007/BF00762944. PMID 2139437. S2CID 1465571.
- ^ Leventis R, Gagné J, Fuller N, Rand RP, Silvius JR (November 1986). "Divalent cation induced fusion and lipid lateral segregation in phosphatidylcholine-phosphatidic acid vesicles". Biochemistry. 25 (22): 6978–87. doi:10.1021/bi00370a600. PMID 3801406.
- ^ Markin VS, Kozlov MM, Borovjagin VL (October 1984). "On the theory of membrane fusion. The stalk mechanism". Gen. Physiol. Biophys. 3 (5): 361–77. PMID 6510702.
- ^ Chernomordik LV, Kozlov MM (2003). "Protein-lipid interplay in fusion and fission of biological membranes". Annu. Rev. Biochem. 72 (1): 175–207. doi:10.1146/annurev.biochem.72.121801.161504. PMID 14527322.
- ^ Georgiev, Danko D.; Glazebrook, James F. (2007). "Subneuronal processing of information by solitary waves and stochastic processes". In Lyshevski, Sergey Edward (ed.). Nano and Molecular Electronics Handbook. Nano and Microengineering Series. CRC Press. pp. 17–1–17–41. doi:10.1201/9781315221670-17. ISBN 978-0-8493-8528-5. S2CID 199021983.
- ^ Chen YA, Scheller RH (February 2001). "SNARE-mediated membrane fusion". Nat. Rev. Mol. Cell Biol. 2 (2): 98–106. doi:10.1038/35052017. PMID 11252968. S2CID 205012830.
- ^ Köhler G, Milstein C (August 1975). "Continuous cultures of fused cells secreting antibody of predefined specificity". Nature. 256 (5517): 495–7. Bibcode:1975Natur.256..495K. doi:10.1038/256495a0. PMID 1172191. S2CID 4161444.
- ^ Jordan, Carol A.; Neumann, Eberhard; Sowershi mason, Arthur E. (1989). Electroporation and electrofusion in cell biology. New York: Plenum Press. ISBN 978-0-306-43043-5.
- ^ Immordino ML, Dosio F, Cattel L (2006). "Stealth liposomes: review of the basic science, rationale, and clinical applications, existing and potential". Int J Nanomed. 1 (3): 297–315. doi:10.2217/17435889.1.3.297. PMC 2426795. PMID 17717971.
- ^ Chonn A, Semple SC, Cullis PR (15 September 1992). "Association of blood proteins with large unilamellar liposomes in vivo. Relation to circulation lifetimes". J. Biol. Chem. 267 (26): 18759–65. doi:10.1016/S0021-9258(19)37026-7. PMID 1527006.
- ^ Boris EH, Winterhalter M, Frederik PM, Vallner JJ, Lasic DD (1997). "Stealth liposomes: from theory to product". Advanced Drug Delivery Reviews. 24 (2–3): 165–77. doi:10.1016/S0169-409X(96)00456-5.
- ^ Maeda H, Sawa T, Konno T (July 2001). "Mechanism of tumor-targeted delivery of macromolecular drugs, including the EPR effect in solid tumor and clinical overview of the prototype polymeric drug SMANCS". J Control Release. 74 (1–3): 47–61. doi:10.1016/S0168-3659(01)00309-1. PMID 11489482.
- ^ Lopes DE, Menezes DE, Kirchmeier MJ, Gagne JF (1999). "Cellular trafficking and cytotoxicity of anti-CD19-targeted liposomal doxorubicin in B lymphoma cells". Journal of Liposome Research. 9 (2): 199–228. doi:10.3109/08982109909024786.
- ^ Matsumura Y, Gotoh M, Muro K, et al. (March 2004). "Phase I and pharmacokinetic study of MCC-465, a doxorubicin (DXR) encapsulated in PEG immunoliposome, in patients with metastatic stomach cancer". Ann. Oncol. 15 (3): 517–25. doi:10.1093/annonc/mdh092. PMID 14998859.
- ^ [1] 바이오코어 주식회사2009년 2월 12일 회수.
- ^ 나노테크놀로지스. 자동 패치 클램프.2010년 2월 28일 검색됨(PDF)
- ^ Bermejo, M.; Avdeef, A.; Ruiz, A.; Nalda, R.; Ruell, J. A.; Tsinman, O.; González, I.; Fernández, C.; Sánchez, G.; Garrigues, T. M.; Merino, V. (2004). "PAMPA--a drug absorption in vitro model 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones". European Journal of Pharmaceutical Sciences. 21 (4): 429–41. doi:10.1016/j.ejps.2003.10.009. PMID 14998573.
- ^ Avdeef, A.; Artursson, P.; Neuhoff, S.; Lazorova, L.; Gråsjö, J.; Tavelin, S. (2005). "Caco-2 permeability of weakly basic drugs predicted with the double-sink PAMPA pKa(flux) method". European Journal of Pharmaceutical Sciences. 24 (4): 333–49. doi:10.1016/j.ejps.2004.11.011. PMID 15734300.
- ^ Avdeef, A.; Nielsen, P. E.; Tsinman, O. (2004). "PAMPA--a drug absorption in vitro model 11. Matching the in vivo unstirred water layer thickness by individual-well stirring in microtitre plates". European Journal of Pharmaceutical Sciences. 22 (5): 365–74. doi:10.1016/j.ejps.2004.04.009. PMID 15265506.
- ^ Dagenais, C.; Avdeef, A.; Tsinman, O.; Dudley, A.; Beliveau, R. (2009). "P-glycoprotein deficient mouse in situ blood-brain barrier permeability and its prediction using an in combo PAMPA model". European Journal of Pharmaceutical Sciences. 38 (2): 121–37. doi:10.1016/j.ejps.2009.06.009. PMC 2747801. PMID 19591928.
- ^ Sinkó, B.; Kökösi, J.; Avdeef, A.; Takács-Novák, K. (2009). "A PAMPA study of the permeability-enhancing effect of new ceramide analogues". Chemistry & Biodiversity. 6 (11): 1867–74. doi:10.1002/cbdv.200900149. PMID 19937821. S2CID 27395246.
- ^ Loeb J (December 1904). "The recent development of Biology". Science. 20 (519): 777–786. Bibcode:1904Sci....20..777L. doi:10.1126/science.20.519.777. PMID 17730464.
- ^ Fricke H (1925). "The electrical capacity of suspensions with special reference to blood". Journal of General Physiology. 9 (2): 137–52. doi:10.1085/jgp.9.2.137. PMC 2140799. PMID 19872238.
- ^ Dooren LJ, Wiedemann LR (1986). "On bimolecular layers of lipids on the chromocytes of the blood". Journal of European Journal of Pediatrics. 145 (5): 329. doi:10.1007/BF00439232. PMID 3539619. S2CID 36842138.
- ^ Gorter E, Grendel F (1925). "On bimolecular layers of lipids on the chromocytes of the blood". Journal of Experimental Medicine. 41 (4): 439–43. doi:10.1084/jem.41.4.439. PMC 2130960. PMID 19868999.
- ^ Sjöstrand FS, Andersson-Cedergren E, Dewey MM (April 1958). "The ultrastructure of the intercalated discs of frog, mouse and guinea pig cardiac muscle". J. Ultrastruct. Res. 1 (3): 271–87. doi:10.1016/S0022-5320(58)80008-8. PMID 13550367.
- ^ Robertson JD (1960). "The molecular structure and contact relationships of cell membranes". Prog. Biophys. Mol. Biol. 10: 343–418. PMID 13742209.
- ^ Robertson JD (1959). "The ultrastructure of cell membranes and their derivatives". Biochem. Soc. Symp. 16: 3–43. PMID 13651159.
- ^ Mueller P, Rudin DO, Tien HT, Wescott WC (June 1962). "Reconstitution of cell membrane structure in vitro and its transformation into an excitable system". Nature. 194 (4832): 979–80. Bibcode:1962Natur.194..979M. doi:10.1038/194979a0. PMID 14476933. S2CID 2110051.
- ^ Bangham, A. D.; Horne, R. W. (1964). "Negative Staining of Phospholipids and Their Structural Modification by Surface-Active Agents As Observed in the Electron Microscope". Journal of Molecular Biology. 8 (5): 660–668. doi:10.1016/S0022-2836(64)80115-7. PMID 14187392.
- ^ Kunitake T (1977). "A totally synthetic bilayer membrane". J. Am. Chem. Soc. 99 (11): 3860–3861. doi:10.1021/ja00453a066.
외부 링크
| 위키미디어 커먼스는 리피드 빌레이어 관련 매체를 보유하고 있다. |
- 아반티 리피드 지질의 가장 큰 상업적 공급 업체 중 하나이다.지질 특성 및 취급 및 지질 빌레이어 준비 기법에 대한 기술 정보.
- LIPIDAT 지질 물리적 특성의 광범위한 데이터베이스
- 지방질 빌레이어의 단면 구조와 관련된 유동질 빌라이어 시뮬레이션 및 간행물 링크.
- 리피드 빌레이어스와 그라미신 채널(자바 플러그인 필요) 사진 및 영화에는 지질 빌레이어의 분자역학 시뮬레이션 결과가 나온다.
- 어바인 캘리포니아 대학교 스테판 화이트 연구소의 액체 지질 빌레이어 구조
- 지질 빌리더 다이내믹 애니메이션(플래시 플러그인 필요)