이상기체의 법칙
Ideal gas law| 열역학 |
|---|
 |
일반 기체 방정식이라고도 불리는 이상 기체 법칙은 가상의 이상 기체 상태 방정식이다.이는 여러 가지 제한이 있지만 여러 조건에서 많은 가스의 거동에 대한 근사치입니다.그것은 1834년 Benott Paul Emile Clapeyron에 의해 경험적 보일의 법칙, 샤를의 법칙, 아보가드로의 법칙, 그리고 게이-루삭의 [1]법칙의 조합으로 처음 언급되었습니다.이상 기체 법칙은 종종 경험적 형태로 작성됩니다.
방정식
가스량의 상태는 압력, 부피 및 온도에 의해 결정됩니다.이 방정식의 현대적 형태는 이것들을 두 가지 주요 형태로 단순하게 관련짓는다.상태 방정식에 사용되는 온도는 절대 온도입니다. 적절한 SI 단위는 켈빈입니다.[4]
공통 양식
가장 자주 소개되는 폼은 다음과 같습니다.
- p는 가스의 절대 압력입니다.
- 디스플레이 스타일 V)는 가스의 부피입니다.
- n은 가스 물질의 양(몰 수라고도 함)입니다.
- R은 볼츠만 상수와 아보가드로 상수의 곱과 동일한 이상적 또는 보편적 기체 상수입니다.
- 는 볼츠만 상수입니다.
- 는 아보가드로 상수입니다.
- T는 가스의 절대 온도입니다.
- {\ N은 가스의 입자 수(일반적으로 원자 또는 분자)입니다.
SI 단위로 p는 파스칼, V는 입방 미터, n은 몰, T는 켈빈 단위로 측정됩니다(켈빈 눈금은 시프트된 섭씨 눈금으로, 여기서 0.00K = -273.15°C, 최저 온도).R의 값은 8.314J/(mol·K) = 1.989µ2cal/(mol·K), 즉 0.0821Lµatm/(mol·K)이다.
어금니
가스의 화학적 양 대신 질량을 부여함으로써 존재하는 가스의 양을 지정할 수 있다.따라서 이상적인 가스 법칙의 다른 형태가 유용할 수 있습니다.화학적 양(n)(몰 단위)은 기체(m)(kg 단위)의 총 질량을 몰 질량(M)(몰당 킬로그램 단위):
n을 m/M으로 대체하고 이어서 밀도 θ = m/V를 도입하면 다음과 같은 결과를 얻을 수 있습니다.
특정 가스 상수specific(r) R을 비 R/M으로 정의하면
이 형태의 이상 기체 법칙은 고려된 가스의 양과는 무관하게 압력, 밀도 및 온도를 독특한 공식으로 연결하기 때문에 매우 유용합니다.또는 밀도의 역수인 특정 부피 v의 관점에서 다음과 같이 법칙을 작성할 수 있다.
특히 공학 및 기상학 분야에서는 기호 R로 특정 가스 상수를 나타내는 것이 일반적이다.이 경우 일반적으로 범용가스상수를 구별하기 위해 R {\ R {\ R과 같은 다른 기호가 부여된다.어떤 경우에도 가스 상수의 맥락 및/또는 단위는 보편적 또는 특정 가스 상수가 [5]참조되고 있는지 명확히 해야 한다.
통계역학
통계역학에서 다음과 같은 분자 방정식은 첫 번째 원리에서 도출된다.
여기서 P는 기체의 절대 압력이고, n은 분자의 수 밀도이다(n은 몰 수인 이전의 공식과 대조적으로 n = N/V 비율에 의해 주어짐), T는 절대 온도이고, k는B 볼츠만 상수이며, 다음과 같이 주어진 온도와 에너지이다.
여기서A N은 Avogadro 상수입니다.
이것으로부터 우리는 원자 질량 상수 m의 μ배인 평균u 입자 질량의 m, 즉 μu의 질량을 가진 m의 기체에 대해 분자의 수는 다음과 같이 주어질 것임을 알 수 있다.
그리고 θ = m/V = nμm이므로u, 우리는 이상 기체 법칙을 다음과 같이 다시 쓸 수 있다는 것을 알아냈다.
SI 단위로 P는 파스칼, V는 세제곱미터, T는 켈빈, kB = 1.38×10−23 JµK는−1 SI 단위로 측정된다.
복합가스 법칙
Charles, Boyle 및 Gay-Lussac의 법칙을 결합하면 이상적인 가스 법칙과 동일한 함수 형태를 취하는 복합 가스 법칙을 얻을 수 있습니다. 단, 몰의 수가 지정되지 않은 경우, P PV 대 T T의 은 [6]상수로 간주됩니다.
서P(\ P는 가스의 압력,V(\ V는 가스의 부피,T(\ T는 가스의 절대 온도,(\ k는 상수입니다.동일한 물질을 두 가지 다른 조건 하에서 비교할 때, 법칙은 다음과 같이 기술될 수 있다.
기체와 관련된 에너지
이상 가스의 운동 이론의 가정에 따르면, 사람들은 이상 가스의 분자 또는 원자 사이에 분자 간 흡인력이 없다고 생각할 수 있다.즉, 그 잠재 에너지는 0입니다.따라서 가스에 의해 소유되는 모든 에너지는 가스의 분자 또는 원자의 운동 에너지이다.
이것은 3개의 자유도를 가진 단원자 가스의 n몰의 운동 에너지에 해당합니다.아래 표는 다양한 양의 단원자 가스에 대한 이 관계를 보여줍니다.
| 단원자 가스의 에너지 | 수식 |
|---|---|
| 하나의 몰과 관련된 에너지 | |
| 1그램과 관련된 에너지 | |
| 원자 1개와 관련된 에너지 |
열역학 프로세스에 대한 응용
아래 표는 특정 프로세스에 대한 이상적인 가스 방정식을 기본적으로 단순화하므로 수치적 방법을 사용하여 이 방정식을 쉽게 풀 수 있습니다.
열역학 프로세스는 상태 1에서 상태 2로 이동하는 시스템으로 정의되며 상태 번호는 첨자로 표시됩니다.표의 첫 번째 열에 나타나듯이 기본 열역학 프로세스는 프로세스 전체에서 기체 특성(P, V, T, S 또는 H) 중 하나가 일정하도록 정의되어 있습니다.
주어진 열역학 공정에서 특정 공정의 범위를 지정하려면 특성 비율 중 하나("알려진 비율" 열 아래에 나열됨)를 직접 또는 간접적으로 지정해야 합니다.또한 비율을 알 수 있는 속성은 이전 열에 일정하게 유지된 특성과 구별되어야 합니다(그렇지 않으면 비율이 통일성이 되고 가스 법칙 방정식을 단순화하는 데 충분한 정보를 사용할 수 없습니다).
마지막 3열에서 상태 2의 특성(p, V 또는 T)은 나열된 방정식을 사용하여 상태 1의 특성으로부터 계산할 수 있습니다.
| 과정 | 일정한 | 알려진 비율 또는 델타 | p2. | 브이2 | T2. |
|---|---|---|---|---|---|
| 등압 과정 | 압력. | 비디오21 | p2 = p1 | V2 = V1(V2/V1) | T2 = T1(V2/V1) |
| T2/T1 | p2 = p1 | V2 = V1(T2/T1) | T2 = T1(T2/T1) | ||
| 아이소코릭법 (이소볼루메트릭 공정) (등축 공정) | 용량 | p2/p1 | p2 = p1(p2/p1) | V2 = V1 | T2 = T1(p2/p1) |
| T2/T1 | p2 = p1(T2/T1) | V2 = V1 | T2 = T1(T2/T1) | ||
| 등온 과정 | 온도 | p2/p1 | p2 = p1(p2/p1) | V2 = V1/(p2/p1) | T2 = T1 |
| 비디오21 | p2 = p1/(V2/V1) | V2 = V1(V2/V1) | T2 = T1 | ||
| 등엔트로픽 과정 (가역적 단열 프로세스) | p2/p1 | p2 = p1(p2/p1) | V2 = V1(p2/p1)(−1/γ) | T2 = T1(p2/p1)(γ − 1)/γ | |
| 비디오21 | p2 = p1(V2/V1)−γ | V2 = V1(V2/V1) | T2 = T1(V2/V1)(1 − γ) | ||
| T2/T1 | p2 = p1(T2/T1)γ/(γ − 1) | V2 = V1(T2/T1)1/(1 − γ) | T2 = T1(T2/T1) | ||
| 폴리트로픽 과정 | PVn | p2/p1 | p2 = p1(p2/p1) | V2 = V1(p2/p1)(−1/n) | T2 = T1(p2/p1)(n − 1)/n |
| 비디오21 | p2 = p1(V2/V1)−n | V2 = V1(V2/V1) | T2 = T1(V2/V1)(1 − n) | ||
| T2/T1 | p2 = p1(T2/T1)n/(n − 1) | V2 = V1(T2/T1)1/(1 − n) | T2 = T1(T2/T1) | ||
| 등각 과정 (가역 불가능한 단열 프로세스) | p2 − p1 | p2 = p1 + (p2 - p1) | T2 = T1JT + μ(p2 - p1) | ||
| T2 − T1 | p2 = p1 + (T2 - T1)/μJT | T2 = T1 + (T2 - T1) |
^a. 등엔트로픽 프로세스에서 시스템 엔트로피(S)는 일정하다.이러한 조건에서 pV11γ = pV이며22γ, 여기서 θ는 열용량비로 정의되며, 이는 열적으로 완벽한 기체에 대해 일정하다.γ에2 사용되는 값은 질소(N2) 및 산소(O)와 같은 이원자 가스(및 공기는 99% 이원자)의 경우 일반적으로 1.4이다.또한 γ는 일반적으로 귀한 가스헬륨(He), 아르곤(Ar)과 같은 단원자 가스의 경우 1.6이다.내연기관에서 δ는 구성가스와 온도에 따라 1.35에서 1.15 사이이다.
^ b. 등각 과정에서는 시스템 엔탈피(H)가 일정하다.이상 기체의 자유 팽창의 경우 분자 상호작용이 없고 온도는 일정하게 유지됩니다.실제 가스의 경우, 분자는 온도와 압력에 따라 흡인 또는 반발을 통해 상호 작용하며 가열 또는 냉각이 발생합니다.이것은 줄이라고 알려져 있습니다.톰슨 효과참고로, 줄-상온 및 해수면에서의 공기에 대한 톰슨 계수JT μ는 0.22°C/[7]bar이다.
실제 가스의 이상 거동으로부터의 편차
여기서 주어진 상태 방정식(PV = nRT)은 이상적인 기체에만 적용되거나 이상적인 기체처럼 충분히 작용하는 실제 가스에 대한 근사치로 적용된다.사실 상태 방정식에는 많은 다른 형태가 있다.이상 기체 법칙은 분자 크기와 분자 간 흡인력을 모두 무시하기 때문에 고온과 저압의 단원자 가스에 가장 정확합니다.인접한 분자 사이의 평균 거리가 분자 크기보다 훨씬 커지기 때문에 밀도가 낮을수록, 즉 압력이 낮을 때 부피가 클수록 분자 크기를 무시하는 것은 덜 중요해진다.분자 간 흡인력의 상대적 중요성은 열 운동 에너지가 증가함에 따라, 즉 온도가 증가함에 따라 감소한다.판데르발스 방정식과 같은 보다 상세한 상태 방정식은 분자 크기와 분자 간 힘에 의해 야기된 이상성으로부터의 편차를 설명한다.
파생상품
경험적
이상 기체 법칙의 도출을 이끈 경험적 법칙은 가스의 두 상태 변수만 바꾸고 다른 하나는 일정하게 유지하는 실험을 통해 발견되었다.
이러한 종류의 설정으로 발견될 수 있는 모든 가능한 가스 법칙은 다음과 같습니다.

여기서 P는 압력, V는 부피, N은 가스 내의 입자 수를 나타냅니다.서 })은 각 방정식의 상수를 나타냅니다.
이상적인 가스 법칙을 도출하기 위해서는 6가지 공식 모두를 알 필요가 없으며, 3가지 공식만 알 수 있고, 나머지 공식은 1가지 더 알 수 있어 4가 필요한 이상적인 가스 법칙을 얻을 수 있습니다.
각 공식은 해당 공식에 관련된 상태 변수만 변화하고 다른 변수(기체의 특성이지만 해당 공식에 명시적으로 명시되지 않음)는 일정하게 유지될 때만 유지되므로, 단순히 대수를 사용하고 모든 변수를 직접 결합할 수 없다.이것이 이유: 보일은 N과 T를 일정하게 유지하면서 그의 실험을 했고 이것은 고려되어야 한다. (같은 방식으로, 모든 실험은 어떤 매개변수를 일정하게 유지했고 이것은 유도에 대해 고려되어야 한다.)
이 점에 유의하여 정확하게 유도하기 위해서는 (실험에서처럼) 한 번에 한 공정씩 가스가 변경되는 것을 상상해야 합니다.4개의 공식을 사용하여 도출하는 방법은 다음과 같습니다.
에 가스는 파라미터 ,}을 가집니다.
예를 들어 보일의 법칙(식 1)에 따라 압력과 부피만 변화하기 시작하면 다음과 같이 됩니다.
| (7) |
이 프로세스 후 가스의 는,,,({},},1})입니다.
그 다음 식 (5)을 사용하여 기체 내 입자의 수와 온도를 변화시킨다.
| (8) |
이 프로세스 후 가스의 는,,,({},},2})입니다.
(6)를 사용하여 압력과 입자의 수를 변경한다.
| (9) |
이 프로세스 후 가스의 는,,,({},},3})입니다.
그때 Charles의 법칙(등식 2)을 사용하여 기체의 부피와 온도를 변경합니다.
| (10) |
이 프로세스 후 가스는 을 갖게 됩니다.
(7), (8), (9) 및 (10) 방정식에 단순 대수를 사용하면 다음과 같은 결과가 나온다.
R B (\ nR_text})라는 을 이용한 또 다른 동등한 결과 여기서 n은 가스의 몰 수이고 R은 범용 가스 상수입니다.
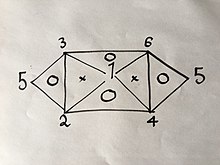
6개의 방정식 중 3개가 알려진 경우, 동일한 방법을 사용하여 나머지 3개를 도출할 수 있습니다.그러나 각 공식에는 두 개의 변수가 있으므로 특정 그룹이 3개인 경우에만 가능합니다.예를 들어, 방정식 (1), (2) 및 (4)을 갖는다면 두 식을 합치면 세 번째 공식만 나오기 때문에 더 이상 구할 수 없습니다.그러나 (1)과 (2)를 조합하면 (4)이 되고 (1)과 (3)이 조합되면 (6)이 되고 (4)와 (6)이 산출되며 (4)와 (6)의 조합은 (5)이 되기 때문에 (2)과 (3)의 조합이 다음과 같이 시각적으로 설명됩니다.
여기서 숫자는 위에 번호가 매겨진 가스 법칙을 나타냅니다.
위에 "O"가 있는 삼각형의 꼭지점에 있는 3개의 법칙 중 2개에서 사용된 것과 동일한 방법을 사용하면 세 번째 방법을 얻을 수 있습니다.
예를 들어 다음과 같습니다.
압력 및 볼륨만 먼저 변경합니다.
| (1') |
볼륨과 온도만:
| (2') |
V3({3에 값을 선택할 수 있으므로 V ({}=}})으로 하면 방정식 (2)은 다음과 같이 됩니다.
| (3인치) |
방정식 (1')과 (3')을 조합하면 ({ {}} = {2}} {}} {}}}}}}이 . 방정식 (4)에 해당하며, 이 도출까지 사전 지식이 없었습니다.
이론적인
운동 이론
이상적인 기체 법칙은 또한 기체의 운동 이론을 사용하는 첫 번째 원리에서 도출될 수 있는데, 여기서 몇 가지 간단한 가정이 만들어지고, 그 중 가장 중요한 것은 기체의 분자 또는 원자가 점질량이고 질량은 가지고 있지만 유의한 부피는 없으며, 서로 그리고 용기의 측면과 탄성 충돌만 겪는 것입니다.선형 운동량과 운동 에너지가 모두 보존되는 er.
기체의 운동 이론의 기본적인 가정은 다음을 암시한다.
Maxwell-Boltzmann 분포를 사용하면 속도가 v v ~ (\v+dv 에 있는 분자의 비율은) v), dv가 .
k는 볼츠만 상수를 나타냅니다.평균 제곱근 속도는 다음과 같이 계산할 수 있습니다.
통합 공식 사용
따라서
이상적인 가스 법칙을 얻을 수 있습니다.
통계역학
q = (qxy, qz, q)와 p = (py, pz, p)는x 각각 이상적인 기체의 입자의 위치 벡터와 운동량 벡터를 나타낸다.F는 그 입자에 가해지는 순력을 나타냅니다.그러면 입자의 시간 평균 운동 에너지는 다음과 같습니다.
여기서 첫 번째 등식은 뉴턴의 두 번째 법칙이고, 두 번째 선은 해밀턴의 방정식과 등분할 정리를 사용한다.N개의 입자로 이루어진 시스템을 합하면 수율이 높아집니다.
뉴턴의 제3법칙과 이상기체 가정에 따르면 시스템의 순력은 용기 벽에 의해 가해지는 힘이며, 이 힘은 가스의 압력 P에 의해 주어진다.이런 이유로
여기서 dS는 용기 벽을 따라 있는 최소 면적 요소입니다.위치 벡터 q의 분산은
발산정리는 을 암시한다.
여기서 dV는 용기 내의 극소 부피이고 V는 용기의 총 부피입니다.
이러한 평등을 종합하면, 생산량은
이는 N개의 입자에 대한 이상적인 가스 법칙을 즉시 암시합니다.
여기서 n = N/N은A 가스의 몰 수이고 R = Nk는AB 가스 상수입니다.
기타 치수
d차원 시스템의 경우 이상적인 가스 압력은 다음과 같습니다.[8]
서 L d L는 가스가 존재하는 d차원 영역의 부피입니다.압력의 치수는 치수에 따라 변한다는 점에 유의하십시오.
「 」를 참조해 주세요.
- 볼츠만 상수 – 입자 운동 에너지와 온도 관련 물리 상수
- 구성 일체형 – 열역학 및 통계물리학 기능
- 동적 압력 – 유체 역학 개념
- 가스 법칙
- 내부 에너지 – 시스템 내 에너지
- Van der Waals 방정식 – 이상적이지 않은 가스 동작을 설명하는 가스 상태 방정식
레퍼런스
- ^ 프랑스 국립도서관의 Clapeyron, E. (1835). "Mémoire sur la puissance motrice de la chaleur". Journal de l'École Polytechnique (in French). XIV: 153–90.팩시밀리(153-90페이지).
- ^ Krönig, A. (1856). "Grundzüge einer Theorie der Gase". Annalen der Physik und Chemie (in German). 99 (10): 315–22. Bibcode:1856AnP...175..315K. doi:10.1002/andp.18561751008. 프랑스 국립도서관의 팩시밀리 (315–22페이지).
- ^ Clausius, R. (1857). "Ueber die Art der Bewegung, welche wir Wärme nennen". Annalen der Physik und Chemie (in German). 176 (3): 353–79. Bibcode:1857AnP...176..353C. doi:10.1002/andp.18571760302. 프랑스 국립도서관의 팩시밀리(353-79페이지).
- ^ "Equation of State". Archived from the original on 2014-08-23. Retrieved 2010-08-29.
- ^ Moran; Shapiro (2000). Fundamentals of Engineering Thermodynamics (4th ed.). Wiley. ISBN 0-471-31713-6.
- ^ Raymond, Kenneth W. (2010). General, organic, and biological chemistry : an integrated approach (3rd ed.). John Wiley & Sons. p. 186. ISBN 9780470504765. Retrieved 29 January 2019.
- ^ J. R. Roebuck (1926). "The Joule-Thomson Effect in Air". Proceedings of the National Academy of Sciences of the United States of America. 12 (1): 55–58. Bibcode:1926PNAS...12...55R. doi:10.1073/pnas.12.1.55. PMC 1084398. PMID 16576959.
- ^ Khotimah, Siti Nurul; Viridi, Sparisoma (2011-06-07). "Partition function of 1-, 2-, and 3-D monatomic ideal gas: A simple and comprehensive review". Jurnal Pengajaran Fisika Sekolah Menengah. 2 (2): 15–18. arXiv:1106.1273. Bibcode:2011arXiv1106.1273N.
추가 정보
- Davis; Masten (2002). Principles of Environmental Engineering and Science. New York: McGraw-Hill. ISBN 0-07-235053-9.
외부 링크
- "Website giving credit to Benoît Paul Émile Clapeyron, (1799–1864) in 1834". Archived from the original on July 5, 2007.
- 헬름홀츠 자유 에너지와 분할 함수 사이의 관계를 사용하지만 등분할 정리는 사용하지 않는 이상 기체 법칙의 대체 통계 역학 도출이 제공되는 구성 적분(통계 역학).Vu-Quoc, L., Configuration integrential (Statistical mechanics), 2008. 이 Wiki 사이트는 다운되었습니다.2012년 4월 28일 웹 아카이브에서 이 기사를 참조하십시오.
- 기체 방정식 상세
































 같은 다른 기호가 부여된다.어떤 경우에도 가스 상수의 맥락 및/또는 단위는 보편적 또는 특정 가스 상수가
같은 다른 기호가 부여된다.어떤 경우에도 가스 상수의 맥락 및/또는 단위는 보편적 또는 특정 가스 상수가 





 상수입니다.동일한 물질을 두 가지 다른 조건 하에서 비교할 때, 법칙은 다음과 같이 기술될 수 있다.
상수입니다.동일한 물질을 두 가지 다른 조건 하에서 비교할 때, 법칙은 다음과 같이 기술될 수 있다.





























 있는 분자의 비율은
있는 분자의 비율은












 가스가 존재하는 d차원 영역의 부피입니다.압력의 치수는 치수에 따라 변한다는 점에 유의하십시오.
가스가 존재하는 d차원 영역의 부피입니다.압력의 치수는 치수에 따라 변한다는 점에 유의하십시오. 
