프로토셀
Protocell| 시리즈의 일부 |
| 진화생물학 |
|---|
 |
원세포(protobiont)는 세포와 생명의 기원에 대한 기본적인 전구체로 제안된 자기 조직화된, 내생적으로 질서 있는, 구형의 지질 모음입니다.[1][2] 진화의 중심적인 질문은 어떻게 단순한 원생세포가 처음 생겨났는지, 그리고 그들의 자손이 어떻게 다양화될 수 있는지, 따라서 시간이 지남에 따라 새로운 생물학적 출현(즉, 생물학적 진화)의 축적을 가능하게 하는 것입니다. 비록 기능적인 프로토셀이 실험실 환경에서 아직 달성되지는 않았지만, 그 과정을 이해하려는 목표는 도달할 수 있는 범위 내에 있습니다.[3][4][5][6]
원세포는 생물 발생 전 세포이며, 리보자임과 같은 생물학적으로 관련된 단순한 분자로 구성된 포함된 시스템이며, 단순한 지방산, 미네랄 구조 또는 암석 기공 구조로 구성된 것으로 생각되는 환경 및 다른 개체로부터 개체를 격리하는 단순한 막 구조로 캡슐화되었습니다.
개요
구획화는 생명의 기원에서 중요했습니다.[7] 멤브레인은 외부 환경과 분리된 밀폐된 구획을 형성하므로 세포에 기능적으로 특화된 수성 공간을 제공합니다. 막의 지질 이중층은 대부분의 친수성 분자(물에 의해 용해됨)에 대해 불침투성이기 때문에, 현대 세포는 폐기물의 수출뿐만 아니라 영양소 흡수를 달성하는 막 수송 시스템을 가지고 있습니다.[8] 이러한 분자 집합체가 개발되기 전에 프로토셀은 양친매성 분자를 사용하여 막 밀매 및 자가 증식과 같은 세포 기능과 관련된 소포 역학을 사용했을 가능성이 있습니다. 원시 지구에서는 유기화합물의 수많은 화학반응이 생명의 성분을 만들어냈습니다.[9] 이러한 물질 중에서 양친매성 분자는 분자 집합에서 세포 생명체로의 진화에 있어서 첫 번째 역할을 할 수 있습니다.[10][11] 소포 역학은 초기 대사와 결합된 자기 복제의 발달로 원세포를 향해 진행될 수 있습니다.[12] 원시 세포는 알칼라인 열수 분출구 또는 철 운석의 충돌 분화구 호수와 같은 다른 지질 환경에서 원시적인 대사 시스템(Wood-Ljungdahl 경로)을 가지고 있었을 가능성이 있습니다.[13]
원세포의 또 다른 개념적 모델은 헝가리의 이론 생물학자 티보르 간티에 의해 도입된 생명체의 기본 단위를 가리키는 "케모톤"('화학적 오토마톤'의 줄임말)이라는 용어와 관련이 있습니다.[14] 가장 오래된 프로토셀의 계산 초록입니다. Gánti는 1952년에 기본적인 아이디어를 생각해 냈고 1971년에 그의 책 "생명의 원리" (원래 헝가리어로 쓰여졌고 2003년에 영어로만 번역되었습니다)에서 그 개념을 공식화했습니다. 그는 케모톤을 모든 유기체의 원래 조상, 즉 마지막 보편적인 공통 조상으로 추측했습니다.[15]
케모톤 모델의 기본 가정은 생명체가 근본적으로 그리고 본질적으로 대사, 자기 복제, 그리고 이중성막의 세 가지 특성을 가져야 한다는 것입니다.[16] 대사 기능과 복제 기능은 함께 생명의 기본 기능에 필요한 자기 촉매 서브 시스템을 형성하고, 이 서브 시스템을 주변 환경과 분리하기 위해 멤브레인이 둘러싸고 있습니다. 따라서 이러한 특성을 가진 모든 시스템은 살아있는 것으로 간주될 수 있으며 자연 선택의 대상이 되는 자가 유지 세포 정보를 포함할 것입니다. 어떤 사람들은 이 모델이 진화 단위의 철학을 제공하기 때문에 생명의 기원에 상당한 기여를 했다고 생각합니다.[17]
구획화를 위한 선택성
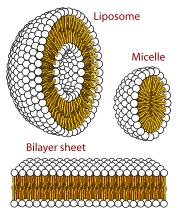
자가 조립 소포는 원시 세포의 필수 구성 요소입니다.[18] 열역학 제2법칙은 우주가 계속해서 무질서하게 될 것을 요구하지만(엔트로피), 생명체는 그것의 큰 조직화 정도에 의해 구별됩니다. 따라서 생명 과정과 비생명체를 분리하기 위해서는 경계가 필요합니다.[19] 이러한 근본적인 필요성은 지구상의 모든 유기체에서 발견되는 유일한 세포 구조인 세포막의 보편성에 의해 뒷받침됩니다.[20]
알려진 모든 세포가 기능하는 수성 환경에서, 세포를 둘러싸서 그 주변으로부터 분리하기 위해서는 비수성 장벽이 필요합니다.[21] 이 비수성 막은 자유 확산에 대한 장벽을 확립하여 장벽 내의 내부 환경을 조절할 수 있습니다. 서브시스템을 열역학적으로 분리해야 하는 필요성은 생명의 환원 불가능한 조건입니다.[21] 현대 생물학에서 이러한 분리는 보통 약 10미터 두께의−8 양친매성 이중층에 의해 이루어집니다.
아이린 A를 포함한 연구원들. Chen과 Jack W. Szostak은 기본 원세포의 단순한 물리화학적 특성이 다윈의 경쟁 및 에너지 저장의 원시적 형태를 포함하여 필수 세포 행동의 더 단순한 개념적 유사체를 생성할 수 있음을 입증했습니다. 막과 캡슐화된 내용물 사이의 이러한 협력적인 상호작용은 복제 분자에서 진정한 세포로의 전환을 크게 단순화할 수 있습니다.[22] 막 분자에 대한 경쟁은 안정화된 막을 선호할 것이며, 이는 가교된 지방산과 심지어 오늘날의 인지질의 진화에 대한 선택적인 이점을 시사합니다.[22] 이 미세 캡슐화는 막 내에서 대사, 작은 분자의 교환 및 큰 물질의 통과 방지를 가능하게 했습니다.[23] 캡슐화의 주요 이점은 화물의 용해도 증가와 화학 구배 형태의 에너지 생성을 포함합니다. 따라서 에너지는 종종 세포 호흡 중에 산소와 화학적으로 결합할 때 에너지를 방출하는 탄수화물, 지질 및 단백질과 같은 분자 구조에 있는 세포에 의해 저장된다고 합니다.[24][25]
소포, 미셀 및 막
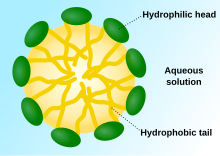
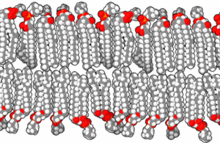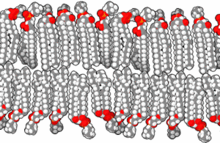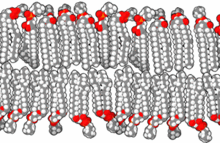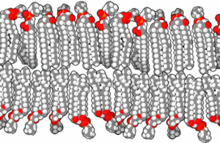
인지질을 물에 넣으면 분자들이 자발적으로 배열해 소수성 꼬리가 물에 가려지도록 해 이중층, 소포, 미셀 등의 막 구조가 형성됩니다.[26] 현대 세포에서 소포체는 대사, 수송, 부력 조절 [27]및 효소 저장에 관여합니다. 그들은 또한 천연 화학 반응 챔버 역할을 할 수 있습니다. 수용액에서 전형적인 소포 또는 미셀은 주변 용매와 접촉하는 친수성 "머리" 영역과 응집체를 형성하여 미셀 중심부의 소수성 단일 꼬리 영역을 격리합니다. 이 단계는 이중층에서 단일 꼬리 지질의 패킹 거동에 의해 발생합니다. 자연에서 지질 단분자층 소포와 미셀을 형성하는 자발적인 자기 조립 과정은 진화 초기에 존재했을지도 모르는 원시적인 소포나 원세포의 종류와 비슷하지만 오늘날의 생물의 이중층 막만큼 정교하지는 않습니다.[28] 길이가 7개 이하인 아미노산을 포함하는 짧고 양전하를 띤 소수성 펩타이드에 의해 유도된 정전기적 상호작용은 RNA를 기본 세포막인 소포막에 부착시킬 수 있습니다.[29][30]
초기 막은 인지질로 구성되기 보다는 단순 지방산의 단일층 또는 이중층으로 형성되었을 수 있으며, 이는 프리바이오틱 환경에서 더 쉽게 형성되었을 수 있습니다.[31] 지방산은 다양한 프리바이오틱 조건에서 실험실에서 합성되었으며 운석에서 발견되어 자연에서 지방산의 자연적 합성을 시사합니다.[32] 올레산 소포는 프리바이오틱 시대에 존재할 수 있었던 막 원세포의 좋은 모델을 나타냅니다.[33]
Cohen et al. (2022)은 초기 원세포막의 발달로 이어지는 지방산의 그럴듯한 프리바이오틱 생산이 금속이 풍부한 광물 표면에 풍부하게 존재하며, 아마도 충돌 분화구로부터 지질의 프리바이오틱 환경 질량을 10배2 증가시킨다는 것을 시사합니다.[34] 그들은 하데스 산맥에서 지방산의 세 가지 가능한 합성 경로를 평가했고, 이 금속 표면이 막 형성과 호환되는 10-101115 kg의 6-18 탄소 지방산을 생성할 수 있다는 것을 발견했습니다. 그들은 또한 알코올과 같은 대체 양친매성 물질이 지방산과 동시 합성되어 막 안정성을 향상시키는 데 도움이 될 수 있다고 제안합니다. 그러나, 이러한 생산에도 불구하고, 저자들은 순 지방산 합성이 지구의 수성 환경의 상당한 증발 없이는 자발적인 막 형성을 위한 충분한 농도를 산출하지 못할 것이라고 말합니다.
막 수송

세포 유기체의 경우 환경 및 다른 개체와 내용물을 교환하기 위해 구획화된 막 장벽을 가로질러 특정 분자의 수송이 필수적입니다. 예를 들어, 개체 간의 내용물 교환은 개체 간의 유전자 교환(수평적 유전자 전달)을 가능하게 하는데, 이는 세포 생명체의 진화에 중요한 요소입니다.[35] 현대 세포는 복잡한 단백질 기계에 의존하여 이러한 중요한 과정을 촉매할 수 있지만, 프로토셀은 보다 단순한 메커니즘을 사용하여 이를 달성했을 것입니다.
지방산으로[36] 구성된 원세포는 주변 환경과 작은 분자와 이온을 쉽게 교환할 수 있었을 것입니다.[37] 현대의 인지질 이중층 세포막은 낮은 투과성을 나타내지만 매우 특정한 방식으로 막을 가로질러 관련 분자를 능동적 및 수동적으로 수송하는 복잡한 분자 집합체를 포함합니다. 이러한 복잡한 결합체가 없으면 단순 지방산 기반 원세포막이 더 투과성이 높고 막을 통한 더 큰 비특이적 수송을 허용합니다.[7] 원세포막을 가로질러 고투과성을 갖는 분자는 뉴클레오사이드 일인산(NMP), 뉴클레오사이드 이인산(NDP) 및 뉴클레오사이드 삼인산(NTP)을 포함하고, 밀리몰 농도의 Mg를2+ 견딜 수 있습니다.[38] 삼투압은 또한 이러한 수동적인 막 수송과 관련하여 중요한 역할을 할 수 있습니다.[37]
환경적 효과는 DNA와 RNA와 같은 더 큰 분자가 원생세포의 막을 가로질러 수송되는 것이 가능한 조건을 촉발하는 것으로 제시되었습니다. 예를 들어, 낙뢰로 인한 전기천공이 이러한 운송을 가능하게 할 수 있다고 제안되었습니다.[39] 전기천공법은 막을 가로지르는 큰 인공 전기장의 적용에 의해 유도된 이중층 투과성의 급격한 증가입니다. 전기천공 시 막에 있는 지질 분자가 위치를 이동하여 핵산과 같은 소수성 분자가 지질 이중층을 통과할 수 있는 전도성 경로 역할을 하는 기공(구멍)이 열립니다.[40] 원형 세포와 주변 용액 사이의 유사한 내용물 전달은 동결 및 후속 해동에 의해 야기될 수 있습니다. 예를 들어, 낮과 밤의 주기가 반복적인 결빙을 유발하는 환경에서 발생할 수 있습니다. 실험실 실험은 그러한 조건들이 원세포 집단들 사이에 유전 정보의 교환을 가능하게 한다는 것을 보여주었습니다.[41] 이것은 막이 상전이 온도보다 약간 낮은 온도에서 투과성이 높다는 사실로 설명될 수 있습니다. 동결-해동 주기 동안 이 지점에 도달하면 크고 전하를 많이 띤 분자도 원세포막을 일시적으로 통과할 수 있습니다.
일부 분자 또는 입자는 이러한 조건에서도 지질 이중층을 통과하기에는 너무 크거나 너무 친수성이지만 소포의 융합 또는 싹트기를 통해 막을 가로질러 이동할 수 있으며,[42] 이는 동결-해동 주기에서도 관찰된 사건입니다.[43] 이것은 결국 분자가 원세포 내부로 이동하는 것을 촉진하거나 (세포내이입) 그 내용물을 세포외 공간으로 방출하는 (세포외이입) 메커니즘으로 이어졌을 수 있습니다.[42]
적절한 프리바이오틱 환경
참고 항목: 생체 생성: 적합한 지질 환경, RNA World: Prebiotic RNA 합성
열수계
깊은 바다의 열수분출구에서 생명이 시작되었다고 제안되었지만, 2012년의 한 연구는 온천이 생명의 기원에 이상적인 특성을 가지고 있다고 제안합니다.[44] 결론은 주로 세포질이 해양 환경에 널리 퍼져 있지 않고 칼륨, 아연, 망간, 인산 이온이 풍부한 현대 세포의 화학에 기초하고 있습니다. 이러한 조건은 뜨거운 열수 유체가 이온을 표면으로 가져오는 곳, 즉 간헐천, 진흙 냄비, 푸마롤 및 기타 지열 특징과 같은 곳에서만 발견된다고 연구자들은 주장합니다. 이러한 발연하고 거품이 나는 분지 안에서 아연과 망간 이온이 풍부한 물이 얕은 웅덩이에서 모아지고, 식히고, 응축될 수 있었습니다.[44] 그러나 최근 바닷물보다 나트륨의 이온 농도가 낮은 알칼리 열수 분출구가 발견된 것은 해양 환경에서 고농도의 칼륨을 발견할 수 있음을 시사합니다.[45]
1990년대의 한 연구는 몬모릴로나이트 점토가 하나의 RNA 분자로 자발적으로 결합된 50개나 되는 뉴클레오티드의 RNA 사슬을 만드는 데 도움을 줄 수 있다는 것을 보여주었습니다.[46] 그 후 2002년, 지방산 미셀(지질구) 용액에 몬모릴로나이트를 첨가함으로써 점토가 소포 형성 속도를 100배나 빠르게 한다는 사실이 밝혀졌습니다.[46]
일부 광물은 열수 분출구 또는 간헐천에서 방출되었을 수 있는 가스인 수소 및 일산화탄소 가스로부터 지방산의 탄화수소 꼬리의 단계적 형성을 촉매할 수 있습니다. 다양한 길이의 지방산은 결국 주변 물로 방출되지만,[47] 소포 형성은 더 높은 농도의 지방산을 필요로 하기 때문에 원세포 형성은 간헐천, 머드포트와 같은 육지로 향하는 열수 담수 환경에서 시작되었다고 제안됩니다. 물이 용질을 증발시키고 농축시키는 푸마롤 및 기타 지열 기능.[46][48][49]
2019년에 Nick Lane과 동료들은 pH 6.5에서 >12, 온도 70°C 사이의 해수 조건에서 소포가 쉽게 형성된다는 것을 보여주었는데, 이는 지질 혼합물이 존재하는 알칼리 열수 분출구의 조건을 모방하기 위한 것이지만 [50]이러한 환경에서 이러한 혼합물에 대한 프리바이오틱 공급원은 불분명합니다. 바닷물 속의 단순한 양친매성 화합물은 이온성 용질의 농도가 높기 때문에 소포로 조립되지 않습니다. 연구에 따르면 소포는 소금 이온과 마그네슘 이온이 있는 상태에서도 프리바이오틱 아미노산에 의해 결합되고 안정화될 수 있습니다.[51]
온천 상태에서는 이온성 용질의 농도가 더 낮은 소포의 자가 조립이 발생합니다.[52] 과학자들은 실험실의 알칼리 열수 환기구 조건에서 RNA를 올리고머화했습니다. 길이가 4단위로 추정되었지만 RNA 중합체가 그러한 환경에서 합성되었을 가능성이 있음을 의미합니다.[53] 온천에서의 실험 연구는 실험실보다 RNA 유사 중합체의 수율을 높였습니다. 폴리머는 재수화될 때 지방산 소포에 캡슐화되어 생물 발생의 온천 가설을 더욱 뒷받침합니다.[54] 이러한 습식-건조 사이클은 소포의 안정성과 결합력도 향상시켰습니다.[51] 자외선 노출은 또한 뉴클레오티드와 같은 안정적인 생체 분자의 합성을 촉진하는 것으로 나타났습니다.[55][56]
화학삼투증의 기원에서 초기 세포가 알칼리 열수 분출구에서 유래했다면 무기막 구조가 암석 공동에 있는 동안 산성 해양과 백인 흡연자의 알칼리성 물에 의해 양성자 구배가 유지될 수 있습니다.[57][51] 초기 세포가 온천과 같은 육상 웅덩이에서 유래했다면 머치슨 운석과 같은 운석에 존재하는 퀴논은 전자 수용체인 페리시아나이드가 결합된 산화환원 반응에 의해 양성자 구배의 발달을 촉진할 것입니다. 소포 안에 있었고 황 화합물 같은 전자 공여체는 지질막 밖에 있었습니다.[52][58] "물 문제" 때문에 원시 ATP 합성효소와 다른 생체 분자는 지상 풀과는 달리 열수 분출구에서 습식-건조 주기가 없기 때문에 가수분해를 거치게 됩니다.[52] 다른 연구자들은 심해 열수 분출구에서 미네랄 젤로 코팅된 열수 기공 시스템을 막 구조의 대체 구획에 제안하고 생체 고분자의 생화학적 반응을 촉진하며 "물 문제"를 해결할 수 있습니다.[59][57] 데이비드 디머(David Deamer)와 브루스 데이머(Bruce Damer)는 중합 시 생체 분자가 이러한 기공 시스템 내에 갇힐 것이며 조합 선택을 거치지 않을 것이라고 주장합니다.[52] 알칼리 열수 분출구의 촉매 FeS 및 NiS 벽도 중합을 촉진하는 것으로 제시되었습니다.[60]
그러나 Jackson(2016)은 알칼리 열수 분출구와 산성 하데스 해수 사이의 pH 구배가 프리바이오틱 합성에 어떤 영향을 미칠 수 있는지 평가합니다.[61] 이 평가에서 크게 세 가지 비판이 나옵니다. 첫째, 난류 pH 구배 사이에 적절하게 위치한 막의 유지 및 안정성은 믿을 수 없는 것처럼 보였습니다. 그들은 CaCO와3 Mg(OH)2 침전물의 제안이 지하 기공에서 유체 혼합과 상호작용하여 만족스러운 환경을 만들어내지 못한다고 주장합니다. 둘째, 그들은 열수 시스템에서 이용 가능한 주요 에너지 구배를 활용하는 데 필요한 분자 집합체가 너무 복잡하여 생명의 기원과 관련이 없었다고 제안합니다. 마지막으로, 그들은 분자 집합체가 이용 가능한 열수 에너지를 수확할 수 있었다고 하더라도, 열수 분출구 가설의 지지자들이 받아들인 제안된 막 두께 내에서 작동하기에는 그 집합체들이 너무 컸을 것이라고 주장합니다. 2017년 Jackson은 한 유기체가 에너지를 위해 자연 pH 구배를 활용하여 알칼리 열수 기공에서 성공적으로 유래하더라도 단독으로 진화했던 환기 환경에서 나온 후 환경의 급격한 변화를 견딜 수 없을 것이라고 제안하며 한 걸음 더 나아갔습니다.[62] 그러나 이러한 출현은 서식지의 다양화와 에너지 전략을 가능하게 하는 생명의 틈새 분화에 필수적입니다. 이러한 주장에 대한 반론은 알칼리 열수 분출구에서 생화학적 경로와 지구화학적 시스템 사이의 밀접한 유사성이 가설에 장점이 있으며 이러한 원세포에 대한 선택이 환경 변화에 대한 회복력을 향상시켜 출현 및 분포를 허용할 것임을 시사합니다.[63]
다른 연구자들은 자외선, 황화아연 광촉매, 연속적인 습윤-건조 사이클의 발생에 노출된 열수성 화산 연못에서 기원한 생명체가 현대 생화학과 비슷하지 않을 것이라고 생각해 왔습니다.[64][65][66] 최대 ATP 합성은 높은 수분 활성과 낮은 이온 농도에서 발생하는 것으로 나타났습니다. 그럼에도 불구하고, 일부 얕은 열수 분출구는 담수를 방출하고 하데안 해양의 2가 양이온 농도는 현대 해양보다 낮을 가능성이 있기 때문에 열수 분출구는 여전히 실현 가능한 환경으로 간주됩니다. 닉 레인(Nick Lane)과 공동 저자들은 "알칼리 열수 시스템은 Ca와2+ Mg2+ 이온을 아라곤라이트와 브루사이트로 침전시키는 경향이 있으므로 일반적으로 그 농도는 평균 해양 값보다 훨씬 낮습니다. Hadean 시스템과 관련된 모델링 작업은 Ca2+ 및2+ Mg의 열수 농도가 <1mM일 가능성이 높으며, 이는 여기에서 인산화를 강화하는 범위에 있음을 나타냅니다. 염도 및 고압을 포함하여 여기서 고려되는 다른 조건은 해저 열수 시스템(일반적으로 100~300Bar 범위의 압력을 갖는)에서 ATP 합성에 제한된 영향만 미칠 것입니다. 알칼리 열수 시스템은 또한 ADP 인산화를 위한 Fe3+ in situ를 생성했을 수 있습니다. 열역학적 모델링은 해저 시스템에서 알칼리 열수 유체와 해수를 혼합하면 철과 제2철 사이의 연속적인 순환을 촉진하여 잠재적으로 가용성 염화수소 제2철을 형성할 수 있음을 보여줍니다. 이는 우리의 실험이 황산제2철과 동일한 효과를 가지고 있음을 보여줍니다."[67]
몬모릴로나이트 거품
또 다른 그룹은 무기 점토 미세 구획 내부에 원시 세포가 형성되었을 수 있으며, 이는 복잡한 유기 분자의 합성 및 구획화를 위한 이상적인 용기를 제공할 수 있다고 제안합니다.[68] 점토로 장식된 기포는 몬모릴로나이트 점토 입자가 물속 기포의 외부 표면에 모이면 자연적으로 형성됩니다. 이것은 환경에서 쉽게 구할 수 있는 물질로 반투과성 소포를 만듭니다. 저자들은 몬모릴로나이트가 화학 촉매 역할을 하는 것으로 알려져 지질이 막을 형성하고 단일 뉴클레오티드가 RNA 가닥으로 결합하도록 유도한다고 말합니다. 점토 기포가 터지면서 지질막에 결합된 생성물이 주변 배지로 방출될 때 원시적인 번식을 상상할 수 있습니다.[68]
막이 없는 물방울
원시 구획을 형성하는 또 다른 방법은 생화학 물질(단백질 및 RNA)을 숙주화하거나 주변 지질 집합체를 스캐폴드하는 능력을 가진 폴리에스테르 막이 없는 구조입니다.[69][70] 이 물방울들이 유전 물질 쪽으로 새는 동안, 이 새는 것은 자손 가설을 촉진했을 수 있습니다.[71]
코아세르베츠
연구자들은 또한 코아세르베이트라고 불리는 수성 상분리 액적에서 조기 캡슐화를 제안했습니다. 이러한 액적은 거대 분자의 축적에 의해 구동되어 보다 묽은 액체 매질 내에서 뚜렷한 조밀한 상액 액적을 생성합니다.[7] 이러한 비말은 배지의 전단력과 난류를 통해 내부 구성을 유지하면서 전파될 수 있으며 초기 원세포의 캡슐화를 복제하는 수단으로 작용했을 수 있습니다. 그러나 복제는 매우 무질서했고 물방울 융합은 일반적이어서 경쟁과 초기 다윈 선택으로 이어지는 뚜렷한 구획화에 대한 진정한 잠재력을 입증하는 데 의문이 제기됩니다.
성생식
Eigen et al.[72] and Woese는[73] 초기 원생세포의 유전체가 단일가닥 RNA로 구성되어 있으며, 개별 유전자는 오늘날의 DNA 유전체처럼 말단에서 말단으로 연결되는 것이 아니라 별개의 RNA 분절에 해당한다고 제안했습니다. 모든 RNA 세그먼트의 단일 병변은 (예를 들어, 복제를 차단하거나 필수 유전자의 기능을 억제함으로써) 원세포에 잠재적으로 치명적일 수 있기 때문에, 반수체(각 RNA 유전자의 한 사본)인 원세포는 손상에 취약할 것입니다.
손상에 대한 취약성은 각 원세포에서 각 RNA 세그먼트의 2개 이상의 사본을 유지함으로써, 즉 이배체 또는 다배체를 유지함으로써 감소될 수 있습니다. 게놈 중복을 통해 손상된 RNA 세그먼트를 상동체의 추가 복제로 대체할 수 있습니다. 그러한 단순한 유기체의 경우, 유전 물질에 묶여 있는 가용 자원의 비율은 전체 자원 예산의 많은 부분을 차지할 것입니다. 제한된 자원 조건에서 원세포 번식률은 배수성 수와 반비례할 가능성이 높으며, 원세포의 적합성은 중복 비용에 의해 감소될 것입니다. 결과적으로 중복 비용을 최소화하면서 손상된 RNA 유전자에 대처하는 것은 초기 프로토셀의 근본적인 문제였을 것입니다.
중복성 유지 비용과 유전체 손상 비용이 균형을 이루는 비용편익 분석이 수행되었습니다.[74] 이러한 분석을 통해 광범위한 상황에서 선택된 전략은 각 원세포가 반수체이지만 다른 반수체 원세포와 주기적으로 융합하여 일시적인 이배체를 형성하는 것이라는 결론을 도출했습니다. 반수체 상태의 유지는 성장 속도를 극대화합니다. 주기적인 융합은 치명적으로 손상된 원세포의 상호 재활성화를 허용합니다. 일시적인 이배체에 각 RNA 유전자의 손상 없는 사본이 적어도 하나 존재하면 생존 가능한 자손이 형성될 수 있습니다. 하나가 아닌 두 개의 생존 가능한 딸 세포가 생산되려면 융합된 원세포의 분열 이전에 손상된 모든 RNA 유전자와 상동성인 온전한 RNA 유전자의 추가 복제가 필요합니다. 반수체 번식의 주기는 때때로 일시적인 이배체 상태로 융합된 후 반수체 상태로 분열되는 가장 원시적인 형태의 성 순환으로 간주될 수 있습니다.[74][75] 이 성 순환이 없다면 필수 RNA 유전자에 손상을 입은 반수체 원세포는 그냥 죽게 될 것입니다.
초기 성 주기에 대한 이 모델은 가상적이지만, 알려진 가장 단순한 유기체 중 하나인 분절된 RNA 바이러스의 알려진 성 행동과 매우 유사합니다. 유전체가 8개의 물리적으로 분리된 단일가닥 RNA 세그먼트로 구성된 인플루엔자 바이러스가 [76]이런 유형의 바이러스의 예입니다. 분절된 RNA 바이러스에서 '교배'는 숙주 세포가 적어도 두 개의 바이러스 입자에 의해 감염될 때 발생할 수 있습니다. 이러한 바이러스가 각각 치명적인 손상을 가진 RNA 세그먼트를 포함하는 경우, 감염된 세포에 각 바이러스 유전자의 손상되지 않은 사본이 적어도 하나 존재하는 경우 다중 감염이 재활성화로 이어질 수 있습니다. 이러한 현상을 "다중 재활성화"라고 합니다. 다중성 재활성화는 UV 조사 및 [77]이온화 방사선에 의한 RNA 손상 유도 후 인플루엔자 바이러스 감염에서 발생하는 것으로 보고되었습니다.[78]
인공모형
Langmuir–Blodgett 퇴적물
고체 표면에 분자를 증착하는 데 일반적으로 사용되는 기술인 Langmuir–Blodgett 증착을 시작으로, 과학자들은 임의의 복잡성을 가진 인지질 막을 층층이 쌓아서 조립할 수 있습니다.[79][80] 이러한 인공 인지질 막은 정제된 막과 제자리에서 발현된 막 단백질의 기능적 삽입을 지원합니다.[80] 이 기술은 우주 생물학자들이 최초의 살아있는 세포가 어떻게 시작되었는지를 이해하는 데 도움이 될 수 있습니다.[79]
지와누 원세포

지와누 원세포는 세포와 유사한 구조를 가지고 있고 기능적인 생명 특성을 가지고 있는 것처럼 보이는 합성 화학 입자입니다.[81] 1963년 햇빛을 쬐면서 단순한 광물과 염기성 유기물로부터 처음 합성된 이 물질은 지금도 일부 대사 능력, 반투과성 막, 아미노산, 인지질, 탄수화물, RNA 유사 분자의 존재가 보고되고 있습니다.[81][82] 지와누의 성격과 속성은 여전히 명확하게 밝혀져야 합니다.[81][82][83]
유사한 합성 실험에서 물, 메탄올, 암모니아 및 일산화탄소의 냉동 혼합물이 자외선(UV) 방사선에 노출되었습니다. 이 조합은 물에 담글 때 덩어리나 소포를 형성하기 위해 스스로 조직화되는 많은 양의 유기물을 산출했습니다.[84] 연구자들은 이 소구체들이 생명의 화학적 성질을 감싸고 집중시키는 세포막과 닮았다고 생각하여 그 내부와 외부를 분리했습니다. 구체의 크기는 10에서 40마이크로 미터 (0.00039에서 0.00157인치) 사이, 즉 적혈구의 크기였습니다. 놀랍게도, 자외선에 노출되었을 때 구형이 형광을 띠거나 빛났습니다. 이렇게 UV를 흡수하여 가시광선으로 바꾸는 것은 원시 세포에 에너지를 공급하는 하나의 가능한 방법으로 여겨졌습니다. 만약 이러한 소구체가 생명의 기원에 역할을 했다면, 그 형광체는 원시 광합성의 전조일 수 있었습니다. 이러한 형광은 자외선에 의해 가해질 수 있는 손상을 확산시켜 자외선 차단제 역할을 하는 이점도 제공합니다. 태양의 가장 파괴적인 자외선을 차단하는 오존층이 광합성 생물이 산소를 생산하기 시작한 후에야 형성되었기 때문에 이러한 보호 기능은 초기 지구 생명체에게 필수적이었을 것입니다.[85]
생체와 유사한 구조
세 종류의 지와누가 합성된 것이 보고되었는데, 그 중 두 종류는 유기질이었고, 나머지 하나는 무기질이었습니다. 다른 유사한 무기 구조도 생산되었습니다. 조사 중인 과학자(V. O. Kalinenko)는 그들을 "생물과 같은 구조"와 "인공 세포"라고 불렀습니다. 전기장의 영향을 받아 증류수(한천 겔에서 뿐만 아니라)에서 형성되는 이들은 단백질, 아미노산, 퓨린 또는 피리미딘 염기 및 특정 효소 활성이 부족합니다. NASA 연구원들에 따르면, "현재 알려진 생물학과 생화학의 과학적 원리는 살아있는 무기 단위를 설명할 수 없다." 그리고 "이러한 살아있는 단위의 존재는 증명되지 않았다."[86]
유사 연구: 플로우 셀
2014년 3월, 나사의 제트 추진 연구소는 생명의 기원을 연구하는 독특한 방법인 연료 전지를 보여주었습니다.[87] 연료전지는 전자도 분자와 전달된다는 점에서 생물학적인 전지와 비슷합니다. 두 경우 모두 전기와 전력으로 이어집니다. 연료 전지에 대한 연구는 지구가 해저에서 전기 에너지를 제공한다는 것이 원시 전지 개발의 중요한 요소임을 시사합니다. "이 에너지는 생명을 시작할 수 있었고 생명이 생긴 후에도 생명을 유지할 수 있었습니다. 이제 우리는 지구뿐만 아니라 화성, 유로파, 그리고 태양계의 다른 곳에서도 생명체가 생겨날 수 있도록 도와줄 수 있었던 다양한 물질과 환경을 실험할 수 있는 방법을 갖게 되었습니다."[87]
윤리, 논란, 연구 고려 사항
원시 세포 연구는 "인공 생명"에 대한 모호한 정의에 대한 비판을 포함하여 논란과 반대 의견을 만들었습니다.[88] 원세포에 대한 가장 광범위한 우려는 통제되지 않은 복제를 통해 인간의 건강과 환경에 대한 잠재적인 위협이지만, 생명의 기본 단위를 만드는 것은 가장 시급한 윤리적 문제입니다.[89]
게다가, 지구상의 생명의 원세포 기원에 대한 조건에 대한 가정은 여전히 논의되고 있습니다. 이 분야의 과학자들은 서로 다른 원세포 형태, 지질학적 조건 및 합성 계획의 프리바이오틱 가능성을 보다 구체적으로 제한하기 위해 이론적 추측보다 추가 가설 기반 실험의 중요성을 강조합니다.[90]
참고 항목
- 생물발생 – 생명이 무생물에서 발생하는 자연적 과정
- 인공 세포 – 생물 세포의 공학적 구성 요소
- 가장 오래된 생명체 – 열수분출구 부근에서 화석화된 것으로 추정되는 미생물
- 출현 – 복잡한 시스템에서 예측 불가능한 현상
- 엔트로피와 생명 – 엔트로피의 열역학적 개념과 생명체의 진화와의 관계
- 마지막 보편적 조상 – 지구상에 존재하는 모든 생명체의 가장 최근 공통 조상 재연결
- 사전 셀 – 완전한 셀 이전의 가상적인 삶
- 영화 프로토셀 서커스
- 사이비-판스페르미아
- RNA 세계 가설 – 지구 생명체의 초기 진화 역사의 가설적 단계 방향 하는 페이지
- 합성생물학 – 생물학과 공학의 학제간 분과
참고문헌
- ^ Chen, Irene A.; Walde, Peter (July 2010). "From Self-Assembled Vesicles to Protocells". Cold Spring Harb Perspect Biol. 2 (7): a002170. doi:10.1101/cshperspect.a002170. PMC 2890201. PMID 20519344.
- ^ Garwood, Russell J. (2012). "Patterns In Palaeontology: The first 3 billion years of evolution". Palaeontology Online. 2 (11): 1–14. Retrieved June 25, 2015.
- ^ National Science Foundation (2013). "Exploring Life's Origins – Protocells". Retrieved 2014-03-18.
- ^ Chen, Irene A. (8 December 2006). "The Emergence of Cells During the Origin of Life". Science. 314 (5805): 1558–59. doi:10.1126/science.1137541. PMID 17158315.
- ^ Zimmer, Carl (26 June 2004). "What Came Before DNA?". Discover Magazine: 1–5.
- ^ Rasmussen, Steen (2 July 2014). "Scientists Create Possible Precursor to Life". A Letters Journal Exploring the Frontiers of Physics. Vol. 107, no. 2. Astrobiology Web. Retrieved 2014-10-24.
- ^ a b c Joyce, Gerald F.; Szostak, Jack W. (September 2018). "Protocells and RNA Self-Replication". Cold Spring Harbor Perspectives in Biology. 10 (9): a034801. doi:10.1101/cshperspect.a034801. ISSN 1943-0264. PMC 6120706. PMID 30181195.
- ^ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Morgan, David; Raff, Martin; Roberts, Keith; Walter, Peter (2014). Molecular Biology of the Cell (6 ed.). New York: Garland Science. ISBN 978-1317563754.
- ^ Liu, Ziwei; Wu, Long-Fei; Kufner, Corinna L.; Sasselov, Dimitar D.; Fischer, Woodward W.; Sutherland, John D. (Oct 2021). "Prebiotic photoredox synthesis from carbon dioxide and sulfite". Nature Chemistry. 13 (11): 1126–1132. doi:10.1038/s41557-021-00789-w. ISSN 1755-4349. PMC 7611910. PMID 34635812.
- ^ Deamer, D.W.; Dworkin, J.P. (2005). "Chemistry and Physics of Primitive Membranes". Top. Curr. Chem. Topics in Current Chemistry. 259: 1–27. doi:10.1007/b136806. ISBN 3-540-27759-5.
- ^ Walde, P (2006). "Surfactant Assemblies and their various possible roles for the origin(s) of life". Orig. Life Evol. Biosph. 36 (2): 109–50. Bibcode:2006OLEB...36..109W. doi:10.1007/s11084-005-9004-3. hdl:20.500.11850/24036. PMID 16642266. S2CID 8928298.
- ^ Sakuma, Yuka; Imai, Masayuki (2015). "From Vesicles to Protocells: The Roles of Amphiphilic Molecules". Life. 5 (1): 651–675. Bibcode:2015Life....5..651S. doi:10.3390/life5010651. PMC 4390873. PMID 25738256.
- ^ Varma, Sreejith J.; Muchowska, Kamila B.; Chatelain, Paul; Moran, Joseph (April 23, 2018). "Native iron reduces CO2 to intermediates and end-products of the acetyl CoA pathway". Nature Ecology & Evolution. 2 (6): 1019–1024. doi:10.1038/s41559-018-0542-2. ISSN 2397-334X. PMC 5969571. PMID 29686234.
- ^ Marshall, Michael (14 December 2020). "He may have found the key to the origins of life. So why have so few heard of him? - Hungarian biologist Tibor Gánti is an obscure figure. Now, more than a decade after his death, his ideas about how life began are finally coming to fruition". National Geographic Society. Archived from the original on December 14, 2020. Retrieved 15 December 2020.
- ^ Hugues Bersini (2011). "Minimal cell: the computer scientist's point of view". In Muriel Gargaud; Purificación López-Garcìa; Hervé Martin (eds.). Origins and Evolution of Life: An Astrobiological Perspective. Cambridge University Press. pp. 60–61. ISBN 9781139494595.
- ^ Van Segbroeck, S.; Nowé, A.; Lenaerts, T. (2009). "Stochastic simulation of the chemoton". Artif Life. 15 (2): 213–226. CiteSeerX 10.1.1.398.8949. doi:10.1162/artl.2009.15.2.15203. PMID 19199383. S2CID 10634307.
- ^ Hoenigsberg, H. F. (2007). "From geochemistry and biochemistry to prebiotic evolution...we necessarily enter into Gánti's fluid automata". Genetics and Molecular Research. 6 (2): 358–373. PMID 17624859.
- ^ Chen, Irene A.; Walde, Peter (July 2010). "From Self-Assembled Vesicles to Protocells". Cold Spring Harb Perspect Biol. 2 (7): a002170. doi:10.1101/cshperspect.a002170. PMC 2890201. PMID 20519344.
- ^ Shapiro, Robert (12 February 2007). "A Simpler Origin for Life". Scientific American. 296 (6): 46–53. Bibcode:2007SciAm.296f..46S. doi:10.1038/scientificamerican0607-46. PMID 17663224.
- ^ Vodopich, Darrell S.; Moore., Randy (2002). "The Importance of Membranes". Biology Laboratory Manual, 6/a. McGraw-Hill. Retrieved 2014-03-17.
- ^ a b Morowitz HJ. (1992) 세포 생명의 시작. 예일대 출판부, 뉴헤이븐, 런던
- ^ a b Chen, Irene A. (8 December 2006). "The Emergence of Cells During the Origin of Life". Science. 314 (5805): 1558–59. doi:10.1126/science.1137541. PMID 17158315.
- ^ Chang, Thomas Ming Swi (2007). Artificial cells : biotechnology, nanomedicine, regenerative medicine, blood substitutes, bioencapsulation, cell/stem cell therapy. Hackensack, New Jersey: World Scientific. ISBN 978-981-270-576-1.
- ^ Knowles, J. R. (1980). "Enzyme-catalyzed phosphoryl transfer reactions". Annu. Rev. Biochem. 49: 877–919. doi:10.1146/annurev.bi.49.070180.004305. PMID 6250450.
- ^ Campbell, Neil A.; Williamson, Brad; Heyden, Robin J. (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 978-0-13-250882-7.
- ^ Garwood, Russell J. (2012). "Patterns In Palaeontology: The first 3 billion years of evolution". Palaeontology Online. 2 (11): 1–14. Retrieved June 25, 2015.
- ^ Walsby, A. E. (1994). "Gas vesicles". Microbiological Reviews. 58 (1): 94–144. doi:10.1128/MMBR.58.1.94-144.1994. PMC 372955. PMID 8177173.
- ^ Szostak, Jack W. (3 September 2004). "Battle of the Bubbles May Have Sparked Evolution". Howard Hughes Medical Institute.
- ^ "Peptide glue may have held first protocell components together".
- ^ Kamat, Neha P.; Tobé, Sylvia; Hill, Ian T.; Szostak, Jack W. (2015). "Electrostatic Localization of RNA to Protocell Membranes by Cationic Hydrophobic Peptides". Angewandte Chemie International Edition. 54 (40): 11735–39. doi:10.1002/anie.201505742. PMC 4600236. PMID 26223820.
- ^ National Science Foundation (2013). "Membrane Lipids of Past and Present". Exploring Life's Origins Project – A timeline of Life's Evolution. Retrieved 2014-03-17.
- ^ Chen, Irene A. (8 December 2006). "The Emergence of Cells During the Origin of Life". Science. 314 (5805): 1558–59. doi:10.1126/science.1137541. PMID 17158315.
- ^ Douliez, Jean-Paul; Zhendre, Vanessa; Grélard, Axelle; Dufourc, Erick J. (24 November 2014). "Aminosilane/Oleic Acid Vesicles as Model Membranes of Protocells". Langmuir. 30 (49): 14717–24. doi:10.1021/la503908z. PMID 25420203.
- ^ Cohen, Zachary R.; Todd, Zoe R.; Wogan, Nicholas; Black, Roy A.; Keller, Sarah L.; Catling, David C. (2023-01-19). "Plausible Sources of Membrane-Forming Fatty Acids on the Early Earth: A Review of the Literature and an Estimation of Amounts". ACS Earth and Space Chemistry. 7 (1): 11–27. doi:10.1021/acsearthspacechem.2c00168. ISSN 2472-3452. PMC 9869395. PMID 36704178.
- ^ Gyles, C.; Boerlin, P. (2013-12-06). "Horizontally Transferred Genetic Elements and Their Role in Pathogenesis of Bacterial Disease". Veterinary Pathology. 51 (2): 328–340. doi:10.1177/0300985813511131. PMID 24318976. S2CID 206510894.
- ^ Müller, A. W. (June 2006). "Re-creating an RNA world". Cell Molelecular Life Science. 63 (11): 1278–1293. doi:10.1007/s00018-006-6047-1. PMID 16649141. S2CID 36021694.
- ^ a b Chen, Irene A.; Walde, Peter (July 2010). "From Self-Assembled Vesicles to Protocells". Cold Spring Harb Perspect Biol. 2 (7): a002170. doi:10.1101/cshperspect.a002170. PMC 2890201. PMID 20519344.
- ^ Ma, Wentao; Yu, Chunwu; Zhang, Wentao; Hu, Jiming (Nov 2007). "Nucleotide synthetase ribozymes may have emerged first in the RNA world". RNA. 13 (11): 2012–2019. doi:10.1261/rna.658507. PMC 2040096. PMID 17878321.
- ^ Demanèche, S.; Bertolla, F.; Buret, F.; et al. (August 2001). "Laboratory-scale evidence for lightning-mediated gene transfer in soil". Applied and Environmental Microbiology. 67 (8): 3440–3444. Bibcode:2001ApEnM..67.3440D. doi:10.1128/AEM.67.8.3440-3444.2001. PMC 93040. PMID 11472916.
- ^ Neumann, E.; Schaefer-Ridder, M.; Wang, Y.; Hofschneider, P. H (1982). "Gene transfer into mouse lyoma cells by electroporation in high electric fields". EMBO J. 1 (7): 841–845. doi:10.1002/j.1460-2075.1982.tb01257.x. PMC 553119. PMID 6329708.
- ^ Litschel, Thomas; Ganzinger, Kristina A.; Movinkel, Torgeir; Heymann, Michael; Robinson, Tom; Hannes Mutschler; Schwille, Petra (2018). "Freeze-thaw cycles induce content exchange between cell-sized lipid vesicles". New Journal of Physics. 20 (5): 055008. Bibcode:2018NJPh...20e5008L. doi:10.1088/1367-2630/aabb96.
- ^ a b Norris, V.; Raine, D. J. (October 1998). "A fission-fussion origin for life". Orig Life Evol Biosph. 28 (4): 523–537. Bibcode:1998OLEB...28..523N. doi:10.1023/A:1006568226145. PMID 9742727. S2CID 24682163.
- ^ Tsuji, Gakushi; Fujii, Satoshi; Sunami, Takeshi; Yomo, Tetsuya (2016-01-19). "Sustainable proliferation of liposomes compatible with inner RNA replication". Proceedings of the National Academy of Sciences. 113 (3): 590–595. Bibcode:2016PNAS..113..590T. doi:10.1073/pnas.1516893113. PMC 4725462. PMID 26711996.
- ^ a b Switek, Brian (13 February 2012). "Debate bubbles over the origin of life". Nature –!News.
- ^ Brunk, Clifford F.; Marshall, Charles R. (2021-07-14). "'Whole Organism', Systems Biology, and Top-Down Criteria for Evaluating Scenarios for the Origin of Life". Life. 11 (7): 690. Bibcode:2021Life...11..690B. doi:10.3390/life11070690. ISSN 2075-1729. PMC 8306273. PMID 34357062.
- ^ a b c Zimmer, Carl (26 June 2004). "What Came Before DNA?". Discover Magazine: 1–5.
- ^ National Science Foundation (2013). "Membrane Lipids of Past and Present". Exploring Life's Origins Project – A timeline of Life's Evolution. Retrieved 2014-03-17.
- ^ Szostak, Jack W. (4 June 2008). "Researchers Build Model Protocell Capable of Copying DNA". HHMI News. Howard Hughes Medical Institute.
- ^ Cohen, Philip (23 October 2003). "Clay's matchmaking could have sparked life". New Scientist.
Journal reference: Science (vol. 302, p. 618)
- ^ Jordan, Sean F.; Rammu, Hanadi; Zheludev, Ivan N.; Hartley, Andrew M.; Maréchal, Amandine; Lane, Nick (4 November 2019). "Promotion of protocell self-assembly from mixed amphiphiles at the origin of life" (PDF). Nature Ecology & Evolution. 3 (12): 1705–1714. doi:10.1038/s41559-019-1015-y. PMID 31686020. S2CID 207891212.
- ^ a b c Cornell, Caitlin E.; Black, Roy A.; Xue, Mengjun; Litz, Helen E.; Ramsay, Andrew; Gordon, Moshe; Mileant, Alexander; Cohen, Zachary R.; Williams, James A.; Lee, Kelly K.; Drobny, Gary P.; Keller, Sarah L. (2019-08-27). "Prebiotic amino acids bind to and stabilize prebiotic fatty acid membranes". Proceedings of the National Academy of Sciences. 116 (35): 17239–17244. Bibcode:2019PNAS..11617239C. doi:10.1073/pnas.1900275116. ISSN 0027-8424. PMC 6717294. PMID 31405964.
- ^ a b c d Damer, Bruce; Deamer, David (2020-04-01). "The Hot Spring Hypothesis for an Origin of Life". Astrobiology. 20 (4): 429–452. Bibcode:2020AsBio..20..429D. doi:10.1089/ast.2019.2045. ISSN 1531-1074. PMC 7133448. PMID 31841362.
- ^ Burcar, Bradley T.; Barge, Laura M.; Trail, Dustin; Watson, E. Bruce; Russell, Michael J.; McGown, Linda B. (1 July 2015). "RNA Oligomerization in Laboratory Analogues of Alkaline Hydrothermal Vent Systems". Astrobiology. 15 (7): 509–522. Bibcode:2015AsBio..15..509B. doi:10.1089/ast.2014.1280. PMID 26154881.
- ^ Deamer, David (10 February 2021). "Where Did Life Begin? Testing Ideas in Prebiotic Analogue Conditions". Life. 11 (2): 134. Bibcode:2021Life...11..134D. doi:10.3390/life11020134. PMC 7916457. PMID 33578711.
- ^ Patel, Bhavesh H.; Percivalle, Claudia; Ritson, Dougal J.; Duffy, Colm. D.; Sutherland, John D. (March 16, 2015). "Common origins of RNA, protein and lipid precursors in a cyanosulfidic protometabolism". Nature Chemistry. 7 (4): 301–307. Bibcode:2015NatCh...7..301P. doi:10.1038/nchem.2202. ISSN 1755-4330. PMC 4568310. PMID 25803468.
- ^ Pearce, Ben K. D.; Pudritz, Ralph E.; Semenov, Dmitry A.; Henning, Thomas K. (2017-10-24). "Origin of the RNA world: The fate of nucleobases in warm little ponds". Proceedings of the National Academy of Sciences. 114 (43): 11327–11332. arXiv:1710.00434. Bibcode:2017PNAS..11411327P. doi:10.1073/pnas.1710339114. ISSN 0027-8424. PMC 5664528. PMID 28973920.
- ^ a b Lane, Nick; Martin, William F. (2012-12-21). "The Origin of Membrane Bioenergetics". Cell. 151 (7): 1406–1416. doi:10.1016/j.cell.2012.11.050. ISSN 0092-8674. PMID 23260134. S2CID 15028935.
- ^ Milshteyn, Daniel; Cooper, George; Deamer, David (2019-08-28). "Chemiosmotic energy for primitive cellular life: Proton gradients are generated across lipid membranes by redox reactions coupled to meteoritic quinones". Scientific Reports. 9 (1): 12447. Bibcode:2019NatSR...912447M. doi:10.1038/s41598-019-48328-5. ISSN 2045-2322. PMC 6713726. PMID 31462644.
- ^ Baaske, Philipp; Weinert, Franz M.; Duhr, Stefan; Lemke, Kono H.; Russell, Michael J.; Braun, Dieter (2007-05-29). "Extreme accumulation of nucleotides in simulated hydrothermal pore systems". Proceedings of the National Academy of Sciences of the United States of America. 104 (22): 9346–9351. doi:10.1073/pnas.0609592104. ISSN 0027-8424. PMC 1890497. PMID 17494767.
- ^ Martin, William; Russell, Michael J (2003-01-29). "On the origins of cells: a hypothesis for the evolutionary transitions from abiotic geochemistry to chemoautotrophic prokaryotes, and from prokaryotes to nucleated cells". Philosophical Transactions of the Royal Society B: Biological Sciences. 358 (1429): 59–85. doi:10.1098/rstb.2002.1183. ISSN 0962-8436. PMC 1693102. PMID 12594918.
- ^ Jackson, J. Baz (2016-08-01). "Natural pH Gradients in Hydrothermal Alkali Vents Were Unlikely to Have Played a Role in the Origin of Life". Journal of Molecular Evolution. 83 (1): 1–11. doi:10.1007/s00239-016-9756-6. ISSN 1432-1432. PMC 4999464. PMID 27534947.
- ^ Jackson, J. Baz (2017). "Ancient Living Organisms Escaping from, or Imprisoned in, the Vents?". Life. 7 (3): 36. doi:10.3390/life7030036. ISSN 2075-1729. PMC 5617961. PMID 28914790.
- ^ Lane, Nick (June 2017). "Proton gradients at the origin of life". BioEssays. 39 (6). doi:10.1002/bies.201600217. ISSN 0265-9247. PMID 28503790. S2CID 3566719.
- ^ Whicher, Alexandra; Camprubi, Eloi; Pinna, Silvana; Herschy, Barry; Lane, Nick (2018-06-01). "Acetyl Phosphate as a Primordial Energy Currency at the Origin of Life". Origins of Life and Evolution of Biospheres. 48 (2): 159–179. Bibcode:2018OLEB...48..159W. doi:10.1007/s11084-018-9555-8. ISSN 1573-0875. PMC 6061221. PMID 29502283.
- ^ Harrison, Stuart A.; Lane, Nick (2018-12-12). "Life as a guide to prebiotic nucleotide synthesis". Nature Communications. 9 (1): 5176. Bibcode:2018NatCo...9.5176H. doi:10.1038/s41467-018-07220-y. ISSN 2041-1723. PMC 6289992. PMID 30538225.
- ^ West, Timothy; Sojo, Victor; Pomiankowski, Andrew; Lane, Nick (2017-12-05). "The origin of heredity in protocells". Philosophical Transactions of the Royal Society B: Biological Sciences. 372 (1735): 20160419. doi:10.1098/rstb.2016.0419. PMC 5665807. PMID 29061892.
- ^ Pinna, Silvana; Kunz, Cäcilia; Halpern, Aaron; Harrison, Stuart A.; Jordan, Sean F.; Ward, John; Werner, Finn; Lane, Nick (2022-10-04). "A prebiotic basis for ATP as the universal energy currency". PLOS Biology. 20 (10): e3001437. doi:10.1371/journal.pbio.3001437. ISSN 1545-7885. PMC 9531788. PMID 36194581.
 이 문서에는 CC BY 4.0 라이센스에 따라 제공되는 이 소스의 텍스트가 포함되어 있습니다.
이 문서에는 CC BY 4.0 라이센스에 따라 제공되는 이 소스의 텍스트가 포함되어 있습니다. - ^ a b Stone, Howard A. (7 February 2011). "Clay-armored bubbles may have formed first protocells". Harvard School of Engineering and Applied Sciences.
- ^ Jia, Tony Z.; Chandru, Kuhan; Hongo, Yayoi; Afrin, Rehana; Usui, Tomohiro; Myojo, Kunihiro; Cleaves, H. James (22 July 2019). "Membraneless polyester microdroplets as primordial compartments at the origins of life". Proceedings of the National Academy of Sciences. 116 (32): 15830–15835. Bibcode:2019PNAS..11615830J. doi:10.1073/pnas.1902336116. PMC 6690027. PMID 31332006.
- ^ Tokyo Institute of Technology (23 July 2019). "ELSI scientists discover new chemistry that may help explain the origins of cellular life – Chemists find simplest organic molecules can self-assemble to give cell-like structures under early Earth conditions". EurekAlert!. Retrieved 23 July 2019.
- ^ Woese, Carl R.; Fox, George E. (March 1977). "The concept of cellular evolution". Journal of Molecular Evolution. 10 (1): 1–6. Bibcode:1977JMolE..10....1W. doi:10.1007/BF01796132. PMID 903983. S2CID 24613906.
- ^ Eigen, M.; Gardiner, W.; Schuster, P.; Winkler-Oswatitsch, R. (Apr 1981). "The origin of genetic information". Scientific American. 244 (4): 88–92, 96, et passim. Bibcode:1981SciAm.244a..88H. doi:10.1038/scientificamerican0481-88. PMID 6164094.
- ^ Woese, C. R. (1983). 주요 혈통과 보편적 조상. 의 장
- ^ a b Bernstein, H.; Byerly, H. C.; Hopf, F. A.; Michod, R. E. (Oct 1984). "Origin of Sex". Journal of Theoretical Biology. 110 (3): 323–351. Bibcode:1984JThBi.110..323B. doi:10.1016/S0022-5193(84)80178-2. PMID 6209512.
- ^ Bernstein, Carol; Bernstein, Harris (1991). Aging, sex, and DNA repair. Boston: Academic Press. ISBN 978-0-12-092860-6. see pgs. 293-297
- ^ Lamb, R. A.; Choppin, P. W. (1983). "The gene structure and replication of influenza virus". Annual Review of Biochemistry. 52: 467–506. doi:10.1146/annurev.bi.52.070183.002343. PMID 6351727.
- ^ Barry, R. D. (Aug 1961). "The multiplication of influenza virus. II. Multiplicity reactivation of ultraviolet irradiated virus" (PDF). Virology. 14 (4): 398–405. doi:10.1016/0042-6822(61)90330-0. hdl:1885/109240. PMID 13687359.
- ^ Gilker, J. C.; Pavilanis, V.; Ghys, R. (Jun 1967). "Multiplicity reactivation in gamma irradiated influenza viruses". Nature. 214 (5094): 1235–7. Bibcode:1967Natur.214.1235G. doi:10.1038/2141235a0. PMID 6066111. S2CID 4200194.
- ^ a b "Scientists Create Artificial Cell Membranes". Astrobiology Magazine. 4 October 2014. Archived from the original on 2013-10-04. Retrieved 2014-05-07.
{{cite journal}}: CS1 maint: 잘못된 URL (링크) - ^ a b Matosevic, Sandro; Paegel, Brian M. (29 September 2013). "Layer-by-layer cell membrane assembly". Nature Chemistry. 5 (11): 958–63. Bibcode:2013NatCh...5..958M. doi:10.1038/nchem.1765. PMC 4003896. PMID 24153375.
- ^ a b c Grote, M. (September 2011). "Jeewanu, or the 'particles of life'" (PDF). Journal of Biosciences. 36 (4): 563–70. doi:10.1007/s12038-011-9087-0. PMID 21857103. S2CID 19551399. Archived from the original (PDF) on 2014-03-23.
- ^ a b Gupta, V. K.; Rai, R. K. (2013). "Histochemical localisation of RNA-like material in photochemically formed self-sustaining, abiogenic supramolecular assemblies 'Jeewanu'". International Research Journal of Science & Engineering. 1 (1): 1–4.
- ^ Caren, Linda D.; Ponnamperuma, Cyril (1967). "A review of some experiments on the synthesis of 'Jeewanu'" (PDF). NASA Technical Memorandum X-1439.
- ^ Dworkin, Jason P.; Deamer, David W.; Sandford, Scott A.; Allamandola, Louis J. (30 January 2001). "Self-assembling amphiphilic molecules: Synthesis in simulated interstellar/precometary ices". Proceedings of the National Academy of Sciences of the United States of America. 98 (3): 815–19. Bibcode:2001PNAS...98..815D. doi:10.1073/pnas.98.3.815. PMC 14665. PMID 11158552.
- ^ Mullen, L. (5 September 2005). "Building Life from Star-Stuff". Astrobiology Magazine. Archived from the original on 2011-06-28.
{{cite journal}}: CS1 maint: 잘못된 URL (링크) - ^ Caren, Linda D.; Ponnamperuma, Cyril (1967). "A review of some experiments on the synthesis of 'Jeewanu'" (PDF). NASA Technical Memorandum X-1439.
- ^ a b Clavin, Whitney (13 March 2014). "How Did Life Arise? Fuel Cells May Have Answers". NASA.
- ^ Bedau, M.; Church, G.; Rasmussen, S.; Caplan, A.; Benner, S.; Fussenegger, M.; Collins, J.; Deamer, D. (27 May 2010). "Life after the synthetic cell". Nature. 465 (7297): 422–24. Bibcode:2010Natur.465..422.. doi:10.1038/465422a. PMID 20495545. S2CID 27471255.
- ^ Bedau, Mark A.; Parke, Emily C. (2009). The ethics of protocells moral and social implications of creating life in the laboratory (Online ed.). Cambridge, MA: MIT Press. ISBN 978-0-262-51269-5.
- ^ Deamer, David (2017-03-28). "Conjecture and hypothesis: The importance of reality checks". Beilstein Journal of Organic Chemistry. 13 (1): 620–624. doi:10.3762/bjoc.13.60. ISSN 1860-5397. PMC 5389200. PMID 28487755.



