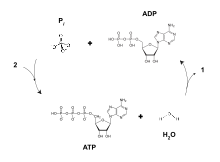아데노신2인산
Adenosine diphosphate | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 아데노신5γ-(삼수소2인산) | |
| 우선 IUPAC 이름 [(2R,3S,4R,5R)-5-(6-아미노-9H-푸린-9-일)-3,4-디히드록시옥솔란-2-일]메틸3수소2인산 | |
| 기타 이름 아데노신 5µ-디인산, 아데노신 5µ-피로인산, 아데노신 피로인산 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 첸블 | |
| 켐스파이더 | |
| 드러그뱅크 | |
| ECHA 정보 카드 | 100.000.356 |
| EC 번호 |
|
| 케그 | |
PubChem CID | |
| RTECS 번호 |
|
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| C10H15N5O10P2 | |
| 몰 질량 | 427.201 g/g |
| 밀도 | 2.49 g/mL |
| 로그 P | -2.640 |
| 위험 요소 | |
| 안전 데이터 시트(SDS) | MSDS |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
아데노신 피로인산염(APP)으로도 알려진 아데노신 이인산염(ADP)은 신진대사에서 중요한 유기 화합물이며 살아있는 세포의 에너지 흐름에 필수적이다.ADP는 아데닌에 부착된 당 골격과 리보스의 5 탄소 원자에 결합된 두 개의 인산염기 등 세 가지 중요한 구조적 요소로 구성됩니다.ADP의 2인산기는 당 골격의 5' 탄소에, 아데닌은 1' [1]탄소에 결합된다.
ADP는 아데노신3인산(ATP)과 아데노신1인산(AMP)으로 상호 변환될 수 있다.ATP는 ADP보다 인산기를 하나 더 많이 포함하고, AMP는 하나 더 적은 인산기를 포함합니다.모든 생물에 의해 사용되는 에너지 전달은 ATPase로 알려진 효소에 의한 ATP의 탈인산화 결과이다.ATP로부터의 인산염 그룹의 분열은 에너지와 대사 반응의 결합을 초래하고 [1]ADP의 부산물을 생성한다. ATP는 낮은 에너지 종인 ADP와 AMP에서 지속적으로 개질된다.ATP의 생합성은 기질 수준 인산화, 산화적 인산화, 광인산화와 같은 과정을 통해 달성되며, 이 모두는 ADP에 인산기를 추가하는 것을 촉진한다.
바이오 에너지
ADP 사이클링은 생물학적 시스템에서 작업을 수행하는 데 필요한 에너지, 즉 에너지를 한 소스에서 다른 소스로 전달하는 열역학 과정을 제공합니다.에너지에는 두 가지 종류가 있다: 위치 에너지와 운동 에너지.잠재 에너지는 저장된 에너지 또는 작업에 사용할 수 있는 사용 가능한 에너지로 생각할 수 있습니다.운동 에너지는 물체의 움직임의 결과인 에너지이다.ATP의 중요성은 인산염 결합 내에 위치 에너지를 저장하는 능력에 있다.이 결합들 사이에 저장된 에너지는 일을 하기 위해 전달될 수 있다.예를 들어, ATP에서 단백질 미오신으로의 에너지 전달은 근육 수축 중에 액틴에 연결될 때 구조 변화를 일으킨다.
효과적으로 하나의 근육 수축을 만들기 위해서는 미오신과 액틴 사이에 여러 가지 반응이 필요하며, 따라서 각각의 근육 수축을 만들기 위해서는 많은 양의 ATP의 가용성이 요구됩니다.이러한 이유로, 생물학적 과정은 [2]ADP로부터 ATP의 잠재적 에너지를 보충하는 효율적인 방법을 생산하도록 진화해 왔다.
ATP의 인 결합 중 하나를 깨면 ATP 몰당 약 30.5 킬로줄(7.3 [3]kcal)이 생성됩니다.ADP는 음식에서 사용 가능한 화학 에너지를 방출하는 과정을 통해 전환되거나 다시 ATP로 구동될 수 있습니다; 인간에서, 이것은 미토콘드리아에서 [2]유산소 호흡을 통해 지속적으로 수행됩니다.식물은 광합성 경로를 사용하여 햇빛으로부터 에너지를 변환하고 저장하며, 또한 ADP를 [3]ATP로 변환합니다.동물들은 포도당과 다른 분자의 분해에서 방출되는 에너지를 ADP를 ATP로 변환하기 위해 사용합니다. 그러면 필요한 성장과 세포 유지를 [2]위해 사용될 수 있습니다.
세포호흡
이화 작용
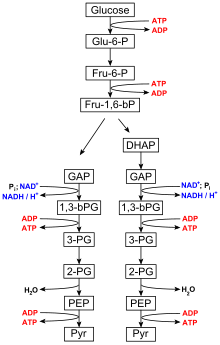
해당과정의 10단계 이화 경로는 포도당 분해에서 자유 에너지 방출의 초기 단계이며 준비 단계와 보상 단계, 두 단계로 나눌 수 있다.ADP와 인산염은 TCA 회로의 보상 반응과 산화적 [4]인산화 메커니즘에서 ATP를 합성하기 위한 전구체로 필요하다.해당과정의 페이오프 단계에서 포스포글리세린산인산화효소 및 피루브산인산화효소는 기질수준인산화를 [5]통해 인산기의 ADP 첨가를 촉진한다.
당분해
당분해는 모든 생물에 의해 수행되며 10단계로 구성됩니다.해당과정의 전체 과정에 대한 순반응은 다음과 같다.[6]
- 포도당 + 2 NAD + 2 Pi + 2 ADP → 2 피루브산 + 2 ATP + 2 NADH + 2 HO2
1단계와 3단계는 ATP를 ADP와i P(무기 인산염)로 가수분해하여 얻은 에너지의 입력을 필요로 하는 반면, 7단계와 10단계는 각각 [7]ATP를 생성하는 ADP의 입력을 필요로 한다.포도당을 분해하는 데 필요한 효소는 세포질에서 발견되는데, 세포질은 살아있는 세포를 채우는 점성이 있는 액체이며, 여기서 해당과정의 반응이 일어납니다.
구연산 회로
크렙스 회로 또는 TCA(트리카르본산) 회로로도 알려진 구연산 회로는 해당과정에 의해 생성된 피루브산을 취하고 4개의 NADH, FADH2, GTP를 생성하는 8단계 과정이며,[8] 이 과정은 ATP로 추가로 전환된다.숙시닐-CoA 합성효소에 의해 GTP가 생성된 5단계에서만 ADP가 사용된다(GTP + ADP → GDP + ATP).[9]
산화적 인산화
산화적 인산화는 NADH 또는 FADH2에서 전자 운반체를 [10]통해 O로2 전자를 전달함으로써 세포 호흡에서 생성된 30개의 ATP 중 26개를 생산한다.전자가 고에너지 NADH 또는 FADH2에서 저에너지2 O로 전달될 때 방출되는 에너지는 ADP를 인산화시키고 다시 ATP를 [11]생성하는데 필요합니다.이러한 에너지 결합과 ATP에 대한 ADP의 인산화는 전자 전달 사슬에 산화적 인산화라는 이름을 부여합니다.
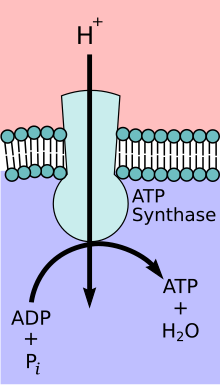
미토콘드리아 ATP합성효소복합체
해당과정의 초기 단계와 TCA 사이클 동안 NAD+와 같은 보조 인자는 미토콘드리아 [13]내막을 가로질러 양성자 구배를 생성하는 전자 전달 사슬의 능력을 돕는 전자를 기증하고 받아들인다[12].ATP 합성효소 복합체는 미토콘드리아 막(FO 부분) 내에 존재하며 기질(F1 부분) 안으로 돌출한다.화학적 구배 결과 도출된 에너지는 ATP 합성효소 활성 부위에서 무기 인산염과 ADP의 반응을 결합하여 ATP를 합성하는데 사용된다. 이에 대한 방정식은 ADP + Pi → ATP로 표기될 수 있다.
혈소판활성화
정상적인 상태에서는 작은 원반 모양의 혈소판이 혈액 내에서 자유롭게 순환하며 서로 상호 작용하지 않습니다.ADP는 혈소판 내부의 고밀도 체내에 저장되며 혈소판이 활성화되면 방출된다.ADP는 혈소판(P2Y1, P2Y12, P2X1)에서 발견되는 ADP 수용체군과 상호작용하여 혈소판 활성화를 유도한다.[14]
- P2Y1 수용체는 ADP와의 상호작용의 결과로 혈소판 응집과 형상 변화를 시작한다.
- P2Y12 수용체는 ADP에 대한 반응을 더욱 증폭시켜 응집 완료를 이끌어낸다.
혈중 ADP는 외부 ADPases의 작용에 의해 아데노신으로 전환되어 아데노신 수용체를 통한 혈소판 활성화를 저해한다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Cox, Michael; Nelson, David R.; Lehninger, Albert L (2008). Lehninger principles of biochemistry. San Francisco: W.H. Freeman. ISBN 978-0-7167-7108-1.
- ^ a b c Nave, C.R. (2005). "Adenosine Triphosphate". Hyper Physics [serial on the Internet]. Georgia State University.
- ^ a b Farabee, M.J. (2002). "The Nature of ATP". ATP and Biological Energy [serial on the Internet]. Archived from the original on 2007-12-01.
- ^ Jensen TE, Richter EA (March 2012). "Regulation of glucose and glycogen metabolism during and after exercise". J. Physiol. 590 (Pt 5): 1069–76. doi:10.1113/jphysiol.2011.224972. PMC 3381815. PMID 22199166.
- ^ Liapounova NA, Hampl V, Gordon PM, Sensen CW, Gedamu L, Dacks JB (December 2006). "Reconstructing the mosaic glycolytic pathway of the anaerobic eukaryote Monocercomonoides". Eukaryotic Cell. 5 (12): 2138–46. doi:10.1128/EC.00258-06. PMC 1694820. PMID 17071828.
- ^ Medh, J.D. "Glycolysis" (PDF). CSUN.Edu. Retrieved 3 April 2013.
- ^ Bailey, Regina. "10 Steps of Glycolysis".
- ^ "Citric Acid Cycle" (PDF). Takusagawa’s Note. Archived from the original (PDF) on 24 March 2012. Retrieved 4 April 2013.
- ^ "Biochemistry" (PDF). UCCS.edu. Archived from the original (PDF) on 2013-02-28.
- ^ "Oxidative phosphorylation". W H Freeman, 2002. Retrieved 4 April 2013.
- ^ Medh, J. D. "Electron Transport Chain (Overview)" (PDF). CSUN.edu. Retrieved 4 April 2013.
- ^ Belenky P, Bogan KL, Brenner C (January 2007). "NAD+ metabolism in health and disease". Trends Biochem. Sci. 32 (1): 12–9. doi:10.1016/j.tibs.2006.11.006. PMID 17161604.
- ^ Murray, Robert F. (2003). Harper's illustrated biochemistry. New York: McGraw-Hill. ISBN 0-07-121766-5.
- ^ Murugappa S, Kunapuli SP (2006). "The role of ADP receptors in platelet function". Front. Biosci. 11: 1977–86. doi:10.2741/1939. PMID 16368572.