실속형 니그라
Substantia nigra| 실속형 니그라 | |
|---|---|
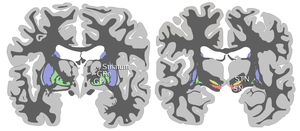
 빨간색으로 강조 표시된 실속형 흑색입니다. | |
 | |
| 세부 사항 | |
| 일부 | 중뇌, 기저신경절 |
| 식별자 | |
| 라틴어 | 실속형 니그라 |
| 약어 | SN |
| 메쉬 | D013378 |
| 신경명 | 536 |
| NeuroLex ID | birnlex_789 |
| TA98 | A14.1.06.111 |
| TA2 | 5881 |
| FMA | 67947 |
| 신경해부술의 해부학적 용어 | |
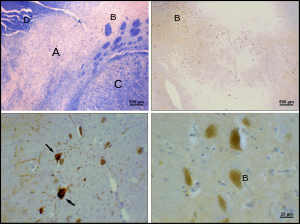
흑질(SN)은 보상과 움직임에 중요한 역할을 하는 중뇌에 위치한 기초 신경절 구조입니다.흑색 실체는 라틴어로 흑색 물질(black substance)을 의미하며, 흑색 실체의 일부가 도파민 작동성 [1]뉴런에서 높은 수준의 뉴로멜라닌으로 인해 주변 영역보다 어둡게 보인다는 사실을 반영한다.파킨슨병은 흑색 [2]파스 콤팩트 내 도파민 작동성 뉴런의 손실을 특징으로 한다.
비록 흑색 실체가 뇌 부분에서 연속적인 띠로 나타나지만, 해부학적 연구는 사실 흑색 실체가 매우 다른 연결과 기능을 가진 두 부분으로 구성되어 있다는 것을 발견했다: 파스 콤팩트카와 파시큘라타.파스 콤팩타는 주로 기저신경절 회로에 돌출되어 선조체에 도파민을 공급합니다.망막은 기저신경절에서 수많은 다른 [3]뇌구조로 신호를 전달합니다.
구조.
다른 네 개의 핵과 함께 흑색 실체는 기저신경절의 일부입니다.그것은 중뇌에서 가장 큰 핵으로, 뇌페달의 뒤쪽에 놓여있다.인간에게는 중간선 양쪽에 하나씩 두 개의 흑인이 있다.
SN은 파스 레티큘라타(SNPR)와 파스 콤팩트타(SNPC)의 두 부분으로 나뉩니다.때때로 제3의 영역인 측두골(pars lateralis)이 언급되기도 하지만, 그것은 보통 망막(pars reticulata (pars reticulata)(SNPR) 및 내부 글로부스 팔리더스(GPI)는 내부 [4]캡슐에 의해 분리됩니다.
망상어류
망막은 글로부스페리두스의 내부 부분과 구조 및 기능적으로 매우 유사합니다.이 두 가지는 때때로 내부 캡슐의 백색 물질에 의해 분리된 동일한 구조의 일부로 간주됩니다.그물망상신경세포는 글로부스페리두스와 마찬가지로 주로 [citation needed]GABAergic이다.
구심 접속
SNPR에 대한 주요 입력은 선조체에서 파생됩니다.그것은 직접 경로와 간접 경로로 알려진 두 가지 경로로 이루어진다.직접 경로는 선조체의 중간 가시가 있는 세포에서 나온 축삭으로 구성되어 있으며, 그 세포들은 그물망으로 직접 돌출되어 있다.간접 경로는 선조체 매체 가시 세포에서 글로부스 팔리두스의 외부로 돌출, 글로부스 팔리두스에서 시상하핵으로 GABAergic 돌출, 시상하핵에서 시상하핵으로 글루탐산 돌출의 세 가지 링크로 구성됩니다.[5][better source needed]따라서 직접 경로를 통한 선조체 활동은 (SNPR)의 뉴런에 억제 효과를 발휘하지만 간접 경로를 통한 흥분 효과를 발휘한다.직접 및 간접 경로는 선조체 중간 가시가 있는 세포의 서로 다른 서브셋에서 비롯된다.그것들은 단단히 뒤섞여 있지만 다른 종류의 도파민 수용체를 발현할 뿐만 아니라 다른 신경화학적 차이도 보인다.
효율적인 접속
GABA를 신경전달물질로 사용하는 망상([6]복부 외측 및 복측 전방핵), 상부 콜로큘러스 및 기타 미상핵에 유의한 돌기가 발생한다.또한 이들 뉴런은 파스 콤팩트파와 파스 레티큘라타 양쪽에 분기하는 최대 5개의 부수체를 형성하여 파스 콤팩트파의 [7]도파민 작동 활성을 조절하는 것으로 보인다.
기능.
흑인은 뇌의 기능, 특히 안구 운동, 운동 계획, 보상 추구, 학습, 중독에서 중요한 역할을 합니다.흑인의 효과의 상당수는 선조체를 통해 매개된다.니그로스트라이어탈 경로를 통해 선조체에 대한 니그랄 도파민 작용성 입력은 [8]선조체의 기능과 밀접하게 연관되어 있다.선조체와 흑색 실체 사이의 상호의존성은 이러한 방식으로 볼 수 있다: 흑색 실체가 전기적으로 자극될 때, 움직임이 일어나지 않는다. 그러나 파킨슨병으로 인한 흑색 변성의 증상은 흑색 실체가 움직임에 미치는 영향을 보여주는 아픈 예이다.선조체 매개 기능 외에 흑색 실체는 다양한 뇌 표적에 대한 GABAergic 억제의 주요 공급원으로도 작용한다.
망상어류
흑색 실체의 망막은 기저신경절의 중요한 처리 중심이다.망막의 GABAergic 뉴런은 기저신경절의 최종 처리 신호를 시상과 상층 콜로큘루스로 전달합니다.또한 파스망막은 축삭부착체를 통해 파스콤팩트 내의 도파민 작동 활성을 억제하지만 이들 접속의 기능적 구조는 불분명하다.
파스망막의 GABAergic 뉴런은 자발적으로 활동전위를 발화합니다.쥐의 활동 전위의 주파수는 약 25Hz입니다.[9]이러한 자발적 활동 전위의 목적은 기저신경절의 표적을 억제하는 것이며 억제 감소는 움직임과 [10]관련이 있다.시상하핵은 이러한 자발적 활동 전위의 발화 속도를 조절하는 흥분성 입력을 제공합니다.그러나 시상하핵의 병변은 파스망막 발화율을 20%만 감소시키는 것으로 나타나 파스망막의 활동전위 발생은 거의 [11]자율적이라는 것을 시사한다.파스망막에서 나온 GABAergic 뉴런 그룹은 높은 수준의 지속적인 억제 [12]활성을 나타내며 상위 콜리큘러스에 투영된다.미상핵에서 상콜리큘러스로의 돌기 또한 천골성 안구 운동을 조절한다.파스 망막 발화의 변화된 패턴은 파킨슨병과 간질에서[13] 발견된다. [14]뇌전증
파스 콤팩트
파스 콤팩타의 가장 두드러진 기능은 운동 [15]제어입니다. 비록 운동 제어에서 실질적으로 흑인의 역할은 간접적이지만; 실질적으로 흑인의 전기적 자극은 움직임의 흑인의 영향에서 선조체의 매개로 인해 움직임을 야기하지 않습니다.파스 콤팩타는 선조체를 흥분시키고 활성화시키는 D1 경로를 통해 선조체로 흥분성 입력을 보내고, 그로 인해 시상핵에 대한 억제 효과를 억제하기 위해 GABA가 글로부스 팔리두스로 방출된다.이것은 시상피질경로를 흥분시키고 운동뉴런 신호를 대뇌피질에 전달하여 파킨슨병에는 없는 움직임을 시작할 수 있게 한다.그러나 파스 콤팩트 뉴런의 부족은 파킨슨병의 증상으로 입증되듯이 움직임에 큰 영향을 미친다.파스 콤팩트(pars compacta)의 운동 역할은 해당 영역에 [16]병변이 있는 동물 모델에서 확인된 바와 같이 미세 운동 제어를 수반할 수 있습니다.
파스 콤팩타는 자극에 대한 학습 반응에 크게 관여한다.영장류에서 도파민성 뉴런의 활동은 새로운 자극이 [17]제시될 때 흑연골 경로에서 증가한다.도파민 작동성 활성은 반복적인 자극 [17]제시와 함께 감소한다.그러나 행동적으로 유의한 자극 제시(즉, 보상)는 실질적인 니그라 파스 콤팩타에서 도파민 작동성 뉴런을 계속 활성화한다.복부 피질 영역("중뇌" 또는 중간뇌의 하단 부분)에서 전전두피질(중피질 경로) 및 핵 어큐벤스(중피질 경로 - "중뇌"를 참조하는 "메소")로 도파민 작동성 돌기는 보상, 쾌락 및 중독성과 관련이 있다.파스 콤팩타는 공간학습, 자신의 환경, 공간에서의 위치 관찰에서도 중요하다.파스의 병변은 동일한 [18]동작을 반복하는 학습결핍으로 이어지고, 일부 연구는 그것이 전통적으로 공간적 또는 일시적 [19]기억기능을 하는 것으로 여겨지는 해마로부터 상대적으로 독립적으로 기능하는 후방 선조체 의존적, 반응 기반 기억시스템에 관여하는 것을 지적한다.
파스 콤팩타는 시간 처리에도 역할을 하며 시간 재생 중에 활성화됩니다.파스의 콤팩트 병변은 시간적 [20]결손으로 이어진다.파스 콤팩타는 최근 파킨슨병 환자가 보고하는 불면증, 렘수면장애 등의 증상과 일치하는 수면주기를 [21]조절하는 것으로 의심받고 있다.그럼에도 불구하고, 운동 조절에 영향을 미치지 않는 부분적인 도파민 결핍은 수면-기상 주기, 특히 [22]해마에서 깨어 있는 동안의 렘과 같은 신경 활동 패턴에 장애를 초래할 수 있다.
임상적 의의
흑색 실체는 파킨슨병과 파킨슨병을 포함한 많은 질병과 신드롬의 발달에 매우 중요하다.좌측 실질에 대한 고주파 자극 전달이 일시적인 급성 우울증 [23]증상을 유발할 수 있다는 연구가 있다.
파킨슨병
파킨슨병은 부분적으로는 SNPC의 도파민 작동성 뉴런이 죽는 것이 특징인 신경 퇴행성 질환이다.파킨슨병의 주요 증상으로는 떨림, 발작, 서맥, [24]경직 등이 있습니다.다른 증상으로는 자세 장애, 피로감, 수면 이상, 우울한 [25]기분 등이 있다.
SNpc에서 도파민 작동성 뉴런의 사인은 알려지지 않았다.그러나 파스 콤팩트에서의 도파민 작동성 뉴런의 독특한 감수성에 대한 몇 가지 기여가 확인되었다.첫째, 도파민성 뉴런은 미토콘드리아 복합체 1에 이상을 보여 알파 시뉴클린의 집적을 유발하며, 이는 단백질 취급 이상과 뉴런 [26]사망을 초래할 수 있다.둘째, 파스 콤팩트 내의 도파민성 뉴런은 다른 도파민성 [27]뉴런보다 적은 칼빈딘을 포함한다.칼빈딘은 세포 내 칼슘 이온 수송에 관여하는 단백질로 세포 내 칼슘 과잉은 독성이 있다.칼빈딘 이론은 복측피질부위에 비해 실질적으로 파킨슨병의 높은 세포독성을 설명할 것이다.신경 사망의 원인에 관계없이 파스 콤팩트 파스의 가소성은 매우 강력하며 파스 콤팩트 도파민성 뉴런의 최대 50-80%가 [28]죽을 때까지 파킨슨 증상은 나타나지 않는다.이러한 가소성의 대부분은 신경화학적인 수준에서 발생한다; 도파민 수송 시스템이 느려져서 도파민이 [28]선조체의 화학적 시냅스에 더 오랫동안 남아 있게 한다.
Menke, Jbabdi, Miller, Matthews 및 Zari(2010)는 건강한 개인과 비교한 파킨슨병 참가자의 SNpc와 SNPR의 체적 차이를 평가하기 위해 확산 텐서 영상촬영과 T1 매핑을 사용했다.이 연구원들은 파킨슨병을 앓고 있는 참가자들이 특히 SNPR에서 지속적으로 더 작은 실질 흑색체를 가지고 있다는 것을 발견했다.SNPR은 후 시상, 복부 시상, 특히 운동 피질에 연결되어 있고, 파킨슨병 참가자가 더 작은 SNprs를 가지고 있다고 보고하기 때문에(Menke, Jbabdi, Miller, Matthews, Zari), 이 영역의 적은 부피가 파킨슨병 환자에서 발견된 운동 장애의 원인이 될 수 있다.s. 이 작은 부피는 파킨슨병 [29]환자가 자주 경험하는 떨림을 야기할 수 있는 더 약하거나 덜 통제된 운동 운동을 일으킬 수 있다.
SNpc의 산화적 스트레스와 산화적 손상은 [30]개인이 나이가 들면서 파킨슨병의 병인에 대한 주요 동인이 될 수 있다.산화 스트레스에 의한 DNA 손상은 알파 시뉴클린이 [31]변조한 작용으로 복구할 수 있다.알파 시뉴클린은 흑색 실체에 발현되지만,[31] 그 DNA 복구 기능은 뉴런을 가진 루이 체내 포섭물에서 손상된 것으로 보인다.이 손실은 세포 사멸을 촉발할 수 있다.
정신분열증
도파민 수치가 증가하는 것은 오랫동안 정신분열증 [32]발병과 관련이 있다.그러나 정신분열증이라는 도파민 가설을 둘러싸고 오늘날까지 많은 논쟁이 계속되고 있다.논란에도 불구하고 도파민 길항제들은 여전히 정신분열증의 표준적이고 성공적인 치료제로 남아있다.이러한 길항제에는 부티로페논, 페노티아진 및 티옥산테네스와 같은 1세대(대표적인) 항정신병 약물들이 포함된다.이들 약물은 주로 클로자핀과 팔리페리돈과 같은 2세대(비정형) 항정신병 약물들로 대체되었다.일반적으로 이러한 약물은 도파민을 생성하는 뉴런 자체에 작용하는 것이 아니라 시냅스 후 뉴런에 있는 수용체에 작용한다.
흑색 실체에 관한 도파민 가설을 뒷받침하는 비약리학적 증거는 시냅스 말단 크기 [33]감소와 같은 파스 콤팩트에서의 구조적 변화를 포함한다.흑색 실체의 다른 변화로는 흑색 실체의 NMDA 수용체 발현 증가와 디스빈딘 발현 감소가 있다.증가된 NMDA 수용체는 정신분열증에서 글루탐산-도파민 상호작용의 관여를 나타낼 수 있다.(반대로) 정신분열증과 관련된 디스빈딘은 도파민 방출을 조절할 수 있으며, 니그라 실체에서의 디스빈딘의 저발현이 정신분열증의 [34]병인학에서 중요할 수 있다.정신분열증 뇌의 흑색 실체 변화에 따라 최종적으로 흑색 [35]실체에서의 정신분열증의 생리적인 징후를 검출하기 위해 특정 이미징 기술(뉴로멜라닌 특이적 이미징 등)을 사용할 수 있을 것이다.
목가슴증후군
펜타닐 흉벽경직증후군이라고도 불리는 나무 가슴은 펜타닐, 술펜타닐, 알펜타닐, 레미펜타닐과 같은 합성 오피오이드의 희귀한 부작용이다.그것은 골격근의 긴장도를 전반적으로 증가시킨다.이 메커니즘은 흑질/스트리아툼의 신경에서 도파민 방출 증가와 GABA 방출 감소를 통한 것으로 생각된다.그 효과는 흉벽 근육에 가장 뚜렷하게 나타나며 통풍 장애로 이어질 수 있다.이 질환은 이러한 약물의 빠른 용량과 높은 용량을 정맥에 [citation needed]투여하는 마취에서 가장 일반적으로 관찰된다.
다중 시스템 위축
선조체의 신경변성과 흑색 실체에 의해 특징지어지는 다발성 시스템 위축은 이전에는 선조체 퇴성으로 불렸다.
흑색 실체의 화학적 수식
신경약리학 및 독극물학 분야에서 흑색체의 화학적 조작과 수정은 중요하다.파킨슨병의 치료와 연구에 레보도파, MPTP와 같은 다양한 화합물이 사용되고 있으며, 다른 많은 약물이 흑질에 영향을 미친다.
암페타민과 미량 아민
연구에 따르면 특정 뇌 영역에서는 암페타민과 미량 아민이 시냅스 균열의 도파민 농도를 증가시켜 시냅스 후 [36]뉴런의 반응을 높인다.로 amphetamine와 미량의 아민 도파민 농도에 영향을 미치는 다양한 매커니즘들 광범위하게 그리고 둘은 동적 주소 변환과 VMAT2.[36][37][38]암페타민 구조에서 도파민과 추적 아민과 비슷하다 포함하는 것으로 알려져 있다;결과로서 그것은 동적 주소 변환뿐만 아니라 neura을 통해 확산 정도를 통해 시냅스 전 뉴런에 입국할 수 있다는 연구되고 있다.나는 막 dir암페타민과 미량아민은 [36]시냅스 전 뉴런에 들어가면 단백질인산화효소 시그널링을 통해 도파민 유출, 인산화 의존성 내화, 비경쟁적 재흡수 [36][39]억제를 유도하는 TAAR1을 활성화한다.암페타민과 미량아민은 유사하기 때문에 모노아민 트랜스포터의 기질이기도 하며, 그 결과 (경쟁적으로)[36] 도파민 및 기타 모노아민과의 흡수를 억제한다.
또한 암페타민 및 미량아민은 신경포성 모노아민 트랜스포터, 소포성 모노아민 트랜스포터 2(VMAT2)[38]의 기질이다.암페타민이 에 의해 흡수되면, 소포는 그 대신 도파민 [38]분자를 세포로 방출합니다.
코카인
코카인의 뇌 작용 메커니즘은 코카인의 중독성을 설명하는 도파민 재흡입의 [40]억제를 포함한다. 도파민은 보상을 위한 중요한 신경전달물질이기 때문이다.그러나 코카인은 흑색체보다 복부 피개 부분의 도파민 작동성 뉴런에서 더 활성화된다.코카인 투여는 흑색체 내 신진대사를 증가시켜 코카인 사용 [41]대상자에게서 나타나는 운동 기능의 변화를 설명할 수 있다.코카인에 의한 도파민 재흡수의 억제 또한 파스 콤팩트카에 [42]의한 자발적 활동 전위의 발사를 억제한다.코카인이 도파민 재흡수를 억제하는 메커니즘은 도파민 운반 단백질과의 결합을 포함한다.그러나, 연구는 코카인이 DAT mRNA 수치 감소를 [43]야기할 수 있다는 것을 보여주는데, 가장 가능성이 높은 것은 코카인이 전사 경로나 번역 [43]경로에 대한 직접적인 간섭보다는 도파민 수용체를 차단하기 때문이다.
흑색체 불활성화는 코카인 중독의 가능한 치료법임이 입증될 수 있다.코카인 의존 쥐를 대상으로 한 연구에서 이식된 카뉴레를 통한 흑색체 불활성화는 코카인 중독 [44]재발을 크게 감소시켰다.
레보도파
흑색 실체는 파킨슨병 치료를 위한 화학적 치료의 대상이다.도파민 전구체인 레보도파(통칭 L-DOPA)[45]는 도파민과 L-DOPA의 신경독성에 대한 논란에도 불구하고 파킨슨병에 가장 일반적으로 처방되는 약이다.이 약은 [46]시간이 지남에 따라 효과가 떨어지기는 하지만 파킨슨병 초기 환자 치료에 특히 효과적이다.레보도파는 혈액-뇌 장벽을 넘을 수 있고 흑색에서 도파민 수치를 증가시켜 파킨슨병의 증상을 완화시킨다.레보도파 치료의 단점은 원인(흑질 내 도파민 작동성 뉴런의 사망)보다는 파킨슨병(도파민 수치가 낮음) 증상을 치료한다는 것이다.
MPTP
MPTP는 뇌의 도파민 작용 세포, 특히 흑색 세포에 특유한 신경 독소이다.MPTP는 1982년 캘리포니아의 헤로인 사용자들이 MPTP에 오염된 MPPP를 복용한 후 파킨슨병 같은 증상을 보이면서 주목을 받았다.경직되고 거의 움직이지 않는 환자들은 레보도파 치료에 반응했다.파킨슨병 유사 증상의 감소는 보고되지 않았으며, 이는 도파민 작동성 [47]뉴런의 돌이킬 수 없는 죽음을 시사한다.MPTP의 제안된 메커니즘은 신진대사의 중단과 [48]유리기의 생성을 포함한 미토콘드리아 기능의 중단을 포함한다.
얼마 지나지 않아 MPTP는 파킨슨병을 유발하는 효능에 대해 동물 모델에서 테스트되었다(성공했다.MPTP는 영장류에서 발작성, 경직성, 떨림을 유발했으며, 그 신경독성은 실질적으로 흑색부위 콤팩타에 [49]매우 특이적인 것으로 밝혀졌다.설치류와 같은 다른 동물에서 MPTP에 의한 파킨슨병의 유도는 불완전하거나 영장류보다 훨씬 높고 빈번한 선량이 필요하다.오늘날 MPTP는 동물 [48][50]모델에서 파킨슨병을 유발하는 가장 선호되는 방법이다.
역사
흑색 실체는 펠릭스 [51]비크-다지르에 의해 1784년에 발견되었고, 사무엘 토마스 폰 소머링은 1791년에 [52]이 구조를 암시했다.실체적인 니그라 파스 레티큘라타와 콤팩트 사이의 구별은 1910년 [53]사노에 의해 처음 제안되었다.1963년, 올레 호니키에비츠는 자신의 관찰로부터 "파킨슨병 환자의 흑질 내 세포 손실이 선조체의 도파민 결핍의 원인이 될 수 있다"[54]고 결론지었다.
기타 이미지
레퍼런스
- ^ Rabey JM, Hefti F (1990). "Neuromelanin synthesis in rat and human substantia nigra". Journal of Neural Transmission. Parkinson's Disease and Dementia Section. 2 (1): 1–14. doi:10.1007/BF02251241. PMID 2357268. S2CID 6769760.
- ^ Kim SJ, Sung JY, Um JW, Hattori N, Mizuno Y, Tanaka K, Paik SR, Kim J, Chung KC (October 2003). "Parkin cleaves intracellular alpha-synuclein inclusions via the activation of calpain". The Journal of Biological Chemistry. 278 (43): 41890–9. doi:10.1074/jbc.M306017200. PMID 12917442.
- ^ Bolam, J. P.; Brown, M. T. C.; Moss, J.; Magill, P. J. (1 January 2009), "Basal Ganglia: Internal Organization", in Squire, Larry R. (ed.), Encyclopedia of Neuroscience, Oxford: Academic Press, pp. 97–104, doi:10.1016/b978-008045046-9.01294-8, ISBN 978-0-08-045046-9, retrieved 7 September 2020
- ^ Kita H, Jaeger D (2016). "Organization of the Globus Pallidus". Handbook of Basal Ganglia Structure and Function, Second Edition. Handbook of Behavioral Neuroscience. Vol. 24. pp. 259–276. doi:10.1016/B978-0-12-802206-1.00013-1. ISBN 9780128022061.
- ^ Nauta HJ, Cole M (July 1978). "Efferent projections of the subthalamic nucleus: an autoradiographic study in monkey and cat". The Journal of Comparative Neurology. 180 (1): 1–16. doi:10.1002/cne.901800102. PMID 418083. S2CID 43046462.
- ^ Carpenter MB, Nakano K, Kim R (February 1976). "Nigrothalamic projections in the monkey demonstrated by autoradiographic technics". The Journal of Comparative Neurology. 165 (4): 401–15. doi:10.1002/cne.901650402. PMID 57125. S2CID 11790266.
- ^ Deniau JM, Kitai ST, Donoghue JP, Grofova I (1982). "Neuronal interactions in the substantia nigra pars reticulata through axon collaterals of the projection neurons. An electrophysiological and morphological study". Experimental Brain Research. 47 (1): 105–13. doi:10.1007/BF00235891. PMID 6288427. S2CID 20289802.
- ^ Nicola SM, Surmeier J, Malenka RC (2000). "Dopaminergic modulation of neuronal excitability in the striatum and nucleus accumbens". Annual Review of Neuroscience. 23: 185–215. doi:10.1146/annurev.neuro.23.1.185. PMID 10845063.
- ^ Gernert M, Fedrowitz M, Wlaz P, Löscher W (November 2004). "Subregional changes in discharge rate, pattern, and drug sensitivity of putative GABAergic nigral neurons in the kindling model of epilepsy". The European Journal of Neuroscience. 20 (9): 2377–86. doi:10.1111/j.1460-9568.2004.03699.x. PMID 15525279. S2CID 24485657.
- ^ Sato M, Hikosaka O (March 2002). "Role of primate substantia nigra pars reticulata in reward-oriented saccadic eye movement". The Journal of Neuroscience. 22 (6): 2363–73. doi:10.1523/JNEUROSCI.22-06-02363.2002. PMC 6758246. PMID 11896175.
- ^ Zahr NM, Martin LP, Waszczak BL (November 2004). "Subthalamic nucleus lesions alter basal and dopamine agonist stimulated electrophysiological output from the rat basal ganglia". Synapse. 54 (2): 119–28. doi:10.1002/syn.20064. PMID 15352137. S2CID 10239473.
- ^ Hikosaka O, Wurtz RH (May 1983). "Visual and oculomotor functions of monkey substantia nigra pars reticulata. III. Memory-contingent visual and saccade responses". Journal of Neurophysiology. 49 (5): 1268–84. doi:10.1152/jn.1983.49.5.1268. PMID 6864250.
- ^ Tseng KY, Riquelme LA, Belforte JE, Pazo JH, Murer MG (January 2000). "Substantia nigra pars reticulata units in 6-hydroxydopamine-lesioned rats: responses to striatal D2 dopamine receptor stimulation and subthalamic lesions". The European Journal of Neuroscience. 12 (1): 247–56. doi:10.1046/j.1460-9568.2000.00910.x. PMID 10651879. S2CID 22886675.
- ^ Deransart C, Hellwig B, Heupel-Reuter M, Léger JF, Heck D, Lücking CH (December 2003). "Single-unit analysis of substantia nigra pars reticulata neurons in freely behaving rats with genetic absence epilepsy". Epilepsia. 44 (12): 1513–20. doi:10.1111/j.0013-9580.2003.26603.x. PMID 14636321. S2CID 6661257.
- ^ Hodge GK, Butcher LL (August 1980). "Pars compacta of the substantia nigra modulates motor activity but is not involved importantly in regulating food and water intake". Naunyn-Schmiedeberg's Archives of Pharmacology. 313 (1): 51–67. doi:10.1007/BF00505805. PMID 7207636. S2CID 24642979.
- ^ Pioli EY, Meissner W, Sohr R, Gross CE, Bezard E, Bioulac BH (June 2008). "Differential behavioral effects of partial bilateral lesions of ventral tegmental area or substantia nigra pars compacta in rats". Neuroscience. 153 (4): 1213–24. doi:10.1016/j.neuroscience.2008.01.084. PMID 18455318. S2CID 11239586.
- ^ a b Ljungberg T, Apicella P, Schultz W (January 1992). "Responses of monkey dopamine neurons during learning of behavioral reactions". Journal of Neurophysiology. 67 (1): 145–63. doi:10.1152/jn.1992.67.1.145. PMID 1552316. S2CID 18024404.
- ^ Da Cunha C, Silva MH, Wietzikoski S, Wietzikoski EC, Ferro MM, Kouzmine I, Canteras NS (December 2006). "Place learning strategy of substantia nigra pars compacta-lesioned rats". Behavioral Neuroscience. 120 (6): 1279–84. doi:10.1037/0735-7044.120.6.1279. PMID 17201473.
- ^ Da Cunha C, Wietzikoski S, Wietzikoski EC, Miyoshi E, Ferro MM, Anselmo-Franci JA, Canteras NS (May 2003). "Evidence for the substantia nigra pars compacta as an essential component of a memory system independent of the hippocampal memory system". Neurobiology of Learning and Memory. 79 (3): 236–42. doi:10.1016/S1074-7427(03)00008-X. PMID 12676522. S2CID 12045200.
- ^ Matell MS, Meck WH (January 2000). "Neuropsychological mechanisms of interval timing behavior". BioEssays. 22 (1): 94–103. doi:10.1002/(SICI)1521-1878(200001)22:1<94::AID-BIES14>3.0.CO;2-E. PMID 10649295.
- ^ Lima MM, Andersen ML, Reksidler AB, Vital MA, Tufik S (June 2007). Brosnan S (ed.). "The role of the substantia nigra pars compacta in regulating sleep patterns in rats". PLOS ONE. 2 (6): e513. Bibcode:2007PLoSO...2..513L. doi:10.1371/journal.pone.0000513. PMC 1876809. PMID 17551593.

- ^ Dzirasa K, Ribeiro S, Costa R, Santos LM, Lin SC, Grosmark A, Sotnikova TD, Gainetdinov RR, Caron MG, Nicolelis MA (October 2006). "Dopaminergic control of sleep-wake states". The Journal of Neuroscience. 26 (41): 10577–89. doi:10.1523/JNEUROSCI.1767-06.2006. PMC 6674686. PMID 17035544.
- ^ Bejjani, Boulos-Paul; Damier, Philippe; Arnulf, Isabelle; Thivard, Lionel; Bonnet, Anne-Marie; Dormont, Didier; Cornu, Philippe; Pidoux, Bernard; Samson, Yves; Agid, Yves (13 May 1999). "Transient Acute Depression Induced by High-Frequency Deep-Brain Stimulation". New England Journal of Medicine. 340 (19): 1476–1480. doi:10.1056/NEJM199905133401905. ISSN 0028-4793. PMID 10320386.
- ^ Jankovic J (April 2008). "Parkinson's disease: clinical features and diagnosis". Journal of Neurology, Neurosurgery, and Psychiatry. 79 (4): 368–76. doi:10.1136/jnnp.2007.131045. PMID 18344392.
- ^ Adler CH (2005). "Nonmotor complications in Parkinson's disease". Movement Disorders. 20 Suppl 11: S23-9. doi:10.1002/mds.20460. PMID 15822106. S2CID 19045599.
- ^ Dawson TM, Dawson VL (October 2003). "Molecular pathways of neurodegeneration in Parkinson's disease". Science. 302 (5646): 819–22. Bibcode:2003Sci...302..819D. doi:10.1126/science.1087753. PMID 14593166. S2CID 35486083.
- ^ Liang CL, Sinton CM, Sonsalla PK, German DC (December 1996). "Midbrain dopaminergic neurons in the mouse that contain calbindin-D28k exhibit reduced vulnerability to MPTP-induced neurodegeneration". Neurodegeneration. 5 (4): 313–8. doi:10.1006/neur.1996.0042. PMID 9117542.
- ^ a b 인터뷰.욜랜드 스미스 박사[verification needed]
- ^ Menke RA, Jbabdi S, Miller KL, Matthews PM, Zarei M (October 2010). "Connectivity-based segmentation of the substantia nigra in human and its implications in Parkinson's disease". NeuroImage. 52 (4): 1175–80. doi:10.1016/j.neuroimage.2010.05.086. PMID 20677376. S2CID 19871414.
- ^ 더블 KL의 Hare DJ, Trist BG입니다.노화현상에서의 산화적 스트레스와 파킨슨병의 병인.에이징 셀. 2019년 12월 18일: e13031. doi: 10.1111/acel.13031.Epub 2019 8월 20일.검토.PMID 31432604
- ^ a b Shaser AJ, Osterberg VR, Dent SE, Stackhouse TL, Wakeham CM, Boutros SW, Weston LJ, Owen N, Weissman TA, Luna E, Raber J, Luk KC, McCullough AK, Woltjer RL, Unni, VNI알파-시뉴클린은 DNA 결합 단백질로 루이 신체 장애에 대한 암시로 DNA 수복을 조절합니다.과학회원 2019년 7월 29일;9일 (1):10919.doi: 10.1038/s41598-019-47227-zPMID 31358782
- ^ van Rossum J (1967). "The significance of dopamine-receptor blockade for the action of neuroleptic drugs". In Brill H, Cole J, Deniker P, Hippius H, Bradley PB (eds.). Neuropsychopharmacology, Proceedings Fifth Collegium Internationale Neuropsychopharmacologicum. pp. 321–9. OCLC 458719.
- ^ Kolomeets NS, Uranova NA (1999). "Synaptic contacts in schizophrenia: studies using immunocytochemical identification of dopaminergic neurons". Neuroscience and Behavioral Physiology. 29 (2): 217–21. doi:10.1007/BF02465329. PMID 10432512. S2CID 2233617.
- ^ Kumamoto N, Matsuzaki S, Inoue K, Hattori T, Shimizu S, Hashimoto R, Yamatodani A, Katayama T, Tohyama M (June 2006). "Hyperactivation of midbrain dopaminergic system in schizophrenia could be attributed to the down-regulation of dysbindin". Biochemical and Biophysical Research Communications. 345 (2): 904–9. doi:10.1016/j.bbrc.2006.04.163. PMID 16701550.
- ^ Shibata E, Sasaki M, Tohyama K, Otsuka K, Endoh J, Terayama Y, Sakai A (September 2008). "Use of neuromelanin-sensitive MRI to distinguish schizophrenic and depressive patients and healthy individuals based on signal alterations in the substantia nigra and locus ceruleus". Biological Psychiatry. 64 (5): 401–6. doi:10.1016/j.biopsych.2008.03.021. PMID 18452894. S2CID 25752976.
- ^ a b c d e Miller GM (January 2011). "The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity". Journal of Neurochemistry. 116 (2): 164–76. doi:10.1111/j.1471-4159.2010.07109.x. PMC 3005101. PMID 21073468.
- ^ "Amphetamine". DrugBank. University of Alberta. 8 February 2013. Retrieved 13 October 2013.
- ^ a b c Eiden LE, Weihe E (January 2011). "VMAT2: a dynamic regulator of brain monoaminergic neuronal function interacting with drugs of abuse". Annals of the New York Academy of Sciences. 1216 (1): 86–98. Bibcode:2011NYASA1216...86E. doi:10.1111/j.1749-6632.2010.05906.x. PMC 4183197. PMID 21272013.
- ^ Maguire JJ, Parker WA, Foord SM, Bonner TI, Neubig RR, Davenport AP (March 2009). "International Union of Pharmacology. LXXII. Recommendations for trace amine receptor nomenclature". Pharmacological Reviews. 61 (1): 1–8. doi:10.1124/pr.109.001107. PMC 2830119. PMID 19325074.
- ^ Heikkila RE, Cabbat FS, Duvoisin RC (1979). "Motor activity and rotational behavior after analogs of cocaine: correlation with dopamine uptake blockade". Communications in Psychopharmacology. 3 (5): 285–90. PMID 575770.
- ^ Lakoski JM, Galloway MP, White FJ (1991). Cocaine. Telford Press. ISBN 978-0-8493-8813-2.
- ^ Lacey MG, Mercuri NB, North RA (April 1990). "Actions of cocaine on rat dopaminergic neurones in vitro". British Journal of Pharmacology. 99 (4): 731–5. doi:10.1111/j.1476-5381.1990.tb12998.x. PMC 1917549. PMID 2361170.
- ^ a b Xia Y, Goebel DJ, Kapatos G, Bannon MJ (September 1992). "Quantitation of rat dopamine transporter mRNA: effects of cocaine treatment and withdrawal". Journal of Neurochemistry. 59 (3): 1179–82. doi:10.1111/j.1471-4159.1992.tb08365.x. PMID 1494906. S2CID 34068876.
- ^ See RE, Elliott JC, Feltenstein MW (October 2007). "The role of dorsal vs ventral striatal pathways in cocaine-seeking behavior after prolonged abstinence in rats". Psychopharmacology. 194 (3): 321–31. doi:10.1007/s00213-007-0850-8. PMID 17589830. S2CID 12652533.
- ^ Cheng N, Maeda T, Kume T, Kaneko S, Kochiyama H, Akaike A, Goshima Y, Misu Y (December 1996). "Differential neurotoxicity induced by L-DOPA and dopamine in cultured striatal neurons". Brain Research. 743 (1–2): 278–83. doi:10.1016/S0006-8993(96)01056-6. PMID 9017256. S2CID 22529926.
- ^ Rascol O, Payoux P, Ory F, Ferreira JJ, Brefel-Courbon C, Montastruc JL (2003). "Limitations of current Parkinson's disease therapy". Annals of Neurology. 53 Suppl 3: S3–12, discussion S12–5. doi:10.1002/ana.10513. PMID 12666094. S2CID 45078589.
- ^ Langston JW, Ballard P, Tetrud JW, Irwin I (February 1983). "Chronic Parkinsonism in humans due to a product of meperidine-analog synthesis". Science. 219 (4587): 979–80. Bibcode:1983Sci...219..979L. doi:10.1126/science.6823561. PMID 6823561. S2CID 31966839.
- ^ a b Schmidt N, Ferger B (2001). "Neurochemical findings in the MPTP model of Parkinson's disease". Journal of Neural Transmission. 108 (11): 1263–82. doi:10.1007/s007020100004. PMID 11768626. S2CID 2834254.
- ^ Langston JW, Forno LS, Rebert CS, Irwin I (February 1984). "Selective nigral toxicity after systemic administration of 1-methyl-4-phenyl-1,2,5,6-tetrahydropyrine (MPTP) in the squirrel monkey". Brain Research. 292 (2): 390–4. doi:10.1016/0006-8993(84)90777-7. PMID 6607092. S2CID 34183578.
- ^ Blanchet PJ, Calon F, Morissette M, Hadj Tahar A, Bélanger N, Samadi P, Grondin R, Grégoire L, Meltzer L, Di Paolo T, Bédard PJ (July 2004). "Relevance of the MPTP primate model in the study of dyskinesia priming mechanisms". Parkinsonism & Related Disorders. 10 (5): 297–304. doi:10.1016/j.parkreldis.2004.02.011. PMID 15196509.
- ^ Tubbs RS, Loukas M, Shoja MM, Mortazavi MM, Cohen-Gadol AA (July 2011). "Félix Vicq d'Azyr (1746-1794): early founder of neuroanatomy and royal French physician". Child's Nervous System. 27 (7): 1031–4. doi:10.1007/s00381-011-1424-y. PMID 21445631.
- ^ Swanson LW (2014). Neuroanatomical terminology : a lexicon of classical origins and historical foundations. England: Oxford University Press. ISBN 9780195340624.
- ^ Sano T (1910). "Beitrag zur vergleichenden Anatomie der Substantia nigra, des Corpus Luysii und der Zona incerta". MSCHR Psychiat Neurol. 28 (1): 26–34. doi:10.1159/000209678.
- ^ Hornykiewicz, O. (2006). "The discovery of dopamine deficiency in the parkinsonian brain". In Riederer, P.; Reichmann, H.; Youdim, M. B. H.; Gerlach, M. (eds.). Parkinson's Disease and Related Disorders. Journal of Neural Transmission. Supplementum. Springer Vienna. pp. 9–15. doi:10.1007/978-3-211-45295-0_3. ISBN 978-3-211-28927-3. PMID 17017502.