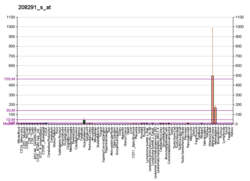
티로신수산화효소
Tyrosine hydroxylase티로신 하이드록실화효소 또는 티로신 3-모노옥시게나아제는 아미노산 L-티로신의 L-3,4-디히드록시페닐알라닌(L-DOPA)[5][6]으로의 전환을 촉매하는 효소이다.그것은 분자 산소(O2)와 철(Fe2+) 및 테트라히드로바이옵테린을 보조 인자로 사용하여 그렇게 한다.L-DOPA는 도파민의 전구체이며, 도파민은 중요한 신경전달물질 노르에피네프린(노르아드레날린)과 에피네프린(아드레날린)의 전구체이다.티로신 하이드록실화효소는 카테콜아민 합성의 속도 제한 단계를 촉매한다.사람의 경우 티로신 하이드록실화효소는 [6]TH유전자에 의해 암호화되며, 이 효소는 중추신경계(CNS), 말초교감신경계 및 부신수질에 존재한다.[6]티로신 하이드록실화효소, 페닐알라닌 하이드록실화효소 및 트립토판 하이드록실화효소는 함께 방향족 아미노산 하이드록실화효소(AAAHs)의 계열을 구성한다.
반응
| 티로신3-모노옥시게나아제 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 1.14.16.2 | ||||||||
| CAS 번호 | 9036-22-0 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| 진 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
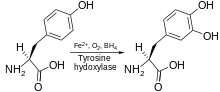
Tyrosine 하이드록실화효소는 L-Tyrosine이 메타위치로 수산화되는 반응을 촉매하여 L-3,4-dihydroxyphenylalanine(L-DOPA)을 얻는다.그 효소는 산소 분해 효소인데, 이것은 기질을 수산기화시키기 위해 분자 산소를 사용한다는 것을 의미한다.O 중의2 산소원자 중 하나는 티로신 분자를 수산화하여 L-DOPA를 얻는 데 사용되며, 다른 하나는 보조인자를 수산화하는데 사용된다.다른 방향족 아미노산 하이드록실화효소(AAAHs)와 마찬가지로, 티로신 하이드록실화효소는 정상 조건에서 보조인자 테트라히드로바이옵테린(BH)4을 사용하지만, 다른 유사한 분자들도 티로신 하이드록실화효소의 [7]보조인자로 작용할 수 있다.
AAAHs는 보조인자 5,6,7,8-테트라히드로바이옵테린(BH)4을 테트라히드로바이옵테린-4a-카르비놀라민(4a-BH)4으로 변환한다.생리조건 하에서 4a-BH는 프테린-4a-카르비놀라민탈수효소(PCD)에 의해 퀴노노이드-디히드로바이옵테린(q-BH)2으로 탈수되고, 이 반응으로 [8][9]물분자가 방출된다.그런 다음 NAD(P)H 의존성 효소인 디히드로프테리딘 환원효소(DHPR)는 q-BH를 [8]BH로 다시4 변환한다.티로신 하이드록실화효소의 4개의 서브유닛 각각은 철과 배위되어 있다.II) 활성 부위에 나타나는 원자.이 철 원자의 산화 상태는 효소 반응에서 촉매 교체를 위해 중요합니다.철분이 Fe(III)로 산화되면 효소는 [10]불활성화된다.
효소 반응의 산물인 L-DOPA는 DOPA 탈탄산화효소에 의해 도파민으로 변환될 수 있다.도파민은 도파민β-히드록실화효소에 의해 노르에피네프린으로 변환되어 페닐타놀N-메틸전달효소에 의해 더욱 변성되어 에피네프린을 [11]얻을 수 있다.L-DOPA는 신경전달물질인 도파민, 노르아드레날린 및 아드레날린의 전구체이기 때문에 티로신 하이드록실화효소는 이러한 카테콜아민을 포함한 모든 세포의 세포에서 발견된다.티로신 하이드록실화효소에 의해 촉매되는 이러한 초기 반응은 카테콜아민 [11]생산의 속도 제한 단계인 것으로 나타났다.
이 효소는 매우 특이하며 인돌 유도체를 수용하지 않는다. 이는 카테콜아민의 생산에 관여하는 다른 많은 효소들처럼 특이한 것이다.트립토판은 티로신 하이드록실화효소에 대한 저조한 기질이지만, L-페닐알라닌을 [7][12][13]히드록실화시켜 L-티로신 및 소량의 3-히드록시페닐알라닌을 형성할 수 있다.그런 다음 효소는 L-티로신을 추가로 촉매하여 L-DOPA를 형성할 수 있다.또한 티로신 하이드록실화효소는 L-DOPA를 산화시켜 5-S-시스테닐-DOPA 또는 다른 L-DOPA [7][14]유도체를 형성하는 등의 다른 반응에도 관여할 수 있다.
구조.
티로신 하이드록실화효소는 4개의 동일한 서브유닛(호모테트라머)으로 이루어진 4량체이다.각 서브유닛은 3개의 도메인으로 구성됩니다.펩타이드 사슬의 카르복실 말단에는 [15]4중합이 가능한 짧은 알파 나선 도메인이 있습니다.중심 ~ 300개의 아미노산은 촉매 코어를 구성하며, 촉매 작용에 필요한 모든 잔류물은 비공유 결합 철 [12]원자와 함께 위치합니다.철분은 히스티딘 잔기 2개와 글루탐산 잔기 1개로 고정되며, 헴이 아닌 비철-황 철 함유 [16]효소입니다.약 150개의 아미노산은 활성 [17]부위에 대한 기질의 접근을 제어하는 조절 영역을 구성합니다.인간에게는 이 조절 영역의 4가지 다른 버전이 있는 것으로 생각되며, 따라서 그들의 구조는 아직 [19]적절하게 결정되지 않았지만 대체 [18]접합에 따라 4가지 버전의 효소가 있다.이 도메인은 명확하게 정의된 3차 구조가 없는 본질적으로 구조화되지 않은 단백질일 수 있다고 제안되어 왔지만, 지금까지 이 [19]주장을 뒷받침하는 증거는 제시되지 않았다.그러나 도메인은 2차 구조의 발생률이 낮기 때문에 전체 구조가 [20]무질서하다는 의심을 약화시키지 않는 것으로 나타났습니다.사분자화 및 촉매 도메인은 X선 결정학을 [21][22]이용한 랫드 티로신 하이드록실라아제(rat tyrosine hydroxylase)에 의해 구조가 확인되었다.이것은 페닐알라닌 하이드록실화효소 및 트립토판 하이드록실화효소와 구조가 어떻게 매우 유사한지를 보여주었다. 이 세 가지는 함께 상동 방향족 아미노산 하이드록실화효소의 [23][24]일군을 구성한다.
규정

티로신 수산화효소 활성은 인산화 작용에 의해 단기적으로 증가한다.티로신 하이드록실화효소의 조절 영역은 다양한 단백질 키나제에 [12][25]의해 인산화되는 Ser8, Ser19, Ser31 및 Ser40을 포함한 여러 세린(Ser) 잔류물을 포함한다.Ser40은 cAMP 의존성 단백질 키나제에 [26]의해 인산화된다.Ser19(및 Ser40은 더 작은 범위)는 칼슘-칼모듈린 의존성 단백질 [27]키나제에 의해 인산화된다.MAPKAPK2(미토겐활성화단백질인산화효소활성화단백질인산화효소)는 Ser40을 선호하지만 Ser19를 [28][29]Ser40의 절반 정도로 인산화한다.Ser31은 ERK1 및 ERK2(세포외조절키나아제1&[30]2)에 의해 인산화되며, Ser40 [28]인산화보다 효소 활성을 덜 증가시킨다.Ser19와 Ser8에서의 인산화효소는 티로신 수산화효소 활성에 직접적인 영향을 미치지 않는다.그러나 Ser19에서의 인산화효소는 Ser40에서의 인산화속도를 증가시켜 효소활성을 증가시킨다.Ser19에서의 인산화 작용은 14-3-3 [31]단백질을 필요로 하는 메커니즘을 통해 두 배의 활성 증가를 일으킨다.Ser31에서의 인산화 작용은 약간의 활성 증가를 일으키며, 이 메커니즘은 알려져 있지 않다.티로신 수산화효소는 조절 세린이 인산화되면 열 [28][32]불활성화되도록 다소 안정화된다.
티로신 하이드록실화효소는 주로 세포질에 존재하지만 [33]혈장막에서도 어느 정도 발견된다.막결합은 소포에 카테콜아민을 채우고 시냅스막을 [33]통해 내보내는 것과 관련이 있을 수 있다.티로신 하이드록실화효소가 막에 결합하는 것은 효소의 N-말단 영역을 포함하며, 14-3-3 단백질, 티로신 하이드록실화효소의 N-말단 영역 및 음으로 대전된 [34]막 사이의 3원 상호작용에 의해 조절될 수 있습니다.
티로신 하이드록실화효소는 저해에 의해 조절될 수도 있다.Ser40에서의 인산화는 카테콜아민 도파민, 에피네프린 및 노르에피네프린에 [35][36]의한 피드백 억제를 완화한다.카테콜아민은 활성 부위 철을 Fe(III) 상태로 포획하여 [7]효소를 억제합니다.
티로신 하이드록실화효소의 발현은 SRY의 발현에 의해 영향을 받을 수 있는 것으로 나타났다.흑질에서 SRY 유전자의 하향 조절은 티로신 수산화효소 [37]발현을 감소시킬 수 있다.
티로신 하이드록실화효소의 장기적 조절은 또한 인산화 메커니즘에 의해 매개될 수 있다.호르몬(예: 글루코콜티코이드), 약물(예: 코카인) 또는 cAMP와 같은 두 번째 메신저는 티로신 수산화효소 전사를 증가시킨다.인산화로 인한 티로신 수산화효소 활성의 증가는 니코틴에 의해 최대 48시간 [7][38]동안 지속될 수 있다.티로신 수산화효소 활성은 단백질 [38]합성에 의해 만성적으로(일) 조절된다.
임상적 의의
티로신 수산화효소 결핍은 에피네프린과 노르에피네프린뿐만 아니라 도파민의 합성 장애를 초래한다.그것은 진행성 뇌증과 나쁜 예후로 나타난다.임상적 특징으로는 레보도파에 대해 최소 또는 무반응인 디스토니아, 추체외 증상, 안검하수증, 미오시스, 자세저혈압 등이 있다.이것은 진행성이고 종종 치명적인 질환으로, 개선될 수는 있지만 레보도파로는 [39]치료되지 않습니다.환자 수가 적고 다른 질환과 증상이 겹치기 때문에 조기 진단과 치료가 [40]여전히 어렵다.치료에 대한 반응은 다양하며 장기적이고 기능적인 결과는 알려져 있지 않습니다.이러한 질병의 역학, 유전자형/표현형 상관관계 및 결과, 환자의 삶의 질에 미치는 영향 및 진단 및 치료 전략에 대한 이해를 개선하기 위한 기반을 제공하기 위해 비영리 신경전달물질 Rela에 대한 국제작업그룹(International Working Group on Neurotransmitter Rela)이 환자 등록부를 구축했다.테드 장애(iNTD).[41]
또한 티로신 하이드록실라아제 활성의 변화는 세가와디스토니아, 파킨슨병,[21][42] 정신분열증 등의 질환에 관여할 수 있다.티로신 하이드록실화효소는 14-3-3 [34]단백질에 대한 인산화 의존 결합에 의해 활성화된다.14-3-3 단백질은 알츠하이머, 파킨슨병, 헌팅턴병 등 신경변성 질환과도 관련이 있을 가능성이 높기 때문에 티로신 수산화효소와의 [43]간접적인 연관성을 갖는다.알츠하이머 환자의 뇌에서 티로신 수산화효소의 활성은 건강한 사람에 비해 [44]현저하게 감소하는 것으로 나타났다.티로신 하이드록실화효소는 또한 자가면역다분비증후군(APS) 타입 [45]I의 자가항원이다.
파킨슨병의 일관된 이상은 흑질 내 도파민 신경세포의 변성으로 선조체 도파민 수치가 감소하는 것이다.티로신 하이드록실라아제는 도파민 생합성 속도제한 단계인 L-DOPA의 형성을 촉매하기 때문에 티로신 하이드록실라아제 결핍은 파킨슨병을 일으키지 않지만 일반적으로 도파민 반응성 디스토니아와 유사한 상태로 스펙트럼이 확장되지만 유아성 파킨슨병을 일으킨다.또한 티로신 하이드록실화효소는 HO 및 기타 활성산소종(ROS)의22 공급원이며 래디칼 매개손상의 표적이기 때문에 직접적인 병원학적 역할도 제안되었다.L-DOPA는 포유동물 티로신 하이드록실화효소에 의해 효과적으로 산화되어 L-DOPA의 [7]세포독성 효과에 기여할 가능성이 있다.다른 세포 단백질과 마찬가지로 티로신 하이드록실라아제 역시 ROS에 의해 유도되는 손상 변화에 대한 가능한 표적이다.이는 티로신 하이드록실라아제에 대한 산화적 손상의 일부가 티로신 하이드록실라아제 시스템 [7]자체에 의해 발생할 수 있음을 시사한다.
α-메틸-파라-티로신(메티로신) 약물로 티로신 하이드록실화효소를 억제할 수 있다.티로신 하이드록실화효소에 의해 합성되는 전구체 L-Dopa(L-3,4-dyhydroxyphenylalanine)의 결핍으로 인해 뇌에서 도파민과 노르에피네페린이 고갈될 수 있다.이 약은 거의 사용되지 않고 우울증을 일으킬 수 있지만, 색소세포종과 저항성 고혈압 치료에도 유용하다.문헌에 언급된 억제제의 오래된 예로는 우데논과[46] 아쿠아야마이신이 [47]있다.
레퍼런스
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG00000180176 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000000214 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Kaufman S (1995). "Tyrosine hydroxylase". Advances in Enzymology and Related Areas of Molecular Biology. Advances in Enzymology - and Related Areas of Molecular Biology. Vol. 70. pp. 103–220. doi:10.1002/9780470123164.ch3. ISBN 978-0-470-12316-4. PMID 8638482.
- ^ a b c Nagatsu T (1995). "Tyrosine hydroxylase: human isoforms, structure and regulation in physiology and pathology". Essays in Biochemistry. 30: 15–35. PMID 8822146.
- ^ a b c d e f g Haavik J, Toska K (Jun 1998). "Tyrosine hydroxylase and Parkinson's disease". Molecular Neurobiology. 16 (3): 285–309. doi:10.1007/BF02741387. PMID 9626667. S2CID 35753000.
- ^ a b Teigen K, McKinney JA, Haavik J, Martínez A (2007). "Selectivity and affinity determinants for ligand binding to the aromatic amino acid hydroxylases". Current Medicinal Chemistry. 14 (4): 455–67. doi:10.2174/092986707779941023. PMID 17305546.
- ^ Thöny B, Auerbach G, Blau N (Apr 2000). "Tetrahydrobiopterin biosynthesis, regeneration and functions". The Biochemical Journal. 347 Pt 1 (1): 1–16. doi:10.1042/0264-6021:3470001. PMC 1220924. PMID 10727395.
- ^ Ramsey AJ, Hillas PJ, Fitzpatrick PF (Oct 1996). "Characterization of the active site iron in tyrosine hydroxylase. Redox states of the iron". The Journal of Biological Chemistry. 271 (40): 24395–400. doi:10.1074/jbc.271.40.24395. PMID 8798695.
- ^ a b Nagatsu T, Levitt M, Udenfriend S (Sep 1964). "Tyrosine Hydroxylase. The Initial Step in Norepinephrine Biosynthesis". The Journal of Biological Chemistry. 239: 2910–7. doi:10.1016/S0021-9258(18)93832-9. PMID 14216443.
- ^ a b c Fitzpatrick PF (1999). "Tetrahydropterin-dependent amino acid hydroxylases". Annual Review of Biochemistry. 68: 355–81. doi:10.1146/annurev.biochem.68.1.355. PMID 10872454.
- ^ Fitzpatrick PF (1994). "Kinetic Isotope Effects on Hydroxylation of Ring-Deuterated Phenylalanines by Tyrosine Hydroxylase Provide Evidence against Partitioning of an Arene Oxide Intermediate". Journal of the American Chemical Society. 116 (3): 1133–1134. doi:10.1021/ja00082a046.
- ^ Haavik J, Flatmark T (Oct 1987). "Isolation and characterization of tetrahydropterin oxidation products generated in the tyrosine 3-monooxygenase (tyrosine hydroxylase) reaction". European Journal of Biochemistry. 168 (1): 21–6. doi:10.1111/j.1432-1033.1987.tb13381.x. PMID 2889594.
- ^ Vrana KE, Walker SJ, Rucker P, Liu X (Dec 1994). "A carboxyl terminal leucine zipper is required for tyrosine hydroxylase tetramer formation". Journal of Neurochemistry. 63 (6): 2014–20. doi:10.1046/j.1471-4159.1994.63062014.x. PMID 7964718. S2CID 46042840.
- ^ Ramsey AJ, Daubner SC, Ehrlich JI, Fitzpatrick PF (Oct 1995). "Identification of iron ligands in tyrosine hydroxylase by mutagenesis of conserved histidinyl residues". Protein Science. 4 (10): 2082–6. doi:10.1002/pro.5560041013. PMC 2142982. PMID 8535244.
- ^ Daubner SC, Le T, Wang S (Apr 2011). "Tyrosine hydroxylase and regulation of dopamine synthesis". Archives of Biochemistry and Biophysics. 508 (1): 1–12. doi:10.1016/j.abb.2010.12.017. PMC 3065393. PMID 21176768.
- ^ Kobayashi K, Kaneda N, Ichinose H, Kishi F, Nakazawa A, Kurosawa Y, Fujita K, Nagatsu T (Jun 1988). "Structure of the human tyrosine hydroxylase gene: alternative splicing from a single gene accounts for generation of four mRNA types". Journal of Biochemistry. 103 (6): 907–12. doi:10.1093/oxfordjournals.jbchem.a122386. PMID 2902075.
- ^ a b Nakashima A, Hayashi N, Kaneko YS, Mori K, Sabban EL, Nagatsu T, Ota A (Nov 2009). "Role of N-terminus of tyrosine hydroxylase in the biosynthesis of catecholamines". Journal of Neural Transmission. 116 (11): 1355–62. doi:10.1007/s00702-009-0227-8. PMID 19396395. S2CID 930361.
- ^ Obsilova V, Nedbalkova E, Silhan J, Boura E, Herman P, Vecer J, Sulc M, Teisinger J, Dyda F, Obsil T (Feb 2008). "The 14-3-3 protein affects the conformation of the regulatory domain of human tyrosine hydroxylase". Biochemistry. 47 (6): 1768–77. doi:10.1021/bi7019468. PMID 18181650.
- ^ a b Goodwill KE, Sabatier C, Marks C, Raag R, Fitzpatrick PF, Stevens RC (Jul 1997). "Crystal structure of tyrosine hydroxylase at 2.3 A and its implications for inherited neurodegenerative diseases". Nature Structural Biology. 4 (7): 578–85. doi:10.1038/nsb0797-578. PMID 9228951. S2CID 20007900.
- ^ Goodwill KE, Sabatier C, Stevens RC (Sep 1998). "Crystal structure of tyrosine hydroxylase with bound cofactor analogue and iron at 2.3 A resolution: self-hydroxylation of Phe300 and the pterin-binding site". Biochemistry. 37 (39): 13437–45. doi:10.1021/bi981462g. PMID 9753429.
- ^ Ledley FD, DiLella AG, Kwok SC, Woo SL (Jul 1985). "Homology between phenylalanine and tyrosine hydroxylases reveals common structural and functional domains". Biochemistry. 24 (14): 3389–94. doi:10.1021/bi00335a001. PMID 2412578.
- ^ Grenett HE, Ledley FD, Reed LL, Woo SL (Aug 1987). "Full-length cDNA for rabbit tryptophan hydroxylase: functional domains and evolution of aromatic amino acid hydroxylases". Proceedings of the National Academy of Sciences of the United States of America. 84 (16): 5530–4. Bibcode:1987PNAS...84.5530G. doi:10.1073/pnas.84.16.5530. PMC 298896. PMID 3475690.
- ^ Haycock JW (Jul 1990). "Phosphorylation of tyrosine hydroxylase in situ at serine 8, 19, 31, and 40". The Journal of Biological Chemistry. 265 (20): 11682–91. doi:10.1016/S0021-9258(19)38451-0. PMID 1973163.
- ^ Roskoski R, Roskoski LM (Jan 1987). "Activation of tyrosine hydroxylase in PC12 cells by the cyclic GMP and cyclic AMP second messenger systems". Journal of Neurochemistry. 48 (1): 236–42. doi:10.1111/j.1471-4159.1987.tb13153.x. PMID 2878973. S2CID 14759673.
- ^ Lehmann IT, Bobrovskaya L, Gordon SL, Dunkley PR, Dickson PW (Jun 2006). "Differential regulation of the human tyrosine hydroxylase isoforms via hierarchical phosphorylation". The Journal of Biological Chemistry. 281 (26): 17644–51. doi:10.1074/jbc.M512194200. PMID 16644734.
- ^ a b c Dunkley PR, Bobrovskaya L, Graham ME, von Nagy-Felsobuki EI, Dickson PW (Dec 2004). "Tyrosine hydroxylase phosphorylation: regulation and consequences". Journal of Neurochemistry. 91 (5): 1025–43. doi:10.1111/j.1471-4159.2004.02797.x. PMID 15569247. S2CID 24324381.
- ^ Sutherland C, Alterio J, Campbell DG, Le Bourdellès B, Mallet J, Haavik J, Cohen P (Oct 1993). "Phosphorylation and activation of human tyrosine hydroxylase in vitro by mitogen-activated protein (MAP) kinase and MAP-kinase-activated kinases 1 and 2". European Journal of Biochemistry. 217 (2): 715–22. doi:10.1111/j.1432-1033.1993.tb18297.x. PMID 7901013.
- ^ Haycock JW, Ahn NG, Cobb MH, Krebs EG (Mar 1992). "ERK1 and ERK2, two microtubule-associated protein 2 kinases, mediate the phosphorylation of tyrosine hydroxylase at serine-31 in situ". Proceedings of the National Academy of Sciences of the United States of America. 89 (6): 2365–9. Bibcode:1992PNAS...89.2365H. doi:10.1073/pnas.89.6.2365. PMC 48658. PMID 1347949.
- ^ Ichimura T, Isobe T, Okuyama T, Takahashi N, Araki K, Kuwano R, Takahashi Y (Oct 1988). "Molecular cloning of cDNA coding for brain-specific 14-3-3 protein, a protein kinase-dependent activator of tyrosine and tryptophan hydroxylases". Proceedings of the National Academy of Sciences of the United States of America. 85 (19): 7084–8. Bibcode:1988PNAS...85.7084I. doi:10.1073/pnas.85.19.7084. PMC 282128. PMID 2902623.
- ^ Royo M, Fitzpatrick PF, Daubner SC (Feb 2005). "Mutation of regulatory serines of rat tyrosine hydroxylase to glutamate: effects on enzyme stability and activity". Archives of Biochemistry and Biophysics. 434 (2): 266–74. doi:10.1016/j.abb.2004.11.007. PMID 15639226.
- ^ a b Chen R, Wei J, Fowler SC, Wu JY (2003). "Demonstration of functional coupling between dopamine synthesis and its packaging into synaptic vesicles" (PDF). Journal of Biomedical Science. 10 (6 Pt 2): 774–81. doi:10.1159/000073965. hdl:1808/17671. PMID 14631117. S2CID 5950778.
- ^ a b Halskau Ø, Ying M, Baumann A, Kleppe R, Rodriguez-Larrea D, Almås B, Haavik J, Martinez A (Nov 2009). "Three-way interaction between 14-3-3 proteins, the N-terminal region of tyrosine hydroxylase, and negatively charged membranes". The Journal of Biological Chemistry. 284 (47): 32758–69. doi:10.1074/jbc.M109.027706. PMC 2781693. PMID 19801645.
- ^ Daubner SC, Lauriano C, Haycock JW, Fitzpatrick PF (Jun 1992). "Site-directed mutagenesis of serine 40 of rat tyrosine hydroxylase. Effects of dopamine and cAMP-dependent phosphorylation on enzyme activity". The Journal of Biological Chemistry. 267 (18): 12639–46. doi:10.1016/S0021-9258(18)42325-3. PMID 1352289.
- ^ Ramsey AJ, Fitzpatrick PF (Jun 1998). "Effects of phosphorylation of serine 40 of tyrosine hydroxylase on binding of catecholamines: evidence for a novel regulatory mechanism". Biochemistry. 37 (25): 8980–6. doi:10.1021/bi980582l. PMID 9636040.
- ^ Dewing P, Chiang CW, Sinchak K, Sim H, Fernagut PO, Kelly S, Chesselet MF, Micevych PE, Albrecht KH, Harley VR, Vilain E (Feb 2006). "Direct regulation of adult brain function by the male-specific factor SRY". Current Biology. 16 (4): 415–20. doi:10.1016/j.cub.2006.01.017. PMID 16488877. S2CID 5939578.
- ^ a b Bobrovskaya L, Gilligan C, Bolster EK, Flaherty JJ, Dickson PW, Dunkley PR (Jan 2007). "Sustained phosphorylation of tyrosine hydroxylase at serine 40: a novel mechanism for maintenance of catecholamine synthesis". Journal of Neurochemistry. 100 (2): 479–89. doi:10.1111/j.1471-4159.2006.04213.x. PMID 17064352. S2CID 20406829.
- ^ Pearl PL, Taylor JL, Trzcinski S, Sokohl A (May 2007). "The pediatric neurotransmitter disorders". J Child Neurol. 22 (5): 606–616. doi:10.1177/0883073807302619. PMID 17690069. S2CID 10689202.
- ^ Nygaard G, Szigetvar PD, Grindheim AK, Ruoff P, Martinez A, Jaavik J, Kleppe R, Flydal MI (November 2021). "Personalized Medicine to Improve Treatment of Dopa-Responsive Dystonia—A Focus on Tyrosine Hydroxylase Deficiency". J. Pers. Med. 11 (1186). doi:10.3390/jpm11111186.
- ^ "Patient registry".
- ^ Thibaut F, Ribeyre JM, Dourmap N, Meloni R, Laurent C, Campion D, Ménard JF, Dollfus S, Mallet J, Petit M (Feb 1997). "Association of DNA polymorphism in the first intron of the tyrosine hydroxylase gene with disturbances of the catecholaminergic system in schizophrenia". Schizophrenia Research. 23 (3): 259–64. doi:10.1016/s0920-9964(96)00118-1. PMID 9075305. S2CID 46062969.
- ^ Steinacker P, Aitken A, Otto M (Sep 2011). "14-3-3 proteins in neurodegeneration". Seminars in Cell & Developmental Biology. 22 (7): 696–704. doi:10.1016/j.semcdb.2011.08.005. PMID 21920445.
- ^ Sawada M, Hirata Y, Arai H, Iizuka R, Nagatsu T (Mar 1987). "Tyrosine hydroxylase, tryptophan hydroxylase, biopterin, and neopterin in the brains of normal controls and patients with senile dementia of Alzheimer type". Journal of Neurochemistry. 48 (3): 760–4. doi:10.1111/j.1471-4159.1987.tb05582.x. PMID 2879891. S2CID 37490585.
- ^ Hedstrand H, Ekwall O, Haavik J, Landgren E, Betterle C, Perheentupa J, Gustafsson J, Husebye E, Rorsman F, Kämpe O (Jan 2000). "Identification of tyrosine hydroxylase as an autoantigen in autoimmune polyendocrine syndrome type I". Biochemical and Biophysical Research Communications. 267 (1): 456–61. doi:10.1006/bbrc.1999.1945. PMID 10623641.
- ^ Ono M, Okamoto M, Kawabe N, Umezawa H, Takeuchi T (Mar 1971). "Oudenone, a novel tyrosine hydroxylase inhibitor from microbial origin". Journal of the American Chemical Society. 93 (5): 1285–6. doi:10.1021/ja00734a054. PMID 5545929.
- ^ Ayukawa S, Takeuchi T, Sezaki M, Hara T, Umezawa H (May 1968). "Inhibition of tyrosine hydroxylase by aquayamycin". The Journal of Antibiotics. 21 (5): 350–3. doi:10.7164/antibiotics.21.350. PMID 5726288.
추가 정보
- Masserano JM, Weiner N (1983). "Tyrosine hydroxylase regulation in the central nervous system". Molecular and Cellular Biochemistry. 53–54 (1–2): 129–52. doi:10.1007/BF00225250. PMID 6137760. S2CID 19361815.
- Meloni R, Biguet NF, Mallet J (2002). "Post-genomic era and gene discovery for psychiatric diseases: there is a new art of the trade? The example of the HUMTH01 microsatellite in the Tyrosine Hydroxylase gene". Molecular Neurobiology. 26 (2–3): 389–403. doi:10.1385/MN:26:2-3:389. PMID 12428766. S2CID 8814324.
- Joh TH, Park DH, Reis DJ (Oct 1978). "Direct phosphorylation of brain tyrosine hydroxylase by cyclic AMP-dependent protein kinase: mechanism of enzyme activation". Proceedings of the National Academy of Sciences of the United States of America. 75 (10): 4744–8. Bibcode:1978PNAS...75.4744J. doi:10.1073/pnas.75.10.4744. PMC 336196. PMID 33381.
- Haycock JW, Ahn NG, Cobb MH, Krebs EG (Mar 1992). "ERK1 and ERK2, two microtubule-associated protein 2 kinases, mediate the phosphorylation of tyrosine hydroxylase at serine-31 in situ". Proceedings of the National Academy of Sciences of the United States of America. 89 (6): 2365–9. Bibcode:1992PNAS...89.2365H. doi:10.1073/pnas.89.6.2365. PMC 48658. PMID 1347949.
- Haycock JW (Jul 1990). "Phosphorylation of tyrosine hydroxylase in situ at serine 8, 19, 31, and 40". The Journal of Biological Chemistry. 265 (20): 11682–91. doi:10.1016/S0021-9258(19)38451-0. PMID 1973163.
- Craig SP, Buckle VJ, Lamouroux A, Mallet J, Craig I (1986). "Localization of the human tyrosine hydroxylase gene to 11p15: gene duplication and evolution of metabolic pathways". Cytogenetics and Cell Genetics. 42 (1–2): 29–32. doi:10.1159/000132246. PMID 2872999.
- Grima B, Lamouroux A, Boni C, Julien JF, Javoy-Agid F, Mallet J (1987). "A single human gene encoding multiple tyrosine hydroxylases with different predicted functional characteristics". Nature. 326 (6114): 707–11. Bibcode:1987Natur.326..707G. doi:10.1038/326707a0. PMID 2882428. S2CID 4314044.
- Kaneda N, Kobayashi K, Ichinose H, Kishi F, Nakazawa A, Kurosawa Y, Fujita K, Nagatsu T (Aug 1987). "Isolation of a novel cDNA clone for human tyrosine hydroxylase: alternative RNA splicing produces four kinds of mRNA from a single gene". Biochemical and Biophysical Research Communications. 146 (3): 971–5. doi:10.1016/0006-291X(87)90742-X. PMID 2887169.
- Kobayashi K, Kaneda N, Ichinose H, Kishi F, Nakazawa A, Kurosawa Y, Fujita K, Nagatsu T (Aug 1987). "Isolation of a full-length cDNA clone encoding human tyrosine hydroxylase type 3". Nucleic Acids Research. 15 (16): 6733. doi:10.1093/nar/15.16.6733. PMC 306135. PMID 2888085.
- O'Malley KL, Anhalt MJ, Martin BM, Kelsoe JR, Winfield SL, Ginns EI (Nov 1987). "Isolation and characterization of the human tyrosine hydroxylase gene: identification of 5' alternative splice sites responsible for multiple mRNAs". Biochemistry. 26 (22): 6910–4. doi:10.1021/bi00396a007. PMID 2892528.
- Le Bourdellès B, Boularand S, Boni C, Horellou P, Dumas S, Grima B, Mallet J (Mar 1988). "Analysis of the 5' region of the human tyrosine hydroxylase gene: combinatorial patterns of exon splicing generate multiple regulated tyrosine hydroxylase isoforms". Journal of Neurochemistry. 50 (3): 988–91. doi:10.1111/j.1471-4159.1988.tb03009.x. PMID 2892893. S2CID 44602622.
- Ginns EI, Rehavi M, Martin BM, Weller M, O'Malley KL, LaMarca ME, McAllister CG, Paul SM (May 1988). "Expression of human tyrosine hydroxylase cDNA in invertebrate cells using a baculovirus vector". The Journal of Biological Chemistry. 263 (15): 7406–10. doi:10.1016/S0021-9258(18)68656-9. PMID 2896667.
- Kobayashi K, Kaneda N, Ichinose H, Kishi F, Nakazawa A, Kurosawa Y, Fujita K, Nagatsu T (Jun 1988). "Structure of the human tyrosine hydroxylase gene: alternative splicing from a single gene accounts for generation of four mRNA types". Journal of Biochemistry. 103 (6): 907–12. doi:10.1093/oxfordjournals.jbchem.a122386. PMID 2902075.
- Coker GT, Vinnedge L, O'Malley KL (Dec 1988). "Characterization of rat and human tyrosine hydroxylase genes: functional expression of both promoters in neuronal and non-neuronal cell types". Biochemical and Biophysical Research Communications. 157 (3): 1341–7. doi:10.1016/S0006-291X(88)81022-2. PMID 2905129.
- Vulliet PR, Woodgett JR, Cohen P (Nov 1984). "Phosphorylation of tyrosine hydroxylase by calmodulin-dependent multiprotein kinase". The Journal of Biological Chemistry. 259 (22): 13680–3. doi:10.1016/S0021-9258(18)89798-8. PMID 6150037.
- Zhou QY, Quaife CJ, Palmiter RD (Apr 1995). "Targeted disruption of the tyrosine hydroxylase gene reveals that catecholamines are required for mouse fetal development". Nature. 374 (6523): 640–3. Bibcode:1995Natur.374..640Z. doi:10.1038/374640a0. PMID 7715703. S2CID 4259663.
- Lüdecke B, Bartholomé K (Jun 1995). "Frequent sequence variant in the human tyrosine hydroxylase gene". Human Genetics. 95 (6): 716. doi:10.1007/BF00209496. PMID 7789962. S2CID 1057532.
- Lüdecke B, Dworniczak B, Bartholomé K (Jan 1995). "A point mutation in the tyrosine hydroxylase gene associated with Segawa's syndrome". Human Genetics. 95 (1): 123–5. doi:10.1007/BF00225091. PMID 7814018. S2CID 26870241.
- Knappskog PM, Flatmark T, Mallet J, Lüdecke B, Bartholomé K (Jul 1995). "Recessively inherited L-DOPA-responsive dystonia caused by a point mutation (Q381K) in the tyrosine hydroxylase gene". Human Molecular Genetics. 4 (7): 1209–12. doi:10.1093/hmg/4.7.1209. PMID 8528210.