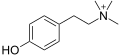
티라민
Tyramine | |
 | |
| 임상 데이터 | |
|---|---|
| ATC 코드 |
|
| 약동학 데이터 | |
| 대사 | CYP2D6, 플라빈 함유 모노옥시게나아제3, 모노아민산화효소A, 모노아민산화효소B, 페닐타놀라민N-메틸전달효소, DBH, 기타 |
| 대사물 | 4-히드록시페닐아세트알데히드, 도파민, N-메틸티라민, 옥토파민 |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| IUPHAR/BPS | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.000.106 |
| 화학 및 물리 데이터 | |
| 공식 | C8H11NO |
| 몰 질량 | 137.165 g/140−1 |
| 3D 모델(JSmol) | |
| 밀도 | 1.120g/cm3[2] 예측 |
| 녹는점 | 164.5°C(328.1°F) |
| 비등점 | 25mmHg에서는 206°C(403°F), 2mmHg에서는[3] 166°C |
| |
| |
티라민(/tatarrmiminn/TY-r--meen)[note 1]은 아미노산 티로신에서 유래한 천연 미량 [4]아민이다.티라민은 카테콜아민 방출제 역할을 한다.특히 혈액-뇌 장벽을 넘을 수 없어 섭취 후 비정신성 말초 교감 효과만 초래한다.그러나 모노아민 산화효소 억제제(MAOI)의 사용과 함께 티라민이 풍부한 음식을 섭취하면 고혈압 위기가 발생할 수 있다.
발생.
티라민은 식물과 동물에서 널리[5] 발생하며 모노아민 산화효소를 포함한 다양한 효소에 의해 대사된다.음식에서, 그것은 종종 발효 또는 부패 중에 티로신의 탈탄산화로 생산된다.발효, 경화, 절임, 숙성, 상하는 음식에는 티라민이 많이 들어 있습니다.티라민 수치는 음식이 상온에 있거나 신선도 날짜가 지나면 높아진다.
상당한 양의 티라민이 함유된 특정 식품은 다음을 포함한다.[6][7][8]
- 강하거나 숙성된 치즈: 체다, 스위스, 파르메산, 스틸턴, 고르곤졸라 또는 블루 치즈; 카망베르, 페타, 멘스터.저온 살균 우유로 만든 치즈는 티라민 함량이 낮습니다.아메리칸, 리코타, 코티지, 파머스, 크림치즈.다른 유제품들도 티라민 함량이 낮습니다: 요구르트, 신선한 우유, 사워 크림, 콩 치즈, 두유, 하바티 치즈, 브리.
- 살라미, 페퍼로니, 드라이 소시지, 핫도그, 볼로냐, 베이컨, 콘 쇠고기, 절이거나 훈제 생선, 캐비어, 숙성된 닭 간, 수프, 육즙으로 만든 육류일부 고기 제품은 티라민이 더 낮다: 신선하거나 냉동된 고기, 가금류, 생선, 달걀, 통조림 고기 또는 생선, 살라미 이외의 점심 고기.
- 절임 또는 발효 식품: 사우어크라우트, 김치, 두부(특히 악취가 나는 두부), 피클, 된장국, 두부, 템페
- 조미료: 콩, 새우, 생선, 된장, 데리야끼, 부용 소스.티라민 함량이 낮다: 케첩, 머스터드, 우스터셔 소스, 샐러드 드레싱; 베지마이트, 프로마이트, 마미트[9]
- 음료: 맥주(특히 수돗물 또는 집에서 담근 맥주), 베르무트, 레드와인, 셰리주, 리큐어.낮은 티라민: 카페인이 없는 커피, 차 또는 탄산음료, 클럽소다, 신선한 우유 또는 두유, 버번, 진, 럼, 보드카
- 콩, 야채, 과일: 콩과 콩 제품, 스노우 콩, 넓은 콩과 그 꼬투리; 생 양파; 오렌지, 자몽, 레몬, 라임, 귤, 파인애플.티라민 함량이 낮다: 대부분의 신선하고 통조림이나 냉동 야채; 건포도.산딸기와 아보카도는 중간 정도의 수치를 가지고 있다.
- 초콜릿과[10] 겨우살이[11]
- 글루탐산나트륨(MSG)[12]을 함유한 식품
대부분의 빵 (사워도우[9] 제외), 파스타, 곡물, 사탕, 그리고 디저트는 티라민이 적습니다.
동물에서
티라민은 또한 다음과 같은 동물에게도 역할을 한다.케노하브디스의 행동 및 운동 기능,[13] 메뚜기 이동자 무리 행동,[14] 그리고 리피체팔루스, 아피스, 로케스타, 페리플라네타, 드로소필라, 포르미아, 파필리오, 봄빅스,[15] 칠로, 헬리오티스, 마메스트라, 아그로티스의 다양한 신경 역할.
물리적 효과 및 약리학
인간 뇌에서 티라민이 존재한다는 증거는 사후 분석으로 [16]확인되었다.또한 티라민이 신경조절기로 직접 작용할 가능성은 티라민에 대한 친화력이 높은 G단백질 결합 수용체 TAAR1의 [17][18]발견으로 밝혀졌다.TAAR1 수용체는 [19]신장을 포함한 말초 조직뿐만 아니라 뇌에서 발견됩니다.티라민은 사람의 [20]작용제로서 TAAR1에 결합한다.
티라민은 모노아민 산화효소(주로 MAO-A), FMO3, PNMT, DBH 및 CYP2D6에 [21][22][23][24][25]의해 생리적으로 대사되며, 인간 모노아민 산화효소 효소는 티라민을 4-히드록시페닐아세트알데히드로 [26]대사한다.모노아민 산화효소 억제제(MAOIs)의 사용으로 모노아민 대사가 저해되고 티라민이 많이 함유된 식품을 섭취하면 티라민이 시냅스 전 소포에서 도파민, 노르에피네프린, 에피네프린과 같은 저장된 모노아민을 치환할 수 있기 때문에 고혈압 위기를 초래할 수 있다.티라민은 노르아드레날린 신경 말단에 들어가 혈류로 들어가 혈관수축을 일으키는 노르에피네프린을 다량 대체하기 때문에 "허위 신경전달물질"로 여겨진다.
게다가, 코카인은 원래 티라민에 기인하는 혈압 상승을 막는 것으로 밝혀졌는데, 이것은 코카인에 의한 아드레날린이 [27]뇌로 재흡수되는 것을 막는 것으로 설명된다.
이 효과의 첫 번째 징후는 당시 MAOI 약물을 복용하고 있던 그의 [28]아내가 치즈를 먹을 때 심한 두통이 있다는 것을 알아차린 영국 약사에 의해 발견되었다.이러한 이유로, 다른 [29]: 30–31 음식들도 같은 문제를 일으킬 수 있지만, 그것은 여전히 "치즈 효과" 또는 "치즈 위기"라고 불린다.
대부분의 가공 치즈에는 고혈압 효과를 일으키기에 충분한 티라민이 함유되어 있지 않지만, 일부 오래된 치즈(스틸튼 등)[30][31]는 함유되어 있다.
티라민(또는 MAO 억제제를 복용하는 동안 티라민 섭취)의 다량 섭취는 티라민 압박 반응을 일으킬 수 있으며, 이는 수축기 혈압이 30mmHg 이상 상승하는 것으로 정의된다.신경 세포나 저장 소포에서 노르에피네프린(노르아드레날린)의 방출이 증가하면 혈관 수축과 압박기 반응의 심박수 및 혈압이 증가하는 것으로 생각됩니다.심한 경우 아드레날린성 위기가 발생할 [medical citation needed]수 있습니다.비록 메커니즘이 불분명하지만, 티라민 섭취는 민감한 사람들의 편두통 발작을 유발하고 심지어 [32]뇌졸중으로 이어질 수도 있습니다.혈관확장, 도파민, 순환인자 모두 편두통에 관련되어 있다.이중맹검 실험은 편두통에 대한 티라민의 효과가 아드레날린 작용일 [33]수 있다는 것을 시사한다.
연구에 따르면 편두통과 티라민 수치가 상승할 가능성이 있다.2007년[34] 신경과학지에 발표된 리뷰에서는 편두통과 군집 질환이 시상하부, 편도체, 도파민 시스템에서 순환하는 신경전달물질과 신경조절제(티라민, 옥토파민, 시네프린 포함)의 증가로 특징지어진다는 데이터가 제시되었다.편두통이 있는 사람들은 부적절한 천연 모노아민 산화효소를 가진 사람들 사이에서 과잉대표되어, MAO 억제제를 복용하는 사람들과 비슷한 문제를 야기한다.많은 편두통 발작 유발물질은 티라민 [35]함량이 높다.
그러나 티라민에 반복적으로 노출되면 압력 반응이 감소한다. 티라민은 옥토파민으로 분해되고 옥토파민은 이후 노르에피네프린(노르아드레날린)[citation needed]과 함께 시냅스 소포에 포장된다.따라서 티라민 노출을 반복한 후, 이러한 소포에는 옥토파민이 증가하며 노르에피네프린이 상대적으로 감소합니다.티라민 섭취 시 이러한 소포들이 분비될 때, 시냅스로 분비되는 노르에피네프린의 양이 줄어들고 옥토파민은 알파 또는 베타 아드레날린 [medical citation needed]수용체를 활성화하지 않기 때문에 압력 반응이 감소한다.
MAO 억제제(MAOI)를 사용할 경우, 경미한 [36]반응의 경우 6~10mg에 비해 심각한 반응의 경우 약 10~25mg의 티라민을 섭취해야 한다.
몸은 [37]췌장에 있는 소화 효소인 트립신과 키모트립신에 의해 티라민 형성을 줄일 수 있다.
생합성
생화학적으로 티라민은 티로신 [38]탈탄산화효소의 작용을 통해 티로신의 탈탄산화로 생성된다.티라민은 메틸화 알칼로이드 유도체 N-메틸티라민, N-디메틸티라민(호르데닌) 및 N, N, N-트리메틸티라민(칸디틴)으로 변환할 수 있다.
인간에서 티라민은 다음 그림과 같이 티로신으로부터 생성된다.
화학
실험실에서 티라민은 다양한 방법으로 합성될 수 있으며, 특히 티로신의 [39][40][41]탈카복실화에 의해 합성될 수 있다.
법적 상태
미국
Tyramine은 미국 연방 차원에서 예정되어 있지 않기 때문에 구매, 판매 또는 [42]소유하는 것이 합법적입니다.
플로리다에서의 상태
Tyramine은 스케줄 I 통제 물질로 환각제로 분류되어 순도 수준이나 어떤 형태로든 면허 없이 플로리다 주에서 구매, 판매 또는 소유하는 것을 불법으로 규정합니다.플로리다 법령의 언어는 티라민이 "티라민의 양을 포함하거나 티라민의 소금, 광학, 위치 또는 기하학적 이성질체를 포함한 이성질체, 이성질체의 염류를 포함하는 모든 물질, 화합물, 혼합물 또는 제제에서 불법이며, 만약 그러한 소금의 존재, 이성질체의 염분이 존재한다면"라고 말한다.특정 화학 [43]명칭 내에서 사용할 수 있습니다."
이번 금지는 환각제인 환각제인 환각제 페네틸아민이 환각제인 환각제라고 오해해 티라민인 페네틸아민에 대한 금지에 지나치게 열을 올린 의원들의 산물일 가능성이 높다.티라민의 광학 이성질체, 위치 이성질체, 기하학적 이성질체 및 그들이 존재하는 이성질체의 염류를 더욱 금지하는 것은 메타 티라민과 페닐레탄올라민, 그리고 다른 흔한 비할루신 유발 물질들이 플로리다에서 [citation needed]구매, 판매 또는 소유하는 것도 불법이라는 것을 의미합니다.티라민이 와인, 치즈, 초콜릿과 같은 많은 음식과 음료에서 자연적으로 발생한다는 것을 고려하면, 플로리다의 이 물질에 대한 전면 금지는 [44]시행하기 어려울 수 있습니다.
메모들
레퍼런스
- ^ Cruickshank L, Kennedy AR, Shankland N (2013). "Tautomeric and ionisation forms of dopamine and tyramine in the solid state". J. Mol. Struct. 1051: 132–136. Bibcode:2013JMoSt1051..132C. doi:10.1016/j.molstruc.2013.08.002.
- ^ SciFinder, Advanced Chemistry Development(ACD/Labs) 소프트웨어 V11.02를 사용하여 계산됨(© 1994-1994년 ACD/Labs)
- ^ a b Merck Index, 제10차 Ed. (1983년), 페이지 1405년, Rahway:Merck & Co.
- ^ "tyramine C8H11NO". PubChem. Retrieved 8 April 2017.
- ^ T. A. 스미스(1977) 피토케미스트리 169-18.
- ^ Hall-Flavin DK (18 December 2018). "Avoid the combination of high-tyramine foods and MAOIs". Mayo Clinic.
- ^ "Tyramine-Free Diets: Foods to Eat". Healthline. 2 December 2014.
- ^ Robinson J (21 June 2020). "Tyramine-Rich Foods As A Migraine Trigger & Low Tyramine Diet". WebMD.
- ^ a b "Low Tyramine Diet" (PDF). Queensland Government. October 2016.
- ^ "Tyramine". pubchem.ncbi.nlm.nih.gov.
- ^ "Tyramine". American Chemical Society. 19 December 2005.
- ^ "tyramine biochemistry Britannica". www.britannica.com. Retrieved 12 November 2021.
- ^ Alkema MJ, Hunter-Ensor M, Ringstad N, Horvitz HR (April 2005). "Tyramine Functions Independently of Octopamine in the Caenorhabditis elegans Nervous System". Neuron. Cell Press (Elsevier BV). 46 (2): 247–60. doi:10.1016/j.neuron.2005.02.024. ISSN 0896-6273. PMID 15848803. S2CID 14914393.
- ^ Ma Z, Guo X, Lei H, Li T, Hao S, Kang L (January 2015). "Octopamine and tyramine respectively regulate attractive and repulsive behavior in locust phase changes". Scientific Reports. Nature/Springer. 5 (1): 8036. Bibcode:2015NatSR...5E8036M. doi:10.1038/srep08036. ISSN 2045-2322. PMC 5389030. PMID 25623394. S2CID 2056338.
- ^ Ohta H, Ozoe Y (2014). "Molecular Signalling, Pharmacology, and Physiology of Octopamine and Tyramine Receptors as Potential Insect Pest Control Targets". Advances in Insect Physiology. Vol. 46. Elsevier. pp. 73–166. doi:10.1016/b978-0-12-417010-0.00002-1. ISBN 978-0-12-417010-0. ISSN 0065-2806. S2CID 80723865.
- ^ Philips SR, Rozdilsky B, Boulton AA (February 1978). "Evidence for the presence of m-tyramine, p-tyramine, tryptamine, and phenylethylamine in the rat brain and several areas of the human brain". Biological Psychiatry. 13 (1): 51–7. PMID 623853.
- ^ Navarro HA, Gilmour BP, Lewin AH (September 2006). "A rapid functional assay for the human trace amine-associated receptor 1 based on the mobilization of internal calcium". Journal of Biomolecular Screening. 11 (6): 688–93. doi:10.1177/1087057106289891. PMID 16831861.
- ^ Liberles SD, Buck LB (August 2006). "A second class of chemosensory receptors in the olfactory epithelium". Nature. 442 (7103): 645–50. Bibcode:2006Natur.442..645L. doi:10.1038/nature05066. PMID 16878137. S2CID 2864195.
- ^ Xie Z, Westmoreland SV, Miller GM (May 2008). "Modulation of monoamine transporters by common biogenic amines via trace amine-associated receptor 1 and monoamine autoreceptors in human embryonic kidney 293 cells and brain synaptosomes". The Journal of Pharmacology and Experimental Therapeutics. 325 (2): 629–40. doi:10.1124/jpet.107.135079. PMID 18310473. S2CID 178180.
- ^ Khan MZ, Nawaz W (October 2016). "The emerging roles of human trace amines and human trace amine-associated receptors (hTAARs) in central nervous system". Biomedicine & Pharmacotherapy. 83: 439–449. doi:10.1016/j.biopha.2016.07.002. PMID 27424325.
- ^ "Trimethylamine monooxygenase (Homo sapiens)". BRENDA. Technische Universität Braunschweig. July 2016. Retrieved 18 September 2016.
- ^ Krueger SK, Williams DE (June 2005). "Mammalian flavin-containing monooxygenases: structure/function, genetic polymorphisms and role in drug metabolism". Pharmacology & Therapeutics. 106 (3): 357–87. doi:10.1016/j.pharmthera.2005.01.001. PMC 1828602. PMID 15922018.
표 5: FMO에 의해 산소화된 N함유 의약품 및 이종생물제 - ^ a b Broadley KJ (March 2010). "The vascular effects of trace amines and amphetamines". Pharmacology & Therapeutics. 125 (3): 363–375. doi:10.1016/j.pharmthera.2009.11.005. PMID 19948186.
- ^ a b Lindemann L, Hoener MC (May 2005). "A renaissance in trace amines inspired by a novel GPCR family". Trends in Pharmacological Sciences. 26 (5): 274–281. doi:10.1016/j.tips.2005.03.007. PMID 15860375.
- ^ a b Wang X, Li J, Dong G, Yue J (February 2014). "The endogenous substrates of brain CYP2D". European Journal of Pharmacology. 724: 211–218. doi:10.1016/j.ejphar.2013.12.025. PMID 24374199.
- ^ "4-Hydroxyphenylacetaldehyde". Human Metabolome Database – Version 4.0. University of Alberta. 23 July 2019. Retrieved 8 August 2019.
- ^ "Preview unavailable - ProQuest". www.proquest.com. Retrieved 12 November 2021.
- ^ Sathyanarayana Rao TS, Yeragani VK (January 2009). "Hypertensive crisis and cheese". Indian Journal of Psychiatry. 51 (1): 65–6. doi:10.4103/0019-5545.44910. PMC 2738414. PMID 19742203.
- ^ E. Siobhan Mitchell "항우울제" 2017년 2월 14일 데이비드 J.에 의해 편집된 "Drugs, the Strate Facts"의 장에서 보관.트리거.2004년 첼시 하우스 퍼블리셔스
- ^ Stahl SM, Felker A (October 2008). "Monoamine oxidase inhibitors: a modern guide to an unrequited class of antidepressants". CNS Spectrums. 13 (10): 855–70. doi:10.1017/S1092852900016965. PMID 18955941. S2CID 6118722.
- ^ Tyramine 제한 다이어트 2014년 5월 13일 W.B. Saunders Company, Wayback Machine 1998에서 아카이브.
- ^ "tyramine biochemistry Britannica". www.britannica.com. Retrieved 12 November 2021.
- ^ Ghose K, Coppen A, Carrol D (May 1977). "Intravenous tyramine response in migraine before and during treatment with indoramin". British Medical Journal. 1 (6070): 1191–3. doi:10.1136/bmj.1.6070.1191. ISSN 0007-1447. PMC 1606859. PMID 324566.
- ^ D'Andrea G, Nordera GP, Perini F, Allais G, Granella F (May 2007). "Biochemistry of neuromodulation in primary headaches: focus on anomalies of tyrosine metabolism". Neurological Sciences. 28 (S2): S94-6. doi:10.1007/s10072-007-0758-4. PMID 17508188. S2CID 1548732.
- ^ "Headache Sufferer's Diet National Headache Foundation". National Headache Foundation. Archived from the original on 2 July 2017. Retrieved 8 April 2017.
- ^ McCabe BJ (August 1986). "Dietary tyramine and other pressor amines in MAOI regimens: a review". Journal of the American Dietetic Association. 86 (8): 1059–64. ISSN 0002-8223. PMID 3525654.
- ^ Şahin-Ercan S, Bozkurt H, Soysal C (18 December 2015). "Reduction of Cadaverine and Tyramine Formation by Proteolytic Enzymes in Model System". International Journal of Food Properties. 19 (7): 1465–1474. doi:10.1080/10942912.2014.1001071. ISSN 1094-2912.
- ^ 티로신 대사 - 교토 유전자 게놈 백과사전(KEGG) 참조 경로
- ^ Barger G (1909). "CXXVII.?Isolation and synthesis of p-hydroxyphenylethylamine, an active principle of ergot soluble in water". J. Chem. Soc. 95: 1123–1128. doi:10.1039/ct9099501123.
- ^ Waser E (1925). "Untersuchungen in der Phenylalanin-Reihe VI. Decarboxylierung des Tyrosins und des Leucins". Helvetica Chimica Acta. 8: 758–773. doi:10.1002/hlca.192500801106.
- ^ Buck JS (1933). "Reduction of Hydroxymandelonitriles. A New Synthesis of Tyramine". Journal of the American Chemical Society. 55 (8): 3388–3390. doi:10.1021/ja01335a058.
- ^ § 1308.11 스케줄 I
- ^ "Statutes & Constitution :View Statutes : Online Sunshine". leg.state.fl.us. Retrieved 3 April 2019.
- ^ Suzzi G, Torriani S (18 May 2015). "Editorial: Biogenic amines in foods". Frontiers in Microbiology. 6: 472. doi:10.3389/fmicb.2015.00472. ISSN 1664-302X. PMC 4435245. PMID 26042107.