Lck
LckLck(또는 림프구 고유 단백질 타이로신키나제)는 56 kDa 단백질로 림프구라 불리는 면역체계의 특화된 세포 안에서 발견된다.Lck는 Src kinase 계열(SFK)의 일원으로, 순진한 T세포와 이펙터 T세포 모두에서 T세포 수용체 신호의 활성화에 중요하다.Lck의 역할은 CD4 T 셀에 비해 메모리 CD8 T 셀의 활성화나 유지보수에 있어서 덜 두드러진다.또한 lck의 역할은 메모리 T세포가 서브셋하는 메모리마다 다르다.마우스의 경우, 이펙터 메모리 T 셀(TEM) 모집단에서 구성 활성 순응으로 존재하는 반면 활성 lck의 20% 미만이 존재하는 것으로 보인다.이러한 차이는 SH2 도메인 포함 인광 효소-1(Shp-1)과 C-단자 Src 키나제에 의한 차등 규제에 기인한다.[5]
Lck는 TCR 관련 체인 내에서 인광 면역수용체 타이로신 기반 활성화 모티브(ITAM)에 의해 세포 내부의 TCR 신호 캐스케이드를 개시할 책임이 있다.
Lck는 면역세포에서 다양한 형태로 발견될 수 있다: 시토솔에서 자유롭거나 미리스토일화와 팔미토일화를 통해 혈장막(PM)에 결합된다.아연 걸쇠 구조에 보존된 CxxC 모티브(C20 및 C23)가 있기 때문에 Lck는 셀 표면 코어셉터 CD8 및\또는 CD4를 바인딩할 수 있다.
바운드 Lck와 프리 Lck는 다른 특성을 가지고 있다: 프리 Lck는 바운드 Lck에 비해 키나아제 활성도가 더 뚜렷하다. 더욱이, 프리 형태는 더 높은 T 셀 활성화를 생산한다.[6]이러한 차이점들의 이유는 아직 잘 이해되지 않는다.
T세포신호
Lck는 T세포에서 가장 흔하게 발견된다.T세포 수용체(TCR) 복합체로부터의 신호 전달을 지원하기 위해 T 도우미 세포와 세포독성 T 세포의 CD4와 CD8 공동수용체의 세포질 꼬리와 각각 연결한다.[7][8]T세포는 T세포 수용체를 이용해 병원체나 암에 반응할 수 있지만 자가면역질환의 발병을 유발하는 자기항생성에도 반응할 수 있다.T세포 성숙은 흉선에서 발생하며, 흉선세포의 양성 선택과 음성 선택 사이의 한계를 정의하는 문턱에 의해 조절된다.자가면역질환의 발병을 피하기 위해, 자가면역 T세포는 음극 선택 시 제거되는 반면, 효율적인 면역반응을 촉진하기 위해서는 약한 자가면역 T세포의 양이 필요한데, 따라서 양성 선택 시 이러한 세포들은 성숙을 위해 선택된다.개발 T 셀의 양성 및 음성 선택 임계값은 Lck와 공동 수용체 사이의 경계로 조절된다.[9]
적응성 면역 반응을 중재하는 T세포에는 각각 MHCII와 MHCI가 제한된 CD4+T세포(또는 도우미 T세포)와 CD8+T세포(또는 세포독성 T세포)가 있다.면역체계에 있어서 그들의 역할은 다르지만 그들의 활성화는 비슷하다.세포독성 T세포는 개인화와 감염된 세포 제거에 직접 관여하는 반면, 도우미 T세포는 다른 면역세포들을 변형시켜 반응을 공급한다.[10]
면역반응의 시작은 T세포가 그들의 인지된 항원을 마주하고 인식할 때 일어난다.항원 표시 세포(APC)는 CD8+T 세포 또는 CD4+T세포에서 인식되는 항원의 일부분을 표면에 노출시킨다.이러한 결합은 TCR 단지의 CD3-제타 체인(ζ-chain)에 위치한 면역수용체 타이로신 기반 활성화 모티브(ITAM)가 Lck에 의해 인산염화되고 Fyn에 의해 덜 확장되는 TCR 신호 캐스케이드의 활성화로 이어진다.[11]둘 다와 자유 Lckcoreceptor-bound T세포 수용체 활성화에 CD3 체인 phosphorylate 수 있는, 증거가 Lck의 자유 형식이며 트리거 더 빨리coreceptor-bound Lck[6]보다 또한 T세포 활성화, 인산화 효소 활성 Lck의 단편 지질 뗏목을(LR)밖에서 안에 지질까지 translocate에 T세포 수용체 신호를 청탁할 수 있다. raFts가 LR 거주자 Fyn과 상호작용하고 활성화하며, 이는 더 다운스트림 신호 활성화에 관여한다.[12][13]일단 ITAM 콤플렉스가 인산염화되면 CD3 체인은 ZAP-70이라는 또 다른 세포질 타이로신 키네아제에 의해 결합될 수 있다.CD8+T 셀의 경우 ZAP70이 CD3을 결합하면 Lck와 관련된 코어셉터가 MCH를 결합하여 TCR-MCH-펩타이드 상호작용을 안정화한다.ZAP-70의 인산화 형태는 T세포의 활성화를 위한 링커라고 불리는 신호 캐스케이드에서 다른 분자를 채용한다.LAT는 인산화 의존적인 방식으로 TCR 근위부 신호를 조절할 수 있는 비계 역할을 한다.[14]인산화 LAT가 포집한 가장 중요한 단백질은 Shc-Grb2-SOS, PI3K, PLC(Phosolipase C)이다.PLC-161(PLC-161)의 모집에 책임이 있는 잔류물은 Y132이다.이러한 결합은 Tec 계열의 키나아제 ITK 매개 PLC-11 인산화 및 활성화로 이어져 결과적으로 칼슘(Ca2+) 이온 동원이 생성된다.림프구 내에서의 중요한 신호 폭포의 활성화.여기에는 Ras-MEK-ERK 경로가 포함되며, 이 경로에는 NFAT, NF-164B, AP-1과 같은 특정 전사 인자가 활성화된다.이러한 전사 인자는 활성화 림프구의 장기 증식과 분화를 촉진하는 인터루킨-2와 같은 가장 주목할 만한 사이토카인, 다수의 유전자 생산물의 생산을 조절한다.T세포 수용체 신호에서 Lck와 Fyn의 중요성 외에도, 이 두 src 키나아제는 T세포에서 TLR 매개 신호에서도 중요한 것으로 나타났다.[15]
Lck의 기능은 유전자 녹아웃(knock-out mouse), Lck가 부족한 Jurkat 세포(JCaM1.6), siRNA 매개 RNA 간섭 등 몇 가지 생화학적 방법을 사용하여 연구되어 왔다.
LCK 활동 규제
Lck의 활성도는 막 단백질 CD146, 투과성 타이로신인산효소 CD45 및 C-terminal Src kinase(Csk)와 같은 다른 단백질의 존재에 의해 양 또는 음성으로 조절될 수 있다.마우스에서 CD146은 세포질 영역을 통해 coreceptor-free LCK의 SH3 영역과 직접 상호작용하여 LCK 자동인산화를 촉진한다.[16]CD45 이소폼의 역할에 대한 이해는 거의 없으며 세포유형별이며 세포의 활성상태와 분화상태에 따라 좌우된다고 알려져 있다.인간의 순수 T세포에서는 CD45RA 등소형이 더 빈번한 반면, 셀이 활성화되면 CD45R0 등소형은 더 높은 농도로 표현된다.생쥐는 흉선세포나 말초 T세포에서 낮은 수준의 고분자량 이소성형(CD45RabC)을 표현한다.낮은 수준의 CD45RB는 프라이밍된 세포에서 전형적으로 나타나는 반면, 높은 수준의 CD45RB는 순한 세포와 프라이밍된 세포 모두에서 발견된다.[17]일반적으로 CD45는 억제 C-단자 꼬리에서 티로신(Y192)을 탈인산화하여 LCK의 활성 형태를 촉진하는 작용을 한다.결과적으로 lck 활성화 루프(Y394)에서 타이로신의 트랜스-자인산화 작용은 개방적인[18] 순응을 촉진하는 그것의 활성 형태를 안정화시켜 키나제 활성과 기질 결합을 더욱 강화시킨다.Y394 부위의 탈인산화는 또한 SH2 도메인 함유 인광효소 1(SHP-1), PEST 도메인 농축 티로신 인광효소(PEP), 단백질 티로신 인광효소-PEST에 의해 규제될 수 있다.[6]대조적으로, Csk는 CD45의 그것과 반대되는 역할을 가지고 있는데, 그것은 억제된 키나제 활성으로 폐쇄적인 순응을 촉진하는 Lck의 Y505를 인지화했다.Y394와 Y505가 모두 비인산화되었을 때, lck는 기저 키나아제 활동을 나타내고, 반대로 인산화가 되었을 때 lck는 Y394 단일 인산화 Lck와 유사한 활동을 나타낸다.
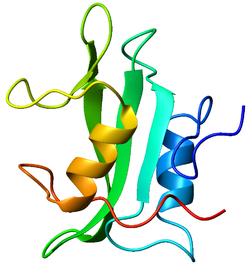
구조
Lck는 56 킬로달톤의 단백질이다.Lck의 N단자 꼬리는 myristoylated와 palmitoylated로 단백질을 세포의 플라즈마 막에 고정시킨다.단백질은 또한 SH3 도메인, SH2 도메인, 그리고 Tyrosine kinase 도메인을 C-단자 부분에 포함한다.Lck에 있는 두 개의 주요 인산화 부위는 타이로신 394와 505이다.전자는 자가인산화 사이트로 단백질의 활성화와 연계되어 있다.후자는 csk에 의해 인산염화되는데, 이는 단백질이 자신의 SH2 영역을 접고 결합하기 때문에 lck를 억제한다.따라서 Lck는 단백질 인산화 작용이 활성화와 억제를 모두 초래할 수 있다는 교훈적인 예시 역할을 한다.
Lck와 질병
Lck의 돌연변이는 SCID(중증 복합면역결핍증)나 CID와 같은 다양한 질병에 호감을 갖고 있다.이러한 병리학에서는 lck의 기능장애 활성화가 T세포 활성화 실패로 이어진다.많은 병리학들이 암, 천식, 당뇨병1, 류마티스 관절염, 건선, 전신 루푸스 홍반, 염증성 장질환(크로엔병 및 궤양성 대장염), 장기이식 거부, 아테롬성경화증, 과민성 반응, 다관절염, 피부염 등 Lck의 과다압박과 연관되어 있다.대장상피세포에서 lck의 증가는 대장암으로 이어질 수 있다.lck는 흉선과 관련된 자가면역 장애인 심모마에서도 역할을 한다.Toromigenesis는 Lck의 낮은 수치로 인한 미성숙 흉선세포의 비정상적인 증식에 의해 강화된다.[19]
림프성 단백질 타이로신인산효소(lyp)는 lck 활성 억제제 중 하나로 이 단백질 내 돌연변이는 당뇨병 1의 발병과 상관관계가 있다.lck의 활동이 증가하면 당뇨병 1의 발병이 촉진된다.
호흡기 질환과 관련해 천식은 분화가 lck로 매개되는 t2형 t세포의 활성화와 관련이 있다.[20]게다가 불균형한 lck의 양을 가진 생쥐는 결과적으로 천식을 일으킬 수 있는 변화된 폐 기능을 보여준다.[21]
기판
Lck tyrosine phosphorylate는 다수의 단백질로, 그 중 가장 중요한 것은 CD3 수용체, CEACAM1, ZAP-70, SLP-76, IL-2 수용체, 단백질 키나아제 C, ITK, PLC, SHC, RasGAP, Cbl, Vav1, PI3K이다.
억제
휴식 중인 T세포에서 Lck는 티로신 505에서 Csk 인산염에 의해 구성적으로 억제된다.Lck는 또한 Tyrosine 394에서 SHP-1 탈인산화에 의해 억제된다.Lck는 또한 유비퀴틴 매개 경로의 일부인 Cblubiquitin legase에 의해 억제될 수 있다.[22]
LCK의 특정 억제제인 Saractinib은 높은 수준의 지질 뗏목을 표시하는 세포에서 이 티로신 키나아제를 표적으로 삼음으로써 생체내뿐만 아니라 인간 T-ALL 세포의 유지보수를 저해한다.[23]
마시티닙은 또한 Lck를 억제하는데, 이것은 개복숭아 마스토시토마에서 그것의 치료 효과에 어느 정도 영향을 미칠 수 있다.[24]
HSP90 억제제 NVP-BEP800은 LCK 키나제의 안정성과 T세포 급성 림프절성 백혈병의 성장에 영향을 미치는 것으로 설명되었다.[25]
상호작용
Lck는 다음과 상호 작용하는 것으로 나타났다.
참고 항목
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000182866 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG00000000409 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Moogk D, Zhong S, Yu Z, Liadi I, Rittase W, Fang V, et al. (July 2016). "Constitutive Lck Activity Drives Sensitivity Differences between CD8+ Memory T Cell Subsets". Journal of Immunology. 197 (2): 644–654. doi:10.4049/jimmunol.1600178. PMID 27271569.
- ^ a b c d Wei Q, Brzostek J, Sankaran S, Casas J, Hew LS, Yap J, et al. (July 2020). "Lck bound to coreceptor is less active than free Lck". Proceedings of the National Academy of Sciences of the United States of America. 117 (27): 15809–15817. doi:10.1073/pnas.1913334117. PMC 7355011. PMID 32571924.
- ^ Rudd CE, Trevillyan JM, Dasgupta JD, Wong LL, Schlossman SF (July 1988). "The CD4 receptor is complexed in detergent lysates to a protein-tyrosine kinase (pp58) from human T lymphocytes". Proceedings of the National Academy of Sciences of the United States of America. 85 (14): 5190–5194. Bibcode:1988PNAS...85.5190R. doi:10.1073/pnas.85.14.5190. PMC 281714. PMID 2455897.
- ^ Barber EK, Dasgupta JD, Schlossman SF, Trevillyan JM, Rudd CE (May 1989). "The CD4 and CD8 antigens are coupled to a protein-tyrosine kinase (p56lck) that phosphorylates the CD3 complex". Proceedings of the National Academy of Sciences of the United States of America. 86 (9): 3277–3281. Bibcode:1989PNAS...86.3277B. doi:10.1073/pnas.86.9.3277. PMC 287114. PMID 2470098.
- ^ Lovatt M, Filby A, Parravicini V, Werlen G, Palmer E, Zamoyska R (November 2006). "Lck regulates the threshold of activation in primary T cells, while both Lck and Fyn contribute to the magnitude of the extracellular signal-related kinase response". Molecular and Cellular Biology. 26 (22): 8655–8665. doi:10.1128/MCB.00168-06. PMC 1636771. PMID 16966372.
- ^ Horkova V, Drobek A, Mueller D, Gubser C, Niederlova V, Wyss L, et al. (February 2020). "Dynamics of the Coreceptor-LCK Interactions during T Cell Development Shape the Self-Reactivity of Peripheral CD4 and CD8 T Cells". Cell Reports. 30 (5): 1504–1514.e7. doi:10.1016/j.celrep.2020.01.008. PMC 7003063. PMID 32023465.
- ^ Janeway C (2012). "Chapter 7: Lymphocyte Receptor Signaling". janeway's immunobiology 8th edition. New York: Garland Science. p. 268.
- ^ Filipp D, Zhang J, Leung BL, Shaw A, Levin SD, Veillette A, Julius M (May 2003). "Regulation of Fyn through translocation of activated Lck into lipid rafts". The Journal of Experimental Medicine. 197 (9): 1221–1227. doi:10.1084/jem.20022112. PMC 2193969. PMID 12732664.
- ^ Filipp D, Moemeni B, Ferzoco A, Kathirkamathamby K, Zhang J, Ballek O, et al. (September 2008). "Lck-dependent Fyn activation requires C terminus-dependent targeting of kinase-active Lck to lipid rafts". The Journal of Biological Chemistry. 283 (39): 26409–26422. doi:10.1074/jbc.M710372200. PMC 3258908. PMID 18660530.
- ^ Lo WL, Shah NH, Rubin SA, Zhang W, Horkova V, Fallahee IR, et al. (November 2019). "Slow phosphorylation of a tyrosine residue in LAT optimizes T cell ligand discrimination". Nature Immunology. 20 (11): 1481–1493. doi:10.1038/s41590-019-0502-2. PMC 6858552. PMID 31611699.
- ^ Sharma N, Akhade AS, Qadri A (April 2016). "Src kinases central to T-cell receptor signaling regulate TLR-activated innate immune responses from human T cells". Innate Immunity. 22 (3): 238–244. doi:10.1177/1753425916632305. PMID 26888964.
- ^ Duan H, Jing L, Jiang X, Ma Y, Wang D, Xiang J, et al. (November 2021). "CD146 bound to LCK promotes T cell receptor signaling and antitumor immune responses in mice". The Journal of Clinical Investigation. 131 (21). doi:10.1172/JCI148568. PMC 8553567. PMID 34491908.
- ^ academic.oup.com https://academic.oup.com/intimm/article/16/9/1323/810800. Retrieved 2022-02-21.
{{cite web}}:누락 또는 비어 있음title=(도움말) - ^ Courtney AH, Shvets AA, Lu W, Griffante G, Mollenauer M, Horkova V, et al. (October 2019). "CD45 functions as a signaling gatekeeper in T cells". Science Signaling. 12 (604): eaaw8151. doi:10.1126/scisignal.aaw8151. PMC 6948007. PMID 31641081.
- ^ Singh PK, Kashyap A, Silakari O (December 2018). "Exploration of the therapeutic aspects of Lck: A kinase target in inflammatory mediated pathological conditions". Biomedicine & Pharmacotherapy = Biomedecine & Pharmacotherapie. 108: 1565–1571. doi:10.1016/j.biopha.2018.10.002. PMID 30372858.
- ^ Kemp KL, Levin SD, Bryce PJ, Stein PL (April 2010). "Lck mediates Th2 differentiation through effects on T-bet and GATA-3". Journal of Immunology. 184 (8): 4178–4184. doi:10.4049/jimmunol.0901282. PMC 4889130. PMID 20237292.
- ^ Pernis AB, Rothman PB (May 2002). "JAK-STAT signaling in asthma". The Journal of Clinical Investigation. 109 (10): 1279–1283. doi:10.1172/JCI15786. PMID 12021241.
- ^ Rao N, Miyake S, Reddi AL, Douillard P, Ghosh AK, Dodge IL, et al. (March 2002). "Negative regulation of Lck by Cbl ubiquitin ligase". Proceedings of the National Academy of Sciences of the United States of America. 99 (6): 3794–3799. Bibcode:2002PNAS...99.3794R. doi:10.1073/pnas.062055999. PMC 122603. PMID 11904433.
- ^ Buffière A, Accogli T, Saint-Paul L, Lucchi G, Uzan B, Ballerini P, et al. (September 2018). "Saracatinib impairs maintenance of human T-ALL by targeting the LCK tyrosine kinase in cells displaying high level of lipid rafts". Leukemia. 32 (9): 2062–2065. doi:10.1038/s41375-018-0081-5. PMID 29535432. S2CID 3833020.
- ^ Gil da Costa RM (July 2015). "C-kit as a prognostic and therapeutic marker in canine cutaneous mast cell tumours: From laboratory to clinic". Veterinary Journal. 205 (1): 5–10. doi:10.1016/j.tvjl.2015.05.002. hdl:10216/103345. PMID 26021891.
- ^ Mshaik R, Simonet J, Georgievski A, Jamal L, Bechoua S, Ballerini P, et al. (March 2021). "HSP90 inhibitor NVP-BEP800 affects stability of SRC kinases and growth of T-cell and B-cell acute lymphoblastic leukemias". Blood Cancer Journal. 11 (3): 61. doi:10.1038/s41408-021-00450-2. PMC 7973815. PMID 33737511.
- ^ Poghosyan Z, Robbins SM, Houslay MD, Webster A, Murphy G, Edwards DR (February 2002). "Phosphorylation-dependent interactions between ADAM15 cytoplasmic domain and Src family protein-tyrosine kinases". The Journal of Biological Chemistry. 277 (7): 4999–5007. doi:10.1074/jbc.M107430200. PMID 11741929.
- ^ Bell GM, Fargnoli J, Bolen JB, Kish L, Imboden JB (January 1996). "The SH3 domain of p56lck binds to proline-rich sequences in the cytoplasmic domain of CD2". The Journal of Experimental Medicine. 183 (1): 169–178. doi:10.1084/jem.183.1.169. PMC 2192399. PMID 8551220.
- ^ Taher TE, Smit L, Griffioen AW, Schilder-Tol EJ, Borst J, Pals ST (February 1996). "Signaling through CD44 is mediated by tyrosine kinases. Association with p56lck in T lymphocytes". The Journal of Biological Chemistry. 271 (5): 2863–2867. doi:10.1074/jbc.271.5.2863. PMID 8576267.
- ^ Ilangumaran S, Briol A, Hoessli DC (May 1998). "CD44 selectively associates with active Src family protein tyrosine kinases Lck and Fyn in glycosphingolipid-rich plasma membrane domains of human peripheral blood lymphocytes". Blood. 91 (10): 3901–3908. doi:10.1182/blood.V91.10.3901. PMID 9573028.
- ^ Hawash IY, Hu XE, Adal A, Cassady JM, Geahlen RL, Harrison ML (April 2002). "The oxygen-substituted palmitic acid analogue, 13-oxypalmitic acid, inhibits Lck localization to lipid rafts and T cell signaling". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1589 (2): 140–150. doi:10.1016/s0167-4889(02)00165-9. PMID 12007789.
- ^ Foti M, Phelouzat MA, Holm A, Rasmusson BJ, Carpentier JL (February 2002). "p56Lck anchors CD4 to distinct microdomains on microvilli". Proceedings of the National Academy of Sciences of the United States of America. 99 (4): 2008–2013. Bibcode:2002PNAS...99.2008F. doi:10.1073/pnas.042689099. PMC 122310. PMID 11854499.
- ^ Marcus SL, Winrow CJ, Capone JP, Rachubinski RA (November 1996). "A p56(lck) ligand serves as a coactivator of an orphan nuclear hormone receptor". The Journal of Biological Chemistry. 271 (44): 27197–27200. doi:10.1074/jbc.271.44.27197. PMID 8910285.
- ^ Hanada T, Lin L, Chandy KG, Oh SS, Chishti AH (October 1997). "Human homologue of the Drosophila discs large tumor suppressor binds to p56lck tyrosine kinase and Shaker type Kv1.3 potassium channel in T lymphocytes". The Journal of Biological Chemistry. 272 (43): 26899–26904. doi:10.1074/jbc.272.43.26899. PMID 9341123.
- ^ a b Sade H, Krishna S, Sarin A (January 2004). "The anti-apoptotic effect of Notch-1 requires p56lck-dependent, Akt/PKB-mediated signaling in T cells". The Journal of Biological Chemistry. 279 (4): 2937–2944. doi:10.1074/jbc.M309924200. PMID 14583609.
- ^ Prasad KV, Kapeller R, Janssen O, Repke H, Duke-Cohan JS, Cantley LC, Rudd CE (December 1993). "Phosphatidylinositol (PI) 3-kinase and PI 4-kinase binding to the CD4-p56lck complex: the p56lck SH3 domain binds to PI 3-kinase but not PI 4-kinase". Molecular and Cellular Biology. 13 (12): 7708–7717. doi:10.1128/mcb.13.12.7708. PMC 364842. PMID 8246987.
- ^ Yu CL, Jin YJ, Burakoff SJ (January 2000). "Cytosolic tyrosine dephosphorylation of STAT5. Potential role of SHP-2 in STAT5 regulation". The Journal of Biological Chemistry. 275 (1): 599–604. doi:10.1074/jbc.275.1.599. PMID 10617656.
- ^ Chiang GG, Sefton BM (June 2001). "Specific dephosphorylation of the Lck tyrosine protein kinase at Tyr-394 by the SHP-1 protein-tyrosine phosphatase". The Journal of Biological Chemistry. 276 (25): 23173–23178. doi:10.1074/jbc.M101219200. PMID 11294838.
- ^ Lorenz U, Ravichandran KS, Pei D, Walsh CT, Burakoff SJ, Neel BG (March 1994). "Lck-dependent tyrosyl phosphorylation of the phosphotyrosine phosphatase SH-PTP1 in murine T cells". Molecular and Cellular Biology. 14 (3): 1824–1834. doi:10.1128/mcb.14.3.1824. PMC 358540. PMID 8114715.
- ^ Koretzky GA, Kohmetscher M, Ross S (April 1993). "CD45-associated kinase activity requires lck but not T cell receptor expression in the Jurkat T cell line". The Journal of Biological Chemistry. 268 (12): 8958–8964. doi:10.1016/S0021-9258(18)52965-3. PMID 8473339.
- ^ Ng DH, Watts JD, Aebersold R, Johnson P (January 1996). "Demonstration of a direct interaction between p56lck and the cytoplasmic domain of CD45 in vitro". The Journal of Biological Chemistry. 271 (3): 1295–1300. doi:10.1074/jbc.271.3.1295. PMID 8576115.
- ^ Gorska MM, Stafford SJ, Cen O, Sur S, Alam R (February 2004). "Unc119, a novel activator of Lck/Fyn, is essential for T cell activation". The Journal of Experimental Medicine. 199 (3): 369–379. doi:10.1084/jem.20030589. PMC 2211793. PMID 14757743.
- ^ a b Thome M, Duplay P, Guttinger M, Acuto O (June 1995). "Syk and ZAP-70 mediate recruitment of p56lck/CD4 to the activated T cell receptor/CD3/zeta complex". The Journal of Experimental Medicine. 181 (6): 1997–2006. doi:10.1084/jem.181.6.1997. PMC 2192070. PMID 7539035.
- ^ Oda H, Kumar S, Howley PM (August 1999). "Regulation of the Src family tyrosine kinase Blk through E6AP-mediated ubiquitination". Proceedings of the National Academy of Sciences of the United States of America. 96 (17): 9557–9562. Bibcode:1999PNAS...96.9557O. doi:10.1073/pnas.96.17.9557. PMC 22247. PMID 10449731.
- ^ Pelosi M, Di Bartolo V, Mounier V, Mège D, Pascussi JM, Dufour E, et al. (May 1999). "Tyrosine 319 in the interdomain B of ZAP-70 is a binding site for the Src homology 2 domain of Lck". The Journal of Biological Chemistry. 274 (20): 14229–14237. doi:10.1074/jbc.274.20.14229. PMID 10318843.
추가 읽기
- Sasaoka T, Kobayashi M (August 2000). "The functional significance of Shc in insulin signaling as a substrate of the insulin receptor". Endocrine Journal. 47 (4): 373–381. doi:10.1507/endocrj.47.373. PMID 11075717.
- Goldmann WH (2003). "p56(lck) Controls phosphorylation of filamin (ABP-280) and regulates focal adhesion kinase (pp125(FAK))". Cell Biology International. 26 (6): 567–571. doi:10.1006/cbir.2002.0900. PMID 12171035. S2CID 86450727.
- Mustelin T, Taskén K (April 2003). "Positive and negative regulation of T-cell activation through kinases and phosphatases". The Biochemical Journal. 371 (Pt 1): 15–27. doi:10.1042/BJ20021637. PMC 1223257. PMID 12485116.
- Zamoyska R, Basson A, Filby A, Legname G, Lovatt M, Seddon B (February 2003). "The influence of the src-family kinases, Lck and Fyn, on T cell differentiation, survival and activation". Immunological Reviews. 191: 107–118. doi:10.1034/j.1600-065X.2003.00015.x. PMID 12614355. S2CID 10156186.
- Summy JM, Gallick GE (December 2003). "Src family kinases in tumor progression and metastasis". Cancer and Metastasis Reviews. 22 (4): 337–358. doi:10.1023/A:1023772912750. PMID 12884910. S2CID 12380282.
- Leavitt SA, SchOn A, Klein JC, Manjappara U, Chaiken IM, Freire E (February 2004). "Interactions of HIV-1 proteins gp120 and Nef with cellular partners define a novel allosteric paradigm". Current Protein & Peptide Science. 5 (1): 1–8. doi:10.2174/1389203043486955. PMID 14965316.
- Tolstrup M, Ostergaard L, Laursen AL, Pedersen SF, Duch M (April 2004). "HIV/SIV escape from immune surveillance: focus on Nef". Current HIV Research. 2 (2): 141–151. doi:10.2174/1570162043484924. PMID 15078178.
- Palacios EH, Weiss A (October 2004). "Function of the Src-family kinases, Lck and Fyn, in T-cell development and activation". Oncogene. 23 (48): 7990–8000. doi:10.1038/sj.onc.1208074. PMID 15489916.
- Joseph AM, Kumar M, Mitra D (January 2005). "Nef: "necessary and enforcing factor" in HIV infection". Current HIV Research. 3 (1): 87–94. doi:10.2174/1570162052773013. PMID 15638726.
- Levinson AD, Oppermann H, Levintow L, Varmus HE, Bishop JM (October 1978). "Evidence that the transforming gene of avian sarcoma virus encodes a protein kinase associated with a phosphoprotein". Cell. 15 (2): 561–572. doi:10.1016/0092-8674(78)90024-7. PMID 214242. S2CID 40461709.
- Thomas PM, Samelson LE (June 1992). "The glycophosphatidylinositol-anchored Thy-1 molecule interacts with the p60fyn protein tyrosine kinase in T cells". The Journal of Biological Chemistry. 267 (17): 12317–12322. doi:10.1016/S0021-9258(19)49841-4. PMID 1351058.
- Shenoy-Scaria AM, Kwong J, Fujita T, Olszowy MW, Shaw AS, Lublin DM (December 1992). "Signal transduction through decay-accelerating factor. Interaction of glycosyl-phosphatidylinositol anchor and protein tyrosine kinases p56lck and p59fyn 1". Journal of Immunology. 149 (11): 3535–3541. PMID 1385527.
- Weber JR, Bell GM, Han MY, Pawson T, Imboden JB (August 1992). "Association of the tyrosine kinase LCK with phospholipase C-gamma 1 after stimulation of the T cell antigen receptor". The Journal of Experimental Medicine. 176 (2): 373–379. doi:10.1084/jem.176.2.373. PMC 2119313. PMID 1500851.
- Cefai D, Ferrer M, Serpente N, Idziorek T, Dautry-Varsat A, Debre P, Bismuth G (July 1992). "Internalization of HIV glycoprotein gp120 is associated with down-modulation of membrane CD4 and p56lck together with impairment of T cell activation". Journal of Immunology. 149 (1): 285–294. PMID 1535086.
- Soula M, Fagard R, Fischer S (February 1992). "Interaction of human immunodeficiency virus glycoprotein 160 with CD4 in Jurkat cells increases p56lck autophosphorylation and kinase activity". International Immunology. 4 (2): 295–299. doi:10.1093/intimm/4.2.295. PMID 1535787.
- Crise B, Rose JK (April 1992). "Human immunodeficiency virus type 1 glycoprotein precursor retains a CD4-p56lck complex in the endoplasmic reticulum". Journal of Virology. 66 (4): 2296–2301. doi:10.1128/JVI.66.4.2296-2301.1992. PMC 289024. PMID 1548763.
- Molina TJ, Kishihara K, Siderovski DP, van Ewijk W, Narendran A, Timms E, et al. (May 1992). "Profound block in thymocyte development in mice lacking p56lck". Nature. 357 (6374): 161–164. Bibcode:1992Natur.357..161M. doi:10.1038/357161a0. PMID 1579166. S2CID 4363506.
- Yoshida H, Koga Y, Moroi Y, Kimura G, Nomoto K (February 1992). "The effect of p56lck, a lymphocyte specific protein tyrosine kinase, on the syncytium formation induced by human immunodeficiency virus envelope glycoprotein". International Immunology. 4 (2): 233–242. doi:10.1093/intimm/4.2.233. PMID 1622897.
- Torigoe T, O'Connor R, Santoli D, Reed JC (August 1992). "Interleukin-3 regulates the activity of the LYN protein-tyrosine kinase in myeloid-committed leukemic cell lines". Blood. 80 (3): 617–624. doi:10.1182/blood.V80.3.617.617. PMID 1638019.