페르투주맙
Pertuzumab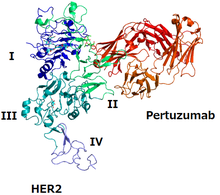 HER2와 pertuzumab의 구조 | |
| 모노클로널항체 | |
|---|---|
| 유형 | 항체전체 |
| 원천 | 인간화(마우스부터) |
| 대상 | HER2 |
| 임상 데이터 | |
| 상호 | 페르제타 |
| 기타 이름 | 2C4 |
| 라이선스 데이터 |
|
| 루트 행정부. | 정맥 주사 |
| ATC 코드 |
|
| 법적 상태 | |
| 법적 상태 | |
| 식별자 | |
| CAS 번호 | |
| 드러그뱅크 | |
| 켐스파이더 |
|
| 유니 | |
| 케그 | |
| 첸블 | |
| | |
Perjeta라는 브랜드명으로 판매되는 Pertuzumab은 전이성 HER2 양성 유방암 치료에 사용되는 모노클로널 항체로 초기 HER2 양성 유방암의 [2]네오아주반트와 동일한 조합으로 사용되었습니다.
복용자의 절반 이상의 부작용은 설사, 탈모, 호중구 소실을 포함한다; 10% 이상은 적혈구 상실, 과민성 또는 알레르기 반응, 주입 반응, 식욕 저하, 불면증, 미각 왜곡, 입이나 입술의 염증, 변비, 발진, 손톱 질환,근육통도 [1]있어요.임신 중이거나 임신을 계획하고 있는 여성은 복용하지 말아야 하며, 특정 심장 질환을 가진 사람들에게는 연구되지 않았고 그러한 사람들에게는 주의해서 사용해야 하며, 무연사슬린과 [1]함께 사용해서는 안 된다.페르투주맙이 독소루비신과 [1]상호작용하는지는 알려져 있지 않다.
이것은 "HER 이량화 억제제"라고 불리는 종류의 약물의 첫 번째 종류입니다. 이것은 다른 HER 수용체와 HER2의 이량화를 억제하고, 세포 성장과 [4]증식을 촉진하는 방식으로 신호를 보내는 것을 방지합니다.
그것은 Genentech에 의해 발견되고 개발되었으며 [5][6]2012년에 처음 승인되었다.
의료 용도
HER2 양성 전이성 유방암의 [2][1]제1라인 치료제로서 트라스트주맙 및 도세탁셀과 함께 정맥주입으로 퍼투주맵을 투여한다.또한 HER2 양성 조기 유방암에 대한 네오아주반트(종양의 크기를 줄이기 위해 수술 또는 방사선 조사 전에 투여됨)와 동일한 조합으로 사용되었으며, 2016년 현재 이 사용이 [2]생존율을 높이는 것으로 입증되지 않았다.
2016년 현재[update], 좌심실 배출율 값이 정상 50% 이하이거나, 울혈성 심부전 이력이 있거나, 통제되지 않는 고혈압, 최근의 심장마비, 심각한 심장 [1]부정맥과 같이 좌심실 기능을 손상시킬 수 있는 상태를 가진 사람에게는 백일해법이 연구되지 않았다.백일해와 안트라사이클린의 [1]조합에 주의해야 한다.또한 독소르비신과 [1]함께 사용할 수 있는 pertuzumab의 안전 데이터도 없다.
가임기 여성은 피임약을 복용하면서 피임을 해야 한다.피임은 임산부의 태아를 손상시킬 수 있으며 [1]모유에서 분비될 수 있다.
부작용
전이성 유방암의 3제 병용요법 임상시험에서 복용자의 절반 이상에서 발생하는 부작용에는 설사, 탈모, 호중구 손실이 포함되었고, 10% 이상의 사람들은 발열과 함께 호중구 손실, 백혈구 [1]손실을 경험했다.일부에서 도세탁셀을 떨어뜨린 후 가장 흔한 부작용은 설사(28.1%), 상기도 감염(18.3%), 발진(18.3%), 두통(17.0%), 피로(13.4%), 코와 목의 붓기(17.4%), 약함(13.4%), 가려움(13.4%) 등이었다.사지의 통증(13.4%), 요통(12.1%), 기침(12.1%)[1] 순으로 나타났다.
이 조합의 네오아주반트 사용에 대한 임상 시험에서, 50% 이상의 사람들이 탈모와 호중구 [1]손실을 겪었다.
두 사용 모두에서 10% 이상의 사람들이 추가로 경험했다: 적혈구 상실, 과민성 또는 알레르기 반응, 주입 반응, 식욕 저하, 불면증, 미각 왜곡, 입이나 입술의 염증, 변비, 발진, 손톱 질환, 근육통.[1]
약리학
백일해대사는 직접적으로 연구되지 않았다.일반적으로 항체는 주로 이화작용에 의해 제거된다.퍼투주맙의 중간 간격은 하루에 0.235리터였고 중간 반감기는 18일이었다.[1]
작용 메커니즘
HER2는 세포외 수용체(수용체 티로신 키나아제)로 활성화되면 세포 증식과 세포 성장을 자극하는 여러 경로를 통해 신호 전달을 유발한다. 과다하게 발현되면 통제 불가능한 성장을 일으킬 수 있다.HER2 양성 유방암은 유방암 [7]종양의 약 15~30%에서 HER2의 과발현을 초래하는 ERB2 유전자 증폭에 의해 발생한다.
많은 수용체들처럼 HER2는 기능하기 위해 보통 다른 단백질을 결합합니다(이합체라고 불리는 과정). HER2는 제2의 HER2 수용체와 결합할 수 있고 HER 패밀리의 다른 수용체와 헤테로다이머화할 수 있습니다.신호 경로를 활성화하기 위한 가장 강력한 이합체는 HER2/HER3입니다.[4]
pertuzumab의 에피토프는 HER3에 결합하는 HER2의 도메인이며, pertuzumab은 HER2/HER3 이합체가 형성되는 것을 방지하여 [4][8]이합체에 의한 시그널링을 차단합니다.Tastuzumab은 HER2에 대한 또 다른 모노클로널 항체로, HER2가 또 다른 HER2 [4]단백질에 결합하는 도메인이다.두 개의 mAb가 함께 있으면 HER2가 [4]작동하지 않습니다.
화학 및 제조
퍼투즈맵은 인간-마우스 모노클로널 2C4 중쇄인 인간-마우스 모노클로널 2C4 [9]γ-사슬에 결합된 이황화물 HER2 단백질에 대한 가변영역을 가진 면역글로불린 G1이다.
역사
모노클로널 항체 2C4는 1990년 Genentech의 [10]과학자들에 의해 F와 같은 해에 처음 발표된 것으로 보인다. 호프만-라 로체 AG는 Genentech의 [11]지분 대부분을 취득했다.
2003년까지 Genentech는 2C4가 다른 HER 수용체와의 HER2 이량화를 방지한다는 것을 이해하고 HER2를 과도하게 발현하는 것이 아니라 광범위한 암을 목표로 1상 시험을 시작했다.최초의 HER 이량화 [12]억제제였어요
2005년 제넨텍은 전립선, 유방암, 난소암의 단일 약물로 2상 백일해 임상시험 결과가 좋지 않다며 다른 난소암 [13][14]치료제와 함께 개발을 계속할 계획이라고 밝혔다.
2007년에 Genentech는 Omnitarg라는 [15][16]상호를 폐기했다.
2009년 3월, Roche는 Genentech를 [17][18]인수했습니다.
2012년, 결과는 HER2 양성 전이 유방암에서 [19]트라스투주맙 및 도세탁셀과 함께 백일해조약 3상 임상시험인 CLATORA 임상시험의 결과가 발표되었다.Pertuzumab은 그해 [6]말 HER2 양성 전이성 유방암 치료에 대한 미국 FDA 승인을 받았다.2012년에 [20]발표된 NeoSphere의 Neoadjuvant 환경에서의 Phase II 시험 결과와 2013년에 [21]발표된 동일한 모집단의 Phase II 심장 안전성 연구 결과.FDA는 2013년에 [22]네오주반트 표시를 승인했다.퍼투주맙은 2013년 [1][3]유럽연합에서 의료용으로 승인되었다.
사회와 문화
경제학
2016년 현재[update] 미국에서는 3주마다 주어지는 3가지 약물 조합의 각 주기는 보조 치료 [23]비용을 제외하고 약 8,500달러의 비용이 든다.
영국에서는 2015년 NICE 평가에서 약물 조합이 비용 효과가 없다는 예비 결과가 나왔고, NICE는 2016년 5월 네오어주반트 환경에서 약물 조합이 생존 [24][25][26]이익을 제공하는지 알 수 없다는 이유로 해당 약물을 거부하였다.이 결정은 이후 6개월 후 번복되었고, 로체가 신주반트 환경에서 환자에게 공개되지 않은 할인 가격으로 NHS에 약을 제공하고 장기적인 재정적 [27]위험을 공유하기로 약속한 이후 거의 10년 만에 NHS에 의해 정기적인 NHS 자금 지원을 위해 NICE에 의해 승인된 최초의 새로운 유방암 약이 되었다.
레퍼런스
- ^ a b c d e f g h i j k l m n o "Perjeta 420 mg Concentrate for Solution for Infusion - Summary of Product Characteristics (SmPC)". (emc). 2 July 2021. Retrieved 3 January 2022.
- ^ a b c d e "Perjeta- pertuzumab injection, solution, concentrate". DailyMed. Retrieved 3 January 2022.
- ^ a b "Perjeta EPAR". European Medicines Agency (EMA). Retrieved 3 January 2022.
- ^ a b c d e Harbeck N, et al. (March 2013). "HER2 Dimerization Inhibitor Pertuzumab - Mode of Action and Clinical Data in Breast Cancer". Breast Care (Basel, Switzerland). 8 (1): 49–55. doi:10.1159/000346837. PMC 3971793. PMID 24715843.
- ^ "Drug Approval Package: Perjeta (pertuzumab) Injection NDA #125409". U.S. Food and Drug Administration (FDA). 3 August 2012. Retrieved 3 January 2022.
- ^ a b "FDA approves Perjeta for type of late-stage breast cancer". U.S. Food and Drug Administration (FDA). 8 June 2012. Archived from the original on 1 November 2012. Retrieved 3 January 2022.
- ^ Mitri Z, Constantine T, O'Regan R (2012). "The HER2 Receptor in Breast Cancer: Pathophysiology, Clinical Use, and New Advances in Therapy". Chemotherapy Research and Practice. 2012: 1–7. doi:10.1155/2012/743193. PMC 3539433. PMID 23320171.
- ^ Badache A, Hynes NE (April 2004). "A new therapeutic antibody masks ErbB2 to its partners" (PDF). Cancer Cell. 5 (4): 299–301. doi:10.1016/s1535-6108(04)00088-1. PMID 15093533.
- ^ "Proposed INN: List 89" (PDF). WHO Drug Information. 17 (3). 2003.
- ^ Fendly BM,(알.(3월 1일 1990년)."murine 단 클론 항체의 특성화가 인간의 표피 성장 인자 수용체 또는 HER2/neu 유전자 산물에 reactive"(PDF).암 연구. 50(5):1550–8.PMID 1689212., 몰리나 MA에서 참조된,(알.(152001년 6월)."Trastuzumab(herceptin), 유방 암 세포를 통해 인간화된anti-Her2 수용체 단 클론 항체,inhibits 기저 표시되고 활성화되 Her2ectodomain 분열"(PDF).암 연구 61(12):4744–9.PMID 11406546.
- ^ Fisher LM (1 October 2000). "Genentech: Survivor Strutting Its Stuff". The New York Times.
- ^ Albanell J, Codony J, Rovira A, Mellado B, Gascón P (2003). Mechanism of action of anti-HER2 monoclonal antibodies: scientific update on trastuzumab and 2C4. Advances in Experimental Medicine and Biology. Vol. 532. pp. 253–68. doi:10.1007/978-1-4615-0081-0_21. ISBN 978-0-306-47762-1. PMID 12908564.
- ^ "Press Release: Data From Omnitarg Clinical Program Presented at American Society of Clinical Oncology Meeting". Genentech. 15 May 2005.
- ^ "Genentech's Omnitarg fails in Phase II". Pharma Times. 16 May 2005.
- ^ "Correction: Letter from the Editor". Cancer Oncology News: 3. February 2012.
- ^ "Press release: Roche in the first half of 2007". Roche. 19 July 2007.
- ^ Morse, Andrew (10 May 2006). "Chugai Shares Post Healthy Gain On Prospects for Cancer Drug". The Wall Street Journal. Retrieved 26 September 2008.
- ^ "Roche Makes $43.7B Bid for Genentech". Genetic Engineering & Biotechnology News. 21 July 2008. Retrieved 26 September 2008.
- ^ Baselga J, CLEOPATRA Study Group, et al. (12 January 2012). "Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer". The New England Journal of Medicine. 366 (2): 109–19. doi:10.1056/nejmoa1113216. PMC 5705202. PMID 22149875.
- ^ 잔니 L,(알.(1월 2012년)."neoadjuvant pertuzumab과 trastuzumab 여성의 지역적 염증, 또는 일찍HER2-positive 발전해 유방 암으로 효능 및 안전(NeoSphere):randomised multicentre, open-label, 2단계 시험".TheLancet.종양 13(1):25–32. doi:10.1016(11)70336-9.PMID 22153890.Mates M,(알.(3월 2015년)에 인용한."체계적her2-positive 초기 여성 유방 암:치료는 증거의 2014년 암 관리 온타리오 체계적인 치료 지침에 대한 체계적인 논평을 목표로 삼았다".현재 종양 22(Suppl 1):S114–22. doi:10.3747/co.22.2322. 1.4381787.PMID 25848335.
- ^ Schneeweiss A, et al. (September 2013). "Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer: a randomized phase II cardiac safety study (TRYPHAENA)". Annals of Oncology. 24 (9): 2278–84. doi:10.1093/annonc/mdt182. PMID 23704196.
- ^ "FDA approves Perjeta for neoadjuvant breast cancer treatment". U.S. Food and Drug Administration (FDA) (Press release). 30 September 2013. Archived from the original on 10 October 2013. Retrieved 3 January 2022.
- ^ Durkee BY, Qian Y, Pollom EL, King MT, Dudley SA, Shaffer JL, et al. (March 2016). "Cost-effectiveness of pertuzumab in human epidermal growth factor receptor 2-positive metastatic breast cancer". Journal of Clinical Oncology. 34 (9): 902–9. doi:10.1200/jco.2015.62.9105. PMC 5070553. PMID 26351332.
- ^ Fleeman N, Bagust A, Beale S, Dwan K, Dickson R, Proudlove C, Dundar Y (January 2015). "Pertuzumab in combination with trastuzumab and docetaxel for the treatment of HER2-positive metastatic or locally recurrent unresectable breast cancer". PharmacoEconomics. 33 (1): 13–23. doi:10.1007/s40273-014-0206-2. PMID 25138171. S2CID 8470253.
- ^ "Breast cancer (HER2 positive, metastatic) - pertuzumab (with trastuzumab and docetaxel) [ID523]". NICE. 1 September 2016. Retrieved 2 November 2016.
- ^ McKee S (20 May 2016). "NICE rejects Roche's breast cancer drug Perjeta". Pharma Times.
- ^ Yip A (22 November 2016). "NICE U-Turns and Backs Approval of Roche's Perjeta for HER2-Positive Breast Cancer". Pharmalive.
추가 정보
- Dean L (2015). "Pertuzumab Therapy and ERBB2 (HER2) Genotype". In Pratt VM, McLeod HL, Rubinstein WS, et al. (eds.). Medical Genetics Summaries. National Center for Biotechnology Information (NCBI). PMID 28520364. Bookshelf ID: NBK315949.
외부 링크
- "Pertuzumab". Drug Information Portal. U.S. National Library of Medicine.


