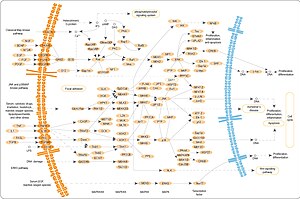
MAPK/ERK 경로
MAPK/ERK pathway
MAPK/ERK 경로(Ras-Raf-MEK-ERK 경로라고도 함)는 세포 표면의 수용체에서 세포 핵의 DNA로 신호를 전달하는 세포 내 단백질 사슬이다.
신호는 신호 분자가 세포 표면의 수용체에 결합할 때 시작되어 핵의 DNA가 단백질을 발현하고 세포 분열과 같은 세포에 어떤 변화를 일으킬 때 끝납니다.이 경로는 원래 세포외 신호 조절 키나제(ERK)라고 불리는 마이트젠 활성화 단백질 키나제(MAPKs)와 같은 많은 단백질을 포함하며, 이는 인접 단백질에 인산기를 추가함으로써(인산화), 이에 따라 "on" 또는 "off" 스위치로 작용한다.
경로의 단백질 중 하나가 변이되면, 그것은 많은 암의 발생에 필요한 단계인 "on" 또는 "off" 위치에 고착될 수 있습니다.사실, MAPK/ERK 경로의 구성요소는 암세포에서 처음 발견되었고, "on" 또는 "off" 스위치를 반전시키는 약물이 암 [1]치료제로 조사되고 있다.
배경
MAPK/ERK 경로를 시작하는 신호는 세포 표면 수용체에 세포 외 마이트겐의 결합이다.이것은 Ras 단백질(작은 GTPase)이 GTP 분자와 GDP 분자를 교환하여 경로의 "on/off 스위치"를 뒤집을 수 있게 합니다.Ras 단백질은 MAP3K(예: Raf)를 활성화하여 MAP2K를 활성화하고 MAPK를 활성화한다.마지막으로 MAPK는 Myc 등의 트랜스크립션 팩터를 활성화할 수 있습니다.이 프로세스에 대해서는, 이하에 자세하게 설명합니다.
RAS 액티베이션
표피성장인자수용체(EGFR)와 같은 수용체 결합 티로신인산화효소는 표피성장인자(EGF)와 같은 세포외배위자에 의해 활성화된다.EGFR에 대한 EGF의 결합은 수용체 세포질 도메인의 티로신인산화효소 활성을 활성화한다.EGFR은 티로신 잔류물에서 인산화된다.GRB2와 같은 도킹 단백질은 활성화된 [2]수용체의 포스포티로신 잔기에 결합하는 SH2 도메인을 포함한다.GRB2는 GRB2의 2개의 SH3 도메인을 통해 구아닌 뉴클레오티드 교환인자 SOS에 결합한다.GRB2-SOS 복합체가 인산화 EGFR에 도킹하면 SOS가 활성화됩니다.[3]그 후 활성화된 SOS는 Ras 서브패밀리(특히 H-Ras 또는 K-Ras)의 멤버로부터의 GDP 제거를 촉진한다.Ras 단백질은 GTP와 결합하여 활성화 될 수 있습니다.
EGFR과는 별도로 GRB2를 통해 이 경로를 활성화할 수 있는 다른 세포 표면 수용체로는 Trk A/B, 섬유아세포 성장인자 수용체(FGFR) 및 PDGFR이 있다.
키나제 캐스케이드
활성화된 Ras는 RAF [4]키나제의 단백질 키나제 활성을 활성화한다.RAF 키나제는 MAPK/ERK 키나제(MEK1 또는 MEK2)를 인산화 및 활성화한다.MEK는 마이트젠 활성화 단백질 키나제(MAPK)를 인산화 및 활성화한다.
RAF 및 MAPK/ERK는 모두 세린/트레오닌 특이 단백질 키나아제이다.MEK는 세린/티로신/트레오닌 키나아제이다.
기술적인 의미에서 RAF, MEK 및 MAPK는 모두 MNK와 마찬가지로 마이트젠 활성화 키나아제입니다(아래 참조).MAPKs는 원래 "세포외 신호 조절 키나제"와 "마이크로튜브 관련 단백질 키나제"로 불렸다.ERK에 의해 인산화되는 것으로 알려진 최초의 단백질 중 하나는 미세관 관련 단백질(MAP)이었다.아래에서 논의한 바와 같이, 후에 MAPK에 의한 인산화 표적들이 많이 발견되었고, 단백질은 "미토겐 활성화 단백질 키나제"(MAPK)로 개명되었다.RAF에서 MEK에서 MAPK로 이어지는 일련의 키나아제들은 단백질 키나아제 캐스케이드의 한 예이다.이러한 일련의 키나아제들은 피드백 조절과 신호 증폭의 기회를 제공한다.
번역 및 전사의 규제
오른쪽 그림에 MAPK에 의해 인산화되는 많은 단백질 중 3개가 나와 있다.MAPK 활성화의 한 가지 효과는 단백질에 대한 mRNA의 변환을 변화시키는 것이다.MAPK는 40S 리보솜 단백질 S6 키나제(RSK)를 인산화한다.이는 RSK를 활성화하고, 이는 리보솜 단백질 S6를 [5]인산화한다.리보솜 단백질 S6를 인산화시키는 미토겐 활성 단백질 키나아제(mitogen-activated protein kinase)가 최초로 [4]분리되었다.
MAPK는 몇 가지 전사 인자의 액티비티를 규제합니다.MAPK는 C-myc를 인산화할 수 있다.MAPK는 MNK를 인산화 및 활성화하고, MNK는 CREB를 인산화한다.MAPK는 또한 C-Fos 유전자의 전사를 조절한다.전사인자의 수준과 활동을 변화시킴으로써, MAPK는 세포주기에 중요한 유전자의 전사를 변화시킨다.
22q11, 1q42 및 19p13 유전자는 ERK 경로에 영향을 줌으로써 정신분열증, 정신분열증, 조울증, 편두통과 관련이 있다.
세포주기 진입 및 증식 조절
세포주기 진행에서 마이트젠 시그널링의 역할
ERK 경로는 표피 성장인자(EGF)와 같은 유사분열물질의 존재로부터 많은 포유동물 세포 유형에서 세포 성장과 증식을 촉진하는 신호 전달 사건에 외부 신호를 통합하는 중요한 역할을 한다.단순화된 모델에서, 유사분열원 및 성장 인자의 존재는 EGFR과 같은 표준 수용체 티로신 키나아제 활성화를 촉발하여 이들의 이량화 및 소량 GTPase [6]Ras의 후속 활성화를 유도한다.이는 MAPK 캐스케이드(Raf-MEK-ERK) 하류에서 일련의 인산화 현상으로 이어지며 궁극적으로 ERK의 인산화 및 활성화를 초래한다.ERK의 인산화효소는 키나아제 활성의 활성화를 초래하고 세포 증식의 조절에 관여하는 많은 하류 표적들의 인산화로 이어진다.대부분의 세포에서, 세포들이 세포 주기 진입을 유도하고 세포 주기의 음성 조절 인자를 억제하는 유전자를 활성화하기 위해 어떤 형태의 지속적 ERK 활성이 필요하다.이러한 두 가지 중요한 표적에는 둘 다 ERK에 [7]의해 인산화되는 Cdk4와 Cdk6(Cdk4/6)을 가진 사이클린 D 복합체가 포함된다.G1에서 S 단계로의 이행은 Cyclin D-Cdk4/6의 활성에 의해 조정되며, Cyclin D-Cdk4/6은 세포들이 승모균에 반응하여 S 단계로 진입할 준비를 하면서 G1 후기 단계에서 증가한다.Cdk4/6 활성화는 망막아세포종 단백질(Rb)의 [7]과인산화와 그에 따른 불안정화에 기여한다.저인산화 Rb는 보통 초기 G1에서 전사인자 E2F에 결합되어 그 전사활성을 억제하여 사이클린 E, 사이클린 A2, Emi1을 [6]포함한 S상 진입유전자의 발현을 방지한다.마이트젠 유도 Ras 시그널링의 다운스트림 ERK1/2 활성화는 이 세포 주기 블록을 제거하고 대부분의 포유동물 세포에서 세포가 S상으로 진행되도록 하는데 필요하고 충분합니다.
다운스트림 피드백 제어 및 쌍안정 G1/S 스위치 생성
제한점(R-point)은 포유동물 세포가 증식에 관여하고 성장 자극으로부터 독립할 때 중요한 사건을 나타낸다.그것은 정상적인 분화와 조직의 항상성에 기본적이며, 거의 모든 암에서 조절이 되지 않는 것으로 보인다.R 지점은 포유동물 세포 주기의 G1-S 전이 조절과 관련된 다양한 활동과 연관되어 있지만, 기본적인 메커니즘은 여전히 불분명하다.단세포 측정을 사용하여, 야오 등은 Rb–E2F 경로가 등급화된 혈청 입력을 모두 또는 전혀 없는 E2F [8]응답으로 변환하는 쌍안정 스위치로 기능한다는 것을 보여준다.
성장 및 승모겐 신호는 ERK 경로의 하류로 전송되며, E2F [8]활성화 수준에서 쌍안정 스위치를 생성하기 위해 여러 양의 피드백 루프에 통합된다.이는 G1 후기 단계에서의 세 가지 주요 상호작용으로 인해 발생합니다.첫 번째는 ERK를 통해 E2F의 [7]직접 활성화인 전사인자 Myc의 발현을 유도하는 마이트겐 자극의 결과이다.두 번째 경로는 Cyclin D와 Cdk4/6의 활성 복합체의 축적을 초래하는 ERK 활성화의 결과이며, 이는 인산화를 통해 Rb를 불안정하게 하고 E2F를 활성화하고 목표물의 발현을 촉진하는 역할을 한다.마지막으로, 이러한 상호작용은 그 자체의 발현으로 사이클린 E와 CDK2의 활성 복합체가 생성되고, 이는 S상으로 진입하는 세포의 결정을 더욱 고정시키는 역할을 하기 때문에 E2F에 의한 추가적인 양의 피드백 루프에 의해 강화된다.그 결과 혈청 농도가 서서히 높아지면 대부분의 포유동물 세포는 S상에 진입할 때 스위치 형태로 반응한다.E2F [9]활성화 후에도 세포가 G1로 복귀하는 것을 억제하기 때문에 쌍안정성이 있는 이 마이트젠 자극 E2F 스위치는 히스테리시스를 나타낸다.
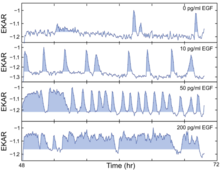
ERK 경로에 의한 동적 신호 처리 EGFR-ERK/MAPK(상피성장인자 수용체 세포외조절인산화효소/미토겐활성단백질인산화효소) 경로는 세포 증식에 중요하지만 신호와 반응 사이의 시간적 분리는 이전 연구에서 신호-반응 관계를 모호하게 한다.2013년 Albeck [10]등은 이러한 지식의 격차를 메우기 위한 핵심 실험 증거를 제공했다.그들은 신호와 출력을 쉽게 연관시킬 수 있는 정상 상태의 EGF 자극으로 신호 강도와 역학을 측정했습니다.그들은 또한 경로의 전체 동적 범위에 걸쳐 신호-응답 관계를 매핑했다.그들은 인산화 ERK(pERK)와 살아있는 세포 FLET 바이오센서의 고함량 면역 형광(HCIF) 검출을 사용하여 살아있는 세포와 고정된 세포 모두에서 ERK 경로의 하류 출력을 모니터링했다.ERK 시그널링의 정량적 특성을 증식률과 더욱 연계하기 위해 그들은 다양한 농도의 EGF를 적용하여 일련의 정상 상태 조건을 확립했다.
단세포 이미징 실험에서 ERK는 EGF의 존재 하에서 확률적 폭발에서 활성화되는 것으로 나타났다.또한 이 경로는 활성의 주파수 변조 펄스를 통해 신호 입력의 강도를 인코딩하는 것으로 나타났다.활세포 FLET 바이오센서를 사용하여, 다양한 빈도의 EGF 불법 활성의 다른 농도로 유도된 세포는 EGF의 높은 수준이 ERK 활성의 더 빈번한 폭발을 초래했다.낮은 EGF 농도에서의 산발적인 ERK 활성 펄스에 의해 S상 진입이 어떻게 영향을 받을 수 있는지 알아보기 위해 그들은 EKAR-EV와 RFP-gemin을 함께 발현하는 MCF-10A 셀을 사용하여 ERK 활성 펄스를 스코어링과 식별한 후 이 ERK 활성 프로파일을 G-inG의 시간 유도 시간에 맞췄다.그들은 긴 ERK 활동이 늘어난 펄스 길이에서 알 수 있듯이 S상 진입을 자극한다는 것을 발견했다.EGFR-ERK 경로의 역학, 특히 주파수 및 진폭 변조 방법을 이해하기 위해 EGFR 억제제 gefitinib 또는 고도로 선택적인 MAPK/ERK 키나제(MEK) 억제제 PD0325901(PD)을 적용했다.두 가지 억제제는 실제로 약간 다른 결과를 낳습니다. 중간 농도의 gefitinib는 맥동 거동을 유발하고 또한 PD에서는 관찰되지 않는 바이모달 시프트를 유발합니다.또한 EGF와 PD를 결합하여 ERK 활동의 빈도는 양적 변동에 의해 변조되고 진폭은 MEK 활동의 변화에 의해 변조된다는 결론을 도출한다.마지막으로 ERK 활동을 직접 추정하는 것이 기술적으로 어렵기 때문에 ERK 경로의 다운스트림 이펙터 중 하나인 Fra-1로 눈을 돌렸다.통합 ERK 경로 출력이 확산률에 어떻게 영향을 미치는지 이해하기 위해, 그들은 광범위한 EGF와 PD 농도의 조합을 사용했고, 실제로 역 "L" 모양의 단일 곡선 관계가 있다는 것을 발견했는데, 이는 낮은 수준의 ERK 경로에서 다음을 암시한다.출력, 신호 강도의 작은 변화는 증식 속도의 큰 변화에 대응하는 반면 동적 범위의 하이엔드 부근의 신호 강도의 큰 변화는 증식에 거의 영향을 미치지 않습니다.ERK 시그널링의 변동은 암의 ERK 경로에서 약물 타겟팅에 대한 생각의 관점에서 새로운 관점을 제공하면서 현재의 치료 접근법의 잠재적 문제를 강조한다.
증식 시 승모겐과 응력 신호의 통합
MCF10A 및 MCF7 세포에 대한 최근의 활세포 이미징 실험은 ERK를 통한 승모원 신호와 모세포의 p53 활성화를 통한 스트레스 신호의 조합이 새롭게 형성된 딸 세포가 세포 사이클에 즉시 재진입할지 또는 유사분열 전에 [11]정지(G0)에 들어갈지 여부에 기여하는 것으로 나타났다.분열 후 핵심 신호단백질이 없는 상태에서 시작하는 것이 아니라 세포 내 장기수명인 마이트젠/ERK 유도 Cyclin D1 mRNA 및 DNA 손상 유도 p53 단백질을 세포 분열 후 모세포에서 안정적으로 유전할 수 있다.이러한 조절제의 수준은 세포마다 유사분열 후 다양하며, Cdk2의 활성화에도 불구하고 세포 주기 확약에 강한 영향을 미친다.모세포에서 ERK 시그널링 억제제 또는 유도제 p53 시그널링을 사용한 화학적 섭동은 높은 수준의 p53 단백질과 낮은 수준의 Cyclin D1 전사물이 주로 G0에 들어가는 것으로 나타난 반면, 높은 Cyclin D1과 낮은 수준의 p53을 가진 세포는 세포 사이클에 다시 진입할 가능성이 가장 높다는 것을 시사한다.이러한 결과는 ERK를 통한 마이트젠 신호와 p53을 [12][13]통한 스트레스 응답의 역사를 통해 암호화된 분자 메모리의 형태를 보여줍니다.
임상적 의의
통제되지 않은 성장은 모든 [14]암의 발생에 필요한 단계이다.많은 암(예: 흑색종)에서 MAP/ERK 경로의 결함은 통제되지 않은 성장을 이끈다.많은 화합물은 MAP/ERK 경로의 단계를 억제할 수 있으므로,[15][16][17][18][19] 예를 들어 Hodgkin [20]질병과 같은 암을 치료하기 위한 잠재적 약물이다.
이 경로에 작용하도록 허가된 첫 번째 약물은 Raf 키나제 억제제인 소라페닙이다.
기타 Raf 억제제: SB590885, PLX4720, XL281, RAF265, encorafenib, dabrafenib, vemurafenib.[19]
일부 MEK 억제제: cobimetinib, CI-1040, PD0325901, Binimetinib(MEK162), selumetinib,[19] Trametinib(GSK1120212)[21]경락점막은 마우스 모델에서 알코올에 의한 위점막 손상을 완화시키는 역할을 하는 것으로 밝혀졌으며, 이는 표피 성장인자/ERK 신호 전달 [22]경로의 상향 조절 활성에 대한 영향과 밀접하게 관련될 수 있다.
RAF-ERK 경로는 다형성 질환인 누난 증후군의 병태생리학에도 관여하며, 여기서 심바스타틴은 CNS 인지 증상을 개선하는 방법으로 제안되었다.
단백질 마이크로어레이 분석은 신호 [23]경로에서 단백질 활성의 미묘한 변화를 검출하기 위해 사용될 수 있다.MAP/ERK 신호 전달 경로의 RAS 성분을 변경하는 유전자의 생식선 돌연변이에 의해 발생하는 발달 증후군을 RASopathies라고 한다.
「 」를 참조해 주세요.
레퍼런스
- ^ Orton RJ, Sturm OE, Vyshemirsky V, Calder M, Gilbert DR, Kolch W (Dec 2005). "Computational modelling of the receptor-tyrosine-kinase-activated MAPK pathway". The Biochemical Journal. 392 (Pt 2): 249–61. doi:10.1042/BJ20050908. PMC 1316260. PMID 16293107.
- ^ Schulze WX, Deng L, Mann M (2005). "Phosphotyrosine interactome of the ErbB-receptor kinase family". Molecular Systems Biology. 1 (1): 2005.0008. doi:10.1038/msb4100012. PMC 1681463. PMID 16729043.
- ^ Zarich N, Oliva JL, Martínez N, et al. (Aug 2006). "Grb2 is a negative modulator of the intrinsic Ras-GEF activity of hSos1". Molecular Biology of the Cell. 17 (8): 3591–7. doi:10.1091/mbc.E05-12-1104. PMC 1525251. PMID 16760435.
- ^ a b Avruch J, Khokhlatchev A, Kyriakis JM, et al. (2001). "Ras activation of the Raf kinase: tyrosine kinase recruitment of the MAP kinase cascade". Recent Progress in Hormone Research. 56 (1): 127–55. doi:10.1210/rp.56.1.127. PMID 11237210.
- ^ Pende M, Um SH, Mieulet V, et al. (Apr 2004). "S6K1,(-/-)/S6K2(-/-) mice exhibit perinatal lethality and rapamycin-sensitive 5'-terminal oligopyrimidine mRNA translation and reveal a mitogen-activated protein kinase-dependent S6 kinase pathway". Molecular and Cellular Biology. 24 (8): 3112–24. doi:10.1128/MCB.24.8.3112-3124.2004. PMC 381608. PMID 15060135.
- ^ a b 멜로체 등..ERK1/2 미토겐 활성화 단백질인산화효소 경로는 G1-에서 S-상으로의 이행의 주요 조절기관이다.Oncogen, vol. 26, no. 22, 2007, 페이지 3227–3239., doi:10.1038/sj.onc.1210414.
- ^ a b c 챔바르, 장-클로드 등"세포 주기 조절에서 ERK의 영향"BBA(Biochimica et Biophysica Acta) - 분자 세포 연구, vol. 1773, No. 8, 2007, 1299–1310 페이지, doi:10.1016/j.bbamcr. 2006.11.010.
- ^ a b 4. 야오, 광 등"Bestable Rb-E2F 스위치는 제한 지점의 기초가 됩니다."Nature Cell Biology, vol. 10, no. 4, 2008, 페이지 476-482., doi:10.1038/ncb1711.
- ^ 야오, 광 등"Bestable Rb-E2F 스위치는 제한 지점의 기초가 됩니다."Nature Cell Biology, vol. 10, no. 4, 2008, 페이지 476-482., doi:10.1038/ncb1711.
- ^ Albeck, John A. G. 등ERK 활동의 주파수 변조 펄스는 양적 확산 신호를 전송한다.분자 세포, vol. 49, no. 2, 2013, 페이지 249–261., doi:10.1016/j.molcel.2012.11.002.
- ^ 8. 양, 희원 등"Mitogen과 p53 신호 제어 셀 사이클 입력의 경쟁 메모리"Nature, vol. 549, No. 7672, 2017년 6월, 페이지 404-408., doi:10.1038/nature 23880.
- ^ 양, 희원 등"Mitogen과 p53 신호 제어 셀 사이클 입력의 경쟁 메모리"Nature, vol. 549, No. 7672, 2017년 6월, 페이지 404-408., doi:10.1038/nature 23880.
- ^ 케지오라, 카타지나 M, 제레미 E.퍼비스."세포 생물학:"기억의 지속성"Nature, vol. 549, No. 7672, 2017년 6월, 343–344페이지, doi:10.1038/nature 23549.
- ^ Downward J (2003). "Targeting RAS signalling pathways in cancer therapy". Nature Reviews Cancer. 3 (1): 11–22. doi:10.1038/nrc969. PMID 12509763. S2CID 43074411.
- ^ Hilger RA, Scheulen ME, Strumberg D (December 2002). "The Ras-Raf-MEK-ERK pathway in the treatment of cancer" (PDF). Onkologie. 25 (6): 511–8. doi:10.1159/000068621. PMID 12566895. S2CID 26673969. Archived from the original on 2012-10-06.
- ^ Sebolt-Leopold JS (June 2008). "Advances in the development of cancer therapeutics directed against the RAS-mitogen-activated protein kinase pathway". Clin. Cancer Res. 14 (12): 3651–6. doi:10.1158/1078-0432.CCR-08-0333. PMID 18559577. Archived from the original on 2011-09-06.
- ^ Hoshino R, Chatani Y, Yamori T, et al. (January 1999). "Constitutive activation of the 41-/43-kDa mitogen-activated protein kinase signaling pathway in human tumors". Oncogene. 18 (3): 813–22. doi:10.1038/sj.onc.1202367. PMID 9989833.
- ^ McCubrey JA, Steelman LS, Chappell WH, et al. (August 2007). "Roles of the Raf/MEK/ERK pathway in cell growth, malignant transformation and drug resistance". Biochim. Biophys. Acta. 1773 (8): 1263–84. doi:10.1016/j.bbamcr.2006.10.001. PMC 2696318. PMID 17126425.
- ^ a b c Kwong-Kwok Wong (2009). "Recent Developments in Anti-Cancer Agents Targeting the Ras/Raf/ MEK/ERK Pathway" (PDF). Archived from the original (PDF) on 2010-06-16.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ Zheng B, Fiumara P, Li YV, et al. (August 2003). "MEK/ERK pathway is aberrantly active in Hodgkin disease: a signaling pathway shared by CD30, CD40, and RANK that regulates cell proliferation and survival". Blood. 102 (3): 1019–27. doi:10.1182/blood-2002-11-3507. PMID 12689928.
- ^ "Cancer Clinical Trial: Study to Determine the Effectiveness of GSK1120212 in BRAF…". Archived from the original on 2012-07-08. Retrieved 2010-11-26.
- ^ Zhang H, Guo H, Zhang YC, Liu M, Ai K, Su YM, Li MH, Li TL (2014). "[Effect of moxibustion intervention on expression of gastric epidermal growth factor receptor and extracellular signal regulated kinase 1/2 expression in rats with gastric ulcer]". Zhen Ci Yan Jiu. 39 (5): 351–7. PMID 25518106.
- ^ Calvert VS, Tang Y, Boveia V, Wulfkuhle J, Schutz-Geschwender A, Oliver DM, Liotta LA, Petricoin EF (2004). "Development of Multiplexed Protein Profiling and Detection Using Near Infrared Detection of Reverse-Phase Protein Microarrays". Clinical Proteomics Journal. 1 (1): 81–89. doi:10.1385/CP:1:1:081.
외부 링크
- MAP 키나제 리소스.
- 교토 유전자 게놈 백과사전 - MAPK 경로
- 미국 국립의학도서관의 MAP+Kinase+Signaling+System Medical Subject Headings(MeSH)