포스포리파아제C
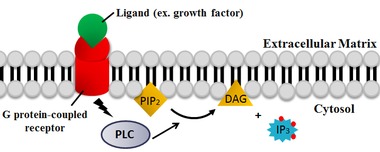
Phospholipase C포스포리파아제 C(PLC)는 인산기 직전에 인지질을 분해하는 막 관련 효소의 한 종류이다(그림 참조).그것은 진핵 세포 생리학, 특히 신호 전달 경로에서 중요한 역할을 하는 이 효소의 인간 형태와 동의어로 가장 일반적으로 받아들여진다.신호 전달에서 포스폴리파아제 C의 역할은 포스파티딜이노시톨 4,5-이인산(PIP)2을 디아실글리세롤(DAG)과 이노시톨 1,4,5-트리인산(IP3)으로 분해하는 것이다.각 PLC의 활성제는 다양하지만, 전형적으로 이종 이성질 G 단백질 소단위, 단백질 티로신 키나아제, 작은 G 단백질, Ca2+ 및 인지질을 [1]포함한다.
포유류의 포스포리파아제 C는 구조에 따라 6가지 이형(β, β, β, δ, δ)으로 분류되는 13가지 종류가 있다.각 PLC에는 발현과 세포하 분포에 대한 고유하고 중복되는 제어가 있습니다.
변종
포유류의 변종
PLC 반응에 의해 발휘되는 광범위한 기능들은 엄격히 조절되어야 하며, 적절한 역학을 통해 여러 세포외 및 세포내 입력에 반응할 수 있어야 한다.이러한 필요성은 동물에서 각각 다른 조절 모드를 가진 6가지 PLC 동형의 진화를 이끌었다.또한 PLC의 사전 mRNA는 포유동물이 최대 30개의 PLC [2]효소를 가질 수 있도록 차등 스플라이싱될 수 있다.
- 베타: PLCB1, PLCB2, PLCB3, PLCB4
- 감마: PLCG1, PLCG2
- 델타: PLCD1, PLCD3, PLCD4
- 엡실론: PLCE1
- 도착 예정일: PLCH1, PLCH2
- 제타: PLCZ1
- 포스포리파아제C양 : PLCL1, PLCL2
세균 변종
포스포리파아제 C의 세균 변이의 대부분은 구조적으로 관련된 단백질의 네 가지 그룹 중 하나로 특징지어진다.독성 포스포리파아제 C는 진핵세포막과 상호작용하여 포스파티딜콜린과 스핑고미엘린을 가수분해하여 궁극적으로 세포 [3]용해를 일으킨다.
- 아연-메탈로포스폴리파아제C: 클로스트리디움퍼프링겐 알파톡신, 바실러스세레우스PLC(BC-PLC)
- 스핑고미에리나아제: B. cereus, 황색포도상구균
- 포스파티딜이노시톨 가수분해효소: B. cereus, B. thuringiensis, L. monocytogenes(PLC-A)
- Pseudomonad 포스포리파아제C : PLC-H 및 PLC-N
효소구조
포유동물에서 PLC는 보존된 핵심 구조를 공유하며 각 과에 특정한 다른 영역에서 다르다.핵심 효소는 분할 삼인산 이성질화효소(TIM) 배럴, 플렉스트린 호몰로지(PH) 도메인, 4개의 탠덤 EF 핸드 도메인 및 C2 [1]도메인을 포함한다.TIM 배럴에는 활성 부위, 모든 촉매 잔류물 및 Ca 결합2+ 부위가 포함됩니다.X-Y 링커라고 불리는 액티비티를 중단하는 자동 억제 삽입 기능이 있습니다.X-Y 링커는 활성 사이트를 차단하고 제거와 함께 [4]PLC가 활성화됩니다.
클로스트리디움 바이페멘탄과 리스테리아 모노사이토제네스의 알파톡신(Clostridium perfringens), 바실러스 세레우스 PLC(BC-PLC) 및 PLCs를 코드하는 유전자를 분리하여 뉴클레오티드를 배열하였다.N 말단에서 약 250개의 잔류물인 시퀀스의 유의한 호몰로지가 있다.α-톡신은 C 말단에 120개의 추가 잔류물을 가지고 있다.알파톡신의 C 말단은 신호 전달에 관여하고 포유류의 포스포이노시티드 포스포리파아제 [5]C에 존재하는 진핵생물에서 발견되는 C2 도메인을 참조하는 "C2-like" 도메인으로 보고되었다.
효소 메커니즘
PLC의 1차 촉매 반응은 지질-물 계면의 불용성 기질에서 발생합니다.활성 부위의 잔류물은 모든 PLC 동형에서 보존됩니다.동물에서 PLC는 포스포디에스테르 결합의 글리세롤 측에서 인지질 포스파티딜이노시톨 4,5-이인산(PIP)2의 가수분해를 선택적으로 촉매한다.약한 효소 결합 중간체, 이노시톨 1,2-사이클 포스포디에스터 및 디아실글리세롤(DAG)의 방출이 있다.그런 다음 중간체를 이노시톨 1,4,5-트리인산(IP3)[6]으로 가수분해한다.따라서 2개의 최종 제품은3 DAG와 IP입니다.산/염기 촉매 작용에는 두 개의 보존 히스티딘 잔기가 필요하며 PIP 가수분해에는2 Ca 이온이 필요합니다2+.활성부위2+ Ca는 4개의 산성 잔류물과 배위하는 것으로 관찰되었으며, 잔류물 중 하나가 변이되면 촉매작용에 [7]더2+ 큰 Ca 농도가 필요하다.
규정
액티베이션
이 경로를 활성화하는 수용체는 주로 G 서브유닛에 결합된αq G 단백질 결합 수용체이며, 여기에는 다음이 포함된다.
- 5-HT2 세로토닌성 수용체
- α1(Alpha-1) 아드레날린수용체[8]
- 칼시토닌수용체
- H1 히스타민수용체
- 글루탐산메타성 글루탐산염 수용체, I군
- M1, M3, M5 무스카린 수용체
- 뇌하수체 전엽 갑상선 방출 호르몬 수용체
G 이외의αq 기타 마이너 액티베이터는 다음과 같습니다.
- MAP인산화효소이 경로의 활성제에는 PDGF와 FGF가 [8]포함된다.
- 성장호르몬 [9]방출호르몬에 의한 성장호르몬 방출의 작은 경로에서와 같이 헤테로 이성질 G단백질의 βγ-복합체.
- 칸나비노이드 수용체
억제
- 소분자 U73122: 아미노스테로이드, 추정 PLC 억제제.[10][11]그러나 U73122의 특이성은 [12]의문시되고 있습니다.U73122는 정제된 PLCs의 [13]포스포리파아제 활성을 활성화하는 것으로 보고되었다.
- 에델포신: 지질유사 항종양제(ET-18-OCH3)[14]
- 포유동물 세포 내 X-Y 링커의 자동 억제:X-Y 링커는 음전하의 밀도가 높은 영역을 형성하는 긴 길이의 산성 아미노산으로 구성되어 있다고 제안됩니다.이러한 영역은 PLC가 막 지질에 결합할 때 음전하 막에 의해 반발될 수 있다.반발과 입체 구속의 조합은 활성 부위 근처에서 X-Y 링커를 제거하고 자동 [1]억제를 완화하는 것으로 생각된다.
- 모르포리노벤조산 비계를 포함한 화합물은 약제상 포스파티딜콜린 특이 PLC 억제제의 [15][16][17]종류에 속한다.
- o-페난트롤린: 아연-아연-유기효소를[18] 억제하는 것으로 알려진 복소환 유기화합물
- EDTA: Zn 이온을 킬레이트하여2+ 효과적으로 PLC를 불활성화하는 분자, 아연 금속 효소를 억제하는[19] 것으로 알려져 있다.
생물학적 기능
PLC는 인지질 포스파티딜이노시톨 4,5-이인산(PIP)2을 디아실글리세롤(DAG) 및 이노시톨 1,4,5-트리인산(IP3)으로 분해한다.따라서 PLC는 많은 지질 게이트 이온 채널의 막 앵커 또는 [20][21]알로스테릭 조절제 및 작용제 역할을 하는 PIP의 고갈에2 큰 영향을 미친다.또한2 PIP는 다반응에서 [22]시그널링을 담당하는 보다 희귀한 지질 포스파티딜이노시톨 3,4,5-트리인산(PIP)3의 합성을 위한 기질로서도 작용한다.따라서 PLC 반응에 의한 PIP 고갈은2 혈장막과 핵막의 국소3 PIP 농도 조절에 매우 중요하다.
PLC 촉매 반응의 두 산물 DAG와3 IP는 다양한 세포 과정을 제어하는 중요한 두 번째 전달자이며 다른 중요한 신호 분자의 합성을 위한 기판입니다.PIP가 분해되면2 DAG는 막에 결합된 상태로 유지되며3, IP는 수용성 구조로서 세포질로 방출된다.그런3 다음 IP는 세포질을 통해 확산되어 IP 수용체, 특히 매끄러운 소포체(ER)의 칼슘 채널에 결합한다3.이것은 세포 내 칼슘 농도를 증가시켜 세포 내 변화와 [23]활동을 증가시킨다.게다가, 칼슘과 DAG는 단백질 키나제 C를 활성화 시키기 위해 함께 작용하며, 이것은 다른 분자들을 인산화함으로써, 변화된 세포 [23]활동을 이끈다.최종 효과에는 미각, 종양 촉진, 소포 세포 외전증, NADPH 산화효소로부터의 초산화물 생성, JNK [23][24]활성화 등이 포함됩니다.
DAG와3 IP는 모두 조절 분자의 합성을 위한 기질이다.DAG는 조절 분자인 포스파티드산의 합성을 위한 기질이다.IP는3 이노시톨 폴리인산염의 합성을 위한 속도 제한 기질이며, 다중 단백질 키나아제, 전사 및 mRNA [25]처리를 자극한다.따라서 PLC 활성의 조절은 세포 생리의 조절에 핵심적인 경로의 다른 효소의 조정과 조절에 필수적이다.
또한 인산화효소 C는 염증 경로에서 중요한 역할을 한다.트롬빈, 에피네프린 또는 콜라겐과 같은 작용제가 혈소판 표면 수용체에 결합하면 포스파티딜이노시톨과 포스파티딜콜린이라는 두 개의 주요 막에서 아라키돈산의 방출을 촉매하기 위해 포스폴리파아제 C의 활성화를 촉발할 수 있습니다.아라키돈산은 시클로옥시게나아제 경로(프로스토글란딘(PGE1, PGE2, PGF2) 생성), 프로스타사이클린(PGI2) 또는 트롬복산(TXA2) 생성 및 리포옥시게나아제 경로(류코트라이엔(LTB4, LTC4) 생성)로 갈 수 있다.
박테리아 변종 클로스트리디움 퍼프링겐스 타입 A는 알파톡신을 생성한다.포스포리파아제C 활성으로 용혈, 치사, 진피증을 일으킨다.고농도에서 알파톡신은 포스파티딜콜린과 스핑고미에린의 대규모 분해를 유도하여 각각 디아실글리세롤과 세라마이드를 생성한다.그런 다음 이러한 분자는 [5]신호 전달 경로에 참여합니다.독소가 분리된 쥐의 [27]대동맥에서 아라키돈산 캐스케이드를 활성화시키는 것으로 보고되었다.독소에 의한 수축은 아라키돈산으로부터 트롬복산2 A의 생성과 관련이 있었다.따라서 박테리아 PLC는 진핵 세포막에서 내생 PLC의 작용을 모방할 수 있다.
「 」를 참조해 주세요.
- 글리코실포스파티딜이노시톨디아실글리세롤리아제EC 4.6.1.14 트리파노솜 효소.
- 포스파티딜이노시톨디아실글리세롤리아제EC 4.6.13 기타 관련 세균효소
- 포스포이노시티드 포스포리파아제 C EC 3.1.4.11 진핵생물, 특히 포유류에서 발견되는 주요 형태.
- C. perfringens(레시티나제라고도 함), P. aeruginosa 및 S. aureus의 알파 독소를 포함하는 박테리아 효소 EC 3.1.4.3 아연 의존성 포스포리파아제 C 패밀리.
레퍼런스
- ^ a b c Kadamur G, Ross EM (2013). "Mammalian phospholipase C". Annual Review of Physiology. 75: 127–54. doi:10.1146/annurev-physiol-030212-183750. PMID 23140367.
- ^ Suh, PG; Park, JI; Manzoli, L; Cocco, L; Peak, JC; Katan, M; Fukami, K; Kataoka, T; Yun, S; Ryu, SH (2008). "Multiple roles of phosphoinositide-specific phospholipase C isozymes". BMB Reports. 41 (6): 415–34. doi:10.5483/bmbrep.2008.41.6.415. PMID 18593525.
- ^ Titball, RW (1993). "Bacterial phospholipases C." Microbiological Reviews. 57 (2): 347–66. doi:10.1128/MMBR.57.2.347-366.1993. PMC 372913. PMID 8336671.
- ^ Hicks SN, Jezyk MR, Gershburg S, Seifert JP, Harden TK, Sondek J (August 2008). "General and versatile autoinhibition of PLC isozymes". Molecular Cell. 31 (3): 383–94. doi:10.1016/j.molcel.2008.06.018. PMC 2702322. PMID 18691970.
- ^ a b Sakurai J, Nagahama M, Oda M (November 2004). "Clostridium perfringens alpha-toxin: characterization and mode of action". Journal of Biochemistry. 136 (5): 569–74. doi:10.1093/jb/mvh161. PMID 15632295.
- ^ Essen LO, Perisic O, Katan M, Wu Y, Roberts MF, Williams RL (February 1997). "Structural mapping of the catalytic mechanism for a mammalian phosphoinositide-specific phospholipase C". Biochemistry. 36 (7): 1704–18. doi:10.1021/bi962512p. PMID 9048554.
- ^ Ellis, MV; James, SR; Perisic, O; Downes, PC; Williams, RL; Katan, M (1998). "Catalytic Domain of Phosphoinositide-specific Phospholipase C (PLC): mutation analysis of residues within the active site of hydrophobic ridge of PLCD1". The Journal of Biological Chemistry. 273 (19): 11650–9. doi:10.1074/jbc.273.19.11650. PMID 9565585.
- ^ a b Walter F. Boron (2003). Medical Physiology: A Cellular And Molecular Approaoch. Elsevier/Saunders. p. 1300. ISBN 978-1-4160-2328-9. 페이지 104
- ^ Gene Globe -> GHRH[permanent dead link] 시그널링 2009년 5월 31일 취득
- ^ Bleasdale JE, Thakur NR, Gremban RS, Bundy GL, Fitzpatrick FA, Smith RJ, Bunting S (November 1990). "Selective inhibition of receptor-coupled phospholipase C-dependent processes in human platelets and polymorphonuclear neutrophils". The Journal of Pharmacology and Experimental Therapeutics. 255 (2): 756–68. PMID 2147038.
- ^ Macmillan D, McCarron JG (July 2010). "The phospholipase C inhibitor U-73122 inhibits Ca(2+) release from the intracellular sarcoplasmic reticulum Ca(2+) store by inhibiting Ca(2+) pumps in smooth muscle". British Journal of Pharmacology. 160 (6): 1295–301. doi:10.1111/j.1476-5381.2010.00771.x. PMC 2938802. PMID 20590621.
- ^ Huang W, Barrett M, Hajicek N, Hicks S, Harden TK, Sondek J, Zhang Q (February 2013). "Small molecule inhibitors of phospholipase C from a novel high-throughput screen". The Journal of Biological Chemistry. 288 (8): 5840–8. doi:10.1074/jbc.M112.422501. PMC 3581404. PMID 23297405.
- ^ Klein RR, Bourdon DM, Costales CL, Wagner CD, White WL, Williams JD, Hicks SN, Sondek J, Thakker DR (April 2011). "Direct activation of human phospholipase C by its well known inhibitor u73122". The Journal of Biological Chemistry. 286 (14): 12407–16. doi:10.1074/jbc.M110.191783. PMC 3069444. PMID 21266572.
- ^ Horowitz LF, Hirdes W, Suh BC, Hilgemann DW, Mackie K, Hille B (September 2005). "Phospholipase C in living cells: activation, inhibition, Ca2+ requirement, and regulation of M current". The Journal of General Physiology. 126 (3): 243–62. doi:10.1085/jgp.200509309. PMC 2266577. PMID 16129772.
- ^ Rees, Shaun W. P.; Leung, Euphemia; Reynisson, Jóhannes; Barker, David; Pilkington, Lisa I. (2021-09-01). "Development of 2-Morpholino-N-hydroxybenzamides as anti-proliferative PC-PLC inhibitors". Bioorganic Chemistry. 114: 105152. doi:10.1016/j.bioorg.2021.105152. ISSN 0045-2068.
- ^ Eurtivong, C.; Pilkington, L. I.; van Rensburg, M.; White, R. M.; Kaur Brar, H.; Rees, S.; Paulin, E. K.; Xu, C. S.; Sharma, N.; Leung, I. K. H.; Leung, E.; Barker, D.; Reynisson, J. (1 February 2020). "Discovery of novel phosphatidylcholine-specific phospholipase C drug-like inhibitors as potential anticancer agents". European Journal of Medicinal Chemistry. 187: 111919. doi:10.1016/j.ejmech.2019.111919. PMID 31810783. S2CID 208813280.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Pilkington, L. I.; Sparrow, K.; Rees, S. W. P.; Paulin, E. K.; van Rensburg, M.; Xu, C. S.; Langley, R. J.; Leung, I. K. H.; Reynisson, J.; Leung, E.; Barker, D. (2020). "Development, Synthesis and Biological Investigation of a Novel Class of Potent PC-PLC Inhibitors". European Journal of Medicinal Chemistry. 191: 112162. doi:10.1016/j.ejmech.2020.112162. PMID 32101781. S2CID 211536972.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Little C, Otnåss AB (June 1975). "The metal ion dependence of phospholipase C from Bacillus cereus". Biochimica et Biophysica Acta (BBA) - Enzymology. 391 (2): 326–33. doi:10.1016/0005-2744(75)90256-9. PMID 807246.
- ^ "Phospholipase C, Phosphatidylinositol-specific from Bacillus cereus" (PDF). Product Information. Sigma Aldrich.
- ^ Hilgemann DW (October 2007). "Local PIP(2) signals: when, where, and how?". Pflügers Archiv. 455 (1): 55–67. doi:10.1007/s00424-007-0280-9. PMID 17534652. S2CID 29839094.
- ^ Hansen (1 May 2015). "Lipid agonism: The PIP2 paradigm of ligand-gated ion channels". Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1851 (5): 620–628. doi:10.1016/j.bbalip.2015.01.011. PMC 4540326. PMID 25633344.
- ^ Falkenburger BH, Jensen JB, Dickson EJ, Suh BC, Hille B (September 2010). "Phosphoinositides: lipid regulators of membrane proteins". The Journal of Physiology. 588 (Pt 17): 3179–85. doi:10.1113/jphysiol.2010.192153. PMC 2976013. PMID 20519312.
- ^ a b c Alberts B, Lewis J, Raff M, Roberts K, Walter P (2002). Molecular biology of the cell (4th ed.). New York: Garland Science. ISBN 978-0-8153-3218-3.
- ^ Li Z, Jiang H, Xie W, Zhang Z, Smrcka AV, Wu D (February 2000). "Roles of PLC-beta2 and -beta3 and PI3Kgamma in chemoattractant-mediated signal transduction". Science. 287 (5455): 1046–9. Bibcode:2000Sci...287.1046L. doi:10.1126/science.287.5455.1046. PMID 10669417.
- ^ Gresset A, Sondek J, Harden TK (2012). "The phospholipase C isozymes and their regulation". Phosphoinositides I: Enzymes of Synthesis and Degradation. Subcellular Biochemistry. Vol. 58. pp. 61–94. doi:10.1007/978-94-007-3012-0_3. ISBN 978-94-007-3011-3. PMC 3638883. PMID 22403074.
- ^ Piomelli, Daniele (1993-04-01). "Arachidonic acid in cell signaling" (PDF). Current Opinion in Cell Biology. 5 (2): 274–280. doi:10.1016/0955-0674(93)90116-8. PMID 7685181.
- ^ Fujii Y, Sakurai J (May 1989). "Contraction of the rat isolated aorta caused by Clostridium perfringens alpha toxin (phospholipase C): evidence for the involvement of arachidonic acid metabolism". British Journal of Pharmacology. 97 (1): 119–24. doi:10.1111/j.1476-5381.1989.tb11931.x. PMC 1854495. PMID 2497921.