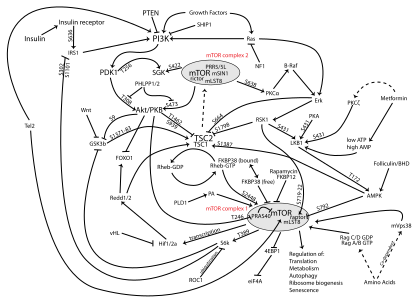
PI3K/AKT/mTOR 경로
PI3K/AKT/mTOR pathwayPI3K/AKT/mTOR 경로는 세포 내 신호 경로로서 세포 주기를 조절하는데 중요하다. 따라서 세포의 정지, 증식, 암, 장수와 직결된다. PI3K 활성화는 AKT를 활성화하여 플라즈마 막에서 국소화한다.[1] AKT는 CREB 활성화,[2] p27 억제,[3] 세포질 내 FOXO의 국소화,[3] PtdIns-3ps 활성화,[4] p70 또는 4EBP1의 전사에 영향을 줄 수 있는 mTOR[3] 활성화 등 여러 다운스트림 효과를 가질 수 있다.[3] EGF, 쉬,[5][2] IGF-1,[2] 인슐린 [3]및 CaM을 포함하여 PI3K/AKT 경로를 개선하는 많은 알려진 요인들이 있다.[4] 렙틴과 인슐린 모두 대사 조절을 위한 PI3K 신호 전달을 모집한다.[6] 이 통로는 [7]PTEN,[2] GSK3B, HB9 등 다양한 요인에 의해 반감을 사고 있다.[5]
많은 암에서 이 경로는 지나치게 활동적이어서 사멸을 줄이고 증식을 허용한다. 그러나 이 길은 성체줄기세포, 특히 신경줄기세포의 분화보다 성장과 증식을 촉진하기 위해 필요하다.[2] 이러한 균형을 다양한 치료법의 개발에 활용하기 위해 연구자들이 결정하고자 하는 것은 적절한 양의 확산 대 분화를 찾는 데 어려움이 있다.[2] 또한, 이 경로는 신경 장기 전위작용에 필요한 요소인 것으로 밝혀졌다.[4][8]
신경줄기세포 확산
포도당에 대한 반응
뇌의 신경줄기세포(NSC)는 분화 및 정지상태와는 반대로 자가 재생과 증식을 통해 다기능성을 유지하는 것 사이에서 균형을 찾아야 한다. PI3K/AKT 경로가 이 의사결정 과정에서 중요하다. NSC는 뇌나 유기체 전체의 변화를 감지하고 대응할 수 있다. 혈당 수치가 급격히 높아지면 췌장에서 인슐린이 분비된다. 인슐린 수용체 활성화는 PI3K/AKT 경로를 활성화시켜 증식을 촉진한다.[3] 이와 같이 유기체에 높은 포도당과 풍부한 에너지가 있을 때 PI3K/AKT 경로가 활성화되고 NSC가 증식하는 경향이 있다. 가용 에너지가 적은 경우 PI3K/AKT 경로의 활성도가 떨어지고 셀은 대기 상태를 채택한다. 이것은 부분적으로 AKT 인산염 FOXO가 세포질 내에 있게 하면서 FOXO를 유지할 때 발생한다.[3] FOXO는 탈인산화되면 핵에 들어가 전사인자로 작용해 p27, p21 등 다양한 종양 억제기의 발현을 촉진할 수 있다.[3] 이러한 종양 억제기는 NSC를 눌러 정지로 들어간다. FOXO knockouts는 세포가 대기상태로 들어갈 수 있는 능력을 상실하고 신경줄기세포 특성을 상실하며, 어쩌면 암과 같은 상태에 들어갈 수도 있다.[3]
PTEN
PI3K/AKT 경로에는 PTEN이라는 천연억제제가 있는데, 이 기능은 세포의 증식을 제한하여 암을 예방하는 데 도움을 준다. PTEN을 녹아웃시키는 것은 규제되지 않은 증식 때문에 뇌의 질량을 증가시키는 것으로 나타났다.[3] PTEN은 AKT가 막에 결합하는 능력을 제한하여 활동을 감소시키는 PIP3를 탈인산화 PIP2로 작용한다. PTEN 결함은 차별화 또는 정지를 구제하기 위해 하류에 보상될 수 있다. 이러한 이유로 PTEN을 탈락시키는 것은 FOXO를 탈락시키는 것만큼 심각하지 않다.[3]
크레비
cAMP 대응 요소 CREB는 증식 여부에 대한 세포 결정과 밀접하게 관련되어 있다. AKT를 과다하게 누를 수밖에 없는 세포는 야생형 세포에 비해 CREB의 양과 증식을 증가시킨다. 또한 이 세포들은 GFAP나 β-tubulin과 같은 덜 광택과 신경 세포 표지를 표현한다.[2] CREB는 증식을 촉진하는 사이클린A의 전사에 영향을 미치는 전사인자이기 때문이다.[2] 예를 들어, 성인 해마 신경 세포는 나중에 분화하기 위해 줄기세포로서 유지가 필요하다. 이것은 쉬에 의해 규제된다. 쉿은 느린 단백질 합성 의존을 통해 PI3K/AKT 경로와 시너지 효과를 내는 다른 계단들을 자극해 증식을 유도한다. 그러면 다른 경로를 끌 수 있고 PI3K/AKT 경로의 효과가 분화를 멈추는 데 불충분해진다.[2] 이 경로의 구체적인 내용은 알려지지 않았다.
암에서의 역할
난소암인
PI3K/AKT/mTOR 경로(pathway)는 난소암의 중심 조절기다. PIM 키나아제는 많은 종류의 암에서 과하게 발현되며 난소암 조절에도 기여한다. PIM은 직간접적으로 mTOR와 AKT와 같은 그것의 업스트림 이펙터를 활성화하는 것으로 발견된다. 게다가 PIM 키나제들은 IRS의 인산화작용을 유발하여 PI3K를 변화시킬 수 있다. PIM과 PI3K/AKT/m의 밀접한 상호작용을 나타낸다.TOR 계단식 및 구성 요소 마찬가지로 AKT도 OC세포에서 BAD 인산화를 수행하는 것으로 보고되었다. PIM과 PI3K/AKT/mTOR 네트워크 둘 다 OC 셀에서 P21과 P27 식을 억제할 수 있다. 이러한 데이터는 난소암 규제에서 PIM 키나제 및 PI3K/AKT/mTOR 네트워크의 상호 작용 및 관련성 가능성을 강하게 시사한다.[9] 그러나 난소암에서 이러한 경로를 목표로 하는 것은 여러 번의 실험이 충분한 임상적 이익을 달성하지 못하면서 어려운 일이었다.[10][11]
인 유방암
많은 종류의 유방암에서 PI3K/AKT/mTOR 경로에서의 이상은 가장 흔한 유전적 이상이다. 가장 일반적으로 알려진 이상은 PIK3를 포함한다.CA 유전자 돌연변이와 기능상실 돌연변이 또는 인산염과 텐신 호몰로뉴(PTEN)의 후생유전학적 침묵.[12] 라파마이신(mTOR) 경로의 인광산화물 3-키나아제(PI3K)/단백질키나제B(Akt)/매말리아 표적(mamalian target)은 BC 사례의 약 30~40%에서 활성화된다. In TNBC, oncogenic activation of the PI3K/AKT/mTOR pathway can happen as a function of overexpression of upstream regulators like EGFR, activating mutations of PIK3CA, loss of function or expression of phosphatase and tensin homolog (PTEN), and the proline-rich inositol polyphosphatase, which are downregulators of PI3K.[13] PI3K 억제제가 획득되었을 때 내분비 치료에 대한 저항을 극복할 수 있다는 가설과 일치한다.
우로텔리알 암에서
PIK3CA는 자궁암에서 기능 돌연변이를 종종 얻는다.[14] PI3Ka와 마찬가지로 PI3Kb는 여러 가지 다른 세포로 표현되며 혈소판 활성화와 혈전병 발병 등에 주로 관여하고 있다. PI3Kb가 종양 증식에도 기여한다는 연구결과가 나왔다. 구체적으로는 PTEN 음성암에서 종양이젠증에 중요한 역할을 하고 있다.[15] PI3Kb에 대한 유전자를 간섭하는 것은 돌연변이 PTEN과 E-캐더린 손실을 동반한 고위험 방광암에 대한 치료적 접근법일 수 있다고 보고되었다. PI3Kb에 대한 특정 이소성형 억제제는 PTEN-결핍성 암에 대한 잠재적 치료제다.[16]
인 전립선암
PI3K 경로는 전립선암에서 약물 내성의 주요 원천이다. 이것은 특히 종양이 안드로겐 결핍 요법에 내성을 갖게 되는 거세 저항성 전립선암에서는 더욱 그러하며, 이는 호르몬 안드로겐을 이용해 성장시키는 종양 능력을 차단하는 것이다.[17] 이는 안드로겐 수용체와 PI3K 경로 사이에 존재하는 복잡한 피드백 메커니즘 때문이다.[18] 다른 종양 유형에서와 같이, 이 경로의 주요 유전자의 돌연변이는 PIK3CA,[19][20] PIK3CA의 복사 횟수의 증가 및 mRNA 발현 증가와 같은 경로의 초활성화를 초래할 수 있다.[21] Gains in the nearby genetic region 3q26.31-32 have been shown to co-occur with a number of nearby PI3K family members including PIK3CA, PIK3CB and PIK3R4, leading to transcriptional changes in PIK3C2G, PIK3CA, PIK3CB, PIK3R4 as well as pathways associated with cell proliferation.[22] 이러한 큰 스패닝 이득은 글리슨 등급, 종양 단계, 림프절 전이 및 기타 공격적인 임상 특징과 관련이 있다.[22] PI3K 억제제로 치료된 환자의 경우 PIK3CB에서 복사 번호 증가가 있는 환자는 약물 민감도가 높아진 것으로 보인다.[23]
치료법
PI3K 억제제
PI3K 억제제는 약물의 내성을 극복하여 고급 유방암(ABC) 결과를 개선할 수 있다.[12] 다른 PI3K 억제제는 다양한 PI3K 유형에 대해 다른 효과를 나타낸다. 클래스 IA 팬-PI3K 억제제는 ISOform 특정 억제제보다 더 광범위하게 연구되었다. 픽틸리시브는 부팔리시브보다 서브유닛α 억제제 활성이 더 큰 또 다른 범PI3K 억제제다.[13] 이델알리시브는 미국 식품의약국(FDA)이 승인한 최초의 PI3K 억제제로 재발·회귀 만성 림프구 백혈병/소 림프구 림프종 및 모낭 림프종 치료에 활용된다. 코판리시브는 최소 두 번의 사전 전신 치료를 받은 환자의 엽 림프종 재발에 대해 승인된다.[24] 듀벨리십은 최소 두 번의 사전 치료를 받은 환자에 대해 재발/회귀 만성 림프구 백혈병/소형 림프구 림프종(CLL/SLL)과 재발/회귀 엽 림프종에 대해 승인된다.[25]
아크트억제제
AKT는 PI3K의 다운스트림이며 Ipatasertib에 의해 억제된다.[13] Akt는 AGC 패밀리 키나아제로서 PAM 경로의 중심적이고 통합된 신호 노드다. Akt isozymes는 Akt1, Akt2, Akt3 등 3개다. Akt1의 소분자 억제제는 유방암의 4~6%와 대장암의 1~2%에서 관찰되는 Akt1 E17K 활성 돌연변이가 높은 종양을 목표로 하는 데 특히 유용할 수 있다.[26] Akt 억제를 위한 연구는 (1) 비활성 효소의 알로스테리 포켓과 (2) ATP 결합 부위의 두 가지 뚜렷한 결합 부위의 억제에 초점을 맞추었다. MK-2206에 의해 강조된 알로스테릭 Akt 억제제는 임상 환경에서 광범위하게 평가되어 왔으며, 최근에는 추가적인 알로스테릭 Akt 억제제가 확인되고 있다. ARQ-092는 종양 성장을 사전 임상적으로 억제할 수 있는 강력한 범악트 억제제로서 현재 임상 1상 연구를 진행 중이다.[26]
mTOR억제제
인지질 mTOR은 1단계와 2단계 TNBC 환자의 생존율과 유의한 상관관계가 있다. mTOR 억제제 라파마이신(rapamycin)을 실험한 환자 유래 제노그라프트 TNBC 모델은 77~99%의 종양 성장 억제를 보였으며, 이는 독소루비신(doxorubicin)에서 관찰된 것보다 상당히 높은 수치였다. 단백질 인산화 연구 결과 mTOR 경로의 구성 활성화가 치료와 함께 감소하는 것으로 나타났다.[13]
이중 PI3K/AKT/mTOR 억제제
PI3K/AKT/mTOR 경로의 막힘은 TNBC의 항균제 활성을 증가시킬 수 있다는 가설이 제기되었다. 이전 임상 데이터는 PI3K/AKT/mTOR 경로에서 서로 다른 인지 분자를 대상으로 하는 화합물의 조합이 시너지 활성을 유도한다는 것을 보여주었다. 이러한 결과에 기초하여 PI3K/AKT/mTOR 경로의 서로 다른 구성요소를 대상으로 하는 새로운 화합물이 동시에 계속 개발되고 있다. 예를 들어, 게다톨리브는 야생형 PI3K-α에 대해 IC50에 해당하는 농도에서 키나제 활성이 높아진 돌연변이 형태의 PI3K-α를 억제한다. PI3K-β, -Δ 및 -γ 이소폼은 PI3K-α에 대해 관측된 것보다 약 10배 높은 농도에서 게다톨리브에 의해 억제되었다.[13] PI3K와 mTOR를 동시에 대상으로 하는 또 다른 이점은 격리된 PI3K 억제에서 보이는 수용체 타이로신 키나제 양성 피드백 루프의 보다 강력한 억제다.[27] 게다톨리브는 현재 PTK7 항체-약물결합제와 결합하여 TNBC 치료를 위해 개발 중에 있다. 아피톨리시브(Apitolisib, GDC-0980)는 또한 mTORC를 표적으로 하는 PI3K 억제제(subunits α, Δ, α, α)이다.
PI3K 경로 공동 표적 치료
PI3K 경로와 교차 대화를 나타내는 수많은 세포 신호 전달 경로가 있으며, 잠재적으로 암세포가 PI3K의 억제를 벗어날 수 있다.[29] 이와 같이 다른 표적과 나란히 PI3K 경로의 억제는 폐암 세포에서 PI3K와 MEK 공동 표적 억제와 같이 시너지 반응을 제공할 수 있다.[30] 보다 최근에는 PIM 키나제와의 PI3K 경로를 공동 목표로 하는 것이 제안되었으며, 임상 전 수많은 연구가 이 접근법의 잠재적 편익을 제시하였다.[31][32] PI3K 경로의 억제에 내성이 있는 셀 라인 패널의 개발은 미래의 공동 표적을 식별하게 할 수 있으며, 약물 치료 후 PI3K 신호의 상실을 보상할 수 있는 경로를 더 잘 이해할 수 있다.[33] 화학요법과 같은 전통적인 치료법과 PI3K 억제를 결합하면 PI3K 억제에 대한 개선된 대응도 제공할 수 있다.[34]
신경줄기세포
성장 요인 신호의 유형은 NSC가 모터 뉴런으로 구분되는지 여부에 영향을 미칠 수 있다. FGF2로 매체를 프라이밍하면 GSK3β를 활성화하는 PI3K/AKT 경로의 활성도가 낮아진다. 이것은 HB9의 표현을 증가시킨다.[5] NSC에서 PI3K를 직접 억제하면 순수하게 HB9+인 세포군이 발생하며 높은 효율로 모터 뉴런으로 분화된다. 이 세포들을 쥐의 다른 부분에 이식하면 이식된 세포의 미세 환경에 상관없이 운동 뉴런이 생성된다.[5] 부상에 이어 신경줄기세포가 수리 단계에 들어가 높은 수준의 PI3K를 표현해 증식을 강화한다. 이것은 뉴런 전체의 생존에 더 좋지만 운동 뉴런을 생성하는 비용을 부담한다. 따라서 손상된 운동 신경세포가 능력을 회복하는 것은 어려울 수 있다.[5] 증식할 수 있지만 여전히 운동 뉴런으로 분화하는 신경줄기세포를 생성하는 것이 현대 연구의 목적이다. PI3K 경로의 영향을 낮추고 NSC에서 GSK3β 및 HB9의 영향을 증가시키는 것이 이러한 셀을 생성하는 잠재적인 방법이다.[5]
PTEN 억제제
PTEN은 PI3K/AKT 경로를 억제하는 종양 억제기다. bisperoxovanadium과 같은 PTEN 억제제는 세포 이동,[36] 생존[37] 및 확산을 촉진하기 위해 PI3K/AKT 경로를 강화할 수 있다.[35][7] 세포주기의 조절장애와 종양기세증에 대한 우려는 있지만 일시적이고 온건한 PTEN 억제는 외상성 뇌손상에[38] 대한 신경치료제를 부여할 수 있고, 축생식에 의한 연결 끊김을 재확립함으로써 CNS 회복을 향상시킬 수 있다.[7] PTEN 억제제의 약학적 가치는 여전히 결정되어야 한다.
장기위력
장기전위제(LTP)가 일어나려면 NMDA 수용체 자극이 있어야 하며, 이 자극으로 인해 AMPA 수용체가 시냅스 후 삽입되게 된다. PI3K는 보존된 영역의 AMPA 수용체에 결합하여 특히 GluR 서브유닛에서 멤브레인 내 수용체 방향을 정한다.[4] PI3K 활성도는 칼슘 이온과 CaM에 반응하여 증가한다. 또한 AKT는 포스트 시냅스에서 PtdIns-3Ps를 국산화하여 tSNare, Vam7 등의 도킹 단백질을 채용한다. 이것은 직접적으로 사후 시냅스에서 AMPA의 도킹으로 이어진다.[4] mTOR은 p70S6K를 활성화했고, 4EBP1은 LTP가 발생하도록 유전자 발현을 변경했다.[8] 장기 공포 조절 훈련은 쥐에게 영향을 미쳤지만 단기 조절에는 효과가 없었다. 특히 편도체는 공포 조절을 상실했다. 이것은 조건부 자극과 조건부 자극의 연관성을 필요로 하는 일종의 학습 추적 조절이다. 이 효과는 PI3K 녹다운에서 손실되었고 PI3K 과다압박에서 증가하였다.[8]
뇌 성장에 있어서의 역할
PI3K-AKT 신호경로는 위에서 설명한 시냅스 가소성에 대한 그것의 역할 외에도, PI3K 신호가 교란될 때 변경되는 뇌 성장에도 중요한 역할을 한다. 예를 들어, 두개내 볼륨은 특히 AKT3 내부 변형과 이 경로와도 연관되어 있다.[39] 갑상선 호르몬은 원래 뇌 성장과 인지를 조절하는 1차 조절기로 확인되었으며, 최근의 증거는 갑상선 호르몬이 PI3K를 통해 시냅스의 성숙과 가소성에 미치는 영향의 일부를 발생시킨다는 것을 증명하고 있다.[40]
참고 항목
참조
- ^ King D, Yeomanson D, Bryant HE (May 2015). "PI3King the lock: targeting the PI3K/Akt/mTOR pathway as a novel therapeutic strategy in neuroblastoma". Journal of Pediatric Hematology/Oncology. 37 (4): 245–51. doi:10.1097/MPH.0000000000000329. PMID 25811750. S2CID 42323379.
- ^ a b c d e f g h i Peltier J, O'Neill A, Schaffer DV (September 2007). "PI3K/Akt and CREB regulate adult neural hippocampal progenitor proliferation and differentiation". Developmental Neurobiology. 67 (10): 1348–61. doi:10.1002/dneu.20506. PMID 17638387. S2CID 16337839.
- ^ a b c d e f g h i j k Rafalski VA, Brunet A (February 2011). "Energy metabolism in adult neural stem cell fate". Progress in Neurobiology. 93 (2): 182–203. doi:10.1016/j.pneurobio.2010.10.007. PMID 21056618. S2CID 16305263.
- ^ a b c d e Man HY, Wang Q, Lu WY, Ju W, Ahmadian G, Liu L, et al. (May 2003). "Activation of PI3-kinase is required for AMPA receptor insertion during LTP of mEPSCs in cultured hippocampal neurons". Neuron. 38 (4): 611–24. doi:10.1016/s0896-6273(03)00228-9. PMID 12765612. S2CID 17419450.
- ^ a b c d e f Ojeda L, Gao J, Hooten KG, Wang E, Thonhoff JR, Dunn TJ, et al. (2011). "Critical role of PI3K/Akt/GSK3β in motoneuron specification from human neural stem cells in response to FGF2 and EGF". PLOS ONE. 6 (8): e23414. Bibcode:2011PLoSO...623414O. doi:10.1371/journal.pone.0023414. PMC 3160859. PMID 21887250.
- ^ Garcia-Galiano D, Borges BC, Allen SJ, Elias CF (2019). "PI3K signalling in leptin receptor cells: Role in growth and reproduction". Journal of Neuroendocrinology. 31 (5): e12685. doi:10.1111/jne.12685. PMC 6533139. PMID 30618188.
- ^ a b c Wyatt LA, Filbin MT, Keirstead HS (August 2014). "PTEN inhibition enhances neurite outgrowth in human embryonic stem cell-derived neuronal progenitor cells". The Journal of Comparative Neurology. 522 (12): 2741–55. doi:10.1002/cne.23580. PMID 24610700. S2CID 205683500.
- ^ a b c Sui L, Wang J, Li BM (October 2008). "Role of the phosphoinositide 3-kinase-Akt-mammalian target of the rapamycin signaling pathway in long-term potentiation and trace fear conditioning memory in rat medial prefrontal cortex". Learning & Memory. 15 (10): 762–76. doi:10.1101/lm.1067808. PMID 18832563.
- ^ Aziz AU, Farid S, Qin K, Wang H, Liu B (February 2018). "PIM Kinases and Their Relevance to the PI3K/AKT/mTOR Pathway in the Regulation of Ovarian Cancer". Biomolecules. 8 (1): 7. doi:10.3390/biom8010007. PMC 5871976. PMID 29401696.
- ^ Ciccone, Marcia A.; Maoz, Asaf; Casabar, Jennifer K.; Machida, Hiroko; Mabuchi, Seiji; Matsuo, Koji (July 2016). "Clinical outcome of treatment with serine-threonine kinase inhibitors in recurrent epithelial ovarian cancer: a systematic review of literature". Expert Opinion on Investigational Drugs. 25 (7): 781–796. doi:10.1080/13543784.2016.1181748. ISSN 1744-7658. PMC 7534810. PMID 27101098. S2CID 28717797.
- ^ Maoz, Asaf; Ciccone, Marcia A.; Matsuzaki, Shinya; Coleman, Robert L.; Matsuo, Koji (2019-11-22). "Emerging serine-threonine kinase inhibitors for treating ovarian cancer". Expert Opinion on Emerging Drugs. 24 (4): 239–253. doi:10.1080/14728214.2019.1696773. ISSN 1744-7623. PMC 7526049. PMID 31755325. S2CID 208227849.
- ^ a b Raphael J, Desautels D, Pritchard KI, Petkova E, Shah PS (March 2018). "Phosphoinositide 3-kinase inhibitors in advanced breast cancer: A systematic review and meta-analysis". European Journal of Cancer. 91: 38–46. doi:10.1016/j.ejca.2017.12.010. PMID 29331750.
- ^ a b c d e Costa RL, Han HS, Gradishar WJ (June 2018). "Targeting the PI3K/AKT/mTOR pathway in triple-negative breast cancer: a review". Breast Cancer Research and Treatment. 169 (3): 397–406. doi:10.1007/s10549-018-4697-y. PMID 29417298. S2CID 19888056.
- ^ Serra V, Markman B, Scaltriti M, Eichhorn PJ, Valero V, Guzman M, et al. (October 2008). "NVP-BEZ235, a dual PI3K/mTOR inhibitor, prevents PI3K signaling and inhibits the growth of cancer cells with activating PI3K mutations". Cancer Research. 68 (19): 8022–30. doi:10.1158/0008-5472.CAN-08-1385. PMID 18829560.
- ^ Liu ST, Hui G, Mathis C, Chamie K, Pantuck AJ, Drakaki A (April 2018). "The Current Status and Future Role of the Phosphoinositide 3 Kinase/AKT Signaling Pathway in Urothelial Cancer: An Old Pathway in the New Immunotherapy Era". Clinical Genitourinary Cancer. 16 (2): e269–e276. doi:10.1016/j.clgc.2017.10.011. PMID 29199023. S2CID 4533538.
- ^ Winkler DG, Faia KL, DiNitto JP, Ali JA, White KF, Brophy EE, et al. (November 2013). "PI3K-δ and PI3K-γ inhibition by IPI-145 abrogates immune responses and suppresses activity in autoimmune and inflammatory disease models". Chemistry & Biology. 20 (11): 1364–74. doi:10.1016/j.chembiol.2013.09.017. PMID 24211136.
- ^ Park, Soonbum; Kim, Young Sik; Kim, Davis Yeon; So, Insuk; Jeon, Ju-Hong (December 2018). "PI3K pathway in prostate cancer: All resistant roads lead to PI3K". Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1870 (2): 198–206. doi:10.1016/j.bbcan.2018.09.001. ISSN 1879-2561. PMID 30300679.
- ^ Carver, Brett S.; Chapinski, Caren; Wongvipat, John; Hieronymus, Haley; Chen, Yu; Chandarlapaty, Sarat; Arora, Vivek K.; Le, Carl; Koutcher, Jason; Scher, Howard; Scardino, Peter T. (2011-05-17). "Reciprocal feedback regulation of PI3K and androgen receptor signaling in PTEN-deficient prostate cancer". Cancer Cell. 19 (5): 575–586. doi:10.1016/j.ccr.2011.04.008. ISSN 1878-3686. PMC 3142785. PMID 21575859.
- ^ Zahari, Muhammad Saddiq; Wu, Xinyan; Blair, Brian G.; Pinto, Sneha M.; Nirujogi, Raja S.; Jelinek, Christine A.; Malhotra, Radhika; Kim, Min-Sik; Park, Ben Ho; Pandey, Akhilesh (2015-09-04). "Activating Mutations in PIK3CA Lead to Widespread Modulation of the Tyrosine Phosphoproteome". Journal of Proteome Research. 14 (9): 3882–3891. doi:10.1021/acs.jproteome.5b00302. ISSN 1535-3907. PMC 4641567. PMID 26267517.
- ^ Pearson, Helen B.; Li, Jason; Meniel, Valerie S.; Fennell, Christina M.; Waring, Paul; Montgomery, Karen G.; Rebello, Richard J.; Macpherson, Arthi A.; Koushyar, Sarah; Furic, Luc; Cullinane, Carleen (June 2018). "Identification of Pik3ca Mutation as a Genetic Driver of Prostate Cancer That Cooperates with Pten Loss to Accelerate Progression and Castration-Resistant Growth". Cancer Discovery. 8 (6): 764–779. doi:10.1158/2159-8290.CD-17-0867. ISSN 2159-8290. PMID 29581176.
- ^ Agell, Laia; Hernández, Silvia; Salido, Marta; de Muga, Silvia; Juanpere, Nuria; Arumí-Uria, Montserrat; Menendez, Silvia; Lorenzo, Marta; Lorente, José A.; Serrano, Sergio; Lloreta, Josep (March 2011). "PI3K signaling pathway is activated by PIK3CA mRNA overexpression and copy gain in prostate tumors, but PIK3CA, BRAF, KRAS and AKT1 mutations are infrequent events". Modern Pathology. 24 (3): 443–452. doi:10.1038/modpathol.2010.208. ISSN 1530-0285. PMID 21113138. S2CID 27405431.
- ^ a b Simpson, Benjamin S.; Camacho, Niedzica; Luxton, Hayley J.; Pye, Hayley; Finn, Ron; Heavey, Susan; Pitt, Jason; Moore, Caroline M.; Whitaker, Hayley C. (2020-08-14). "Genetic alterations in the 3q26.31-32 locus confer an aggressive prostate cancer phenotype". Communications Biology. 3 (1): 440. doi:10.1038/s42003-020-01175-x. ISSN 2399-3642. PMC 7429505. PMID 32796921. S2CID 221118233.
- ^ Bono, Johann de; Arkenau, Hendrik-Tobias; Mateo, Joaquin; Infante, Jeffrey R.; Burris, Howard A.; Bang, Yung-Jue; Eder, Joseph; Sharma, Sunil; Chung, Hyun C.; Decordova, Shaun; Swales, Karen E. (2015-08-01). "Abstract CT328: Exploratory genetic analysis of tumors from a phase I/II dose escalation study of GSK2636771 in patients (pts) with PTEN deficient advanced tumors". Cancer Research. 75 (15 Supplement): CT328. doi:10.1158/1538-7445.AM2015-CT328. ISSN 0008-5472.
- ^ Greenwell IB, Ip A, Cohen JB (November 2017). "PI3K Inhibitors: Understanding Toxicity Mechanisms and Management". Oncology. 31 (11): 821–8. PMID 29179250.
- ^ "duvelisib (COPIKTRA, Verastem, Inc.) for adult patients with relapsed or refractory chronic lymphocytic leukemia (CLL) or small lymphocytic lymphoma (SLL)". U.S. Food and Drug Administration. Retrieved 23 October 2018.
- ^ a b Huck BR, Mochalkin I (July 2017). "Recent progress towards clinically relevant ATP-competitive Akt inhibitors". Bioorganic & Medicinal Chemistry Letters. 27 (13): 2838–2848. doi:10.1016/j.bmcl.2017.04.090. PMID 28506751.
- ^ Chakrabarty A, Sánchez V, Kuba MG, Rinehart C, Arteaga CL (February 2012). "Feedback upregulation of HER3 (ErbB3) expression and activity attenuates antitumor effect of PI3K inhibitors". Proceedings of the National Academy of Sciences of the United States of America. 109 (8): 2718–23. Bibcode:2012PNAS..109.2718C. doi:10.1073/pnas.1018001108. PMC 3286932. PMID 21368164.
- ^ Cappellen D, Gil Diez de Medina S, Chopin D, Thiery JP, Radvanyi F (June 1997). "Frequent loss of heterozygosity on chromosome 10q in muscle-invasive transitional cell carcinomas of the bladder". Oncogene. 14 (25): 3059–66. doi:10.1038/sj.onc.1201154. PMID 9223669.
- ^ Heavey, Susan; O'Byrne, Kenneth J.; Gately, Kathy (April 2014). "Strategies for co-targeting the PI3K/AKT/mTOR pathway in NSCLC". Cancer Treatment Reviews. 40 (3): 445–456. doi:10.1016/j.ctrv.2013.08.006. ISSN 1532-1967. PMID 24055012.
- ^ Heavey, Susan; Cuffe, Sinead; Finn, Stephen; Young, Vincent; Ryan, Ronan; Nicholson, Siobhan; Leonard, Niamh; McVeigh, Niall; Barr, Martin; O'Byrne, Kenneth; Gately, Kathy (2016-11-29). "In pursuit of synergy: An investigation of the PI3K/mTOR/MEK co-targeted inhibition strategy in NSCLC". Oncotarget. 7 (48): 79526–79543. doi:10.18632/oncotarget.12755. ISSN 1949-2553. PMC 5346733. PMID 27765909.
- ^ Luszczak, Sabina; Kumar, Christopher; Sathyadevan, Vignesh Krishna; Simpson, Benjamin S.; Gately, Kathy A.; Whitaker, Hayley C.; Heavey, Susan (2020). "PIM kinase inhibition: co-targeted therapeutic approaches in prostate cancer". Signal Transduction and Targeted Therapy. 5: 7. doi:10.1038/s41392-020-0109-y. ISSN 2059-3635. PMC 6992635. PMID 32025342.
- ^ Malone, Tom; Schäfer, Lea; Simon, Nathalie; Heavey, Susan; Cuffe, Sinead; Finn, Stephen; Moore, Gillian; Gately, Kathy (March 2020). "Current perspectives on targeting PIM kinases to overcome mechanisms of drug resistance and immune evasion in cancer" (PDF). Pharmacology & Therapeutics. 207: 107454. doi:10.1016/j.pharmthera.2019.107454. ISSN 1879-016X. PMID 31836451. S2CID 209357486.
- ^ Heavey, Susan; Dowling, Paul; Moore, Gillian; Barr, Martin P.; Kelly, Niamh; Maher, Stephen G.; Cuffe, Sinead; Finn, Stephen P.; O'Byrne, Kenneth J.; Gately, Kathy (26 January 2018). "Development and characterisation of a panel of phosphatidylinositide 3-kinase - mammalian target of rapamycin inhibitor resistant lung cancer cell lines". Scientific Reports. 8 (1): 1652. Bibcode:2018NatSR...8.1652H. doi:10.1038/s41598-018-19688-1. ISSN 2045-2322. PMC 5786033. PMID 29374181.
- ^ Heavey, Susan; Godwin, Peter; Baird, Anne-Marie; Barr, Martin P.; Umezawa, Kazuo; Cuffe, Sinéad; Finn, Stephen P.; O'Byrne, Kenneth J.; Gately, Kathy (October 2014). "Strategic targeting of the PI3K-NFκB axis in cisplatin-resistant NSCLC". Cancer Biology & Therapy. 15 (10): 1367–1377. doi:10.4161/cbt.29841. ISSN 1555-8576. PMC 4130730. PMID 25025901.
- ^ Schmid AC, Byrne RD, Vilar R, Woscholski R (May 2004). "Bisperoxovanadium compounds are potent PTEN inhibitors". FEBS Letters. 566 (1–3): 35–8. doi:10.1016/j.febslet.2004.03.102. PMID 15147864.
- ^ Mihai C, Bao S, Lai JP, Ghadiali SN, Knoell DL (February 2012). "PTEN inhibition improves wound healing in lung epithelia through changes in cellular mechanics that enhance migration". American Journal of Physiology. Lung Cellular and Molecular Physiology. 302 (3): L287-99. doi:10.1152/ajplung.00037.2011. PMC 3289272. PMID 22037358.
- ^ Lai JP, Dalton JT, Knoell DL (December 2007). "Phosphatase and tensin homologue deleted on chromosome ten (PTEN) as a molecular target in lung epithelial wound repair". British Journal of Pharmacology. 152 (8): 1172–84. doi:10.1038/sj.bjp.0707501. PMC 2189995. PMID 17922022.
- ^ Walker CL, Walker MJ, Liu NK, Risberg EC, Gao X, Chen J, Xu XM (2012). "Systemic bisperoxovanadium activates Akt/mTOR, reduces autophagy, and enhances recovery following cervical spinal cord injury". PLOS ONE. 7 (1): e30012. Bibcode:2012PLoSO...730012W. doi:10.1371/journal.pone.0030012. PMC 3254642. PMID 22253859.
- ^ Adams HH, Hibar DP, Chouraki V, Stein JL, Nyquist PA, Rentería ME, et al. (December 2016). "Novel genetic loci underlying human intracranial volume identified through genome-wide association". Nature Neuroscience. 19 (12): 1569–1582. doi:10.1038/nn.4398. PMC 5227112. PMID 27694991.
- ^ Martin NP, Marron Fernandez de Velasco E, Mizuno F, Scappini EL, Gloss B, Erxleben C, et al. (September 2014). "A rapid cytoplasmic mechanism for PI3 kinase regulation by the nuclear thyroid hormone receptor, TRβ, and genetic evidence for its role in the maturation of mouse hippocampal synapses in vivo". Endocrinology. 155 (9): 3713–24. doi:10.1210/en.2013-2058. PMC 4138568. PMID 24932806.