칼모듈린
Calmodulin| 칼모듈린 | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| 식별자 | |||||||
| 기호. | CaM | ||||||
| PDB | 1OSA | ||||||
| 유니프로트 | P62158 | ||||||
| |||||||

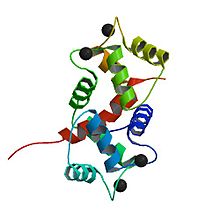
칼모듈린(CaM)은 모든 진핵세포에서 [1]발현되는 다기능 중간 칼슘결합 메신저 단백질이다.2차 메신저2+ Ca의 세포내 표적이며, Ca의 결합은 칼모듈린의 활성화를2+ 위해 필요하다.일단 Ca에 결합되면2+, 칼모듈린은 키나아제 또는 포스파타아제 [2][3][4]같은 다양한 표적 단백질과의 상호작용을 수정함으로써 칼슘 신호 전달 경로의 일부로 작용한다.
구조.
칼모듈린은 148개의 아미노산 길이(16.7kDa)의 작고 보존성이 높은 단백질입니다.단백질은 각 구상 영역에 2개씩 [6]총 4개의 Ca2+ 결합 부위에 대해 유연한 링커 영역에 의해 분리된 EF 손 모티브[5] 쌍이 포함된 대략 대칭 구상 도메인(N- 및 C- 도메인)을 가지고 있다.그 Ca2+-free 상태에서는, 4EF-hands을 형성하는 나선형 콤팩트형 방위에, 중앙 잔디 링커, Ca2+-saturated 상태[5][6][7][8]에서 EF-hand이 나선형, 중앙 잔디 링커 형태 크리스탈 structure,[5]에 연장된 alpha-helix -LSB- 열린 방향 다른 사람과 거의 수직을 채택하다 어수선한 있었고 있다.6해결지만 남아 있솔루션이 흐트러져 있습니다.[9]C 도메인은 N [10][11]도메인보다 Ca에 대한2+ 바인딩 어피니티가 높습니다.
칼모듈린은 구조적으로 4개의 EF-핸드 모티브를 포함하는 또 다른 Ca2+ 결합 단백질인 트로포닌 C와 [5][12]매우 유사하다.단, 트로포닌C는 N말단에 추가 알파나선을 포함하고 있으며, 그 타깃인 트로포닌I에 구성적으로 결합되어 있다.따라서 칼모듈린과 같은 다양한 표적 인식을 보이지 않는다.
칼모듈린의 유연성 중요성
칼모듈린의 엄청난 범위의 표적 단백질을 인식하는 능력은 상당 부분 그것의 구조적 [13]유연성 때문이다.중앙 링커 도메인의 유연성과 더불어 N 도메인과 C 도메인은 Ca-bound2+ [9]스테이트에서 오픈 클로즈드 컨포메이션사이클을 수행합니다.칼모듈린은 또한 큰 구조적 가변성을 나타내며 [14][15][16]표적에 결합할 경우 상당한 구조 변동을 겪는다.또한 칼모듈린과 대부분의 표적 간 결합의 소수성 성질이 광범위한 표적 단백질 [14][17]배열을 인식할 수 있게 한다.이러한 특징들은 함께 칼모듈린이 다양한 CaM 결합 배열 모티브를 나타내는 약 300개의 표적[18] 단백질을 인식할 수 있도록 한다.
메커니즘
EF-hands에 의한 Ca2+ 결합은 N-도메인과 C-도메인의 개구부를 유발하여 소수성 표적 [6]결합 표면을 노출시킨다.이러한 표면은 표적 단백질의 보완적인 비극성 부분과 상호작용하며, 일반적으로 10–16 극성 [18][14]및/또는 염기성 아미노산으로 분리된 부피가 큰 소수성 아미노산 그룹으로 구성된다.칼모듈린의 유연한 중심 도메인은 단백질이 표적 주위를 감싸도록 허용하지만, 대체 결합 모드는 알려져 있습니다.myosin 경쇄 키나아제 및 CaMKII와 같은 칼모듈린의 "Canonical" 표적은 Ca 결합2+ 단백질에만 결합하는 반면, NaV 채널 및 IQ-motif 단백질과 같은 일부 단백질은 [14]Ca가 없을2+ 때 칼모듈린에도 결합한다.칼모듈린의 결합은 "상호 유도 적합"[19]을 통해 표적 단백질의 배열을 유도하여 표적 단백질의 기능 변화를 초래한다.
칼모듈린에 의한 칼슘 결합은 상당한 협동성을 [5][11]나타내며, 칼모듈린은 단량체(단쇄) 협동 결합 단백질의 특이한 예가 된다.또한 타깃 결합은 Ca [20][21][22]이온에 대한2+ 칼모듈린의 결합 친화성을 변화시켜 Ca와 타깃 결합 상호작용 [23]간의 복잡한2+ 알로스테릭 상호작용을 가능하게 한다.표적결합이 Ca 친화성에 미치는2+ 영향은 소전도성 Ca활성칼륨2+([24]SK) 채널과 같이 칼모듈린에 구성적으로 결합되어 있는 단백질의 Ca 활성화를 허용하는 것으로 여겨진다2+.
칼모듈린은 주로 Ca 결합2+ 단백질로 작동하지만 다른 금속 이온도 배위합니다.예를 들어 전형적인 세포내 농도인2+ Mg(0.5~1.0mM)와 휴지 농도인 Ca(100nM)가2+ 존재하는 경우, 칼모듈린의 Ca 결합2+ 부위는 [25]Mg에2+ 의해 적어도 부분적으로 포화되며, 이2+ Mg는 시그널링 현상에 의해 생성된 높은 농도의2+ Ca로 치환된다.마찬가지로 Ca 자체는2+ [26][27]Ca보다 더2+ 강한 칼모듈린의 결합 포켓과 관련된 3가 란타니드 같은 다른 금속 이온에 의해 치환될 수 있다.이러한 이온은 칼모듈린의 구조를[28][29] 왜곡하고 체외 결핍으로 인해 일반적으로 생리적으로 관련이 없지만, 칼모듈린 구조와 [30][31][26]기능을 보고하는 리포터로서 널리 과학적으로 사용되어 왔다.
동물에서의 역할
칼모듈린은 염증, 대사, 아포토시스, 평활근 수축, 세포 내 움직임, 단기 및 장기 기억, 면역 [32][33]반응과 같은 많은 중요한 과정을 매개합니다.칼슘은 초기 자극에 대한 확산성 제2메신저로서 작용함으로써 세포내 신호전달시스템에 관여한다.그것은 많은 효소, 이온 채널, 아쿠아포린과 다른 [4]단백질을 포함한 세포 내의 다양한 표적들을 결합시킴으로써 이것을 한다.칼모듈린은 많은 세포 유형으로 발현되며 세포질, 세포질, 세포소기관 내 또는 혈장 또는 세포소기관막과 관련된 다른 세포하 위치를 가질 수 있지만 항상 세포 내에서 [33]발견됩니다.칼모듈린이 결합하는 단백질의 대부분은 칼슘 자체를 결합할 수 없으며, 칼슘 센서와 신호 전달기로 칼모듈린을 사용한다.칼모듈린은 또한 내소체 및 석소체 내의 칼슘 축적물을 이용할 수 있다.칼모듈린은 인산화, 아세틸화, 메틸화 및 단백질 분해 분해 분해와 같은 번역 후 변형을 겪을 수 있으며, 각각은 그 작용을 변조할 수 있는 잠재력을 가지고 있다.
구체적인 예
평활근 수축의 역할
칼모듈린은 들뜸 수축(EC) 결합과 평활근의 교차교 사이클링 시작에서 중요한 역할을 하며, 궁극적으로 평활근 [34]수축의 원인이 된다.평활근의 수축을 활성화하기 위해서는 미오신 경쇄의 머리가 인산화되어야 한다.이 인산화효소는 미오신 경쇄 키나제에 의해 이루어진다.이 MLC 키나제는 칼슘과 결합할 때 칼모듈린에 의해 활성화되므로 칼모듈린의 결합과 MLC [34]키나제의 활성화를 통해 칼슘의 유무에 따라 평활근 수축이 이루어진다.
칼모듈린이 근육 수축에 영향을 미치는 또 다른 방법은 세포막과 석소체막 양쪽에서 Ca의 움직임을2+ 조절하는 것이다.석소체의 리아노딘 수용체와 같은 Ca 채널은2+ 칼슘에 결합된 칼모듈린에 의해 억제되어 세포 내 칼슘의 전반적인 [35]수준에 영향을 미칠 수 있다.칼슘 펌프는 세포질에서 칼슘을 빼내거나 세포질 망막에 저장하며 이 조절은 많은 하류 과정을 조절하는데 도움을 줍니다.
이것은 칼모듈린의 매우 중요한 기능인데, 왜냐하면 칼모듈린은 소화와 동맥 [36]수축과 같은 평활근 수축에 의해 간접적으로 영향을 받는 모든 생리적 과정에 영향을 받기 때문입니다.
신진대사의 역할
칼모듈린은 포스포릴라아제 인산화효소의 활성화에 중요한 역할을 하며, 이는 궁극적으로 글리코겐 포스포릴라아제에 [37]의해 포도당이 글리코겐으로부터 분리되도록 유도한다.
칼모듈린은 또한 칼시토닌에 영향을 미쳐 지질 대사에 중요한 역할을 한다.칼시토닌은 혈중2+ Ca 수치를 낮추고 cAMP 생성을 유도하는 G단백질 캐스케이드를 활성화하는 폴리펩타이드 호르몬이다.칼시토닌의 작용은 칼시토닌의 [37]활성화에 중요한 역할을 하는 칼모듈린의 작용을 억제함으로써 차단될 수 있다.
단기 및 장기 기억에서의 역할
Ca/calmodulin 의존성 단백질인산화효소 II(CaMKII)는2+ 칼슘/칼모듈린의 존재를 필요로 하는 장기전위화(LTP)로 알려진 시냅스 가소성의 유형에 중요한 역할을 한다.CaMKII는 AMPA 수용체의 인산화 작용을 하여 AMPA [38]수용체의 민감도를 증가시킨다.게다가, 연구는 CaMK를 억제하는 것이II가 [38]LTP를 방해합니다.
식물에서의 역할
효모가 단일 CaM 유전자를 가지고 있는 반면, 식물과 척추동물은 진화적으로 보존된 형태의 CaM 유전자를 가지고 있습니다.Ca2+ 신호에서 식물과 동물의 차이는 식물에 진화적으로 보존된 형태에 [39]더하여 CaM의 확장된 패밀리가 포함되어 있다는 것이다.칼모듈린은 식물의 발달과 환경 자극에 대한 적응에 필수적인 역할을 한다.
칼슘은 세포벽과 세포막 시스템의 구조적 무결성에 중요한 역할을 합니다.단, 높은 칼슘 농도는 식물의 세포 에너지 대사에 독성이 있을 수 있으므로 세포 내 소기관 또는 세포 내강 중 어느 한쪽으로 세포소기관2+ Ca를 제거함으로써 세포 내 Ca2+ 농도를 미량 수준으로 유지한다.유입과2+ 유출의 증가로 생성된 Ca 펄스는 호르몬, 빛, 중력, 비생물적 스트레스 요인 및 [40]병원체와의 상호작용과 같은 외부 자극에 반응하여 세포 신호로 작용합니다.
식물에는 일반적인 CaM 단백질과는 별도로 CaM 관련 단백질(CML)이 포함되어 있습니다.CML은 전형적인 CaMs와 약 15%의 아미노산 유사성을 가지고 있습니다. Arabidopsis thaliana는 약 50개의 다른 CML 유전자를 포함하고 있으며, 이는 이러한 다양한 범위의 단백질이 세포 기능에서 어떤 목적으로 작용하는지 의문을 낳습니다.모든 식물 종은 CML 유전자에 이러한 다양성을 보인다.서로 다른 CaMs와 CML은 생체 내에서 CaM 조절 효소와 결합하고 활성화하기 위한 친화력이 다르다.또한 CaM 또는 CML은 다른 오가넬 컴파트먼트에 배치되어 있습니다.
식물의 성장과 개발
Arabidopsis에서 단백질 DWF1은 성장에 필요한 식물에서 스테로이드 호르몬인 브라시노스테로이드의 생합성에 효소적 역할을 한다.CaM과 DWF1 [clarification needed]사이에 상호작용이 발생하여 CaM을 결합할 수 없는 DWF1은 식물에서 규칙적인 성장 표현형을 생성할 수 없습니다.따라서 CaM은 식물 성장 시 DWF1 기능에 필수적입니다.
CaM 결합 단백질은 또한 식물의 생식 발달을 조절하는 것으로 알려져 있다.예를 들어 담배의 CaM결합단백질인산화효소는 개화의 음성조절제로서 작용한다.단, 이러한 CaM결합단백질인산화효소는 담배의 첨단의 연골에도 존재하며, 연골에 이러한 키나아제 농도가 높으면 식물에서 개화으로의 이행이 지연된다.
S-로커스 수용체 키나제(SRK)는 CaM과 상호작용하는 또 다른 단백질 키나제이다.SRK는 Brassica의 꽃가루-피질 상호작용과 관련된 자가불일치 반응에 관여합니다.
Arabidopsis의 CaM 표적은 꽃가루의 발달과 수정에도 관여한다.Ca2+ 운반체는 꽃가루 튜브의 성장에 필수적이다.따라서 수정 과정에서 꽃가루 튜브의 꼭대기에 일정한2+ Ca 구배를 유지하여 신장시킨다.마찬가지로, CaM은 꽃가루 튜브의 꼭대기에서 필수적이며, 주된 역할은 꽃가루 튜브의 성장을 유도하는 것입니다.
미생물과의 상호작용
결절 형성
Ca는2+ 콩의 결절 형성에 중요한 역할을 한다.질소는 식물에 필요한 필수 요소이며, 질소를 독립적으로 고정할 수 없는 많은 콩과물은 질소를 암모니아로 감소시키는 질소 고정 박테리아와 공생적으로 짝을 이룬다.이 콩-리조비움 상호작용을 확립하려면 Rhizobium 박테리아에 의해 생성되는 Nod 인자가 필요합니다.결절 인자는 콩과에서 결절 형성에 관여하는 뿌리 털 세포에 의해 인식됩니다.다양한2+ 성질의 Ca 반응은 노드 인자 인식에 관여하는 것이 특징이다.뿌리 털 끝에는 처음에는2+ Ca 플럭스가 있고, 그 후 세포질에서 Ca의2+ 반복적인 진동이 일어나며, 또한2+ Ca 스파이크가 핵 주변에서 발생합니다.DMI3는 Ca 스파이킹2+ 시그니처의 다운스트림 노드 인자 시그널링 기능의 필수 유전자이며, Ca 시그니처를 인식하고2+ 있을 가능성이 있습니다.또한 Medicago 및 Lotus의 여러 CaM 및 CML 유전자가 결절 형태로 발현된다.
병원체 방어
식물이 병원균에 대해 활용하는 다양한 방어 전략 중에서 Ca 시그널링은 점점2+ 더 보편화되고 있다.세포질 내 유리 Ca 수치는2+ 병원성 감염에 반응하여 증가한다.이러한2+ 성질의 Ca 시그니처는 보통 방어와 관련된 유전자와 과민성 세포 사멸을 유도함으로써 식물 방어 체계를 활성화시킨다.CaMs, CMLs 및 CaM 결합 단백질은 식물 방어 신호 경로에서 최근에 확인된 요소 중 일부입니다.담배, 콩, 토마토의 여러 CML 유전자는 병원균에 반응한다.CML43은 유전자 발현 분석용 아라비도시스 병내성 잎의 APR134 유전자에서 분리된 CaM 관련 단백질로 잎에 Pseudomonas syringae를 접종하면 신속하게 유도된다.이 유전자들은 토마토에서도 발견됩니다.APR134의 CML43은 또한 체외에서 Ca 이온에2+ 결합하며, 이는 박테리아 [41]병원체에 대한 식물 면역 반응 동안 CML43과 APR134가 Ca 의존적2+ 시그널링에 관여함을 보여준다.아라비도시스 탈리아나의 CML9 발현은 식물성 병원균, 편모균 및 살리실산에 [42]의해 빠르게 유도된다.트랜스제닉 담배 및 Arabidopsis에서 콩 SCaM4 및 SCaM5의 발현은 병원체 내성과 관련된 유전자의 활성화를 유발하고 또한 광범위한 병원체 감염에 대한 내성을 증가시킨다.보존성이 높은 CaM Isoforms인 콩 SCM1 및 SCaM2의 경우는 동일하지 않다.AtBAG6 단백질은 CaM이 없을 때만 CaM에2+ 결합하는 CaM 결합 단백질이며 CaM이 없을 때만 결합한다.AtBAG6는 병원체 감염의 확산을 방지하거나 병원체 성장을 제한하기 위해 프로그램된 세포사의 과민 반응을 담당합니다.CaM 결합 단백질의 돌연변이는 병원체 감염에 대한 식물의 방어 반응에 심각한 영향을 미칠 수 있다.고리형 뉴클레오티드 게이트 채널(CNGCs)은 Ca와 같은2+ CaM 결합 부위가 겹치는 2가의 양이온을 가진 혈장막 내의 기능성 단백질 채널이다.단, 발전소 방어를 위한 이 경로에서 CNGC의 정확한 역할은 여전히 불분명하다.
식물의 비생물적 스트레스 반응
세포2+ 내 Ca 수치의 변화는 기계적 자극, 삼투압 및 염분 처리, 냉·열 충격에 대한 다양한 반응을 나타내는 신호로 사용된다.근세포의 종류에 따라 삼투압과 염분 스트레스에 대한2+ Ca 반응이 다르며, 이는 Ca 패턴의2+ 세포 특이성을 암시한다.외부 응력에 반응하여 CaM은 L-글루탐산염의 GABA로의 전환을 촉매하는 글루탐산탈카르복실화효소(GAD)를 활성화한다.GABA 합성에 대한 엄격한 통제는 식물 발달에 중요하기 때문에 GABA 수치가 증가하면 식물 발달에 근본적으로 영향을 미칠 수 있다.따라서 외부 스트레스는 식물의 성장과 발달에 영향을 미칠 수 있으며 CaM은 이 효과를 [citation needed]제어하는 경로에 관여한다.
플랜트 예시
수수
수수는 잘 확립된 모델 생물로 덥고 건조한 환경에 적응할 수 있다.이 때문에,[43] 식물에 있어서의 칼모듈린의 역할을 연구하기 위한 모델로 사용되고 있다.수수에는 글리신이 풍부한 RNA결합단백질 SbGRBP를 발현하는 묘목이 포함되어 있다.이 특정 단백질은 열을 스트레스 요인으로 사용하여 조절될 수 있습니다.세포핵과 세포질에서 그것의 독특한 위치는 [44]Ca의 사용을2+ 필요로 하는 칼모듈린과의 상호작용을 보여준다.식물을 다용도 스트레스 조건에 노출시킴으로써, 그것은 식물 세포가 환경 변화를 견딜 수 있게 하는 다른 단백질을 억제하게 할 수 있다.이러한 변형된 스트레스 단백질은 CaM과 상호작용하는 것으로 나타났다.수수에서 발현되는 CaMBP 유전자는 더위와 가뭄 스트레스에 대한 내성을 연구하기 위한 "모델 작물"로 묘사된다.
아라비도시스속
Arabidopsis Thaliana 연구에서,[43] 수백 개의 다른 단백질들이 식물에서 CaM과 결합할 수 있는 가능성을 보여주었다.
가족 구성원
- 칼모듈린 1(CALM1)
- 칼모듈린2(CALM2)
- 칼모듈린3(CALM3)
- 칼모듈린1 의사유전자1(CALM1P1)
- 칼모듈린라이크3(CALM3)
- 칼모듈린 라이크 4(CALM4)
- 칼모듈린 라이크 5(CALM5)
- 칼모듈린 라이크 6(CALM6)
기타 칼슘결합단백질
칼모듈린은 EF 손 단백질이라고 불리는 칼슘 결합 단백질의 두 가지 주요 그룹 중 하나에 속합니다.아넥신이라고 불리는 다른 그룹은 칼슘과 리포코르틴과 같은 인지질을 결합시킨다.많은 다른 단백질들은 칼슘과 결합하지만, 칼슘과 결합하는 것은 세포에서 그들의 주요 기능으로 간주되지 않을 수 있습니다.
「 」를 참조해 주세요.
- Calmodulin의 Proteopedia 페이지 및 그 구성 변경
- 단백질인산화효소
- Ca/칼모듈린 의존성 단백질인산화효소2+
레퍼런스
- ^ Stevens FC (August 1983). "Calmodulin: an introduction". Canadian Journal of Biochemistry and Cell Biology. 61 (8): 906–10. doi:10.1139/o83-115. PMID 6313166.
- ^ Chin D, Means AR (August 2000). "Calmodulin: a prototypical calcium sensor". Trends in Cell Biology. 10 (8): 322–8. doi:10.1016/S0962-8924(00)01800-6. PMID 10884684.
- ^ Purves D, Augustine G, Fitzpatrick D, Hall W, LaMantia AS, White L (2012). Neuroscience. Massachusetts: Sinauer Associates. pp. 95, 147, 148. ISBN 9780878936953.
- ^ a b "CALM1 – Calmodulin – Homo sapiens (Human) – CALM1 gene & protein". www.uniprot.org. Retrieved 2016-02-23.
- ^ a b c d e Gifford JL, Walsh MP, Vogel HJ (July 2007). "Structures and metal-ion-binding properties of the Ca2+-binding helix-loop-helix EF-hand motifs". The Biochemical Journal. 405 (2): 199–221. doi:10.1042/BJ20070255. PMID 17590154.
- ^ a b c d Chin D, Means AR (August 2000). "Calmodulin: a prototypical calcium sensor". Trends in Cell Biology. 10 (8): 322–8. doi:10.1016/s0962-8924(00)01800-6. PMID 10884684.
- ^ Kuboniwa H, Tjandra N, Grzesiek S, Ren H, Klee CB, Bax A (September 1995). "Solution structure of calcium-free calmodulin". Nature Structural Biology. 2 (9): 768–76. doi:10.1038/nsb0995-768. PMID 7552748. S2CID 22220229.
- ^ Zhang M, Tanaka T, Ikura M (September 1995). "Calcium-induced conformational transition revealed by the solution structure of apo calmodulin". Nature Structural Biology. 2 (9): 758–67. doi:10.1038/nsb0995-758. PMID 7552747. S2CID 35098883.
- ^ a b Chou JJ, Li S, Klee CB, Bax A (November 2001). "Solution structure of Ca(2+)-calmodulin reveals flexible hand-like properties of its domains". Nature Structural Biology. 8 (11): 990–7. doi:10.1038/nsb1101-990. PMID 11685248. S2CID 4665648.
- ^ Yang JJ, Gawthrop A, Ye Y (August 2003). "Obtaining site-specific calcium-binding affinities of calmodulin". Protein and Peptide Letters. 10 (4): 331–45. doi:10.2174/0929866033478852. PMID 14529487.
- ^ a b Linse S, Helmersson A, Forsén S (May 1991). "Calcium binding to calmodulin and its globular domains". The Journal of Biological Chemistry. 266 (13): 8050–4. doi:10.1016/S0021-9258(18)92938-8. PMID 1902469.
- ^ Houdusse A, Love ML, Dominguez R, Grabarek Z, Cohen C (December 1997). "Structures of four Ca2+-bound troponin C at 2.0 A resolution: further insights into the Ca2+-switch in the calmodulin superfamily". Structure. 5 (12): 1695–711. doi:10.1016/s0969-2126(97)00315-8. PMID 9438870.
- ^ Yamniuk AP, Vogel HJ (May 2004). "Calmodulin's flexibility allows for promiscuity in its interactions with target proteins and peptides". Molecular Biotechnology. 27 (1): 33–57. doi:10.1385/MB:27:1:33. PMID 15122046. S2CID 26585744.
- ^ a b c d Tidow H, Nissen P (November 2013). "Structural diversity of calmodulin binding to its target sites". The FEBS Journal. 280 (21): 5551–65. doi:10.1111/febs.12296. PMID 23601118.
- ^ Frederick KK, Marlow MS, Valentine KG, Wand AJ (July 2007). "Conformational entropy in molecular recognition by proteins". Nature. 448 (7151): 325–9. Bibcode:2007Natur.448..325F. doi:10.1038/nature05959. PMC 4156320. PMID 17637663.
- ^ Gsponer J, Christodoulou J, Cavalli A, Bui JM, Richter B, Dobson CM, Vendruscolo M (May 2008). "A coupled equilibrium shift mechanism in calmodulin-mediated signal transduction". Structure. 16 (5): 736–46. doi:10.1016/j.str.2008.02.017. PMC 2428103. PMID 18462678.
- ^ Ishida H, Vogel HJ (2006). "Protein-peptide interaction studies demonstrate the versatility of calmodulin target protein binding". Protein and Peptide Letters. 13 (5): 455–65. doi:10.2174/092986606776819600. PMID 16800798.
- ^ a b "Calmodulin Target Database". Retrieved 27 July 2020.
- ^ Wang Q, Zhang P, Hoffman L, Tripathi S, Homouz D, Liu Y, et al. (December 2013). "Protein recognition and selection through conformational and mutually induced fit". Proceedings of the National Academy of Sciences of the United States of America. 110 (51): 20545–50. Bibcode:2013PNAS..11020545W. doi:10.1073/pnas.1312788110. PMC 3870683. PMID 24297894.
- ^ Johnson JD, Snyder C, Walsh M, Flynn M (January 1996). "Effects of myosin light chain kinase and peptides on Ca2+ exchange with the N- and C-terminal Ca2+ binding sites of calmodulin". The Journal of Biological Chemistry. 271 (2): 761–7. doi:10.1074/jbc.271.2.761. PMID 8557684. S2CID 9746955.
- ^ Bayley PM, Findlay WA, Martin SR (July 1996). "Target recognition by calmodulin: dissecting the kinetics and affinity of interaction using short peptide sequences". Protein Science. 5 (7): 1215–28. doi:10.1002/pro.5560050701. PMC 2143466. PMID 8819155.
- ^ Theoharis NT, Sorensen BR, Theisen-Toupal J, Shea MA (January 2008). "The neuronal voltage-dependent sodium channel type II IQ motif lowers the calcium affinity of the C-domain of calmodulin". Biochemistry. 47 (1): 112–23. doi:10.1021/bi7013129. PMID 18067319.
- ^ Stefan MI, Edelstein SJ, Le Novère N (August 2008). "An allosteric model of calmodulin explains differential activation of PP2B and CaMKII". Proceedings of the National Academy of Sciences of the United States of America. 105 (31): 10768–73. Bibcode:2008PNAS..10510768S. doi:10.1073/pnas.0804672105. PMC 2504824. PMID 18669651.
- ^ Zhang M, Abrams C, Wang L, Gizzi A, He L, Lin R, et al. (May 2012). "Structural basis for calmodulin as a dynamic calcium sensor". Structure. 20 (5): 911–23. doi:10.1016/j.str.2012.03.019. PMC 3372094. PMID 22579256.
- ^ Grabarek Z (May 2011). "Insights into modulation of calcium signaling by magnesium in calmodulin, troponin C and related EF-hand proteins". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1813 (5): 913–21. doi:10.1016/j.bbamcr.2011.01.017. PMC 3078997. PMID 21262274.
- ^ a b Brittain HG, Richardson FS, Martin RB (December 1976). "Terbium (III) emission as a probe of calcium(II) binding sites in proteins". Journal of the American Chemical Society. 98 (25): 8255–60. doi:10.1021/ja00441a060. PMID 993525.
- ^ Kilhoffer MC, Demaille JG, Gerard D (July 1980). "Terbium as luminescent probe of calmodulin calcium-binding sites; domains I and II contain the high-affinity sites". FEBS Letters. 116 (2): 269–72. doi:10.1016/0014-5793(80)80660-0. PMID 7409149.
- ^ Edington SC, Gonzalez A, Middendorf TR, Halling DB, Aldrich RW, Baiz CR (April 2018). "Coordination to lanthanide ions distorts binding site conformation in calmodulin". Proceedings of the National Academy of Sciences of the United States of America. 115 (14): E3126–E3134. Bibcode:2018PNAS..115E3126E. doi:10.1073/pnas.1722042115. PMC 5889669. PMID 29545272.
- ^ Chao SH, Suzuki Y, Zysk JR, Cheung WY (July 1984). "Activation of calmodulin by various metal cations as a function of ionic radius". Molecular Pharmacology. 26 (1): 75–82. PMID 6087119.
- ^ Horrocks Jr WD, Sudnick DR (1981-12-01). "Lanthanide ion luminescence probes of the structure of biological macromolecules". Accounts of Chemical Research. 14 (12): 384–392. doi:10.1021/ar00072a004. ISSN 0001-4842.
- ^ Mulqueen P, Tingey JM, Horrocks WD (November 1985). "Characterization of lanthanide (III) ion binding to calmodulin using luminescence spectroscopy". Biochemistry. 24 (23): 6639–45. doi:10.1021/bi00344a051. PMID 4084548.
- ^ "Home Page for Calmodulin". structbio.vanderbilt.edu. Retrieved 2016-02-23.
- ^ a b McDowall J. "Calmodulin". InterPro Protein Archive. Retrieved 23 February 2016.
- ^ a b Tansey MG, Luby-Phelps K, Kamm KE, Stull JT (April 1994). "Ca(2+)-dependent phosphorylation of myosin light chain kinase decreases the Ca2+ sensitivity of light chain phosphorylation within smooth muscle cells". The Journal of Biological Chemistry. 269 (13): 9912–20. doi:10.1016/S0021-9258(17)36969-7. PMID 8144585.
- ^ Walsh MP (June 1994). "Calmodulin and the regulation of smooth muscle contraction". Molecular and Cellular Biochemistry. 135 (1): 21–41. doi:10.1007/bf00925958. PMID 7816054. S2CID 2304136.
- ^ Martinsen A, Dessy C, Morel N (2014-10-31). "Regulation of calcium channels in smooth muscle: new insights into the role of myosin light chain kinase". Channels. 8 (5): 402–13. doi:10.4161/19336950.2014.950537. PMC 4594426. PMID 25483583.
- ^ a b Nishizawa Y, Okui Y, Inaba M, Okuno S, Yukioka K, Miki T, et al. (October 1988). "Calcium/calmodulin-mediated action of calcitonin on lipid metabolism in rats". The Journal of Clinical Investigation. 82 (4): 1165–72. doi:10.1172/jci113713. PMC 442666. PMID 2844851.
- ^ a b Lledo PM, Hjelmstad GO, Mukherji S, Soderling TR, Malenka RC, Nicoll RA (November 1995). "Calcium/calmodulin-dependent kinase II and long-term potentiation enhance synaptic transmission by the same mechanism". Proceedings of the National Academy of Sciences of the United States of America. 92 (24): 11175–9. Bibcode:1995PNAS...9211175L. doi:10.1073/pnas.92.24.11175. PMC 40594. PMID 7479960.
- ^ Ranty B, Aldon D, Galaud JP (May 2006). "Plant calmodulins and calmodulin-related proteins: multifaceted relays to decode calcium signals". Plant Signaling & Behavior. 1 (3): 96–104. doi:10.4161/psb.1.3.2998. PMC 2635005. PMID 19521489.
- ^ Virdi, Amardeep S.; Singh, Supreet; Singh, Prabhjeet (2015). "Abiotic stress responses in plants: roles of calmodulin-regulated proteins". Frontiers in Plant Science. 6: 809. doi:10.3389/fpls.2015.00809. ISSN 1664-462X. PMC 4604306. PMID 26528296.
- ^ Chiasson D, Ekengren SK, Martin GB, Dobney SL, Snedden WA (August 2005). "Calmodulin-like proteins from Arabidopsis and tomato are involved in host defense against Pseudomonas syringae pv. tomato". Plant Molecular Biology. 58 (6): 887–897. doi:10.1007/s11103-005-8395-x. PMID 16240180. S2CID 1572549.
- ^ Leba LJ, Cheval C, Ortiz-Martín I, Ranty B, Beuzón CR, Galaud JP, Aldon D (September 2012). "CML9, an Arabidopsis calmodulin-like protein, contributes to plant innate immunity through a flagellin-dependent signalling pathway". The Plant Journal. 71 (6): 976–89. doi:10.1111/j.1365-313x.2012.05045.x. PMID 22563930.
- ^ a b Sanchez AC, Subudhi PK, Rosenow DT, Nguyen HT (2002). "Mapping QTLs associated with drought resistance in sorghum (Sorghum bicolor L. Moench)". Plant Molecular Biology. 48 (5–6): 713–26. doi:10.1023/a:1014894130270. PMID 11999845. S2CID 25834614.
- ^ Singh S, Virdi AS, Jaswal R, Chawla M, Kapoor S, Mohapatra SB, et al. (June 2017). "A temperature-responsive gene in sorghum encodes a glycine-rich protein that interacts with calmodulin". Biochimie. 137 (Supplement C): 115–123. doi:10.1016/j.biochi.2017.03.010. PMID 28322928.
외부 링크
- "Myelin-associated Glycoprotein". Molecule of the Month. RCSB PDB. July 2020. Archived from the original on 2010-05-29. Retrieved 2021-06-19.
- Nelson M, Chazin W. "Home Page for Calmodulin". EF-Hand Calcium-Binding Proteins Data Library. Vanderbilt University. Retrieved 2008-03-22.
- Ikura M (2000). "Calmodulin Target Database". Journal of Structural and Functional Genomics. Ontario Cancer Institute, University of Toronto. 1 (1): 8–14. doi:10.1023/a:1011320027914. PMID 12836676. S2CID 23097597. Retrieved 2008-03-22.
- 미국 국립의학도서관의 칼모듈린 의학 제목(MeSH)
- InterPro: IPR015754