신경전달물질
Neurotransmitter| 일반적인 화학 시냅스의 구조 |
|---|
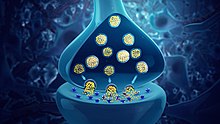
신경전달물질은 시냅스를 가로지르는 다른 세포에 영향을 주기 위해 뉴런에 의해 분비되는 신호 분자다.신호를 받는 세포, 즉 어떤 주체 부위나 표적 세포는 또 다른 뉴런일 수도 있지만, 선이나 근육 세포일 수도 있다.[1]
신경전달물질은 시냅스 vesicle에서 시냅스 구획으로 방출되어 대상 세포의 신경전달물질 수용체와 상호작용할 수 있다.대상 세포에 대한 신경전달물질의 영향은 그것이 결합하는 수용체에 의해 결정된다.많은 신경전달물질은 아미노산과 같은 단순하고 풍부한 전구체로부터 합성되는데, 이는 쉽게 구할 수 있고 변환을 위해 적은 수의 생합성 단계를 필요로 하는 경우가 많다.
신경전달물질은 복잡한 신경계통의 기능에 필수적이다.인간의 고유한 신경전달물질의 정확한 수는 알려지지 않았지만 100개 이상의 것이 확인되었다.[2]일반적인 신경전달물질로는 글루탐산염, GABA, 아세틸콜린, 글리신, 노레피네프린 등이 있다.
메커니즘 및 사이클
합성
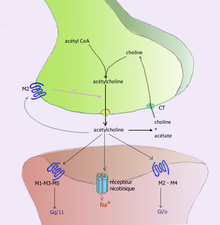
신경전달물질은 일반적으로 뉴런에서 합성되며 세포에서 풍부하게 발견되는 전구분자로 구성되거나, 또는 세포에서 파생된다.신경전달물질의 종류로는 아미노산, 모노아민, 펩타이드 등이 있다.모노아민은 단일 아미노산을 변경하여 합성된다.예를 들어 세로토닌의 전구체는 아미노산 트립토판이다.펩타이드 송신기 또는 신경펩타이드(Neuropeptide)는 종종 다른 송신기와 함께 방출되어 조절 효과를 갖는 단백질 전송기다.[3]ATP와 같은 퓨린 신경전달물질은 핵산에서 파생된다.다른 신경전달물질은 질소산화물과 일산화탄소와 같은 대사 제품으로 구성되어 있다.
| 예 | |
|---|---|
| 아미노산 | 글루타민산 글리신 |
| 모노아민 | 세로토닌, 에피네프린, 도파민 |
| 펩타이드 | 물질 P, 오피오이드 |
| 청록색 | ATP, GTP |
| 기타 | 산화질소, 일산화탄소 |
저장
신경전달물질은 일반적으로 시냅스(synaptic vesicle)에 저장되며, 시냅스(presynaptic) 뉴런의 액손 단자에 있는 세포막에 가깝게 군집되어 있다.그러나, 대사 가스인 일산화탄소나 일산화질소와 같은 일부 신경전달물질은 합성되어 염소에 저장되지 않은 채 작용 전위에 따라 즉시 방출된다.[4]
해제
일반적으로 신경전달물질은 사전시냅스 단자에서 사전시냅스 뉴런의 작용전위라고 불리는 전기 신호에 반응하여 방출된다.그러나 낮은 수준의 '베이스라인' 해제도 전기 자극 없이 발생한다.신경전달물질은 시냅스 구획으로 방출되어 확산되며, 시냅스 후 뉴런의 막에 있는 특정 수용체와 결합한다.[5]
수용체 상호작용
시냅스 구획으로 방출된 후, 신경전달물질은 목표 세포의 수용체와 상호작용할 수 있는 시냅스 전체에 확산된다.신경전달물질의 효과는 시냅스에 존재하는 표적세포 수용체의 정체에 따라 달라진다.수용체에 따라 신경전달물질의 결합은 시냅스 후 뉴런의 흥분, 억제 또는 변조를 유발할 수 있다.자세한 내용은 아래를 참조하십시오.
제거
사후 시냅스나 표적세포에서 수용체가 지속적으로 활성화되지 않도록 하려면 시냅스 구획에서 신경전달물질을 제거해야 한다.[6]신경전달물질은 다음 세 가지 메커니즘 중 하나를 통해 제거된다.
- 확산 – 신경전달물질은 시냅스 구획에서 표류하며, 거기서 그들은 글라이알 세포에 흡수된다.보통 아스트로사이테스인 이 글라이알 세포들은 과잉 신경전달물질을 흡수한다.글리알 세포에서 신경전달물질은 효소에 의해 분해되거나 다시 로 펌프된다.
- 효소 분해 – 효소라고 불리는 단백질은 신경전달물질을 분해한다.
- 재흡수 – 신경전달물질이 시냅스 전 뉴런에 재흡수된다.전달체, 즉 막이 단백질을 운반하는 것은 시냅스 구획에서 신경전달물질을 액손 단자(사전 시냅스 뉴런)로 다시 펌프하여 재사용을 위해 보관한다.
예를 들어 아세틸콜린은 아세틸콜린에 의해 그 아세틸 그룹을 아세틸콜린에 의해 분해되어 제거된다. 그리고 나서 나머지 콜린은 더 많은 아세틸콜린을 합성하기 위해 사전 시냅스 뉴런에 의해 흡수되어 재활용된다.[7]다른 신경전달물질은 목표한 시냅스 접합으로부터 멀리 분산될 수 있고 신장을 통해 몸에서 제거되거나 간에서 파괴된다.각 신경전달물질은 신체의 규제체계나 약물의 표적이 될 수 있는 규제지점의 매우 구체적인 분해경로를 가지고 있다.코카인은 도파민 재흡수의 원인이 되는 도파민 운반체를 차단한다.전달체가 없으면 도파민은 시냅스 구획으로부터 훨씬 더 천천히 확산되어 대상 세포의 도파민 수용체를 계속 활성화시킨다.[8]
디스커버리
20세기 초까지 과학자들은 뇌의 시냅스 통신의 대다수가 전기적인 것이라고 추측했다.그러나 라몬 이 카잘의 역사학적 검사를 통해 오늘날 시냅스 구획으로 알려진 뉴런 사이의 20~40nm의 간격이 발견되었다.그러한 간극의 존재는 화학적 메신저를 통해 시냅스 구분을 가로지르는 통신을 암시했고, 1921년 독일의 약리학자 오토 뢰위(Otto Loewi)는 뉴런이 화학물질을 방출함으로써 의사소통을 할 수 있다는 것을 확인했다.뢰위는 개구리의 부랑신경이 관련된 일련의 실험을 통해 부랑신경에 존재하는 식염수의 양을 조절함으로써 수동으로 개구리의 심박수를 늦출 수 있었다.이 실험을 완료한 후, Loewi는 심장 기능에 대한 동정적 조절은 화학적 농도의 변화를 통해 매개될 수 있다고 주장했다.게다가, 오토 뢰위 씨는 최초로 알려진 신경전달물질인 아세틸콜린(ACH)을 발견한 공로를 인정받고 있다.[9]
식별
신경전달물질을 식별하기 위한 네 가지 주요 기준은 다음과 같다.
- 그 화학 물질은 뉴런에서 합성되어야 하며 그렇지 않으면 뉴런 안에 존재해야 한다.
- 뉴런이 활성화되면 화학물질을 방출하고 일부 표적에서 반응을 생성해야 한다.
- 화학물질을 실험 대상에 올려놓을 때도 같은 반응을 얻어야 한다.
- 작업이 완료된 후 활성화 현장에서 화학물질을 제거하는 메커니즘이 존재해야 한다.
그러나 약리학, 유전학, 화학신경절제술의 진보에 따라 "신경전달물질"이라는 용어는 다음과 같은 화학물질에 적용될 수 있다.
- 시냅스 후 막에 대한 영향을 통해 뉴런 사이에 메시지를 전달한다.
- 멤브레인 전압에는 거의 또는 전혀 영향을 미치지 않지만 시냅스의 구조 변경과 같은 공통 운반 기능을 가진다.
- 송신기의 해제 또는 재흡수에 영향을 미치는 역방향 메시지를 전송하여 통신한다.
신경전달물질의 해부학적 국소화는 일반적으로 송신기 물질 자체의 위치나 그 합성에 관여하는 효소의 위치를 식별하는 면역세포화학적 기법을 사용하여 결정된다.면역세포화학적 기술은 또한 많은 송신기, 특히 신경펩타이드들이 공동 국부화되어 있다는 것을 밝혀냈다. 즉, 뉴런이 시냅스 단자에서 하나 이상의 송신기를 방출할 수도 있다.[10]중앙 신경계 전반에 걸쳐 신경전달물질을 식별하기 위해 얼룩, 자극, 수집 등 다양한 기법과 실험을 사용할 수 있다.[11]
행동들
뉴런은 신경 자극 - 행동 잠재력 - 이동하기 위한 정교한 네트워크를 형성한다.각 뉴런은 이웃 뉴런과 무려 15,000개의 연결을 가지고 있다.
뉴런은 서로 접촉하지 않는다(갭 접점을 통한 전기 시냅스의 경우는 제외한다). 대신 뉴런은 시냅스라고 불리는 접촉 지점 즉, 두 개의 신경 세포 내의 접합 부분에서 상호작용을 하며, 이 지점에서는 임펄스가 신경 전달체에 의해 운반되는 작은 틈새로 구성되어 있다.뉴런은 행동전위라고 불리는 신경충동을 통해 정보를 전달한다.시냅스의 사전 시냅스 단자 버튼에 작용 전위가 도착하면 신경전달물질의 방출을 자극할 수 있다.이러한 신경전달물질은 시냅스 구획으로 방출되어 시냅스 후막의 수용체에 결합하고 또 다른 세포에 영향을 미치며 억제 또는 흥분으로 작용한다.다음 뉴런은 더 많은 뉴런과 연결될 수 있으며, 만약 흥분제 영향의 총량이 억제 효과를 뺀다면, 그것 또한 "불"이 될 것이다.즉, 그것은 신경전달물질을 방출하고 또 다른 이웃 뉴런에게 정보를 전달하면서 액손 힐록에서 새로운 행동 잠재력을 창출할 것이다.
변조
신경전달물질은 대상 세포에 흥분, 억제 또는 조절 효과를 가질 수 있다.그 효과는 신경전달물질이 시냅스 후 막에서 상호작용하는 수용체에 의해 결정된다.신경전달물질은 트랜스메인 이온 흐름에 영향을 주어 접촉하는 셀이 작용 전위를 발생시킬 확률을 증가시키거나 감소시킨다.흥분 효과가 있는 수용체를 포함하는 시냅스를 제1형 시냅스라고 하며, 제2형 시냅스는 억제 효과가 있는 수용체를 포함한다.[12]따라서, 시냅스의 다양성에도 불구하고, 그들은 모두 이 두 종류의 메시지만 전달한다.두 종류는 다른 외관이고 주로 그 영향 아래 뉴런의 다른 부분에 위치한다.[13]조절 효과가 있는 수용체들은 세포의 기능을 조절하는 데 도움을 주는 동작 신호 캐스케이드 안에서 모든 시냅스 막과 신경전달물질의 결합으로 확산된다.[14]조절 효과가 있는 수용체에 신경전달물질을 결합하는 것은 많은 결과를 가져올 수 있다.예를 들어 그것은 시냅스 막에 수용체를 더 많거나 적게 모집함으로써 미래 자극에 대한 민감도를 증가시키거나 감소시킬 수 있다.
제1형(흥분) 시냅스는 일반적으로 덴드라이트의 축이나 가시에 위치하는 반면, 제2형 시냅스는 일반적으로 세포 본체에 위치한다.또한 제1종 시냅스는 원형 시냅스 vesicle을 가지고 있는 반면, 제2종 시냅스의 vesicle은 납작해진다.사전 시냅스 및 사후 시냅스 막의 소재는 타입 II보다 타입 I 시냅스 내 밀도가 높고 타입 I 시냅스 구분이 넓다.마지막으로, 타입 I 시냅스의 활성 구역은 타입 II 시냅스의 활성 구역보다 크다.
I형과 II형 시냅스의 서로 다른 위치는 뉴런을 흥분성 덴드리트리와 억제성 세포체의 두 영역으로 나눈다.억제적인 관점에서 흥분은 덴드라이트 위로 들어와 액손 힐록으로 퍼져 행동 잠재력을 촉발한다.메시지를 중지하려면 동작 전위가 발생하는 축음기 힐록 근처에 있는 세포 본체에 억제를 가하여 중지하는 것이 가장 좋다.흥분-억제적 상호작용을 개념화하는 또 다른 방법은 억제를 극복하는 그림 흥분이다.세포 본체가 정상적으로 억제 상태에 있는 경우, 축음기 힐록에서 작용 전위를 발생시키는 유일한 방법은 세포 본체의 억제력을 줄이는 것이다.이 "문열기" 전략에서 흥분 메시지는 트랙을 달릴 준비가 된 경주마와 같지만, 우선 억제 출발 관문을 제거해야 한다.[15]
신경전달물질 작용
위에서 설명한 것처럼 신경전달물질의 유일한 직접 작용은 수용체를 활성화하는 것이다.따라서 신경전달물질 시스템의 효과는 송신기를 사용하는 뉴런의 연결부와 수용체의 화학적 특성에 따라 달라진다.
- 글루탐산염은 뇌와 척수에 있는 대부분의 빠른 흥분성 시냅스에서 사용된다.그것은 또한 "수정 가능한" 대부분의 시냅스에서 사용된다. 즉, 강도를 증가시키거나 감소시킬 수 있다.수정 가능한 시냅스는 뇌의 주요 기억 저장 요소로 여겨진다.과다한 글루탐산염 방출은 뇌를 과도하게 자극하고 흥분독성으로 이어져 세포가 사망하게 하여 발작이나 뇌졸중을 일으킬 수 있다.[16]흥분독성은 허혈성 뇌졸중, 간질, 근위축성 측경화증, 알츠하이머병, 헌팅턴병, 파킨슨병 등 특정 만성질환에 연루돼 왔다.[17]
- GABA는 뇌의 거의 모든 부분에서 대부분의 빠른 억제 시냅스에서 사용된다.많은 진정제/트랜퀼팅 약물은 GABA의 효과를 높여 작용한다.[18]이에 상응하여 글리신은 척수에 있는 억제전달물질이다.
- 아세틸콜린은 말초신경계와 중추신경계에서 발견된 최초의 신경전달물질이다.그것은 체신경계의 골격근육을 활성화시키고 자율체계의 내부장기를 흥분시키거나 억제할 수 있다.[11]운동신경과 근육을 연결하는 신경근 접합부의 송신기로 구별된다.마비성 화살 독은 이러한 시냅스에서의 전송을 차단함으로써 작용한다.아세틸콜린은 또한 뇌의 많은 영역에서 활동하지만 니코틴 수용체와 무스카린 수용체를 포함한 다른 종류의 수용체를 사용한다.[19]
- 도파민은 뇌에서 많은 중요한 기능들을 가지고 있다; 이것은 운동 행동의 조절, 동기 부여와 관련된 즐거움, 그리고 감정적인 흥분도 포함한다.그것은 보상체계에 중요한 역할을 한다; 파킨슨병은 낮은 도파민 수치와 연관되어 있고 조현병은 높은 도파민 수치와 연관되어 있다.[20]
- 세로토닌은 모노아민 신경전달물질이다.대부분은 장에 의해 생성되고 발견되며(약 90%), 나머지는 중추신경계 뉴런에서 발생한다.식욕, 수면, 기억과 학습, 온도, 기분, 행동, 근육수축, 심혈관계 및 내분비계통의 기능을 조절하는 기능을 한다.일부 우울증 환자들은 뇌척수액과 뇌조직에서 세로토닌 대사물 농도가 낮은 것으로 보여 우울증에도 작용한 것으로 추정된다.[21]
종류들
신경전달물질을 분류하는 방법은 다양하다.그것들을 아미노산, 펩타이드, 모노아민으로 나누는 것은 어떤 분류 목적을 위해 충분하다.[22]
주요 신경전달물질:
- 아미노산: 글루탐산염,[23] 아스파테이트, D-세린, 감마-아미노부티르산(GABA),[nb 1] 글리신
- 가소트랜스미터: 질소산화물(NO), 일산화탄소(CO), 황화수소(HS2)
- 모노아민:도파민(DA), 노레피네프린(NE, NA), 에피네프린(아드레날린), 히스타민, 세로토닌(SER, 5-HT)
- 트레이스 아민: 페네틸아민, N-메틸페네틸아민, 티라민, 3-오도티로나민, 문어민, 트립타민 등
- 펩타이드: 옥시토신, 소마토스타틴, 물질 P, 코카인 및 암페타민 규제 대본, 오피오이드 펩타이드[24]
- 청진: 아데노신 삼인산(ATP), 아데노신
- 기타: 아세틸콜린(ACH), 아난다미드 등
또 100여종의 신경활성 펩타이드도 발견됐으며, 정기적으로 새로운 펩타이드도 발견된다.[25][26]이것들 중 많은 것들이 작은 분자 송신기와 함께 공동 발표된다.그럼에도 불구하고 어떤 경우에는 펩타이드가 시냅스에서의 1차 송신기가 된다.베타엔돌핀은 중추신경계의 오피오이드 수용체와 고도로 구체적인 상호작용을 하기 때문에 펩타이드 신경전달물질의 비교적 잘 알려진 예다.
단일 이온(시냅트로 방출되는 아연 등)도 일부에 의해 신경전달물질로 간주되며,[27] 질산화물(NO), 일산화탄소(CO), 황화수소(HS2)와 같은 일부 기체 분자도 이에 해당된다.[28]이 기체는 신경 세포질에서 생성되며 즉시 세포막을 통해 세포외 액체로 확산되어 인근 세포로 확산되어 두 번째 전령기의 생산을 자극한다.용해성 가스 신경전달물질은 빠른 속도로 작용하고 즉시 분해되어 단 몇 초 동안만 존재하기 때문에 연구하기가 어렵다.
가장 보편적인 송신기는 글루탐산염인데, 이것은 인간의 뇌에 있는 시냅스의 90% 이상에서 흥분된다.[23]다음으로 가장 널리 보급된 것은 글루타민산(glutamate)을 사용하지 않는 시냅스의 90% 이상에서 억제되는 감마-아미노부티산(gamma-aminobutyric acid, GABA)이다.비록 다른 송신기가 더 적은 시냅스에서 사용되지만, 그것들은 기능적으로 매우 중요할 수 있다: 대부분의 정신 활성 약물은 글루탐산염이나 GABA 이외의 송신기를 통해 작용하는 일부 신경전달물질 시스템의 작용을 변화시킴으로써 그 효과를 발휘한다.코카인과 암페타민 같은 중독성 있는 약물은 주로 도파민 계통에 그 효과를 발휘한다.중독성 있는 아편제들은 주로 오피오이드 펩타이드의 기능적 아날로그로서 그 효과를 발휘하며, 이는 다시 도파민 수치를 조절한다.
신경전달물질, 펩타이드, 기체 신호분자 목록
뇌신경전달물질계
특정한 종류의 신경전달물질을 발현하는 뉴런은 때때로 구별되는 시스템을 형성하는데, 이 체계의 활성화가 부피 전달이라 불리는 대량의 뇌에 영향을 미친다.주요 신경전달물질 계통으로는 노르아드레날린(노레피네프린) 계통, 도파민 계통, 세로토닌 계통, 콜린에르기 계통 등이 있다.미량아민은 미량아민 관련 수용체를 통한 신호를 통해 뇌 전체의 모노아민 경로(즉, 도파민, 노레피네프린, 세로토닌 경로)에서 신경전달에 대한 조절효과를 가진다.[32][33] 이러한 시스템의 간략한 비교는 다음과 같다.
| 시스템 | 경로 원점 및 투영 | 통제된 인지 과정 및 행동 |
|---|---|---|
| 노라드레날린계 [34][35][36][37][38][39] | 노드레너기 경로:
|
|
| 도파민계 [36][37][38][40][41][42] | 도파민성 경로:
| |
| 히스타민계 [37][38][43] | 히스타민성 경로:
| |
| 세로토닌계 [34][36][37][38][44][45][46] | 세로토닌 경로: CN(Cudal nuclei):
로스트랄 핵(RN):
| |
| 아세틸콜린계 [34][36][37][38][47] | 콜린거 경로: 전뇌 콜린거 핵(FCN):
선조체 톤 활성 콜린거 뉴런(TAN) 뇌계 콜린거 핵(BCN):
| |
| 아드레날린계 [48][49] | 아드레날린 경로:
|
|
약물 효과
신경전달물질에 미치는 약물의 영향을 이해하는 것은 신경과학 분야의 연구 시책의 상당 부분을 차지한다.이 분야에 관여하는 대부분의 신경과학자들은 이러한 노력이 다양한 신경학적 질병과 장애에 책임이 있는 회로에 대한 우리의 이해를 더욱 발전시킬 수 있을 뿐만 아니라, 효과적으로 치료하고 언젠가는 그러한 질병을 예방하거나 치료할 수 있는 방법들을 더욱 발전시킬 수 있을 것으로 믿는다.[50][medical citation needed]
약은 신경전달물질 활동을 변화시킴으로써 행동에 영향을 줄 수 있다.예를 들어, 약물은 신경전달물질의 합성효소에 영향을 줌으로써 신경전달물질의 합성 속도를 감소시킬 수 있다.신경전달물질 합성이 차단되면 방출할 수 있는 신경전달물질의 양이 현저히 낮아져 신경전달물질 활동이 감소한다.어떤 약은 특정 신경전달물질의 방출을 막거나 자극한다.또는 시냅스 vesicle 막이 새도록 하여 시냅스 vesicle에 신경전달물질 저장을 막을 수 있다.신경전달물질의 수용체 결합을 막는 약물을 수용체 길항제라고 한다.예를 들어 할로페리돌, 클로로프롬아진, 클로자핀 등 조현병 환자를 치료하는 데 사용되는 약물은 뇌내 수용체에서 도파민에 대항하는 약이다.다른 약물은 수용체에 결합하여 정상적인 신경전달물질을 모방하여 작용한다.이런 약을 수용체 작용제라고 한다.수용체 작용제의 예로는 내생 신경전달물질 β-엔돌핀의 효과를 모방한 아편인 모르핀이 있다.다른 약물은 신경전달물질이 분비된 후 비활성화되는 것을 방해하여 신경전달물질의 작용을 연장시킨다.이것은 재흡수를 막거나 분해 효소를 억제함으로써 이루어질 수 있다.마지막으로, 약물은 또한 중추신경계와 말초신경계 전체의 신경 활동을 차단하여 작용전위가 발생하는 것을 막을 수 있다.신경 활동을 차단하는 테트로도톡신 같은 약은 일반적으로 치명적이다.
주요 시스템의 신경전달물질을 대상으로 하는 약물은 전체 시스템에 영향을 미치며, 이는 일부 약물의 작용 복잡성을 설명할 수 있다.예를 들어 코카인은 도파민의 재흡수를 사전 시냅스 뉴런으로 차단해 신경전달물질 분자를 시냅스 갭에 장기간 방치한다.도파민이 시냅스에 더 오래 남아 있기 때문에 신경전달물질은 시냅스 후 뉴런의 수용체와 계속 결합해 즐거운 감정적 반응을 이끌어낸다.코카인에 대한 신체적 중독은 시냅스 내의 과잉 도파민에 장기간 노출되어 일부 시냅스 후 수용체들의 하향 조절로 이어질 수 있다.약물 마모의 효과가 사라진 후에는 신경전달물질이 수용체에 결합할 확률을 감소시켜 우울증에 걸릴 수 있다.플루옥세틴은 선택적 세로토닌 재흡수 억제제(SSRI)로 시냅스에 존재하는 세로토닌의 양을 증가시키고 나아가 그곳에 더 오래 머물 수 있게 해 자연적으로 방출되는 세로토닌의 효과에 대한 잠재력을 제공한다.[51]AMPT는 도파민의 전구체인 L-DOPA로의 티로신 전환을 방지하고, 레세핀은 베시클 내의 도파민 저장을 방지하며, 디프레닐은 모노아민 산화효소(MAO)-B를 억제하여 도파민 수치를 높인다.
| 마약 | 상호 작용: | 수용체 상호작용: | 유형 | 영향들 |
|---|---|---|---|---|
| 보툴리눔 톡신(보톡스) | 아세틸콜린 | – | 길항제 | PNS에서 아세틸콜린 방출 차단 근육 수축 방지 |
| 블랙 위도우 스파이더 베놈 | 아세틸콜린 | – | 작용제 | PNS에서 아세틸콜린 방출 촉진 근육의 수축 촉진 |
| 네오스티그민 | 아세틸콜린 | – | – | 아세틸콜리네라제 활동 방해 수용체에서 ACh의 효과 증가 마이스테니아 그라비스를 치료하는 데 사용된다. |
| 니코틴 | 아세틸콜린 | 니코틴(골격근) | 작용제 | ACh 활동 증가 주의력 향상 보강효과 |
| d-tub암호화폐 | 아세틸콜린 | 니코틴(골격근) | 길항제 | 수용체 현장의 활성도 감소 |
| 쿠라레 | 아세틸콜린 | 니코틴(골격근) | 길항제 | ACh 활성 감소 근육 수축 방지 |
| 무스카린 | 아세틸콜린 | 무스카리닉 (심장과 부드러운 근육) | 작용제 | ACh 활동 증가 독성의 |
| 아트로핀 | 아세틸콜린 | 무스카리닉 (심장과 부드러운 근육) | 길항제 | 동공 수축 차단 침 생산 차단 |
| 스코폴라민(하이오신) | 아세틸콜린 | 무스카리닉 (심장과 부드러운 근육) | 길항제 | 멀미, 수술 후 구역질 및 구토 치료 |
| AMPT | 도파민/노레피네프린 | – | – | 티로신 수산화효소 불활성화 및 도파민 생성 억제 |
| 레서핀 | 도파민 | – | – | 시냅스 vesicle에 도파민 및 기타 모노아민 저장 방지 진정 및 우울증의 원인 |
| 아포모르핀 | 도파민 | D2 수용체(presynaptic autorceptor/postsynaptic caps) | 길항제(저선량)/직접작용제(고선량) | 저선량: 블록 자동 감지기 고선량: 시냅스 후 수용체 자극 |
| 암페타민 | 도파민/노레피네프린 | – | 간접작용제 | 도파민, 노르아드레날린, 세로토닌 배출 |
| 필로폰 | 도파민/노레피네프린 | – | – | 도파민 및 노르아드레날린 방출 블록 재흡수 |
| 메틸페니다이트 | 도파민 | – | – | 블록 재흡수 ADHD에서 주의력 및 충동 제어 기능 향상 |
| 코카인 | 도파민 | – | 간접작용제 | 블록이 다시 사전 시냅스로 전환됨 전압 의존성 나트륨 채널 차단 국소마취제로 사용 가능(눈방울) |
| 디프레닐 | 도파민 | – | 작용제 | MAO-B 억제 도파민 파괴 방지 |
| 클로로프로마진 | 도파민 | D2 수용체 | 길항제 | 블록 D2 수용체 환각 완화 |
| MPTP | 도파민 | – | – | 파킨슨과 같은 증상을 보이는 결과 |
| PCPA | 세로토닌(5-HT) | – | 길항제 | 트립토판 히드록실라아제의 활동을 차단하여 세로토닌 합성을 방해함 |
| 온단세트론 | 세로토닌(5-HT) | 5-HT3 수용체 | 길항제 | 화학요법 및 방사선 치료 부작용 감소 구역질 및 구토 감소 |
| 부스피론 | 세로토닌(5-HT) | 5-HT1A 수용체 | 부분작용제 | 불안과 우울증의 증상 치료 |
| 플루옥세틴 | 세로토닌(5-HT) | 5-HT 재흡수 지원 | SSRI | 세로토닌 재흡수 억제 우울증, 일부 불안 장애, 강박장애를[51] 치료하는 일반적인 예: Prozac과 Sarafem |
| 펜플루라민 | 세로토닌(5-HT) | – | – | 세로토닌 방출의 원인 세로토닌 재흡수 억제 식욕억제제로 사용됨 |
| 리세르그산 디에틸아미드 | 세로토닌(5-HT) | 포스트 시냅스 5-HT2A 수용체 | 다이렉트 어게인스트 | 시각적 지각 왜곡을 발생 전뇌에서 5-HT2A 수용체 자극 |
| 메틸렌디오옥시메탐페타민(MDMA) | 세로토닌(5-HT)/노레핀프린 | – | – | 세로토닌과 노르에피네프린 분비를 촉진하고 재흡수 억제 흥분 및 환각 유발 효과 |
| 스트라이치닌 | 글리신 | – | 길항제 | 심한 근육 경련을[53] 일으킨다. |
| 디펜하이드라민 | 히스타민 | 혈액뇌장벽을 넘어 졸음을 유발한다. | ||
| 테트라하이드로카나비놀(THC) | 엔도카나비노이드 | 카나비노이드(CB) 수용체 | 작용제 | 진통 및 진정제 생성 식욕 증진 인지 효과 |
| 리모나반트 | 엔도카나비노이드 | 카나비노이드(CB) 수용체 | 길항제 | 식욕을 억제하다. 금연에 사용됨 |
| MAFP | 엔도카나비노이드 | – | – | FAAH 억제 캐나비노이드 시스템 활동을 증가시키기 위한 연구에 사용됨 |
| AM1172 | 엔도카나비노이드 | – | – | 블록 카나비노이드 재흡수 캐나비노이드 시스템 활동을 증가시키기 위한 연구에 사용됨 |
| 아난다미드(내생성) | – | CB(Cannabinoid) 수용체, 5-HT3 수용체 | – | 메스꺼움 및 구토 감소 |
| 카페인 | 아데노신 | 아데노신 수용체 | 길항제 | 아데노신 수용체 차단 기상도가 높아진다. |
| PCP | 글루탐산염 | NMDA 수용체 | 간접 길항제 | PCP 바인딩 사이트 차단 칼슘 이온이 뉴런으로 유입되는 것을 방지한다. 학습을 손상시킨다. |
| AP5 | 글루탐산염 | NMDA 수용체 | 길항제 | NMDA 수용체에서 글루탐산염 결합 부위 차단 시냅스 가소성과 특정 형태의 학습을 저해한다. |
| 케타민 | 글루탐산염 | NMDA 수용체 | 길항제 | 마취제로 사용됨 무아지경 같은 상태를 유도하고 통증 완화와 진정 작용을 돕는다. |
| NMDA | 글루탐산염 | NMDA 수용체 | 작용제 | NMDA 수용체 연구에 사용됨 이온성 수용체 |
| 암파 | 글루탐산염 | AMPA 수용체 | 작용제 | AMPA 수용체 연구를 위한 연구에 사용됨 이온성 수용체 |
| 앨리글리신 | 가바 | – | – | GABA 합성 억제 발작을 일으키다. |
| 무시몰 | 가바 | GABA수용체 | 작용제 | 진정작용을 일으킨다. |
| 비쿠쿨린 | 가바 | GABA수용체 | 길항제 | 발작의 원인 |
| 벤조디아제핀 | 가바 | GABA수용체A | 간접작용제 | 항불안제, 진정제, 기억력 장애, 근육 이완 |
| 바비투라테스 | 가바 | GABA수용체A | 간접작용제 | 진정, 기억력 장애, 근육 이완 |
| 알코올 | 가바 | GABA수용체 | 간접작용제 | 진정, 기억력 장애, 근육 이완 |
| 피크로톡신 | 가바 | GABA수용체A | 간접적 길항제 | 과다 복용은 발작을 일으킨다. |
| 티아가빈 | 가바 | – | 길항제 | GABA 트랜스포터 길항제 GABA의 가용성 향상 발작 가능성 감소 |
| 모클로베미드 | 노레피네프린 | – | 작용제 | 우울증 치료를 위한 MAO-A 차단 |
| 이다작산 | 노레피네프린 | 알파-2 아드레날린 자동 감지기 | 작용제 | 알파-2 자동 감지기 차단 노레피네프린 시스템을 연구하는데 사용됨 |
| 후사르산 | 노레피네프린 | – | – | 노레피네프린 생산을 차단하는 도파민 베타-하이드록실라제의 활성 억제 도파민 시스템에 영향을 주지 않고 노레피네프린 시스템을 연구하는데 사용됨 |
| 아편제(오피움, 모르핀, 헤로인, 옥시코돈) | 오피오이드 | 오피오이드 수용체[54] | 고민자 | 진통, 진정, 보강 효과 |
| 날록손 | 오피오이드 | – | 길항제 | 역행성 섭취 또는 과다복용 증상(즉 호흡 문제) |
고민자
이 절은 완전한 작용제 적용 범위와 부분작용제 및 역작용제와의 구별을 가진 확장성을 필요로 한다.덧셈을 하면 도움이 된다. (2015년 8월) |
작용제는 신경전달물질 수용체와 같이 수용체에 결합할 수 있고 내생물질의 결합에 의해 일반적으로 생성되는 동일한 반응을 일으킬 수 있는 화학물질을 말한다.[55]따라서 신경전달물질의 작용제는 송신기와 동일한 수용체 반응을 일으킬 것이다.뉴런에서 작용제 약물은 직접 또는 간접적으로 신경전달물질 수용체를 활성화할 수 있다.직접 결합 작용제는 완전한 작용제, 부분작용제, 역작용제로 더욱 특징지어질 수 있다.[56][57]
직접 작용제는 그 관련 수용체 부위와 직접 결합하여 신경전달물질과 유사한 작용을 하는데, 이는 시냅스 뉴런이나 시냅스 후 뉴런 또는 둘 다에 위치할 수 있다.[58]반면neurotransmitter autoreceptors이 시냅스전 뉴런에 위치하게 된 이유로 모노아민 신경 전달 물질을 위하는 경우에는 일반적으로, 신경 전달 물질 수용체가 시냅스 후 뉴런에,;[32]어떤 경우에는 신경 전달 물질 시대에 역행하는 제품 신경 전달, 피드백 신호를 사용하는 뉴런에서 신경 전달 물질 r형식을 사용 위치한다ele시냅스 후 결합하여 시냅스 전 뉴런에 위치한 대상 수용체에 결합한다.[59][note 1]담배에서 발견되는 화합물인 니코틴은 대부분의 니코틴 아세틸콜린 수용체들의 직접적인 작용제로 주로 콜린성 뉴런에 위치한다.[54]모르핀, 헤로인, 하이드로코돈, 옥시코돈, 코데인, 메타돈과 같은 아편물은 μ-오피오이드 수용체 작용제로서, 이 작용은 그들의 행복감과 고통을 경감시키는 특성을 매개한다.[54]
간접작용제는 신경전달물질의 유출을 자극하거나 신경전달물질의 재흡수를 방지함으로써 목표 수용체에서 신경전달물질의 결합을 증가시킨다.[58]어떤 간접 작용제는 신경전달물질 방출을 유발하고 신경전달물질 재흡수를 방지한다.예를 들어 시냅스 후부의 도파민의 암페타민, 간접적인 모두의 효능 제이다, 노르 에피네프린, 그리고 각각은 그들의 각각의 뉴런에 세로토닌 수용체,[32][33]고 시냅스 틈에서 TAAR1, 시냅스전을 활성화하여 그들의 재흡수 방해하지 못하도록 하는 시냅스전 뉴런으로 신경 전달 물질 방출, 그 후에 시냅스 틈을 생산한다. Gprote결합 수용체, 그리고 모노아민 뉴런 내의 시냅스 vesicle에 위치한 모노아민 전달체의 일종인 VMAT2의 현장에 결합.[32][33]
반목자
길항제란 다른 화학 물질의 생리학적 활성을 감소시키기 위해 체내에서 작용하는 화학물질로, 특히 신경 수용체와 결합하여 차단함으로써 체내에서 자연적으로 발생하는 약물이나 물질의 신경계에 작용하는 것에 반대하는 화학물질이다.[60]
길항제 유형에는 직접 작용하는 길항제 유형과 간접 작용하는 길항제 유형 두 가지가 있다.
- 직접적으로 작용하는 길항제로서, 다른 방법으로 신경전달물질에 의해 점유되는 수용체에 존재하는 공간을 차지한다.이것은 신경전달물질이 수용체에 결합되는 것을 막게 한다.가장 흔한 것은 아트로핀이라고 불린다.
- 신경전달물질(예: Reserpine)의 방출/생산을 억제하는 간접 작용 길항제 약품.
마약 적대자
길항제 약물은 그 수용체를 활성화하지 않고 수용체라고 불리는 부위에 부착(또는 결합)하여 생물학적 반응을 일으키는 약이다.따라서 본질적인 활동이 없다고 한다.길항자는 현장에서 작용제의 효과를 차단하기 때문에 수용체 "차단기"라고도 할 수 있다.따라서 길항제 약리학적 효과는 해당 수용체 부위의 작용제(예: 약물, 호르몬, 신경전달물질)가 결합하여 활성화되는 것을 방지한다.적대자들은 "경쟁적"일 수도 있고 "불가역적"일 수도 있다.
경쟁 상대는 수용체와의 결합을 위해 작용제와 경쟁한다.길항제 농도가 높아지면 작용제의 결합이 점차 억제되어 생리적 반응이 감소한다.높은 농도의 적수는 반응을 완전히 억제할 수 있다.그러나 작용제와 길항제 간에 수용체와의 결합을 위해 경쟁하기 때문에 이러한 억제는 작용제 농도의 증가에 의해 역전될 수 있다.따라서 경쟁적 적대자는 작용제에 대한 용량-반응 관계를 오른쪽으로 이동시키는 특징을 가질 수 있다.경쟁적 적대자가 있는 경우, 적대자가 없을 때 관찰된 동일한 반응을 생성하기 위해서는 작용제의 집중력이 증가해야 한다.
돌이킬 수 없는 길항제란 수용체에 강하게 결합하여 수용체를 작용제에게 결합할 수 없게 한다.돌이킬 수 없는 길항제들은 수용체와 공밸런스 화학적 결합을 형성할 수도 있다.어느 경우든 되돌릴 수 없는 길항제 농도가 충분히 높다면 작용제 결합을 위해 남아 있는 결합 수용체 수가 너무 적어 작용제의 고농도에서도 최대 생물학적 반응이 나오지 않을 수 있다.[61]
전구체
신경전달물질 전구체의 섭취가 신경전달물질 합성을 증가시키기는 하지만, 신경전달물질 방출과 시냅스 후 수용체 발사가 증가하는지에 대한 증거가 혼재된다.신경전달물질 방출이 증가하더라도 신경계통이 신경전달물질 합성증가 등의 변화에 적응해 지속적인 발화상태를 유지할 수 있기 때문에 이것이 신경전달물질 신호강도의 장기적 증가를 가져올지는 불분명하다.[65][unreliable medical source?]일부 신경전달물질은 우울증에 영향을 미칠 수 있으며, 이러한 신경전달물질의 전구체 섭취가 경미하고 적당한 우울증 치료에 유용할 수 있다는 증거가 있다.[65][unreliable medical source?][66]
카테콜아민과 미량아민 전구체
혈액뇌장벽을 넘는 도파민의 전구체인 L-DOPA는 파킨슨병 치료에 쓰인다.신경전달물질 노레피네프린의 저활성화가 수반되는 우울증 환자의 경우 신경전달물질 전구 투여의 유익성에 대한 증거는 거의 없다.L-페닐알라닌과 L-티로신 모두 도파민, 노레피네프린, 에피네프린 전구체다.이러한 변환에는 비타민 B6, 비타민 C, S-adenosylmethionine이 필요하다.몇몇 연구는 L-페닐알라닌과 L-티로신의 잠재적인 항우울제 효과를 제시하지만, 이 분야에서 더 많은 연구를 할 여지가 있다.[65][unreliable medical source?]
세로토닌 전구체
세로토닌의 전구체인 L-트립토판을 투여하면 뇌의 세로토닌 생산량이 두 배로 늘어난 것으로 보인다.경미하고 적당한 우울증 치료에 플라시보보다 훨씬 효과적이다.[65][unreliable medical source?]이 변환에는 비타민 C 5-하이드록시트리토판(5-HTP)이 필요하며, 세로토닌의 전구체도 위약보다 더 효과적이다.[21][65][unreliable medical source?]
질병과 장애
질병과 장애는 또한 특정 신경전달물질 시스템에도 영향을 미칠 수 있다.다음은 특정 신경전달물질의 증가, 감소 또는 불균형에 관련된 질환이다.
도파민:
예를 들어 도파민 생성 문제(주로 실체형 니그라의 경우)는 파킨슨병, 즉 사람의 마음대로 움직이는 능력에 영향을 주는 질환으로 경직, 떨림, 떨림 등의 증상이 나타날 수 있다.일부 연구는 뇌의 사고와 느낌 영역에서 도파민을 너무 적게 또는 너무 많이 사용하거나 사용하는 문제가 정신분열증이나 주의력 결핍 과잉행동 장애(ADHD)와 같은 질환에 영향을 미칠 수 있다고 제안한다.도파민은 중독과 약물 사용에도 관여하는데, 대부분의 레크리에이션 약물이 뇌에 도파민의 유입을 유발하여 쾌적한 느낌을 만들어 내므로(특히 오피오이드와 필로폰) 이용자들이 지속적으로 약물을 갈망하는 이유가 된다.
세로토닌:
마찬가지로, 세로토닌의 재활용이나 재흡수를 막는 약물이 우울증 진단을 받은 일부 사람들에게 도움이 되는 것처럼 보인다는 연구 결과가 나온 후, 우울증을 앓고 있는 사람들이 정상보다 낮은 세로토닌 수치를 가질 수 있다는 이론이 나왔다.널리 대중화되었지만, 이 이론은 후속 연구에서 제시되지 않았다.[67]따라서 선택적 세로토닌 재흡수 억제제(SSRIs)를 사용하여 시냅스 내 세로토닌 양을 증가시킨다.
글루탐산염:
게다가 글루탐산염을 생산하거나 사용하는 문제는 자폐증, 강박장애(OCD), 정신분열증, 우울증 등 많은 정신질환과 시사적이고 잠정적으로 연계되어 왔다.[68]글루탐산염이 너무 많은 것은 파킨슨병, 다발성 경화증, 알츠하이머병, 뇌졸중, ALS(조영성 측경화증)와 같은 신경학적 질병과 연관되어 있다.[69]
신경전달물질 불균형
일반적으로 적절한 수준의 "표준"이나 서로 다른 신경전달물질의 "균형"에 대해 과학적으로 확립된 "표준"은 없다.대부분의 경우 뚜렷한 순간에 뇌나 신체의 신경전달물질 수치를 측정하는 것은 실용적으로 불가능하다.신경전달물질은 서로의 방출을 규제하고, 이 상호 규제의 약한 일관적인 불균형은 건강한 사람들의 기질과 연결되어 있었다.[70][71][72][73][74] 신경전달물질 시스템에 대한 강한 불균형이나 장애는 많은 질병과 정신질환과 연관되어 왔다.여기에는 파킨슨병, 우울증, 불면증, 주의력결핍과잉행동장애(ADHD), 불안감, 기억력 저하, 체중과 중독의 극적인 변화 등이 포함된다.만성적인 육체적 또는 감정적 스트레스는 신경전달물질 시스템 변화의 원인이 될 수 있다.유전학은 신경전달물질 활동에도 역할을 한다.레크리에이션 사용과는 별도로, 하나 이상의 송신기 또는 그 수용체와 직간접적으로 상호작용하는 약물은 일반적으로 정신과 및 심리학적 문제에 대해 처방된다.특히 세로토닌이나 노레피네프린과 상호작용하는 약물은 우울증이나 불안과 같은 문제가 있는 환자에게 처방되지만, 그러한 개입을 뒷받침할 수 있는 확실한 의학적 증거가 많이 있다는 생각은 널리 비판되어 왔다.[75]도파민 불균형이 다발성 경화증과 기타 신경학적 장애에 영향을 미친다는 연구 결과가 나왔다.[76]
참고 항목
메모들
- ^ 중추신경계에서는 아난다미드(anandamide other endocannabinoid)는 시냅스 후 분비물이므로 역행성 신경전달물질을 이용하는 반면, 대상수용체인 카나비노이드 수용체 1(CB1)은 전시냅스성을 띤다.[59]대마초 식물에는 CB1의 직접작용제인 Δ-테트라하이드로카나비놀이9 들어 있다.[59]
- ^ GABA는 비단백성 아미노산이다.
참조
- ^ Lodish H, Berk A, Zipursky SL (2000). "Section 21.4 Neurotransmitters, Synapses, and Impulse Transmission". Molecular Cell Biology (4th ed.). New York: W. H. Freeman.
- ^ Cuevas J (1 January 2019). "Neurotransmitters and Their Life Cycle". Reference Module in Biomedical Sciences. Elsevier. doi:10.1016/b978-0-12-801238-3.11318-2. ISBN 978-0-12-801238-3.
- ^ Purves D, Augustine GJ, Fitzpatrick D, Katz LC, LaMantia AS, McNamara JO, Williams SM (2001). "Peptide Neurotransmitters". Neuroscience (2nd ed.).
- ^ Sanders KM, Ward SM (January 2019). "Nitric oxide and its role as a non-adrenergic, non-cholinergic inhibitory neurotransmitter in the gastrointestinal tract". British Journal of Pharmacology. 176 (2): 212–227. doi:10.1111/bph.14459. PMC 6295421. PMID 30063800.
- ^ Elias LJ, Saucier DM (2005). Neuropsychology: Clinical and Experimental Foundations. Boston: Pearson.
- ^ Chergui K, Suaud-Chagny MF, Gonon F (October 1994). "Nonlinear relationship between impulse flow, dopamine release and dopamine elimination in the rat brain in vivo". Neuroscience. 62 (3): 641–645. doi:10.1016/0306-4522(94)90465-0. PMID 7870295. S2CID 20465561.
- ^ Thapa S, Lv M, Xu H (30 November 2017). "Acetylcholinesterase: A Primary Target for Drugs and Insecticides". Mini Reviews in Medicinal Chemistry. 17 (17): 1665–1676. doi:10.2174/1389557517666170120153930. PMID 28117022.
- ^ Vasica G, Tennant CC (September 2002). "Cocaine use and cardiovascular complications". The Medical Journal of Australia. 177 (5): 260–262. doi:10.5694/j.1326-5377.2002.tb04761.x. PMID 12197823. S2CID 18572638.
- ^ 살라딘, 케네스 S.해부학 및 생리학: 형태와 기능의 통일.맥그로우 힐.2009 ISBN 0-07-727620-5
- ^ Breedlove SM, Watson NV (2013). Biological psychology : an introduction to behavioral, cognitive, and clinical neuroscience (Seventh ed.). Sunderland, MA: Sinauer Associates. ISBN 978-0878939275.
- ^ a b Whishaw B, Kolb IQ (2014). An introduction to brain and behavior (4th ed.). New York, NY: Worth Publishers. pp. 150–151. ISBN 978-1429242288.
- ^ Peters A, Palay SL (December 1996). "The morphology of synapses". Journal of Neurocytology. 25 (12): 687–700. doi:10.1007/BF02284835. PMID 9023718. S2CID 29365393.
- ^ Shier D, Butler J, Lewis R (5 January 2015). Hole's human anatomy & physiology (Fourteenth ed.). New York, NY. ISBN 978-0-07-802429-0. OCLC 881146319.
- ^ Di Chiara G, Morelli M, Consolo S (June 1994). "Modulatory functions of neurotransmitters in the striatum: ACh/dopamine/NMDA interactions". Trends in Neurosciences. 17 (6): 228–233. doi:10.1016/0166-2236(94)90005-1. PMID 7521083. S2CID 32085555.
- ^ Whishaw B, Kolb IQ (2014). An introduction to brain and behavior (4th ed.). New York, NY: Worth Publishers. ISBN 978-1429242288.
- ^ Gross L (November 2006). ""Supporting" players take the lead in protecting the overstimulated brain". PLOS Biology. 4 (11): e371. doi:10.1371/journal.pbio.0040371. PMC 1609133. PMID 20076484.
- ^ Yang JL, Sykora P, Wilson DM, Mattson MP, Bohr VA (August 2011). "The excitatory neurotransmitter glutamate stimulates DNA repair to increase neuronal resiliency". Mechanisms of Ageing and Development. 132 (8–9): 405–11. doi:10.1016/j.mad.2011.06.005. PMC 3367503. PMID 21729715.
- ^ 오레신 수용체는 새로운 종류의 수면제인 국민수면재단에 대항한다.
- ^ "Acetylcholine Receptors". Ebi.ac.uk. Retrieved 25 August 2014.
- ^ 슈터, 길버트, 웨거.심리학2009년 미국인쇄하다
- ^ a b University of Bristol. "Introduction to Serotonin". Retrieved 15 October 2009.
- ^ Prasad BV (2020). Examining Biological Foundations of Human Behavior. United States of America: IGI Global. p. 81. ISBN 978-1799-8286-17.
- ^ a b Sapolsky R (2005). "Biology and Human Behavior: The Neurological Origins of Individuality, 2nd edition". The Teaching Company.
see pages 13 & 14 of Guide Book
- ^ Snyder SH, Innis RB (1979). "Peptide neurotransmitters". Annual Review of Biochemistry. 48: 755–82. doi:10.1146/annurev.bi.48.070179.003543. PMID 38738.
- ^ Corbière A, Vaudry H, Chan P, Walet-Balieu ML, Lecroq T, Lefebvre A, et al. (18 September 2019). "Strategies for the Identification of Bioactive Neuropeptides in Vertebrates". Frontiers in Neuroscience. 13: 948. doi:10.3389/fnins.2019.00948. PMC 6759750. PMID 31619945.
- ^ Fricker LD, Devi LA (May 2018). "Orphan neuropeptides and receptors: Novel therapeutic targets". Pharmacology & Therapeutics. 185: 26–33. doi:10.1016/j.pharmthera.2017.11.006. PMC 5899030. PMID 29174650.
- ^ Kodirov SA, Takizawa S, Joseph J, Kandel ER, Shumyatsky GP, Bolshakov VY (October 2006). "Synaptically released zinc gates long-term potentiation in fear conditioning pathways". Proceedings of the National Academy of Sciences of the United States of America. 103 (41): 15218–23. Bibcode:2006PNAS..10315218K. doi:10.1073/pnas.0607131103. PMC 1622803. PMID 17005717.
- ^ "International Symposium on Nitric Oxide – Dr. John Andrews – MaRS". MaRS. Archived from the original on 14 October 2014.
- ^ "Dopamine: Biological activity". IUPHAR/BPS guide to pharmacology. International Union of Basic and Clinical Pharmacology. Retrieved 29 January 2016.
- ^ Grandy DK, Miller GM, Li JX (February 2016). ""TAARgeting Addiction"--The Alamo Bears Witness to Another Revolution: An Overview of the Plenary Symposium of the 2015 Behavior, Biology and Chemistry Conference". Drug and Alcohol Dependence. 159: 9–16. doi:10.1016/j.drugalcdep.2015.11.014. PMC 4724540. PMID 26644139.
TAAR1 is a high-affinity receptor for METH/AMPH and DA
- ^ Lin Y, Hall RA, Kuhar MJ (October 2011). "CART peptide stimulation of G protein-mediated signaling in differentiated PC12 cells: identification of PACAP 6-38 as a CART receptor antagonist". Neuropeptides. 45 (5): 351–8. doi:10.1016/j.npep.2011.07.006. PMC 3170513. PMID 21855138.
- ^ a b c d e Miller GM (January 2011). "The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity". Journal of Neurochemistry. 116 (2): 164–76. doi:10.1111/j.1471-4159.2010.07109.x. PMC 3005101. PMID 21073468.
- ^ a b c d Eiden LE, Weihe E (January 2011). "VMAT2: a dynamic regulator of brain monoaminergic neuronal function interacting with drugs of abuse". Annals of the New York Academy of Sciences. 1216 (1): 86–98. Bibcode:2011NYASA1216...86E. doi:10.1111/j.1749-6632.2010.05906.x. PMC 4183197. PMID 21272013.
VMAT2 is the CNS vesicular transporter for not only the biogenic amines DA, NE, EPI, 5-HT, and HIS, but likely also for the trace amines TYR, PEA, and thyronamine (THYR) ... [Trace aminergic] neurons in mammalian CNS would be identifiable as neurons expressing VMAT2 for storage, and the biosynthetic enzyme aromatic amino acid decarboxylase (AADC).
- ^ a b c Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. p. 155. ISBN 9780071481274.
Different subregions of the VTA receive glutamatergic inputs from the prefrontal cortex, orexinergic inputs from the lateral hypothalamus, cholinergic and also glutamatergic and GABAergic inputs from the laterodorsal tegmental nucleus and pedunculopontine nucleus, noradrenergic inputs from the locus ceruleus, serotonergic inputs from the raphe nuclei, and GABAergic inputs from the nucleus accumbens and ventral pallidum.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 145, 156–157. ISBN 9780071481274.
Descending NE fibers modulate afferent pain signals. ... The locus ceruleus (LC), which is located on the floor of the fourth ventricle in the rostral pons, contains more than 50% of all noradrenergic neurons in the brain; it innervates both the forebrain (eg, it provides virtually all the NE to the cerebral cortex) and regions of the brainstem and spinal cord. ... The other noradrenergic neurons in the brain occur in loose collections of cells in the brainstem, including the lateral tegmental regions. These neurons project largely within the brainstem and spinal cord. NE, along with 5HT, ACh, histamine, and orexin, is a critical regulator of the sleep-wake cycle and of levels of arousal. ... LC firing may also increase anxiety ...Stimulation of β-adrenergic receptors in the amygdala results in enhanced memory for stimuli encoded under strong negative emotion ... Epinephrine occurs in only a small number of central neurons, all located in the medulla. Epinephrine is involved in visceral functions, such as control of respiration.
- ^ a b c d Rang HP (2003). Pharmacology. Edinburgh: Churchill Livingstone. pp. 474 for noradrenaline system, page 476 for dopamine system, page 480 for serotonin system and page 483 for cholinergic system. ISBN 978-0-443-07145-4.
- ^ a b c d e Iwańczuk W, Guźniczak P (2015). "Neurophysiological foundations of sleep, arousal, awareness and consciousness phenomena. Part 1". Anaesthesiology Intensive Therapy. 47 (2): 162–7. doi:10.5603/AIT.2015.0015. PMID 25940332.
The ascending reticular activating system (ARAS) is responsible for a sustained wakefulness state. ... The thalamic projection is dominated by cholinergic neurons originating from the pedunculopontine tegmental nucleus of pons and midbrain (PPT) and laterodorsal tegmental nucleus of pons and midbrain (LDT) nuclei [17, 18]. The hypothalamic projection involves noradrenergic neurons of the locus coeruleus (LC) and serotoninergic neurons of the dorsal and median raphe nuclei (DR), which pass through the lateral hypothalamus and reach axons of the histaminergic tubero-mamillary nucleus (TMN), together forming a pathway extending into the forebrain, cortex and hippocampus. Cortical arousal also takes advantage of dopaminergic neurons of the substantia nigra (SN), ventral tegmenti area (VTA) and the periaqueductal grey area (PAG). Fewer cholinergic neurons of the pons and midbrain send projections to the forebrain along the ventral pathway, bypassing the thalamus [19, 20].
- ^ a b c d e Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 12: Sleep and Arousal". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, USA: McGraw-Hill Medical. p. 295. ISBN 9780071481274.
The ARAS is a complex structure consisting of several different circuits including the four monoaminergic pathways ... The norepinephrine pathway originates from the locus ceruleus (LC) and related brainstem nuclei; the serotonergic neurons originate from the raphe nuclei within the brainstem as well; the dopaminergic neurons originate in ventral tegmental area (VTA); and the histaminergic pathway originates from neurons in the tuberomammillary nucleus (TMN) of the posterior hypothalamus. As discussed in Chapter 6, these neurons project widely throughout the brain from restricted collections of cell bodies. Norepinephrine, serotonin, dopamine, and histamine have complex modulatory functions and, in general, promote wakefulness. The PT in the brain stem is also an important component of the ARAS. Activity of PT cholinergic neurons (REM-on cells) promotes REM sleep. During waking, REM-on cells are inhibited by a subset of ARAS norepinephrine and serotonin neurons called REM-off cells.
- ^ Rinaman L (February 2011). "Hindbrain noradrenergic A2 neurons: diverse roles in autonomic, endocrine, cognitive, and behavioral functions". American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 300 (2): R222-35. doi:10.1152/ajpregu.00556.2010. PMC 3043801. PMID 20962208.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 147–148, 154–157. ISBN 9780071481274.
Neurons from the SNc densely innervate the dorsal striatum where they play a critical role in the learning and execution of motor programs. Neurons from the VTA innervate the ventral striatum (nucleus accumbens), olfactory bulb, amygdala, hippocampus, orbital and medial prefrontal cortex, and cingulate cortex. VTA DA neurons play a critical role in motivation, reward-related behavior, attention, and multiple forms of memory. ... Thus, acting in diverse terminal fields, dopamine confers motivational salience ("wanting") on the reward itself or associated cues (nucleus accumbens shell region), updates the value placed on different goals in light of this new experience (orbital prefrontal cortex), helps consolidate multiple forms of memory (amygdala and hippocampus), and encodes new motor programs that will facilitate obtaining this reward in the future (nucleus accumbens core region and dorsal striatum). ... DA has multiple actions in the prefrontal cortex. It promotes the "cognitive control" of behavior: the selection and successful monitoring of behavior to facilitate attainment of chosen goals. Aspects of cognitive control in which DA plays a role include working memory, the ability to hold information "on line" in order to guide actions, suppression of prepotent behaviors that compete with goal-directed actions, and control of attention and thus the ability to overcome distractions. ... Noradrenergic projections from the LC thus interact with dopaminergic projections from the VTA to regulate cognitive control. ...
- ^ Calipari ES, Bagot RC, Purushothaman I, Davidson TJ, Yorgason JT, Peña CJ, et al. (March 2016). "In vivo imaging identifies temporal signature of D1 and D2 medium spiny neurons in cocaine reward". Proceedings of the National Academy of Sciences of the United States of America. 113 (10): 2726–31. Bibcode:2016PNAS..113.2726C. doi:10.1073/pnas.1521238113. PMC 4791010. PMID 26831103.
Previous work has demonstrated that optogenetically stimulating D1 MSNs promotes reward, whereas stimulating D2 MSNs produces aversion.
- ^ Ikemoto S (November 2010). "Brain reward circuitry beyond the mesolimbic dopamine system: a neurobiological theory". Neuroscience and Biobehavioral Reviews. 35 (2): 129–50. doi:10.1016/j.neubiorev.2010.02.001. PMC 2894302. PMID 20149820.
Recent studies on intracranial self-administration of neurochemicals (drugs) found that rats learn to self-administer various drugs into the mesolimbic dopamine structures–the posterior ventral tegmental area, medial shell nucleus accumbens and medial olfactory tubercle. ... In the 1970s it was recognized that the olfactory tubercle contains a striatal component, which is filled with GABAergic medium spiny neurons receiving glutamatergic inputs form cortical regions and dopaminergic inputs from the VTA and projecting to the ventral pallidum just like the nucleus accumbens
그림 3: 암페타민의 복측 선조체 및 자가 관리 - ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 175–176. ISBN 9780071481274.
Within the brain, histamine is synthesized exclusively by neurons with their cell bodies in the tuberomammillary nucleus (TMN) that lies within the posterior hypothalamus. There are approximately 64000 histaminergic neurons per side in humans. These cells project throughout the brain and spinal cord. Areas that receive especially dense projections include the cerebral cortex, hippocampus, neostriatum, nucleus accumbens, amygdala, and hypothalamus. ... While the best characterized function of the histamine system in the brain is regulation of sleep and arousal, histamine is also involved in learning and memory ...It also appears that histamine is involved in the regulation of feeding and energy balance.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 158–160. ISBN 9780071481274.
[The] dorsal raphe preferentially innervates the cerebral cortex, thalamus, striatal regions (caudate-putamen and nucleus accumbens), and dopaminergic nuclei of the midbrain (eg, the substantia nigra and ventral tegmental area), while the median raphe innervates the hippocampus, septum, and other structures of the limbic forebrain. ... it is clear that 5HT influences sleep, arousal, attention, processing of sensory information in the cerebral cortex, and important aspects of emotion (likely including aggression) and mood regulation. ...The rostral nuclei, which include the nucleus linearis, dorsal raphe, medial raphe, and raphe pontis, innervate most of the brain, including the cerebellum. The caudal nuclei, which comprise the raphe magnus, raphe pallidus, and raphe obscuris, have more limited projections that terminate in the cerebellum, brainstem, and spinal cord.
- ^ Nestler EJ. "Brain Reward Pathways". Icahn School of Medicine at Mount Sinai. Nestler Lab. Retrieved 16 August 2014.
The dorsal raphe is the primary site of serotonergic neurons in the brain, which, like noradrenergic neurons, pervasively modulate brain function to regulate the state of activation and mood of the organism.
- ^ Marston OJ, Garfield AS, Heisler LK (June 2011). "Role of central serotonin and melanocortin systems in the control of energy balance". European Journal of Pharmacology. 660 (1): 70–9. doi:10.1016/j.ejphar.2010.12.024. PMID 21216242.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 167–175. ISBN 9780071481274.
The basal forebrain cholinergic nuclei are comprised the medial septal nucleus (Ch1), the vertical nucleus of the diagonal band (Ch2), the horizontal limb of the diagonal band (Ch3), and the nucleus basalis of Meynert (Ch4). Brainstem cholinergic nuclei include the pedunculopontine nucleus (Ch5), the laterodorsal tegmental nucleus (Ch6), the medial habenula (Ch7), and the parabigeminal nucleus (Ch8).
- ^ Guyenet PG, Stornetta RL, Bochorishvili G, Depuy SD, Burke PG, Abbott SB (August 2013). "C1 neurons: the body's EMTs". American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 305 (3): R187-204. doi:10.1152/ajpregu.00054.2013. PMC 3743001. PMID 23697799.
- ^ Stornetta RL, Guyenet PG (March 2018). "C1 neurons: a nodal point for stress?". Experimental Physiology. 103 (3): 332–336. doi:10.1113/EP086435. PMC 5832554. PMID 29080216.
- ^ "Neuron Conversations: How Brain Cells Communicate". Brainfacts.org. Retrieved 2 December 2014.
- ^ a b Yadav VK, Ryu JH, Suda N, Tanaka KF, Gingrich JA, Schütz G, et al. (November 2008). "Lrp5 controls bone formation by inhibiting serotonin synthesis in the duodenum". Cell. 135 (5): 825–37. doi:10.1016/j.cell.2008.09.059. PMC 2614332. PMID 19041748.
- ^ 칼슨, N. R. & 비르케트, M. A. (2017.행동 생리학(12조)피어슨, pgs 100–115ISBN 978-0134080918
- ^ "CDC Strychnine Facts about Strychnine Public Health Emergency Preparedness& Response". emergency.cdc.gov. Retrieved 7 May 2018.
- ^ a b c "Neurotransmitters and Drugs Chart". Ocw.mit.edu. Retrieved 25 August 2014.
- ^ "Agonist – Definition and More from the Free Merriam-Webster Dictionary". Merriam-webster.com. Retrieved 25 August 2014.
- ^ 아택 J, 라브라이센 H. (2010) 작용제.인: 스톨러만 I.P. (eds) 정신 무기학 백과사전스프링거, 베를린, 하이델베르크https://doi.org/10.1007/978-3-540-68706-1_1565
- ^ Roth BL (February 2016). "DREADDs for Neuroscientists". Neuron. 89 (4): 683–94. doi:10.1016/j.neuron.2016.01.040. PMC 4759656. PMID 26889809.
- ^ a b Ries RK, Fiellin DA, Miller SC (2009). Principles of addiction medicine (4th ed.). Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins. pp. 709–710. ISBN 9780781774772. Retrieved 16 August 2015.
- ^ a b c Flores A, Maldonado R, Berrendero F (December 2013). "Cannabinoid-hypocretin cross-talk in the central nervous system: what we know so far". Frontiers in Neuroscience. 7: 256. doi:10.3389/fnins.2013.00256. PMC 3868890. PMID 24391536.
• 그림 1: OX1 또는 OX2를 표현하는 뇌 CB1 표현 및 광섬유 뉴런의 도식
• 그림 2: 카나비노이드 및 오레신 시스템의 시냅스 신호 메커니즘 - ^ "Antagonist". Medical definition of Antagonist. Retrieved 5 November 2014.
- ^ Goeders NE (2001). "Antagonist". Encyclopedia of Drugs, Alcohol, and Addictive Behavior. Retrieved 2 December 2014.
- ^ Broadley KJ (March 2010). "The vascular effects of trace amines and amphetamines". Pharmacology & Therapeutics. 125 (3): 363–375. doi:10.1016/j.pharmthera.2009.11.005. PMID 19948186.
- ^ Lindemann L, Hoener MC (May 2005). "A renaissance in trace amines inspired by a novel GPCR family". Trends in Pharmacological Sciences. 26 (5): 274–281. doi:10.1016/j.tips.2005.03.007. PMID 15860375.
- ^ Wang X, Li J, Dong G, Yue J (February 2014). "The endogenous substrates of brain CYP2D". European Journal of Pharmacology. 724: 211–218. doi:10.1016/j.ejphar.2013.12.025. PMID 24374199.
- ^ a b c d e Meyers S (February 2000). "Use of neurotransmitter precursors for treatment of depression" (PDF). Alternative Medicine Review. 5 (1): 64–71. PMID 10696120. Archived from the original (PDF) on 5 August 2004.
- ^ van Praag HM (March 1981). "Management of depression with serotonin precursors". Biological Psychiatry. 16 (3): 291–310. PMID 6164407.
- ^ Healy D (April 2015). "Serotonin and depression". BMJ. 350: h1771. doi:10.1136/bmj.h1771. PMID 25900074. S2CID 38726584.
- ^ "NIMH Brain Basics". U.S. National Institutes of Health. Retrieved 29 October 2014.
- ^ Bittigau P, Ikonomidou C (November 1997). "Glutamate in neurologic diseases". Journal of Child Neurology. 12 (8): 471–85. doi:10.1177/088307389701200802. PMID 9430311. S2CID 1258390.
- ^ Netter, P. (1991) 기질 연구의 생화학 변수.Strelau, J. & Angleitner, A. (Eds.)에서 기질 탐색:이론과 측정에 대한 국제적 관점 147–161.뉴욕: 플레넘 프레스.
- ^ Trofimova I, Robbins TW (May 2016). "Temperament and arousal systems: A new synthesis of differential psychology and functional neurochemistry". Neuroscience and Biobehavioral Reviews. 64: 382–402. doi:10.1016/j.neubiorev.2016.03.008. PMID 26969100. S2CID 13937324.
- ^ 클로닝러 CR, Svrakic DM, Przybeck TR.기질과 성격의 정신생물학적 모델"아치 젠 정신의학 1993; 50:975-990.
- ^ Trofimova IN (2016). "The interlocking between functional aspects of activities and a neurochemical model of adult temperament.". In Arnold MC (ed.). Temperaments: Individual Differences, Social and Environmental Influences and Impact on Quality of Life. New York: Nova Science Publishers, Inc. pp. 77–147.
- ^ Depue RA, Morrone-Strupinsky JV (June 2005). "A neurobehavioral model of affiliative bonding: implications for conceptualizing a human trait of affiliation". The Behavioral and Brain Sciences. 28 (3): 313–50, discussion 350-95. doi:10.1017/s0140525x05000063. PMID 16209725.
- ^ 레오, J, & 라카세, J. (2007년 10월 10일)언론과 화학적 불균형 우울증 이론.http://psychrights.org/articles/TheMediaandChemicalImbalanceTheoryofDepression.pdf에서 2014년 12월 1일 검색
- ^ Dobryakova E, Genova HM, DeLuca J, Wylie GR (12 March 2015). "The dopamine imbalance hypothesis of fatigue in multiple sclerosis and other neurological disorders". Frontiers in Neurology. 6: 52. doi:10.3389/fneur.2015.00052. PMC 4357260. PMID 25814977.
외부 링크
| 위키미디어 커먼즈에는 신경전달물질과 관련된 미디어가 있다. |
| 위키북스에는 '신경과학/세포 신경생물학/신경전달물질'이라는 주제의 책이 있다. |