파킨슨병
Parkinson's disease이 기사는 업데이트해야 합니다. (2023년 11월) |
| 파킨슨병 | |
|---|---|
| 기타이름 | 파킨슨병, 특발성 또는 원발성 파킨슨병, 저역동성 경직 증후군, 마비성 아지탄, 떨림성 마비 |
A. 1880년대 파킨슨병(PD)의 예시 B. 가벼운 운동성 PD 다. 중간 PD D. 미만성 악성 PD | |
| 전문 | 신경학 |
| 증상 | 경직, 움직임의 느림, 떨림, 보행의[1] 어려움 |
| 합병증 | 치매, 우울증, 불안,[2] 섭식 문제, 수면 문제 |
| 보통발병 | 60세[1][3] 이상 |
| 원인들 | 알[4] 수 없음 |
| 위험요소 | 농약 노출, 머리 부상[4] |
| 진단방법 | 증상을[1] 기준으로 |
| 감별진단 | Lewy 신체를 동반한 치매, 진행성 초핵성 마비, 본태성 떨림, 항정신병적 사용[5] |
| 치료 | 의약품, 수술[1] |
| 약 | 도파민 작용제[2], L-DOPA |
| 빈도수. | 620만명(2015년)[6] |
| 죽음 | 117,400 (2015)[7] |
| 이름은 다음과 같습니다. | 제임스 파킨슨 |
파킨슨병(Parkin's disease, PD) 또는 간단히 파킨슨병은 운동계와 비운동계 모두에 영향을 미치는 중추신경계의 만성 퇴행성 질환입니다. 증상은 보통 천천히 나타나고, 질병이 진행됨에 따라 운동을 하지 않는 증상이 더 흔해집니다. 초기 증상은 떨림, 경직, 움직임의 둔화, 보행의 어려움 등입니다. 인지, 행동, 수면 및 감각 시스템에도 문제가 발생할 수 있습니다. 파킨슨병 치매는 진행 단계에서 흔히 발생합니다.
이 질병의 운동 증상은 기저 신경절에 도파민을 공급하는 중뇌 영역인 니그라(substantia nigra)의 신경 세포 사멸에서 비롯됩니다. 이 세포 사멸의 원인은 잘 알려져 있지 않지만, 단백질 알파-시뉴클레인이 뉴런 내의 루이체에 응집되는 것을 포함합니다. 전체적으로 주된 운동 증상은 파킨슨증으로 알려져 있습니다. 기여 요인에는 유전적 요인과 환경적 요인이 복합적으로 포함됩니다. 영향을 받은 가족이 있는 사람들은 유전 가능한 위험 요소로 알려진 특정 유전자와 함께 질병에 걸릴 위험이 증가합니다. 환경적 위험에는 살충제 노출 및 이전 머리 부상이 포함되며 트리클로로에틸렌 노출 이력도 의심됩니다.
파킨슨병의 진단은 주로 증상을 위주로 하는데, 대개 운동과 관련이 있습니다. PD는 일반적으로 60세 이상에서 발생하며, 그 중 약 1%가 영향을 받습니다. 50세 미만에서는 조기 발병 PD라고 합니다. 진단 후 평균 수명은 7-15년입니다. PD에 대한 치료법은 알려져 있지 않으며, 치료는 증상을 완화하는 것을 목표로 합니다. 초기 치료는 일반적으로 L-DOPA, MAO-B 억제제 또는 도파민 작용제를 포함합니다. 질병이 진행됨에 따라 이러한 약물은 효과가 떨어지고 무의식적인 근육 움직임으로 특징지어지는 부작용을 낳습니다. 식단과 특정 형태의 재활은 증상을 개선하는 데 어느 정도 효과를 보였습니다. 약물이 효과가 없는 심각한 운동 증상을 줄이기 위해 뇌심부 자극을 위한 미세 전극을 배치하는 수술이 사용되었습니다. 수면 장애, 정서적 문제와 같은 PD의 비동과 관련된 증상에 대한 치료에 대한 증거는 덜 강력합니다.
이 병의 이름은 1817년 '흔들리는 팔시에 관한 에세이'에 처음으로 상세한 설명을 발표한 영국 의사 제임스 파킨슨의 이름을 따서 지어졌습니다. 대중 인식 캠페인에는 세계 파킨슨의 날이 포함되며, 빨간 튤립을 사용하는 것은 파킨슨의 인식을 상징합니다. 이 병에 대한 대중의 인식을 높인 PD가 있는 사람들 중에는 권투선수 무하마드 알리와 배우 마이클 J. 폭스가 있습니다.
분류
진행성 신경퇴행성 질환인 파킨슨병([9]Parkin's disease, PD)은 떨림, 서맥운동, 경직, 자세 불안정 등을 포괄하는 파킨슨병의 가장 흔한 형태로, 원인을 알 수 없다는 의미로 특발성 파킨슨병이라고도 합니다.[10]
파킨슨병은 다른 방법으로 분류할 수 있습니다. 파킨슨 증후군에는 다른 질환과 함께 파킨슨 증후군이 포함됩니다.[11] Lewy 신체 질환[12] 중에 포함되며, 뇌에 알파-시뉴클레인 단백질이 비정상적으로 침착되는 것이 특징인 시뉴클레인 병증입니다. 시뉴클레오틴 병증으로는 Lewy 신체를 동반한 치매, 다발성 시스템 위축, 기타 더 희귀한 질환 등이 있습니다.[13][9] 일부 희귀한 유전자 형태의 파킨슨병은 알파-시뉴클레인 응집을 나타내지 않습니다.[14]
징후 및 증상
가장 잘 알려진 증상은 움직임(운동)과 관련된 것으로 떨림, 서맥 운동(움직임의 느림), 경직성, 엉킴/굽혀진 걸음걸이 등이 있습니다.[15] 자율 기능 장애, 신경 정신 질환(기분, 인지, 행동 또는 생각의 변화), 감각(특히 후각의 변화) 및 수면 장애를 포함한 운동 이외의 증상도 나타날 수 있습니다. 파킨슨병을 앓고 있는 사람은 변비, 무뇨증(냄새를 맡을 수 없는 상태), 렘 행동 장애를 포함한 운동 증상이 시작되기 전에 운동을 하지 않는 증상이 있을 수 있습니다. 일반적으로 치매, 정신병, 기립성, 더 심한 낙상 등의 증상이 나중에 발생합니다.[15] PD에서 구강인두 연하 곤란의 유병률은 82%까지 높은 것으로 추정됩니다. 연하 곤란(삼킴 곤란)은 질병의 모든 단계에서 보고되었습니다.[17] 연하 곤란으로 인한 합병증으로는 탈수, 영양실조, 체중감소, 흡인성 폐렴 등이 있습니다. 폐렴은 PD가 있는 사람들의 가장 흔한 입원 원인이자 주요 사망 원인입니다.[18]
모터
PD에서는 떨림, 움직임의 느림(bradykinesia), 경직, 자세의 불안정 등 네 가지 운동 증상이 기본적인 징후로 간주됩니다.[15]
가장 흔한 증상은 안정을 취할 때 손이 거칠고 천천히 떨리는 것으로, 영향을 받은 팔을 자발적으로 움직이는 동안 그리고 수면의 더 깊은 단계에서 사라집니다.[15] 일반적으로 한 손에만 나타나 결국 질병이 진행됨에 따라 두 손 모두에 영향을 미칩니다.[15] PD 떨림의 주파수는 4~6헤르츠(초당 주기)입니다. 떨림의 일반적인 특징은 알약을 굴리는 것인데, 검지와 엄지가 원을 그리며 함께 만지고 수행하는 경향이 있습니다.[15][19] 이 용어는 PD가 있는 사람들의 움직임과 수동으로 알약을 만드는 초기 약술 사이의 유사성에서 비롯되었습니다.[19]
브래디키니아는 운동 시작의 운동 계획의 방해로 인한 것이며, 운동의 계획에서 시작, 실행에 이르기까지 운동 과정의 전체 과정에서 어려움과 관련이 있습니다. 순차 및 동시 이동의 성능이 손상됩니다. 브래디키니아는 파킨슨병의 가장 손이 많이 가는 증상으로 옷을 입히고, 먹이를 주고, 목욕을 하는 등의 일상적인 업무에 어려움을 나타냅니다. 두 개의 독립적인 운동 활동을 동시에 수행하는 데 특히 어려움을 겪고, 정서적 스트레스나 병이 동시에 발생하여 악화될 수 있습니다. 역설적으로 PD가 있는 사람들은 자전거를 타거나 계단을 더 쉽게 오를 수 있습니다. 대부분의 의사들은 서맥 운동을 쉽게 알아차릴 수 있지만, 공식적인 평가는 사람들이 손가락과 발로 반복적인 움직임을 해야 합니다.[20]
파킨슨병에서 강직성 또는 저역동증은 균일할 수 있으며, 리드-파이프 강성 또는 톱니바퀴 강성으로 알려져 있습니다.[10][15] 떨림과 증가된 음색의 결합은 톱니바퀴 강성의 기원으로 여겨집니다.[21] 경직은 관절 통증과 관련이 있을 수 있습니다. 그러한 통증은 질병의 빈번한 초기 증상입니다.[15] PD 초기에는 경직성이 비대칭적이며 얼굴과 사지의 근육보다 목과 어깨 근육에 먼저 영향을 주는 경향이 있습니다.[22] 질병이 진행됨에 따라 경직성은 일반적으로 전신에 영향을 미치고 운동 능력을 저하시킵니다.
자세의 불안정성은 질병의 후기 단계에서 전형적으로 나타나는데, 이는 균형의 손상과 잦은 낙상으로 이어지고,[23] 이차적으로는 뼈 골절, 자신감 상실, 이동성의 저하로 이어집니다.[24] 초기에는 불안정함이 없으며, 특히 젊은 층에서, 특히 양쪽 증상이 발생하기 전에는 더욱 그렇습니다.[25] PD 진단을 받은 사람의 최대 40%는 낙상을 경험할 수 있으며, 약 10%는 매주 낙상을 경험할 수 있으며, 낙상 횟수는 PD의 중증도와 관련이 있습니다.[15]
다른 인식된 운동 징후와 증상으로는 페스티네이션(festination)과 같은 보행 및 자세 장애(빠른 셔플 스텝 및 유연한 팔 스윙 없이 걸을 때 전방으로 유연한 자세)가 있습니다. 다른 일반적인 징후로는 걸음걸이가 얼어붙는 것(발이 바닥에 달라붙는 것처럼 보일 때, 특히 방향을 바꾸거나 할 때 잠시 멈춤), 흐릿하고 단조롭고 조용한 목소리, 마스크 같은 표정, 점점 작아지는 글씨체 등이 있습니다.[26] PD를 가진 사람들은 일반적으로 신체의 한쪽 면에 주로 운동 증상이 있지만 마스크와 같은 표정은 얼굴 양쪽에 나타날 수 있습니다.[27]
인식의
PD는 인지, 기분, 행동, 생각의 장애를 포함하여 경미한 것부터 심각한 것까지 신경정신과적 장애를 유발합니다.[15] 인지 장애는 진단 초기 또는 진단 전에 발생할 수 있으며, 질병의 지속 기간에 따라 유병률이 증가할 수 있습니다.[15][28] 가장 흔한 인지적 결핍은 계획, 인지적 유연성, 추상적 사고, 규칙 습득, 부적절한 행동 억제, 적절한 행동 시작, 작업 기억, 주의력 통제의 문제를 포함할 수 있는 실행 기능 장애입니다.[28][29] 다른 인지적 어려움으로는 인지 처리 속도가 느려지고, 기억력이 저하되고, 시간에 대한 인식과 추정력이 저하되는 등이 있습니다.[28][29] 그럼에도 불구하고, 기억이 단서에 의해 도움을 받을 때 개선이 나타납니다.[28] 시각 공간적 어려움은 질병의 한 부분으로, 예를 들어, 개인이 얼굴 인식과 그려진 선의 방향에 대한 인식 테스트를 수행하도록 요청받을 때 볼 수 있습니다.[28][29]
정신병
정신병은 26~83%[30][31]의 유병률을 보이는 증상으로 간주할 수 있습니다. 환청이나 망상은 PD가 있는 사람의 약 50%에서 질병이 진행되는 동안 발생하며 치매의 출현을 예고할 수 있습니다. 이러한 것들은 사소한 환각에서부터 (사람 옆을 빠르게 지나가는 것) 또는 존재감 (사람 옆이나 뒤에 서 있는 어떤 것 또는 누군가의 지각), 완전히 날려버린 생생한, 형성된 시각적 환각 및 편집증적 관념에 이르기까지 다양합니다. 환청은 PD에게 드물고, 목소리로 묘사되는 경우는 거의 없습니다. 정신병은 그 질병의 필수적인 부분이라고 여겨집니다. 망상과 동반된 섬망을 동반한 정신병은 항파킨슨 약물 치료의 알려진 합병증입니다. 요로 감염(노인에게서 빈번한) 및 기저 뇌 병리학 또는 신경 전달 물질 또는 그 수용체의 변화(예: 아세틸콜린, 세로토닌)가 PD의 정신병에 역할을 하는 것으로 생각됩니다.[32][33]
신경정신과
행동 및 기분 변화는 인지 장애가 없는 PD에서 일반인보다 더 흔하며 치매가 있는 PD에서 보통 존재합니다. 가장 빈번한 기분의 어려움은 우울증, 무관심, 불안감입니다.[15] 우울증은 환자의 20%에서 35%로 추정되며, 질병의 모든 단계에서 나타날 수 있습니다. 질병 과정에 공통적인 증상(피로감, 불면증, 집중력 저하)으로 나타날 수 있어 진단이 어렵습니다. 도파민, 세로토닌, 노르아드레날린 호르몬의 불균형 및 변화와 기능 장애는 PD 영향을 받는 사람들의 우울증의 원인이 됩니다.[30][34] 자살 생각은 일반인보다 높지만 자살 시도 자체는 낮은 편입니다.[30][34] 우울증의 위험 요인에는 50세 미만의 질병 발병, 여성, 이전 우울증 병력 또는 심한 운동 증상이 포함됩니다.[30]
불안은 PD에 영향을 받는 사람들에게 보통 30-40% 정도의 유병률을 보이는 것으로 추정되며, 최대 60%까지 발견되었습니다.[30][34] PD와의 불안은 복잡하며 PD 특유의 증상으로 이루어져 있습니다.[35][page needed] 운동 '오프' 기간(약물 복용이 효과가 없는 시간)에는 불안감이 높아질 수 있고, 신경전달물질 경로의 기능 장애로 진단 후 진단될 가능성이 높습니다.[35][page needed] PD의 영향을 받는 사람들은 일반인들에 비해 공황발작을 더 자주 경험합니다. 불안과 우울증 모두 삶의 질 저하와 관련이 있는 것으로 나타났습니다.[30][36] 증상의 범위는 경미하고 일시적인 것부터 만성적인 것까지 다양하며, 잠재적인 원인은 비정상적인 감마 아미노부티르산 수치와 증상 또는 질병에 대한 당혹감 또는 두려움입니다.[30][36] PD의 불안 위험 요인은 50세 미만의 질병 발병, 여성 및 비주기입니다.[30]
무감각증과 무감각증은 동기부여의 상실과 즐거움을[37] 경험할 수 있는 능력의 손상으로 정의되며 우울증과 고전적으로 관련된 증상이지만 PD 영향을 받는 사람들마다 치료와 기전이 다릅니다. 무관심은 약 16.5-40%에서 나타납니다. 무관심의 증상으로는 새로운 활동이나 주변 세계에 대한 주도성/관심의 감소, 정서적 무관심, 타인에 대한 애정이나 걱정의 상실 등이 있습니다.[30] 무관심은 실행력과 언어 기억력을 포함한 인지 기능의 결손과 관련이 있습니다.[34] 무헤도니아는 평가된 연구 모집단에 따라 PD가 있는 사람의 5-75%에서 발생하며 무감각과 겹칩니다.[38]
약물과 관련된 것으로, 특히 경구용 도파민 작용제는 병리적 도박, 강박적 성행위, 폭식, 강박적 쇼핑, 무분별한 관대함을 포함한 충동조절 장애입니다. 도파민 조절 장애 증후군(과다 사용에 기여하는 약물 부족)은 레보도파 사용의 드문 합병증입니다.[39]
위장
파킨슨병의 위장 문제로는 변비, 위 배출 장애(위운동장애), 과도한 타액 생산 등이 있어 불편을 초래하거나 건강을 위협할 정도로 심각할 수 있습니다.[40][41] 다른 상부위장관 증상으로는 연하장애(Orophinal dysphagia)와 소장 세균 과증식이 있습니다.[42]
파킨슨병 환자는 뇌뿐만 아니라 소화관에도 알파-시뉴클레인 침전물이 있습니다.[42] 변비는 PD의 위험 증가와 관련된 증상 중 하나이며 PD의 진단에 선행할 수 있습니다.[42]
다른.
수면장애는 PD와 함께 발생하며 약물로 인해 악화될 수 있습니다.[15] 증상은 낮의 졸음(기면증과 유사한 갑작스러운 수면 발작 포함), 빠른 눈 움직임의 수면 장애 또는 불면증으로 나타날 수 있습니다.[15] REM 행동 장애는 Lewy 신체를 가진 PD 또는 치매의 운동 또는 인지 요소가 발달하기 수년 전에 시작될 수 있습니다.[43]
자율신경계의 변화는 기립성 저혈압(입상시 저혈압), 지성 피부, 과도한 발한, 요실금, 성기능의 변화를 초래할 수 있습니다.[15]
지각의 변화는 후각의 장애, 시력의 장애, 통증, 그리고 감각의 장애를 포함할 수 있습니다.[15] 이러한 증상은 질병 진단 몇 년 전에 발생할 수 있습니다.[15]
원인 및 위험요인
파킨슨병의 대표적인 운동 증상은 신경초종(substantia nigra pars compacta, SNpc) 뇌 부위에서 도파민 신경세포가 사멸되어 선조체에 도파민 결핍이 발생하기 때문입니다. 살아남은 뉴런들은 보통 세포 과정을 방해하는 알파-시뉴클레인으로 구성된 루이의 몸을 가지고 있습니다.[44]
그러나 파킨슨병의 근본적인 원인은 알려지지 않았으며,[45] 제안된 위험 인자 중 어느 것도 확실하게 입증되지 않았습니다.[46] 나이는 가장 중요한 위험 요소입니다.[47] 가장 빈번하게 반복되는 환경적 관계는 살충제에 노출된 사람들의 위험 증가와 흡연자들의 위험 감소입니다.[46][48] 연구에 따르면 PD는 유전적 요인과 환경적 요인 사이의 복잡한 상호작용에서 비롯됩니다.[4] 오직 유전적인 원인에 의해서만 원인을 찾을 수 있는 경우는 극소수에 불과합니다. 특발성 PD는 수십 년에 걸쳐 지속되고 진행될 수 있기 때문에 노출 시기가 특정 단계의 진행 또는 중증도에 영향을 미칠 수 있습니다.[49]
유전의
연구에 따르면 PD는 유전적 요인과 환경적 요인 사이의 복잡한 상호작용에서 비롯됩니다.[4] 진단받은 사람의 약 15%는 이 질병에 1급 친척이 있으며,[10] 5-10%는 적어도 하나의 고위험 유전자에 돌연변이가 있습니다.[50][51] 이러한 유전자 돌연변이 중 하나가 있으면 질병으로 이어지지 않을 수 있습니다; 민감도 요인은 발병 연령, 심각도 및 진행에 영향을 미치는 다른 요인과 함께 위험을 증가시킵니다.[50]
2022년 현재 약 90개의 유전적 위험 유전자좌가 확인되었습니다.[52][53] 이들 유전자 중 상당수는 세포사멸, 염증 등의 세포 과정과 미토콘드리아, 리소좀, 엔도솜 등의 소기관 기능 장애에 기여하는 것으로 알려져 있습니다.[52] 파킨슨병의 가장 큰 유전적 위험인자는 효소를 암호화하는 GBA1 유전자의 이형접합 돌연변이입니다. PD가 있는 사람의 5~10%에서 발견됩니다.[54] 소수의 유전자만이 "단일 유전자" 파킨슨병을 유발할 수 있으며, 이는 사례의 10~20%를 차지합니다.[55]
SNCA 유전자 돌연변이에 의해 암호화된 단백질인 알파-시뉴클레인은 PD를 가진 사람들의 뇌에 축적되는 루이체의 주성분입니다.[50] 알파-시뉴클레인은 주요 DNA 손상 복구 신호 키나제인 taxia telangiectasia 돌연변이를 활성화합니다.[56] 또한 알파-시뉴클레인은 비동질 말단 접합 DNA 복구 경로를 활성화합니다. Lewy 신체에서 알파-시뉴클레인의 응집은 감소된 DNA 복구와 PD의 뇌세포 사멸 사이의 연결고리로 보입니다.[56] Lewy 신체에 기여하지 않는 주요 유전적 위험 인자로는 LRRK2와 PRKN이 있습니다.[57]
비유전적
수십 년에 걸친 연구를 통해 농업, 농약 노출, 농촌 거주와 관련하여 파킨슨병 발병 가능성이 증가하는 것으로 나타났습니다. 드라이클리닝 및 탈지와 같은 상업적 및 산업적 응용에 사용되는 염소화 용매는 PD 위험 증가, 특히 트리클로로에틸렌과 관련이 있습니다.[58][59] 기타 화학적 위험 요소로는 망간, 교통 매연으로 인한 부유 입자, 수은 및 납과 같은 기타 중금속 노출 등이 있습니다.[59][60] 외상성 뇌 손상(TBI)은 PD의 위험 요소로 강하게 연관되어 있습니다.[61]
일부 의학적 약물은 파킨슨병과 관련이 있습니다. 약물 유발 파킨슨병은 페노티아진, 부티로페논, 메토클로프라미드 및 테트라베나진과 [14]같은 공격적인 약제를 중단함으로써 일반적으로 가역적입니다. MPTP는 동물 모델 연구에서 흔히 사용되는 비가역적 파킨슨증을 유발하는 것으로 알려진 약물입니다.[14][62][63] 혈중 저농도의 요산염은 위험 증가와 관련이 있습니다.[64] 더욱이 PD와 헬리코박터 파일로리 감염 사이에는 레보도파를 포함한 일부 약물의 흡수를 막을 수 있는 가능성이 있습니다.[65][66]
병태생리학

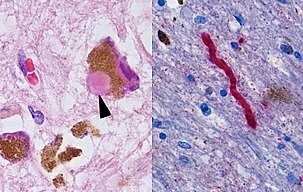
PD의 주요 병리학적 특징은 뇌 기저 신경절의 세포 사멸(생명이 끝날 때까지 실질 니그라파스 콤팩트의 도파민 분비 뉴런의 최대 70%에 영향을 미치는 것)입니다.[67] 파킨슨병에서는 알파-시뉴클레인이 잘못 접혀져서 다른 알파-시뉴클레인과 뭉치게 됩니다. 세포는 이러한 덩어리를 제거하지 못하고 알파-시뉴클레인은 세포독성이 되어 세포를 손상시킵니다.[68][69] 이 덩어리들은 현미경으로 뉴런에서 볼 수 있으며 Lewy body라고 불립니다. 뉴런의 손실은 성상교세포(별 모양의 신경교세포)의 사멸과 실질 니그라의 미세교세포(다른 종류의 신경교세포)의 증가를 동반합니다.[70][page needed] PD의 영향을 받는 뇌 부위의 진행 중증도는 Braak 병기 설정으로 측정할 수 있습니다. 이 병기에 따르면 PD는 연수와 후각 구근에서 시작하여 중뇌/기저 전뇌의 나머지 부분으로 이동합니다. 움직임 증상은 질병이 흑반병에 영향을 미치기 시작할 때 발생합니다.[71]
뇌의 다섯 가지 주요 경로는 다른 뇌 영역과 기저 신경절을 연결합니다. 이것들은 운동, 안구 운동, 연상, 변연계 및 전방 회로의 궤도로 알려져 있습니다. 이름은 각 회로의 주 투영 영역을 나타냅니다.[72] 모두 PD의 영향을 받고 있으며, 그들의 장애는 움직임, 주의 집중 및 학습 관련 질병의 증상을 유발합니다.[72] 과학적으로 모터 회로를 가장 집중적으로 조사했습니다.[72]
1980년부터 모터 회로의 특정 개념 모델과 PD와의 변경이 영향을 미쳤지만 몇 가지 한계가 지적되어 수정이 이루어졌습니다.[72] 이 모델에서 기저 신경절은 일반적으로 광범위한 운동 시스템에 지속적인 억제 영향을 주어 부적절한 시기에 활성화되는 것을 방지합니다. 특정 동작을 수행하기로 결정하면 필요한 모터 시스템에 대한 억제가 감소하여 활성화를 위해 방출됩니다. 도파민은 이러한 억제의 방출을 촉진하는 작용을 하므로 높은 수준의 도파민 기능은 운동 활동을 촉진하는 경향이 있는 반면 PD에서 발생하는 것과 같은 낮은 수준의 도파민 기능은 주어진 움직임에 대해 더 많은 노력을 요구합니다. 도파민 고갈의 결과는 운동 출력의 전반적인 감소인 저운동량을 생성하는 것입니다.[72] 반대로 PD 치료에 사용되는 약물은 과도한 도파민 활성을 생성하여 부적절한 시기에 운동 시스템이 활성화되어 운동 장애를 유발할 수 있습니다.[72]
뇌세포사
뇌세포 사멸의 한 메커니즘은 손상된 세포에서 유비퀴틴에 결합된 단백질 알파-시뉴클레인이 비정상적으로 축적되는 것에서 비롯됩니다. 이 불용성 단백질은 Lewy body로 알려진 뉴런 내부에 축적되어 내포물을 형성합니다.[67][73] 이 신체들은 먼저 후각구, 연수 및 음경에 나타납니다. 이 단계에 있는 사람들은 증상이 없거나 운동을 하지 않는 초기 증상(예: 후각 상실 또는 일부 수면 또는 자동 기능 장애)이 있을 수 있습니다. 질병이 진행됨에 따라 Lewy 신체는 중뇌와 기저 전뇌의 영역인 흑질 실질에서 발달하고 마지막으로 신피질에서 발달합니다.[67] 이러한 뇌 부위는 PD에서 신경세포 퇴화의 주요 장소이지만, Lewy 신체는 (이상 단백질이 격리되거나 벽으로 막혀 있는 상태에서) 세포 사멸로부터 보호될 수 있습니다. Lewy body와 Lewy neurite에 응집되지 않는 다른 형태의 알파-시뉴클레인(예: 올리고머)은 사실 단백질의 독성 형태일 수 있습니다.[74][73] 치매가 있는 사람들에게서, 일반적으로 Lewy 신체의 존재는 피질 부위에서 흔합니다. 알츠하이머병의 특징인 신경섬유 엉킴과 노인성 플라크는 치매가 아닌 이상 흔하지 않습니다.[70][page needed]
다른 메커니즘으로는 프로테아좀 및 리소좀 시스템 기능 장애 및 미토콘드리아 활성 감소가 있습니다.[74] 일반적으로 실질 니그라의 철 축적은 단백질 포함물과 함께 관찰됩니다. 산화 스트레스, 단백질 응집, 신경세포 사멸과 관련이 있을 수 있지만 그 기전은 잘 알려져 있지 않습니다.[75]
신경면역 상호작용
신경 면역 상호 작용은 PD 병리학에 크게 관련되어 있습니다. PD와 자가면역질환은 유전적 변이와 분자 경로를 공유합니다. 일부 자가 면역 질환은 한 연구에서 PD 발병 위험을 최대 33%까지 증가시킬 수 있습니다.[76] 단핵구 및 CD4+ T 세포의 단백질 발현 프로파일과 연관된 자가면역질환은 PD와 연관되어 있습니다. 헤르페스 바이러스 감염은 아마도 바이러스 단백질의 분자 모방을 통해 알파-시뉴클레인에 대한 자가면역 반응을 유발할 수 있습니다.[77] 알파-시뉴클레인과 그 집합체 형태인 Lewy body는 미세아교세포와 결합할 수 있습니다. 인플라마좀의 MHC 수용체에 알파-시뉴클레인이 결합하면 미세아교세포가 증식하고 과활성화되어 IL-1β, IFN γ, TNFα 등의 전염증성 사이토카인이 방출됩니다.
활성화된 미세아교세포는 성상세포의 활성화에 영향을 미쳐 신경보호 표현형을 신경독성 표현형으로 전환시킵니다. 건강한 뇌의 성상세포는 신경 연결을 보호하는 역할을 합니다. 파킨슨병에서 성상세포는 선조체의 도파민 연결을 보호할 수 없습니다. 미세아교세포는 MHC-I와 MHC-II를 통해 T세포에 항원을 전달합니다. 이렇게 활성화된 CD4+ T세포는 혈액뇌장벽(BBB)을 통과하여 인터페론-γ(IFN γ), TNFα, IL-1β 등의 전염증성 사이토카인을 더 많이 방출합니다. 비만 세포 탈과립화 및 후속 전염증성 사이토카인 방출은 PD의 BBB 분해와 관련이 있습니다. PD와 관련된 또 다른 면역 세포는 말초 단핵구이며 PD를 가진 사람들의 실질적인 니그라에서 발견되었습니다. 이러한 단핵구는 더 많은 도파민 연결을 파괴할 수 있습니다. 또한 파킨슨병 환자로부터 분리된 단핵구는 혈관 확장을 통해 PD 관련 단백질인 LRRK2를 비PD 개인에 비해 더 높은 수준으로 발현합니다.[79] 또한 IL-6와 같은 높은 수준의 친염증성 사이토카인은 PD를 가진 사람들에게 흔히 발견되는 또 다른 단백질인 간에 의한 C-반응성 단백질의 생성으로 이어져 말초 염증을 증가시킬 수 있습니다.[80][81]
말초 염증은 PD와 연관성이 높은 신체 부위인 장-뇌 축에 영향을 미칠 수 있습니다. PD가 있는 사람들은 운동 문제가 발생하기 몇 년 전부터 장내 미생물과 대장 문제를 바꿨습니다.[80][81] 알파-시뉴클레인은 장에서 생성되며 미주신경을 통해 뇌간으로 이동한 다음 실질 니그라로 이동할 수 있습니다.[undue weight? ][better source needed][82]
진단.
의사의 초기 평가는 일반적으로 병력과 신경학적 검사를 기반으로 합니다.[15] 그들은 임상 진단 기준을 사용하여 운동 증상(가벼운 운동, 정지 떨림 등)을 평가합니다. 부검에서 중뇌에서 발견된 Lewy 시신은 대개 PD가 있었다는 최종 증거로 간주됩니다. 시간이 지남에 따라 질병의 임상 경과는 PD와 다를 수 있으므로 진단의 정확성을 확인하기 위해 주기적으로 프레젠테이션을 검토해야 합니다.[15][83]
파킨슨병이나 비슷하게 생긴 질환은 여러 가지 원인이 생길 수 있습니다. 뇌졸중, 특정 약물, 독소는 "2차 파킨슨병"을 유발할 수 있으므로 방문 중 평가가 필요합니다.[71][83] 진행성 초핵성 마비, 다발성 시스템 위축 등 파킨슨 플러스 증후군을 고려하고 적절히 배제하여 다른 치료 및 질병 진행을 시작해야 합니다(반파킨슨병 약물은 일반적으로 파킨슨 플러스 증후군의 증상 조절에 덜 효과적입니다).[15] 더 빠른 진행 속도, 초기 인지 기능 장애 또는 자세 불안정, 최소한의 떨림 또는 초기 대칭은 PD 자체보다는 파킨슨병을 나타낼 수 있습니다.[84]
의료 단체들은 특히 질병의 초기 단계에서 진단 과정을 쉽게 하고 표준화하기 위해 진단 기준을 만들었습니다. 가장 널리 알려진 기준은 영국 퀸 스퀘어 뇌 은행과 미국 국립 신경 장애 및 뇌졸중 연구소에서 나온 것입니다. Queen Square Brain Bank 기준은 움직임의 느림(bradykinesia)과 함께 경직, 정지 떨림 또는 자세의 불안정성을 요구합니다. 이러한 증상의 다른 가능한 원인은 배제되어야 합니다. 마지막으로, 발병 또는 진화 중에 세 가지 이상의 지원 증상이 필요합니다: 일방적인 발병, 정지 상태의 떨림, 시간의 진행, 운동 증상의 비대칭, 최소 5년 동안의 레보도파에 대한 반응, 최소 10년의 임상 경과 및 과도한 레보도파 섭취에 의해 유발된 운동 장애의 출현.[85] 전기화학적 피부 전도도를 통한 선운동 기능 평가는 자율성 장애 진단에 도움이 될 수 있습니다.[86]
PD 진단을 부검으로 확인했을 때, 운동장애 전문가는 초기 진단 시 79.6%의 정확도를, 추적 검사 시 진단을 정제한 후 83.9%의 정확도를 보이는 것으로 나타났습니다. 비전문가 위주로 시행하는 임상진단을 부검으로 확인했을 때 평균 정확도는 73.8%입니다. 전체적으로 PD 진단의 80.6%가 정확하고, 브레인 뱅크 기준을 이용한 진단의 82.7%가 정확합니다.[87]
이미징
PD가 있는 사람들의 컴퓨터 단층 촬영(CT) 스캔은 보통 정상으로 보입니다.[88] 자기공명영상은 시간이 지남에 따라 질병의 진단에 있어 더 정확해 졌으며, 특히 최소 3T의 자기장 강도에서 철에 민감한 T2* 및 민감도 가중 영상 시퀀스를 통해, 두 가지 모두 등외측 실질에 특징적인 'swallow 꼬리' 영상 패턴이 없음을 보여줄 수 있습니다. 메타 분석에서 이 패턴의 부재는 질병에 매우 민감하고 특이적이었습니다.[90] 메타 분석 결과, 뉴로멜라닌-MRI는 파킨슨병 환자를 건강한 피험자와 구별할 수 있는 것으로 나타났습니다.[91] 확산 MRI는 진단적 가치가 [92]아직 연구 중이지만 PD와 파킨슨병 이상 증후군, PD 운동 아형을 구별하는 데 잠재력을 보여주었습니다.[88] CT 및 MRI는 기저 신경절 종양 및 수두증과 같은 빈도가 낮은 개체뿐만 아니라 파킨슨증, 가장 일반적인 뇌염 및 만성 허혈성 모욕의 2차 원인이 될 수 있는 다른 질병을 배제하는 데 사용됩니다.[88]
기저 신경절에서 도파민 수송체의 대사 활성은 양전자 방출 단층 촬영과 단일 광자 방출 컴퓨터 단층 촬영 스캔으로 직접 측정할 수 있습니다. PD의 임상 진단과 높은 일치도를 보였습니다.[93] 기저 신경절의 도파민 관련 활동 감소는 약물로 인한 파킨슨증을 배제하는 데 도움이 될 수 있습니다. 이 소견은 비특이적이며 PD 및 파킨슨 플러스 장애 모두에서 볼 수 있습니다.[88] 미국에서 DaTSANs는 PD 또는 파킨슨 증후군과 본질적인 떨림을 구별하기 위해 FDA 승인을 받은 것에 불과합니다.[94]
요오드-123-meta-iodobenzylguanidine 심근 신티그래피는 PD 진단을 지원할 수 있는 심장 근육의 탈신경을 찾는 데 도움이 될 수 있습니다.[71]
감별진단
이차성 파킨슨병 – 파킨슨병의 여러 원인은 주의 깊은 병력, 신체 검사 및 적절한 영상 촬영을 통해 감별할 수 있습니다.[71][95] 다른 파킨슨 플러스 증후군은 비슷한 운동 증상을 보이지만 다양한 관련 증상을 가지고 있습니다. 이 중 일부는 시뉴클레오틴 병증이기도 합니다. 신체 치매는 인지 기능 장애가 조기에 시작되는 운동 증상과 운동 증상에 앞서 환각 증상을 수반합니다. 또는 여러 시스템 위축 또는 MSA는 일반적으로 자율 기능 장애(정위와 같은)의 조기 발병을 가지며, 자율 우세, 소뇌 증상 우세 또는 파킨슨병 우세를 가질 수 있습니다.[96]
다른 파킨슨 플러스 증후군은 알파-시뉴클린이 아닌 타우를 포함합니다. 진행성 초핵성마비(PSP)와 피질기저증후군(CBS)이 여기에 포함됩니다. PSP는 주로 경직, 조기 낙상, 구불구불한 증상 및 수직 시선 제한을 수반하며, 전방 측두부 치매 증상과 연관될 수 있습니다. CBS는 비대칭성 파킨슨증, 디스토니아증, 외계인 사지 및 근클론성 저킹을 포함합니다.[97] 프레젠테이션 일정 및 관련 증상은 유사한 운동 장애를 특발성 파킨슨병과 구별하는 데 도움이 될 수 있습니다.[medical citation needed]
혈관성 파킨슨병은 파킨슨병 증상이 혈관성 사건(뇌졸중 등)의 소견과 결합되어 나타나는 현상입니다. 도파민성 경로의 손상은 혈관성 파킨슨증과 특발성 PD 모두의 원인이 비슷하므로 유사한 증상을 보입니다. 침상 검사, 이력 평가, 영상 촬영 등 세심한 검사로 감별이 가능합니다.[98][99]
파킨슨 플러스 증후군 – 파킨슨 플러스 그룹의 일부로 간주될 수 있는 여러 질병은 피질 기저 증후군, 다발성 시스템 위축, 진행성 초핵성 마비, 그리고 Lewy 신체를 가진 치매를 포함합니다. 감별진단은 정밀한 병력과 신체검사(특히 특정 증상의 순차적인 발병, 질병의 진행, 치료에 대한 반응에 중점을 두어)로 좁혀질 수 있습니다.[100][95] 몇 가지 주요 증상:[14][95]
- 코르티코바살 증후군 – 레보도파 저항성, 근클론성, 디스토니아, 코르티코감각 상실, 무프락시아, 비유체성 실어증
- Lewy 신체를 동반한 치매 – 레보도파 저항성, 운동 증상 이전의 인지 우세, 요동치는 인지 증상 (시각적 환각은 이 질병에서 흔히 발생함)
- 본질적인 떨림 – 이것은 처음에는 파킨슨병처럼 보일 수 있지만 주요한 차별화 요소를 가지고 있습니다. 본질적인 떨림에서는 떨림이 작용하면서 악화되고(PD에서 호전됨), PD에서 다른 증상이 부족한 경우가 흔하며, 정상적인 DatSCAN이 보입니다.[95]
- 다발성 시스템 위축 – 레보도파 저항성, 급속 진행성, 자율 기능 부전, 스트리더, 현재 바빈스키 징후, 소뇌 운동 실조 및 특정 MRI 소견
- 진행성 초핵성 마비 – 레보도파 저항성, 제한적 수직 시선, 특정 MRI 소견 및 초기 및 다른 자세 장애
PD와 유사한 프레젠테이션을 가질 수 있는 다른 조건은 다음과 같습니다.[95][14]
예방
중년의 운동은 나중에 PD의 위험을 줄일 수 있습니다.[101] 카페인은 커피와 같은 카페인 음료를 더 많이 섭취하면 위험이 더 크게 감소하여 보호 효과가 있는 것으로 보입니다.[102]
비타민 C와 E 같은 항산화제가 질병을 예방하기 위해 제안되었지만, 연구 결과는 모순되어 긍정적인 효과는 나타나지 않았습니다.[46] 지방과 지방산에 관한 결과는 상반되었습니다.[46] 비스테로이드성 항염증제(NSAIDs) 및 칼슘 채널 차단제의 사용은 보호적일 수 있습니다.[4] 2010년 메타 분석에 따르면 NSAIDs는 (아스피린을 제외하고) PD 발병률의 최소 15%(장기 및 정기 사용자에서 더 높음) 감소와 관련이 있습니다.[103] 2019년[update] 현재 메타 분석에서는 이 연결을 확인하지 못했습니다. 여러 연구에서 이부프로펜 사용과 파킨슨 발병 위험 감소 사이의 연관성이 입증되었습니다.[104]
관리
파킨슨병에 대한 치료법은 알려져 있지 않습니다. 약물, 수술, 그리고 신체적 치료는 안도감을 제공하고, 한 사람의 삶의 질을 향상시킬 수 있으며, 알츠하이머병, 운동 뉴런증, 그리고 파킨슨-플러스 증후군과 같은 다른 신경 질환에 대한 치료보다 훨씬 더 효과적입니다.[105] 운동 증상 치료에 유용한 약물의 주요 계열은 항상 도파 데카복실화효소 억제제와 COMT 억제제, 도파민 작용제 및 MAO-B 억제제와 결합된 레보도파입니다. 질병의 단계와 질병 발병 연령은 어떤 그룹이 가장 유용한지를 결정합니다.[105]
PD의 브레이크 스테이징은 초기, 중기, 후기를 식별할 수 있는 6단계를 사용합니다.[106] 일부 장애가 이미 발생하여 약물 치료가 필요한 초기 단계는 레보도파 사용과 관련된 합병증의 발생과 관련된 후기 단계와 도파민 결핍 또는 레보도파 치료와 관련 없는 증상이 우세할 수 있는 세 번째 단계가 뒤따릅니다.[106]
첫 번째 단계의 치료는 증상 조절과 치료 부작용 사이의 최적의 균형을 목표로 합니다. 레보도파 치료 시작은 레보도파 사용으로 인한 합병증 발생을 지연시키기 위해 MAO-B 억제제와 도파민 작용제와 같은 다른 약물을 사용함으로써 처음에 연기될 수 있습니다.[107] 레보도파는 여전히 PD의 운동 증상에 가장 효과적인 치료법이며 삶의 질이 손상된 사람들에게 치료는 신속해야 합니다. 레보도파 관련 운동 장애는 레보도파 치료 기간보다 질병의 지속 기간 및 중증도와 더 강한 상관관계가 있습니다.[108]
이후 단계에서는 PD 증상을 줄이는 동시에 약물 효과의 변동을 제어하는 것이 목표입니다. 갑작스러운 약물 복용 중단이나 약물 과다 복용을 관리해야 합니다.[107] 경구 약물이 증상 조절에 부적절할 때 수술(심뇌자극 또는 고강도 집속 초음파[109]), 피하 각성일 아포모르핀 주입, 장내 도파 펌프가 유용할 수 있습니다.[110] 말기 PD는 특히 우울증, 기립성 저혈압, 방광 기능 장애 및 발기 장애를 포함한 다양한 치료를 요구하는 문제를 제시합니다.[110] 질병의 마지막 단계에서는 사람의 삶의 질을 향상시키기 위해 완화 의료가 제공됩니다.[111]
2020년 코크란 리뷰는 인지 훈련이 파킨슨병, 치매 또는 경도 인지 장애를 가진 사람들에게 도움이 된다는 확실한 증거를 발견하지 못했습니다.[112] 이 연구 결과는 7개 연구의 낮은 확실성 증거에 기초하고 있습니다.
PD 관련 불안에 대한 표준 치료법은 존재하지 않습니다.[35][page needed]
의약품

레보도파
레보도파는 파킨슨병을 치료할 때 보통 가장 먼저 선택하는 약물로 1980년대 이후 가장 널리 사용된 PD 치료제입니다.[107][113] PD의 운동 증상은 뇌 기저 신경절의 도파민 생성 감소의 결과입니다. 도파민은 혈액-뇌 장벽을 통과하지 못하므로 뇌의 고갈된 도파민 수치를 증가시키는 약으로 복용할 수 없습니다. 도파민의 전구체인 레보도파는 뇌로 전달되어 도파민으로 쉽게 전환됩니다. 레보도파의 투여는 PD의 운동 증상을 일시적으로 감소시킵니다.
레보도파의 5-10%만이 혈액-뇌 장벽을 통과합니다. 나머지 대부분은 신체의 다른 곳에서 도파민으로 대사되어 메스꺼움, 구토, 기립성 저혈압 등 다양한 부작용을 일으킵니다.[114] 카비도파와 벤세라지드는 도파 데카복실화효소 억제제로 혈액-뇌 장벽을 넘지 못하고 레보도파가 뇌 밖 도파민으로 전환되는 것을 억제해 부작용을 줄이고 레보도파의 뇌 통과 가능성을 높여줍니다. 이 약들 중 하나는 보통 레보도파와 함께 복용되며 같은 알약에 레보도파와 함께 사용할 수 있습니다.[115]
레보도파의 장기간 사용은 비자발적인 움직임(운동장애) 및 약물의 영향 변동과 같은 합병증의 발생과 관련이 있습니다.[107] 변동이 발생하면 약물에 대한 반응이 좋고 PD 증상이 감소하는 단계("on state")와 약물에 대한 반응이 좋지 않고 PD 증상이 증가하는 단계("off state")[107][116]를 순환할 수 있습니다. 저용량의 레보도파를 사용하면 이러한 레보도파 유발 합병증의 위험과 심각성을 줄일 수 있습니다.[117] 레보도파 관련 운동 장애와 변동을 줄이기 위한 "약물 휴일"이라고 불리는 이전의 전략은 신경성 악성 증후군과 같은 위험한 부작용을 가져올 수 있고 억제되는 [113]레보도파 약물을 한동안 중단하는 것이었습니다.[107] PD가 있는 대부분의 사람들은 결국 레보도파가 필요하고 나중에 레보도파로 인한 변동과 운동 장애가 생깁니다.[107] 운동 장애를 포함한 레보도파의 부작용은 질병에 영향을 받는 사람들과 때로는 그들의 의료 전문가가 치료를 지연시키는 데 잘못 영향을 미칠 수 있으며, 이는 최적의 결과를 얻을 수 있는 잠재력을 감소시킵니다.[medical citation needed]
레보도파는 경구, 흡입 및 주입 형태로 제공되며, 경구 레보도파 요법이 "오프" 기간이 길어지는 시점에 도달했을 때 흡입 레보도파를 사용할 수 있습니다.[118][119]
COMT 억제제

PD 과정에서 영향을 받은 사람들은 레보도파를 투여한 후 다음 투여 직전에 증상이 재발하는 마모 현상을 경험할 수 있습니다.[71] Catechol-O-methyltransferase (COMT)는 혈액-뇌 장벽을 통과하기 전에 레보도파를 분해하는 단백질이며 COMT 억제제는 더 많은 레보도파가 교차할 수 있도록 합니다.[121] 일반적으로 후기 증상 관리에 사용되지만, 운동 증상으로 착용 오프 현상을 겪을 때 레보도파/카비도파와 함께 사용할 수 있습니다.[71][113]
성인의 PD 및 복용량 종료 운동 변동을 치료하기 위해 세 가지 COMT 억제제(opicapone, entacapone, tolcapone)가 사용됩니다.[71] 톨카폰은 사용할 수 있었지만 간 기능 모니터링이 필요한 간 손상 합병증으로 인해 그 유용성이 제한됩니다.[122][71][121][14] 엔타카폰과 오피카폰은 간 기능에 거의 변화를 주지 않습니다.[121][123][124] 엔타카폰의 허가된 제제에는 엔타카폰 단독 또는 카르비도파 및 레보도파와 함께 함유되어 있습니다.[125][14][126] 오피카폰은 1일 1회 COMT 억제제입니다.[127][71]
도파민 작용제
뇌의 도파민 수용체와 결합하는 도파민 작용제는 레보도파와 비슷한 효과를 가지고 있습니다.[107] 이들은 처음에는 레보도파 합병증(온오프 변동 및 운동 장애)을 경험하는 개인을 위한 레보도파 보완 요법으로 사용되었으며, 주로 레보도파 치료의 시작을 지연시켜 레보도파 합병증의 시작을 지연시키기 위한 목적으로 PD의 운동 증상에 대한 첫 번째 요법으로 자체적으로 사용됩니다.[107][128] 도파민 작용제에는 브로모크립틴, 퍼골라이드, 프라미펙솔, 로피니롤, 피리베딜, 카베르골린, 아포모르핀, 리수라이드 등이 있습니다.
도파민 작용제는 PD 운동 증상을 조절하는 데 레보도파보다 효과가 적지만 치료 첫 해에 이러한 증상을 관리할 수 있을 정도로 효과적입니다.[10] 도파민 작용제로 인한 운동장애는 PD가 있는 젊은 층에서는 드물지만 다른 합병증과 함께 시작 시 나이가 많을수록 더 흔해집니다.[10] 따라서 도파민 작용제는 젊은 발병 PD가 선호하는 초기 치료제이며 레보도파는 나이가 많은 발병 PD가 선호합니다.[10]
도파민 작용제는 졸음, 환각, 불면증, 메스꺼움, 변비 등의 부작용을 일으킵니다.[107][113] 부작용은 최소 임상적으로 유효한 용량으로 나타나 의사가 다른 약물을 검색할 이유를 제공합니다.[107] 진통제는 다른 항파킨슨 약물보다 충동조절 장애(성 활동 증가, 식사, 도박, 쇼핑 등)와 더 강하게 연관되어 있습니다.[129][113]
도파민 작용제인 아포모르핀은 후기 PD에서 주기 및 운동 장애를 줄이는 데 사용될 수 있습니다.[107] 간헐적인 주사나 지속적인 피하주사로만 투여합니다.[107] 혼동, 환각 등의 2차적인 효과가 흔히 나타나므로 아포모르핀 치료를 받는 사람은 주의 깊게 관찰해야 합니다.[107] 피부 패치를 통해 투여되는 두 가지 도파민 작용제(리수라이드 및 로티고틴)는 초기 단계의 사람들에게 유용하며, 진행된 상태의 사람들을 통제하는 데 유용합니다.[130][page needed] 에르고트 유래 도파민 작용제(브로모크립틴, 카베르골린, 디하이드로에르고크립틴, 리수라이드, 퍼골라이드)를 사용하면 심장 섬유화 위험이 증가하므로 레보도파에 대한 보조 요법만 고려해야 합니다.[113]
MAO-B 억제제
MAO-B 억제제(safinamide, selegiline, rasagiline)는 도파민을 분해하는 효소인 모노아민 산화효소 B의 활성을 억제하여 기저 신경절의 도파민 양을 증가시킵니다.[107] 레보도파와 함께 사용하면 운동 증상을 완화하는 데 도움이 되는 것으로 밝혀졌습니다. 레보도파와 함께 사용하면 오프 단계에서 보내는 시간이 줄어듭니다.[131][113] 셀레길린은 레보도파 시작의 필요성을 지연시키는 것으로 나타났으며, 이는 신경을 보호하고 질병의 진행을 늦출 수 있음을 시사합니다.[132] 초기 연구에 따르면 레보도파와 함께 셀레길린이 사망 위험을 증가시키는 것으로 나타났지만, 이는 반박되었습니다.[133]
일반적인 부작용으로는 메스꺼움, 현기증, 불면증, 졸림, (셀레길린과 라사길린에서) 기립성 저혈압이 있습니다.[132][71] MAO-B는 세로토닌을 증가시키고 세로토닌 증후군으로 알려진 잠재적인 위험한 상태를 유발하는 것으로 알려져 있습니다.[132]
기타약물
아만타딘과 같은 다른 약물은 운동 증상의 치료로 유용할 수 있지만 사용에 대한 근거가 부족합니다.[107][134] 항콜린제는 운동 장애나 운동 장애에 사용해서는 안 되지만 국소적으로 침 흘리기에 대해 고려될 수 있습니다.[113] 운동 기능과 관련된 증상을 넘어 다양한 범위의 증상을 약학적으로 치료할 수 있습니다.[135] 정신병에는 케티아핀이나 클로자핀을, 치매에는 콜린에스테라제 억제제나 메만틴을, 낮에 과도한 졸음에는 모다피닐을 사용하는 것이 그 예입니다.[135][136][113] 2016년 피마반세린은 PD 정신병 관리를 위해 허가를 받았습니다.[137] 독세핀과 라사글린은 PD의 신체적 피로를 감소시킬 수 있습니다.[138]
수술.

운동 증상을 수술로 치료하는 것이 한때 일반적인 관행이었지만 레보도파의 발견으로 시술의 양이 줄었습니다.[139] 연구를 통해 수술 기법이 크게 개선되었기 때문에 더 이상 약물 치료가 충분하지 않은 진행성 PD를 가진 사람들에게 수술을 사용할 수 있습니다.[139] PD에 대한 수술은 크게 병변과 뇌심부자극(DBS) 두 그룹으로 나눌 수 있습니다. DBS 또는 병변의 표적 부위는 시상, 회맹부 또는 시상하핵을 포함합니다.[139] DBS는 뇌의 특정 부분에 전기 자극을 보내는 신경 자극기라고 불리는 의료 기기의 이식을 포함합니다. DBS는 약물에 의해 운동 변동과 떨림이 적절히 조절되지 않는 PD가 있는 사람 또는 심각한 신경정신과적 문제가 없는 약물에 내성이 없는 사람에게 권장됩니다.[140] 다른 덜 일반적인 수술 요법은 특정 피질하 부위의 과잉 활동을 억제하기 위해 의도적으로 병변을 형성하는 것을 포함합니다. 예를 들어, 개복술은 운동 장애를 조절하기 위해 개복근을 외과적으로 파괴하는 것을 포함합니다.[139]
PD에서 신경 자극기로 뇌의 4개 영역을 치료했습니다.[141] 이것들은 팔리두스 인테나, 시상하부, 시상하부 핵, 그리고 봉와직핵입니다. 팔리두스 인테나의 DBS는 운동 기능을 향상시키는 반면, 탈골 DBS의 DBS는 떨림을 개선시키지만 서맥 운동이나 경직에는 거의 영향을 주지 않습니다. 시상하부 핵의 DBS는 우울증이나 신경 인지 장애의 병력이 있는 경우 일반적으로 피합니다. 시상하핵의 DBS는 약물 감소와 관련이 있습니다. Pedunculopontine nucleus DBS는 현재 실험 상태로 남아 있습니다. 일반적으로 DBS는 운동 점수 평가에서 30-60% 향상과 관련이 있습니다.[141]
재활
PD가 있는 사람들에게는 운동 프로그램이 권장됩니다.[101] 몇몇 증거들은 비록 연구가 부족하고 품질이 낮지만, 언어나 이동성 문제가 재활로 개선될 수 있다는 것을 보여줍니다.[142][143] 물리치료를 받거나 하지 않는 규칙적인 신체 운동은 이동성, 유연성, 힘, 걸음걸이 속도, 삶의 질을 유지하고 향상시키는 데 도움이 될 수 있습니다.[143] 물리치료사의 지도하에 운동프로그램을 실시하였을 때, 가정에서 자가지도 운동프로그램에 비해 운동증상, 정신·정서적 기능, 일상생활활동, 삶의 질 등에서 더 많은 향상이 발생합니다.[144] 임상 운동은 파킨슨병 환자의 전반적인 복지를 목표로 하는 효과적인 중재가 될 수 있습니다. 운동 기능의 향상과 우울증이 발생할 수 있습니다.[145]
경직을 경험하는 사람들의 유연성과 운동 범위를 향상시키는 데 있어 부드러운 흔들기와 같은 일반화된 이완 기술이 과도한 근육 긴장을 감소시키는 것으로 밝혀졌습니다. 이완을 촉진하는 다른 효과적인 기술로는 사지와 몸통의 느린 회전 움직임, 리듬 개시, 횡경막 호흡, 명상 기술 등이 있습니다.[146] 보행과 저혈압, 셔플링, 팔 스윙 감소와 같은 질병과 관련된 문제를 해결하기 위해 물리치료사는 기능적 이동성과 안전성을 향상시키기 위한 다양한 전략을 가지고 있습니다. 재활 프로그램 중 보행과 관련된 관심 분야는 보행 속도, 지지 기반, 보폭 길이, 몸통과 팔을 흔드는 움직임을 개선하는 데 중점을 둡니다. 전략에는 보조 장비 사용(폴 워킹 및 트레드밀 워킹), 언어 큐잉(수동, 시각 및 청각), 운동(행진 및 PNF 패턴), 환경 변경(표면, 입력, 개방 대 폐쇄)이 포함됩니다.[147] 강화 운동은 원발성 근력 약화와 경증에서 중등증의 PD와 관련된 운동 기능의 개선을 보여주었지만, 보고에 따르면 힘과 약을 복용한 시간 사이의 상호작용이 있습니다. 따라서 PD가 있는 사람은 능력이 있을 때 약물 복용 후 45분에서 1시간 정도 운동을 해야 합니다.[148] 깊은 횡경막 호흡 운동은 흉부-벽 이동성을 개선하고 고급 PD에서 전방 유연 자세 및 호흡 기능 장애에 의해 감소된 활력 용량을 개선하는 데 도움이 됩니다.[149] 운동은 변비를 개선시킬 수 있습니다.[40] PD에서 운동이 신체적 피로를 감소시키는지 여부는 불분명합니다.[138]
근력 운동은 PD가 있는 사람들이 수동 퍼티로 운동한 후 수동 손재주를 증가시키는 것으로 나타났습니다. 손재주와 힘이 모두 향상되면 파킨슨병 환자에게 긍정적인 영향을 미칠 수 있어 물건을 잡아야 하는 일상 활동에서 독립성을 높일 수 있습니다.[150]
LSVT(Lee Silverman voice treatment)는 PD와 관련된 언어 장애에 대한 가장 널리 사용되는 치료법 중 하나입니다.[142][151] 언어 치료, 특히 LSVT는 언어를 향상시킬 수 있습니다.[142] 작업 치료(OT)는 질병을 가진 사람들이 일상 생활 활동의 많은 부분에 참여할 수 있도록 도와줌으로써 건강과 삶의 질을 증진시키는 것을 목표로 합니다.[142] OT의 효과에 대한 연구는 거의 수행되지 않았으며, 치료 기간 동안 운동 기술과 삶의 질을 향상시킬 수 있다는 일부 징후가 있지만 품질이 좋지 않습니다.[142][152]
완화의료
완화의료의 목표는 질병의 증상과 스트레스를 완화함으로써 환자와 가족 모두의 삶의 질을 향상시키는 것입니다.[153] 파킨슨병은 치료가 불가능하기 때문에 치료는 감소 속도를 늦추고 삶의 질을 개선하는 데 초점을 맞추고 있으므로 완화적입니다.[154]
완화 의료는 질병 과정에서 나중이 아니라 더 일찍 참여해야 합니다.[155][156] 완화의료 전문가는 신체적 증상, 기능 상실 및 일자리 상실과 같은 정서적 요인, 우울증, 두려움 및 실존적 우려에 대해 도움을 줄 수 있습니다.[155][156][157]
완화의료는 환자와 가족 모두에게 정서적인 지원을 제공하는 것과 함께 치료의 목표를 다룹니다. PD가 있는 사람은 수유 튜브, 비침습적 인공호흡기 또는 기관절개술, 심폐소생술에 대한 희망 또는 반대, 호스피스 관리 사용 시기 등 질병이 진행됨에 따라 결정하기 어려울 수 있습니다.[154] 완화의료팀 구성원은 PD와 함께 이러한 복잡하고 감정적인 주제에 대한 질문에 답하고 사람들이 가치에 기반한 의사결정을 할 수 있도록 안내하는 데 도움을 줄 수 있습니다.[156][158]
소화과정을 조절하는 근육과 신경이 PD에 의해 영향을 받아 변비와 위마비(위 내용물의 장기간 비움)가 발생할 수 있습니다.[40] 주기적인 영양 평가를 기반으로 하는 균형 잡힌 식단이 권장되며 체중 감소나 체중 증가를 피하고 위장 기능 장애의 결과를 최소화하도록 설계되어야 합니다.[40] 질병이 진행됨에 따라 삼킴 곤란(dysphagia)이 나타날 수 있습니다. 액체 섭취 시 증점제를 사용하고 음식을 먹을 때는 바른 자세를 취하는 것이 유용할 수 있습니다. 두 가지 방법 모두 질식 위험을 줄입니다. 위루술은 음식을 위로 직접 배달하는 데 사용할 수 있습니다.[40]
레보도파와 단백질은 장과 혈액-뇌 장벽에서 동일한 수송 시스템을 사용하여 접근 경쟁을 합니다.[40] 이들을 함께 복용하면 약물의 효과가 감소합니다.[40] 따라서 레보도파를 도입하면 균형 잡힌 지중해식 식단을 선호하기 위해 과도한 단백질 섭취를 억제합니다. 진행 단계에서는 비슷한 이유로 빵이나 파스타 등 저단백 제품을 추가로 섭취하는 것이 좋습니다.[40] 단백질과의 상호작용을 최소화하기 위해 레보도파는 식사 30분 전에 복용해야 합니다.[40] 동시에 PD를 위한 요법은 아침과 점심 동안 단백질을 제한하여 저녁에 단백질을 섭취할 수 있습니다.[40]
예후
PD는 항상 시간에 따라 진행됩니다. 통합 파킨슨병 등급 척도(UPDRS)는 임상 연구에서 가장 일반적으로 사용되는 척도입니다. MDS-UPDRS로 알려진 수정된 버전도 사용됩니다. 호엔과 야흐르 척도(원래 1967년에 발표됨)로 알려진 오래된 스케일링 방법과 수정된 호엔과 야흐르 척도로 알려진 유사한 척도가 사용되었습니다. 호엔과 야흐르 척도는 다섯 가지 기본 진행 단계를 정의합니다.
운동 증상은 질병의 초기에 공격적으로 진행되고 이후에 더 천천히 진행될 수 있습니다. 치료를 받지 않으면 평균 8년 후에는 독립적인 보행 능력을 잃고 10년 후에는 병상에 누울 것으로 예상됩니다. 약물치료로 운동 증상의 예후가 좋아졌습니다. 레보도파를 복용하는 사람들의 경우, 증상의 진행 시간이 간병인으로부터 의존도가 높은 단계로 15년 이상 걸릴 수 있습니다. 질병이 주어진 개인에게 어떤 경로를 택할지 예측하는 것은 어렵습니다.[159] 나이는 질병 진행의 적절한 예측 변수입니다. 진단 당시 장애가 적은 사람일수록 운동 저하율이 큰 반면, 증상이 시작된 70세 이상에서는 인지 장애가 더 자주 발생합니다.[74]
2023년 현재 PD 진행과 PD 장애 전체 간의 밀접한 상관관계는 발견되지 않았습니다. 그러나 초기 PD 장애는 주로 운동 증상과 관련이 있는 반면, 후기 단계에서는 주로 질병의 비운동 증상과 관련이 있는 경우가 많습니다. 이러한 후자의 증상을 어느 정도 개선하거나 완화할 수 있는 치료법이 존재합니다.[74] [159] 질병이 진행됨에 따라 장애는 약물로 통제할 수 없는 운동 증상(연하 및 관절 장애, 걸음걸이 및 균형 문제 등)과 레보도파 사용 5년 후 최대 50%의 개인에게 나타나는 레보도파 유발 합병증과 더 관련이 있습니다. 마지막으로, 이 병을 앓고 있는 대부분의 사람들은 10년 후 자율 장애, 수면 문제, 기분 변화 및 인지 기능 저하를 겪습니다. 이러한 증상, 특히 인지 기능 저하는 장애를 크게 증가시킵니다.[74][159]
PD가 있는 사람들의 수명이 줄어듭니다. 사망률은 영향을 받지 않은 사람들의 사망률의 약 두 배입니다. 인지기능 저하와 치매, 발병 시 노환, 질병의 진행 상태, 삼킴 문제의 유무 등이 모두 사망 위험 요소입니다. 그러나 경직성이 아닌 떨림이 주된 특징인 질병 패턴은 생존율 향상을 예측합니다. 흡인성 폐렴으로 인한 사망은 건강한 집단보다 PD가 있는 개인에서 두 배 더 흔합니다.[159]
2016년에 PD는 전 세계적으로 약 21만 1천 명의 사망자를 냈으며, 이는 1990년 이후 161% 증가한 수치입니다.[160] 그 기간 전체 사망률은 인구 10만 명당 1.81명으로 19% 증가했습니다.[160]
PD가 있는 사람은 일반인에 비해 치매 위험이 2~6배 정도 높습니다.[15][28] PD가 있는 사람의 78%가 파킨슨병 치매를 앓고 있습니다.[161] 치매는 PD와 그 보호자의 삶의 질 저하, 사망률 증가, 요양원 관리가 필요할 확률 증가와 관련이 있습니다.[28]
역학
이 문서의 일부(이 하위 섹션과 관련된 부분)를 업데이트해야 합니다. (2023년 11월) |
PD는 두 번째로 흔한 신경퇴행성 질환으로 전 세계적으로 약 6백만 명에게 영향을 미칩니다.[45] 파킨슨병은 2021년 기준으로 사망률과 유병률 모두에서 전 세계적으로 가장 빠르게 증가하는 신경퇴행성 질환이었습니다.[55] 특정 시간에 인구가 차지하는 비율은 선진국에서 약 0.3%입니다. PD는 노인에게 더 흔하며 60세 이상에서 1%에서 80세 이상 인구의 4%로 비율이 증가합니다.[46][162] 20세에서 50세 사이에 시작되는 5-10%는 젊은 발병 PD로 분류되지만 평균 발병 연령은 약 60세입니다.[10] 수컷은 암컷에 비해 약 3:2의 비율로 영향을 받습니다.[4] PD는 아프리카 및 아시아 혈통(남아시아 포함)에서 덜 널리 퍼질 수 있지만, 이 발견은 논란의 여지가 있습니다.[46] PD의 연간 신규 진단 수는 10만 명당 8~18명입니다.[46]
중국은 2030년에 전 세계 파킨슨병 인구의 거의 절반을 차지할 것으로 예측됩니다.[163] 2040년까지 환자 수는 약 1,400만 명으로 증가할 것으로 예상되며, 이 성장은 파킨슨병(Parkin's Pandemic)이라고 불립니다.[164]
치매의 유병률은 나이가 들수록, 그리고 질병의 지속 기간이 짧을수록 증가합니다.[165]
역사
이집트의 파피루스, 아유르베다 의학 논문, 성경, 갈렌의 글을 포함한 초기 자료는 PD와 유사한 증상을 설명합니다.[168] Galen 이후에는 17세기까지 PD와 관련된 언급이 명확하게 나타나지 않습니다.[168] 17세기와 18세기에, 프랑시스쿠스 실비우스, 히에로니무스 다비드 가비우스, 존 헌터, 오귀스트 프랑수아 초멜은 그 병의 요소들에 대해 썼습니다.[168][169][170]
1817년, 제임스 파킨슨은 여섯 명의 중풍 환자들을 보고하는 그의 에세이를 출판했습니다.[171] 흔들리는 팔시에 대한 에세이는 특징적인 휴식 떨림, 비정상적인 자세와 걸음걸이, 마비와 근력 저하, 그리고 시간이 지남에 따라 질병이 진행되는 방식에 대해 설명했습니다.[172][173] 이 질병에 대한 지식에 더 많은 기여를 한 초기 신경학자들은 1868년과 1881년 사이에 이 질병에 대한 이해를 높인 트루소, 고워스, 키니에 윌슨과 에르브, 그리고 장-마틴 샤르코를 포함합니다.[171] Charcot은 다른 발전들 중에서도 강성, 약점 그리고 서맥 운동을 구별했습니다.[171] 그는 제임스 파킨슨을 기리기 위해 그 병의 이름을 바꾸는 것을 지지했습니다.[171]
1912년에 프레데릭 루이는 영향을 받은 뇌의 미세한 입자를 기술했고, 나중에 루이의 몸이라고 이름 지었습니다.[171] 1919년 콘스탄틴 트레티아코프(Constantin Tretiakoff)는 흑질이 영향을 받는 주요 대뇌 구조라고 보고했지만, 이 발견은 1938년 롤프 하슬러(Rolf Hassler)에 의해 발표된 추가 연구에 의해 확인될 때까지 거부되었습니다.[171] 뇌의 근본적인 생화학적 변화는 1950년대에 주로 신경전달물질 도파민에 대한 Arvid Carlsson의 연구와 PD에 대한 역할에 대한 Oleh Hornykiewicz의 연구로 인해 확인되었습니다.[174] 1997년, 알파-시뉴클레인은 스필란티니, 트로이노스키, 괴데르트 등에 의해 레위 몸체의 주성분으로 밝혀졌습니다.[73]
레보도파가 오기 전까지 항콜린제와 수술(피질척추 경로의 병변 또는 기저 신경절 구조의 일부)이 유일한 치료법이었고, 이는 그들의 사용을 극적으로 줄였습니다.[169][175] 레보도파는 1911년 카시미르 펑크(Casimir Funk)에 의해 처음으로 합성되었지만 20세기 중반까지 거의 주목을 받지 못했습니다.[174] 1967년 임상에 진입하여 PD 관리에 혁명을 가져왔습니다.[174][176] 1980년대 후반 프랑스 그르노블의 Alim Louis Benabid와 동료들이 도입한 뇌심부자극술이 가능한 치료법으로 등장했습니다.[177]
윌리엄 리차드 고워스에 의한 진행성 파킨슨병의 한 예는 1886년에 알버트 론드의 것으로 추정되는 1879개의 사진들을 바탕으로 한 신경계의 질병 매뉴얼에 출판되었습니다.[166][167] 심각도 수준의 다양성을 나타내기 위해 2020년에 새로운 이미지가 만들어졌습니다.[178][179]
사회와 문화
사회적 영향
PD가 있는 일부 사람들에게 가면을 쓴 표정과 감정의 표정을 조절하거나 다른 사람의 표정을 인식하는 데 어려움이 사회 복지에 영향을 미칠 수 있습니다.[27] 상태가 진행됨에 따라 떨림, 기타 운동 증상, 의사소통의 어려움 또는 이동성 문제가 사회적 참여를 방해하여 PD를 가진 사람들이 고립감을 느낄 수 있습니다.[180] 떨림, 환각, 흐린 말투, 균형이 맞지 않는 등 PD 증상에 대한 대중의 인식과 인식이 일부 국가에서는 부족하고 낙인으로 이어질 수 있습니다.[180]
비용.
이 문서의 일부(이 하위 섹션과 관련된 부분)를 업데이트해야 합니다. (2020년 8월) |
PD가 사회에 미치는 비용은 높은 편인데, 2007년에는 직접 비용의 가장 큰 부분이 입원 치료 및 요양 시설에서 발생한 반면, 의약품에서 발생한 비율은 훨씬 낮았습니다.[181] 생산성 저하와 간병인의 부담으로 간접 비용이 높습니다.[181] PD는 경제적 비용 외에도 질병을 앓고 있는 사람들과 그들을 돌보는 사람들의 삶의 질을 떨어뜨립니다.[181]
2017년 데이터를 기반으로 한 연구에서는 직접 의료비 254억 달러와 간접 및 비의료비 265억 달러를 포함하여 미국의 경제 PD 부담을 519억 달러로 추정했습니다. 예상되는 총 경제적 부담은 2037년까지 790억 달러를 초과합니다. 이러한 연구 결과는 PD의 발병률을 줄이고, 질병 진행을 지연시키며, PD의 미래 경제적 부담을 감소시킬 수 있는 증상 부담을 완화하기 위한 개입의 필요성을 강조합니다.[182]
옹호

4월 11일 제임스 파킨슨의 생일이 세계 파킨슨의 날로 지정되었습니다.[171] 붉은 튤립은 2005년 이 병의 상징으로 국제 기구들에 의해 선정되었습니다; 그것은 네덜란드의 원예학자에 의해 1981년에 등록된 '제임스 파킨슨' 튤립 품종을 나타냅니다.[183]
옹호 단체로는 1982년부터 1억 8천만 달러 이상의 치료, 연구, 지원 서비스를 제공한 국립 파킨슨 재단, 파킨슨 [184]병 재단, 1957년 윌리엄 블랙이 설립한 이래 1억 1천 5백만 달러 이상의 연구비와 거의 5천만 달러에 가까운 교육 및 옹호 프로그램을 배포했습니다.[185][186][188] 1961년 설립된 미국 파킨슨병 협회,[187] 1992년 설립된 유럽 파킨슨병 협회입니다.
주목할 만한 사례

21세기에 들어, 파킨슨 병에 대한 대중의 이해가 높아졌습니다.[189]
배우 마이클 J. 폭스(Michael J. Fox)는 29세에 PD 진단을 받았고,[190] 그의 진단을 질병에 대한 인식을 높이기 위해 사용했습니다.[191] 이 질병의 영향을 설명하기 위해, 폭스는 텔레비전 역할에 약물 없이, 그리고 약물 없이 미국 의회에 출석했습니다.[192] 그가 2000년에 설립한 마이클 J. 폭스 재단은 파킨슨병 연구를 위해 20억 달러 이상을 모았습니다.[193] 권투선수 무하마드 알리는 38살 때 PD 증세를 보였지만 42살까지 진단받지 못하고 '세계에서 가장 유명한 파킨슨 환자'로 불렸습니다.[194] 복싱과 관련된 PD나 파킨슨병이 있었는지는 아직 해결되지 않았습니다.[195][196] 40세에 파킨슨병을 진단받은 사이클 선수이자 올림픽 메달리스트인 데이비스 피니는 2004년에 PD 연구를 지원하기 위해 데이비스 피니 재단을 설립했습니다.[197][198] 중국의 가장 중요한 지도자였던 덩샤오핑은 파킨슨병이 진행되었습니다.[199][200][201]
2014년 자살 당시 미국 배우이자 코미디언인 로빈 윌리엄스는 PD 진단을 [202]받았지만 부검 결과 루이 시신으로 치매가 밝혀져 정확한 진단에 어려움이 있었습니다.[202][203][204][205][206]
임상연구
이 문서의 일부(이 하위 섹션과 관련된 부분)를 업데이트해야 합니다. (2020년 7월) |

2022년[update] 현재 파킨슨병에는 질병을 변형시키는 약물(원인이나 손상을 표적으로 하는 약물)이 승인되지 않아 파킨슨병 연구의 주요 초점이 되고 있습니다.[207][208] 적극적인 연구 방향에는 질병의 새로운 동물 모델을 찾고 유전자 치료, 줄기세포 이식, 신경 보호제의 잠재적 유용성에 대한 연구가 포함됩니다.[209] 조기 진단을 돕기 위해 질병의 전구 바이오마커를 식별하기 위한 연구 기준이 수립되었습니다.[210]
유전자치료
유전자 치료는 일반적으로 비감염성 바이러스를[211] 사용하여 유전 물질을 뇌의 일부로 이동시키는 것을 포함합니다. 접근법은 손상을 방지하기 위한 성장 인자(GDNF 계열 성장 인자인 Neurturin)와 글루탐산 탈탄산효소(GABA를 생성하는 효소인 GAD), 티로신 하이드록실화효소(L-DOPA를 생성하는 효소인 COMT) 및 카테콜-O-메틸 전이효소(L-DOPA를 도파민으로 전환시키는 효소인 COMT)와 같은 효소의 발현을 포함합니다. 안전성에 대한 우려는 보고되지 않았지만 2상 임상시험에서 이 접근법은 크게 실패했습니다.[209] GAD의 납품은 2011년 2단계 시험에서 가능성을 보였으나, 모터 기능 개선에는 효과가 있었지만 DBS에 비해 열세였습니다. 동일한 코호트에서의 후속 연구는 지속적인 개선을 시사했습니다.[212]
신경보호치료
인간 면역 체계가 알파-시뉴클레인인 PD01A를 파괴하도록 프라이밍하는 백신이 임상 시험에 들어갔고 2020년 1상 보고서는 안전성과 내약성을 제시했습니다.[213][214] 2018년, 항체 PRX002/RG7935는 1단계 시험에서 2단계 시험까지 계속되는 것을 뒷받침하는 예비 안전성 증거를 보여주었습니다.[215]
세포 기반 치료법
다른 신경퇴행성 질환과 달리, 많은 파킨슨씨의 증상은 단일 세포 유형, 즉 중간엽 도파민 신경세포의 손실에 기인할 수 있습니다. 결과적으로, DA 뉴런 재생은 유망한 치료 접근법입니다.[216] 대부분의 초기 연구는 태아의 뇌 조직으로부터 DA 뉴런 전구체 세포를 생성하고자 하였지만,[217] 만능 줄기 세포, 특히 유도 만능 줄기 세포(iPSC)는 점점 더 대중적인 조직 공급원이 되었습니다.[218][219]
태아와 iPSC 유래 DA 뉴런 모두 임상시험에서 환자에게 이식되었습니다.[220][221] 일부 환자는 호전을 보이지만 결과는 매우 다양합니다. 이식된 조직에 의한 과도한 도파민 방출로 인해 발생하는 운동장애와 같은 부작용도 관찰되었습니다.[222][223]
제약
파킨슨병에 대한 아데노신 수용체(특히 A2A)의 길항제가 연구되었습니다.[224] 이 중 이스트레이드필린은 가장 성공적인 의약품으로 부상했으며 2019년 미국에서 의료용으로 허가를 받았습니다.[225] 레보도파/카비도파 체제에 대한 추가 치료제로 승인되었습니다.[225] LRRK2 키나제 억제제도 관심사입니다.[226]
참고문헌
인용
- ^ a b c d "Parkinson's Disease Information Page". NINDS. 30 June 2016. Retrieved 18 July 2016.
- ^ a b Sveinbjornsdottir S (October 2016). "The clinical symptoms of Parkinson's disease". Journal of Neurochemistry. 139 (Suppl 1): 318–324. doi:10.1111/jnc.13691. PMID 27401947.
- ^ Truong & Bidayasiri 2016, p. 188
- ^ a b c d e f Kalia LV, Lang AE (August 2015). "Parkinson's disease". Lancet. 386 (9996): 896–912. doi:10.1016/s0140-6736(14)61393-3. PMID 25904081. S2CID 5502904.
- ^ 페리 2010, 제 P장
- ^ Vos T, Allen C, Arora M, Barber RM, Bhutta ZA, Brown A, et al. (GBD 2015 Disease and Injury Incidence and Prevalence Collaborators) (October 2016). "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ^ Wang H, Naghavi M, Allen C, Barber RM, Bhutta ZA, Carter A, et al. (GBD 2015 Mortality and Causes of Death Collaborators) (October 2016). "Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1459–1544. doi:10.1016/s0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
- ^ Connie T, Aderinola TB, Ong TS, Goh MKO, Erfianto B, Purnama B (12 December 2022). "Pose-Based Gait Analysis for Diagnosis of Parkinson's Disease". Algorithms. MDPI AG. 15 (12): 474. doi:10.3390/a15120474. ISSN 1999-4893.
- ^ a b Tulisiak CT, Mercado G, Peelaerts W, Brundin L, Brundin P (2019). "Can infections trigger alpha-synucleinopathies?". Prog Mol Biol Transl Sci. Progress in Molecular Biology and Translational Science. 168: 299–322. doi:10.1016/bs.pmbts.2019.06.002. ISBN 9780128178744. PMC 6857718. PMID 31699323.
- ^ a b c d e f g Samii A, Nutt JG, Ransom BR (May 2004). "Parkinson's disease". Lancet. 363 (9423): 1783–1793. doi:10.1016/S0140-6736(04)16305-8. PMID 15172778. S2CID 35364322.
- ^ Levin J, Kurz A, Arzberger T, Giese A, Höglinger GU (February 2016). "The differential diagnosis and treatment of atypical parkinsonism". Dtsch Ärztebl Int (Review). 113 (5): 61–69. doi:10.3238/arztebl.2016.0061. PMC 4782269. PMID 26900156.
- ^ Kon T, Tomiyama M, Wakabayashi K (February 2020). "Neuropathology of Lewy body disease: Clinicopathological crosstalk between typical and atypical cases". Neuropathology. 40 (1): 30–39. doi:10.1111/neup.12597. PMID 31498507. S2CID 201983865.
- ^ Goedert M, Jakes R, Spillantini MG (2017). "The synucleinopathies: Twenty years on". J Parkinsons Dis (Review). 7 (s1): S51–S71. doi:10.3233/JPD-179005. PMC 5345650. PMID 28282814.
- ^ a b c d e f g 사이먼, 그린버그 & 아미노프 2017, 페이지 번호 필요.
- ^ a b c d e f g h i j k l m n o p q r s t u Jankovic J (April 2008). "Parkinson's disease: clinical features and diagnosis". Journal of Neurology, Neurosurgery, and Psychiatry. 79 (4): 368–376. doi:10.1136/jnnp.2007.131045. PMID 18344392. Archived from the original on 19 August 2015.
- ^ a b Winiker & Kertscher 2023, sec. "Introduction".
- ^
 이 문서에는 CC BY 4.0 라이센스에 따라 제공되는 이 소스의 텍스트가 포함되어 있습니다.[16]
이 문서에는 CC BY 4.0 라이센스에 따라 제공되는 이 소스의 텍스트가 포함되어 있습니다.[16] - ^
 이 문서에는 CC BY 4.0 라이센스에 따라 제공되는 이 소스의 텍스트가 포함되어 있습니다.[16]
이 문서에는 CC BY 4.0 라이센스에 따라 제공되는 이 소스의 텍스트가 포함되어 있습니다.[16] - ^ a b Cooper, Eichhorn & Rodnitzky 2008, pp. 508–512.
- ^ Lees AJ, Hardy J, Revesz T (June 2009). "Parkinson's disease". Lancet. 373 (9680): 2055–2066. doi:10.1016/S0140-6736(09)60492-X. PMID 19524782. S2CID 42608600.
- ^ Fung & Thompson 2007, pp. 504–513.
- ^ O'Sullivan & Schmitz 2007, 페이지 856–857.
- ^ Yao SC, Hart AD, Terzella MJ (May 2013). "An evidence-based osteopathic approach to Parkinson disease". Osteopathic Family Physician. 5 (3): 96–101. doi:10.1016/j.osfp.2013.01.003.
- ^ Hallett M, Poewe W (2008). Therapeutics of Parkinson's Disease and Other Movement Disorders. John Wiley & Sons. p. 417. ISBN 978-0-470-71400-3. Archived from the original on 8 September 2017.
- ^ Hoehn MM, Yahr MD (May 1967). "Parkinsonism: onset, progression and mortality". Neurology. 17 (5): 427–442. doi:10.1212/wnl.17.5.427. PMID 6067254.
- ^ Pahwa R, Lyons KE (2003). Handbook of Parkinson's Disease (Third ed.). CRC Press. p. 76. ISBN 978-0-203-91216-4. Archived from the original on 8 September 2017.
- ^ a b Prenger MTM, Madray R, Van Hedger K, Anello M, MacDonald PA (2020). "Social Symptoms of Parkinson's Disease". Parkinsons Dis. 2020: 8846544. doi:10.1155/2020/8846544. PMC 7790585. PMID 33489081.
- ^ a b c d e f g Caballol N, Martí MJ, Tolosa E (September 2007). "Cognitive dysfunction and dementia in Parkinson disease". Movement Disorders. 22 (Suppl 17): S358–S366. doi:10.1002/mds.21677. PMID 18175397. S2CID 3229727.
- ^ a b c Parker KL, Lamichhane D, Caetano MS, Narayanan NS (October 2013). "Executive dysfunction in Parkinson's disease and timing deficits". Frontiers in Integrative Neuroscience. 7: 75. doi:10.3389/fnint.2013.00075. PMC 3813949. PMID 24198770.
- ^ a b c d e f g h i Han JW, Ahn YD, Kim WS, Shin CM, Jeong SJ, Song YS, et al. (November 2018). "Psychiatric Manifestation in Patients with Parkinson's Disease". Journal of Korean Medical Science. 33 (47): e300. doi:10.3346/jkms.2018.33.e300. PMC 6236081. PMID 30450025.
- ^ Ffytche DH, Creese B, Politis M, Chaudhuri KR, Weintraub D, Ballard C, Aarsland D (February 2017). "The psychosis spectrum in Parkinson disease". Nature Reviews. Neurology. 13 (2): 81–95. doi:10.1038/nrneurol.2016.200. PMC 5656278. PMID 28106066.
- ^ Shergill SS, Walker Z, Le Katona C (October 1998). "A preliminary investigation of laterality in Parkinson's disease and susceptibility to psychosis". Journal of Neurology, Neurosurgery, and Psychiatry. 65 (4): 610–611. doi:10.1136/jnnp.65.4.610. PMC 2170290. PMID 9771806.
- ^ Friedman JH (November 2010). "Parkinson's disease psychosis 2010: a review article". Parkinsonism & Related Disorders. 16 (9): 553–560. doi:10.1016/j.parkreldis.2010.05.004. PMID 20538500.
- ^ a b c d Weintraub D, Mamikonyan E (September 2019). "The Neuropsychiatry of Parkinson Disease: A Perfect Storm". The American Journal of Geriatric Psychiatry. 27 (9): 998–1018. doi:10.1016/j.jagp.2019.03.002. PMC 7015280. PMID 31006550.
- ^ a b c Dissanayaka 2021, 139-156쪽.
- ^ a b Goetz CG (2010). "New developments in depression, anxiety, compulsiveness, and hallucinations in Parkinson's disease". Movement Disorders. 25 (S1): S104–S109. doi:10.1002/mds.22636. PMID 20187250. S2CID 35420377.
- ^ Husain M, Roiser JP (August 2018). "Neuroscience of apathy and anhedonia: a transdiagnostic approach". Nature Reviews. Neuroscience. 19 (8): 470–484. doi:10.1038/s41583-018-0029-9. PMID 29946157. S2CID 49428707.
- ^ Turner V, Husain M (2022). "Anhedonia in Neurodegenerative Diseases". Current Topics in Behavioral Neurosciences. 58: 255–277. doi:10.1007/7854_2022_352. ISBN 978-3-031-09682-2. PMID 35435648.
- ^ Noyce AJ, Bestwick JP, Silveira-Moriyama L, et al. (December 2012). "Meta-analysis of early nonmotor features and risk factors for Parkinson disease". Annals of Neurology (Review). 72 (6): 893–901. doi:10.1002/ana.23687. PMC 3556649. PMID 23071076.
- ^ a b c d e f g h i j Barichella M, Cereda E, Pezzoli G (October 2009). "Major nutritional issues in the management of Parkinson's disease". Movement Disorders. 24 (13): 1881–1892. doi:10.1002/mds.22705. hdl:2434/67795. PMID 19691125. S2CID 23528416.
- ^ Warnecke T, Schäfer KH, Claus I, Del Tredici K, Jost WH (March 2022). "Gastrointestinal involvement in Parkinson's disease: pathophysiology, diagnosis, and management". npj Parkinson's Disease. 8 (1): 31. doi:10.1038/s41531-022-00295-x. PMC 8948218. PMID 35332158.
- ^ a b c Skjærbæk C, Knudsen K, Horsager J, Borghammer P (January 2021). "Gastrointestinal Dysfunction in Parkinson's Disease". J Clin Med. 10 (3): 493. doi:10.3390/jcm10030493. PMC 7866791. PMID 33572547.
- ^ Kim YE, Jeon BS (1 January 2014). "Clinical implication of REM sleep behavior disorder in Parkinson's disease". Journal of Parkinson's Disease. 4 (2): 237–244. doi:10.3233/jpd-130293. PMID 24613864.
- ^ 패니커 2021, pp. 1~2. CITEREF 패니커 (
- ^ a b Toloda 2021, pp. 2. sfn CITEREFT 2021 (
- ^ a b c d e f g de Lau LM, Breteler MM (June 2006). "Epidemiology of Parkinson's disease". The Lancet. Neurology. 5 (6): 525–535. doi:10.1016/S1474-4422(06)70471-9. PMID 16713924. S2CID 39310242.
- ^ Toloda 2021, pp. . sfn CITEREFT 2021 (
- ^ Barreto GE, Iarkov A, Moran VE (January 2015). "Beneficial effects of nicotine, cotinine and its metabolites as potential agents for Parkinson's disease". Frontiers in Aging Neuroscience. 6: 340. doi:10.3389/fnagi.2014.00340. PMC 4288130. PMID 25620929.
- ^ De Miranda 2022, pp. 46. CITEREFde_Miranda (
- ^ a b c Lesage S, Brice A (April 2009). "Parkinson's disease: from monogenic forms to genetic susceptibility factors". Human Molecular Genetics. 18 (R1): R48–59. doi:10.1093/hmg/ddp012. PMID 19297401.
- ^ Deng H, Wang P, Jankovic J (March 2018). "The genetics of Parkinson disease". Ageing Research Reviews. 42: 72–85. doi:10.1016/j.arr.2017.12.007. PMID 29288112. S2CID 28246244.
- ^ a b Toloda 2021, pp. . sfn CITEREFT 2021 (
- ^ Blauwendraat 2019, pp. 1. CITEREF 2019 (
- ^ Polissidis 2020, pp. 2. CITEREF 2020 (
- ^ a b 패니커 2021, 페이지 1. 오류: CITEREF 패니커 (
- ^ a b Abugable AA, Morris JL, Palminha NM, et al. (September 2019). "DNA repair and neurological disease: From molecular understanding to the development of diagnostics and model organisms". DNA Repair. 81: 102669. doi:10.1016/j.dnarep.2019.102669. PMID 31331820.
- ^ Blauwendraat 2019, pp. 3. CITEREF 2019 (
- ^ Dorsey ER, Zafar M, Lettenberger SE, et al. (2023). "Trichloroethylene: An Invisible Cause of Parkinson's Disease?". J Parkinsons Dis. 13 (2): 203–218. doi:10.3233/JPD-225047. PMC 10041423. PMID 36938742.
- ^ a b Simon DK, Tanner CM, Brundin P (2020). "Parkinson Disease Epidemiology, Pathology, Genetics, and Pathophysiology". Clinical Geriatric Medicine. 36 (1): 1–12. doi:10.1016/j.cger.2019.08.002. PMC 6905381. PMID 31733690. S2CID 201961979.
- ^ Bjorklund G, Stejskal V, Urbina MA, Dadar M, Chirumbolo S, Mutter J (2018). "Metals and Parkinson's Disease: Mechanisms and Biochemical Processes" (PDF). Curr Med Chem. 25 (19): 2198–2214. doi:10.2174/0929867325666171129124616. PMID 29189118. S2CID 4648656.
- ^ Delic V, Beck KD, Pang KC, Citron BA (2020). "Biological links between traumatic brain injury and Parkinson's disease". Acta Neuropathologica Communications. 8 (1): 45. doi:10.1186/s40478-020-00924-7. PMC 7137235. PMID 32264976.
- ^ Langston JW (6 March 2017). "The MPTP Story". Journal of Parkinson's Disease. 7 (s1): S11–S19. doi:10.3233/JPD-179006. PMC 5345642. PMID 28282815.
- ^ Song L, Xu MB, Zhou XL, Zhang DP, Zhang SL, Zheng GQ (2017). "A Preclinical Systematic Review of Ginsenoside-Rg1 in Experimental Parkinson's Disease". Oxidative Medicine and Cellular Longevity. 2017: 2163053. doi:10.1155/2017/2163053. PMC 5366755. PMID 28386306.
- ^ Chahine LM, Stern MB, Chen-Plotkin A (January 2014). "Blood-based biomarkers for Parkinson's disease". Parkinsonism & Related Disorders. 20 (Suppl 1): S99–103. doi:10.1016/S1353-8020(13)70025-7. PMC 4070332. PMID 24262199.
- ^ Çamcı G, Oğuz S (April 2016). "Association between Parkinson's Disease and Helicobacter Pylori". Journal of Clinical Neurology. 12 (2): 147–150. doi:10.3988/jcn.2016.12.2.147. PMC 4828559. PMID 26932258.
- ^ McGee DJ, Lu XH, Disbrow EA (2018). "Stomaching the Possibility of a Pathogenic Role for Helicobacter pylori in Parkinson's Disease". Journal of Parkinson's Disease. 8 (3): 367–374. doi:10.3233/JPD-181327. PMC 6130334. PMID 29966206.
- ^ a b c Davie CA (2008). "A review of Parkinson's disease". British Medical Bulletin. 86 (1): 109–127. doi:10.1093/bmb/ldn013. PMID 18398010.
- ^ Villar-Piqué A, Lopes da Fonseca T, Outeiro TF (October 2016). "Structure, function and toxicity of alpha-synuclein: the Bermuda triangle in synucleinopathies". Journal of Neurochemistry. 139 (Suppl 1): 240–255. doi:10.1111/jnc.13249. PMID 26190401. S2CID 11420411.
- ^ Burré J, Sharma M, Südhof TC (March 2018). "Cell Biology and Pathophysiology of α-Synuclein". Cold Spring Harbor Perspectives in Medicine. 8 (3): a024091. doi:10.1101/cshperspect.a024091. PMC 5519445. PMID 28108534.
- ^ a b 딕슨 2007, 271-283쪽.
- ^ a b c d e f g h i j Armstrong MJ, Okun MS (February 2020). "Diagnosis and Treatment of Parkinson Disease: A Review". JAMA. 323 (6): 548–560. doi:10.1001/jama.2019.22360. PMID 32044947. S2CID 211079287.
- ^ a b c d e f Obeso JA, Rodríguez-Oroz MC, Benitez-Temino B, Blesa FJ, Guridi J, Marin C, Rodriguez M (2008). "Functional organization of the basal ganglia: therapeutic implications for Parkinson's disease". Movement Disorders. 23 (Suppl 3): S548–S559. doi:10.1002/mds.22062. PMID 18781672. S2CID 13186083.
- ^ a b c Schulz-Schaeffer WJ (August 2010). "The synaptic pathology of alpha-synuclein aggregation in dementia with Lewy bodies, Parkinson's disease and Parkinson's disease dementia". Acta Neuropathologica. 120 (2): 131–143. doi:10.1007/s00401-010-0711-0. PMC 2892607. PMID 20563819.
- ^ a b c d e Obeso JA, Rodriguez-Oroz MC, Goetz CG, et al. (June 2010). "Missing pieces in the Parkinson's disease puzzle". Nature Medicine. 16 (6): 653–661. doi:10.1038/nm.2165. PMID 20495568. S2CID 3146438.
- ^ Hirsch EC (December 2009). "Iron transport in Parkinson's disease". Parkinsonism & Related Disorders. 15 (Suppl 3): S209–S211. doi:10.1016/S1353-8020(09)70816-8. PMID 20082992.
- ^ Li X, Sundquist J, Sundquist K (23 December 2011). "Subsequent Risks of Parkinson Disease in Patients with Autoimmune and Related Disorders: A Nationwide Epidemiological Study from Sweden". Neurodegenerative Diseases. 10 (1–4): 277–284. doi:10.1159/000333222. ISSN 1660-2854. PMID 22205172. S2CID 39874367.
- ^ Lai SW, Lin CH, Lin HF, Lin CL, Lin CC, Liao KF (February 2017). "Herpes zoster correlates with increased risk of Parkinson's disease in older people: A population-based cohort study in Taiwan". Medicine (Baltimore). 96 (7): e6075. doi:10.1097/MD.0000000000006075. PMC 5319504. PMID 28207515.
- ^ Tan EK, Chao YX, West A, Chan LL, Poewe W, Jankovic J (June 2020). "Parkinson disease and the immune system - associations, mechanisms and therapeutics". Nat Rev Neurol. 16 (6): 303–318. doi:10.1038/s41582-020-0344-4. ISSN 1759-4758. PMID 32332985. S2CID 216111568.
- ^ Raj T, Rothamel K, Mostafavi S, Ye C, Lee MN, Replogle JM, et al. (May 2014). "Polarization of the effects of autoimmune and neurodegenerative risk alleles in leukocytes". Science. 344 (6183): 519–23. Bibcode:2014Sci...344..519R. doi:10.1126/science.1249547. PMC 4910825. PMID 24786080.
- ^ a b Du G, Dong W, Yang Q, Yu X, Ma J, Gu W, Huang Y (2020). "Altered Gut Microbiota Related to Inflammatory Responses in Patients With Huntington's Disease". Front Immunol. 11: 603594. doi:10.3389/fimmu.2020.603594. ISSN 1664-3224. PMC 7933529. PMID 33679692.
- ^ a b Gamborg M, Hvid LG, Dalgas U, Langeskov-Christensen M (3 October 2021). "Review for "Parkinson's disease and intensive exercise therapy — An updated systematic review and meta‐analysis"". Acta Neurologica Scandinavica. doi:10.1111/ane.13579/v1/review2. ISSN 1600-0404.
- ^ [1차가 아닌 소스가 필요합니다.]Kim S, Kwon SH, Kam TI, Panicker N, Karuppagounder SS, Lee S, et al. (August 2019). "Transneuronal Propagation of Pathologic α-Synuclein from the Gut to the Brain Models Parkinson's Disease". Neuron. 103 (4): 627–641.e7. doi:10.1016/j.neuron.2019.05.035. PMC 6706297. PMID 31255487.
- ^ a b The National Collaborating Centre for Chronic Conditions, ed. (2006). "Diagnosing Parkinson's Disease". Parkinson's Disease. London: Royal College of Physicians. pp. 29–47. ISBN 978-1-86016-283-1. Archived from the original on 24 September 2010.
- ^ Poewe W, Wenning G (November 2002). "The differential diagnosis of Parkinson's disease". European Journal of Neurology. 9 (Suppl 3): 23–30. doi:10.1046/j.1468-1331.9.s3.3.x. PMID 12464118.
- ^ Gibb WR, Lees AJ (June 1988). "The relevance of the Lewy body to the pathogenesis of idiopathic Parkinson's disease". Journal of Neurology, Neurosurgery, and Psychiatry. 51 (6): 745–752. doi:10.1136/jnnp.51.6.745. PMC 1033142. PMID 2841426.
- ^ Mustafa HI, Fessel JP, Barwise J, Shannon JR, Raj SR, Diedrich A, et al. (January 2012). "Dysautonomia: perioperative implications". Anesthesiology. 116 (1): 205–215. doi:10.1097/ALN.0b013e31823db712. PMC 3296831. PMID 22143168.
- ^ Rizzo G, Copetti M, Arcuti S, Martino D, Fontana A, Logroscino G (February 2016). "Accuracy of clinical diagnosis of Parkinson disease: A systematic review and meta-analysis". Neurology. 86 (6): 566–576. doi:10.1212/WNL.0000000000002350. PMID 26764028. S2CID 207110404.
- ^ a b c d Brooks DJ (April 2010). "Imaging approaches to Parkinson disease". Journal of Nuclear Medicine. 51 (4): 596–609. doi:10.2967/jnumed.108.059998. PMID 20351351.
- ^ Schwarz ST, Afzal M, Morgan PS, Bajaj N, Gowland PA, Auer DP (2014). "The 'swallow tail' appearance of the healthy nigrosome – a new accurate test of Parkinson's disease: a case-control and retrospective cross-sectional MRI study at 3T". PLOS ONE. 9 (4): e93814. Bibcode:2014PLoSO...993814S. doi:10.1371/journal.pone.0093814. PMC 3977922. PMID 24710392.
- ^ Mahlknecht P, Krismer F, Poewe W, Seppi K (April 2017). "Meta-analysis of dorsolateral nigral hyperintensity on magnetic resonance imaging as a marker for Parkinson's disease". Movement Disorders. 32 (4): 619–623. doi:10.1002/mds.26932. PMID 28151553. S2CID 7730034.
- ^ Cho SJ, Bae YJ, Kim JM, et al. (September 2020). "Diagnostic performance of neuromelanin-sensitive magnetic resonance imaging for patients with Parkinson's disease and factor analysis for its heterogeneity: a systematic review and meta-analysis". European Radiology. 30 (10): 1268–1280. doi:10.1007/s00330-020-07240-7. PMID 32886201. S2CID 221478854.
- ^ Boonstra JT, Michielse S, Temel Y, Hoogland G, Jahanshahi A (February 2021). "Neuroimaging Detectable Differences between Parkinson's Disease Motor Subtypes: A Systematic Review". Movement Disorders Clinical Practice. 8 (2): 175–192. doi:10.1002/mdc3.13107. PMC 7853198. PMID 33553487.
- ^ Suwijn SR, van Boheemen CJ, de Haan RJ, Tissingh G, Booij J, de Bie RM (2015). "The diagnostic accuracy of dopamine transporter SPECT imaging to detect nigrostriatal cell loss in patients with Parkinson's disease or clinically uncertain parkinsonism: a systematic review". EJNMMI Research. 5: 12. doi:10.1186/s13550-015-0087-1. PMC 4385258. PMID 25853018.
- ^ "DaTSCAN Approval Letter" (PDF). FDA.gov. Food and Drug Administration. Retrieved 22 March 2019.
- ^ a b c d e 그린란드 & 바커 2018.
- ^ McCann H, Stevens CH, Cartwright H, Halliday GM (January 2014). "α-Synucleinopathy phenotypes". Parkinsonism & Related Disorders. 20 (Suppl 1): S62–S67. doi:10.1016/S1353-8020(13)70017-8. hdl:1959.4/53593. PMID 24262191.
- ^ Ganguly J, Jog M (5 November 2020). "Tauopathy and Movement Disorders-Unveiling the Chameleons and Mimics". Frontiers in Neurology. 11: 599384. doi:10.3389/fneur.2020.599384. PMC 7674803. PMID 33250855.
- ^ Gupta D, Kuruvilla A (December 2011). "Vascular parkinsonism: what makes it different?". Postgraduate Medical Journal. 87 (1034): 829–836. doi:10.1136/postgradmedj-2011-130051. PMID 22121251. S2CID 29227069.
- ^ Miguel-Puga A, Villafuerte G, Salas-Pacheco J, Arias-Carrión O (22 September 2017). "Therapeutic Interventions for Vascular Parkinsonism: A Systematic Review and Meta-analysis". Frontiers in Neurology. 8: 481. doi:10.3389/fneur.2017.00481. PMC 5614922. PMID 29018399.
- ^ Levin J, Kurz A, Arzberger T, Giese A, Höglinger GU (February 2016). "The Differential Diagnosis and Treatment of Atypical Parkinsonism". Deutsches Ärzteblatt International. 113 (5): 61–69. doi:10.3238/arztebl.2016.0061. PMC 4782269. PMID 26900156.
- ^ a b Ahlskog JE (July 2011). "Does vigorous exercise have a neuroprotective effect in Parkinson disease?". Neurology. 77 (3): 288–294. doi:10.1212/wnl.0b013e318225ab66. PMC 3136051. PMID 21768599.
- ^ Costa J, Lunet N, Santos C, Santos J, Vaz-Carneiro A (2010). "Caffeine exposure and the risk of Parkinson's disease: a systematic review and meta-analysis of observational studies". Journal of Alzheimer's Disease. 20 (Suppl 1): S221–238. doi:10.3233/JAD-2010-091525. PMID 20182023.
- ^ Gagne JJ, Power MC (March 2010). "Anti-inflammatory drugs and risk of Parkinson disease: a meta-analysis". Neurology. 74 (12): 995–1002. doi:10.1212/WNL.0b013e3181d5a4a3. PMC 2848103. PMID 20308684.
- ^ Elkouzi A, Vedam-Mai V, Eisinger RS, Okun MS (April 2019). "Emerging therapies in Parkinson disease – repurposed drugs and new approaches". Nat Rev Neurol. 15 (4): 204–223. doi:10.1038/s41582-019-0155-7. PMC 7758837. PMID 30867588.
- ^ a b Connolly BS, Lang AE (30 April 2014). "Pharmacological treatment of Parkinson disease: a review". JAMA. 311 (16): 1670–1683. doi:10.1001/jama.2014.3654. PMID 24756517. S2CID 205058847.
- ^ a b Olanow CW, Stocchi F, Lang AE (2011). "The non-motor and non-dopaminergic features of PD". Parkinson's Disease: Non-Motor and Non-Dopaminergic Features. Wiley-Blackwell. ISBN 978-1405191852. OCLC 743205140.
- ^ a b c d e f g h i j k l m n o p The National Collaborating Centre for Chronic Conditions, ed. (2006). "Symptomatic pharmacological therapy in Parkinson's disease". Parkinson's Disease (Technical report). London: Royal College of Physicians. pp. 59–100. ISBN 978-1-86016-283-1. Archived from the original on 24 September 2010. Retrieved 14 March 2023.
- ^ Zhang J, Tan LC (2016). "Revisiting the Medical Management of Parkinson's Disease: Levodopa versus Dopamine Agonist". Current Neuropharmacology. 14 (4): 356–363. doi:10.2174/1570159X14666151208114634. PMC 4876591. PMID 26644151.
- ^ Moosa S, Martínez-Fernández R, Elias WJ, Del Alamo M, Eisenberg HM, Fishman PS (September 2019). "The role of high-intensity focused ultrasound as a symptomatic treatment for Parkinson's disease". Mov Disord. 34 (9): 1243–1251. doi:10.1002/mds.27779. ISSN 0885-3185. PMID 31291491. S2CID 195879250.
- ^ a b Pedrosa DJ, Timmermann L (2013). "Review: management of Parkinson's disease". Neuropsychiatric Disease and Treatment (Review). 9: 321–340. doi:10.2147/NDT.S32302. PMC 3592512. PMID 23487540.
- ^ The National Collaborating Centre for Chronic Conditions, ed. (2006). "Palliative care in Parkinson's disease". Parkinson's Disease. London: Royal College of Physicians. pp. 147–151. ISBN 978-1-86016-283-1. Archived from the original on 24 September 2010.
- ^ Orgeta V, McDonald KR, Poliakoff E, Hindle JV, Clare L, Leroi I (February 2020). "Cognitive training interventions for dementia and mild cognitive impairment in Parkinson's disease". The Cochrane Database of Systematic Reviews. 2020 (2): CD011961. doi:10.1002/14651858.cd011961.pub2. PMC 7043362. PMID 32101639.
- ^ a b c d e f g h i "Recommendations Parkinson's disease in adults Guidance NICE". NICE. 2006. Retrieved 16 March 2023.
- ^ Maria N (2017). Levodopa pharmacokinetics – from stomach to brain: A study on patients with Parkinson's disease. Linköping: Linköping University Electronic Press. p. 10. ISBN 978-9176855577. OCLC 993068595.
- ^ Oertel WH (13 March 2017). "Recent advances in treating Parkinson's disease". F1000Research (Review). 6: 260. doi:10.12688/f1000research.10100.1. PMC 5357034. PMID 28357055.
- ^ Binde et al. 2018, p. missing.
- ^ Aquino CC, Fox SH (January 2015). "Clinical spectrum of levodopa-induced complications". Movement Disorders. 30 (1): 80–89. doi:10.1002/mds.26125. PMID 25488260. S2CID 22301199.
- ^ Yan Z, Wang W, Tao X, Cheng W, Zuo G, Chen Z (30 July 2022). "High-dose versus low-dose inhaled levodopa (CVT-301) in patients with Parkinson disease for the treatment of OFF episodes: a meta-analysis of randomized controlled trials". Neurological Sciences. 43 (11): 6233–6241. doi:10.1007/s10072-022-06298-z. PMID 35907110. S2CID 251162631. Retrieved 14 March 2023.
- ^ Paik J (June 2020). "Levodopa Inhalation Powder: A Review in Parkinson's Disease". Drugs. 80 (8): 821–828. doi:10.1007/s40265-020-01307-x. PMID 32319076. S2CID 216033034.
- ^ Tambasco N, Romoli M, Calabresi P (2018). "Levodopa in Parkinson's Disease: Current Status and Future Developments". Current Neuropharmacology. 16 (8): 1239–1252. doi:10.2174/1570159X15666170510143821. PMC 6187751. PMID 28494719.
- ^ a b c Akhtar MJ, Yar MS, Grover G, Nath R (January 2020). "Neurological and psychiatric management using COMT inhibitors: A review". Bioorganic Chemistry. 94: 103418. doi:10.1016/j.bioorg.2019.103418. PMID 31708229.
- ^ "Tasmar 100 mg Tablets – Summary of Product Characteristics (SmPC) – (emc)". www.medicines.org.uk. Archived from the original on 6 August 2020. Retrieved 7 January 2021.
- ^ Scott LJ (September 2016). "Opicapone: A Review in Parkinson's Disease". Drugs. 76 (13): 1293–1300. doi:10.1007/s40265-016-0623-y. PMID 27498199. S2CID 5787752.
- ^ Watkins P (2000). "COMT inhibitors and liver toxicity". Neurology. 55 (11 Suppl 4): S51–52, discussion S53–56. PMID 11147510.
- ^ "Comtess 200 mg film-coated Tablets – Summary of Product Characteristics (SmPC) – (emc)". www.medicines.org.uk. Retrieved 7 January 2021.
- ^ "Stalevo 150 mg/37.5 mg/200 mg Film-coated Tablets – Summary of Product Characteristics (SmPC) – (emc)". www.medicines.org.uk. Retrieved 7 January 2021.
- ^ "Ongentys 50 mg hard capsules – Summary of Product Characteristics (SmPC) – (emc)". www.medicines.org.uk. Retrieved 7 January 2021.
- ^ Goldenberg MM (October 2008). "Medical management of Parkinson's disease". P & T. 33 (10): 590–606. PMC 2730785. PMID 19750042.
- ^ Ceravolo R, Frosini D, Rossi C, Bonuccelli U (December 2009). "Impulse control disorders in Parkinson's disease: definition, epidemiology, risk factors, neurobiology and management". Parkinsonism & Related Disorders. 15 (Suppl 4): S111–S115. doi:10.1016/S1353-8020(09)70847-8. PMID 20123548.
- ^ Tolosa & Katzenchlager 2007, 페이지 110–145.
- ^ Binde et al. 2018, p. 1924.
- ^ a b c Alborghetti M, Nicoletti F (2019). "Different Generations of Type-B Monoamine Oxidase Inhibitors in Parkinson's Disease: From Bench to Bedside". Current Neuropharmacology. 17 (9): 861–873. doi:10.2174/1570159X16666180830100754. PMC 7052841. PMID 30160213.
- ^ Ives NJ, Stowe RL, Marro J, Counsell C, Macleod A, Clarke CE, et al. (September 2004). "Monoamine oxidase type B inhibitors in early Parkinson's disease: meta-analysis of 17 randomised trials involving 3525 patients". BMJ. 329 (7466): 593. doi:10.1136/bmj.38184.606169.AE. PMC 516655. PMID 15310558.
- ^ Crosby N, Deane KH, Clarke CE (2003). "Amantadine in Parkinson's disease". The Cochrane Database of Systematic Reviews. 2010 (1): CD003468. doi:10.1002/14651858.CD003468. PMC 8715353. PMID 12535476.
- ^ a b The National Collaborating Centre for Chronic Conditions, ed. (2006). "Non-motor features of Parkinson's disease". Parkinson's Disease. London: Royal College of Physicians. pp. 113–133. ISBN 978-1-86016-283-1. Archived from the original on 24 September 2010.
- ^ Hasnain M, Vieweg WV, Baron MS, Beatty-Brooks M, Fernandez A, Pandurangi AK (July 2009). "Pharmacological management of psychosis in elderly patients with parkinsonism". The American Journal of Medicine. 122 (7): 614–622. doi:10.1016/j.amjmed.2009.01.025. PMID 19559160.
- ^ "FDA approves first drug to treat hallucinations and delusions associated with Parkinson's disease". www.fda.gov (Press release). 29 April 2016. Retrieved 12 October 2018.
- ^ a b Elbers RG, Verhoef J, van Wegen EE, Berendse HW, Kwakkel G (October 2015). "Interventions for fatigue in Parkinson's disease". The Cochrane Database of Systematic Reviews (Review). 2015 (10): CD010925. doi:10.1002/14651858.CD010925.pub2. PMC 9240814. PMID 26447539.
- ^ a b c d The National Collaborating Centre for Chronic Conditions, ed. (2006). "Surgery for Parkinson's disease". Parkinson's Disease. London: Royal College of Physicians. pp. 101–111. ISBN 978-1-86016-283-1. Archived from the original on 24 September 2010.
- ^ Bronstein JM, Tagliati M, Alterman RL, et al. (February 2011). "Deep brain stimulation for Parkinson disease: an expert consensus and review of key issues". Archives of Neurology. 68 (2): 165. doi:10.1001/archneurol.2010.260. PMC 4523130. PMID 20937936.
- ^ a b Dallapiazza et al. 2018.
- ^ a b c d e The National Collaborating Centre for Chronic Conditions, ed. (2006). "Other key interventions". Parkinson's Disease. London: Royal College of Physicians. pp. 135–146. ISBN 978-1-86016-283-1. Archived from the original on 24 September 2010.
- ^ a b Goodwin VA, Richards SH, Taylor RS, Taylor AH, Campbell JL (April 2008). "The effectiveness of exercise interventions for people with Parkinson's disease: a systematic review and meta-analysis". Movement Disorders. 23 (5): 631–640. doi:10.1002/mds.21922. hdl:10871/17451. PMID 18181210. S2CID 3808899.
- ^ Dereli EE, Yaliman A (April 2010). "Comparison of the effects of a physiotherapist-supervised exercise programme and a self-supervised exercise programme on quality of life in patients with Parkinson's disease". Clinical Rehabilitation. 24 (4): 352–362. doi:10.1177/0269215509358933. PMID 20360152. S2CID 10947269.
- ^ Jin X, Wang L, Liu S, Zhu L, Loprinzi PD, Fan X (December 2019). "The Impact of Mind-body Exercises on Motor Function, Depressive Symptoms, and Quality of Life in Parkinson's Disease: A Systematic Review and Meta-analysis". International Journal of Environmental Research and Public Health. 17 (1): 31. doi:10.3390/ijerph17010031. PMC 6981975. PMID 31861456.
- ^ O'Sullivan & Schmitz 2007, 873, 876쪽.
- ^ O'Sullivan & Schmitz 2007, 879쪽.
- ^ O'Sullivan & Schmitz 2007, 877쪽.
- ^ O'Sullivan & Schmitz 2007, 880쪽.
- ^ Ramazzina I, Bernazzoli B, Costantino C (31 March 2017). "Systematic review on strength training in Parkinson's disease: an unsolved question". Clinical Interventions in Aging. 12: 619–628. doi:10.2147/CIA.S131903. PMC 5384725. PMID 28408811.
- ^ Fox CM, Ramig LO, Ciucci MR, Sapir S, McFarland DH, Farley BG (November 2006). "The science and practice of LSVT/LOUD: neural plasticity-principled approach to treating individuals with Parkinson disease and other neurological disorders". Seminars in Speech and Language. 27 (4): 283–299. doi:10.1055/s-2006-955118. PMID 17117354. S2CID 260320960.
- ^ Dixon L, Duncan D, Johnson P, et al. (July 2007). "Occupational therapy for patients with Parkinson's disease". The Cochrane Database of Systematic Reviews. 2007 (3): CD002813. doi:10.1002/14651858.CD002813.pub2. PMC 6991932. PMID 17636709.
- ^ Ferrell B, Connor SR, Cordes A, et al. (June 2007). "The national agenda for quality palliative care: the National Consensus Project and the National Quality Forum". Journal of Pain and Symptom Management. 33 (6): 737–744. doi:10.1016/j.jpainsymman.2007.02.024. PMID 17531914.
- ^ a b Lorenzl S, Nübling G, Perrar KM, Voltz R (2013). "Palliative treatment of chronic neurologic disorders". Ethical and Legal Issues in Neurology. Handbook of Clinical Neurology. Vol. 118. Elsevier. pp. 133–139. doi:10.1016/B978-0-444-53501-6.00010-X. ISBN 978-0444535016. PMID 24182372.
- ^ a b Ghoche R (December 2012). "The conceptual framework of palliative care applied to advanced Parkinson's disease". Parkinsonism & Related Disorders. 18 (Suppl 3): S2–5. doi:10.1016/j.parkreldis.2012.06.012. PMID 22771241.
- ^ a b c Wilcox SK (January 2010). "Extending palliative care to patients with Parkinson's disease". British Journal of Hospital Medicine. 71 (1): 26–30. doi:10.12968/hmed.2010.71.1.45969. PMID 20081638.
- ^ Moens K, Higginson IJ, Harding R (October 2014). "Are there differences in the prevalence of palliative care-related problems in people living with advanced cancer and eight non-cancer conditions? A systematic review". Journal of Pain and Symptom Management. 48 (4): 660–677. doi:10.1016/j.jpainsymman.2013.11.009. PMID 24801658.
- ^ Casey G (August 2013). "Parkinson's disease: a long and difficult journey". Nursing New Zealand. 19 (7): 20–24. PMID 24195263.
- ^ a b c d Poewe W (December 2006). "The natural history of Parkinson's disease". Journal of Neurology. 253 (Suppl 7): vii2–vii6. doi:10.1007/s00415-006-7002-7. PMID 17131223. S2CID 35082340.
- ^ a b Feigin VL, Nichols E, Alam T, et al. (May 2019). "Global, regional, and national burden of neurological disorders, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016". Lancet Neurol. 18 (5): 459–480. doi:10.1016/S1474-4422(18)30499-X. PMC 6459001. PMID 30879893.
- ^ Gomperts SN (April 2016). "Lewy Body Dementias: Dementia With Lewy Bodies and Parkinson Disease Dementia". Continuum (Minneap Minn) (Review). 22 (2 Dementia): 435–463. doi:10.1212/CON.0000000000000309. PMC 5390937. PMID 27042903.
- ^ Binde et al. 2018, p. 1989.
- ^ Li G, Ma J, Cui S, He Y, Xiao Q, Liu J, Chen S (31 July 2019). "Parkinson's disease in China: a forty-year growing track of bedside work". Translational Neurodegeneration. 8 (1): 22. doi:10.1186/s40035-019-0162-z. PMC 6668186. PMID 31384434.
- ^ Dorsey ER, Sherer T, Okun MS, Bloem BR (2018). "The Emerging Evidence of the Parkinson Pandemic". Journal of Parkinson's Disease. 8 (s1): S3–S8. doi:10.3233/JPD-181474. PMC 6311367. PMID 30584159.
- ^ Garcia-Ptacek S, Kramberger MG (September 2016). "Parkinson Disease and Dementia". Journal of Geriatric Psychiatry and Neurology. 29 (5): 261–270. doi:10.1177/0891988716654985. PMID 27502301. S2CID 21279235.
- ^ a b "Art and Medicine Bibliography, Paul de Saint-Léger". Art and Medicine. Retrieved 29 April 2023.
- ^ a b Lewis PA, Plun-Favreau H, Rowley M, Spillane J (March 2020). "Pierre D. and the First Photographs of Parkinson's Disease". Movement Disorders. 35 (3): 389–391. doi:10.1002/MDS.27965. PMC 7155099. PMID 31975439.
- ^ a b c García Ruiz PJ (December 2004). "Prehistoria de la enfermedad de Parkinson" [Prehistory of Parkinson's disease]. Neurologia (in Spanish). 19 (10): 735–737. PMID 15568171.García Ruiz PJ (December 2004). "Prehistoria de la enfermedad de Parkinson" [Prehistory of Parkinson's disease]. Neurologia (in Spanish). 19 (10): 735–737. PMID 15568171.기사는 잡 33:19 대신 잡 34:19를 잘못 언급하고 있습니다.
- ^ a b Lanska DJ (2009). "Chapter 33 the history of movement disorders". History of Neurology. Handbook of Clinical Neurology. Vol. 95. Elsevier. pp. 501–546. doi:10.1016/S0072-9752(08)02133-7. ISBN 978-0444520098. PMID 19892136.
- ^ Koehler PJ, Keyser A (September 1997). "Tremor in Latin texts of Dutch physicians: 16th–18th centuries". Movement Disorders. 12 (5): 798–806. doi:10.1002/mds.870120531. PMID 9380070. S2CID 310819.
- ^ a b c d e f g Lees AJ (September 2007). "Unresolved issues relating to the shaking palsy on the celebration of James Parkinson's 250th birthday". Movement Disorders. 22 (Suppl 17): S327–S334. doi:10.1002/mds.21684. PMID 18175393. S2CID 9471754.
- ^ Parkinson J (1817). An Essay on the Shaking Palsy. London: Whittingham and Roland for Sherwood, Neely, and Jones. Archived from the original on 24 September 2015.
- ^ Louis ED (November 1997). "The shaking palsy, the first forty-five years: a journey through the British literature". Movement Disorders. 12 (6): 1068–1072. doi:10.1002/mds.870120638. PMID 9399240. S2CID 34630080.
- ^ a b c Fahn S (2008). "The history of dopamine and levodopa in the treatment of Parkinson's disease". Movement Disorders. 23 (Suppl 3): S497–508. doi:10.1002/mds.22028. PMID 18781671. S2CID 45572523.
- ^ Guridi J, Lozano AM (November 1997). "A brief history of pallidotomy". Neurosurgery. 41 (5): 1169–1180, discussion 1180–1183. doi:10.1097/00006123-199711000-00029. PMID 9361073.
- ^ Hornykiewicz O (2002). "L-DOPA: from a biologically inactive amino acid to a successful therapeutic agent". Amino Acids. 23 (1–3): 65–70. doi:10.1007/s00726-001-0111-9. PMID 12373520. S2CID 25117208.
- ^ Coffey RJ (March 2009). "Deep brain stimulation devices: a brief technical history and review". Artificial Organs. 33 (3): 208–220. doi:10.1111/j.1525-1594.2008.00620.x. PMID 18684199.
- ^ "UF neurologists create a new image of Parkinson disease". McKnight Brain Institute, University of Florida. 27 July 2020. Retrieved 17 November 2023.
- ^ Armstrong MJ, Okun MS (November 2020). "Time for a New Image of Parkinson Disease". JAMA Neurol. 77 (11): 1345–1346. doi:10.1001/jamaneurol.2020.2412. PMID 32716484. S2CID 220796667.
- ^ a b Crooks S, Carter G, Wilson CB, Wynne L, Stark P, Doumas M, Rodger M, O'Shea E, Mitchell G (2023). "Exploring public perceptions and awareness of Parkinson's disease: A scoping review". PLOS ONE. 18 (9): e0291357. Bibcode:2023PLoSO..1891357C. doi:10.1371/journal.pone.0291357. PMC 10503766. PMID 37713383.
- ^ a b c Findley LJ (September 2007). "The economic impact of Parkinson's disease". Parkinsonism & Related Disorders. 13 (Suppl): S8–S12. doi:10.1016/j.parkreldis.2007.06.003. PMID 17702630.
- ^ Yang W, Hamilton JL, Kopil C, et al. (2020). "Current and projected future economic burden of Parkinson's disease in the U.S". npj Parkinson's Disease. 6: 15. doi:10.1038/s41531-020-0117-1. PMC 7347582. PMID 32665974. 자료는 Creative Commons Attribution 4.0 International License(Creative Commons Attribution 4.0 International License)에 따라 제공되는 이 소스에서 복사되었습니다.
- ^ "Parkinson's – 'the shaking palsy'". GlaxoSmithKline. 1 April 2009. Archived from the original on 14 May 2011.
- ^ "National Parkinson Foundation – Mission". Archived from the original on 21 December 2010. Retrieved 28 March 2011.
- ^ "Education: Joy in Giving". Time. 18 January 1960. Archived from the original on 20 February 2011. Retrieved 2 April 2011.
- ^ "About PDF". Parkinson's Disease Foundation. Archived from the original on 15 May 2011. Retrieved 24 July 2016.
- ^ "American Parkinson Disease Association: Home". American Parkinson Disease Association. Archived from the original on 10 May 2012. Retrieved 9 August 2010.
- ^ "About EPDA". European Parkinson's Disease Association. 2010. Archived from the original on 15 August 2010. Retrieved 9 August 2010.
- ^ "Notable Figures with Parkinson's". Parkinson's Foundation. Retrieved 22 November 2023.
- ^ "Michael's Story". The Michael J. Fox Foundation for Parkinson's Research. Retrieved 7 May 2023.
- ^ Davis P (3 May 2007). "Michael J. Fox". The Time 100. New York: Time. Archived from the original on 25 April 2011. Retrieved 2 April 2011.
- ^ Brockes E (11 April 2009). "'It's the gift that keeps on taking'". The Guardian. London. Archived from the original on 8 October 2013. Retrieved 25 October 2010.
- ^ Burleson, Nate; Breen, Kerry (9 November 2023). "Michael J. Fox talks funding breakthrough research for Parkinson's disease". CBS News. Retrieved 23 November 2023.
- ^ Brey RL (April 2006). "Muhammad Ali's Message: Keep Moving Forward". Neurology Now. 2 (2): 8. doi:10.1097/01222928-200602020-00003. Archived from the original on 27 September 2011. Retrieved 22 August 2020.
- ^ Matthews W (April 2006). "Ali's Fighting Spirit". Neurology Now. 2 (2): 10–23. doi:10.1097/01222928-200602020-00004. S2CID 181104230.
- ^ Tauber P (17 July 1988). "Ali: Still Magic". The New York Times. Archived from the original on 17 November 2016. Retrieved 2 April 2011.
- ^ Macur J (26 March 2008). "For the Phinney Family, a Dream and a Challenge". The New York Times. Archived from the original on 6 November 2014. Retrieved 25 May 2013.
About 1.5 million Americans have received a diagnosis of Parkinson's disease, but only 5 to 10 percent learn of it before age 40, according to the National Parkinson Foundation. Davis Phinney was among the few.
- ^ "Who We Are". Davis Phinney Foundation. Archived from the original on 11 January 2012. Retrieved 18 January 2012.
- ^ Jones JM (December 2004). "Great shakes: famous people with Parkinson disease". South Med J. 97 (12): 1186–9. doi:10.1097/01.SMJ.0000145284.79746.B3. PMID 15646755. S2CID 44340931.
- ^ Mufson, Steven (20 February 1997). "China's Deng Xiaoping Is Dead at 92". The Washington Post. Retrieved 30 November 2023.
- ^ "Parkinson's experts sent to help Deng". South China Morning Post. Hong Kong. 26 January 1995. Archived from the original on 30 November 2023. Retrieved 30 November 2023.
- ^ a b Gallman S (4 November 2015). "Robin Williams' widow speaks: Depression didn't kill my husband". CNN. Archived from the original on 4 November 2015. Retrieved 6 April 2018.
- ^ Williams SS (September 2016). "The terrorist inside my husband's brain". Neurology. 87 (13): 1308–1311. doi:10.1212/WNL.0000000000003162. PMID 27672165.
- ^ Robbins R (30 September 2016). "How Lewy body dementia gripped Robin Williams". Scientific American. Retrieved 9 April 2018.
- ^ "LBDA Clarifies Autopsy Report on Comedian, Robin Williams". Lewy Body Dementia Association. 10 November 2014. Archived from the original on 12 August 2020. Retrieved 19 April 2018.
- ^ McKeith IG (6 November 2015). "Robin Williams had dementia with Lewy bodies – so, what is it and why has it been eclipsed by Alzheimer's?". The Conversation. Archived from the original on 4 November 2016. Retrieved 6 April 2018.
- ^ Mari Z, Mestre TA (2022). "The Disease Modification Conundrum in Parkinson's Disease: Failures and Hopes". Frontiers in Aging Neuroscience. 14: 810860. doi:10.3389/fnagi.2022.810860. PMC 8920063. PMID 35296034.
- ^ McFarthing K, Rafaloff G, Baptista M, Mursaleen L, Fuest R, Wyse RK, Stott SR (24 May 2022). "Parkinson's Disease Drug Therapies in the Clinical Trial Pipeline: 2022 Update". Journal of Parkinson's Disease. 12 (4): 1073–1082. doi:10.3233/JPD-229002. PMC 9198738. PMID 35527571.
- ^ a b Poewe W, Seppi K, Tanner CM, Halliday GM, Brundin P, Volkmann J, et al. (March 2017). "Parkinson disease". Nature Reviews. Disease Primers. 3 (1): 17013. doi:10.1038/nrdp.2017.13. PMID 28332488. S2CID 11605091.
- ^ Heinzel S, Berg D, Gasser T, Chen H, Yao C, Postuma RB (October 2019). "Update of the MDS research criteria for prodromal Parkinson's disease". Movement Disorders. 34 (10): 1464–1470. doi:10.1002/mds.27802. PMID 31412427. S2CID 199663713.
- ^ Sudhakar V, Richardson RM (January 2019). "Gene Therapy for Neurodegenerative Diseases". Neurotherapeutics. 16 (1): 166–175. doi:10.1007/s13311-018-00694-0. PMC 6361055. PMID 30542906.
- ^ Hitti FL, Yang AI, Gonzalez-Alegre P, Baltuch GH (September 2019). "Human gene therapy approaches for the treatment of Parkinson's disease: An overview of current and completed clinical trials". Parkinsonism & Related Disorders. 66: 16–24. doi:10.1016/j.parkreldis.2019.07.018. PMID 31324556. S2CID 198132349.
- ^ Volc D, Poewe W, Kutzelnigg A, et al. (July 2020). "Safety and immunogenicity of the α-synuclein active immunotherapeutic PD01A in patients with Parkinson's disease: a randomised, single-blinded, phase 1 trial". The Lancet. Neurology. 19 (7): 591–600. doi:10.1016/S1474-4422(20)30136-8. PMID 32562684. S2CID 219947651.
- ^ "World's first Parkinson's vaccine is trialled". New Scientist. London. 7 June 2012. Archived from the original on 23 April 2015.
- ^ Jankovic J, Goodman I, Safirstein B, et al. (October 2018). "Safety and Tolerability of Multiple Ascending Doses of PRX002/RG7935, an Anti-α-Synuclein Monoclonal Antibody, in Patients With Parkinson Disease: A Randomized Clinical Trial". JAMA Neurology. 75 (10): 1206–1214. doi:10.1001/jamaneurol.2018.1487. PMC 6233845. PMID 29913017.
- ^ Parmar 2020, pp. 103. CITEREF (
- ^ Parmar 2020, pp. 103–104. CITEREF (
- ^ Parmar 2020, pp. 106. CITEREF (
- ^ 헨치클리프 2018, 페이지 134. CITEREF 헨치클리프 (
- ^ Parmar 2020, pp. 106, 108. CITEREF (
- ^ 슈바이처 2020, 페이지 1926. 오류:(
- ^ Parmar 2020, pp. 105, 109. CITEREF (
- ^ 헨치클리프 2018, 페이지 132. CITEREF 헨치클리프 (
- ^ Jenner P (2014). "An overview of adenosine A2A receptor antagonists in Parkinson's disease". International Review of Neurobiology. 119: 71–86. doi:10.1016/B978-0-12-801022-8.00003-9. ISBN 978-0128010228. ISSN 2162-5514. PMID 25175961.
- ^ a b Office of the Commissioner (20 February 2020). "FDA approves new add-on drug to treat off episodes in adults with Parkinson's disease". FDA. Retrieved 23 February 2020.
- ^ Blauwendraat 2019, pp. 2. CITEREF 2019 (
인용된 작품
책들
- Cooper G, Eichhorn G, Rodnitzky RL (2008). "Parkinson's disease". In Conn PM (ed.). Neuroscience in medicine. Humana Press. ISBN 978-1603274548.
- Dissanayaka NN (8 March 2021). "Chapter 9: Anxiety in Parkinson's Disease". In Byrne GJ, Panchana NA (eds.). Anxiety in Older People: Clinical and Research Perspectives. Cambridge University Press. pp. 139–156. doi:10.1017/9781139087469.009. ISBN 978-1108826365. S2CID 87250745.
- Ferri FF (2010). "Chapter P". Ferri's differential diagnosis: a practical guide to the differential diagnosis of symptoms, signs, and clinical disorders (2nd ed.). Elsevier/Mosby. ISBN 978-0323076999.
- O'Sullivan SB, Schmitz TJ (2007). "Parkinson's Disease". Physical Rehabilitation (5th ed.). F.A. Davis. ISBN 978-0803612471.
- Simon RP, Greenberg D, Aminoff MJ (2017). Lange Clinical Neurology (10th ed.). McGraw-Hill. ISBN 978-1259861727.
- Stoker TB, Greenland JC, eds. (December 2018). Parkinson's Disease: Pathogenesis and Clinical Aspects. Codon Publications. ISBN 978-0994438164.
- Dallapiazza RF, De Vloo PD, Fomenko A, Lee DJ, Hamani C, Munhoz RP, Hodaie M, Lozano AM, Fasano A, Kalia SK (2018). "Chapter 8: Considerations for Patient and Target Selection in Deep Brain Stimulation surgery for Parkinson's disease". In Stoker TB, Greenland JC (eds.). Parkinson's disease: Pathogenesis and Clinical Aspects. Codon Publications. doi:10.15586/codonpublications.parkinsonsdisease.2018.ch8. ISBN 978-0994438164. PMID 30702838. S2CID 81155324.
- Greenland JC, Barker RA (2018). "Chapter 6: The Differential Diagnosis of Parkinson's Disease". In Stoker TB, Greenland JC (eds.). Parkinson's disease: Pathogenesis and Clinical Aspects. Codon Publications. pp. 109–128. doi:10.15586/codonpublications.parkinsonsdisease.2018.ch6. ISBN 978-0994438164. PMID 30702839. S2CID 80908095.
- Stoker TB, Torsney KM, Barker RA (2018). "Chapter 3: Pathological mechanisms and clinical aspects of GBA1 mutation-associated Parkinson's disease". In Stoker TB, Greenland JC (eds.). Parkinson's Disease: Pathogenesis and clinical aspects. pp. 45–64. doi:10.15586/codonpublications.parkinsonsdisease.2018.ch3. ISBN 978-0994438164. PMID 30702840. S2CID 92170834.
- Tolosa E, Jankovic E, eds. (2007). Parkinson's disease and movement disorders. Lippincott Williams & Wilkins. ISBN 978-0781778817.
- Dickson DV (2007). "Neuropathology of movement disorders". In Tolosa E, Jankovic JJ (eds.). Parkinson's disease and movement disorders. Lippincott Williams & Wilkins. ISBN 978-0781778817.
- Fung VS, Thompson PD (2007). "Rigidity and spasticity". In Tolosa E, Jankovic E (eds.). Parkinson's disease and movement disorders. Lippincott Williams & Wilkins. ISBN 978-0781778817.
- Tolosa E, Katzenschlager R (2007). "Pharmacological management of Parkinson's disease". In Tolosa E, Jankovic JJ (eds.). Parkinson's disease and movement disorders. Lippincott Williams & Wilkins. ISBN 978-0781778817.
- Truong DD, Bhidayasiri R (2016). "50: Parkinson's disease". In Lisak RP, Truong DD, Carroll WM, Bhidayasiri R (eds.). International Neurology. John Wiley & Sons. ISBN 978-1118777367.
저널 기사
- Binde CD, Tvete IF, Gåsemyr J, Natvig B, Klemp M (21 May 2018). "A multiple treatment comparison meta-analysis of monoamine oxidase type B inhibitors for Parkinson's disease". British Journal of Clinical Pharmacology. 84 (9): 1917–1927. doi:10.1111/bcp.13651. PMC 6089809. PMID 29847694.
- De Miranda BR, Goldman SM, Miller GW, Greenamy T, Dorseye ER (2022). "Preventing Parkinson's Disease: An Environmental Agenda". Journal of Parkinson's Disease. 12 (1): 45–68. doi:10.3233/JPD-212922. PMC 8842749. PMID 34719434. S2CID 240235393.
- Henchcliffe C, Parmar M (2018). "Repairing the Brain: Cell Replacement Using Stem Cell-Based Technologies". Journal of Parkinson's Disease. 8 (s1): S131–S137. doi:10.3233/JPD-181488. PMC 6311366. PMID 30584166.
- Panicker N, Ge P, Dawson V, Dawson T (April 2021). "The cell biology of Parkinson's disease". Journal of Cell Biology. 220 (4). doi:10.1083/jcb.202012095. PMC 8103423. PMID 33749710.
- Parmar M, Shane G, Claire H (February 2020). "The future of stem cell therapies for Parkinson disease". Nature Reviews Neuroscience. 21 (2): 103–115. doi:10.1038/s41583-019-0257-7. PMID 31907406.
- Polissidis A, Petropoulou-Vathi L, Nakos-Bimpos M, Rideout H (June 2020). "The Future of Targeted Gene-Based Treatment Strategies and Biomarkers in Parkinson's Disease". Biomolecules. 10 (6). doi:10.3390/biom10060912. PMID 32560161.
- Schweitzer JS, Song B, Herrington TM, et al. (May 2020). "Personalized iPSC-Derived Dopamine Progenitor Cells for Parkinson's Disease". The New England Journal of Medicine. 382 (20): 1926–1932. doi:10.1056/NEJMoa1915872. PMC 7288982. PMID 32402162.
- Tolosa E, Garrido A, Scholz S, Poewe W (May 2021). "Challenges in the diagnosis of Parkinson's disease". Lancet Neurology. 20 (5): 385–397. doi:10.1016/S1474-4422(21)00030-2. PMC 8185633. PMID 33894193.
- Blauwendraat C, Nalls M, Singleton A (February 2020). "The genetic architecture of Parkinson's disease". Lancet Neurology. 19 (2): 170–178. doi:10.1016/S1474-4422(19)30287-X. PMC 8972299. PMID 31521533.
- Winiker K, Kertscher B (2023). "Behavioural interventions for swallowing in subjects with Parkinson's disease: A mixed methods systematic review". Int J Lang Commun Disord. 58 (4): 1375–1404. doi:10.1111/1460-6984.12865. PMID 36951546.
 이 문서에는 CC BY 4.0 라이센스에 따라 제공되는 이 소스의 텍스트가 포함되어 있습니다.
이 문서에는 CC BY 4.0 라이센스에 따라 제공되는 이 소스의 텍스트가 포함되어 있습니다.
외부 링크
- "The Lancet Neurology Video". thelancet.com. Retrieved 27 December 2023. 파킨슨병을 앓고 있는 사람들을 보여주는 여러 개의 영상을 포함한 신경학 관련 영상.