윌슨병
Wilson's disease| 윌슨병 | |
|---|---|
| 기타이름 | 윌슨병, 간세포변성 |
 | |
| 윌슨병을 앓고 있는 소년 | |
| 전문 | 소화기내과 |
| 증상 | 다리의 부종, 황갈색 피부, 성격 변화[1] |
| 보통발병 | 5세~35세[1] |
| 원인들 | 유전의 |
| 감별진단 | 만성간질환, 파킨슨병, 다발성경화증, 기타[2][3] |
| 치료 | 식이 변화, 킬레이트제, 아연 보충제, 간 이식[1] |
| 빈도수. | ~30,000명당[1] 1개 |
윌슨병은 과량의 구리가 체내에 쌓이는 유전적 장애입니다. 증상은 일반적으로 뇌와 간과 관련이 있습니다. 간 관련 증상으로는 구토, 쇠약감, 복부의 체액 축적, 다리의 부종, 피부가 누렇게 변하고 가려움 등이 있습니다. 뇌와 관련된 증상으로는 떨림, 근육 경직, 말하기 곤란, 성격 변화, 불안, 정신병 등이 있습니다.[1]
윌슨병은 윌슨병 단백질(ATP7B) 유전자의 돌연변이에 의해 발생합니다. 이 단백질은 과도한 구리를 담즙으로 운반하여 폐기물로 배출합니다. 그 상태는 상염색체 열성입니다; 사람들이 영향을 받으려면, 그들은 양쪽 부모로부터 유전자의 돌연변이 사본을 물려받아야 합니다. 진단이 어려울 수 있으며 혈액 검사, 소변 검사 및 간 조직 검사를 병행하는 경우가 많습니다. 유전자 검사는 영향을 받은 사람들의 가족을 선별하는 데 사용될 수 있습니다.[1]
윌슨병은 일반적으로 식이요법과 약물치료로 치료됩니다. 식이 변화에는 구리가 적은 식단을 섭취하고 구리 조리기구를 사용하지 않는 것이 포함됩니다. 사용되는 약물에는 트리엔틴 및 d-페니실라민과 같은 킬레이트제 및 아연 보충제가 포함됩니다. 윌슨병의 합병증은 간부전, 신장 문제를 포함할 수 있습니다. 간 이식은 다른 치료법이 효과적이지 않거나 간부전이 발생한 경우에 도움이 될 수 있습니다.[1]
윌슨병은 약 3만명 중 1명꼴로 발병합니다.[1] 증상은 보통 5세에서 35세 사이에 시작됩니다.[1] 1854년 독일의 병리학자 프리드리히 테오도르 폰 프레리히에 의해 처음 기술되었으며 영국의 신경학자 사무엘 윌슨의 이름을 따서 명명되었습니다.[4]
징후 및 증상
구리 축적의 주요 부위는 간과 뇌이며, 결과적으로 간질환과 신경정신과적 증상이 진단으로 이어지는 주요 특징입니다.[5] 간에 문제가 있는 사람들은 일반적으로 20대 이상인 신경과적, 정신과적 증상이 있는 사람들보다 어린이나 10대로서 일찍 진료를 받으러 오는 경향이 있습니다. 일부는 친척들이 윌슨병 진단을 받았기 때문에 확인되는데, 이들 중 상당수는 검사를 받은 결과 이 병의 증상을 경험했지만 진단을 받지 못한 것으로 드러났습니다.[6]
간질환
간질환은 피로감, 황달,[7] 출혈 경향 증가 또는 혼란(간성뇌증으로 인한), 문맥압항진증 등으로 나타날 수 있습니다. 마지막으로, 간문맥의 압력이 현저하게 증가하는 상태는 식도 정맥류, 생명을 위협하는 방식으로 출혈을 일으킬 수 있는 식도의 혈관뿐만 아니라 비장의 비대(비장종대)와 복강 내의 액체 축적(복강 내의 복수)으로 이어집니다. 검사상 거미혈관종(작은 확장된 혈관, 대개 가슴에 있음)과 같은 만성 간질환의 징후가 관찰될 수 있습니다. 만성 활동성 간염은 증상이 생길 때쯤 대부분 간경변증을 유발했습니다. 간경변증이 있는 대부분의 사람들은 간세포암(간암)의 위험이 증가하지만 윌슨병에서는 이 위험이 상대적으로 매우 낮습니다.[5]
전체의 약 5%는 용혈성 빈혈(적혈구 파괴로 인한 빈혈)이 종종 발생하는 상황에서 전격성 급성 간부전이 발생해야 진단을 받습니다. 이로 인해 간에 의한 단백질 생성 및 대사에 이상이 발생합니다. 흐트러진 단백질 대사는 혈류에 암모니아와 같은 노폐물이 축적되게 합니다. 이것들이 뇌를 자극할 때, 사람은 간성뇌증(혼란, 혼수, 발작, 그리고 마침내 생명을 위협하는 뇌의 부종)을 일으킵니다.[5]
신경정신과적 증상

윌슨병을 앓고 있는 사람들의 절반 정도는 신경학적 또는 정신과적 증상을 가지고 있습니다. 대부분은 초기에 가벼운 인지 기능 저하와 어설픈 증상을 보이며, 행동의 변화도 있습니다. 일반적으로 특정 신경학적 증상이 뒤따르며, 종종 파킨슨병의 형태로 나타납니다(코그휠 경직, 브래디키니아 또는 느린 움직임과 균형의 결여는 가장 흔한 파킨슨병의[8] 특징입니다). 전형적인 손 떨림, 가면을 쓴 얼굴 표정, 흐릿한 말투, 운동 장애(협조력의 결여), 또는 디스토니아(몸의 일부의 twisting 및 반복적인 움직임). 윌슨병에서 발작과 편두통이 더 흔한 것 같습니다.[5] "날개 뛰는 떨림"으로 설명되는 특징적인 떨림은 윌슨과 함께 있는 많은 사람들에게 발생합니다. 이것은 휴식할 때는 없지만 팔을 잡고 팔꿈치를 정중선 쪽으로 구부리면 유발될 수 있습니다.[9]
인지는 상호 배타적이지 않은 두 가지 범주 - 전두엽 장애 (충동성, 판단력 손상, 난잡함, 무관심 및 계획 및 의사결정이 좋지 않은 실행 기능 장애로 나타날 수 있음) 및 피질하 치매 (느린 사고, 기억 상실 및 실행 기능 장애로 나타날 수 있음)에서도 영향을 받을 수 있습니다. 실어증, 무프락시아, 불가지증의 징후 없이). 이러한 인지적 관여는 질병의 정신 의학적 징후와 관련이 있고 밀접하게 연관되어 있다고 생각됩니다.[8]
윌슨병으로 인한 정신과적 문제로는 행동 변화, 우울증, 불안장애, 정신병 등이 있을 수 있습니다.[5] 정신과적 증상은 흔히 신경학적 증상과 함께 나타나며 스스로 발현되는 경우는 거의 없습니다. 이러한 증상은 종종 잘 정의되지 않으며 때로는 다른 원인에 기인할 수 있습니다. 이 때문에 정신과적 증상만 있을 때는 윌슨병 진단이 거의 이뤄지지 않습니다.[8]
기타 장기계
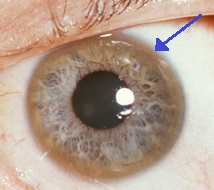
의학적 상태는 윌슨병의 구리 축적과 관련이 있습니다.
- 눈: 카이저-Fleischer ring(KF ring)은 구리의 침전물이 각막 주위에 고리를 형성하기 때문에 직접 또는 슬릿 램프 검사에서 눈의 각막에 보일 수 있습니다. 이것은 Decemet의 막에 구리가 침착되기 때문입니다. 이 고리들은 짙은 갈색, 황금색 또는 적록색일 수 있고, 너비가 1~3mm이며, 각막 가장자리에 나타납니다. 윌슨병을 앓고 있는 모든 사람에게 발생하는 것은 아니며 만성 담즙 정체증이 있는 사람에게서도 볼 수 있습니다.[10][11] 윌슨병은 또한 전방 및 후방 수정체 캡슐의 갈색 또는 녹색 색소 침착으로 나타나는 해바라기 백내장과 관련이 있습니다.[12] 둘 다 시각적 손실을 크게 유발하지 않습니다.[5] KF 링은 진단된 환자의 약 66%에서 발생합니다(간 문제가 있는 경우보다는 신경학적 증상이 있는 경우가 더 많습니다).[6]
- 신장: 신장 세뇨관 산증(제2형), 근위 세뇨관에 의한 중탄산염 취급 장애는 신장 칼슘증(신장에 칼슘 축적), 뼈의 약화(칼슘 및 인산염 손실로 인한), 때때로 아미노산뇨(단백질 합성에 필요한 필수 아미노산의 손실)로 이어집니다.[5]
- 심장: 심근병증(심장 근육의 약화)은 윌슨병에서 드물지만 인식되는 문제입니다. 심장 기능 저하로 인한 심부전(펌프 기능 저하로 인한 체액 축적) 및 심장 부정맥(불규칙적이거나 비정상적으로 빠른 심장박동 또는 느린 심장박동의 증상)으로 이어질 수 있습니다.[5]
- 호르몬: 부갑상선 기능저하증(부갑상선 기능저하증), 범뇌하수체 기능저하증(뇌하수체에서 호르몬이 생성됨), 불임, 재발성 유산.[5][13]
- 근골격계: 관절염과 뼈의 얇아짐(골다공증 또는 골다공증).[14]
- 40세 남성의 해바라기 백내장과 두꺼운 KF 링으로 윌슨병과 비대상성 간질환을 앓고 있습니다
- 각막의 미만성 조명
- 각막 데세메트 막에 구리가 침착되는 현상
유전학

윌슨병 유전자(ATP7B)는 13번 염색체(13q14.3)에 있으며, 주로 간, 신장, 태반에서 발현됩니다. 이 유전자는 구리를 담즙으로 운반하여 세룰로플라스민에 통합하는 P형(양이온전달효소) ATPase를 암호화합니다.[5] 사례의 90%에서 돌연변이를 발견할 수 있습니다. 대부분(60%)은 ATP7B 돌연변이에 대해 동형접합이며(2개의 비정상적인 사본), 30%는 하나의 비정상적인 사본만을 가지고 있습니다. 약 10%는 검출 가능한 돌연변이가 없습니다.[6]
비록 ATP7B의 300개의 돌연변이가 기술되었지만, 대부분의 집단에서 윌슨병의 사례는 그 집단에 특정한 소수의 돌연변이 때문입니다. 예를 들어, 서양인 집단에서는 H1069Q 돌연변이(단백질의 1069 위치에서 글루타민으로 히스티딘을 대체함)가 37-63%에 존재하는 반면, 중국에서는 이 돌연변이가 매우 드물고 R778L(778에서 류신으로 아르기닌)이 더 자주 발견됩니다. 일부 연구에 따르면 H1069Q 돌연변이가 나중에 발병하고 주로 신경학적 문제를 예측하는 것처럼 보이지만 다양한 돌연변이의 상대적 영향에 대해서는 상대적으로 거의 알려져 있지 않습니다.[5][15] 포괄적인 임상 주석이 달린 리소스인 WilsonGen은 최근 ACMG & AMP 가이드라인에[16] 따라 변종에 대한 임상 분류를 제공합니다.
PRNP 유전자의 정상적인 변이는 발병 연령을 지연시키고 발병하는 증상의 유형에 영향을 줌으로써 질병의 경과를 수정할 수 있습니다. 이 유전자는 프리온 단백질을 생산하는데, 이 단백질은 뇌와 다른 조직에서 활동하며 구리 운반에도 관여하는 것으로 보입니다.[17] ApoE 유전자의 역할은 처음에는 의심되었지만 확인할 수 없었습니다.[15]
이 상태는 상염색체 열성 패턴으로 유전됩니다. 유전을 하려면 개인의 부모 모두 영향을 받는 유전자를 가지고 있어야 합니다. 대부분 가족력이 없습니다.[15] 하나의 비정상적인 유전자만을 가진 사람들을 캐리어(헤테로자임신고트)라고 하며, 경미하지만 의학적으로는 미미한 구리 대사 이상을 가질 수 있습니다.[14]
윌슨병은 간에 구리 과부하를 일으키는 유전성 질환의 가장 흔한 병입니다. 모두 어린 나이에 간경변을 일으킬 수 있습니다. 이 그룹의 다른 구성원은 인도 소아 간경변증(ICC), 풍토병인 Tyrolean 영아 간경변증 및 특발성 구리 중독증입니다. 이것들은 ATP7B 돌연변이와 관련이 없습니다. 예를 들어 ICC는 KRT8 및 KRT18 유전자의 돌연변이와 관련이 있습니다.[15]
병태생리학

구리는 신체에서 여러 가지 기능을 위해 필요하며, 주로 세룰로플라스민, 시토크롬 c 산화효소, 도파민 β-하이드록실라제, 초과산화물 디스무타제 및 티로시나제와 같은 여러 효소의 보조인자로 사용됩니다.[15]
구리는 소화관을 통해 몸속으로 들어갑니다. 소장 세포에 있는 수송 단백질인 구리막 수송체 1(Ctr1; SLC31A1)은 세포 내부에서 구리를 운반하며, 일부는 메탈로티오네인에 결합되고 일부는 ATOX1에 의해 트랜스-골기 네트워크로 알려진 소기관으로 운반됩니다. 여기서 구리의 농도 상승에 반응하여 ATP7A(Menkes' protein)라는 효소가 간으로 가는 간문맥으로 구리를 방출합니다. 간세포도 CMT1 단백질을 갖고 있는데 메탈로티오네인과 ATOX1이 세포 안에 결합하지만 여기서는 ATP7B가 구리를 세룰로플라스민과 연결해 혈류로 방출하는 것은 물론 담즙으로 분비해 과잉 구리를 제거합니다. ATP7B의 두 가지 기능은 윌슨병에서 모두 손상되었습니다. 구리는 간 조직에 축적되는데, 세룰로플라스민은 여전히 분비되지만, 구리가 부족한 형태(apo-ceruloplasmin이라 함)로 혈류에서 빠르게 분해됩니다.[15]
간 내 구리의 양이 정상적으로 결합하는 단백질을 압도하게 되면 펜톤 화학이라는 과정을 통해 산화적 손상을 일으키는데, 이러한 손상은 결국 만성 활동성 간염, 섬유화(결합조직의 침착), 간경변증으로 이어집니다. 간은 또한 세룰로플라스민과 결합되지 않은 구리를 혈류로 방출합니다. 이 유리 구리는 몸 전체에 침전되지만 특히 신장, 눈, 뇌에 침전됩니다. 뇌에서 대부분의 구리는 기저 신경절, 특히 부비동과 팔리두스(함께 렌티큘러 핵이라고 함)에 침착됩니다. 이 영역들은 일반적으로 움직임의 조정에 참여하고 자극의 처리와 기분 조절과 같은 신경 인지 과정에서 중요한 역할을 합니다. 펜톤 화학에 의해 이러한 부위가 손상되면 윌슨병에서 볼 수 있는 신경정신과적 증상이 나타납니다.[15]
윌슨병이 용혈을 일으키는 이유는 불분명하지만, 다양한 증거에 따르면 높은 수준의 유리(비세룰로플라스민 결합) 구리는 헤모글로빈의 산화, 적혈구의 에너지 공급 효소의 억제 또는 세포막의 직접적인 손상에 직접적인 영향을 미칩니다.[18]
진단.

윌슨병은 위에서 언급한 모든 증상을 근거로 의심할 수도 있고, 가까운 친척이 윌슨병에 걸린 것으로 밝혀졌을 때 의심할 수도 있습니다. 대부분 아스파르테이트 트랜스아미나제, 알라닌 트랜스아미나제, 빌리루빈 수치 상승 등 약간의 간기능 검사 이상이 있습니다. 간 손상이 심할 경우 손상된 간 세포가 이 단백질을 생성하지 못해 알부민이 감소할 수 있으며, 마찬가지로 간에서 응고 인자로 알려진 단백질을 생성하지 못해 프로트롬빈 시간(응고 테스트)이 길어질 수 있습니다.[5] Wilson과 관련된 급성 간부전이 있는 사람들은 알칼리성 포스파타제 수치가 상대적으로 낮습니다.[19] 신경학적 증상이 보이면 뇌의 자기공명영상을 주로 하는데, 이는 T2 환경에서 기저신경절이라는 뇌 부위의 초강도를 보여줍니다.[14] MRI는 또한 특징적인 "자이언트 팬더의 얼굴" 패턴을 보여줄 수 있습니다.[20]
윌슨병에 대한 완전히 신뢰할 수 있는 검사는 알려져 있지 않지만, 혈액 속의 세로로플라스민과 구리의 수치와 24시간 동안 소변으로 배설되는 구리의 양은 몸 속의 구리의 양에 대한 인상을 형성하는 데 함께 사용됩니다. 금본위제 혹은 가장 이상적인 검사는 간 조직검사입니다.[5]
세룰로플라스민

ceruloplasmin의 수치는 80-95%에서 비정상적으로 낮습니다(<0.2 g/L).[5] 그러나 급성기 단백질이기 때문에 지속적인 염증이 있는 사람에게는 정상 수준으로 존재할 수 있습니다. 낮은 세룰로플라스민은 멘케스병과 세룰로플라스민혈증에서도 발견되는데, 이들은 윌슨병과 관련이 있지만 그보다 훨씬 더 희귀합니다.[5][14] 윌슨병의 진단은 신경학적 증상과 눈의 징후, 낮은 세룰로플라스민 수치의 조합만으로도 충분하다고 생각됩니다. 그러나 많은 경우 추가 테스트가 필요합니다.[14]
혈청 및 소변 구리
혈청 구리가 낮은데, 윌슨병이 구리 과잉의 병이라는 점을 감안하면 역설적으로 보일 수 있습니다. 그러나 혈장 구리의 95%는 세룰로플라스민에 의해 운반되는데, 이는 윌슨병에서 종종 낮은 수준입니다. 소변 구리는 윌슨병에서 상승되어 구리가 없는 라이너가 있는 병에 24시간 동안 모아집니다. 100μg/24h(1.6μmol/24h) 이상의 수치는 윌슨병을 확인하고, 40μg/24h(0.6μmol/24h) 이상의 수치는 강한 징후입니다.[5] 높은 소변 구리 수치는 윌슨병에만 있는 것이 아닙니다. 자가면역 간염과 담즙 정체(간에서 소장으로 담즙의 흐름을 방해하는 모든 질병)에서 가끔 관찰됩니다.[14]
소아의 경우 페니실라민 검사를 사용할 수 있습니다. 페니실라민 500mg을 경구 투여하고 소변을 24시간 동안 채취합니다. 이것이 1600μg(25μmol) 이상 포함되어 있으면 윌슨병의 신뢰할 수 있는 지표입니다.[clarification needed] 이 테스트는 성인에서 검증되지 않았습니다.[14]
슬릿 램프 검사
Kayser를 찾기 위해 환자의 눈을 슬릿 램프로 검사합니다.Fleischer 고리는 Wilson 병과 강하게 연관되어 있으며 Descemet 막의 내부 각막에 구리가 침착되어 발생합니다.[10]
간생검
다른 조사에서 윌슨병이 발견되면 간 조직검사를 통해 소량의 간 조직을 제거하는 것이 가장 좋은 검사입니다. 이것은 지방증과 간경변의 정도에 대해 현미경으로 평가되며, 구리의 조직화학과 정량화는 구리 축적의 심각성을 측정하는 데 사용됩니다. 건조된 간 조직 1g당 구리 250μg의 수치는 윌슨병을 확인시켜줍니다. 간혹 낮은 수준의 구리가 발견되기도 하는데, 이 경우 조직검사 결과와 다른 모든 검사를 결합하면 윌슨병에 대한 공식적인 진단을 내릴 수 있습니다.[5]
질병의 초기 단계에서 조직검사는 일반적으로 지방증(지방 물질의 침착), 핵의 글리코겐 증가 및 괴사 영역(세포 사멸)을 보여줍니다. 더 진행된 질병에서 관찰된 변화는 염증 세포에 의한 침윤, 단편적 괴사, 섬유화(흉터 조직)와 같은 자가면역 간염에서 볼 수 있는 변화와 상당히 유사합니다. 진행성 질환에서는 마지막으로 간경변이 주된 소견입니다. 급성 간부전에서는 간세포의 변성과 간조직 구조의 붕괴가 관찰되는데, 일반적으로 간경화 변화를 배경으로 합니다. 구리를 검출하는 조직화학적 방법은 일관성이 없고 신뢰할 수 없으며, 단독으로 복용하는 것만으로는 진단을 내리기에 부족한 것으로 간주됩니다.[14]
유전자검사
ATP7B 유전자와 간 내 구리 축적과 연관된 다른 유전자의 돌연변이 분석을 수행할 수 있습니다. 변이가 확인되면 임상 유전학 가족 상담의 일환으로 가족을 대상으로 질병 검진을 받을 수 있습니다.[5] 윌슨병과 관련된 유전자의 지역 분포는 임상의가 적절한 스크리닝 전략을 설계하는 데 도움이 될 수 있기 때문에 따라야 하는 중요합니다. ATP7B 유전자의 돌연변이는 집단마다 다르기 때문에, 미국이나 영국과 같은 나라들에서 행해지는 연구와 유전자 검사는 그들이 더 많은 혼합 집단을 가지고 있는 경향이 있기 때문에 문제를 일으킬 수 있습니다.[21]
치료
다이어트
일반적으로 구리 함유 식품이 적은 식단은 버섯, 견과류, 초콜릿, 말린 과일, 간, 참깨와 참기름, 조개류 등을 피하는 것이 좋습니다.[5]
약
윌슨병은 의학적 치료가 가능합니다. 어떤 것은 몸에서 구리가 제거되는 것을 증가시키는 반면, 다른 것은 식단에서 구리가 흡수되는 것을 방지합니다.
일반적으로 페니실라민은 가장 먼저 사용되는 치료제입니다. 이것은 구리를 묶어서 소변으로 구리가 배설되게 합니다. 따라서 소변 내 구리의 양을 모니터링하여 충분히 많은 양을 섭취할 수 있도록 할 수 있습니다. 페니실라민은 문제가 없는 것이 아닙니다. 약 20%는 약물로 인한 루푸스(관절통 및 피부 발진 유발) 또는 근육감소증(근육 약화로 이어지는 신경 상태)과 같은 페니실라민 치료의 부작용 또는 합병증을 경험합니다. 신경학적 증상을 보인 사람들 중 거의 절반은 증상이 역설적으로 악화되는 것을 경험합니다. 이러한 현상은 윌슨병의 다른 치료에서 관찰되지만, 일반적으로 페니실라민을 중단하고 2차 치료를 시작하는 징후로 간주됩니다.[5][14] 페니실라민에 대한 내성은 대신 킬레이트 특성을 갖는 트리엔틴 염산염에서 시작될 수 있습니다. 일부에서는 트리엔틴을 1차 치료로 권장하지만 페니실라민에 대한 경험은 더 광범위합니다.[14] Wilson Therapeutics의 임상 조사에 따르면, Wilson 병에서 활동성이 알려진 추가 약제는 tetrathiomolybate입니다. 일부 연구에서 유익한 효과가 나타났지만,[14] 이는 실험적인 것으로 간주됩니다.[5]
모든 결과가 정상으로 돌아오면 체내에서 안정적인 구리 수준을 유지하기 위해 킬레이트제 대신 아연(보통 갈진이라고 불리는 아세트산아연 처방의 형태)을 사용할 수 있습니다. 아연은 장세포에 있는 단백질인 메탈로티오네인을 자극하여 구리를 결합시키고 간으로의 흡수와 운반을 막습니다. 증상이 재발하거나 구리의 소변 배설량이 증가하지 않는 한 아연 치료를 계속합니다.[14]
경구 치료제 중 어느 것도 효과가 없는 드문 경우, 특히 심각한 신경 질환에서 다이머카프롤(British anti-Lewisite)이 필요한 경우가 간혹 있습니다. 이 치료법은 몇 주에 한 번씩 근육 내(근육 내) 주사를 맞고 통증과 같은 불쾌한 부작용이 있습니다.[22]
무증상자(예를 들어 가족 검진을 통해 진단받거나 검사 결과 이상으로 진단받은 사람)는 구리 축적으로 인해 향후 장기적인 손상이 발생할 수 있으므로 일반적으로 치료합니다. 이 사람들이 페니실라민이나 아세트산 아연으로 가장 잘 치료되는지는 불분명합니다.[14]
물리치료 및 작업치료
물리치료와 작업치료는 신경학적 형태의 질병을 가진 환자들에게 유익합니다. 구리 킬레이트 치료법은 효과를 시작하는 데 최대 6개월이 걸릴 수 있으며, 이러한 치료법은 운동실조, 운동실조 및 떨림에 대처하고 운동실조로 인해 발생할 수 있는 수축의 발달을 방지하는 데 도움이 될 수 있습니다.[23]
이식
간 이식은 윌슨병의 효과적인 치료법이지만, 시술과 관련된 위험과 합병증 때문에 특정 시나리오에서만 사용됩니다. 주로 치료에 반응하지 못하는 전격성 간부전 환자나 진행성 만성 간질환자에게 사용됩니다. 간 이식은 그 이점이 입증되지 않은 심각한 신경 정신 질환에서 기피됩니다.[5][14]
예후
윌슨의 병은 치료를 받지 않고 방치하면 점차 악화되는 경향이 있고 결국에는 치명적입니다. 심각한 합병증으로는 간경변, 급성 신부전, 정신병 등이 있습니다. 간암과 담관암이 발생할 수도 있지만 다른 만성 간질환에 비해 발생률이 낮고 치료로 위험도가 크게 줄어듭니다.[13] 조기 발견과 치료로 피해자 대부분은 비교적 정상적인 생활을 할 수 있고, 일반인에 가까운 기대수명을 가질 수 있습니다.[13] 치료 전에 발생하는 간 및 신경 손상은 호전될 수 있지만 영구적인 경우가 많습니다.[24] 불임은 보통 정상이고 치료를 받는 윌슨병 환자의 임신 합병증은 증가하지 않습니다.[13]
역사
이 병은 1912년에 뇌와 간의 병리학적 변화를 포함하여 이 병을 기술한 신경학자인 영국 의사 사무엘 알렉산더 키니에 윌슨 (1878–1937)의 이름을 가지고 있습니다.[25] 윌슨의 연구는 1883년 독일의 신경학자 칼 베스트팔(Karl Westphal, 1888년 영국의 신경학자 윌리엄 고워스(William Gowers, 1888년),[26] 질병의 유전적 특성에 주목한 핀란드의 신경병리학자 에른스트 알렉산더 호멘(Ernst Alexander Homén, 1889년-1892년),[27] 그리고 아돌프 스트룀펠(Adolph Strümpell, 1898년)의 보고에 의해 선행되고 그 결과를 도출했습니다. 간경변증에 주목한 [26]사람입니다 신경병리학자 존 나다니엘 커밍스는 1948년에 간과 뇌 모두에 구리가 축적되는 것을 연결시켰습니다.[28] 용혈의 발생은 1967년에 주목되었습니다.[29]
1951년, 미국에서 일하는 커밍스와 뉴질랜드의 신경학자 데릭 데니 브라운은 동시에 금속 킬레이트제인 영국산 안티 르위사이트를 사용한 최초의 효과적인 치료법을 보고했습니다.[30][31] 이 치료법은 주사를 맞아야 했지만, 신경학 분야에서 사용할 수 있는 최초의 치료법 중 하나였습니다. 이 분야는 고전적으로 관찰하고 진단할 수 있었지만, 제공할 수 있는 치료법은 거의 없었습니다.[26][32] 최초의 효과적인 경구용 킬레이트제인 페니실라민은 1956년 영국의 신경학자 존 월쉬에 의해 발견되었습니다.[33] 1982년, Walshe는 트리엔틴(trientine)을 도입하기도 했으며,[34] 테트라티오몰리브데이트(tetra-thiomolybate)를 임상에 사용하기 위해 최초로 개발했습니다.[35] 아세트산아연 치료법은 네덜란드에서 처음 등장했는데, 의사인 Schouwink와 Hoogenraad가 각각 1961년과 1970년대에 사용했지만, 이후 미시간 대학교의 브루어와 동료들에 의해 더 발전되었습니다.[22][36]
윌슨병의 유전적 기초와 ATP7B 돌연변이와의 연관성은 1980년대와 1990년대에 여러 연구 그룹에 의해 밝혀졌습니다.[37][38]
다른 동물들에게서
유전적 구리 축적은 일반적으로 간에만 영향을 미치는 [39]베들링턴 테리어에서 설명되었습니다. COMD1(또는 MURR1) 유전자의 돌연변이 때문입니다.[40] 이러한 연구 결과에도 불구하고, COMD1 돌연변이는 유전적 기원을 설명하기 위해 비 Wilsonian 구리 축적 상태(인도 소아 간경변증과 같은)를 가진 사람에게서는 검출되지 않았습니다.[41]
참고 항목
참고문헌
- ^ a b c d e f g h i "Wilson Disease". NIDDK. July 2014. Archived from the original on 2016-10-04. Retrieved 2016-11-06.
- ^ Lynn, D. Joanne; Newton, Herbert B.; Rae-Grant, Alexander (2004). The 5-minute Neurology Consult. Lippincott Williams & Wilkins. p. 442. ISBN 9780683307238. Archived from the original on 2016-11-07.
- ^ Sahani, Dushyant V.; Samir, Anthony E. (2016). Abdominal Imaging: Expert Radiology Series (2 ed.). Elsevier Health Sciences. p. 400. ISBN 9780323431613. Archived from the original on 2016-11-07.
- ^ "Whonamedit – dictionary of medical eponyms". www.whonamedit.com. Archived from the original on 2016-11-07. Retrieved 2016-11-06.
- ^ a b c d e f g h i j k l m n o p q r s t u v Ala A, Walker AP, Ashkan K, Dooley JS, Schilsky ML (2007). "Wilson's disease". Lancet. 369 (9559): 397–408. doi:10.1016/S0140-6736(07)60196-2. PMID 17276780. S2CID 24663871.
- ^ a b c Merle U, Schaefer M, Ferenci P, Stremmel W (2007). "Clinical presentation, diagnosis and long‐term outcome of Wilson's disease: a cohort study". Gut. 56 (1): 115–20. doi:10.1136/gut.2005.087262. PMC 1856673. PMID 16709660.
- ^ "Wilson's disease - Symptoms and causes". Mayo Clinic. Retrieved 2022-10-05.
- ^ a b c Lorincz MT (2010). "Neurologic Wilson's disease" (PDF). Annals of the New York Academy of Sciences. 1184 (1): 173–87. Bibcode:2010NYASA1184..173L. doi:10.1111/j.1749-6632.2009.05109.x. hdl:2027.42/78731. PMID 20146697. S2CID 2989668.
- ^ Pagonabarraga, J; Goetz, C (2012). Biller, J (ed.). Practical Neurology (4th ed.). Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins Heath. p. 282. ISBN 978-1451142631.
- ^ a b Pandey, Nivedita; John, Savio (21 June 2022). "Kayser-Fleischer Ring". StatPearls. Treasure Island, Florida: StatPearls Publishing. PMID 29083643. Retrieved 30 November 2022.
- ^ Roberts, Eve A.; Schilsky, Michael L. (2008). "Diagnosis and treatment of Wilson disease: An update". Hepatology. 47 (6): 2089–2111. doi:10.1002/hep.22261. PMID 18506894.
- ^ Yanoff, Myron; Jay S. Duker (2008). Ophthalmology (3rd ed.). Edinburgh: Mosby. p. 411. ISBN 978-0323057516.
- ^ a b c d Roberts, Eve A.; Schilsky, Michael L. (7 September 2023). "Current and Emerging Issues in Wilson's Disease". New England Journal of Medicine. 389 (10): 922–938. doi:10.1056/NEJMra1903585.
- ^ a b c d e f g h i j k l m n Roberts, Eve A.; Schilsky, Michael L. (2003). "A practice guideline on Wilson disease". Hepatology. 37 (6): 1475–92. doi:10.1053/jhep.2003.50252. PMID 12774027. S2CID 263620.
- ^ a b c d e f g de Bie P, Muller P, Wijmenga C, Klomp LW (November 2007). "Molecular pathogenesis of Wilson and Menkes disease: correlation of mutations with molecular defects and disease phenotypes". J. Med. Genet. 44 (11): 673–88. doi:10.1136/jmg.2007.052746. PMC 2752173. PMID 17717039.
- ^ Kumar, Mukesh; Gaharwar, Utkarsh; Paul, Sangita; Poojary, Mukta; Pandhare, Kavita; Scaria, Vinod; Bk, Binukumar (2020-06-03). "WilsonGen a comprehensive clinically annotated genomic variant resource for Wilson's Disease". Scientific Reports. 10 (1): 9037. Bibcode:2020NatSR..10.9037K. doi:10.1038/s41598-020-66099-2. ISSN 2045-2322. PMC 7270127. PMID 32493955.
- ^ Grubenbecher S, Stüve O, Hefter H, Korth C (2006). "Prion protein gene codon 129 modulates clinical course of neurological Wilson disease". NeuroReport. 17 (5): 549–52. doi:10.1097/01.wnr.0000209006.48105.90. PMID 16543824. S2CID 37186426.
- ^ Lee GR (1999). "Chapter 48: acquired hemolytic anaemias resulting from direct effects of infectious, chemical or physical agents". In Lee GR, Foerster J, Lukens J, et al. (eds.). Wintrobe's clinical hematology. Vol. 1 (10th ed.). Williams & Wilkins. pp. 1298. ISBN 978-0-683-18242-2.
- ^ Shaver WA, Bhatt H, Combes B (1986). "Low serum alkaline phosphatase activity in Wilson's disease". Hepatology. 6 (5): 859–63. doi:10.1002/hep.1840060509. PMID 3758940. S2CID 24055787.
- ^ Das SK, Ray K (September 2006). "Wilson's disease: an update". Nat Clin Pract Neurol. 2 (9): 482–93. doi:10.1038/ncpneuro0291. PMID 16932613. S2CID 205340375.
- ^ Ferenci, Peter (2006-06-22). "Regional distribution of mutations of the ATP7B gene in patients with Wilson disease: impact on genetic testing". Human Genetics. 120 (2): 151–159. doi:10.1007/s00439-006-0202-5. ISSN 0340-6717. PMID 16791614. S2CID 10124665.
- ^ a b Walshe JM (July 1996). "Treatment of Wilson's disease: the historical background". QJM. 89 (7): 553–55. doi:10.1093/qjmed/89.7.553. PMID 8759497.
- ^ Brewer GJ, Askari FK (2005). "Wilson's disease: clinical management and therapy". Journal of Hepatology. 42 (Suppl 1): 13–21. doi:10.1016/j.jhep.2004.11.013. PMID 15777568.
- ^ "Definition and Facts NIDDK". National Institute of Diabetes and Digestive and Kidney Diseases. Retrieved 2019-02-01.
- ^ Kinnier Wilson SA (1912). "Progressive lenticular degeneration: a familial nervous disease associated with cirrhosis of the liver". Brain. 34 (1): 295–507. doi:10.1093/brain/34.4.295.
- ^ a b c Robertson WM (February 2000). "Wilson's disease". Arch. Neurol. 57 (2): 276–77. doi:10.1001/archneur.57.2.276. PMID 10681092.
- ^ Homén EA (1892). "Eine eigenthümliche bei drei Geschwistern auftretende typische Krankheit unter der Form einer progressiven Dementia in Verbindung mit ausgedehnten Gefässveränderungen (wohl Lues hereditaria tarda)". Archiv für Psychiatrie und Nervenkrankheiten. 24: 1–38.
- ^ Cumings JN (1948). "The copper and iron content of brain and liver in the normal and in hepato-lenticular degeneration". Brain. 71 (Dec): 410–15. doi:10.1093/brain/71.4.410. PMID 18124738.
- ^ McIntyre N, Clink HM, Levi AJ, Cumings JN, Sherlock S (February 1967). "Hemolytic anemia in Wilson's disease". N. Engl. J. Med. 276 (8): 439–44. doi:10.1056/NEJM196702232760804. PMID 6018274.
- ^ Cumings JN (March 1951). "The effects of B.A.L. in hepatolenticular degeneration". Brain. 74 (1): 10–22. doi:10.1093/brain/74.1.10. PMID 14830662.
- ^ Denny-Brown D, Porter H (December 1951). "The effect of BAL (2,3-dimercaptopropanol) on hepatolenticular degeneration (Wilson's disease)". N. Engl. J. Med. 245 (24): 917–25. doi:10.1056/NEJM195112132452401. PMID 14882450.
- ^ Vilensky JA, Robertson WM, Gilman S (September 2002). "Denny-Brown, Wilson's disease, and BAL (British antilewisite [2,3-dimercaptopropanol])". Neurology. 59 (6): 914–16. doi:10.1212/wnl.59.6.914. PMID 12297577.
- ^ Walshe JM (January 1956). "Wilson's disease; new oral therapy". Lancet. 270 (6906): 25–26. doi:10.1016/S0140-6736(56)91859-1. PMID 13279157.
- ^ Walshe JM (March 1982). "Treatment of Wilson's disease with trientine (triethylene tetramine) dihydrochloride". Lancet. 1 (8273): 643–47. doi:10.1016/S0140-6736(82)92201-2. PMID 6121964. S2CID 205999334.
- ^ Harper PL, Walshe JM (December 1986). "Reversible pancytopenia secondary to treatment with tetrathiomolybdate". Br. J. Haematol. 64 (4): 851–53. doi:10.1111/j.1365-2141.1986.tb02250.x. PMID 3801328. S2CID 11546705.
- ^ Brewer GJ (January 2000). "Recognition, diagnosis, and management of Wilson's disease". Proc. Soc. Exp. Biol. Med. 223 (1): 39–46. doi:10.1046/j.1525-1373.2000.22305.x. PMID 10632959. Archived from the original on 2008-04-09. Retrieved 2008-05-20.
- ^ Bull PC, Thomas GR, Rommens JM, Forbes JR, Cox DW (1993). "The Wilson disease gene is a putative copper transporting P-type ATPase similar to the Menkes gene". Nat. Genet. 5 (4): 327–37. doi:10.1038/ng1293-327. PMID 8298639. S2CID 1236890.
- ^ Tanzi RE, Petrukhin K, Chernov I, et al. (1993). "The Wilson disease gene is a copper transporting ATPase with homology to the Menkes disease gene". Nat. Genet. 5 (4): 344–50. doi:10.1038/ng1293-344. PMID 8298641. S2CID 610188.
- ^ Sternlieb I, Twedt DC, Johnson GF, et al. (1977). "Inherited copper toxicity of the liver in Bedlington terriers". Proc. R. Soc. Med. 70 Suppl 3 (Suppl 3): 8–9. PMC 1543595. PMID 122681.
- ^ van De Sluis B, Rothuizen J, Pearson PL, van Oost BA, Wijmenga C (2002). "Identification of a new copper metabolism gene by positional cloning in a purebred dog population". Hum. Mol. Genet. 11 (2): 165–73. doi:10.1093/hmg/11.2.165. PMID 11809725.
- ^ Müller T, van de Sluis B, Zhernakova A, et al. (2003). "The canine copper toxicosis gene MURR1 does not cause non-Wilsonian hepatic copper toxicosis". J. Hepatol. 38 (2): 164–68. doi:10.1016/S0168-8278(02)00356-2. PMID 12547404.





