염기성 갱년기병
Basal ganglia disease| 염기성 갱년기병 | |
|---|---|
 | |
| 기초 갱년기 및 관련 구조물 | |
| 전문 | 신경학 |
| 종류들 | 8 |
기저성 갱년기 질환은 기저성 갱년기로 알려진 뇌의 핵군이 원치 않는 움직임을 제대로 억제하지 못하거나 상부 운동 뉴런 회로를 적절히 프라이밍하지 못해 운동기능을 시작할 때 발생하는 신체적 문제의 집단이다.[1] 연구 결과에 따르면 기저 신경세포의 생산량이 증가하면 혈전투영 뉴런이 억제된다. 이러한 뉴런의 적절한 활성화 또는 비활성화는 적절한 움직임을 위한 필수 요소다. 만약 어떤 것이 너무 많은 기저성 갱년기 출력을 유발한다면, 복측 전방(VA)과 복측(VL) 탈모구투영 뉴런은 너무 억제되어 자발적인 움직임을 시작할 수 없게 된다. 이 장애들은 저동맥 질환으로 알려져 있다. 그러나 기저신경절의 비정상적인 저출력으로 이어지는 장애는 피질에 시냅스되는 태음극 투영 뉴런(VA와 VL)의 억제를 감소시켜 흥분시킨다. 이런 상황은 원치 않는 움직임을 억제할 수 없게 된다. 이러한 장애는 과육성 장애로 알려져 있다.[2]
기저 갱년기 생산량이 비정상적으로 증가하거나 감소하는 이유는 아직 잘 알려져 있지 않다. 한 가지 가능한 요인은 철분이 기저조직에 자연적으로 축적되어 독성, 자유방사성 반응에 관여하기 때문에 신경분열을 유발하는 것일 수 있다.[3] 운동장애가 기저성 강박증과 관련된 가장 흔한 증상임에도 불구하고, 최근의 연구는 기초 강박장애가 강박-강박장애(OCD), 투레트 증후군 같은 다른 장애로 이어질 수 있다는 것을 보여준다.[4]
기본 갱도 회로
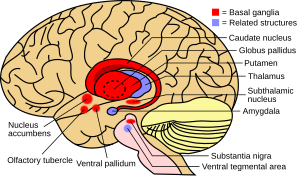
기초적인 갱년기는 뇌의 구조들의 집합적인 그룹이다. 여기에는 선조체(Putamen 및 Caudate nucleus composed), 글로부스 팔리두스(globus palidus), 실체니아 니그라(semberia nigra), 아탈람 핵 등이 포함된다. 다른 구조물과 함께 기저성 갱년기는 자발적 운동 기능에 필수적인 신경 회로의 일부분이다.[1] 한때는 대뇌피질로부터의 투영을 통합하고, 홍상을 통해 운동피질까지 정보를 투영하는 것이 기저조직의 주요 기능이라고 믿어졌다. 연구 결과에 따르면 기저신경절은 피질 영역에서 발생하며 기저신경절을 통과하고 전두엽의 특정 부위에서 종단되는 평행 재전위 피질-하위체 회로의 구성 요소 그룹으로 모델링될 수 있다.[4] 이 영역들은 운동 기능뿐만 아니라 오쿨로모터, 전전면, 연관성, 변연성 영역을 통제하는 것으로 생각된다.[2] 이러한 회로를 이해하는 것은 기초적인 갱년기의 장애를 이해하는 데 획기적인 발전을 가져왔다.
직접경로
모든 회로 중에서 모터 회로가 운동 장애에 중요하기 때문에 가장 많이 연구되고 있다. 모터 회로의 직접 경로는 피질로부터 피질로부터 피질로부터 피질로부터 피질까지 직접 피질로부터 피질로부터 피질까지 직접 피질부로 이동하여 글로부스 팔리두스(GPI, GP-Medial) 또는 실체니아 니그라, 파스 레티쿨라타(SNR)로 이동한 다음, 탈라무의 복측핵(VA)으로 향하는 것이다.s(VL) 및 뇌계.[2][4] 이 경로를 통해 기저성 갱년기는 상부 운동 뉴런을 구동하는 탈라믹 뉴런을 억제하지 않음으로써 자발적인 움직임을 시작할 수 있다.[1] 이 과정은 선조체가 SNc의 D도파민1 수용체에 분비하는 도파민에 의해 조절된다. 도파민은 직접 경로에 있는 선조체 뉴런을 흥분시킨다.[5] 적절한 선조체 도파민 방출은 탈라믹 뉴런의 활동성을 증가시키기 위해 필요한 기저 갱년기 출력의 억제에 필수적이다.[2] 탈라믹 핵에서 이 활동은 자발적 운동의 필수 요소다.
간접경로
모터 회로의 간접 경로는 피질, 피질, 피질, 피질, 피질, 피질, 피질, 피질, 피질, 뇌실, 피질, 피질, 피질(GPe)의 외부 구간을 지나 치질핵(STN)을 우회적으로 투영한 후 글로부스 팔리두스(GPI)의 내부 구간으로 되돌아가는 것으로 생각된다.[4] 간접적인 통로가 이동 종료를 책임진다. 간접경로는 다른 GPI와 SNr 뉴런에 대한 흥분 입력이 동시에 증가하여 원치 않는 움직임을 억제한다.[4] 직접 경로와 유사하게, 간접 경로는 선조체 도파민에 의해 조절된다. D2 도파민 수용체는 간접 경로를 통한 전달을 억제한다. D2 수용체는 간접적이고 억제적인 경로에서 선조체 뉴런을 억제한다.[5] 간접통로에 대한 도파민의 이러한 억제 효과는 기저 갱년기 출력을 감소시켜 운동 뉴런의 저하를 초래한다는 점에서 직접통로의 흥분 효과와 같은 기능을 한다.[2]
관련 장애
저동맥 장애
저동맥질환은 운동기능이 저하된 것으로 묘사되는 운동장애다. 이는 일반적으로 정상 기저 신경세포 출력이 정상보다 높기 때문에 탈모성 운동 신경세포의 억제가 발생하기 때문이다.
파킨슨병
파킨슨병의 주요 운동 증상인 근육 경직성, 정지 상태의 떨림, 움직임의 시작과 실행의 느려짐은 실체성 니그라의 파스 콤팩타로부터 점차적으로 내경사가 감소하여 기저 갱리아 운동 부위, 특히 피타멘에서 도파민성 활성의 감소에 기인한다.[6] 자율기능 장애, 인지 장애, 보행/균형 장애와 같은 파킨슨병들의 다른 운동결손과 일반적인 비운동적 특징들은 낮은 뇌간에서 시작하여 중뇌, 편도, 쇄골, 궁극적으로는 대뇌피질까지 상승하는 광범위한 진행성 병리학적 변화에서 기인한다고 생각된다.[4]
과육성 장애
과키네틱장애는 걷잡을 수 없는 운동기능이 증가해 나타나는 운동장애다. 그것들은 기저 갱년기 출력의 감소에 의해 발생하는데, 이것은 원치 않는 움직임을 멈출 수 없게 만드는 탈모성 기능을 증가시킨다.
헌팅턴병
헌팅턴병은 행동, 인지, 그리고 통제되지 않는 빠르고 육포적인 움직임의 결함을 일으키는 유전병이다.[1] 헌팅턴병은 4번 염색체의 짧은 팔 p에 위치한 헌팅틴 유전자(HTT)에서 확장된 CAG 반복으로 구성된 결함으로 인해 발생한다.[7] 헌팅턴병 환자들의 기저성 강낭콩이 미토콘드리아 경로인 복합 II-III의 활동 감소를 보인다는 증거가 있다. 그러한 결핍은 종종 기저성 갱년기 퇴화와 관련이 있다.[8] GPe에 투영되는 선조체 뉴런의 이러한 퇴화는 간접적인 경로의 저해, 비탈사성 핵의 억제 증가, 그리고 따라서 기저 갱년기 출력의 감소로 이어진다.[2] 뉴런 퇴화는 결국 10~20년 안에 죽음을 초래한다.
디스토니아
디스토니아(Dystonia)는 과육성 운동 장애로, 무의식적인 움직임과 의도적인 움직임의 둔화가 특징이다. 대사, 혈관, 구조적 이상 등 다이어스토니아의 원인이 알려져 있지만 뚜렷한 원인이 없는 다이어스토니아 환자는 여전히 존재한다. 디스토니아는 과육성 장애로 발생하거나 파킨슨병과 같은 저동맥성 질환의 부작용으로 발생할 수 있다.[9] 최근까지 디스토니아는 푸타멘과 GPI 사이의 직접적인 경로의 기능이 극도로 부족했기 때문일 가능성이 높다고 생각되었다. 다시 말하지만, 이러한 기능장애는 시상하부에 대한 기저 갱년기 출력의 감소와 그 결과 전치 및 운동 피질에 대한 탈라믹 투영의 거부감을 증가시키는 결과를 초래한다고 생각되었다.[10] 그러나 쥐의 최근 모델들은 소뇌의 기능장애가 디스토니아에서도 같은 역할을 할 수 있다는 것을 보여준다.[11]
헤미발리스무스
헤미발리스무스는 몸의 한쪽에 통제되지 않는 움직임을 일으키는 과육운동장애다. 그것은 일반적으로 STN(Subthalamic nuclear)의 손상에 의해 발생한다. 글로부스 팔리두스(GPI)의 내부 부분이 STN과 탈라믹 투영 사이의 회로의 연결고리인 만큼, 완화증을 통한 GPI 내 국부적 뇌세포의 파괴는 혈전증에 유용한 치료제 역할을 하는 것으로 입증되었다.[9]
기타 기저성 갱년기 질환
일반적으로 기저질환을 수반하는 다음의 질병은 피하증이나 과육상증에 명확하게 들어맞지 않는다.
뇌전증
실체형 니그라 파스 레티쿨라타와 그것의 직접 입력 구조인 아탈라믹 핵은 발작 전파 회로에 역할을 하며 발작 게이트 핵으로 설명되어 왔다. 이러한 핵의 억제는 다양한 실험 간질 모델에서 발작을 억제한다. 발작을 일으킨 환자들은 비정상적인 전기생리학적 활동과 그들의 기저 조직 내 위축증, 변화된 혈액관류, 신진대사 같은 구조적 변화를 보인다. 몇몇 사례보고서는 비탈사핵의 깊은 뇌 자극이 발작을 줄이는 데 성공했다고 설명한다. 다른 표적 치료 접근법은 실험 환경에 제한되었고 국소 약물 주입과 세포 이식을 포함했다.[12]
투렛 증후군/욕구-강제 장애
투렛 증후군은 행동과 운동 틱스, 강박장애, 주의력결핍과잉행동장애(ADHD)가 특징인 질환이다. 이러한 이유로, 기저 갱년기의 변연, 연관성, 운동회로를 포함하는 병리학이 있을 가능성이 높다고 일반적으로 여겨진다. 투렛 증후군, OCD와 같은 신드롬이 기저성 갱도 회로의 비운동성 루프 기능 장애에 의해 발생한다는 인식 이후, 이러한 장애에 대한 새로운 치료법이 개발되고 있다.[4]
시덴햄의 안무
시든햄의 안무는 빠르고 조정되지 않은 저킹 동작이 주로 얼굴, 손, 발에 영향을 미치는 것이 특징이다.[13] 그룹 A β-헬리틱 스트렙토코치(GAB)에 의한 감염 후 발생하는 자가면역반응의 결과물이다.HS)[14] 기저 갱년기의 말뭉치 선조체 내 세포를 파괴하는 물질이다.[15][14][16]
판다
PANDA는 강박-강박장애(OCD)나 틱장애의 빠른 발병을 가진 아이들의 하위집합이 존재하며 이러한 증상은 그룹 A β-혈액성 연쇄구균(GAB)에 의해 발생한다는 가설에 논란의 여지가 있다.HS) 감염.[17][18][19] 감염과 이러한 장애 사이의 제안된 연결고리는 GAB에 대한 초기 자가면역 반응이다.HS 감염은 기초적인 갱년기 기능을 방해하는 항체를 생성하여 증상 악화를 초래한다. 이러한 자가면역반응이 광범위한 신경정신과 증세를 일으킬 수 있다는 제안이 나왔다.[20][21]
이질성 뇌성마비
이상성 뇌성마비는 주로 빌리루빈 뇌병증과 저산소성 뇌손상으로 인해 뇌 발달 중에 발생하는 병변 형태의 기저강박 손상과 관련된 뇌성마비의 일종이다.[22] 증상으로는 사지와 몸통의[23] 느리고 통제되지 않는 움직임과 안마라고 알려진 작고, 빠르고, 무작위적이고, 반복적이고, 통제되지 않는 움직임이 있다.[24] 무의식적인 움직임은 종종 감정적인 스트레스나 흥분 기간 동안 증가하며, 환자가 잠을 자거나 산만할 때 사라진다.[24]
애티모어 증후군
Athymhormic syndrome은 극단적인 수동성, 무관심, 무감각성, 무감각한 영향, 그리고 자기 동력의 심오한 일반화된 상실로 특징지어지는 희귀한 사이코패스 및 신경학적 증후군이다. 이 증후군은 기저신경절 또는 전두피질, 특히 동기부여와 집행기능을 담당하는 선조체 및 구상체 팔리두스의 손상 때문인 것으로 생각된다.[25]
레슈-니한 증후군
레슈-니한 증후군은 효소 히산산산틴-과닌인산인포리보실전달효소(HGPRT) 결핍으로 인한 희귀 X연계 열성질환으로 요산이 쌓이고 도파민 생산량이 부족하게 된다.[26] 생후 처음 몇 년 안에 외사적 관여는 운동조절의 상실(디스토니아), 비틀림 운동(코레오테토누스), 척추의 아치(오피스토토토누스)와 같은 비정상적인 비자발적 근육수축을 일으킨다. 이질성 뇌성마비증의 유사성은 명백하며, 그 결과 대부분의 사람들은 처음에 뇌성마비를 앓고 있는 것으로 진단된다. 심리적인 행동에는 원하는 간식이나 여행을 거부하고, 냉혹하거나 분노로 친절함을 보답하고, 공부에도 불구하고 시험 문제를 정확하게 답하지 못하거나, 애정이 필요할 때 간병인으로부터 분노를 유발하거나, 성공하려는 욕구가 포함될 수 있다.[27]
윌슨병
윌슨병은 구리전달유전자 ATP7B의 돌연변이에 의해 발생하는 자가 열성 유전질환으로 구리가 과도하게 쌓이게 된다. 영향을 받은 사람들 중 약 절반은 파킨슨병(가장 흔하게 톱니바퀴 경직성, 브래디키네시아 또는 느린 움직임과 균형 부족)[28]을 포함하여 전형적인 손 떨림, 가면을 쓴 얼굴 표정, 비루한 말씨, 아탁시아 또는 디스토니아를 포함하거나 포함하지 않는다.[29]
화씨병과 석회화
화씨병은 유전적으로 지배적인 희귀한 유전적 신경계 질환으로 칼슘의 비정상적인 퇴적, 주로 기저성 갱년기에 나타난다.[30] 약 0.3~1.5%의 사람들이 무증상 기저신경절 석회화를 가지고 있다.[31]
블레파로스파스
눈꺼풀은 눈꺼풀의 비정상적인 수축이나 경련이다. 혈색소판은 뇌의 기저조직의 비정상적인 기능에서 오는 것일 수 있다.[32]
리서치
유전자 치료
기초적인 갱년기의 많은 장애는 국부적인 지역의 기능 장애 때문이다. 이러한 이유로, 유전자 치료는 신경 퇴행성 장애에 대해 실행 가능한 것으로 보인다. 유전자 치료는 병든 표현형을 새로운 유전 물질로 대체하여 행해진다. 이 과정은 아직 초기 단계지만 조기 성과가 기대된다. 이 요법의 한 예로 체내에서 도파민으로 전환될 수 있는 타이로신 수산화효소를 표현하기 위해 유전적으로 변형된 세포를 이식하는 것이 포함될 수 있다. 기저 조직에서 도파민 수치를 증가시키면 파킨슨병의 효과를 상쇄할 수 있을 것이다.[1]
절제
병변은 치료 목적으로 사용되는 특정 부위의 신경세포가 의도적으로 파괴되는 것이다. 비록 이것이 위험해 보이지만, 운동 장애를 가진 환자들에게서 엄청난 개선이 이루어졌다.[33] 정확한 과정은 일반적으로 GPI의 센서리모터 영역에서의 일방적인 병변을 포함한다. 이 과정을 완구절개술이라고 한다. 운동장애의 영향을 줄이는 데 완두콩이 성공하는 것은 GPI에서 비정상적인 신경활동이 중단되는 데서 비롯될 수 있다고 생각된다. 이 절제 기술은 단순히 회로의 결함 부분을 제거하는 것으로 볼 수 있다. 회로의 손상된 부분을 제거하면 회로의 정상 부위가 정상 작동을 계속할 수 있다.[9]
심뇌 자극
심뇌 자극은 스테레오택스 수술을 통해 뇌의 센서리모터 영역에 전극을 삽입하는 것을 포함한다.[1][4] 이 전극들은 이식된 부위에 고주파 자극을 방출한다.[4] 대칭적 결과뿐 아니라 비주기 강도 및 지속시간을 줄일 수 있을 뿐만 아니라 기간 내 지속시간을 증가시킬 수 있는 능력에도 쌍방향 삽입이 필요하다.[1][4] 심뇌 자극에 임플란트에 가장 효과적인 구조는 내부 글로부스 팔리두스(GPI)와 비탈람핵(STN)이다. 이는 상부 운동 뉴런 회로의 신경 활동을 직접 변화시키는 것보다 탈모핵에 대한 기저성 신경조직의 영향을 변화시키는 것이 더 안전하고 효과적이기 때문이다.[1] 심뇌 자극은 절제술과 같은 다른 치료법보다 더 복잡한 과정이다. 증거는 STN 심뇌 자극의 이점이 혈류 활성화와 혈류 경로 전체에 전파되는 GPI의 방출 패턴의 변조에 기인한다는 것을 암시한다.[4] 자극 프로토콜을 조정할 수 있는 능력은 기초적인 갱년기 회로의 활동을 변화시킬 수 있는 능력 때문에 이 치료법을 다양한 장애에 빌려준다.[1]
참고 항목
참조
- ^ a b c d e f g h i Purves, D.; Augustine, G.; Fitzpatrick, D.; Hall, W.; LaManita, A.-S.; McNamara, J.; et al. (2008). Neuroscience (4th ed.). Sunderland MA: Sinauer Associates.
- ^ a b c d e f Wichmann T, DeLong MR (December 1996). "Functional and pathophysiological models of the basal ganglia". Curr. Opin. Neurobiol. 6 (6): 751–8. doi:10.1016/S0959-4388(96)80024-9. PMID 9000030. S2CID 30435859.
- ^ Curtis AR, Fey C, Morris CM, et al. (August 2001). "Mutation in the gene encoding ferritin light polypeptide causes dominant adult-onset basal ganglia disease". Nat. Genet. 28 (4): 350–4. doi:10.1038/ng571. PMID 11438811. S2CID 25483839.
- ^ a b c d e f g h i j k DeLong MR, Wichmann T (January 2007). "Circuits and circuit disorders of the basal ganglia". Arch. Neurol. 64 (1): 20–4. doi:10.1001/archneur.64.1.20. PMID 17210805.
- ^ a b Nambu A (December 2008). "Seven problems on the basal ganglia". Curr. Opin. Neurobiol. 18 (6): 595–604. doi:10.1016/j.conb.2008.11.001. PMID 19081243. S2CID 24956799.
- ^ Heinz Steiner; Kuei Y. Tseng (4 January 2010). Handbook of Basal Ganglia Structure and Function. Academic Press. p. 663. ISBN 978-0-12-374767-9. Retrieved 20 April 2012.
- ^ Walker, FO (20 January 2007). "Huntington's disease". Lancet. 369 (9557): 218–28. doi:10.1016/S0140-6736(07)60111-1. PMID 17240289. S2CID 46151626.
- ^ Beal MF (August 1998). "Mitochondrial dysfunction in neurodegenerative diseases". Biochim. Biophys. Acta. 1366 (1–2): 211–23. doi:10.1016/s0005-2728(98)00114-5. PMC 3422529. PMID 9714810.
- ^ a b c Vitek JL, Chockkan V, Zhang JY, et al. (July 1999). "Neuronal activity in the basal ganglia in patients with generalized dystonia and hemiballismus". Ann. Neurol. 46 (1): 22–35. doi:10.1002/1531-8249(199907)46:1<22::AID-ANA6>3.0.CO;2-Z. PMID 10401777.
- ^ Janavs JL, Aminoff MJ (October 1998). "Dystonia and chorea in acquired systemic disorders". J. Neurol. Neurosurg. Psychiatry. 65 (4): 436–45. doi:10.1136/jnnp.65.4.436. PMC 2170280. PMID 9771763.
- ^ Neychev VK, Fan X, Mitev VI, Hess EJ, Jinnah HA (September 2008). "The basal ganglia and cerebellum interact in the expression of dystonic movement". Brain. 131 (Pt 9): 2499–509. doi:10.1093/brain/awn168. PMC 2724906. PMID 18669484.
- ^ Bröer, Sonja (2020). "Not Part of the Temporal Lobe, but Still of Importance? Substantia Nigra and Subthalamic Nucleus in Epilepsy". Frontiers in Systems Neuroscience. 14: 581826. doi:10.3389/fnsys.2020.581826. ISSN 1662-5137. PMC 7768985. PMID 33381016.
- ^ "시든햄 안디나 정보 페이지" 2010-07-22 웨이백 머신 생 비투스 댄스, 국립 신경 장애 및 뇌졸중 연구소의 류마티스 뇌염에 보관. 2008년 4월 26일 접속
- ^ a b 시든햄의 안디카 증상.2009년 9월 24일에 접속. 2008년 4월 18일 웨이백 머신에 보관
- ^ Swedo SE, Leonard HL, Shapiro MB (1993). "Sydenham's Chorea:Physical and Psychological Symptoms of St Vitus Dance". Pediatrics. 91 (4): 706–713. PMID 8464654.
- ^ Faustino PC, Terreri MT, Rocha AJ, et al. (2003). "Clinical, laboratory, psychiatric and magnetic resonance findings in patients with sydenham chorea". Neuroradiology. 45 (7): 456–462. doi:10.1007/s00234-003-0999-8. PMID 12811441. S2CID 23605799.
- ^ Wilbur C, Bitnun A, Kronenberg S, Laxer RM, Levy DM, Logan WJ, Shouldice M, Yeh EA (May 2019). "PANDAS/PANS in childhood: Controversies and evidence". Paediatr Child Health. 24 (2): 85–91. doi:10.1093/pch/pxy145. PMC 6462125. PMID 30996598.
- ^ Sigra S, Hesselmark E, Bejerot S (March 2018). "Treatment of PANDAS and PANS: a systematic review". Neurosci Biobehav Rev. 86: 51–65. doi:10.1016/j.neubiorev.2018.01.001. PMID 29309797.
- ^ Moretti G, Pasquini M, Mandarelli G, Tarsitani L, Biondi M (2008). "What every psychiatrist should know about PANDAS: a review". Clin Pract Epidemiol Ment Health. 4 (1): 13. doi:10.1186/1745-0179-4-13. PMC 2413218. PMID 18495013.
- ^ de Oliveira SK, Pelajo CF (March 2010). "Pediatric Autoimmune Neuropsychiatric Disorders Associated with Streptococcal Infection (PANDAS): a Controversial Diagnosis". Curr Infect Dis Rep. 12 (2): 103–9. doi:10.1007/s11908-010-0082-7. PMID 21308506. S2CID 30969859.
- ^ Boileau B (2011). "A review of obsessive-compulsive disorder in children and adolescents". Dialogues Clin Neurosci. 13 (4): 401–11. doi:10.31887/DCNS.2011.13.4/bboileau. PMC 3263388. PMID 22275846.
- ^ Hou, M; Zhao, J; Yu, R (2006). "Recent advances in dyskinetic cerebral palsy" (PDF). World J Pediatr. 2 (1): 23–28.
- ^ "Athetoid Dyskinetic". Swope, Rodante P.A. Retrieved 31 October 2012.
- ^ a b Hou, M; Zhao, J; Yu, R (2006). "Recent advances in dyskinetic cerebral palsy" (PDF). World J Pediatr. 2 (1): 23–28.
- ^ Bogousslavsky, J.; Cummings, J.L. (2000). Behavior and Mood Disorders in Focal Brain Lesions. Cambridge University Press. ISBN 9780521774826.
- ^ 레쉬-니한 증후군 유전학 홈 레퍼런스. 2007-05-24에 검색됨.
- ^ 구알티에리, C. 토마스(2002년). 뇌손상 및 정신지체: 정신의학 및 신경정신과 257페이지. 리핀콧 윌리엄스 & 윌킨스. ISBN 0-7817-3473-8. [1]
- ^ Lorincz MT (2010). "Neurologic Wilson's disease" (PDF). Annals of the New York Academy of Sciences. 1184 (1): 173–87. Bibcode:2010NYASA1184..173L. doi:10.1111/j.1749-6632.2009.05109.x. hdl:2027.42/78731. PMID 20146697. S2CID 2989668.
- ^ Ala A, Walker AP, Ashkan K, Dooley JS, Schilsky ML (2007). "Wilson's disease". Lancet. 369 (9559): 397–408. doi:10.1016/S0140-6736(07)60196-2. PMID 17276780. S2CID 24663871.
- ^ "Archived copy". Archived from the original on 2009-05-11. Retrieved 2009-06-13.CS1 maint: 제목으로 보관된 복사본(링크)
- ^ Verulashvili IV, Glonti LSh, Miminoshvili DK, Maniia MN, Mdivani KS (2006). "[Basal ganglia calcification: clinical manifestations and diagnostic evaluation]". Georgian Med News (in Russian) (140): 39–43. PMID 17179586.
- ^ "Benign Essential Blepharospasm". NORD (National Organization for Rare Disorders). Retrieved 2020-01-29.
- ^ Baron MS, Vitek JL, Bakay RA, et al. (September 1996). "Treatment of advanced Parkinson's disease by posterior GPi pallidotomy: 1-year results of a pilot study". Ann. Neurol. 40 (3): 355–66. doi:10.1002/ana.410400305. PMID 8797525. S2CID 10245634.
외부 링크
| 분류 | |
|---|---|
| 외부 자원 |




