망간
Manganese 순수 망간 큐브 및 산화 망간 칩 | |||||||||||||||||||||||||||||||||||
| 망간 | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 발음 | /ˈmæŋɡəniːz/ | ||||||||||||||||||||||||||||||||||
| 외모 | 은빛 금속성의 | ||||||||||||||||||||||||||||||||||
| 표준원자량 Ar°(Mn) | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| 주기율표의 망간 | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| 원자 번호 (Z) | 25 | ||||||||||||||||||||||||||||||||||
| 그룹. | 7조 | ||||||||||||||||||||||||||||||||||
| 기간 | 4교시 | ||||||||||||||||||||||||||||||||||
| 블록 | 디블록 | ||||||||||||||||||||||||||||||||||
| 전자배치 | [Ar] 3d5 4s2 | ||||||||||||||||||||||||||||||||||
| 쉘당 전자 수 | 2, 8, 13, 2 | ||||||||||||||||||||||||||||||||||
| 물리적 특성 | |||||||||||||||||||||||||||||||||||
| 단계 STP에서 | 단단한 | ||||||||||||||||||||||||||||||||||
| 융점 | 1519K(1246°C, 2275°F) | ||||||||||||||||||||||||||||||||||
| 비등점 | 2334K (2061°C, 3742°F) | ||||||||||||||||||||||||||||||||||
| 밀도 (근처) | 7.21g/cm3 | ||||||||||||||||||||||||||||||||||
| 액체 상태일 때(에) | 5.95g/cm3 | ||||||||||||||||||||||||||||||||||
| 핵융합열 | 12.91 kJ/mol | ||||||||||||||||||||||||||||||||||
| 기화열 | 221 kJ/mol | ||||||||||||||||||||||||||||||||||
| 몰열용량 | 26.32 J/(mol·K) | ||||||||||||||||||||||||||||||||||
증기압
| |||||||||||||||||||||||||||||||||||
| 원자 특성 | |||||||||||||||||||||||||||||||||||
| 산화상태 | -3, -2, -1, 0, +1, +2, +3, +4, +5, +6, +7 (산화 상태에 따라 산성, 염기성 또는 양성 산화물) | ||||||||||||||||||||||||||||||||||
| 전기 음성도 | 폴링 눈금 : 1.55 | ||||||||||||||||||||||||||||||||||
| 이온화 에너지 |
| ||||||||||||||||||||||||||||||||||
| 원자 반지름 | 경험 : 오후 127시 | ||||||||||||||||||||||||||||||||||
| 공유반경 | 저회전 : 139±5pm 고회전 : 161±8pm | ||||||||||||||||||||||||||||||||||
| 기타속성 | |||||||||||||||||||||||||||||||||||
| 자연발생 | 태고의 | ||||||||||||||||||||||||||||||||||
| 결정구조 | 바디중심큐빅(bcc) | ||||||||||||||||||||||||||||||||||
| 음속 얇은 막대 | 5150 m/s (20 °C에서) | ||||||||||||||||||||||||||||||||||
| 열팽창 | 21.7 µm/(m⋅K)(25°C에서) | ||||||||||||||||||||||||||||||||||
| 열전도율 | 7.81 W/(m⋅K) | ||||||||||||||||||||||||||||||||||
| 전기저항 | 1.44 Ωm (20 °C에서) | ||||||||||||||||||||||||||||||||||
| 자기순서 | 상자성의 | ||||||||||||||||||||||||||||||||||
| 어금니 자기 민감도 | (α) +529.0x10cm−63/mol (293K)[2] | ||||||||||||||||||||||||||||||||||
| 영률 | 198 GPa | ||||||||||||||||||||||||||||||||||
| 벌크 모듈러스 | 120 GPa | ||||||||||||||||||||||||||||||||||
| 모스경도 | 6.0 | ||||||||||||||||||||||||||||||||||
| 브리넬 경도 | 196 MPa | ||||||||||||||||||||||||||||||||||
| CAS 번호 | 7439-96-5 | ||||||||||||||||||||||||||||||||||
| 역사 | |||||||||||||||||||||||||||||||||||
| 디스커버리 | 칼 빌헬름 쉴레(1774) | ||||||||||||||||||||||||||||||||||
| 1차 격리 | 요한 고틀립 간(1774) | ||||||||||||||||||||||||||||||||||
| 망간 동위 원소 | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
망간은 Mn과 원자 번호 25를 가진 화학 원소입니다.그것은 단단하고 부서지기 쉬운 은빛의 금속이며, 철과 광물에서 종종 발견됩니다.망간은 산업용 합금 용도의 다면 배열, 특히 스테인리스강에 사용되는 전이금속입니다.강도, 작업성, 내마모성을 향상시켜줍니다.산화망간은 산화제, 고무 첨가제, 유리 제조, 비료 및 세라믹으로 사용됩니다.황산망간은 살균제로 사용될 수 있습니다.
망간은 또한 인간의 필수적인 식이 요소이며, 다량영양소 대사, 뼈 형성 및 자유 라디칼 방어 시스템에 중요합니다.그것은 수십 개의 단백질과 [4]효소에 중요한 성분입니다.그것은 주로 뼈에서 발견되지만 간과 신장 그리고 [5]뇌에서도 발견됩니다.인간의 뇌에서 망간은 망간 금속 단백질, 특히 성상세포에서 글루타민 합성효소와 결합되어 있습니다.
망간은 1774년에 처음으로 분리되었습니다.과망간산칼륨의 깊은 바이올렛 소금 형태로 실험실에서 친숙합니다.일부 효소의 [6]활성 부위에서 발생합니다.특히 관심사는 식물이 산소를 생산하는 데 산소 발생 복합체인 Mn-O 클러스터를 사용하는 것입니다.
특성.
물리적 특성
망간은 철을 닮은 은회색 금속입니다.단단하고 매우 부서지기 쉬우며, 융합하기 어렵지만 [7]산화되기 쉽습니다.망간 금속과 그 공통 이온은 [8]상자성입니다.망간은 공기 중에서 천천히 변색되고 용해된 [citation needed]산소를 포함한 물 속에서 철처럼 산화(녹)됩니다.
동위 원소
자연적으로 생성되는 망간은 안정 동위 원소인 Mn으로 구성되어 있습니다. 여러 방사성 동위 원소가 분리되어 기술되었으며 원자량은 46u(46Mn)에서 72u(72Mn)에 이릅니다.가장 안정한 것은 반감기가 370만 년인 Mn, 반감기가 312.2일인 Mn, 반감기가 5.591일인 Mn.나머지 방사성 동위 원소들은 모두 반감기가 3시간 미만이며, 대부분은 1분 미만입니다.가장 풍부한 안정 동위 원소인 Mn보다 가벼운 동위 원소에서 1차 붕괴 모드는 전자 포획이고 더 무거운 동위 원소에서 1차 붕괴 모드는 베타 [9]붕괴입니다.망간은 또한 세가지 메타 [9]상태를 가지고 있습니다.
망간은 초신성 [10]폭발 직전에 큰 별들에서 합성된 것으로 생각되는 철 성분 그룹의 일부입니다.53Mn은 반감기가 370만 년으로 Cr로 붕괴합니다.반감기가 상대적으로 짧기 때문에 Mn은 [11]철에 대한 우주선의 충격에 의해 생성되는 비교적 희귀합니다.망간 동위 원소 함량은 일반적으로 크롬 동위 원소 함량과 결합되며 동위 원소 지질학 및 방사선 연대 측정에 적용됩니다.Mn-Cr 동위원소 비율은 태양계의 초기 역사에 대한 Al과 Pd의 증거를 강화합니다.여러 운석에서 나오는 Cr/52Cr 및 Mn/Cr 비율의 변화는 초기 Mn/55Mn 비율을 시사하며, 이는 Mn-Cr 동위원소 조성이 분화된 행성체에서 Mn의 실제 붕괴로 인해 발생해야 함을 나타냅니다.그러므로 Mn은 태양계의 [12][13][14][15]병합 직전에 핵합성 과정에 대한 추가적인 증거를 제공합니다.
동소체
 | 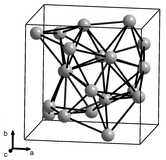 |
고체 망간의 4가지 동소체(구조 형태)가 알려져 있으며, α, β, γ 및 γ로 표시되어 있으며, 연속적으로 높은 온도에서 발생합니다.모두 금속성이고, 표준 압력에서 안정적이며, 입방정 격자를 가지고 있지만, [16][17][18]원자 구조는 매우 다양합니다.
알파 망간(α-Mn)은 상온에서의 평형상입니다.그것은 신체 중심의 입방 격자를 가지고 있고, 매우 복잡한 단위 셀을 가지고 있다는 점에서 원소 금속 중에서는 이례적인데, 네 가지 다른 [19][16]유형의 사이트에서 셀 당 58개의 원자(원시 단위 셀 당 29개의 원자)를 가지고 있습니다.상온에서는 상자성이고 온도는 95K(-178°C)[20] 이하에서는 반강자성입니다.
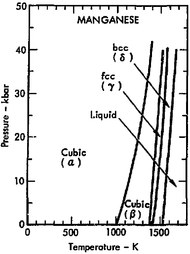 |
베타 망간(β-Mn)은 973 K(700 °C; 1,290 °F)의 전이 온도 이상에서 가열될 때 형성됩니다.두 종류의 부위에서 단위 셀 당 20개의 원자를 갖는 원시 입방 구조를 가지고 있으며, 이는 다른 원소 [21]금속과 마찬가지로 복잡한 구조입니다.급격한 퀀칭에 의해 상온에서 쉽게 준안정상으로 얻어집니다.측정된 최저 온도(1.1K)[21][22][23]까지 상자성을 유지하면서 자기 순서를 표시하지 않습니다.
감마 망간은 1,370 K (1,100 °C, 2,010 °F) 이상으로 가열하면 생성됩니다.단순한 면심 입방 구조(단위 셀 당 4개의 원자)를 가지고 있습니다.실온으로 급냉하면 β-Mn으로 변환되지만, 적어도 5%의 다른 원소(예를 들어, C, Fe, Ni, Cu, Pd 또는 Au)와 합금화함으로써 실온에서 안정화될 수 있으며, 이러한 용질 안정화된 합금은 면 중심의 정방정계 [24][23]구조로 왜곡됩니다.
델타 망간(δ-Mn)은 1,406 K(1,130 °C; 2,070 °F) 이상으로 가열하면 생성되며 망간 용융점이 1,519 K(1,250 °C; 2,270 °F)까지 안정적입니다.그것은 신체 중심의 입방 구조(입방체 단위 [17][23]셀 당 2개의 원자)를 가지고 있습니다.
화합물

망간의 일반적인 산화 상태는 +2, +3, +4, +6, +7이지만 -3에서 +7까지의 모든 산화 상태가 관찰되었습니다.산화 상태 +7의 망간은 강렬한 보라색 과망간산 음이온4− MnO의 염으로 표시됩니다. 과망간산칼륨은 산화성 때문에 일반적으로 사용되는 실험실 시약입니다. 그것은 국소 의약품으로 사용됩니다(예를 들어, 어류 질환 치료에 사용됨).과망간산칼륨 용액은 전자현미경을 [26]위한 생물학적 세포와 조직의 준비에 사용될 최초의 얼룩과 고정제들 중 하나였습니다.
다양한 과망간산염 이외에, Mn(VII)은 불안정하고 휘발성인 유도체27 MnO로 표시됩니다.옥시할라이드(MnOF3 및 MnOCl3)는 강력한 [7]산화제입니다.+6 산화 상태에서 Mn의 가장 두드러진 예는 녹색 음이온 망간산[MnO]2-입니다4.망간염은 광석에서 망간을 추출하는 중간생성물입니다.산화 상태가 +5인 화합물은 다소 다루기 어렵고, 한 예로 청색 음이온 하이포망가네이트[MnO4]3-가 있습니다.
산화 상태 +5의 Mn을 갖는 화합물은 거의 마주치지 않으며 산화물(O2-) 또는 질화물([27][28]N3-) 리간드와 관련된 경우가 많습니다.
Mn(IV)은 자연계에서는 흔하지만 합성 화학에서는 훨씬 더 드물기 때문에 다소 수수께끼입니다.가장 일반적인 Mnore인 pyrolusite는 MnO입니다2.그것은 많은 동굴 그림의 어두운 갈색 색소이지만 또한 건전지 배터리의 일반적인 성분이기도 합니다.Mn(IV)의 복합체는 잘 알려져 있지만 정교한 리간드를 필요로 합니다.Mn(IV)-OH 복합체는 [29]식물의 산소 진화 중심(OEC)을 포함한 일부 효소의 중간체입니다.
단순한 유도체+3 Mn은 거의 마주치지 않지만 적절하게 기본적인 리간드에 의해 안정화될 수 있습니다.망간(III) 아세테이트는 유기 합성에 유용한 산화제입니다.망간(III)의 고체 화합물은 자홍색이 강하고 얀 텔러 [citation needed]효과로 인한 왜곡된 팔면체 협응을 선호하는 것이 특징입니다.

수용액 중 망간에 대한 특히 일반적인 산화 상태는 옅은 분홍색을 띠는 +2입니다.망간()이)II) 망간으로부터 유도된 아쿠아 복합체와 같은 화합물이 알려져 있습니다(II) 황산염(MnSO4) 및 망간(II) 염화물(MnCl2).이 산화 상태는 광물 로도크로사이트(망간()에서도 볼 수 있습니다.II) 탄산염).망간()II) 망간에 대한 높은 페어링 에너지 때문에 높은 스핀, S = 5/2의 지면 상태로 일반적으로 존재함(II). 망간에는 스핀 허용 d-d 전이가 없습니다(II), 희미한 [30]색을 설명합니다.
| 망간의[31] 산화상태 | |
|---|---|
| 0 | Mn 2(CO) 10 |
| +1 | MnCHCHCH 5 4 3(CO) 3 |
| +2 | MnCl 2, MnCO 3, MnO |
| +3 | MnF 3, Mn(OAc) 3, Mn 2O 3 |
| +4 | MnO 2 |
| +5 | K 3MnO 4 |
| +6 | K 2MnO 4 |
| +7 | KMnO 4, Mn 2O 7 |
| 일반적인 산화 상태는 굵게 표시됩니다. | |
유기망간 화합물
망간은 다양한 유기금속 유도체, 즉 Mn-C 결합을 갖는 화합물을 형성합니다.유기금속 유도체는 낮은 산화 상태, 즉 Mn(I)을 통한 Mn(-III)의 수많은 예를 포함합니다.이러한 유기금속 화학 영역은 Mn이 저렴하고 [citation needed]독성이 비교적 낮기 때문에 매력적입니다.
상업적으로 가장 큰 관심을 끄는 것은 "MMT", 메틸사이클로펜타디에닐 망간 트리카르보닐이며, 이는 일부 국가에서 휘발유(휘발유)에 첨가되는 노크 방지 화합물로 사용됩니다.Mn(I)을 특징으로 합니다.Mn(II) 화학의 다른 측면과 일치하며, 망간세( Mn(CH55)2은 고스핀(high-spin.이와 대조적으로, 이웃한 금속 철은 페로센(Fe(CH55))2 형태의 공기 안정적인 저스핀 유도체를 형성합니다.일산화탄소의 대기 하에서 수행될 때, Mn(II) 염의 환원은 오렌지 및 휘발성 고체인 디망간 데카보닐2 Mn(CO)10을 제공합니다.이 Mn(0) 화합물(및 그 많은 유도체)의 공기 안정성은 일산화탄소의 강력한 전자 수용기 특성을 반영합니다.많은 알켄 복합체 및 알킨 복합체는 Mn(CO)10[citation needed]으로부터2 유도됩니다.
Mn(CH)(dmpe)에서 Mn(II)는 저스핀이며, 이는 그 전구체인 MnBr(dmpe)(dmpe = (CH)PCHP(CH))의 고스핀 특성과 대조됩니다.망간의 폴리알킬 및 폴리아릴 유도체는 알킬 및 아릴 리간드의 전자 방출 특성을 반영하여 종종 더 높은 산화 상태로 존재합니다.한 예로 [Mn(CH3)]62-[citation needed]이 있습니다.
역사
망간이란 이름의 유래는 복합적입니다.고대에, 두 개의 검은 광물들이 마그네소스 반도의 지역들에서 확인되었습니다 (현대 그리스에 위치한 마그네시아 또는 현대 [33]터키에 위치한 마그네시아 애드 시필룸).그들은 그들의 출신지로부터 자석이라고 불렸지만, 성별에 있어서는 다르다고 여겨졌습니다.수컷 자석은 철을 끌어당겼고, 지금은 로드스톤 또는 자철석으로 알려진 철광석이었고, 이것은 아마도 우리에게 자석이라는 용어를 알려주었을 것입니다.암컷 마그네오린은 철을 끌어당기지 않고, 유리를 탈색하는 데 사용되었습니다.이 여성 마그네시아는 후에 마그네시아라고 불리게 되었는데, 현대에는 피로루사이트 또는 [citation needed]이산화망간으로 알려져 있습니다.이 광물이나 망간 원소는 자성을 띠지 않습니다.16세기에 이산화망간은 유리 제조자들에 의해 망간수(하나 대신 두 Ns를 주목하라)라고 불렸는데, 연금술사와 유리 제조자들이 결국 마그네시아 알바(마그네시아의 백색 광석)와 마그네시아 니그라(흑광)를 구별해야 했기 때문에 두 단어의 부패와 연결되었을 가능성이 있습니다.Michele Mercati는 마그네시아 nigra manganesa라고 불렀고, 마침내 그것으로부터 분리된 금속은 망간(독일어: Mangan)이라고 알려지게 되었습니다.마그네시아라는 이름은 결국 백색 마그네시아 알바(산화마그네슘)만을 지칭하는 데 사용되었으며, 이것은 훨씬 [34]나중에 분리되었을 때 자유 원소에 마그네슘이라는 이름을 제공했습니다.

천연에 풍부한 이산화망간은 오랫동안 안료로 사용되어 왔습니다.가르가스의 30,000년에서 24,000년 된 동굴 벽화들은 MnO2 [36]색소의 광물 형태로 만들어졌습니다.
망간 화합물은 이집트와 로마의 유리 제조사들에 의해 [37]유리에 색을 첨가하거나 제거하기 위해 사용되었습니다."유리 제조기 비누"로서 사용은 중세를 거쳐 현대에 이르기까지 계속되었으며 [38]14세기 베니스의 유리에서 분명하게 드러납니다.

유리 제조에 사용되었기 때문에 이산화망간은 최초의 화학자인 연금술사들의 실험에 이용할 수 있었습니다.이그나티우스 고트프리드 카임 (1770)과 요한 글라우버 (17세기)는 이산화망간이 유용한 실험실 [39]시약인 과망간산염으로 전환될 수 있다는 것을 발견했습니다.18세기 중반까지 스웨덴의 화학자 칼 빌헬름 셸은 염소를 생산하기 위해 이산화망간을 사용했습니다.먼저 염산, 즉 희황산과 염화나트륨의 혼합물을 이산화망간과 반응시키기 위해 만들어졌고, 나중에 르블랑 공정의 염산을 사용하고 이산화망간을 웰던 공정으로 재활용했습니다.염소 및 차아염소산염 표백제의 생산은 망간 [citation needed]광석의 큰 소비자였습니다.
셸레와 다른 사람들은 피롤루사이트(이산망간의 광물 형태)가 새로운 원소를 함유하고 있다는 것을 알고 있었습니다.Johan Gottlieb Gahn은 1774년에 망간 금속의 불순한 샘플을 처음으로 분리해냈습니다.[citation needed] 그는 이산화탄소를 탄소로 환원함으로써 그 일을 했습니다.
그리스에서 사용된 일부 철광석의 망간 함량은 그 광석에서 생산된 강철이 추가적인 망간을 함유하고 있어 스파르타의 강철을 매우 단단하게 만들 [40]것이라는 추측을 낳았습니다.19세기 초 무렵, 망간은 철강 제조에 사용되었고 몇몇 특허들이 부여되었습니다.1816년에 망간과 합금된 철은 더 단단하지만 더 부서지기 쉽진 않다는 것이 기록되었습니다.1837년, 영국의 학자 제임스 쿠퍼는 광부들의 망간에 대한 심한 노출과 파킨슨병 [41]사이의 연관성에 주목했습니다.1912년, 망간 인산염 전기화학적 변환 코팅으로 녹과 부식으로부터 화기를 보호하는 것에 대한 미국 특허가 승인되었으며,[42] 그 이후로 이 방법은 널리 사용되고 있습니다.
1866년 르클랑셰 전지의 발명과 이산화망간을 음극 탈분극제로 함유한 전지의 후속적인 개선은 이산화망간에 대한 수요를 증가시켰습니다.니켈-카드뮴과 리튬 전지가 개발되기 전까지는 대부분의 전지가 망간을 함유하고 있었습니다.아연-탄소 배터리와 알칼리 배터리는 일반적으로 공업적으로 생산된 이산화망간을 사용하는데, 이는 자연적으로 발생하는 이산화망간이 불순물을 포함하기 때문입니다.20세기에 이산화망간은 표준(아연-탄소)[43] 및 알칼리성 유형의 상업용 일회용 건전지의 음극으로 널리 사용되었습니다.
발생
망간은 지각의 약 1000ppm(0.1%)을 차지하는데, 지각의 원소 중 [5]12번째로 풍부합니다.토양에는 평균 [5]440ppm의 망간이 7~9000ppm 함유되어 있습니다.대기 중에는 0.01μg/[5]m의3 대기가 포함되어있습니다.망간은 주로 피로루사이트(MnO2), 브라운사이트(MnMnMn2+3+6)[44]SiO12), 실로멜란(Ba,HO2)2MnO510, 로도크로사이트(MnCO3)보다 적은 정도.
 |  |  |  |  |
| 망간광석 | 실로멜란(망간광) | 슈피겔라이젠은 망간 함량이 약 15%인 철 합금입니다. | 독일 솔호펜의 석회암에 있는 망간 산화물 덴드라이트 – 가성 화석의 일종.눈금은 mm 단위입니다. | 광물 로도크로사이트(망간()II) 탄산염) |

가장 중요한 망간 광석은 피로루사이트(MnO2)입니다.경제적으로 중요한 다른 망간 광석은 보통 스팔레라이트와 [7][46]같은 철광과 공간적으로 밀접한 관계를 보여줍니다.토지 기반 자원은 규모가 크지만 불규칙적으로 분포되어 있습니다.알려진 세계 망간 자원의 약 80%가 남아프리카에 있습니다. 다른 중요한 망간 매장량은 우크라이나, 호주, 인도, 중국, 가봉 그리고 [45]브라질에 있습니다.1978년 추정에 의하면 해저에는 5천억 톤의 망간 [47]단괴가 있다고 합니다.경제적으로 실행 가능한 망간 단괴 수확 방법을 찾으려는 시도는 1970년대에 [48]중단되었습니다.
남아프리카 공화국에서는 확인된 퇴적물 대부분이 북부 케이프 지방(칼라하리 망간전)의 호타젤 근처에 위치해 있으며, 2011년 추정치는 150억 톤입니다.2011년 남아프리카 공화국은 340만 톤을 생산했는데, [49]이는 다른 모든 국가에서 가장 높은 수치입니다.
망간은 주로 남아프리카, 오스트레일리아, 중국, 가봉, 브라질, 인도, 카자흐스탄, 가나, 우크라이나,[50] 말레이시아에서 채굴됩니다.
생산.
망간산철을 생산하기 위해 망간 광석은 철광석과 탄소를 혼합한 후 고로 또는 [51]전기로에서 환원됩니다.생성된 페로망간은 망간 함량이 30~80%[7]입니다.무철 합금 제조에 사용되는 순수 망간은 망간 광석을 황산으로 침출한 후 후속 전기도금 [52]공정을 통해 제조됩니다.

더 진보적인 추출 공정은 더미 침출에 의해 망간 광석을 직접적으로 감소시키는 것을 포함합니다.이 작업은 천연 가스를 더미 바닥을 통해 침투시켜 수행됩니다. 천연 가스는 열(850°C 이상)과 환원제(일산화탄소)를 제공합니다.이것은 망간 광석을 모두 망간 산화물(MnO)로 환원시키는데, 이것은 침출 가능한 형태입니다.그런 다음 광석은 분쇄 회로를 통과하여 광석의 입자 크기를 150 ~ 250 μm로 줄이고 표면적을 늘려 침출을 돕습니다.그 다음, 광석을 황산과 철(Fe2+)로 이루어진 침출조에 1.6:1 비율로 첨가합니다.철은 이산화망간(MnO2)과 반응하여 수산화철(FeO(OH))과 망간 원소(Mn)[citation needed]를 형성합니다.
이 공정을 통해 망간을 약 92% 회수할 수 있습니다.추가 정제를 위해 망간을 전기 배선 시설로 [53]보낼 수 있습니다.
1972년 CIA의 프로젝트 아조리안은 억만장자 하워드 휴즈를 통해 [54]해저에서 망간 단괴를 채취하는 커버스토리로 휴즈 글로마르 익스플로러호에 의뢰했습니다.그것은 망간 단괴를 수집하기 위한 활동의 쇄도를 촉발시켰는데, 이것은 실제로 실용적이지 않았습니다.휴즈 글로마르 익스플로러의 진짜 임무는 소련의 암호책을 회수하는 [55]것을 목표로 침몰한 소련 잠수함 K-129를 인양하는 것이었습니다.
해저에서 [56][57]발견되는 망간 단괴 형태의 풍부한 망간 자원.29%의 [58]망간으로 구성된 이 결절들은 해저를 따라 위치하고 있으며 이 결절들을 채굴하는 것의 잠재적인 영향을 연구하고 있습니다.이 결절 채굴이 해저를 어지럽히고 퇴적물 플룸을 형성하게 하여 물리적, 화학적, 생물학적 환경적 영향이 발생할 수 있습니다.이 현탁액에는 금속 및 무기 영양소가 포함되어 있어 용해된 독성 화합물로 인해 바닥에 가까운 물이 오염될 수 있습니다.망간 단괴는 또한 방목장, 거주 공간, 그리고 엔도- 및 에피파뉴얼 시스템을 위한 보호입니다.이 결절들이 제거되면 이들 시스템은 직접적인 영향을 받습니다.전반적으로, 이것은 종들이 그 지역을 떠나거나 완전히 [59]죽게 할 수 있습니다.채굴 자체가 시작되기 전에, 이러한 [60]영향을 완화하기 위해 환경 영향을 완전히 이해하기 위한 연구가 유엔 산하 기구와 국가 지원 회사에 의해 수행되고 있습니다.
해양환경
바다의 많은 미량 원소들은 열수 [61]분출구에서 나오는 금속이 풍부한 열수 입자들에서 나옵니다.용해된 망간(dMn)은 전 세계 해양에서 발견되며, 이 중 90%는 열수 [62]분출구에서 비롯됩니다.입자성 Mn은 활성 환기원에서 부력이 있는 플룸에서 발생하는 반면 dMn은 [61]보수적으로 작용합니다.Mn 농도는 바다의 물기둥마다 다릅니다.표면에서 dMn은 강, 먼지, 선반 퇴적물과 같은 외부 공급원으로부터의 입력으로 인해 상승합니다.해안 퇴적물은 일반적으로 Mn 농도가 낮지만, 강 투입물로부터 해양으로 유입되는 광산 및 철강 제조업과 같은 산업에서 발생하는 인위적인 배출로 인해 증가할 수 있습니다.표면 dMn 농도는 광합성을 통해 생물학적으로, 그리고 해안가 상승 및 바람에 의한 표면 전류로부터 물리적으로 높아질 수 있습니다.UV 복사로 인한 광-환원과 같은 내부 사이클링은 Mn-산화물의 용해와 산화적 소기를 가속화하여 Mn이 더 깊은 [63]물로 가라앉는 것을 방지함으로써 수준을 높일 수 있습니다.중위도의 수위 상승은 중위도 융기와 열수 분출구 근처에서 발생할 수 있습니다.열수 분출구는 Mn 농축액을 물 속으로 방출했습니다.dMn은 존재하는 미생물 캡슐로 인해 최대 4,000km까지 이동할 수 있으며 입자와의 교환을 방지하여 가라앉는 속도를 낮춥니다.용존 Mn 농도는 산소 농도가 낮을 때 더욱 높습니다.전반적으로, dMn 농도는 보통 해안 지역에서 더 높고,[63] 해상으로 이동할 때는 감소합니다.
흙
망간은 3가지 산화 상태의 토양에서 발생합니다. 2가2 양이온인2+ Mn과 MnOOH 및 MnO와 같은 Mn(III,IV)을 포함하는 갈색-흑색 산화물 및 수산화물입니다. 토양 pH 및 산화 환원 조건은 주어진 토양에서 이 세 가지 형태의 Mn 중 어느 것이 우세한지에 영향을 미칩니다.pH 값이 6 미만이거나 혐기성 조건에서는 Mn(II)이 우세한 반면, 보다 알칼리성 및 호기성 조건에서는 Mn(III,IV) 산화물 및 수산화물이 우세합니다.Mn의 형태에 대한 토양 산도와 공기화 상태의 이러한 영향은 미생물의 활성에 의해 변형되거나 조절될 수 있습니다.미생물 호흡은 산화물에 Mn의 산화를2+ 둘 다 유발할 수 있고, 산화물이 [64]2가 양이온으로 환원되는 원인이 될 수 있습니다.
Mn(III,IV) 산화물은 모래, 실트 및 점토 입자에 갈색을 띠는 검은색 얼룩 및 작은 결절로 존재합니다.다른 토양 입자의 이러한 표면 코팅은 높은 표면적을 가지고 있으며 음전하를 가지고 있습니다.대전된 부위는 다양한 양이온, 특히 중금속(예를3+ 들어, Cr2+, Cu2+2+, Zn 및 Pb)을 흡착하고 보유할 수 있습니다.게다가 산화물은 유기산과 다른 화합물을 흡착할 수 있습니다.금속 및 유기 화합물의 흡착은 Mn(III,IV) 산화물이 Mn으로2+ 환원되는 동안 산화될 수 있습니다(예를 들어, Cr3+ 내지 Cr(VI) 및 무색 하이드로퀴논 내지 차색 퀴논 폴리머).[65]
적용들
망간은 야금학의 [45]주요 응용 분야에서 만족할 만한 대체물이 없습니다.소량의 응용(예: 망간 인산화)에서 아연 및 바나듐은 실행 가능한 대체 물질입니다.
강철

망간은 1856년에 과잉 용존 산소인 술푸를 제거하기 위해 강철에 슈피겔라이젠의 형태로 원소를 도입한 영국의 야금학자 로버트 포레스터 무셰(1811–1891)에 의해 처음으로 인식된 것처럼, 황 고정, 탈산화 및 합금 특성으로 인해 철 및 강철 생산에 필수적입니다.r, 가단성을 향상시키기 위해 인.망간 수요의 대부분은 제철 성분을 포함한 [66]제강이 차지하고 있으며,[52] 현재는 전체 수요의 85%에서 90%의 범위에 있습니다.망간은 저가 스테인리스강의 [67][68]핵심 성분입니다.종종 페로망간(일반적으로 약 80%의 망간)은 현대 공정에서 중간체입니다.
소량의 망간은 고용융 황화물을 형성하고 결정립계에 액상의 황화물이 형성되는 것을 방지함으로써 고온에서 강재의 가공성을 향상시킵니다.망간 함량이 4%에 도달하면 강철의 취성이 주요 특징이 됩니다.취화율은 망간 농도가 높을수록 감소하며 8%에서 허용 수준에 도달합니다.망간을 8~15% 함유한 강철은 최대 863MPa의 높은 [69][70]인장강도를 갖습니다.12% 망간을 함유한 강철은 1882년 로버트 하드필드(Robert Hadfield)에 의해 발견되었으며, 지금도 하드필드 강(Mangalloy)으로 알려져 있습니다.이것은 영국군 철모에 사용되었고 나중에는 미군에 [71]의해 사용되었습니다.
알루미늄합금
망간은 알루미늄과의 합금 생산에 사용됩니다.망간이 약 1.5% 함유된 알루미늄은 불순물을 흡수하는 입자를 [72]통해 부식에 대한 저항력이 높아져 갈바닉 부식을 초래합니다.대부분의 음료 [73]캔에는 부식에 강한 알루미늄 합금 3004와 3104(0.8~1.5% 망간)이 사용됩니다.2000년 이전에는 160만 톤 이상의 합금이 사용되었으며, 망간 1%에서는 16,000톤의 [failed verification][73]망간을 소비했습니다.
건전지
망간()IV) 산화물은 원래 형태의 드라이 셀 배터리에서 아연의 전자 수용체로 사용되었으며, 카본-아연 타입의 플래시 라이트 셀에서 검은색을 띠는 물질입니다.방전시 이산화망간이 산화망간-수산화MnO(OH)로 환원되어 [74]전지의 음극에서 수소가 형성되는 것을 방지합니다.
- MnO + HO + e → MnO(OH) + OH
동일한 물질은 더 새로운 알칼리성 배터리(일반적으로 배터리 셀)에서도 작동하며, 이 배터리는 기본적인 반응은 같지만 다른 전해질 혼합물을 사용합니다.2002년에는 230,[43][74]000톤 이상의 이산화망간이 이 목적으로 사용되었습니다.

저항기
망간과 같은 망간의 구리 합금은 비교적 많은 양의 전류를 측정하기 위해 사용되는 금속 요소 션트 저항에서 일반적으로 발견됩니다.이 합금들은 온도 저항계수가 매우 낮고 황에 강합니다.이를 통해 가혹한 자동차 및 산업 [75]환경에서 합금이 특히 유용하게 사용됩니다.
비료 및 사료첨가제
망간 산화물과 황산염은 비료의 성분입니다.2000년에는 미국에서만 약 20,000톤의 이 화합물이 비료에 사용되었습니다.동물 사료에도 비슷한 양의 Mn 화합물이 사용되었습니다.
틈새
메틸사이클로펜타디에닐 망간 트리카르보닐은 옥탄가를 높이고 엔진 노킹을 줄이기 위해 일부 무연 휘발유에 첨가된 물질입니다.
망간()IV) 산화물(이산화망간, MnO2)은 벤질 알코올(수산화수소기가 방향족 고리에 인접한)의 산화를 위한 유기 화학에서 시약으로 사용됩니다.이산화망간은 예로부터 미량의 철 [38]오염으로부터 유리의 녹색을 산화시키고 중화시키는 데 사용되었습니다.MnO는2 산소 및 염소 제조 및 흑색 도료 건조에도 사용됩니다.몇몇 준비물에서, 그것은 페인트를 위한 갈색 안료이고 천연수의 [78]구성성분입니다.
4가 망간은 적색 방출 형광체에서 활성제로 사용됩니다.발광을 [79]나타내는 많은 화합물이 알려져 있지만, 대부분의 화합물은 낮은 효율 또는 짙은 적색 [80][81]방출로 인해 상업적 응용에 사용되지 않습니다.그러나 몇몇 Mn4+ 활성화 불소는 온백색 [82][83]LED의 잠재적인 적색 방출 형광체로 보고되었습니다.그러나 현재까지 KSiF만26:Mn은 온백색 [84]LED에 상용화되어 있습니다4+.
2000년까지 망간을 사용한 유일한 [85]미국 동전은 1942년부터 1945년까지 "전시" 니켈이었습니다.전통적으로 구리 75%와 니켈 25%의 합금이 니켈 동전의 제조에 사용되었습니다.그러나, 전쟁 중 니켈 금속이 부족했기 때문에, 더 많은 가용 은과 망간으로 대체되었고, 그 결과 구리 56%, 은 35%, 망간 9%의 합금이 만들어졌습니다.2000년 이후, 달러 동전, 예를 들어 사카가웨아 달러와 대통령 1달러 동전은 순수한 [86]구리심을 가진 망간을 7% 함유한 황동으로 만들어집니다.니켈과 달러의 두 경우 모두, 동전에 망간을 사용한 것은 자판기의 메커니즘에서 이전과 동일한 크기와 가치가 있는 동전의 전자기적 특성을 복제하기 위한 것이었습니다.후기 미국 달러 동전의 경우, 망간 합금은 이전 수잔 B에서 사용된 구리/니켈 합금의 특성을 복제하기 위한 것이었습니다. 앤서니 달러.
망간 화합물은 색소와 세라믹과 유리의 착색을 위해 사용되어 왔습니다.세라믹의 갈색은 때때로 망간 [87]화합물의 결과입니다.유리 산업에서 망간 화합물은 두 가지 효과를 위해 사용됩니다.망간(III)은 철(II) 적은 색의 철(III)과 약간의 분홍색 망간()을 형성하여 유리의 강한 녹색을 감소시킵니다.II), 철(III)[38]의 잔류색을 보상하는 것.더 많은 양의 망간은 분홍색 유리를 만드는데 사용됩니다.2009년, Oregon State University의 Mas Subramanian 교수와 연구원들은 망간이 이트륨과 인듐과 결합하여 강렬한 파란색, 무독성, 불활성, 페이드 저항성 색소를 형성할 수 있다는 것을 발견했는데, 이것은 200년 만에 처음으로 발견된 새로운 [citation needed]파란색 색소입니다.
생화학

많은 종류의 효소는 산화환원효소, 전이효소, 가수분해효소, 라이아제, 이성질화효소 및 리가아제를 포함한 망간 보조 인자를 포함합니다.망간을 포함하는 다른 효소는 아르기나아제와 Mn을 포함하는 슈퍼옥사이드 디스뮤타아제(Mn-SOD)입니다.많은 레트로 바이러스(HIV와 같은 렌티바이러스는 아니지만)의 일부 역전사효소에는 망간이 포함되어 있습니다.망간 함유 폴리펩티드는 디프테리아 독소, 렉틴, 인테그린입니다.[88]
4개의 망간 원자를 포함하는 산소-진화 복합체(OEC)는 엽록체의 틸라코이드 막에 포함된 광계 II의 일부입니다.OEC는 광합성의 빛 반응 동안 물의 최종적인 광산화를 담당하는데, 즉 [89][90]식물에 의해 생성된 O2를 만드는 촉매입니다.
인간의 건강과
망간은 인간의 필수적인 식생활 요소입니다.이것은 대영양소 대사, 뼈 형성, 그리고 자유 라디칼 방어 시스템을 포함하는 다양한 생물학적 과정에서 조효소로 존재합니다.그것은 수십 개의 단백질과 [4]효소에 중요한 성분입니다.인간의 몸에는 대부분 뼈에 있는 망간이 12mg 정도 들어있습니다.나머지 연조직은 간과 [5]신장에 집중되어 있습니다.인간의 뇌에서 망간은 망간 금속 단백질, 특히 [91]성상세포에서 글루타민 합성효소와 결합되어 있습니다.
| 수컷 | 여성 | ||
|---|---|---|---|
| 나이 | AI (mg/day) | 나이 | AI (mg/day) |
| 1–3 | 1.2 | 1–3 | 1.2 |
| 4–8 | 1.5 | 4–8 | 1.5 |
| 9–13 | 1.9 | 9–13 | 1.6 |
| 14–18 | 2.2 | 14–18 | 1.6 |
| 19+ | 2.3 | 19+ | 1.8 |
| 임신한 상태: 2명 | |||
| 수유: 2.6 | |||
규정
2001년 미국 의학연구소(IOM)는 미네랄에 대한 EARs(Estimate Average Requirements)와 RDAs(Recommended Dietary Allowances)를 업데이트했습니다.망간의 경우 EARs 및 RDAs를 설정하기에 충분한 정보가 없었기 때문에 AI(Afficient Intakes)에 대한 추정치로 필요성을 설명합니다.안전을 위해, IOM은 증거가 충분할 때 비타민과 미네랄에 대해 허용 가능한 상위 섭취 수준(ULs)을 설정합니다.망간의 경우 성인 UL은 11mg/day로 설정됩니다.EARs, RDAs, AIs 및 ULs를 종합하여 DRIs([92]식용 기준 섭취량)라고 합니다.망간 결핍증은 아주 [93]드물어요.
유럽 식품 안전청(EFSA)은 RDA 대신 인구 기준 섭취량(PRI), EAR 대신 평균 요구량(Average Requirement)으로 정보의 집합을 식이 기준 값(Dietry Reference Values)이라고 합니다.AI와 UL은 미국과 동일하게 정의했습니다.15세 이상의 경우 인공지능은 하루에 3.0mg으로 설정됩니다.임신과 수유를 위한 인공지능은 하루에 3.0mg입니다.1-14세 어린이의 경우 AI가 0.5~2.0mg/일로 증가합니다.성인용 인공지능은 미국의 RDA보다 높습니다.[94]EFSA는 동일한 안전 문제를 검토하여 [95]UL을 설정하기에 충분한 정보가 없다고 결정했습니다.
미국 식품 및 식이 보충제 표시 목적의 경우 1인분의 양은 일일 가치(%DV)의 백분율로 표시됩니다.망간 표시 목적상 일일치의 100%는 2.0 mg 이었으나, 2016년 5월 27일부로 2.3 mg으로 수정되어 [96][97]RDA와 합의하였습니다. 구 및 신 성인 일일치 표는 Reference Daily 섭취량에 제공됩니다.
과도한 노출이나 섭취는 도파민성 신경세포 사망과 파킨슨병과 [5][98]유사한 증상을 유발하는 신경퇴행성 질환인 망간증으로 알려진 질환으로 이어질 수 있습니다.
결핍증
희귀한 망간 결핍은 여러 가지 의학적 문제를 야기합니다.망간의 결핍은 동물의 골격 변형을 일으키고 상처 [citation needed]치유에 콜라겐의 생성을 억제합니다.
노출
물속에서
수인성 망간은 식이 망간보다 생체이용률이 높습니다.2010년 [99]연구 결과에 따르면, 식수에서 망간에 더 많이 노출되는 것은 학령기 아동의 지적 장애 증가와 지능 지수 감소와 관련이 있습니다.샤워수에서 자연적으로 발생하는 망간을 흡입함으로써 장기간 노출될 경우 최대 870만 명의 미국인들이 [100]위험에 처하게 된다는 가설이 있습니다.그러나 데이터에 따르면 인체는 망간 과다 노출로 인한 특정 부작용을 회복할 수 있으며, 만약 노출이 중단되고 인체가 [101]과다 노출을 제거할 수 있다면 말입니다.
저산소 기간이 [102]발생할 때 바닷물에서 Mn 수치가 증가할 수 있습니다.1990년부터 어류, 갑각류, 연체동물, 극피동물을 포함한 해양생물에서 Mn 축적에 대한 보고가 있었습니다.특정 조직은 아가미, 뇌, 혈액, 신장, 간/간을 포함한 다양한 종의 표적입니다.이 종들에서 생리학적인 영향이 보고되었습니다.Mn은 식세포증과 프로페놀옥시다제의 활성화와 같은 면역세포와 그 기능성에 영향을 미쳐 유기체의 면역체계를 억제할 수 있습니다.이것은 유기체들이 감염에 더 취약하도록 만듭니다.기후변화가 일어나면서 병원체 분포가 증가하고, 생물체가 생존하고 이러한 병원체로부터 자신을 방어하기 위해서는 건강하고 강한 면역체계가 필요합니다.만일 그들의 시스템이 높은 Mn 수준으로부터 손상된다면, 그들은 이 병원균들과 싸워 [62]이길 수 없을 것이고 죽을 것입니다.
휘발유.

MMT(Methyl cyclopentadienyl manguage tricarbonyl)는 옥탄가 등급을 향상시키기 위해 가솔린의 납 화합물을 대체하기 위해 개발된 첨가제입니다.MMT는 일부 국가에서만 사용됩니다.망간을 함유한 연료는 망간 탄화물을 형성하는 경향이 있으며, 이는 배기 밸브를 손상시킵니다.
항공사
1953년에 비해 공기 중 망간 수준이 떨어졌습니다.[103]일반적으로 주변 Mn 공기 농도가 5μg Mn/m을3 초과하면 Mn에 의한 증상이 나타날 수 있습니다.인간 배아 신장(HEK293) 세포에서 페로포르틴 단백질 발현 증가는 세포 내 Mn 농도 감소 및 세포 독성 약화와 관련이 있으며, 이는 Mn 감소된 글루타메이트 섭취 및 젖산 탈수소효소 [104]누출 감소로 특징지어집니다.
규정
미국의 망간 노출은 산업안전보건국(OSHA)[105]에 의해 규제됩니다.망간을 흡입하거나 삼킴으로써 사람들은 직장에서 망간에 노출될 수 있습니다.OSHA는 작업장 내 망간 노출에 대한 법적 허용치(허용 노출 한도)를 8시간 근무일 동안 5mg3/m로 설정했습니다.국립산업안전보건원(NIOSH)은 하루 8시간 근무에 1mg/m의3 권장 노출 한도(REL)와 3mg/m의3 단기 제한을 설정했습니다.망간은 500mg/m3 수준에서 생명과 [106]건강에 즉시 위험합니다.
건강과 안전
망간은 비록 mg의 양이지만 인간의 건강에 필수적입니다.
현재 미국 EPA 규정에 따른 최대 안전 농도는 50 μg Mn/[107]L입니다.
만가니즘
망간 과다 노출은 망간 과다 섭취 또는 흡입과 관련된 희귀 신경학적 장애인 망간 과다 노출과 가장 자주 관련이 있습니다.역사적으로[108][109] 망간합금의 제조나 가공에 종사하는 사람들은 망간증에 걸릴 위험성이 있지만,[105] 선진국에서는 건강 및 안전에 관한 규정이 근로자들을 보호하고 있습니다.이 질환은 1837년 영국의 학자 존 쿠퍼가 망간 분쇄기를 [41]사용한 두 명의 환자를 연구하여 처음으로 설명했습니다.
망간증은 2상성 장애입니다.초기 단계에서, 술에 취한 사람은 우울증, 감정 변화, 강박적 행동, 그리고 정신병을 경험할 수 있습니다.초기 신경학적 증상은 파킨슨병과 비슷한 후기 망간증에 자리를 내줍니다.증상으로는 나약함, 단조롭고 느린 말투, 무표정한 얼굴, 떨림, 앞으로 기대어 걷는 걸음걸이, 넘어지지 않고 뒤로 걷지 못하는 장애, 경직, 손재주, 걸음걸이,[41][110] 균형에 대한 일반적인 문제 등이 있습니다.파킨슨병과 달리 망간증은 후각의 상실과 관련이 없으며 환자들은 전형적으로 L-DOPA [111]치료에 반응하지 않습니다.노출원을 제거하고 뇌 망간 수치가 [110]정상으로 돌아오더라도 시간이 지남에 따라 망간 말기 증상은 더욱 심해집니다.
만성 망간 노출은 운동 [112]이상을 특징으로 하는 파킨슨병과 유사한 질병을 일으키는 것으로 나타났습니다.이 상태는 PD 치료에 사용되는 일반적인 치료법에 반응하지 않으며, 실질 흑막 [112]내의 일반적인 도파민성 손실보다 대안적인 경로를 제시합니다.망간이 기저 신경절에 축적되어 비정상적인 [113]움직임으로 이어질 수 있습니다.이 파킨슨병과 유사한 질병은 [114]세포내 Mn을 감소시키는데 필요한 망간 방출 전달체인 SLC30A10 유전자의 변이와 관련이 있습니다.PD에 전형적인 루이체는 Mn-유도 파킨슨증에서 [113]볼 수 없습니다.
동물 실험은 통제된 조건에서 망간 과다 노출의 결과를 조사할 수 있는 기회를 주었습니다.(공격적이지 않은) 쥐에서 망간은 쥐를 죽이는 [115]행동을 유도합니다.
독성
| 유해성 | |
|---|---|
| GHS 라벨링: | |
| H401 | |
| P273, P501[116] | |
| NFPA 704 (파이어다이아몬드) | |
망간 화합물은 니켈이나 [117]구리와 같은 널리 퍼져있는 다른 금속들보다 독성이 덜합니다.그러나 망간 분진과 매연에 노출되는 것은 독성 [118]수준 때문에 단기간이라도 5mg3/m의 천 장값을 초과해서는 안 됩니다.망간 중독은 운동 능력의 저하와 인지 [119]장애와 관련이 있습니다.
신경퇴행성질환
DMT1이라고 불리는 단백질은 장에서 망간을 흡수하는 주요 운반자이며 혈액-뇌 장벽을 가로지르는 망간의 주요 운반자일 수 있습니다.DMT1은 흡입된 망간을 비강 상피를 가로질러 운반하기도 합니다.망간 독성에 대한 제안된 메커니즘은 조절 장애가 산화 스트레스, 미토콘드리아 기능 장애, 글루탐산염 매개 흥분 독성 및 [120]단백질의 응집을 초래한다는 것입니다.
참고 항목
- 망간 수출국, 막 수송 단백질
- 망간 생산량에 따른 나라 목록
- 파커라이징
참고문헌
- ^ "Standard Atomic Weights: Manganese". CIAAW. 2017.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). "The NUBASE2020 evaluation of nuclear properties" (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ a b Erikson, Keith M.; Ascher, Michael (2019). "Chapter 10. Manganese: Its Role in Disease and Health". In Sigel, Astrid; Freisinger, Eva; Sigel, Roland K. O.; Carver, Peggy L. (eds.). Essential Metals in Medicine:Therapeutic Use and Toxicity of Metal Ions in the Clinic. pp. 253–266. doi:10.1515/9783110527872-016. ISBN 978-3-11-052691-2. PMID 30855111. S2CID 73725546.
{{cite book}}:journal=무시됨(도움말) - ^ a b c d e f Emsley, John (2001). "Manganese". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, UK: Oxford University Press. pp. 249–253. ISBN 978-0-19-850340-8.
- ^ Roth, Jerome; Ponzoni, Silvia; Aschner, Michael (2013). "Manganese Homeostasis and Transport". In Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. pp. 169–201. doi:10.1007/978-94-007-5561-1_6. ISBN 978-94-007-5560-4. PMC 6542352. PMID 23595673. 전자책 ISBN 978-94-007-5561-1
- ^ a b c d Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Mangan". Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. pp. 1110–1117. ISBN 978-3-11-007511-3.
- ^ Lide, David R. (2004). Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics. CRC press. ISBN 978-0-8493-0485-9. Archived from the original on 17 December 2019. Retrieved 7 September 2019.
- ^ a b Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). "The NUBASE2016 evaluation of nuclear properties" (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- ^ Clery, Daniel (4 June 2020). "The galaxy's brightest explosions go nuclear with an unexpected trigger: pairs of dead stars". Science. Retrieved 26 July 2021.
- ^ Schaefer, Jeorg; Faestermann, Thomas; Herzog, Gregory F.; Knie, Klaus; Korschinek, Gunther; Masarik, Jozef; Meier, Astrid; Poutivtsev, Michail; Rugel, Georg; Schlüchter, Christian; Serifiddin, Feride; Winckler, Gisela (2006). "Terrestrial manganese-53 – A new monitor of Earth surface processes". Earth and Planetary Science Letters. 251 (3–4): 334–345. Bibcode:2006E&PSL.251..334S. doi:10.1016/j.epsl.2006.09.016.
- ^ Birck, J.; Rotaru, M.; Allègre, C. (1999). "53Mn-53Cr evolution of the early solar system". Geochimica et Cosmochimica Acta. 63 (23–24): 4111–4117. Bibcode:1999GeCoA..63.4111B. doi:10.1016/S0016-7037(99)00312-9.
- ^ Lugmair, G.; Shukolyukov, A. (1998). "Early solar system timescales according to 53Mn-53Cr systematics". Geochimica et Cosmochimica Acta. 62 (16): 2863–2886. Bibcode:1998GeCoA..62.2863L. doi:10.1016/S0016-7037(98)00189-6.
- ^ Shukolyukov, Alexander; Lugmair, Günter W. (2000). "On The 53Mn Heterogeneity In The Early Solar System". Space Science Reviews. 92: 225–236. Bibcode:2000SSRv...92..225S. doi:10.1023/A:1005243228503.
- ^ Trinquier, A.; Birck, J.; Allègre, C.; Göpel, C.; Ulfbeck, D. (2008). "53Mn–53Cr systematics of the early Solar System revisited". Geochimica et Cosmochimica Acta. 72 (20): 5146–5163. Bibcode:2008GeCoA..72.5146T. doi:10.1016/j.gca.2008.03.023.
- ^ a b c Young, D.A. (1975). "Phase diagrams of the elements". International Nuclear Information System. LNL: 15. Retrieved 30 January 2023.
- ^ a b Dhananjayan, N.; Banerjee, T. (1969). Crystallographic modifications of manganese and their transformation characteristics. Chapter 1 of: Structure of Electro-Deposited Manganese. CSIR-NML. pp. 3–28.
- ^ Kemmitt, R. D. W.; Peacock, R. D. (1973). The Chemistry of Manganese, Technetium and Rhenium. Pergamon Texts in Inorganic Chemistry. Saint Louis: Elsevier Science. p. 778. ISBN 978-1-4831-3806-0. OCLC 961064866.
- ^ Bradley, A.J.; Thewlis, J. (1927). "The crystal structure of α-manganese". Proceedings of the Royal Society of London, Series A. 115 (771): 456–471. Bibcode:1927RSPSA.115..456B. doi:10.1098/rspa.1927.0103. ISSN 0950-1207.
- ^ Lawson, A. C.; Larson, Allen C.; Aronson, M. C.; et al. (1994). "Magnetic and crystallographic order in α‐manganese". J. Appl. Phys. 76 (10): 7049–7051. Bibcode:1994JAP....76.7049L. doi:10.1063/1.358024. ISSN 0021-8979.
- ^ a b Prior, Timothy J; Nguyen-Manh, Duc; Couper, Victoria J; Battle, Peter D (2004). "Ferromagnetism in the beta-manganese structure: Fe1.5Pd0.5Mo3N". Journal of Physics: Condensed Matter. 16 (13): 2273–2281. Bibcode:2004JPCM...16.2273P. doi:10.1088/0953-8984/16/13/008. ISSN 0953-8984. S2CID 250784683.
- ^ Funahashi, S.; Kohara, T. (1984). "Neutron diffuse scattering in β‐manganese". J. Appl. Phys. 55 (6): 2048–2050. Bibcode:1984JAP....55.2048F. doi:10.1063/1.333561. ISSN 0021-8979.
- ^ a b c Duschanek, H.; Mohn, P.; Schwarz, K. (1989). "Antiferromagnetic and ferromagnetic gamma-manganese generalisation of the fixed-spin-moment method". Physica B: Condensed Matter. 161 (1–3): 139–142. doi:10.1016/0921-4526(89)90120-8. ISSN 0921-4526.
- ^ Bacon, G E; Cowlam, N (1970). "A study of some alloys of gamma -manganese by neutron diffraction". Journal of Physics C: Solid State Physics. 3 (3): 675–686. Bibcode:1970JPhC....3..675B. doi:10.1088/0022-3719/3/3/023. ISSN 0022-3719.
- ^ "Ch. 20". Shriver and Atkins' Inorganic Chemistry. Oxford University Press. 2010. ISBN 978-0-19-923617-6.
- ^ Luft, J. H. (1956). "Permanganate – a new fixative for electron microscopy". Journal of Biophysical and Biochemical Cytology. 2 (6): 799–802. doi:10.1083/jcb.2.6.799. PMC 2224005. PMID 13398447.
- ^ Man, Wai-Lun; Lam, William W. Y.; Lau, Tai-Chu (2014). "Reactivity of Nitrido Complexes of Ruthenium(VI), Osmium(VI), and Manganese(V) Bearing Schiff Base and Simple Anionic Ligands". Accounts of Chemical Research. 47 (2): 427–439. doi:10.1021/ar400147y. PMID 24047467.
- ^ Goldberg, David P. (2007). "Corrolazines: New Frontiers in High-Valent Metalloporphyrinoid Stability and Reactivity". Accounts of Chemical Research. 40 (7): 626–634. doi:10.1021/ar700039y. PMID 17580977.
- ^ Yano, Junko; Yachandra, Vittal (2014). "Mn4Ca Cluster in Photosynthesis: Where and How Water is Oxidized to Dioxygen". Chemical Reviews. 114 (8): 4175–4205. doi:10.1021/cr4004874. PMC 4002066. PMID 24684576.
- ^ Rayner-Canham, Geoffrey and Overton, Tina (2003) 기술 무기 화학, Macmillan, p. 491, ISBN 0-7167-4620-4.
- ^ Schmidt, Max (1968). "VII. Nebengruppe". Anorganische Chemie II (in German). Wissenschaftsverlag. pp. 100–109.
- ^ Girolami, Gregory S.; Wilkinson, Geoffrey; Thornton-Pett, Mark; Hursthouse, Michael B. (1983). "Hydrido, alkyl, and ethylene 1,2-bis(dimethylphosphino)ethane complexes of manganese and the crystal structures of MnBr2(dmpe)2, [Mn(AlH4)(dmpe)2]2 and MnMe2(dmpe)2". Journal of the American Chemical Society. 105 (22): 6752–6753. doi:10.1021/ja00360a054.
- ^ languagehat (28 May 2005). "MAGNET". languagehat.com. Retrieved 18 June 2020.
- ^ Calvert, J. B. (24 January 2003). "Chromium and Manganese". Archived from the original on 31 December 2016. Retrieved 10 December 2022.
- ^ Chalmin, Emilie; Menu, Michel; Vignaud, Colette (2003). "Analysis of rock art painting and technology of Palaeolithic painters". Measurement Science and Technology. 14 (9): 1590–1597. doi:10.1088/0957-0233/14/9/310. S2CID 250842390.
- ^ Chalmin, E.; Vignaud, C.; Salomon, H.; Farges, F.; Susini, J.; Menu, M. (2006). "Minerals discovered in paleolithic black pigments by transmission electron microscopy and micro-X-ray absorption near-edge structure" (PDF). Applied Physics A. 83 (12): 213–218. Bibcode:2006ApPhA..83..213C. doi:10.1007/s00339-006-3510-7. hdl:2268/67458. S2CID 9221234.
- ^ Sayre, E. V.; Smith, R. W. (1961). "Compositional Categories of Ancient Glass". Science. 133 (3467): 1824–1826. Bibcode:1961Sci...133.1824S. doi:10.1126/science.133.3467.1824. PMID 17818999. S2CID 25198686.
- ^ a b c Mccray, W. Patrick (1998). "Glassmaking in renaissance Italy: The innovation of venetian cristallo". JOM. 50 (5): 14–19. Bibcode:1998JOM....50e..14M. doi:10.1007/s11837-998-0024-0. S2CID 111314824.
- ^ Rancke-Madsen, E. (1975). "The Discovery of an Element". Centaurus. 19 (4): 299–313. Bibcode:1975Cent...19..299R. doi:10.1111/j.1600-0498.1975.tb00329.x.
- ^ Alessio, L.; Campagna, M.; Lucchini, R. (2007). "From lead to manganese through mercury: mythology, science, and lessons for prevention". American Journal of Industrial Medicine. 50 (11): 779–787. doi:10.1002/ajim.20524. PMID 17918211.
- ^ a b c Couper, John (1837). "On the effects of black oxide of manganese when inhaled into the lungs". Br. Ann. Med. Pharm. Vital. Stat. Gen. Sci. 1: 41–42.
- ^ Olsen, Sverre E.; Tangstad, Merete; Lindstad, Tor (2007). "History of omanganese". Production of Manganese Ferroalloys. Tapir Academic Press. pp. 11–12. ISBN 978-82-519-2191-6.
- ^ a b Preisler, Eberhard (1980). "Moderne Verfahren der Großchemie: Braunstein". Chemie in unserer Zeit (in German). 14 (5): 137–148. doi:10.1002/ciuz.19800140502.
- ^ Bhattacharyya, P. K.; Dasgupta, Somnath; Fukuoka, M.; Roy Supriya (1984). "Geochemistry of braunite and associated phases in metamorphosed non-calcareous manganese ores of India". Contributions to Mineralogy and Petrology. 87 (1): 65–71. Bibcode:1984CoMP...87...65B. doi:10.1007/BF00371403. S2CID 129495326.
- ^ a b c USGS 광물상품 요약 2009
- ^ Cook, Nigel J.; Ciobanu, Cristiana L.; Pring, Allan; Skinner, William; Shimizu, Masaaki; Danyushevsky, Leonid; Saini-Eidukat, Bernhardt; Melcher, Frank (2009). "Trace and minor elements in sphalerite: A LA-ICPMS study". Geochimica et Cosmochimica Acta. 73 (16): 4761–4791. Bibcode:2009GeCoA..73.4761C. doi:10.1016/j.gca.2009.05.045.
- ^ Wang, X; Schröder, HC; Wiens, M; Schlossmacher, U; Müller, WEG (2009). "Manganese/polymetallic nodules: micro-structural characterization of exolithobiontic- and endolithobiontic microbial biofilms by scanning electron microscopy". Micron. 40 (3): 350–358. doi:10.1016/j.micron.2008.10.005. PMID 19027306.
- ^ United Nations (1978). Manganese Nodules: Dimensions and Perspectives. p. 343. Bibcode:1981MGeol..41..343C. doi:10.1016/0025-3227(81)90092-X. ISBN 978-90-277-0500-6. OCLC 4515098.
{{cite book}}:journal=무시됨(도움말) - ^ "Manganese Mining in South Africa – Overview". MBendi Information Services. Archived from the original on 5 February 2016. Retrieved 10 December 2022.
- ^ Elliott, R; Coley, K; Mostaghel, S; Barati, M (2018). "Review of Manganese Processing for Production of TRIP/TWIP Steels, Part 1: Current Practice and Processing Fundamentals". JOM. 70 (5): 680–690. Bibcode:2018JOM....70e.680E. doi:10.1007/s11837-018-2769-4. S2CID 139950857.
- ^ Corathers, L. A.; Machamer, J. F. (2006). "Manganese". Industrial Minerals & Rocks: Commodities, Markets, and Uses (7th ed.). SME. pp. 631–636. ISBN 978-0-87335-233-8.
- ^ a b Zhang, Wensheng; Cheng, Chu Yong (2007). "Manganese metallurgy review. Part I: Leaching of ores/secondary materials and recovery of electrolytic/chemical manganese dioxide". Hydrometallurgy. 89 (3–4): 137–159. Bibcode:2007HydMe..89..137Z. doi:10.1016/j.hydromet.2007.08.010.
- ^ Chow, Norman; Nacu, Anca; Warkentin, Doug; Aksenov, Igor & Teh, Hoe (2010). "The Recovery of Manganese from low grade resources: bench scale metallurgical test program completed" (PDF). Kemetco Research Inc. Archived from the original (PDF) on 2 February 2012.
- ^ "The CIA secret on the ocean floor". BBC News. 19 February 2018. Retrieved 3 May 2018.
- ^ "Project Azorian: The CIA's Declassified History of the Glomar Explorer". National Security Archive at George Washington University. 12 February 2010. Retrieved 18 September 2013.
- ^ Hein, James R. (January 2016). Encyclopedia of Marine Geosciences - Manganese Nodules. Springer. pp. 408–412. Retrieved 2 February 2021.
- ^ Hoseinpour, Vahid; Ghaemi, Nasser (1 December 2018). "Green synthesis of manganese nanoparticles: Applications and future perspective–A review". Journal of Photochemistry and Photobiology B: Biology. 189: 234–243. doi:10.1016/j.jphotobiol.2018.10.022. PMID 30412855. S2CID 53248245. Retrieved 2 February 2021.
- ^ International Seabed Authority. "Polymetallic Nodules" (PDF). isa.org. International Seabed Authority. Retrieved 2 February 2021.
- ^ Oebius, Horst U; Becker, Hermann J; Rolinski, Susanne; Jankowski, Jacek A (January 2001). "Parametrization and evaluation of marine environmental impacts produced by deep-sea manganese nodule mining". Deep Sea Research Part II: Topical Studies in Oceanography. 48 (17–18): 3453–3467. Bibcode:2001DSRII..48.3453O. doi:10.1016/s0967-0645(01)00052-2. ISSN 0967-0645.
- ^ Thompson, Kirsten F.; Miller, Kathryn A.; Currie, Duncan; Johnston, Paul; Santillo, David (2018). "Seabed Mining and Approaches to Governance of the Deep Seabed". Frontiers in Marine Science. 5. doi:10.3389/fmars.2018.00480. S2CID 54465407.
- ^ a b Ray, Durbar; Babu, E. V. S. S. K.; Surya Prakash, L. (1 January 2017). "Nature of Suspended Particles in Hydrothermal Plume at 3°40'N Carlsberg Ridge:A Comparison with Deep Oceanic Suspended Matter". Current Science. 112 (1): 139. doi:10.18520/cs/v112/i01/139-146. ISSN 0011-3891.
- ^ a b Hernroth, Bodil; Tassidis, Helena; Baden, Susanne P. (March 2020). "Immunosuppression of aquatic organisms exposed to elevated levels of manganese: From global to molecular perspective". Developmental & Comparative Immunology. 104: 103536. doi:10.1016/j.dci.2019.103536. ISSN 0145-305X. PMID 31705914. S2CID 207935992.
- ^ a b Sim, Nari; Orians, Kristin J. (October 2019). "Annual variability of dissolved manganese in Northeast Pacific along Line-P: 2010–2013". Marine Chemistry. 216: 103702. Bibcode:2019MarCh.21603702S. doi:10.1016/j.marchem.2019.103702. ISSN 0304-4203. S2CID 203151735.
- ^ Bartlett, Richmond; Ross, Donald (2005). "Chemistry of Redox Processes in Soils". In Tabatabai, M.A.; Sparks, D.L. (eds.). Chemical Processes in Soils. SSSA Book Series, no. 8. Madison, Wisconsin: Soil Science Society of America. pp. 461–487. LCCN 2005924447.
- ^ Dixon, Joe B.; White, G. Norman (2002). "Manganese Oxides". In Dixon, J.B.; Schulze, D.G. (eds.). Soil Mineralogy with Environmental Applications. SSSA Book Series no. 7. Madison, Wisconsin: Soil Science Society of America. pp. 367–386. LCCN 2002100258.
- ^ Verhoeven, John D. (2007). Steel metallurgy for the non-metallurgist. Materials Park, Ohio: ASM International. pp. 56–57. ISBN 978-0-87170-858-8.
- ^ 망간USGS 2006
- ^ Dastur, Y. N.; Leslie, W. C. (1981). "Mechanism of work hardening in Hadfield manganese steel". Metallurgical Transactions A. 12 (5): 749–759. Bibcode:1981MTA....12..749D. doi:10.1007/BF02648339. S2CID 136550117.
- ^ Stansbie, John Henry (2007). Iron and Steel. Read Books. pp. 351–352. ISBN 978-1-4086-2616-0.
- ^ Brady, George S.; Clauser, Henry R.; Vaccari. John A. (2002). Materials Handbook: an encyclopedia for managers, technical professionals, purchasing and production managers, technicians, and supervisors. New York, NY: McGraw-Hill. pp. 585–587. ISBN 978-0-07-136076-0.
- ^ Tweedale, Geoffrey (1985). "Sir Robert Abbott Hadfield F.R.S. (1858–1940), and the Discovery of Manganese Steel Geoffrey Tweedale". Notes and Records of the Royal Society of London. 40 (1): 63–74. doi:10.1098/rsnr.1985.0004. JSTOR 531536. S2CID 73176861.
- ^ "Chemical properties of 2024 aluminum allow". Metal Suppliers Online, LLC. Retrieved 30 April 2009.
- ^ a b Kaufman, John Gilbert (2000). "Applications for Aluminium Alloys and Tempers". Introduction to aluminum alloys and tempers. ASM International. pp. 93–94. ISBN 978-0-87170-689-8.
- ^ a b Dell, R. M. (2000). "Batteries fifty years of materials development". Solid State Ionics. 134 (1–2): 139–158. doi:10.1016/S0167-2738(00)00722-0.
- ^ "WSK1216" (PDF). vishay. Vishay Intertechnology. Retrieved 30 April 2022.
- ^ Reidies, Arno H. (2000). "Manganese Compounds". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a16_123. ISBN 9783527303854.
- ^ "EPA Comments on the Gasoline Additive MMT". epa.gov. EPA. 5 October 2015. Retrieved 25 June 2023.
- ^ Shorter Oxford English Dictionary (5th ed.). Oxford University Press. 2002. ISBN 978-0-19-860457-0.
A red brown earth containing iron and manganese oxides and darker than ochre and sienna, used to make various pigments.
- ^ Chen, Daquin; Zhou, Yang; Zhong, Jiasong (2016). "A review on Mn4+ activators in solids for warm white light-emitting diodes". RSC Advances. 6 (89): 86285–86296. Bibcode:2016RSCAd...686285C. doi:10.1039/C6RA19584A.
- ^ Baur, Florian; Jüstel, Thomas (2016). "Dependence of the optical properties of Mn4+ activated A2Ge4O9 (A=K,Rb) on temperature and chemical environment". Journal of Luminescence. 177: 354–360. Bibcode:2016JLum..177..354B. doi:10.1016/j.jlumin.2016.04.046.
- ^ Jansen, T.; Gorobez, J.; Kirm, M.; Brik, M. G.; Vielhauer, S.; Oja, M.; Khaidukov, N. M.; Makhov, V. N.; Jüstel, T. (1 January 2018). "Narrow Band Deep Red Photoluminescence of Y2Mg3Ge3O12:Mn4+,Li+ Inverse Garnet for High Power Phosphor Converted LEDs". ECS Journal of Solid State Science and Technology. 7 (1): R3086–R3092. doi:10.1149/2.0121801jss. S2CID 103724310.
- ^ Jansen, Thomas; Baur, Florian; Jüstel, Thomas (2017). "Red emitting K2NbF7:Mn4+ and K2TaF7:Mn4+ for warm-white LED applications". Journal of Luminescence. 192: 644–652. Bibcode:2017JLum..192..644J. doi:10.1016/j.jlumin.2017.07.061.
- ^ Zhou, Zhi; Zhou, Nan; Xia, Mao; Yokoyama, Meiso; Hintzen, H. T. (Bert) (6 October 2016). "Research progress and application prospects of transition metal Mn4+-activated luminescent materials". Journal of Materials Chemistry C. 4 (39): 9143–9161. doi:10.1039/c6tc02496c.
- ^ "TriGain LED phosphor system using red Mn4+-doped complex fluorides" (PDF). GE Global Research. Retrieved 10 December 2022.
- ^ Kuwahara, Raymond T.; Skinner III, Robert B.; Skinner Jr., Robert B. (2001). "Nickel coinage in the United States". Western Journal of Medicine. 175 (2): 112–114. doi:10.1136/ewjm.175.2.112. PMC 1071501. PMID 11483555.
- ^ "Design of the Sacagawea dollar". United States Mint. Retrieved 4 May 2009.
- ^ Shepard, Anna Osler (1956). "Manganese and Iron–Manganese Paints". Ceramics for the Archaeologist. Carnegie Institution of Washington. pp. 40–42. ISBN 978-0-87279-620-1.
- ^ Rice, Derek B.; Massie, Allyssa A.; Jackson, Timothy A. (2017). "Manganese–Oxygen Intermediates in O–O Bond Activation and Hydrogen-Atom Transfer Reactions". Accounts of Chemical Research. 50 (11): 2706–2717. doi:10.1021/acs.accounts.7b00343. PMID 29064667.
- ^ Umena, Yasufumi; Kawakami, Keisuke; Shen, Jian-Ren; Kamiya, Nobuo (May 2011). "Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9 Å" (PDF). Nature. 473 (7345): 55–60. Bibcode:2011Natur.473...55U. doi:10.1038/nature09913. PMID 21499260. S2CID 205224374.
- ^ Dismukes, G. Charles; Willigen, Rogier T. van (2006). "Manganese: The Oxygen-Evolving Complex & Models". Manganese: The Oxygen-Evolving Complex & Models Based in part on the article Manganese: Oxygen-Evolving Complex & Models by Lars-Erik Andréasson & Tore Vänngård which appeared in the Encyclopedia of Inorganic Chemistry, First Edition, First Edition. Encyclopedia of Inorganic Chemistry. doi:10.1002/0470862106.ia128. ISBN 978-0470860786.
- ^ Takeda, A. (2003). "Manganese action in brain function". Brain Research Reviews. 41 (1): 79–87. doi:10.1016/S0165-0173(02)00234-5. PMID 12505649. S2CID 1922613.
- ^ a b Institute of Medicine (US) Panel on Micronutrients (2001). "Manganese". Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Chromium, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Chromium. National Academy Press. pp. 394–419. ISBN 978-0-309-07279-3. PMID 25057538.
- ^ 봐 "Manganese". Micronutrient Information Center. Oregon State University Linus Pauling Institute. 23 April 2014.
- ^ "Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies" (PDF). 2017.
- ^ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF), European Food Safety Authority, 2006
- ^ "Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR page 33982" (PDF).
- ^ "Daily Value Reference of the Dietary Supplement Label Database (DSLD)". Dietary Supplement Label Database (DSLD). Archived from the original on 7 April 2020. Retrieved 16 May 2020.
- ^ Silva Avila, Daiana; Luiz Puntel, Robson; Aschner, Michael (2013). "Manganese in Health and Disease". In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 199–227. doi:10.1007/978-94-007-7500-8_7. ISBN 978-94-007-7499-5. PMC 6589086. PMID 24470093.
- ^ Bouchard, M. F; Sauvé, S; Barbeau, B; Legrand, M; Bouffard, T; Limoges, E; Bellinger, D. C; Mergler, D (2011). "Intellectual impairment in school-age children exposed to manganese from drinking water". Environmental Health Perspectives. 119 (1): 138–143. doi:10.1289/ehp.1002321. PMC 3018493. PMID 20855239.
- ^ Barceloux, Donald; Barceloux, Donald (1999). "Manganese". Clinical Toxicology. 37 (2): 293–307. doi:10.1081/CLT-100102427. PMID 10382563.
- ^ Devenyi, A. G; Barron, T. F; Mamourian, A. C (1994). "Dystonia, hyperintense basal ganglia, and high whole blood manganese levels in Alagille's syndrome". Gastroenterology. 106 (4): 1068–71. doi:10.1016/0016-5085(94)90769-2. PMID 8143974. S2CID 2711273.
- ^ Hernroth, Bodil; Krång, Anna-Sara; Baden, Susanne (February 2015). "Bacteriostatic suppression in Norway lobster (Nephrops norvegicus) exposed to manganese or hypoxia under pressure of ocean acidification". Aquatic Toxicology. 159: 217–224. doi:10.1016/j.aquatox.2014.11.025. ISSN 0166-445X. PMID 25553539.
- ^ 독성물질 및 질병 등록기관 (2012) 6. 인체 노출 가능성, 망간의 독성학적 프로필, 애틀랜타, 조지아: 미국 보건복지부.
- ^ Yin, Z.; Jiang, H.; Lee, E. S.; Ni, M.; Erikson, K. M.; Milatovic, D.; Bowman, A. B.; Aschner, M. (2010). "Ferroportin is a manganese-responsive protein that decreases manganese cytotoxicity and accumulation" (PDF). Journal of Neurochemistry. 112 (5): 1190–8. doi:10.1111/j.1471-4159.2009.06534.x. PMC 2819584. PMID 20002294.
- ^ a b "Safety and Health Topics: Manganese Compounds (as Mn)". U.S. Occupational Safety and Health Administration.
- ^ "NIOSH Pocket Guide to Chemical Hazards – Manganese compounds and fume (as Mn)". Centers for Disease Control. Retrieved 19 November 2015.
- ^ "Drinking Water Contaminants". US EPA. Retrieved 2 February 2015.
- ^ Baselt, R. (2008) 독성 약물 및 화학물질의 인간에서의 처분, 8판, 바이오메디컬 출판물, Foster City, CA, pp. 883–886, ISBN 0-9626523-7-7.
- ^ Normandin, Louise; Hazell, A. S. (2002). "Manganese neurotoxicity: an update of pathophysiologic mechanisms". Metabolic Brain Disease. 17 (4): 375–87. doi:10.1023/A:1021970120965. PMID 12602514. S2CID 23679769.
- ^ a b Cersosimo, M. G.; Koller, W.C. (2007). "The diagnosis of manganese-induced parkinsonism". NeuroToxicology. 27 (3): 340–346. doi:10.1016/j.neuro.2005.10.006. PMID 16325915.
- ^ Lu, C. S.; Huang, C.C; Chu, N.S.; Calne, D.B. (1994). "Levodopa failure in chronic manganism". Neurology. 44 (9): 1600–1602. doi:10.1212/WNL.44.9.1600. PMID 7936281. S2CID 38040913.
- ^ a b Guilarte TR, Gonzales KK (August 2015). "Manganese-Induced Parkinsonism Is Not Idiopathic Parkinson's Disease: Environmental and Genetic Evidence". Toxicological Sciences (Review). 146 (2): 204–12. doi:10.1093/toxsci/kfv099. PMC 4607750. PMID 26220508.
- ^ a b Kwakye GF, Paoliello MM, Mukhopadhyay S, Bowman AB, Aschner M (July 2015). "Manganese-Induced Parkinsonism and Parkinson's Disease: Shared and Distinguishable Features". Int J Environ Res Public Health (Review). 12 (7): 7519–40. doi:10.3390/ijerph120707519. PMC 4515672. PMID 26154659.
- ^ Peres TV, Schettinger MR, Chen P, Carvalho F, Avila DS, Bowman AB, Aschner M (November 2016). "Manganese-induced neurotoxicity: a review of its behavioral consequences and neuroprotective strategies". BMC Pharmacology & Toxicology (Review). 17 (1): 57. doi:10.1186/s40360-016-0099-0. PMC 5097420. PMID 27814772.
- ^ Lazrishvili, I.; et al. (2016). "Manganese loading induces mouse-killing behaviour in nonaggressive rats". Journal of Biological Physics and Chemistry. 16 (3): 137–141. doi:10.4024/31LA14L.jbpc.16.03.
- ^ "Safety Data Sheet". Sigma-Aldrich. Retrieved 26 July 2021.
- ^ Hasan, Heather (2008). Manganese. The Rosen Publishing Group. p. 31. ISBN 978-1-4042-1408-8.
- ^ "Manganese Chemical Background". Metcalf Institute for Marine and Environmental Reporting University of Rhode Island. April 2006. Archived from the original on 28 August 2006. Retrieved 30 April 2008.
- ^ "Risk Assessment Information System Toxicity Summary for Manganese". Oak Ridge National Laboratory. Retrieved 23 April 2008.
- ^ Prabhakaran, K.; Ghosh, D.; Chapman, G.D.; Gunasekar, P.G. (2008). "Molecular mechanism of manganese exposure-induced dopaminergic toxicity". Brain Research Bulletin. 76 (4): 361–367. doi:10.1016/j.brainresbull.2008.03.004. ISSN 0361-9230. PMID 18502311. S2CID 206339744.





