척수근위축증
Spinal muscular atrophy| 척수근위축증 | |
|---|---|
| 기타 이름 | 상염색체 열성 근위근위축증, 5q척수근위축증 |
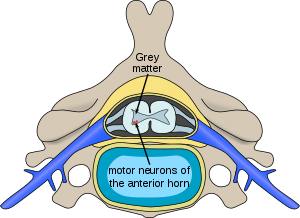 | |
| 척수근위축의 영향을 받는 뉴런의 위치 | |
| 전문 | 신경학 |
| 증상 | 진행성 근력[1] 저하 |
| 합병증 | 척추측만증, 관절수축, 폐렴[2] |
| 종류들 | 0을 입력하고 4를 입력합니다[2]. |
| 원인들 | SMN1에서의[2] 변환 |
| 진단 방법 | 유전자 검사[1] |
| 차동 진단 | 선천성 근위축증, 듀센 근위축증, 프라더-윌리[2] 증후군 |
| 치료 | 지원 케어, 의약품[1] |
| 약 | 누시네르센, 오나셈노진아베파르보벡, 리스디플람 |
| 예후 | 유형에 따라[2] 다르다 |
| 빈도수. | 10,000명[2] 중 1명 |
척추근육위축증은 운동신경세포의 손실과 진행성 [3][4][5]근육소모를 초래하는 희귀한 신경근육질환이다.보통 유아기나 유아기에 진단되며 치료하지 않고 방치하면 유아 사망의 가장 [6]흔한 유전적 원인이 된다.그것은 또한 나중에 나타나서 그 병의 경과가 좀 더 가벼워질 수도 있다.일반적인 특징은 자발적인 근육의 진행성 약화로 팔, 다리, 호흡기 근육이 [7][8]먼저 영향을 받는다.관련 문제로는 머리 조절 불량, 삼키기 어려움, 척추 측만증, 관절 [2][8]수축 등이 있을 수 있습니다.
발병 연령과 증상의 심각도는 척추근육위축의 전통적인 [4]분류의 기초를 형성한다.
척추근육위축은 운동뉴런의 [8]생존에 필요한 단백질인 SMN을 암호화하는 SMN1[1][2] 유전자의 이상(변성)에 기인한다.척수에서 이러한 뉴런의 상실은 뇌와 골격 [8]근육 사이의 신호를 방해한다.다른 유전자인 SMN2는 질병을 수정하는 유전자로 간주되는데, 보통 SMN2가 더 많이 복제될수록 더 가벼운 질병이기 때문이다.SMA의 진단은 증상에 근거해 이루어지며 유전자 [9][1]검사를 통해 확인된다.
보통 SMN1 유전자의 돌연변이는 부모로부터 상염색체 열성적인 방식으로 유전되지만, 약 2%의 경우 초기 발달 중에 발생한다(de [1][10]novo).전 세계적으로 척추근육위축 발생률은 출생아 약 4,000명 중 1명에서 [11]출생아 약 16,000명 중 1명까지 다양하며,[2] 유럽과 미국에서는 각각 7,000명 중 1명, 10,000명 중 1명이 공통적으로 인용된다.
질병의 자연스러운 과정에서의 결과는 가장 급성인 경우 출생 후 몇 주 이내에 사망하는 것에서부터 장기화된 SMA [8]형태의 정상적인 수명에 이르기까지 다양하다.2016년 원인 치료제의 도입으로 결과가 크게 개선되었다.질병의 유전적 원인을 대상으로 하는 약물로는 누시네르센, 리스디플람, 유전자 치료 약물인 오나셈노진 아베파르보벡 등이 있다.지원적 치료에는 물리치료, 작업치료, 호흡기 지원, 영양 지원, 정형외과 중재 및 이동성 [1]지원이 포함됩니다.
분류
5q SMA는 광범위한 중증도에 걸쳐 나타나는 단일 질환으로, 유아에서 성인까지 영향을 미친다.유전학이 이해되기 전에, 그 다양한 징후는 다른 질병으로 생각되었다 – 어린 아이들이 영향을 받았을 때 베르디니그-호프만 병과 늦게 발병했을 때 쿠겔베르크-벨랜더 병.[12]
1990년에, 이러한 분리된 질병들이 동일한 장애의 스펙트럼을 형성한다는 것이 밝혀졌다.척추근육위축은 증상 시작 연령 또는 [10][12]달성된 최대 운동 기능에 따라 3-5가지 임상 유형으로 분류되었다.현재, 척추근육위축의 표현형은 [10]아형의 명확한 묘사 없이 일련의 증상들에 걸쳐 있다는 것이 일치된 의견이다.하지만, 아래 표에 요약된 전통적인 분류는 오늘날에도 여전히 임상 연구 모두에서 그리고 때로는 논쟁적으로 치료에 대한 접근 기준으로 사용되고 있습니다.
| 유형 | 에포니메 | 통상적인 발병 연령 | 자연사(약리치료 미사용) | 옴 |
|---|---|---|---|---|
| SMA 0 | 태내 | 출생 시 증상이 관찰되며 태아기 때 태아 운동이 감소하면서 종종 뚜렷해진다.영향을 받는 어린이들은 보통 SMN2 유전자의 한 부만을 가지고 있고, 24시간 365일 호흡기를 지원하더라도 보통 몇 주밖에 살지 못합니다.이러한 형태는 매우 드물며, 사례의 약 2%를 차지합니다. | ||
| SMA 1 (유아) | 베르드니히호프만병 | 0 ~ 6개월 | 이 형태는 생후 첫 몇 주 또는 몇 개월 내에 발병하는 환자의 약 50%에서 진단됩니다.그 후 SMA는 다양한 근육군이 점진적으로 실패하면서 빠르고 예기치 않은 발병을 일으킨다.유아들은 절대 지지대 없이 앉는 법을 배우지 않고 대부분 점차적으로 그들의 근육 기능을 잃는다.사망은 보통 폐렴(자주 흡인성 폐렴)에 의해 유발되는 호흡근의 기능 상실에 의해 발생한다.호흡 보조 장치 및/또는 약물 치료를 조기에 제공하지 않는 한 SMA 유형 1로 진단된 아기는 일반적으로 2세 이상 생존하지 못한다.적절한 호흡 보조 장치를 통해 SMA 1 사례의 약 10%를 차지하는 가벼운 SMA 1형 표현형은 항상 24시간 관리가 필요하지만, 약리학적 치료를 받지 않아도 청소년기와 성인기까지 생존하는 것으로 알려져 있다. | 253300 |
| SMA 2 (중간) | 두보위츠병 | 6~18개월 | 환자의 약 20%에서 진단된 중간 형태는 인생에서 적어도 일정 시간 동안 앉은 자세를 유지할 수 있었지만 지지 없이 걷는 법을 배운 적이 없는 사람들을 나타낸다.약함의 시작은 보통 생후 6개월에서 18개월 사이에 나타난다.진행상황이 크게 달라 시간이 지날수록 점차 약해지는 사람이 있는 반면 세심한 유지관리를 통해 비교적 안정적인 상태를 유지하는 사람도 있는 것으로 알려져 있다.몸의 근육이 약해지고, 근육 수축과 척추 만곡과 마찬가지로 호흡계가 주요 관심사입니다.SMA2를 가진 대부분의 사람들은 치료를 받지 않아도 성인까지 잘 살지만 기대수명은 감소한다. | 253550 |
| SMA 3 (청소년) | 쿠겔베르크-웨랜더병 | 12개월 이상 | 약 30%의 환자에게서 진단된 이 청소년 형태는 생후 12개월 이후 또는 아이들이 적어도 몇 가지 독립적인 행동을 하는 것을 이미 배운 후에 나타난다.이 병은 서서히 진행되며 SMA3를 가진 대부분의 사람들은 일생 동안 보행 능력을 잃기 때문에 이동 지원이 필요하다.호흡기 질환은 드물고 기대수명은 정상 또는 거의 정상이다. | 253400 |
| SMA 4 (어른의 시작) | 성년기 | 이것은 성인 온셋 형태를 나타내며, 때로는 후기 온셋 SMA 유형 3으로 분류되기도 한다.그것은 환자의 약 5%에서 발생하며 보통 3-4년차에 나타난다.증상은 다리 근육의 점진적인 약화로 이루어져 환자가 보행 보조 기구를 사용해야 하는 경우가 많다.다른 합병증은 드물고 기대수명은 영향을 받지 않는다. | 271150 |
편의상 환자를 실제 기능 상태에 따라 "비시터", "시터" 및 "보행자"로 분류합니다.
SMA에 걸린 사람의 운동 발달과 질병 진행은 일반적으로 검증된 기능 척도(CHOP-INTEVENT(The Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders) 또는 HINE(Hammersmith Infant Neurochical Examinical Examination of Ne of Ne of Ne of Ne of Ne of Neorculares))를 사용하여 평가되며, 또는 여러 측정의 MFMature 또는 MFMature(운동 변종 측정) 중 하나를 사용하여 평가된다.HFMS(Hammersmith Functional Motor Scale)[13][14][15][16]를 사용합니다.
동명 라벨 베르드니그-호프만 병(때로는 단일 n으로 철자가 잘못 표기됨)은 요한 호프만과 귀도 베르드니그의 [12]소아 SMA에 대한 초기 임상 기술이다.쿠겔베르그-웨인더 병이라는 용어는 말기 형태를 최초로 문서화하고 [12]근위축증과 구별한 에릭 클라스 헨드릭 쿠겔베르그(1913–1983)와 리사 벨랜더(1909–2001)의 이름을 딴 것이다.매우 드물게 사용되는 두보위츠병은 중간 SMA 표현형에 [citation needed]대한 여러 연구를 저술한 영국의 신경학자인 빅터 두보위츠의 이름을 따왔다.
징후 및 증상
증상은 SMA의 종류, 병의 단계, 그리고 개별 요인에 따라 다르다.아래의 징후와 증상은 중증 SMA 타입 0/[17][medical citation needed]I에서 가장 많이 나타납니다.
- 아레플렉시아, 특히 사지에
- 전반적인 근육 약화, 근육 긴장 불량, 절룩거림 또는 넘어지는 경향
- 개발 이정표 달성 어려움, 앉기/서기/보행 어려움
- 어린아이의 경우: 앉았을 때 개구리 다리 자세 채택(유괴, 무릎 굽힘)
- 호흡근의 힘 상실: 기침 약함, 울음 약함(유아), 폐 또는 목의 분비물 축적, 호흡곤란
- 중증 SMA 유형의 종 모양 몸통(호흡을 위해 복근만 사용하여 발생)
- 혀의 경련(트위칭)
- 흡입 또는 삼키기 어려움, 공급 부족
원인들
척추근육위축은 SMN1 [18]유전자의 유전자 돌연변이에 의해 발생한다.
인간 염색체 5는 5q13 위치에 거의 동일한 두 개의 유전자, 즉 텔로미어 복제 SMN1과 센트로미 복제 SMN2를 포함하고 있다. 건강한 개인에서 SMN1 유전자는 이름처럼 운동 뉴런의 생존에 중요한 역할을 하는 운동 뉴런 단백질의 생존을 코드화한다.반면 SMN2 유전자는 단일 뉴클레오티드의 변화로 인해 발생한다(840).C→T) – 인트론 6과 엑손 8의 접합부에서 대체 스플라이싱을 거치며, 운동 뉴런 단백질(SMN-fl)의 완전한 기능적 생존을 코드하는 SMN2 전사물의 10-20%와 전사물의 80-90%가 [19]세포에서 빠르게 분해되는 잘린 단백질 화합물(SMNNN7)을 생성한다.
SMA에 의해 영향을 받는 개인에서 SMN1 유전자는 exon[21] 7에서 발생하는 결손 또는 다른 지점 돌연변이[20](종종 SMN1 배열이 SMN2로 기능적으로 변환됨)로 인해 SMN 단백질을 올바르게 코드화할 수 없는 방식으로 돌연변이를 일으킨다.그러나, 거의 모든 사람들은 SMN2 유전자의 기능적 복사본을 하나 이상 가지고 있으며, 대부분은 여전히 SMN 단백질의 통상적인 수준의 10-20%를 코드화하여 일부 뉴런이 생존할 수 있도록 한다.그러나 장기적으로 볼 때 SMN 단백질의 가용성 감소는 척수와 뇌의 앞 뿔에 있는 운동 뉴런 세포의 점진적인 죽음을 초래한다.모두 신경 입력을 위해 운동 뉴런에 의존하는 골격 근육은 이제 신경 감퇴를 줄였고, 따라서 중추 신경계로부터의 입력을 줄였다.운동 뉴런을 통한 임펄스 전달의 감소는 감소된 근육의 수축성 활동을 감소시킨다.그 결과, 경화된 근육은 진행성 위축(노폐물 낭비)[citation needed]을 겪는다.
하지의 근육은 보통 먼저 영향을 받고, 그 다음에는 상지, 척추, 목의 근육, 그리고 더 심한 경우에는 폐근육과 유방근육이 영향을 받는다.근위근육은 항상 [22]원위근육보다 더 일찍 그리고 더 큰 정도로 영향을 받는다.
SMA 증상의 심각도는 남아있는 SMN2 유전자가 SMN1의 기능 상실을 얼마나 잘 보충할 수 있는가에 크게 관련되어 있다.이것은 부분적으로 염색체에 존재하는 SMN2 유전자의 복제 수에 달려 있다.건강한 사람은 보통 두 개의 SMN2 유전자 복사본을 가지고 있지만, SMA를 가진 사람은 1개에서 5개(또는 그 이상) 사이의 유전자를 가질 수 있다. SMN2 복사본의 수가 많을수록 질병의 심각도는 경미해진다.따라서, 대부분의 SMA 타입 I 아기들은 하나 또는 두 개의 SMN2 복사본을 가지고 있다; SMA II와 III를 가진 사람들은 보통 적어도 세 개의 SMN2 복사본을 가지고 있다; 그리고 SMA IV를 가진 사람들은 보통 적어도 네 개의 복사본을 가지고 있다.그러나 증상 심각도와 SMN2 복사 번호 사이의 상관관계는 절대적이지 않으며 질병 표현형에 [23]영향을 미치는 다른 요인이 존재하는 것으로 보인다.
척추근육위축은 상염색체 열성 패턴으로 유전되는데, 이것은 결함이 있는 유전자가 자동 염색체에 위치한다는 것을 의미한다.이 장애를 유전하기 위해서는 각 부모로부터 하나씩, 결함이 있는 유전자의 두 개의 복사본이 필요하다: 부모가 매개체일 수 있고 개인적으로 영향을 받지 않을 수 있다.SMA는 약 2-4%의 [citation needed]사례에서 새로 나타나는 것으로 보인다(즉, 유전적 원인이 없는 경우).
척추근육위축은 겸상적혈구병이나 낭포성 섬유증과 같은 잘 알려진 다른 상염색체 열성 질환과 달리 모든 민족의 개인에게 영향을 미친다.모든 유형 및 모든 민족에 걸친 SMA의 전체 유병률은 10,000명당 1명 범위이며, 유전자 빈도는 약 1:100이므로 약 50명 중 1명이 [24][25]보균자다.보균자가 됨으로써 건강에 미치는 영향은 알려져 있지 않다.사람은 자녀가 SMA의 영향을 받거나 SMN1 유전자의 염기서열을 [citation needed]분석함으로써 보균자 상태를 알 수 있다.
영향을 받은 형제자매는 보통 SMA의 매우 유사한 형태를 가지고 있다. 그러나 형제자매 사이에 다른 SMA 유형의 발생이 존재한다. 드물기는 하지만, 이러한 경우는 NAIP 유전자와 관련되지 않은 SMN 유전자의 추가 de novo 결손 또는 SMN2 복사 [citation needed]번호의 차이 때문일 수 있다.
진단.
SMA는 [17]환자의 95% 이상에서 SMN1 유전자의 동형 결실을 검출하는 유전자 검사와 나머지 환자의 복합 SMN1 돌연변이를 이용하여 진단된다.유전자 검사는 보통 혈액 샘플을 사용하여 수행되며, MLPA는 임상적으로 [17]중요한 SMN2 유전자 복제의 수를 파악할 수 있기 때문에 더 자주 사용되는 유전자 검사 기술 중 하나이다.
증상적으로 SMA는 역설적인 호흡, 양쪽의 낮은 근육 긴장 및 부재 [citation needed]힘줄 반사로 진행성 질환을 나타내는 급성형 어린이에서만 어느 정도 확실성을 가지고 진단할 수 있다.
조기 진단
질병의 무증상 단계에서 SMA의 조기 진단은 다음을 가능하게 한다.
이식 전 검사
이식 전 유전자 진단을 사용하여 시험관 [citation needed]수정 중 SMA에 영향을 받은 배아를 선별할 수 있습니다.
태아 검사
SMA 태아 검사는 융모막 채취, 무세포 태아 DNA 분석 및 기타 방법을 [citation needed]통해 가능합니다.
신생아 검진
질병의 [26][27][28]무증상 단계에서 가장 효과적인 원인 치료의 가용성을 감안할 때, SMA에 대한 정기적인 신생아 검진은 선진국에서 점점 더 보편화되고 있다.2018년에 SMA에 대한 신생아 검진은 미국의 권장 신생아 검진[29][30][31] 목록에 추가되었으며, 2020년 4월 현재 미국 [32][33]39개 주에서 채택되었다.2021년 5월 현재 SMA 신생아 선별은 대만에서[34] 시행되었으며 호주,[35] 벨기에,[36] 캐나다, 프랑스, 독일,[37] 네덜란드,[38] 폴란드, 세르비아 및 슬로베니아에서 시행 중이다.또, 호주,[39] 중국, 이탈리아,[40] 일본에서도 파일럿 프로젝트가 진행되고 있습니다.
캐리어 테스트
SMN1 결실의 보균자가 될 위험이 있고 따라서 SMA에 의해 영향을 받는 자손을 가질 위험이 있는 사람은 혈액 또는 타액 샘플을 사용하여 보균자 분석을 받을 수 있다.미국 산부인과 학회는 임신을 생각하고 있는 모든 사람들에게 [41]보균자인지 여부를 검사해 볼 것을 권고하고 있다.SMA의 반송파 빈도는 시상혈증과 같은 다른 질환과 비슷하며, 북부 인도 코호트에서 [42]38명 중 1명꼴로 나타났다.그러나 약 2%의 환자가 새로운 돌연변이에 의해 발생하며 정상인구의 5%가 동일한 염색체에 SMN1을 두 개 가지고 있어 하나의 염색체가 2개이고 두 번째 염색체가 0개여서 보균자가 될 수 있기 때문에 유전자 검사로는 위험에 처한 모든 사람을 식별할 수 없다.이러한 상황은 기존의 유전자 [43][44]검사로는 보균자 상태가 올바르게 감지되지 않기 때문에 잘못된 음성 결과를 초래할 수 있습니다.
관리
SMA 관리는 중대도와 유형에 따라 달라집니다.가장 심각한 형태(타입 0/1)에서, 개인은 신속한 개입이 필요한 가장 큰 근육 약화를 가지고 있다.가장 덜 심각한 형태(타입 4/어른 발병)인 반면, 개인은 인생에서 나중에(사망)까지 특정한 관리 측면을 추구하지 않을 수 있다.SMA의 종류와 개인은 각 유형에 따라 다를 수 있지만, 따라서 개인의 특정 관리 측면은 [medical citation needed]다를 수 있다.
약
누시네르센은 [45]척추근위축증을 치료하는데 사용된다.SMN2 [45]유전자의 대체 스플라이싱을 수정하는 안티센스 뉴클레오티드입니다.그것은 뇌하수체 [45][46]내 주사를 사용하여 중추신경계에 직접 투여된다.Nusinersen은 SMA에 [47][48]의한 영유아의 생존 연장 및 운동 기능 향상으로 2016년 미국에서, 2017년 [49][50][51]EU에서 사용이 승인되었습니다.
오나셈노진아베파르보벡(Zolgensma로 시판)은 SMN1 트랜스겐을 [52][53]전달하는 벡터로서 자기보완성 아데노 관련 바이러스 타입 9(scAAAV-9)를 사용하는 유전자 치료법이다.이 치료법은 [54][55]생후 24개월 미만의 어린이를 위한 정맥주사 제제로 2019년 5월 미국에서 처음 승인되었다.유럽 연합, 일본 및 기타 국가에서의 승인이 뒤따랐지만, [56][57]승인 범위는 종종 달랐습니다.
리스디플람(Evrysdi)은 액체로 [58][59]경구 복용하는 약이다.스플라이싱 패턴을 [60][61]수정하여 SMN2 유전자가 생성하는 기능성 생존 운동 뉴런 단백질의 양을 증가시켜 작용하는 피리다진 유도체입니다.Risdiplam은 2020년 8월[58] 미국에서 의료용으로 처음 승인되었으며 이후 30개국 이상에서 승인되었습니다.
숨쉬기
SMA 타입 0/1과 2에서는 호흡기가 가장 흔하고 합병증이 주요 사망 원인이다. SMA 타입 3은 유사한 호흡기 질환을 가질 수 있지만 더 [22]드물다.신경의 자극 부족으로 늑간 근육이 약해져 발생하는 합병증입니다.횡격막은 늑간 [22]근육보다 덜 영향을 받는다.일단 약해진 근육은 호흡과 기침, 그리고 다른 기능들을 돕는 것과 같은 기능을 완전히 회복하지 못한다.따라서 호흡이 더 어려워지고 충분한 산소/숨을 쉬지 못하고 기도 분비물이 부족해질 위험이 있습니다.이러한 문제들은 근육이 더 이완될 때 잠자는 동안 더 흔하게 발생한다.인두의 근육을 삼키는 것은 영향을 받을 수 있으며, 나쁜 기침 메커니즘과 함께 흡인력을 유발하여 감염/[62]폐렴의 가능성을 높입니다.분비물 이동 및 제거에는 자세 배수를 통한 수동 또는 기계적인 흉부 물리치료와 수동 또는 기계적인 기침 보조 장치가 포함됩니다.호흡에 도움을 주기 위해 비침습적 인공호흡(BiPAP)이 자주 사용되며 때로는 더 심각한 경우 [63]기관절제술이 수행될 수 있습니다. 기관절제술은 언어발달을 [64]방해하지만 두 방법 모두 비슷한 수준으로 생존을 연장합니다.
영양
SMA의 유형이 심각할수록 영양과 관련된 건강 문제가 발생할 가능성이 높아집니다.건강상의 문제에는 먹이주기, 턱 벌리기, 씹기, 삼키기 등이 포함될 수 있다.이러한 어려움을 겪고 있는 사람들은 영양 과잉 또는 영양 부족, 번영 실패 및 포부의 위험을 증가시킬 수 있습니다.다른 영양상의 문제들, 특히 비전구성(더 심각한 유형의 SMA)인 사람들에게서, 음식물이 위를 충분히 빨리 통과하지 못하고, 위 역류, 변비, 구토 그리고 팽창이 [65][medical citation needed]포함됩니다.따라서 SMA 타입 I과 더 심한 타입 II의 경우 공급관 또는 [65][66][67]위루절제술이 필요할 수 있다.또한 SMA에 기인하는 대사 이상은 근육 내 지방산의 β산화를 저해하고 유기산혈증 및 특히 공복 [68][69]시 근육 손상을 초래할 수 있다.SMA를 가진 사람들, 특히 질병의 더 심각한 형태를 가진 사람들은 [62]흡인을 피하기 위해 지방 섭취를 줄이고 장기간의 단식([70]즉, 건강한 사람들보다 더 자주 먹는 것)을 피하는 것이 권장된다.급성 질환, 특히 어린이에서 영양 문제는 전해질이나 혈당 [71][medical citation needed]장애와 같은 다른 건강 문제를 야기할 뿐만 아니라 먼저 기존의 문제를 야기하거나 악화시킬 수 있습니다.
정형외과
SMA의 약한 근육과 관련된 골격 문제에는 제한된 범위의 움직임, 고관절 탈구, 척추 변형, 골감소증, 골절 및 [22]통증의 위험 증가 등이 포함됩니다.척추와 같은 관절을 정상적으로 안정시키는 약한 근육은 척추후만증 및/또는 척추측만증의 발병과 관절수축을 [22]일으킨다.척추 융접은 SMA I/II가 있는 사람이 8-10세가 되면 폐에 가해지는 기형 척추의 압력을 완화하기 위해 수행되기도 한다.또한,[71] 운동 범위뿐만 아니라 움직이지 않는 사람, 이동 장치에서의 자세와 위치, 그리고 골격 강화가 합병증을 예방하는데 중요할 수 있습니다.SMA를 가진 사람들은 또한 다양한 형태의 물리치료,[citation needed] 작업치료 그리고 물리치료로부터 큰 혜택을 받을 수 있다.
몸을 지탱하고 보행을 보조하기 위해 직립식 장치를 사용할 수 있습니다.예를 들어 발을 안정시키기 위해 AFO(랭클 다리 직교)와 같은 직교제를 사용하고, 보행을 돕기 위해 TLSO(흉부 요추 천골 직교)를 사용하여 몸통을 안정시킨다.보조 기술은 움직임과 일상 활동을 관리하고 [citation needed]삶의 질을 크게 향상시킵니다.
다른.
비록 심장은 일상적인 관심사는 아니지만, SMA와 특정 심장 상태 사이의 연관성이 [72][73][74][75]제안되었다.
SMA를 가진 아이들은 그들의 행동에서 일반 인구와 다르지 않다; 그들의 인지 발달은 약간 더 빠를 수 있고 그들의 지능의 특정 측면은 [76][77][78]평균 이상이다.그들의 장애에도 불구하고, SMA에 영향을 받은 사람들은 [79]삶에 대한 높은 만족도를 보고한다.
SMA의 완화 치료는 전 세계 표준 채택에 권장된 척추근위축증의[22] 관리 표준을 위한 컨센서스 스테이트먼트에 표준화되어 있다.
예후
약리학적 치료가 없으면 SMA에 걸린 사람들은 시간이 지남에 따라 악화되는 경향이 있다.최근, 공격적이고 사전 예방적인 보조 호흡 및 영양 [80]지원을 통해 중증 SMA 환자에서 생존율이 증가하고 있다.
치료하지 않으면 SMA 타입 0과 1로 진단된 어린이의 대부분은 4세에 이르지 못하며, 재발성 호흡기 질환이 주요 [81]사망 원인이다.적절한 관리를 통해 경미한 SMA 타입 I 환자(전체 SMA1 환자 중 약 10%를 차지)가 [82]성인까지 살 수 있다.SMA 타입 I에서의 장기 생존은 충분히 입증되지 않았지만, 2007년 현재 호흡 보조 장치의 발전은 사망률을 [83]낮춘 것으로 보인다.
치료되지 않은 SMA 타입 II에서, 질병의 진행 과정은 더 느리고 기대 수명은 건강한 인구보다 짧습니다.SMA에 걸린 많은 사람들이 부모와 조부모가 될 때까지 살지만, 20세 이전에 사망하는 일은 자주 있다.SMA 타입 III는 관리 기준을 준수할 경우 정상 또는 거의 정상 수명에 가깝다.타입 IV, 성인용 SMA는 일반적으로 이동성 장애만을 의미하며 기대 [citation needed]수명에 영향을 주지 않습니다.
조사 방향
SMA의 근본적인 유전적 원인이 [20]1995년에 확인된 이후, 운동 신경 [84]세포에서 SMN 단백질의 가용성을 증가시키는 데 주로 초점을 맞춘 몇 가지 치료적 접근법이 제안되고 조사되었다.주요 연구 방향은 다음과 같다.
SMN1 유전자 치환
SMA 유전자 치료는 바이러스 벡터를 이용해 세포핵에 특수하게 조작된 뉴클레오티드 배열(SMN1 트랜스젠)을 삽입함으로써 SMN1 유전자 기능을 회복시키는 것을 목표로 한다.이 접근법은 SMA, scAAV-9 기반 치료제의 최초 승인된 유전자 치료법에 의해 이용되었다.[85]
SMN2 대체 스플라이싱 변조
이 접근법은 SMN2 유전자의 대체 스플라이싱을 수정하여 전장 SMN 단백질의 더 높은 비율을 코드화하는 것을 목표로 한다.때때로 그것은 또한 유전자 변환이라고도 불리는데, 이는 기능적으로 SMN2 유전자를 SMN1 유전자로 바꾸려고 시도하기 때문이다.이는 승인된 의약품 누시네르센과 리스디플람의 치료 메커니즘이다.
브라나플람은 임상 [86]개발 단계에 도달한 또 다른 SMN2 스플라이싱 조절제입니다.
역사적으로, 이 연구 방향은 다른 분자들도 조사했다.Quinazoline495로도 알려진 RG3039는 Repligen에 의해 개발되어 2014년 3월에 Pfizer에 라이선스된 독점 키나졸린 유도체로, 그 직후에 단종되어 1단계 시험만 완료했습니다.PTK-SMA1은 파라텍제약이 개발한 테트라사이클린 그룹의 전매 소분자 스플라이싱 모듈레이터로 2013년 임상개발을 앞두고 있으나 파라텍의 다운사이징으로 인해 발생하지 않았다.호프만-라 로슈가 개발한 RG7800은 리스디플람과 유사한 분자로 1상 시험을 거쳤으나 동물 [87]독성 때문에 중단됐다.초기 납에는 오르토바나산나트륨과[88] 아크라루비신도 [89]포함되어 있었다.
누시네르센과 같은 세포 표적을 가진 모르포리노형 안티센스 올리고뉴클레오티드는 런던 대학과[90] [91]옥스퍼드 대학을 포함한 SMA 및 기타 단일 유전자 질환 치료에 대한 연구 대상으로 남아 있다.
SMN2유전자활성화
이 접근법은 SMN2 유전자의 발현(활성)을 증가시켜 사용 가능한 전장 SMN 단백질의 양을 증가시키는 것을 목표로 한다.
- 인기 천식 치료제인 경구용 살부타몰(알부테롤)은 호흡기 혜택을 제공하는 것 외에 SMA 타입[92] 2와 [93][94][95]3을 가진 환자가 참여한 세 번의 소규모 임상시험에서 SMA에서 치료 가능성을 보였다.
일부 화합물은 당초 유망했지만 임상시험에서 효능을 보여주지 못했다.부틸레이트(부틸레이트나트륨 및 페닐부틸레이트나트륨)는 체외[96][97][98] 연구에서 어느 정도 가능성이 있었지만 증상이 있는 사람들을 대상으로 한 임상시험에서는 그 [99]효능이 확인되지 않았다.증상 전 유형 1-2 유아에 대한 또 다른 임상시험은 2015년에 완료되었지만 결과는 [100]발표되지 않았다.
- 발프로산(VPA)은 1990년대와 2000년대에 SMA에 실험적으로 사용되었는데, 이는 시험관내 연구에서 발프로산([101][102]VPA)의 효과가 중간 수준임을 시사했기 때문이다.그러나 대규모 임상시험 [103][104][105]대상에서는 달성 가능한 농도에서 효과가 나타나지 않았다.또한 SMA를 가진 일부 사람들에게 효과적일 수 있지만,[106] 그 작용은 다른 사람들의 지방산 전이 효소에 의해 억제될 수 있다는 것이 제안되었다.다른 사람들은 이것이 실제로 SMA [107]증상을 악화시킬 수 있다고 주장한다.장기 사용과 관련된 심각한 부작용의 위험 때문에 현재는 사용되지 않는다.2019년 메타 분석에 따르면 VPA는 기능 [108]점수를 개선하지 않고도 이점을 제공할 수 있다.
- 히드록시카르바미드(hydroxycarbamide, 히드록시우레아)는 마우스 모델에서[109] 효과가 나타났고 덴마크 노보 노르디스크에 의해 상업적으로 연구되었지만 후속 임상 시험에서 [110]SMA에 걸린 사람들에게는 효과가 없었다.
는 시험관에서 배양되지만 임상 무대에 도착하지 않았 SMN2 활동 증가했다 화합물 성장 호르몬 다양한 히스톤 deacetylase inhibitors,[111]벤즈 아마이드 M344,[112]hydroxamic은(CBHA, SBHA,entinostat, panobinostat,[113]trichostatin A,[114][115]vorinostat[116]), prolactin[117]뿐만 아니라 resv 같은 자연의 폴리페놀 화합물을 포함한다.eratrol고 지연시키다.[118][119]P38 경로 활성화제인 셀렉시브(Celecoxib)는 단일[120] 동물 연구를 기반으로 SMA를 가진 사람에 의해 오프 라벨로 사용되기도 하지만 임상 단계 연구에 의해 그러한 사용이 뒷받침되지는 않는다.
SMN 안정화
SMN 안정화는 SMN2 유전자에 의해 코드화된 단수명 결함 단백질인 SMNΩ7 단백질을 안정시켜 신경 [121]세포를 유지할 수 있도록 하는 것을 목표로 한다.
어떤 화합물도 임상 단계로 진행되지 않았다.아미노글리코시드는 두 [122][123]가지 연구에서 SMN 단백질 가용성을 증가시키는 능력을 보였다.인도프로펜은 [124]체외에서 약간의 약속을 했다.
신경 보호
신경보호제는 SMN 단백질 수치가 낮더라도 운동신경세포의 생존을 가능하게 하는 것을 목적으로 한다.
- 올레옥심(Oleoxime)은 프랑스 트로포스가 개발한 전매 신경보호 화합물로, 이후 호프만 라 로슈가 인수하여 SMA 타입 2와 3을 가진 사람들을 대상으로 한 2상 임상시험에서 안정화 효과를 보였다.Nusinersen과의 경쟁과 오픈 라벨 확장 [125]시험으로부터의 데이터 부족 때문에 2018년에 개발이 중단되었습니다.
효능을 나타내지 않은 임상 연구 화합물의 경우, 티로트로핀 방출 호르몬(TRH)은 개방 라벨 비통제[126][127][128] 임상시험에서 [129]어느 정도 가능성을 보였지만 이후 이중맹검 플라시보 대조시험에서는 효과가 입증되지 않았다.근위축성 측삭경화증에서 임상적 이점을 제한적으로 제공하는 약물인 리루졸은 [130][131]SMA에서도 유사하게 시험할 것을 제안했다. 그러나 만족스러운 결과가 [133]나오지 않아 SMA 유형 2와 3의[132] 2008-2010 시험은 조기에 중단되었다.시험관내 연구에서 약간의 신경보호 효과를 보였지만 생체내 연구로 넘어가지 않은 다른 화합물로는 β-락탐 항생제(예: 세프트리아손)[134][135]와 모피스타틴이 [136]있다.
근육 회복
이 접근법은 신경세포 대신 근육조직을 표적으로 하여 SMA의 효과에 대항하는 것을 목표로 한다.
- 렐데셈티브(CK-2127107, CK-107)는 Cytokinetics가 Astellas와 협력하여 개발한 골격 트로포닌 활성제이다.이 약은 신경 신호가 감소했음에도 불구하고 근육 반응성을 증가시키는 것을 목표로 한다.이 분자는 SMA 타입 2, 3, [137]4의 청소년과 성인의 2상 임상 시험에서 어느 정도 성공을 보였다.
- 아피테그로맵(SRK-015)은 골격근 단백질 미오스타틴의 활성화를 차단하여 근육조직의 성장을 촉진하는 모노클로널 항체이다.2021년 현재, 이 분자는 누시네르센으로 [138]치료된 소아과 및 성인 환자에서 실험적인 부가 치료제로 성공을 보였다.
- Hoffman-La Roche가 개발한 GYM329(RO7204239)는 미오스타틴 활성화를 차단하여 아피테그로맵과 유사하게 작동합니다.2022년 현재, 리스디플람과 [139]결합된 SMA가 2-10세의 비 앰뷸런트 아동을 대상으로 임상 개발을 진행 중이다.
줄기세포
줄기세포가 SMA에 대해 인정된 치료법의 일부를 형성하지 않는 반면, 규제감독이 느슨한 나라에 위치한 많은 민간 기업들은 SMA를 포함한 광범위한 장애의 "치료제"로서 미디어 광고와 시장 줄기세포 주입을 이용하고 있다.의료적 합의는 그러한 절차가 상당한 위험을 수반하는 동안 임상적 유익성을 제공하지 않기 때문에 SMA를 가진 사람들은 그러한 [140][141]절차를 수행하지 말 것을 권고한다.2013-2014년, 스태미너 사기 사건 이후 소수의 이탈리아 SMA1 어린이들이 법원의 허가를 받은 줄기세포 주사를 맞았으나 치료 효과가 없는 것으로[142][143] 보고되었다.
레지스트리
유럽연합(EU)의 SMA 보유자는 TREAT-NMD가 [144]관리하는 레지스트리에 자신의 세부사항을 입력하면 임상연구에 참여할 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d e f g "Spinal muscular atrophy". Genetic and Rare Diseases Information Center (GARD) – an NCATS Program. Retrieved 27 May 2019.
- ^ a b c d e f g h i "Spinal Muscular Atrophy". NORD (National Organization for Rare Disorders). Retrieved 27 May 2019.
- ^ "Spinal muscular atrophy". nhs.uk. 23 October 2017. Retrieved 24 October 2020.
- ^ a b "Spinal muscular atrophy: MedlinePlus Genetics". medlineplus.gov. Retrieved 24 October 2020.
- ^ "Spinal Muscular Atrophy (SMA) Boston Children's Hospital". www.childrenshospital.org. Retrieved 25 October 2020.
- ^ "FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality". FDA. 24 May 2019. Retrieved 27 May 2019.
- ^ "Spinal Muscular Atrophy Fact Sheet National Institute of Neurological Disorders and Stroke". NINDS. Retrieved 27 May 2019.
- ^ a b c d e "Spinal muscular atrophy". Genetics Home Reference. Retrieved 27 May 2019.
- ^ "Spinal Muscular Atrophy – Conditions Children's National". childrensnational.org. Retrieved 25 October 2020.
- ^ a b c Prior, Thomas W.; Leach, Meganne E.; Finanger, Erika (1993), Adam, Margaret P.; Ardinger, Holly H.; Pagon, Roberta A.; Wallace, Stephanie E. (eds.), "Spinal Muscular Atrophy", GeneReviews®, Seattle (WA): University of Washington, Seattle, PMID 20301526, retrieved 25 October 2020
- ^ Verhaart, Ingrid E. C.; Robertson, Agata; Leary, Rebecca; McMacken, Grace; König, Kirsten; Kirschner, Janbernd; Jones, Cynthia C.; Cook, Suzanne F.; Lochmüller, Hanns (July 2017). "A multi-source approach to determine SMA incidence and research ready population". Journal of Neurology. 264 (7): 1465–1473. doi:10.1007/s00415-017-8549-1. ISSN 0340-5354. PMC 5502065. PMID 28634652.
- ^ a b c d Dubowitz, Victor (2009). "Ramblings in the history of spinal muscular atrophy". Neuromuscular Disorders. 19 (1): 69–73. doi:10.1016/j.nmd.2008.10.004. PMID 18951794. S2CID 37576912.
- ^ Main M, Kairon H, Mercuri E, Muntoni F (2003). "The Hammersmith functional motor scale for children with spinal muscular atrophy: a scale to test ability and monitor progress in children with limited ambulation". European Journal of Paediatric Neurology. 7 (4): 155–9. doi:10.1016/S1090-3798(03)00060-6. PMID 12865054.
- ^ Krosschell KJ, Maczulski JA, Crawford TO, Scott C, Swoboda KJ (July 2006). "A modified Hammersmith functional motor scale for use in multi-center research on spinal muscular atrophy". Neuromuscular Disorders. 16 (7): 417–26. doi:10.1016/j.nmd.2006.03.015. PMC 3260054. PMID 16750368.
- ^ O'Hagen JM, Glanzman AM, McDermott MP, Ryan PA, Flickinger J, Quigley J, Riley S, Sanborn E, Irvine C, Martens WB, Annis C, Tawil R, Oskoui M, Darras BT, Finkel RS, De Vivo DC (October 2007). "An expanded version of the Hammersmith Functional Motor Scale for SMA II and III patients". Neuromuscular Disorders. 17 (9–10): 693–7. doi:10.1016/j.nmd.2007.05.009. PMID 17658255. S2CID 10365924.
- ^ Glanzman AM, O'Hagen JM, McDermott MP, Martens WB, Flickinger J, Riley S, Quigley J, Montes J, Dunaway S, Deng L, Chung WK, Tawil R, Darras BT, De Vivo DC, Kaufmann P, Finkel RS, et al. (Pediatric Neuromuscular Clinical Research Network for Spinal Muscular Atrophy (PNCR)) (December 2011). "Validation of the Expanded Hammersmith Functional Motor Scale in spinal muscular atrophy type II and III". Journal of Child Neurology. 26 (12): 1499–507. doi:10.1177/0883073811420294. PMID 21940700. S2CID 206549483.
- ^ a b c Oskoui M, Darras BT, DeVivo DC (2017). "Chapter 1". In Sumner CJ, Paushkin S, Ko CP (eds.). Spinal Muscular Atrophy: Disease Mechanisms. Elsevier. ISBN 978-0-12-803685-3.
- ^ Brzustowicz LM, Lehner T, Castilla LH, Penchaszadeh GK, Wilhelmsen KC, Daniels R, Davies KE, Leppert M, Ziter F, Wood D (April 1990). "Genetic mapping of chronic childhood-onset spinal muscular atrophy to chromosome 5q11.2–13.3". Nature. 344 (6266): 540–1. Bibcode:1990Natur.344..540B. doi:10.1038/344540a0. PMID 2320125. S2CID 4259327.
- ^ "Spinal muscular atrophy". Genetics Home Reference. Retrieved 15 May 2019.
- ^ a b Lefebvre S, Bürglen L, Reboullet S, Clermont O, Burlet P, Viollet L, Benichou B, Cruaud C, Millasseau P, Zeviani M (January 1995). "Identification and characterization of a spinal muscular atrophy-determining gene". Cell. 80 (1): 155–65. doi:10.1016/0092-8674(95)90460-3. PMID 7813012. S2CID 14291056.
- ^ Passini MA, Bu J, Richards AM, Kinnecom C, Sardi SP, Stanek LM, Hua Y, Rigo F, Matson J, Hung G, Kaye EM, Shihabuddin LS, Krainer AR, Bennett CF, Cheng SH (March 2011). "Antisense oligonucleotides delivered to the mouse CNS ameliorate symptoms of severe spinal muscular atrophy". Science Translational Medicine. 3 (72): 72ra18. doi:10.1126/scitranslmed.3001777. PMC 3140425. PMID 21368223.
- ^ a b c d e f Wang CH, Finkel RS, Bertini ES, Schroth M, Simonds A, Wong B, Aloysius A, Morrison L, Main M, Crawford TO, Trela A (August 2007). "Consensus statement for standard of care in spinal muscular atrophy". Journal of Child Neurology. 22 (8): 1027–49. doi:10.1177/0883073807305788. PMID 17761659. S2CID 6478040.
- ^ Jedrzejowska M, Milewski M, Zimowski J, Borkowska J, Kostera-Pruszczyk A, Sielska D, Jurek M, Hausmanowa-Petrusewicz I (2009). "Phenotype modifiers of spinal muscular atrophy: the number of SMN2 gene copies, deletion in the NAIP gene and probably gender influence the course of the disease". Acta Biochimica Polonica. 56 (1): 103–8. doi:10.18388/abp.2009_2521. PMID 19287802.
- ^ Su YN, Hung CC, Lin SY, Chen FY, Chern JP, Tsai C, Chang TS, Yang CC, Li H, Ho HN, Lee CN (February 2011). Schrijver I (ed.). "Carrier screening for spinal muscular atrophy (SMA) in 107,611 pregnant women during the period 2005–2009: a prospective population-based cohort study". PLOS ONE. 6 (2): e17067. Bibcode:2011PLoSO...617067S. doi:10.1371/journal.pone.0017067. PMC 3045421. PMID 21364876.
- ^ Sugarman EA, Nagan N, Zhu H, Akmaev VR, Zhou Z, Rohlfs EM, Flynn K, Hendrickson BC, Scholl T, Sirko-Osadsa DA, Allitto BA (January 2012). "Pan-ethnic carrier screening and prenatal diagnosis for spinal muscular atrophy: clinical laboratory analysis of >72,400 specimens". European Journal of Human Genetics. 20 (1): 27–32. doi:10.1038/ejhg.2011.134. PMC 3234503. PMID 21811307.
- ^ Serra-Juhe C, Tizzano EF (December 2019). "Perspectives in genetic counseling for spinal muscular atrophy in the new therapeutic era: early pre-symptomatic intervention and test in minors". European Journal of Human Genetics. 27 (12): 1774–1782. doi:10.1038/s41431-019-0415-4. PMC 6871529. PMID 31053787.
- ^ Glascock J, Sampson J, Haidet-Phillips A, Connolly A, Darras B, Day J, et al. (29 May 2018). "Treatment Algorithm for Infants Diagnosed with Spinal Muscular Atrophy through Newborn Screening". Journal of Neuromuscular Diseases. 5 (2): 145–158. doi:10.3233/JND-180304. PMC 6004919. PMID 29614695.
- ^ Dangouloff T, Burghes A, Tizzano EF, Servais L (January 2020). "244th ENMC international workshop: Newborn screening in spinal muscular atrophy May 10-12, 2019, Hoofdorp, The Netherlands". Neuromuscular Disorders. 30 (1): 93–103. doi:10.1016/j.nmd.2019.11.002. PMID 31882184.
- ^ Lopes JM (16 July 2018). "SMA Added to List of Recommended Screenings for Disease Given to..." SMA News Today. Retrieved 4 May 2020.
- ^ Stephenson K (5 July 2018). "SMA Added to National List of Disorders to Screen for at Birth". Muscular Dystrophy Association. Retrieved 4 May 2020.
- ^ "Recommended Uniform Screening Panel". Official web site of the U.S. Health Resources & Services Administration. 3 July 2017. Retrieved 4 May 2020.
- ^ McCall S. "Newborn Screening for Spinal Muscular Atrophy". Cure SMA. Retrieved 4 May 2020.
- ^ Kraszewski JN, Kay DM, Stevens CF, Koval C, Haser B, Ortiz V, et al. (June 2018). "Pilot study of population-based newborn screening for spinal muscular atrophy in New York state". Genetics in Medicine. 20 (6): 608–613. doi:10.1038/gim.2017.152. PMID 29758563.
- ^ Chien YH, Chiang SC, Weng WC, Lee NC, Lin CJ, Hsieh WS, et al. (November 2017). "Presymptomatic Diagnosis of Spinal Muscular Atrophy Through Newborn Screening". The Journal of Pediatrics. 190: 124–129.e1. doi:10.1016/j.jpeds.2017.06.042. PMID 28711173. S2CID 20621772.
- ^ Kariyawasam DS, Russell JS, Wiley V, Alexander IE, Farrar MA (March 2020). "The implementation of newborn screening for spinal muscular atrophy: the Australian experience". Genetics in Medicine. 22 (3): 557–565. doi:10.1038/s41436-019-0673-0. PMID 31607747. S2CID 204459317.
- ^ Boemer F, Caberg JH, Dideberg V, Dardenne D, Bours V, Hiligsmann M, et al. (May 2019). "Newborn screening for SMA in Southern Belgium". Neuromuscular Disorders. 29 (5): 343–349. doi:10.1016/j.nmd.2019.02.003. PMID 31030938. S2CID 72332212.
- ^ Vill K, Kölbel H, Schwartz O, Blaschek A, Olgemöller B, Harms E, et al. (31 October 2019). "One Year of Newborn Screening for SMA – Results of a German Pilot Project". Journal of Neuromuscular Diseases. 6 (4): 503–515. doi:10.3233/JND-190428. PMC 6918901. PMID 31594245.
- ^ Ministerie van Volksgezondheid, Welzijn en Sport (23 July 2019). "Neonatal screening for spinal muscular atrophy – Advisory report – The Health Council of the Netherlands". www.healthcouncil.nl. Retrieved 4 May 2020.
- ^ Lin Y, Lin CH, Yin X, Zhu L, Yang J, Shen Y, et al. (2019). "Newborn Screening for Spinal Muscular Atrophy in China Using DNA Mass Spectrometry". Frontiers in Genetics. 10: 1255. doi:10.3389/fgene.2019.01255. PMC 6928056. PMID 31921298.
- ^ Shinohara M, Niba ET, Wijaya YO, Takayama I, Mitsuishi C, Kumasaka S, Kondo Y, Takatera A, Hokuto I, Morioka I, Ogiwara K (December 2019). "A Novel System for Spinal Muscular Atrophy Screening in Newborns: Japanese Pilot Study". International Journal of Neonatal Screening. 5 (4): 41. doi:10.3390/ijns5040041. PMC 7510215. PMID 33072999.
- ^ "Carrier Screening in the Age of Genomic Medicine – ACOG". www.acog.org. Retrieved 24 February 2017.
- ^ Nilay, M, Moirangthem, A, Saxena, D, Mandal, K, Phadke, SR (October 2020). "Carrier frequency of SMN1 related spinal muscular atrophy in north Indian population: The need for population based screening program". American Journal of Medical Genetics Part A. 185 (1): 274–277. doi:10.1002/ajmg.a.61918. PMID 33051992. S2CID 222353383.
- ^ Prior TW (November 2008). "Carrier screening for spinal muscular atrophy". Genetics in Medicine. 10 (11): 840–2. doi:10.1097/GIM.0b013e318188d069. PMC 3110347. PMID 18941424.
- ^ Ar Rochmah M, Awano H, Awaya T, Harahap NI, Morisada N, Bouike Y, Saito T, Kubo Y, Saito K, Lai PS, Morioka I, Iijima K, Nishio H, Shinohara M (November 2017). "Spinal muscular atrophy carriers with two SMN1 copies". Brain & Development. 39 (10): 851–860. doi:10.1016/j.braindev.2017.06.002. PMID 28676237. S2CID 26504674.
- ^ a b c "Spinraza- nusinersen injection, solution". DailyMed. 30 June 2020. Retrieved 8 August 2020.
- ^ Grant C (27 December 2016). "Surprise Drug Approval Is Holiday Gift for Biogen". The Wall Street Journal. ISSN 0099-9660. Retrieved 27 December 2016.
- ^ Finkel RS, Mercuri E, Darras BT, Connolly AM, Kuntz NL, Kirschner J, et al. (November 2017). "Nusinersen versus Sham Control in Infantile-Onset Spinal Muscular Atrophy". New England Journal of Medicine. 377 (18): 1723–32. doi:10.1056/NEJMoa1702752. PMID 29091570. S2CID 4771819.
- ^ Wadman, Renske I.; van der Pol, W. Ludo; Bosboom, Wendy Mj; Asselman, Fay-Lynn; van den Berg, Leonard H.; Iannaccone, Susan T.; Vrancken, Alexander Fje (1 June 2020). "Drug treatment for spinal muscular atrophy types II and III". The Cochrane Database of Systematic Reviews. 1: CD006282. doi:10.1002/14651858.CD006282.pub5. ISSN 1469-493X. PMC 6995983. PMID 32006461.
- ^ "Spinraza (nusinersen) Injection". U.S. Food and Drug Administration (FDA). 18 January 2017. Retrieved 8 August 2020.
- ^ "Spinraza EPAR". European Medicines Agency (EMA). Retrieved 8 August 2020.
- ^ "Spinraza (Nusinersen) Approved in the European Union as First Treatment for Spinal Muscular Atrophy". Agence France-Presse (AFP). 1 June 2017. Retrieved 1 June 2017.
- ^ "Zolgensma 2 x 1013 vector genomes/mL solution for infusion". www.medicines.org.uk. Retrieved 8 August 2020.
- ^ "Zolgensma- onasemnogene abeparvovec-xioi kit". DailyMed. 24 May 2019. Retrieved 8 August 2020.
- ^ "FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality". U.S. Food and Drug Administration (FDA) (Press release). 24 May 2019. Retrieved 27 May 2019.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ "Zolgensma". U.S. Food and Drug Administration (FDA). 24 May 2019. Retrieved 8 August 2020.
- ^ "Zolgensma EPAR". European Medicines Agency (EMA). 24 March 2020. Retrieved 8 August 2020.
- ^ "Novartis receives approval from Japanese Ministry of Health, Labour and Welfare for Zolgensma the only gene therapy for patients with spinal muscular atrophy (SMA)". Novartis (Press release). Retrieved 8 August 2020.
- ^ a b "FDA Approves Oral Treatment for Spinal Muscular Atrophy". U.S. Food and Drug Administration (FDA) (Press release). 7 August 2020. Retrieved 7 August 2020.
- ^ "Evrysdi (risdiplam) for oral solution" (PDF). Genentech. Retrieved 8 August 2020.
- ^ Maria Joao Almeida (8 September 2016). "RG7916". BioNews Services. Retrieved 8 October 2017.
- ^ Zhao X, Feng Z, Ling KK, Mollin A, Sheedy J, Yeh S, et al. (May 2016). "Pharmacokinetics, pharmacodynamics, and efficacy of a small-molecule SMN2 splicing modifier in mouse models of spinal muscular atrophy". Human Molecular Genetics. 25 (10): 1885–1899. doi:10.1093/hmg/ddw062. PMC 5062580. PMID 26931466.
- ^ a b Bodamer O (November 2017). "Spinal Muscular Atrophy". uptodate.com. Retrieved 1 December 2017.
- ^ Bach JR, Niranjan V, Weaver B (April 2000). "Spinal muscular atrophy type 1: A noninvasive respiratory management approach". Chest. 117 (4): 1100–5. doi:10.1378/chest.117.4.1100. PMID 10767247.
- ^ Bach JR, Saltstein K, Sinquee D, Weaver B, Komaroff E (May 2007). "Long-term survival in Werdnig-Hoffmann disease". American Journal of Physical Medicine & Rehabilitation. 86 (5): 339–45 quiz 346–8, 379. doi:10.1097/PHM.0b013e31804a8505. PMID 17449977. S2CID 9942245.
- ^ a b Messina S, Pane M, De Rose P, Vasta I, Sorleti D, Aloysius A, Sciarra F, Mangiola F, Kinali M, Bertini E, Mercuri E (May 2008). "Feeding problems and malnutrition in spinal muscular atrophy type II". Neuromuscular Disorders. 18 (5): 389–93. doi:10.1016/j.nmd.2008.02.008. PMID 18420410. S2CID 23302291.
- ^ Chen YS, Shih HH, Chen TH, Kuo CH, Jong YJ (March 2012). "Prevalence and risk factors for feeding and swallowing difficulties in spinal muscular atrophy types II and III". The Journal of Pediatrics. 160 (3): 447–451.e1. doi:10.1016/j.jpeds.2011.08.016. PMID 21924737.
- ^ Tilton AH, Miller MD, Khoshoo V (June 1998). "Nutrition and swallowing in pediatric neuromuscular patients". Seminars in Pediatric Neurology. 5 (2): 106–15. doi:10.1016/S1071-9091(98)80026-0. PMID 9661244.
- ^ Tein I, Sloane AE, Donner EJ, Lehotay DC, Millington DS, Kelley RI (January 1995). "Fatty acid oxidation abnormalities in childhood-onset spinal muscular atrophy: primary or secondary defect(s)?". Pediatric Neurology. 12 (1): 21–30. doi:10.1016/0887-8994(94)00100-G. PMID 7748356.
- ^ Crawford TO, Sladky JT, Hurko O, Besner-Johnston A, Kelley RI (March 1999). "Abnormal fatty acid metabolism in childhood spinal muscular atrophy". Annals of Neurology. 45 (3): 337–43. doi:10.1002/1531-8249(199903)45:3<337::AID-ANA9>3.0.CO;2-U. PMID 10072048.
- ^ Leighton S (2003). "Nutrition issues associated with spinal muscular atrophy". Nutrition & Dietetics. 60 (2): 92–96.
- ^ a b Apkon S (Summer 2017). "SMA CARE SERIES – Musculoskeletal System" (PDF). www.curesma.org.
- ^ Rudnik-Schöneborn S, Heller R, Berg C, Betzler C, Grimm T, Eggermann T, Eggermann K, Wirth R, Wirth B, Zerres K (October 2008). "Congenital heart disease is a feature of severe infantile spinal muscular atrophy". Journal of Medical Genetics. 45 (10): 635–8. doi:10.1136/jmg.2008.057950. PMID 18662980. S2CID 7170069.
- ^ Heier CR, Satta R, Lutz C, DiDonato CJ (October 2010). "Arrhythmia and cardiac defects are a feature of spinal muscular atrophy model mice". Human Molecular Genetics. 19 (20): 3906–18. doi:10.1093/hmg/ddq330. PMC 2947406. PMID 20693262.
- ^ Shababi M, Habibi J, Yang HT, Vale SM, Sewell WA, Lorson CL (October 2010). "Cardiac defects contribute to the pathology of spinal muscular atrophy models". Human Molecular Genetics. 19 (20): 4059–71. doi:10.1093/hmg/ddq329. PMID 20696672.
- ^ Bevan AK, Hutchinson KR, Foust KD, Braun L, McGovern VL, Schmelzer L, Ward JG, Petruska JC, Lucchesi PA, Burghes AH, Kaspar BK (October 2010). "Early heart failure in the SMNDelta7 model of spinal muscular atrophy and correction by postnatal scAAV9-SMN delivery". Human Molecular Genetics. 19 (20): 3895–905. doi:10.1093/hmg/ddq300. PMC 2947399. PMID 20639395.
- ^ von Gontard A, Zerres K, Backes M, Laufersweiler-Plass C, Wendland C, Melchers P, Lehmkuhl G, Rudnik-Schöneborn S (February 2002). "Intelligence and cognitive function in children and adolescents with spinal muscular atrophy". Neuromuscular Disorders. 12 (2): 130–6. doi:10.1016/S0960-8966(01)00274-7. PMID 11738354. S2CID 46694209.
- ^ Billard C, Gillet P, Signoret JL, Uicaut E, Bertrand P, Fardeau M, Barthez-Carpentier MA, Santini JJ (1992). "Cognitive functions in Duchenne muscular dystrophy: a reappraisal and comparison with spinal muscular atrophy". Neuromuscular Disorders. 2 (5–6): 371–8. doi:10.1016/S0960-8966(06)80008-8. PMID 1300185. S2CID 22211725.
- ^ Laufersweiler-Plass C, Rudnik-Schöneborn S, Zerres K, Backes M, Lehmkuhl G, von Gontard A (January 2003). "Behavioural problems in children and adolescents with spinal muscular atrophy and their siblings". Developmental Medicine and Child Neurology. 45 (1): 44–9. doi:10.1017/S0012162203000082. PMID 12549754.
- ^ de Oliveira CM, Araújo AP (January 2011). "Self-reported quality of life has no correlation with functional status in children and adolescents with spinal muscular atrophy". European Journal of Paediatric Neurology. 15 (1): 36–9. doi:10.1016/j.ejpn.2010.07.003. PMID 20800519.
- ^ Darras B, Finkel R (2017). Spinal Muscular Atrophy. United Kingdom, United States: Elsevier. p. 417. ISBN 978-0-12-803685-3.
- ^ Yuan N, Wang CH, Trela A, Albanese CT (June 2007). "Laparoscopic Nissen fundoplication during gastrostomy tube placement and noninvasive ventilation may improve survival in type I and severe type II spinal muscular atrophy". Journal of Child Neurology. 22 (6): 727–31. doi:10.1177/0883073807304009. PMID 17641258. S2CID 38799022.
- ^ Bach JR (May 2007). "Medical considerations of long-term survival of Werdnig-Hoffmann disease". American Journal of Physical Medicine & Rehabilitation. 86 (5): 349–55. doi:10.1097/PHM.0b013e31804b1d66. PMID 17449979. S2CID 39989993.
- ^ Oskoui M, Levy G, Garland CJ, Gray JM, O'Hagen J, De Vivo DC, Kaufmann P (November 2007). "The changing natural history of spinal muscular atrophy type 1". Neurology. 69 (20): 1931–6. doi:10.1212/01.wnl.0000290830.40544.b9. PMID 17998484. S2CID 7528894.
- ^ d'Ydewalle C, Sumner CJ (April 2015). "Spinal Muscular Atrophy Therapeutics: Where do we Stand?". Neurotherapeutics. 12 (2): 303–16. doi:10.1007/s13311-015-0337-y. PMC 4404440. PMID 25631888.
- ^ "$2.1m Novartis gene therapy to become world's most expensive drug". The Guardian. Reuters. 25 May 2019. ISSN 0261-3077.
- ^ "Novartis Releases Update on LMI070 (Branaplam) Clinical Trial". CureSMA. Retrieved 7 October 2017.
- ^ Kletzl, Heidemarie; Marquet, Anne; Günther, Andreas; Tang, Wakana; Heuberger, Jules; Groeneveld, Geert Jan; Birkhoff, Willem; Mercuri, Eugenio; Lochmüller, Hanns; Wood, Claire; Fischer, Dirk; Gerlach, Irene; Heinig, Katja; Bugawan, Teodorica; Dziadek, Sebastian; Kinch, Russell; Czech, Christian; Khwaja, Omar (2019). "The oral splicing modifier RG7800 increases full length survival of motor neuron 2 mRNA and survival of motor neuron protein: Results from trials in healthy adults and patients with spinal muscular atrophy". Neuromuscular Disorders. Elsevier BV. 29 (1): 21–29. doi:10.1016/j.nmd.2018.10.001. ISSN 0960-8966. PMID 30553700. S2CID 54315649.
- ^ Zhang ML, Lorson CL, Androphy EJ, Zhou J (October 2001). "An in vivo reporter system for measuring increased inclusion of exon 7 in SMN2 mRNA: potential therapy of SMA". Gene Therapy. 8 (20): 1532–8. doi:10.1038/sj.gt.3301550. PMID 11704813.
- ^ Andreassi C, Jarecki J, Zhou J, Coovert DD, Monani UR, Chen X, Whitney M, Pollok B, Zhang M, Androphy E, Burghes AH (November 2001). "Aclarubicin treatment restores SMN levels to cells derived from type I spinal muscular atrophy patients". Human Molecular Genetics. 10 (24): 2841–9. doi:10.1093/hmg/10.24.2841. PMID 11734549.
- ^ Zhou H, Meng J, Marrosu E, Janghra N, Morgan J, Muntoni F (November 2015). "Repeated low doses of morpholino antisense oligomer: an intermediate mouse model of spinal muscular atrophy to explore the window of therapeutic response". Human Molecular Genetics. 24 (22): 6265–77. doi:10.1093/hmg/ddv329. PMC 4614699. PMID 26264577.
- ^ Hammond SM, Hazell G, Shabanpoor F, Saleh AF, Bowerman M, Sleigh JN, Meijboom KE, Zhou H, Muntoni F, Talbot K, Gait MJ, Wood MJ (September 2016). "Systemic peptide-mediated oligonucleotide therapy improves long-term survival in spinal muscular atrophy". Proceedings of the National Academy of Sciences of the United States of America. 113 (39): 10962–7. doi:10.1073/pnas.1605731113. PMC 5047168. PMID 27621445.
- ^ Angelozzi C, Borgo F, Tiziano FD, Martella A, Neri G, Brahe C (January 2008). "Salbutamol increases SMN mRNA and protein levels in spinal muscular atrophy cells". Journal of Medical Genetics. 45 (1): 29–31. doi:10.1136/jmg.2007.051177. PMID 17932121. S2CID 29911453.
- ^ Pane M, Staccioli S, Messina S, D'Amico A, Pelliccioni M, Mazzone ES, Cuttini M, Alfieri P, Battini R, Main M, Muntoni F, Bertini E, Villanova M, Mercuri E (July 2008). "Daily salbutamol in young patients with SMA type II". Neuromuscular Disorders. 18 (7): 536–40. doi:10.1016/j.nmd.2008.05.004. PMID 18579379. S2CID 34334434.
- ^ Tiziano FD, Lomastro R, Pinto AM, Messina S, D'Amico A, Fiori S, Angelozzi C, Pane M, Mercuri E, Bertini E, Neri G, Brahe C (December 2010). "Salbutamol increases survival motor neuron (SMN) transcript levels in leucocytes of spinal muscular atrophy (SMA) patients: relevance for clinical trial design" (PDF). Journal of Medical Genetics. 47 (12): 856–8. doi:10.1136/jmg.2010.080366. PMID 20837492. S2CID 21825049.
- ^ Morandi L, Abiusi E, Pasanisi MB, Lomastro R, Fiori S, Di Pietro L, Angelini C, Sorarù G, Gaiani A, Mongini T, Vercelli L (2013). "P.6.4 Salbutamol tolerability and efficacy in adult type III SMA patients: Results of a multicentric, molecular and clinical, double-blind, placebo-controlled study". Neuromuscular Disorders. 23 (9–10): 771. doi:10.1016/j.nmd.2013.06.475. S2CID 54398218.
- ^ Chang JG, Hsieh-Li HM, Jong YJ, Wang NM, Tsai CH, Li H (August 2001). "Treatment of spinal muscular atrophy by sodium butyrate". Proceedings of the National Academy of Sciences of the United States of America. 98 (17): 9808–13. Bibcode:2001PNAS...98.9808C. doi:10.1073/pnas.171105098. PMC 55534. PMID 11504946.
- ^ Andreassi C, Angelozzi C, Tiziano FD, Vitali T, De Vincenzi E, Boninsegna A, Villanova M, Bertini E, Pini A, Neri G, Brahe C (January 2004). "Phenylbutyrate increases SMN expression in vitro: relevance for treatment of spinal muscular atrophy". European Journal of Human Genetics. 12 (1): 59–65. doi:10.1038/sj.ejhg.5201102. PMID 14560316.
- ^ Brahe C, Vitali T, Tiziano FD, Angelozzi C, Pinto AM, Borgo F, Moscato U, Bertini E, Mercuri E, Neri G (February 2005). "Phenylbutyrate increases SMN gene expression in spinal muscular atrophy patients". European Journal of Human Genetics. 13 (2): 256–9. doi:10.1038/sj.ejhg.5201320. PMID 15523494.
- ^ Mercuri E, Bertini E, Messina S, Solari A, D'Amico A, Angelozzi C, Battini R, Berardinelli A, Boffi P, Bruno C, Cini C, Colitto F, Kinali M, Minetti C, Mongini T, Morandi L, Neri G, Orcesi S, Pane M, Pelliccioni M, Pini A, Tiziano FD, Villanova M, Vita G, Brahe C (January 2007). "Randomized, double-blind, placebo-controlled trial of phenylbutyrate in spinal muscular atrophy". Neurology. 68 (1): 51–5. doi:10.1212/01.wnl.0000249142.82285.d6. PMID 17082463. S2CID 30429093.
- ^ 임상시험번호 NCT00528268 - "척수근위축증 전 유아의 페닐낙산나트륨 평가 연구(STOPSMA)" (ClinicalTrials.gov )
- ^ Brichta L, Hofmann Y, Hahnen E, Siebzehnrubl FA, Raschke H, Blumcke I, Eyupoglu IY, Wirth B (October 2003). "Valproic acid increases the SMN2 protein level: a well-known drug as a potential therapy for spinal muscular atrophy". Human Molecular Genetics. 12 (19): 2481–9. doi:10.1093/hmg/ddg256. PMID 12915451.
- ^ Tsai LK, Tsai MS, Ting CH, Li H (November 2008). "Multiple therapeutic effects of valproic acid in spinal muscular atrophy model mice". Journal of Molecular Medicine. 86 (11): 1243–54. doi:10.1007/s00109-008-0388-1. PMID 18649067. S2CID 24565272.
- ^ Swoboda KJ, Scott CB, Crawford TO, Simard LR, Reyna SP, Krosschell KJ, Acsadi G, Elsheik B, Schroth MK, D'Anjou G, LaSalle B, Prior TW, Sorenson SL, Maczulski JA, Bromberg MB, Chan GM, Kissel JT, et al. (Project Cure Spinal Muscular Atrophy Investigators Network) (August 2010). Boutron I (ed.). "SMA CARNI-VAL trial part I: double-blind, randomized, placebo-controlled trial of L-carnitine and valproic acid in spinal muscular atrophy". PLOS ONE. 5 (8): e12140. Bibcode:2010PLoSO...512140S. doi:10.1371/journal.pone.0012140. PMC 2924376. PMID 20808854.
- ^ Kissel JT, Scott CB, Reyna SP, Crawford TO, Simard LR, Krosschell KJ, Acsadi G, Elsheik B, Schroth MK, D'Anjou G, LaSalle B, Prior TW, Sorenson S, Maczulski JA, Bromberg MB, Chan GM, Swoboda KJ, et al. (Project Cure Spinal Muscular Atrophy Investigators' Network) (2011). "SMA CARNIVAL TRIAL PART II: a prospective, single-armed trial of L-carnitine and valproic acid in ambulatory children with spinal muscular atrophy". PLOS ONE. 6 (7): e21296. Bibcode:2011PLoSO...621296K. doi:10.1371/journal.pone.0021296. PMC 3130730. PMID 21754985.
- ^ Darbar IA, Plaggert PG, Resende MB, Zanoteli E, Reed UC (March 2011). "Evaluation of muscle strength and motor abilities in children with type II and III spinal muscle atrophy treated with valproic acid". BMC Neurology. 11: 36. doi:10.1186/1471-2377-11-36. PMC 3078847. PMID 21435220.
- ^ Garbes L, Heesen L, Hölker I, Bauer T, Schreml J, Zimmermann K, Thoenes M, Walter M, Dimos J, Peitz M, Brüstle O, Heller R, Wirth B (January 2013). "VPA response in SMA is suppressed by the fatty acid translocase CD36". Human Molecular Genetics. 22 (2): 398–407. doi:10.1093/hmg/dds437. PMID 23077215.
- ^ Rak K, Lechner BD, Schneider C, Drexl H, Sendtner M, Jablonka S (December 2009). "Valproic acid blocks excitability in SMA type I mouse motor neurons". Neurobiology of Disease. 36 (3): 477–87. doi:10.1016/j.nbd.2009.08.014. PMID 19733665. S2CID 34657615.
- ^ Elshafay A, Hieu TH, Doheim MF, Kassem MA, ELdoadoa MF, Holloway SK, Abo-Elghar H, Hirayama K, Huy NT (March 2019). "Efficacy and Safety of Valproic Acid for Spinal Muscular Atrophy: A Systematic Review and Meta-Analysis". CNS Drugs. 33 (3): 239–250. doi:10.1007/s40263-019-00606-6. PMID 30796634. S2CID 73495750.
- ^ Grzeschik SM, Ganta M, Prior TW, Heavlin WD, Wang CH (August 2005). "Hydroxyurea enhances SMN2 gene expression in spinal muscular atrophy cells". Annals of Neurology. 58 (2): 194–202. doi:10.1002/ana.20548. PMID 16049920. S2CID 19509393.
- ^ Chen TH, Chang JG, Yang YH, Mai HH, Liang WC, Wu YC, Wang HY, Huang YB, Wu SM, Chen YC, Yang SN, Jong YJ (December 2010). "Randomized, double-blind, placebo-controlled trial of hydroxyurea in spinal muscular atrophy". Neurology. 75 (24): 2190–7. doi:10.1212/WNL.0b013e3182020332. PMID 21172842. S2CID 25858890.
- ^ Evans MC, Cherry JJ, Androphy EJ (October 2011). "Differential regulation of the SMN2 gene by individual HDAC proteins". Biochemical and Biophysical Research Communications. 414 (1): 25–30. doi:10.1016/j.bbrc.2011.09.011. PMC 6538936. PMID 21925145.
- ^ Riessland M, Brichta L, Hahnen E, Wirth B (August 2006). "The benzamide M344, a novel histone deacetylase inhibitor, significantly increases SMN2 RNA/protein levels in spinal muscular atrophy cells". Human Genetics. 120 (1): 101–10. doi:10.1007/s00439-006-0186-1. PMID 16724231. S2CID 24804136.
- ^ Garbes L, Riessland M, Hölker I, Heller R, Hauke J, Tränkle C, Coras R, Blümcke I, Hahnen E, Wirth B (October 2009). "LBH589 induces up to 10-fold SMN protein levels by several independent mechanisms and is effective even in cells from SMA patients non-responsive to valproate". Human Molecular Genetics. 18 (19): 3645–58. doi:10.1093/hmg/ddp313. PMID 19584083.
- ^ Narver HL, Kong L, Burnett BG, Choe DW, Bosch-Marcé M, Taye AA, Eckhaus MA, Sumner CJ (October 2008). "Sustained improvement of spinal muscular atrophy mice treated with trichostatin A plus nutrition". Annals of Neurology. 64 (4): 465–70. doi:10.1002/ana.21449. PMID 18661558. S2CID 5595968.
- ^ Avila AM, Burnett BG, Taye AA, Gabanella F, Knight MA, Hartenstein P, Cizman Z, Di Prospero NA, Pellizzoni L, Fischbeck KH, Sumner CJ (March 2007). "Trichostatin A increases SMN expression and survival in a mouse model of spinal muscular atrophy". The Journal of Clinical Investigation. 117 (3): 659–71. doi:10.1172/JCI29562. PMC 1797603. PMID 17318264.
- ^ Riessland M, Ackermann B, Förster A, Jakubik M, Hauke J, Garbes L, Fritzsche I, Mende Y, Blumcke I, Hahnen E, Wirth B (April 2010). "SAHA ameliorates the SMA phenotype in two mouse models for spinal muscular atrophy". Human Molecular Genetics. 19 (8): 1492–506. doi:10.1093/hmg/ddq023. PMID 20097677.
- ^ Farooq F, Molina FA, Hadwen J, MacKenzie D, Witherspoon L, Osmond M, Holcik M, MacKenzie A (August 2011). "Prolactin increases SMN expression and survival in a mouse model of severe spinal muscular atrophy via the STAT5 pathway". The Journal of Clinical Investigation. 121 (8): 3042–50. doi:10.1172/JCI46276. PMC 3148738. PMID 21785216.
- ^ Sakla MS, Lorson CL (January 2008). "Induction of full-length survival motor neuron by polyphenol botanical compounds". Human Genetics. 122 (6): 635–43. doi:10.1007/s00439-007-0441-0. PMID 17962980. S2CID 12460406.
- ^ Dayangaç-Erden D, Bora G, Ayhan P, Kocaefe C, Dalkara S, Yelekçi K, Demir AS, Erdem-Yurter H (March 2009). "Histone deacetylase inhibition activity and molecular docking of (e )-resveratrol: its therapeutic potential in spinal muscular atrophy". Chemical Biology & Drug Design. 73 (3): 355–64. CiteSeerX 10.1.1.515.8424. doi:10.1111/j.1747-0285.2009.00781.x. PMID 19207472. S2CID 764215.
- ^ Farooq F, Abadía-Molina F, MacKenzie D, Hadwen J, Shamim F, O'Reilly S, Holcik M, MacKenzie A (September 2013). "Celecoxib increases SMN and survival in a severe spinal muscular atrophy mouse model via p38 pathway activation". Human Molecular Genetics. 22 (17): 3415–24. doi:10.1093/hmg/ddt191. PMID 23656793.
- ^ Burnett BG, Muñoz E, Tandon A, Kwon DY, Sumner CJ, Fischbeck KH (March 2009). "Regulation of SMN protein stability". Molecular and Cellular Biology. 29 (5): 1107–15. doi:10.1128/MCB.01262-08. PMC 2643817. PMID 19103745.
- ^ Mattis VB, Rai R, Wang J, Chang CW, Coady T, Lorson CL (November 2006). "Novel aminoglycosides increase SMN levels in spinal muscular atrophy fibroblasts". Human Genetics. 120 (4): 589–601. doi:10.1007/s00439-006-0245-7. PMID 16951947. S2CID 28834037.
- ^ Mattis VB, Fosso MY, Chang CW, Lorson CL (November 2009). "Subcutaneous administration of TC007 reduces disease severity in an animal model of SMA". BMC Neuroscience. 10: 142. doi:10.1186/1471-2202-10-142. PMC 2789732. PMID 19948047.
- ^ Lunn MR, Root DE, Martino AM, Flaherty SP, Kelley BP, Coovert DD, Burghes AH, Man NT, Morris GE, Zhou J, Androphy EJ, Sumner CJ, Stockwell BR (November 2004). "Indoprofen upregulates the survival motor neuron protein through a cyclooxygenase-independent mechanism". Chemistry & Biology. 11 (11): 1489–93. doi:10.1016/j.chembiol.2004.08.024. PMC 3160629. PMID 15555999.
- ^ Taylor NP (1 June 2018). "Roche scraps €120M SMA drug after hitting 'many difficulties'". www.fiercebiotech.com. Retrieved 8 June 2018.
- ^ Takeuchi Y, Miyanomae Y, Komatsu H, Oomizono Y, Nishimura A, Okano S, Nishiki T, Sawada T (July 1994). "Efficacy of thyrotropin-releasing hormone in the treatment of spinal muscular atrophy". Journal of Child Neurology. 9 (3): 287–9. doi:10.1177/088307389400900313. PMID 7930408. S2CID 41678161.
- ^ Tzeng AC, Cheng J, Fryczynski H, Niranjan V, Stitik T, Sial A, Takeuchi Y, Foye P, DePrince M, Bach JR (2000). "A study of thyrotropin-releasing hormone for the treatment of spinal muscular atrophy: a preliminary report". American Journal of Physical Medicine & Rehabilitation. 79 (5): 435–40. doi:10.1097/00002060-200009000-00005. PMID 10994885. S2CID 20416253.
- ^ Kato Z, Okuda M, Okumura Y, Arai T, Teramoto T, Nishimura M, Kaneko H, Kondo N (August 2009). "Oral administration of the thyrotropin-releasing hormone (TRH) analogue, taltireline hydrate, in spinal muscular atrophy". Journal of Child Neurology. 24 (8): 1010–2. doi:10.1177/0883073809333535. PMID 19666885. S2CID 29321906.
- ^ Wadman RI, Bosboom WM, van den Berg LH, Wokke LH, Iannaccone ST, Vrancken AF, et al. (The Cochrane Collaboration) (7 December 2011). Wadman RI (ed.). "Drug treatment for spinal muscular atrophy type I". Cochrane Database of Systematic Reviews. John Wiley & Sons, Ltd (12): CD006281. doi:10.1002/14651858.cd006281.pub3. PMID 22161399.
- ^ Haddad H, Cifuentes-Diaz C, Miroglio A, Roblot N, Joshi V, Melki J (October 2003). "Riluzole attenuates spinal muscular atrophy disease progression in a mouse model". Muscle & Nerve. 28 (4): 432–7. doi:10.1002/mus.10455. PMID 14506714. S2CID 10300057.
- ^ Dimitriadi M, Kye MJ, Kalloo G, Yersak JM, Sahin M, Hart AC (April 2013). "The neuroprotective drug riluzole acts via small conductance Ca2+-activated K+ channels to ameliorate defects in spinal muscular atrophy models". The Journal of Neuroscience. 33 (15): 6557–62. doi:10.1523/JNEUROSCI.1536-12.2013. PMC 3652322. PMID 23575853.
- ^ 임상시험번호 NCT00774423 - "척수근위축증(SMA)을 가진 어린이 및 청소년에게 리루졸의 효능을 평가하는 연구" (ClinicalTrials.gov )
- ^ "Riluzole: premiers résultats décevants" (in French). AFM Téléthon. 22 September 2010.
- ^ Nizzardo M, Nardini M, Ronchi D, Salani S, Donadoni C, Fortunato F, Colciago G, Falcone M, Simone C, Riboldi G, Govoni A, Bresolin N, Comi GP, Corti S (June 2011). "Beta-lactam antibiotic offers neuroprotection in a spinal muscular atrophy model by multiple mechanisms" (PDF). Experimental Neurology. 229 (2): 214–25. doi:10.1016/j.expneurol.2011.01.017. hdl:2434/425410. PMID 21295027. S2CID 47567316.
- ^ Hedlund E (September 2011). "The protective effects of β-lactam antibiotics in motor neuron disorders". Experimental Neurology. 231 (1): 14–8. doi:10.1016/j.expneurol.2011.06.002. PMID 21693120. S2CID 26353910.
- ^ Rose FF, Mattis VB, Rindt H, Lorson CL (March 2009). "Delivery of recombinant follistatin lessens disease severity in a mouse model of spinal muscular atrophy". Human Molecular Genetics. 18 (6): 997–1005. doi:10.1093/hmg/ddn426. PMC 2649020. PMID 19074460.
- ^ "CK-2127107".
- ^ "Scholar Rock Announces Positive 12-Month Top-Line Results From the TOPAZ Phase 2 Clinical Trial Evaluating Apitegromab in Patients With Type 2 and Type 3 Spinal Muscular Atrophy (SMA)". www.businesswire.com. 6 April 2021. Retrieved 13 May 2021.
- ^ PhD, Patricia Inacio. "Pediatric Phase 2/3 Trial to Test Anti-myostatin Antibody with Evrysdi". Retrieved 23 January 2022.
- ^ Committee for Advanced Therapies and CAT Scientific Secretariat (August 2010). "Use of unregulated stem-cell based medicinal products". Lancet. 376 (9740): 514. doi:10.1016/S0140-6736(10)61249-4. PMID 20709228. S2CID 6906599.
- ^ European Medicines Agency (16 April 2010). "Concerns over unregulated medicinal products containing stem cells" (PDF). European Medicines Agency.
- ^ Carrozzi M, Amaddeo A, Biondi A, Zanus C, Monti F, Alessandro V (November 2012). "Stem cells in severe infantile spinal muscular atrophy (SMA1)". Neuromuscular Disorders. 22 (11): 1032–4. doi:10.1016/j.nmd.2012.09.005. PMID 23046997. S2CID 42093152.
- ^ Mercuri E, Bertini E (December 2012). "Stem cells in severe infantile spinal muscular atrophy". Neuromuscular Disorders. 22 (12): 1105. doi:10.1016/j.nmd.2012.11.001. PMID 23206850. S2CID 43858783.
- ^ "National registries for DMD, SMA and DM". Archived from the original on 22 January 2011.
추가 정보
- Parano E, Pavone L, Falsaperla R, Trifiletti R, Wang C (August 1996). "Molecular basis of phenotypic heterogeneity in siblings with spinal muscular atrophy". Annals of Neurology. 40 (2): 247–51. doi:10.1002/ana.410400219. PMID 8773609. S2CID 42514712.
- Wang CH, Finkel RS, Bertini ES, Schroth M, Simonds A, Wong B, Aloysius A, Morrison L, Main M, Crawford TO, Trela A (August 2007). "Consensus statement for standard of care in spinal muscular atrophy". Journal of Child Neurology. 22 (8): 1027–49. doi:10.1177/0883073807305788. PMID 17761659. S2CID 6478040.


