근위축성 측삭경화증
Amyotrophic lateral sclerosis| 근위축성 측삭경화증 (AL) | |
|---|---|
| 기타 이름 | 루게릭병 샤르코트병 운동뉴런병(MND)[1] |
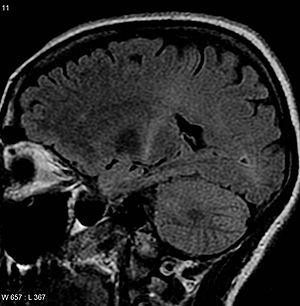 | |
| 운동피질까지 추적할 수 있는 내부캡슐 후부에서 증가한 T2 신호를 가진 뇌의 MRI로, ALS 진단과 일치합니다. | |
| 전문 | 신경학 |
| 증상 | 초기: 근육 경련, 근육 경련, 서서히 증가하는[2] 쇠약 나중에 : 말하기, 삼키기, 호흡곤란, 호흡부전[2] |
| 통상적인 개시 | 50~60대[3] |
| 원인들 | 알 수 없음(대부분), 상속됨(소수) |
| 진단 방법 | 증상에 따라 의심되며 MRI에 의해[2] 지원됩니다. |
| 치료 | 비침습적 인공호흡[4] |
| 약 | 리루졸레, 에다라본[5][6] |
| 예후 | 평균 수명 2 ~4년[4] |
| 빈도수. | 연간 2.6/100,000(유럽)[7] |
근위축성 측삭경화증(ALS)은 운동뉴런병(MND) 또는 루게릭병(Lou Gerick병)으로도 알려져 자발적인 근육을 [2][10][11]조절하는 운동뉴런의 점진적 손실을 초래하는 신경변성[a] 질환이다.ALS는 운동뉴런 [12][13]질환의 가장 흔한 유형이다.ALS의 초기 증상으로는 근육 경련, 그리고 점차 증가하는 약함과 근육 [2]소모 등이 있습니다.변연계 ALS는 팔이나 다리의 약함에서 시작되지만, 불모성 ALS는 말하거나 [2][9]삼키는 데 어려움을 겪는다.ALS를 앓고 있는 사람들 중 절반은 사고와 행동에 최소한 가벼운 어려움을 겪으며, 약 15%는 전두엽 [8]치매에 걸린다.대부분의 사람들은 고통을 [14]겪는다.영향을 받은 근육은 음식을 씹고, 말하고,[2] 걷는 역할을 합니다.운동뉴런의 손실은 먹고, 말하고, 움직이고, 마지막으로 호흡하는 능력을 [2]잃을 때까지 계속된다.ALS는 결국 마비와 조기 사망을 초래하는데, 보통 호흡부전으로 [15]인한 것입니다.
ALS의 대부분의 경우(약 90~95%)는 원인이 밝혀지지 않았으며 산발적 [2][16]ALS로 알려져 있습니다.그러나 유전적 요소와 환경적 요인 모두 관련이 [17]있는 것으로 생각된다.나머지 5%~10%는 가족 내 질병 병력과 관련된 유전적 원인을 가지고 있으며, 이를 [16][3]가족성 ALS라고 한다.이러한 유전적 사례의 약 절반은 두 개의 특정 유전자 [2]중 하나에 기인한다.ALS와 전두엽 치매(FTD)는 유전적, 임상적, 병리학적 [18]유사성 때문에 일반 질병 스펙트럼(ALS-FTD)의 일부로 간주된다.근본적인 메커니즘은 상부와 하부의 운동 [2]뉴런에 손상을 수반한다; ALS-FTD에서는 뇌의 전두엽과 측두엽의 뉴런도 [19]죽는다.진단은 다른 잠재적 [2]원인을 배제하기 위해 시행된 검사와 함께 사람의 징후와 증상에 기초한다.
ALS에 [2]대한 알려진 치료법은 없다.치료의 목적은 [8]증상을 개선하는 것입니다.리루졸이라는 약은 수명을 약 2~3개월 연장할 [5]수 있다.비침습적 인공호흡을 통해 품질과 [4]수명이 모두 향상될 수 있습니다.기계적 인공호흡은 생존을 연장할 수 있지만 질병의 [20]진행을 막지는 못한다.영양 공급 튜브가 도움이 [21]될 수 있습니다.이 질병은 모든 연령대의 사람들에게 영향을 미칠 수 있지만, 보통 60세 전후로 발병하고 50세 [3]전후로 유전되는 경우에는 발병한다.발병부터 사망까지의 평균 생존 기간은 2년에서 4년이지만, 이것은 다양하며, 약 10%는 10년 [4][22][2]이상 생존하며, 사망은 보통 호흡 부전으로 [3]인한 것이다.유럽에서는 매년 [7]10만 명당 2~3명꼴로 발병한다.세계 대부분의 지역의 요율은 [23]불분명하다.미국에서는 흑인보다 백인에게 [24]더 흔하다.
그 질병에 대한 설명은 찰스 [25]벨에 의해 적어도 1824년까지 거슬러 올라간다.1869년, 증상들과 근본적인 신경학적 문제들 사이의 연관성은 1874년 근위축성 [25]측삭경화증이라는 용어를 사용하기 시작한 프랑스 신경학자 장 마르탱 샤르코에 의해 처음 설명되었습니다.그것은 1939년 야구 선수 루게릭에게 영향을 미쳤던 20세기 미국에서 잘 알려졌고, 그 후 1963년 당시 21세의 우주학자 스티븐 [26][27]호킹의 진단에 따라 전 세계적으로 알려지게 되었다.하지만, ALS에 걸린 대부분의 사람들과 달리, 호킹 박사는 55년 더 그의 병을 견뎌냈다.첫 번째 ALS 유전자는 1993년에 발견되었고 첫 번째 동물 모델은 [28][29]1994년에 개발되었습니다.2014년, 아이스 버킷 챌린지의 동영상이 인터넷에서 입소문을 타면서 그 [30]상태에 대한 대중의 인식이 높아졌습니다.
분류
ALS는 운동신경계 질환으로 "운동신경계 질환"이라고도 불리며 신체의 [2]자발적인 근육을 제어하는 세포인 운동신경계에 선택적으로 영향을 미치는 신경계 질환의 집단이다.다른 운동 신경 질환은 일차성 측삭경화증, 진행성 근위축증, 진행성 구근성 마비, 의사 구근성 마비, 그리고 단수성 근위축증을 포함한다.[31]
ALS 자체는 몇 가지 다른 방법으로 분류할 수 있다: 발병 연령과 관련된 질병의 진행 속도, 가족성 또는 산발성 여부, 그리고 처음 [2]영향을 받은 지역에 따라 분류될 수 있다.약 25%의 경우 얼굴, 입, 목의 근육이 먼저 영향을 받는 것은 뇌간 부위인 '수질오목(medulla oblonata)'의 운동신경세포가 하부 운동신경세포와 함께 먼저 죽기 시작하기 때문이다.이 형식을 "bulbar-onset ALS"라고 합니다.약 5%의 경우 몸통의 근육이 [3]먼저 영향을 받는다.대부분의 경우 그 질병은 다른 척수 부위에 퍼지고 영향을 미친다.ALS를 가진 소수의 사람들은 두 번째 영역으로 확산되기 전에 최소한 12개월에서 24개월 동안 한 척수 영역으로 제한되는 증상을 보인다; 이러한 지역 변종 ALS는 더 나은 [32]예후와 관련이 있다.
기존 ALS, PLS 및 PMA
ALS는 영향을 받는 운동 뉴런의 유형에 따라 분류될 수 있다.전형적인 또는 "고전적" ALS는 뇌의 상부 운동 뉴런과 [33]척수의 하부 운동 뉴런을 포함합니다.원발성 측삭경화증(PLS)은 상부 운동뉴런만 관여하고 진행성 근위축증(PMA)은 하부 운동뉴런만 관여한다.PLS와 PMA가 별개의 질병인지 아니면 단순히 [8]ALS의 변형인지에 대한 논란이 있다.
고전적 ALS는 전체 ALS 사례의 약 70%를 차지하며 림온셋 ALS(척수온셋이라고도 함)와 벌바온셋 [8]ALS로 세분될 수 있다.사지경련성 ALS는 팔과[9] 다리의 약함에서 시작되며 모든 전형적인 ALS 사례의 [8]약 3분의 2를 차지한다.불바온셋 ALS는 언어, 씹기, 삼키는[33] 근육의 약함에서 시작되며 나머지 1/3의 [8]경우를 차지한다.벌바 발병은 림 온셋 ALS보다 더 나쁜 예후와 관련이 있다. 인구 기반 연구에 따르면 벌바 온셋 ALS는 2.0년 중간 생존율과 3%인 반면 림 온셋 ALS는 2.6년 중간 생존율과 13%[34]의 10년 생존율을 보인다.드문 변형은 호흡성 ALS로,[8] ALS의 모든 사례의 약 3%를 차지한다. 초기 증상은 노력, 휴식 또는 누워 있을 때 호흡곤란(디스피어)[35]이다.척추와 구근의 증상은 처음에는 경미하거나 없는 경향이 있다.그것은 [22]남성들에게서 더 흔하다.ALS는 ALS 변종 중 예후가 가장 나빴다. 모집단 기반 연구에서, 호흡기 ALS는 1.4년의 중간 생존과 10년의 [34]0% 생존을 보였다.
원발성 측삭경화증(PLS)은 ALS의 모든 사례의 약 5%를 차지하며 팔과 [22]다리의 상부 운동 신경세포에 영향을 미친다.그러나 PLS가 명백한 사람의 75% 이상이 증상 발생 후 4년 이내에 하부 운동 뉴런 징후가 나타나기 때문에 [36]그때까지 PLS의 확실한 진단을 내릴 수 없다.PLS는 진행 속도가 느리고 기능 저하가 적고 호흡 능력에 영향을 주지 않으며 체중 [22]감량을 덜 일으키기 때문에 전형적인 ALS보다 예후가 좋다.
진행성 근위축증(PMA)은 ALS의 모든 사례의 약 5%를 차지하며 팔과 [22]다리의 하부 운동 뉴런에 영향을 미친다.PMA는 전형적인 ALS보다 평균적으로 더 긴 생존과 관련이 있지만, 시간이 지남에 따라 다른 척수 영역으로 진행되어 결국 호흡부전과 [8]사망으로 이어집니다.상부 운동 뉴런 신호는 PMA 과정에서 늦게 발생할 수 있으며, 이 경우 진단이 고전 [36]ALS로 변경될 수 있습니다.
지역별 변종
ALS의 지역적 변종은 적어도 1년 동안 단일 척수 영역에 국한된 증상을 가지고 있다; 그것들은 전통적인 ALS보다 더 느리게 진행되며 더 긴 생존과 관련이 있다.예를 들어 후레일 팔 증후군, 후레일 다리 증후군, 고립된 구근 ALS 등이 있습니다.후레일 팔 증후군과 후레일 다리 증후군은 하부 운동 신경 세포만을 포함하기 때문에 종종 PMA의 지역적 변종으로 간주됩니다.고립된 볼바 ALS는 상부 또는 하부 운동 뉴런을 포함할 수 있습니다.이러한 지역적 변종 ALS는 증상 시작 시 진단할 수 없습니다. 질병이 장기간에 걸쳐(최소 12개월) 다른 척수 영역으로 확산되지 않는 것을 [32]관찰해야 합니다.
상완근위축성 [b]쌍안구증이라고도 불리는 후두근증후군은 경추에서만 운동신경세포가 손상되어 근위팔근육의 약화가 서서히 시작되고 반사작용이 감소하거나 없는 것이 특징이다.다리 근위축성 [c]쌍안개라고도 불리는 후레일 다리 증후군은 요골 척수에서만 하부 운동 뉴런이 손상되어 다리에 서서히 약해지고 반사작용이 감소하거나 없는 것이 특징이다.고립된 불바 ALS는 불바 영역에서만 상부 또는 하부 운동 뉴런 손상에 의해 특징지어지며, 언어(디사르트리아) 및 삼키기(디사르시아)의 점진적인 어려움으로 이어진다. 호흡(호흡)은 적어도 초기에는 일반적으로 보존된다.두 개의 작은 연구는 고립된 불바 ALS를 가진 사람들이 [32]불바온셋 ALS를 가진 사람들보다 더 오래 살 수 있다는 것을 보여주었다.
발병 연령
ALS는 또한 발병 연령에 따라 분류될 수 있다.산발성 ALS의 경우 최고 발병 연령이 58세에서 63세, [3]가족성 ALS의 경우 47세에서 52세 사이인 반면, ALS의 모든 사례의 약 10%는 45세 이전에 시작되고, 모든 사례의 약 1%는 25세 이전에 시작된다(청소년 [33]ALS).젊은 ALS가 발병하는 사람들은 남성일 가능성이 높고, 증상의 시작은 덜하며,[36] 질병의 진행은 더 느립니다.청소년 ALS는 성인 ALS보다 가족성이 더 높다; 청소년 ALS와 연관된 것으로 알려진 유전자는 ALS2, SETX, SPG11, FUS, SIGMAR1을 포함한다.청소년 ALS를 가진 대부분의 사람들이 성인 ALS를 가진 사람들보다 더 오래 살지만, 그들 중 일부는 나쁜 [37]예후와 관련된 FUS와 SOD1에 특정한 돌연변이를 가지고 있다.(65세 이후) 늦게 발병하는 것은 더 빠른 기능 저하와 더 [38]짧은 생존과 관련이 있다.
징후 및 증상
이 질환은 상부 운동과 하부 운동 뉴런의 퇴화로 인해 전신에 근육 약화, 위축, 근육 경련을 일으킨다.방광과 장의 기능과 안구외 근육은 질병의 [19]마지막 단계까지 보호되지만[39][d], 이 장애에 의해 영향을 받는 사람들은 궁극적으로 모든 자발적인 [4]움직임을 시작하고 통제하는 능력을 잃을 수 있습니다.
인지 또는 행동 장애는 [41]ALS에 걸린 사람의 30-50%에서 나타난다.ALS에 걸린 사람들의 약 절반이 인식과 행동에 경미한 변화를 경험하고, 10-15%는 전두엽 치매(FTD)[4]의 징후를 보일 것이다.진단 당시 정상적인 인지력을 가진 ALS를 가진 대부분의 사람들은 그들의 질병의 과정 내내 인지력을 보존했다; 기준선에서 정상적인 인지력을 가진 사람들의 인지 장애의 발달은 더 나쁜 [42]예후와 관련이 있다.반복적인 구절이나 제스처, 무관심 및 억제 상실은 [43]ALS의 행동 특징에 자주 보고됩니다.언어 기능 장애, 행정 기능 장애, 그리고 사회적 인식과 언어 기억과 관련된 문제들은 ALS에서 가장 흔하게 보고된 인지 증상들이다; 메타 분석에서는 기능 장애와 [44]질병 심각도 사이의 관계가 발견되지 않았다.하지만, 인지 및 행동 장애는 ALS에 걸린 사람들의 생존 감소와 간병인 부담 증가와 관련이 있는 것으로 밝혀졌습니다; 이것은 부분적으로 사회적 [44]인식의 결핍 때문일 수 있습니다.ALS를 앓고 있는 약 절반의 사람들이 이유 없이 울거나 웃는 감정적 능력을 경험한다; 그것은 ALS를 [4]가진 사람들에게서 더 흔하다.
통증은 ALS를 가진 대부분의 사람들에 의해 경험되는 증상이고 신경성 통증, 경련성, 근육 경련, 그리고 운동 저하와 근육 쇠약으로 인한 침윤통증의 형태를 취할 수 있습니다; ALS의 침윤통증의 예로는 수축, 목 통증, 허리 통증, 신발 등이 있습니다.노인의 통증과 [14]욕창이 있어요
감각신경과 자율신경계는 일반적으로 영향을 받지 않으며, 이는 ALS에 걸린 대부분의 사람들이 청각, 시각, 촉각, 후각,[2] 미각을 유지한다는 것을 의미한다.
초기 증상
ALS의 시작은 증상이 [2]간과될 정도로 미묘할 수 있다.ALS의 초기 증상은 근육 약화나 근육 위축이다.다른 증상으로는 삼키거나 숨쉬기, 경련, 또는 영향을 받는 근육의 경직, 팔이나 다리에 영향을 주는 근육 약화, 또는 헐렁한 코맹맹이 등이 있습니다.ALS의 초기 증상에 의해 영향을 받는 신체 부위는 신체의 어떤 운동 뉴런이 먼저 [10]손상되느냐에 따라 달라집니다.
사지경련성 ALS의 첫 증상은 팔이나 다리에 있습니다.만약 다리가 먼저 영향을 받는다면, 사람들은 걷거나 달릴 때 어색함, 발을 헛디디거나 비틀거리는 것을 경험할 수 있다; 이것은 종종 땅에 부드럽게 질질 끄는 "떨어진 발"로 특징지어진다.팔이 먼저 영향을 받는 경우 셔츠 단추를 잠그거나, 글을 쓰거나,[10] 자물쇠로 키를 돌리는 등 손재주가 필요한 작업에 어려움을 겪을 수 있습니다.
구근성 ALS에서 첫 번째 증상은 말을 하거나 삼키는 데 어려움을 겪는 것이다.말투가 흐릿해지거나 콧소리가 나거나 조용해질 수 있습니다.삼키는 데 어려움이 있고 혀의 이동성을 잃을 수 있다.더 적은 비율의 사람들이 호흡을 지탱하는 늑간 근육이 먼저 [3]영향을 받는 "호흡기성" ALS를 경험합니다.
시간이 지남에 따라, 사람들은 움직이거나 삼키거나 말을 하거나 단어를 만드는 데 어려움을 겪습니다.상부 운동 뉴런의 관여의 증상에는 긴장하고 경직된 근육(경련성)과 과잉 활동적인 개그 반사를 포함한 과장된 반사(고반사)가 포함된다.흔히 바빈스키 증후군이라고 불리는 비정상적인 반사 또한 상부 운동 뉴런의 손상을 나타낸다.하부 운동 뉴런 퇴화의 증상에는 근육 약화와 위축, 근육 경련, 피부 아래에서 볼 수 있는 근육의 일시적인 경련이 포함됩니다.그러나 경련은 진단적 증상이라기 보다는 부작용에 가깝다; 경련은 약해지고 [2]위축된 후에 발생하거나.
진행
초기 증상과 진행 속도는 사람마다 다르지만 결국 발병하지 않은 지역으로 확산돼 발병률이 높아진다.대부분의 사람들은 결국 걷지 못하거나 손과 팔을 사용할 수 없게 되고, 말하는 능력과 음식, 자신의 침을 삼킬 수 있는 능력을 잃으며, 기침을 하거나 스스로 [4]숨을 쉬는 능력을 잃기 시작한다.
추이율은 근 위축성 측색 경화증 기능 평가 등급-개정된(ALSFRS-R),12-item 악기 조사에서 48(정상적인 기능)과 0( 심각한 장애)사이의 점수를 생산하는 임상 인터뷰나,self-reported 설문지로 관리했던 사용하고 측정할 수 있다.임상 실험에서[45]그것은 가장 일반적으로 사용되는outcome의 조치이며 사용된다.질병 [46]진행 상황을 추적하는 의사들에 의해.변동성이 높고 훨씬 느린 장애를 가진 비율은 적지만, ALS에 걸린 사람들은 평균적으로 한 달에 0.9 FRS 포인트를 잃습니다.임상의의 조사에 근거한 연구에 의하면, ALSFRS-R의 기울기의 20%변화가 임상적으로 [47]유의미하다고 평가되고 있다.
발병 [48]시 40세 미만, 가벼운 비만, 주로 한쪽 사지에 국한된 증상, 그리고 주로 상부 운동 뉴런 증상을 가진 [34]사람들에게서 질병 진행이 더 느린 경향이 있다.반대로, 전두엽성 ALS, 호흡온성 ALS 및 전두엽성 [34]치매 환자는 진행이 더 빠르고 예후가 좋지 않다.
후기 단계
씹고 삼키는 것의 어려움은 먹는 것을 매우 어렵게 만들고 질식하거나 음식을 폐로 흡입할 위험을 증가시킨다.이 질환의 후반기에는 흡인성 폐렴이 발병할 수 있으며 건강한 체중을 유지하는 것은 영양 튜브 삽입이 필요할 수 있는 중대한 문제가 될 수 있다.호흡을 지탱하는 늑골의 횡격막과 늑간 근육이 약해지면서 활력이나 흡기압 등 폐기능 측정치가 저하된다.호흡온성 ALS에서 이는 심각한 사지 약화가 나타나기 전에 발생할 수 있다.ALS 환자들 사이에서 가장 흔한 사인은 호흡부전이나[3] 폐렴이며,[10] ALS 환자들 대부분은 수면 중에 호흡이 멎은 채 자신의 집에서 사망한다.
호흡 보조 장치는 호흡 문제를 완화시키고 생존을 연장할 수 있지만 ALS의 진행에는 영향을 미치지 않습니다.ALS에 걸린 대부분의 사람들은 진단 [4]후 2년에서 4년 사이에 사망한다.ALS 환자의 약 절반은 증상이 시작된 지 30개월 이내에 사망하며, ALS 환자의 약 20%는 증상이 시작된 [3]후 5년에서 10년 사이에 산다.기타리스트 제이슨 베커는 1989년부터 이 장애를 안고 살았고, 우주학자 스티븐 호킹은 그의 진단에 따라 55년을 더 살았지만, 그들은 특이한 [50]경우로 여겨진다.
원인
ALS의 정확한 원인은 알려져 있지 않지만, 유전적 요소와 환경적 요인은 거의 동일한 중요성을 [17]지닌 것으로 생각된다.유전적 요인은 환경적 요인보다 더 잘 이해된다; 특정한 환경적 요인이 ALS를 유발하는 것으로 확실히 증명되지 않았다.ALS에 대한 책임 임계값 모델은 출생 시 존재하는 유전적 요인 및 [23]평생 환경 위험에 노출되어 시간이 지남에 따라 세포 손상이 누적된다고 제안한다.
유전학
ALS는 [22][51]가족력이 있는지 여부에 따라 가족성 또는 산발성 질환으로 분류될 수 있다.가족성 ALS의 정확한 정의에 대해서는 신경학자들 사이에 합의가 이루어지지 않았다.가장 엄격한 정의는 ALS에 걸린 사람은 ALS에 걸린 두 명 이상의 1급 친척(자녀, 형제자매 또는 부모)이 있어야 한다는 것입니다.덜 엄격한 정의는 ALS에 걸린 사람은 [52]ALS에 걸린 적어도 1급 또는 2급 친척(조부모, 손자, 고모, 삼촌, 조카, 조카 또는 이복 자매)이 있어야 한다는 것이다.가족성 ALS는 일반적으로 모든 ALS 사례의 10%를 차지하는 것으로 알려져 있지만 추정치는 5%[53]에서 20%[54] 사이이다.높은 추정치는 가족성 ALS의 광범위한 정의를 사용하고 ALS에 걸린 사람들의 가족력을 더 철저히 [52]조사한다.
산발성 ALS의 경우 [19]가족력이 없습니다.산발성 ALS와 가족성 ALS는 임상적으로나 병리적으로 동일하며 [54]유전적으로도 유사하다. 산발성 ALS를 가진 사람들의 약 10%가 [8]가족성 ALS를 일으키는 것으로 알려진 유전자 돌연변이를 가지고 있다.이러한 유사성에 비추어 볼 때, "스포라딕 ALS"라는 용어는 산발적인 ALS의 경우 환경적 요인에 의해서만 발생한다는 것을 의미하기 때문에 오해를 불러일으키는 것으로 비판되어 왔다. "고립 ALS"라는 용어는 보다 정확한 [54]대안으로 제시되었다.
가족성 ALS와 관련된 유전자는 20개 이상이며, 가족성 [55]ALS의 경우 C9orf72(40%), SOD1(20%), FUS(1~5%), TARDBP(1~5%)[8] 등 4개가 대부분을 차지한다.가족성 ALS의 유전학은 산발성 [8]ALS의 유전학보다 더 잘 알려져 있다. 2016년 현재[update] 알려진 ALS 유전자는 가족성 ALS의 약 70%, 산발성 [56][57]ALS의 약 15%를 설명하고 있다.전반적으로 ALS에 걸린 개인의 1급 친척은 [17][58]ALS에 걸릴 위험이 1%이다.ALS는 [28]질병을 일으키기 위해 두 개 이상의 유전자의 돌연변이가 필요하다는 것을 의미한다.
ALS와 전두엽 치매(FTD)는 유전적, 임상적, 병리학적 [18]유사성 때문에 현재 일반적인 질병 스펙트럼(FTD-ALS)의 일부로 간주된다.유전적으로 C9orf72 반복 확장은 가족성 ALS의 약 40%, 가족성 [28]FTD의 25%를 차지한다.임상적으로, ALS를 가진 사람들의 50%가 인지 또는 행동 장애를 가지고 있고, 5~15%가 FTD를 가지고 있는 반면, FTD를 가진 사람들의 40%는 운동 뉴런 증상을 가지고 있고, 12.5%는 [8]ALS를 가지고 있다.병리적으로, TDP-43 단백질의 비정상적인 집적은 ALS 환자의 최대 97%와 FTD 환자의 최대 50%에서 나타난다.[59]2021년 12월, TDP-43 단백질 병증이 TARDBP [60]유전자 발현을 조절하는 사이클로필린 A 결함으로 인해 발생한다는 논문이 발표되었습니다.FTD-ALS를 일으키는 것으로 알려진 다른 유전자로는 CHCHD10, SQSTM1, TBK1이 [55]있다.
환경 요인
질병의 가족력이 없는 경우(환자 중 약 90%), 원인은 밝혀지지 않았다.증거가 확실하지 않은 가능한 연관성에는 군복무와 [41]흡연이 포함된다.군사와 ALS 빈도에 대한 연구는 일관성이 없지만 양의 [61]상관관계에 대한 증거는 약하다.제안된 다양한 요인에는 (지리적 배치 연구에서 인용된) 환경 독소에 대한 노출, 군 [61]복무 중 술과 담배 사용이 포함된다.
16개 메타 분석의 2016년 리뷰에서는 납에 대한 만성 직업상 피폭과 관련된 설득력 있는 증거가 있다고 결론지었다. 농업, 납 이외의 중금속 피폭, 베타카로틴 섭취 및 머리 부상에 대한 암시적 증거, 오메가3 지방산 섭취, 초저주파수 선택 피폭에 대한 약한 증거로마그네틱 필드, 살충제,[62] 혈청 요산.
미국 질병통제예방센터가 1985년부터 2011년까지 미국 사망자를 분석한 2017년 연구에서 ALS 사망과 관련된 직업(관리직,[63] 재무직, 건축직, 컴퓨팅직, 법률직, 교육직 등)은 화이트칼라였다.화학적 노출, 전자기장 노출, 직업, 신체적 외상 및 [64][65]감전 등 기타 잠재적 위험 요인은 확인되지 않은 채로 남아 있다.유기 염소 살충제인 알드린, 딜드린, DDT 및 [66][67][68]톡사펜을 포함한 다양한 살충제에 대한 노출과 잠정적인 연관성이 있다.
머리 부상
2015년 리뷰에서 중간에서 심각한 외상성 뇌손상은 ALS의 위험 요소이지만 가벼운 외상성 뇌손상 증가율은 불분명하다.[69]2017년 메타 분석에서 머리 부상과 ALS 사이의 연관성이 발견되었다. 그러나 저자들이 역원인 가능성을 고려하면서 이 연관성은 사라졌다. 즉, 머리 부상은 [70]ALS의 원인이 아닌 진단되지 않은 ALS의 초기 증상이라는 생각이다.
신체 활동
2021년 이전의 여러 검토에서는 물리적 활동의 양과 [71][72][73]ALS 발병 위험 사이에 아무런 관련이 없는 것으로 나타났다.2009년 리뷰에서 ALS의 위험 요소로서의 신체 활동에 대한 증거는 제한적이고 상충되며 확실한 [74]결론을 내리기에는 품질이 불충분하다는 것이 밝혀졌다.2014년 리뷰는 신체 활동이 일반적으로 ALS의 위험 요소가 아니며, 축구와 미식축구는 ALS와 관련이 있을 수 있으며, 신체적으로 힘든 직업이 [75]ALS와 관련이 있는지 여부를 말할 수 있는 충분한 증거가 없다고 결론지었다.2016년 리뷰에서는 증거가 결정적이지 않은 것으로 나타났으며,[76] 연구 설계의 차이가 ALS에 대해 동일한 신체 활동 척도나 동일한 진단 기준을 사용하지 않기 때문에 연구를 비교하는 것을 어렵게 한다는 점에 주목했다.그러나 2021년에 발표된 연구는 위험 유전자형을 [77]가진 사람들에게 ALS와 격렬한 신체 운동 사이에 긍정적인 인과 관계가 있음을 시사했다.
스포츠
축구와 미식축구 모두 ALS의 위험 요인으로 여러 연구에서 확인되었지만, 이 연관성은 소수의 [78]ALS 사례에 기초하고 있다.전 NFL 선수 3,439명을 대상으로 한 2012년 소급 코호트 연구는 그들의 신경 퇴행성 원인에 의한 사망 위험이 일반 미국 인구보다 3배 더 높았고, 그들의 ALS 또는 알츠하이머 병으로 사망할 위험은 4배 [79]더 높았다.그러나 이 증가된 위험은 이 코호트의 총 사망자 334명 중 알츠하이머병으로 인한 사망자 2명과 ALS로 인한 사망자 6명을 기준으로 계산되었으며, 이는 이 연구가 미식축구가 [80]ALS에 대한 위험 요소라는 것을 확실히 증명하지 못한다는 것을 의미한다.ALS로 사망한 것으로 생각되는 몇몇 NFL 선수들은 [69][e]ALS와 매우 유사한 증상을 보일 수 있는 다발성 머리 부상과 관련된 신경 변성 질환인 만성 외상성 뇌증(CTE)을 실제로 가지고 있었을지도 모른다.
1960년과 1996년 사이에 활약한 24,000명의 이탈리아 축구 선수들을 대상으로 한 회고적 코호트 연구에서 축구는 ALS의 가능한 위험 요인으로 확인되었다.이 그룹에는 ALS 8명을 포함해 375명이 사망했다.이 정보와 ALS 발병률을 바탕으로 축구 선수들이 ALS로 사망할 확률이 일반 [23]이탈리아인보다 11배 높은 것으로 계산됐다.그러나 이 계산은 [74]코호트에서 ALS의 예상 환자 수가 부적절하게 낮다는 비판을 받아왔다.ALS 발병의 평생 위험을 예상 환자 수를 예측하기 위해 사용했을 때, 축구 선수들은 [23]일반 인구보다 ALS로 사망할 가능성이 낮았다.
흡연석을 부탁해요.
흡연은 ALS와 관련이 있을 수 있다.2009년 리뷰는 흡연이 [83]ALS의 확립된 위험 요소라는 결론을 내렸다.2010년 체계적 검토와 메타 분석 결과 흡연과 ALS 사이에는 강한 연관성이 없지만 흡연이 여성 [84]ALS의 높은 위험과 관련이 있을 수 있다는 결론을 내렸다.2011년 메타 분석에서는 흡연이 ALS의 위험과 절대 담배를 피우지 않는다는 결론을 내렸습니다.흡연자들 사이에서, 그들이 담배를 일찍 피우기 시작할수록, 그들은 ALS에 걸릴 가능성이 더 높았다. 그러나 흡연 연수와 하루에 피우는 담배의 수는 ALS에 [85]걸릴 위험성에 영향을 주지 않았다.
리스크 팩터
ALS는 어떤 연령에도 발병할 수 있지만 나이가 [86]들수록 발병률이 높아집니다.ALS가 발병하는 대부분의 사람들은 40세에서 70세 사이이며,[87] 진단 시 평균 연령은 55세이다.ALS는 [87]여성보다 남성에게서 20% 더 흔하지만,[86] 70세 이후에는 그 차이가 사라질 것이다.그 이유는 [88]불분명하지만, 퇴역 군인들은 ALS에 걸릴 확률이 1.5배에서 2배 정도 더 높다는 것이 또한 제시되었다.
병태생리학
신경병리학
ALS의 결정적인 특징은 상부 운동 뉴런(뇌의 운동 피질에 위치)과 하부 운동 뉴런(뇌간과 [89]척수에 위치)의 죽음이다.전두엽성 치매가 있는 ALS에서는 뇌의 전두엽과 측두엽에 있는 뉴런도 [19]죽는다.ALS의 병리학적 특징은 운동 뉴런의 세포질에서 부니나 체로 알려진 포섭체(단백질의 비정상적인 집합체)의 존재이다.ALS를 가진 사람의 약 97%에서 봉입체의[90][91] 주성분은 TDP-43 [9]단백질이지만 SOD1 또는 FUS 돌연변이를 가진 사람의 주성분은 [33]SOD1 단백질 또는 FUS 단백질이다.육안으로 볼 수 있는 질환의 특징인 ALS의 총 병리학은 골격근 위축, 운동피질 위축, 피질척수 및 피질막대의 경화, 설하신경(혀를 제어하는)의 얇아짐, 척수의 [9]전근의 얇아짐 등을 포함한다.운동신경세포의 죽음과는 별도로, 대부분의 ALS 변이형에게 공통적인 두 가지 특징은 증상이 단일 척수 영역에서 시작된다는 것을 의미하는 국소 초기 병리와 시간이 지남에 따라 증상이 추가 영역으로 확산된다는 것을 의미한다.세포에서 세포로 잘못 접힌 단백질의 프리온 같은 전파는 왜 ALS가 한 지역에서 시작되고 [33]다른 지역으로 퍼지는지를 설명할 수 있다.림프계는 또한 [92]ALS의 병리 형성에 관여할 수 있다.
생화학
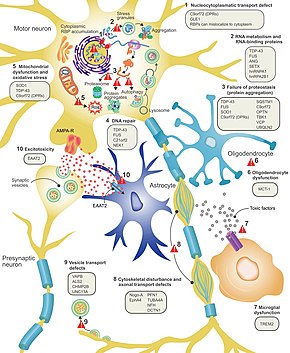
왜 뉴런이 ALS에서 죽는지 아직 완전히 이해되지 않았지만, 이 신경 변성은 많은 다른 세포와 분자 과정을 [8]수반하는 것으로 생각된다.ALS에 관여하는 것으로 알려진 유전자는 정상 기능에 따라 단백질 분해, 세포골격, RNA 처리의 세 가지 일반적인 범주로 분류될 수 있다.돌연변이 SOD1 단백질은 단백질 분해를 억제하는 세포 내 응집을 형성한다.야생형(정상) SOD1 단백질의 세포질 집적은 산발성 [19]ALS에서 일반적이다.잘못 접힌 돌연변이 SOD1은 인접 뉴런에서 프리온과 같은 방법으로 [9]야생형 SOD1의 오접힘과 집적을 일으킬 수 있다고 생각된다.변이 시 ALS를 일으킬 수 있는 다른 단백질 분해 유전자는 VCP, OPTN, TBK1, SQSTM1이며, 세포골격 유지와[19] 축삭수송에[9] 중요한 ALS와 관련된 세 가지 유전자는 DCTN1, PFN1, TUBA4A이다.[19]
RNA결합단백질을 암호화하는 다수의 ALS 유전자가 있다.가장 먼저 발견된 것은 거의 모든 ALS의 경우 운동 뉴런 세포질에 집적되는 핵단백질인 TDP-43 [19]단백질이다. 그러나 TDP-43을 코드하는 유전자인 TARDBP의 [9]돌연변이는 ALS의 드문 원인이다.FUS는 돌연변이 [28]시 ALS를 일으킬 수 있는 TDP-43과 유사한 기능을 가진 또 다른 RNA 결합 단백질인 FUS를 코드합니다.TARDBP와 FUS의 돌연변이는 저복잡도 도메인의 결합 친화력을 증가시켜 각각의 단백질이 세포질에 응집되도록 하는 것으로 생각된다.일단 이러한 돌연변이 RNA 결합 단백질이 잘못 접혀지고 집적되면, 그들은 프리온과 [19]같은 방식으로 세포 내부와 세포 사이에 정상적인 단백질을 잘못 접을 수 있다.이것은 또한 핵에서 RNA 결합 단백질의 수치를 감소시키는데, 이것은 그들의 표적 RNA 전사가 정상적인 처리를 거치지 않는다는 것을 의미할 수 있다.ALS와 관련된 다른 RNA 대사 유전자는 ANG, SETX 및 MATR3를 [9]포함한다.
C9orf72는 ALS에서 가장 흔하게 변이된 유전자이며 많은 메커니즘을 [19]통해 운동 뉴런의 죽음을 야기한다.병원성 돌연변이는 헥사뉴클레오티드 반복 팽창이다;[59] 최대 30번의 반복을 가진 사람들은 정상으로 간주되는 반면, 수백 또는 수천 번의 반복을 가진 사람들은 가족성 ALS, 전두엽성 치매 또는 때때로 산발성 ALS를 가질 수 있다.이러한 C9orf72 반복과 관련된 세 가지 질병 메커니즘은 핵에서의 RNA 전사 퇴적, 세포질에서 독성 디펩타이드 반복 단백질로의 RNA 변환, 그리고 정상 C9orf72 [19]단백질의 감소이다.기능 장애 운동 뉴런 축삭 항상성(축삭 길이 감소 및 미토콘드리아 화물의 축삭 이동)을 초래하는 미토콘드리아 생체 에너지 장애는 CRISPR/Cas9 유전자 편집 및 인간 사후 척수 조직과 결합된 인간 유도 다능성 줄기세포(iPSC) 기술을 사용하여 C9orf72-ALS에서 발생하는 것으로 나타났다.e [94]검사
흥분성 신경전달물질인 글루탐산염에 의한 과도한 자극으로 인한 세포 내 칼슘의 높은 수치에 의해 야기되는 흥분성 독성은 모든 형태의 ALS에 공통적인 것으로 생각되는 메커니즘이다.운동 뉴런은 칼슘 완충 능력이 낮고 칼슘에 더 투과성이 높은 글루탐산 수용체(AMPA 수용체)의 종류를 가지고 있기 때문에 다른 유형의 뉴런보다 흥분 독성에 더 민감합니다.ALS에서는 시냅스에서 글루탐산을 제거하는 주요 운반체인 흥분성 아미노산 트랜스포터 2(EAAT2)의 수치가 감소하며, 이는 시냅스 글루탐산 수치와 흥분독성을 증가시킨다.리루졸은 ALS에서 생존을 다소 연장하는 약물로, 시냅스 전 뉴런에서 글루탐산염 방출을 억제한다; 하지만, 이 메커니즘이 치료 [9]효과에 책임이 있는지는 불분명하다.
진단.
비록 한쪽 팔다리에 상·하부 운동 뉴런의 징후가 강하게 [2]나타나지만, 어떤 검사도 ALS의 확실한 진단을 제공할 수 없다.대신, ALS의 진단은 주로 의사가 그 사람에게서 관찰하는 증상과 징후와 다른 [2]질병을 배제하기 위한 일련의 테스트에 기초한다.의사는 환자의 전체 병력을 파악해 근육 약화, 근육 위축, 과반사, 경련 등의 증상이 [2]악화되고 있는지 여부를 평가하기 위해 정기적으로 신경과 검사를 한다.많은 바이오마커가 이 질환에 대해 연구되고 있지만, 아직까지 일반적인 [95][96]의학에서는 사용되지 않고 있다.
진단 기준
ALS의 진단은 El Escorial 개정 기준과 Awaji [9]기준에 기초한다.원래의 El Escorial 기준은 네 개의 척수 부위 중 얼마나 많은 부분이 관련되었는지를 기준으로 네 가지 진단 확실도 수준을 가지고 있었다. 즉, 구근, 경추, 흉부, 요추.확실한 ALS는 3개의 척수 영역에서 상부 운동 뉴런(UMN) 및 하부 운동 뉴런(LMN) 징후로 정의되었고, 두 영역에서 가능한 ALS는 UMN 및 LMN 징후로 정의되었으며, 한 영역에서만 가능한 ALS와 LMN 징후로 의심되었다.에어리 하우스 기준으로도 알려진 El Escorial Revisioned 기준은 "의심 ALS" 범주를 삭제하고 "실험실 지원 가능 ALS" 범주를 추가했다.Awaji 기준은 비정상적인 EMG 테스트에 [36]ALS 진단 시 LMN 기능 장애의 임상 징후와 동일한 가중치를 부여하므로 "검사실 지원 가능 ALS" 범주가 불필요해진다.Awaji 기준의 유일한 세 가지 범주는 확실한 ALS, 가능한 ALS [97]및 가능한 ALS이다.
El Escorial Revisioned 기준은 ALS에 특화되어 있습니다.이것은 기준을 충족하는 사람이 ALS에 걸릴 가능성이 매우 높음을 의미합니다.다만, ALS에 대해서는 특별히 민감하지 않기 때문에, 기준을 충족하지 않는 사람도 ALS에 걸릴 수 있습니다.ALS의 초기 단계에서는 민감도가 특히 떨어진다.Awaji 기준은 특히 [36]벌바온셋 ALS의 경우 El Escorial 개정 기준보다 민감도가 높다.2012년 메타분석 결과 El Escorial Revisioned 기준은 62.2%의 민감도를 보였고, Awaji 기준은 81.1%의 민감도를 보였으며, 두 기준 모두 약 98%[98]의 특이성을 보였다.El Escorial 기준은 임상시험을[99] 위해 환자 그룹을 표준화하도록 설계되었지만 임상 실무에서는 유용하지 않다. El Escorial 기준에 의해 설명되는 가능한 ALS는 거의 항상 임상적으로 [9]ALS이다.
차동 진단
ALS의 증상은 매우 다양하고 더 치료 가능한 질병이나 장애의 증상과 유사할 수 있기 때문에 다른 질환의 가능성을 배제하기 위해 적절한 검사를 실시해야 한다.이러한 테스트들 중 하나는 근육의 전기 활동을 감지하는 특별한 기록 기술인 근전도 검사이다.특정 EMG 소견은 ALS 진단을 지원할 수 있습니다.또 다른 일반적인 테스트는 신경 전도 속도(NCV)를 측정합니다.예를 들어 NCV 결과의 특정 이상은 ALS가 아닌 말초신경병증(말초신경 손상) 또는 근병증(근육 질환)의 형태를 가지고 있음을 시사할 수 있다.자기공명영상(MRI)은 종종 초기 ALS를 가진 사람들에게서 정상적이지만, 그것은 척수 종양, 다발성 경화증, 목의 탈장 디스크, 척수근증,[2][100] 또는 자궁경추척추증 등과 같은 증상을 일으킬 수 있는 다른 문제의 증거를 드러낼 수 있다.
의사는 환자의 증상과 검사 및 검사 결과를 바탕으로 혈액 및 소변 샘플에 대한 검사를 지시하여 다른 질병의 가능성을 제거할 수 있으며 정기적인 검사실 검사도 수행할 수 있습니다.예를 들어 의사가 ALS가 아닌 근질환이 있을 수 있다고 의심하는 경우 근육 생검이 [2]수행될 수 있습니다.
인간면역결핍바이러스(HIV), 인간T림프트로픽바이러스(HTLV), 라임병,[8] 매독을 포함한 많은 감염성 질환이 ALS와 유사한 증상을 [2]일으킬 수 있습니다.다발성 경화증, 폴리오 증후군, 다초점 운동 신경증, CIDP, 척추근위축증, 척수근위축증과 같은 신경학적 장애도 질병의 특정 측면을 모방할 수 있으므로 [2]고려되어야 한다.
ALS는 ALS 또는 그 변형과 유사한 증상 및 임상적 특징을 가질 수 있는 관련 [101]없는 질환인 "ALS 모방 증후군"과 구별되어야 한다.운동신경계 질환의 ALS 및 밀접하게 관련된 아형의 예후는 일반적으로 좋지 않기 때문에 신경학자는 다른 진단 가능성을 평가하고 제외하기 위해 조사를 수행할 수 있다.근력증(MG)과 램버트-이튼 근력증(Lambert-Eaton myasthenic) 증후군과 같은 신경근접점의 장애도 ALS를 모방할 수 있지만, 이는 시간이 [102][103]지남에 따라 진단상의 어려움을 거의 나타내지 않는다.양성유발증후군과 경련유발증후군도 간혹 ALS의 초기 증상 중 일부를 모방할 수 있다.그럼에도 불구하고, ALS와 함께 무자비하게 발달하는 다른 신경학적 특징이 없다는 것은 시간이 지남에 따라 그 구별이 경험이 많은 신경학자에게 어떠한 어려움도 주지 않는다는 것을 의미한다. 의심이 남는다면, EMG가 도움이 [104]될 수 있다.
그러나 대부분의 ALS 환자는 올바르게 진단되며, 대형 ALS 클리닉의 진단 오류율은 10% [105][106]미만이다.한 연구는 MND/ALS 진단 기준을 충족하는 190명을 조사했으며, 연구 프로토콜과 정기적인 모니터링을 모두 준수하는 실험실 연구를 보완했다.이들 중 30명(16%)은 임상 관찰 개발 [107]기간 동안 진단이 완전히 바뀌었다.같은 연구에서 3명이 ALS와 다른 신경계 질환을 모방할 수 있는 MG에 대한 잘못된 음성 진단을 받아 진단과 치료가 지연됐다.MG는 현저하게 치료가능하지만 ALS는 치료가능하지 않다.[108]
관리
ALS에는 [8]치료법이 없다.경영진은 삶의 질 향상과 생존 [8]연장을 목표로 증상 치료와 지원 케어 제공에 초점을 맞추고 있습니다.이 관리는 여러 분야의 의료 전문가 팀이 제공하는 것이 가장 좋습니다. 여러 분야의 ALS 클리닉에 참석하는 것은 생존 기간 연장, 입원 수 감소, 삶의 [4]질 향상과 관련이 있습니다.리루졸은 생존을 약 2~3개월 [5]연장한다.에다라본은 [109]ALS에 걸린 소수의 사람들의 기능 저하를 약간 늦춘다; 그것은 비싸고 삶의 [110]질을 떨어뜨릴 수 있는 매일 링거 주사를 맞아야 한다.다른 [111]증상들을 관리하기 위해 다른 약들이 사용될 수 있다.
비침습적 인공호흡(NIV)은 [9]ALS 호흡부전의 주요 치료법입니다.불바 기능이 정상인 사람의 경우, 그것은 생존을 약 7개월 연장하고 삶의 질을 향상시킵니다.한 연구는 NIV가 근기능이[112] 떨어지는 사람들에게 효과가 없는 반면, 다른 연구는 NIV가 약간의 [8]생존 이익을 제공할 수 있다는 것을 발견했다.ALS에 걸린 많은 사람들은 NIV를 [113]견디는데 어려움을 겪는다.NIV가 증상을 관리하기에 충분하지 않을 때 [4]침습적 인공호흡은 고도 ALS를 가진 사람들에게 선택 사항이다.침습적인 인공호흡이 생존을 연장하는 반면, 질병의 진행과 기능 저하가 [20]계속되고 있습니다.그것은 ALS 환자나 [21][20]간병인의 삶의 질을 떨어뜨릴 수 있다.침습성 [114]인공호흡은 북미나 유럽보다 일본에서 더 많이 사용되고 있다.
물리치료는 유산소,[111] 운동범위, 스트레칭 운동을 통해 기능적[115][116] 독립성을 촉진할 수 있다.직업 치료는 적응 장비를 [117]통해 일상생활 활동을 도울 수 있다.언어치료는 [116]말하는데 어려움을 겪는 ALS 환자들에게 도움을 줄 수 있다.ALS를 앓고 있는 사람들의 체중 감소와 영양실조를 예방하는 것은 생존과 [8]삶의 질을 향상시킨다.처음에, 삼키기 어려움(디스피지아)은 식생활 변화와 삼키기 기술로 관리할 수 있습니다.만약 ALS에 걸린 사람이 몸무게의 5% 이상을 줄이거나 [9]음식과 물을 안전하게 삼킬 수 없다면 영양 튜브를 고려해야 한다.공급 튜브는 일반적으로 경피 내시경 위루(PEG)를 통해 삽입됩니다.PEG 튜브가 [118]생존을 향상시킨다는 증거가 거의 없다.PEG 삽입은 보통 [21]삶의 질을 향상시키기 위해 수행됩니다.
완화의 치료는 누군가가 [119]ALS 진단을 받은 직후에 시작해야 한다.수명 만료 문제에 대한 논의는 ALS 환자가 수명 만료 관리에 대한 선호도를 되돌아볼 시간을 주고 원치 않는 개입이나 절차를 피하는 데 도움이 될 수 있다.호스피스 케어는 수명 말기에 증상 관리를 개선하고 평화로운 [21]죽음을 맞이할 가능성을 높일 수 있습니다.인생의 마지막 날에는 오피오이드가 통증과 호흡곤란을 치료하는데 사용되는 반면 벤조디아제핀은 [20]불안감을 치료하는데 사용될 수 있다.
약품
리루졸은 생존을 약 2~[120][5]3개월 정도 연장하는 것으로 밝혀졌다.그것은 불바온셋 [5]ALS를 가진 사람들에게 더 큰 생존 혜택을 줄 수 있다.그것은 시냅스 전 [9]뉴런에서 흥분성 신경전달물질 글루탐산염의 방출을 감소시킴으로써 작동할 수 있다.가장 흔한 부작용은 메스꺼움과 에너지 부족이다.[5]ALS를 앓고 있는 사람들은 [119]진단 후 가능한 한 빨리 리루졸 치료를 시작해야 한다.
에다라본은 초기 [f][g][109][122]ALS를 가진 소수의 사람들 집단에서 기능 저하를 다소 늦추는 것으로 나타났다.산화 [123]스트레스로부터 운동 뉴런을 보호함으로써 효과가 있을 수 있다.가장 흔한 부작용은 멍과 보행 [122]장애이다.에다라본을 사용한 치료는 비용이 많이 들고 2주 [110]동안 10일 동안 매일 1시간씩 링거를 맞아야 한다.
다른 약들은 피로를 줄이고, 근육 경련을 완화시키고, 경련을 조절하고, 과도한 침과 [111]가래를 줄이기 위해 사용될 수 있다.신경통에는 가바펜틴, 프레가발린, 그리고 삼환계 항우울제(예: 아미트리프틸린)가 사용될 수 있고, 비스테로이드성 항염증제(NSAIDs), 아세트아미노펜 및 오피오이드는 침습성 [14]통증에 사용될 수 있다.
우울증은 선택적 세로토닌 재흡수 억제제([9]SSRI) 또는 삼환식 항우울제로 치료될 수 있는 반면 벤조디아제핀은 불안에 [4]사용될 수 있다.인지 장애/전두엽 치매(FTD)를 치료하기 위한 약은 없지만, SSRI와 항정신병 약물들은 [9]FTD의 증상 중 일부를 치료하는데 도움을 줄 수 있다.바클로펜과 티자니딘은 경구용 약물로 경추내 바클로펜 펌프를 사용하여 [9]경련을 치료할 수 있습니다.아트로핀, 스코폴라민, 아미트리프틸린 또는 글리코피롤레이트는 ALS에 걸린 사람들이 침(시아로르헤아)[9]을 삼키는데 어려움을 겪을 때 처방될 수 있다.
2017년 리뷰에서는 [122]2016년부터 무작위 대조 실험을 통해 멕실레틴이 ALS의 경련 치료에 안전하고 효과적이라는 결론을 내렸다.2020년 연구에서 페닐부티르산나트륨과 타우루소디올의 조합인 AMX0035는 환자의 생존을 수개월 [124]연장하는 것으로 나타났다.2022년 3월, FDA의 독립 자문 위원회는 데이터가 [125]ALS의 진행 속도를 늦추는 것을 보여주기에 불충분하다고 6 대 4로 투표했다.
호흡 보조 장치
비침습적 인공호흡

비침습적 인공호흡(NIV)은 ALS의[9] 호흡부전에 대한 주요 치료법이며 생존과 [4]삶의 질을 향상시키는 것으로 나타난 최초의 치료법이었다.NIV는 인공호흡기에 연결된 얼굴 또는 코 마스크를 사용하여 간헐적인 양압을 제공하여 호흡을 지원합니다.지속적인 양압은 호흡을 [20]더 어렵게 만들기 때문에 ALS에 걸린 사람들에게는 권장되지 않는다.호흡 부전의 첫 번째 징후는 수면 중의 가스 교환 감소이기 때문에 처음에 NIV는 야간에만[4] 사용됩니다; 이 야간 저환기와 관련된 증상에는 중단되는 수면, 불안, 아침 두통, 그리고 주간 피로가 포함됩니다.이 병이 진행됨에 따라, ALS에 걸린 사람들은 누워 있을 때, 신체 활동이나 말을 할 때, 그리고 결국 숨을 [126]쉴 때 숨이 가빠진다.다른 증상으로는 집중력 저하, 기억력 저하, 혼란, 호흡기 감염, 약한 기침 등이 있다.호흡부전은 [4]ALS에서 가장 흔한 사망 원인이다.
호흡기 증상이 시작된 직후에 NIV를 시작하는 것은 생존율 증가와 관련이 있기 때문에 3개월마다 ALS를 가진 사람들의 호흡 기능을 관찰하는 것이 중요하다.이것은 ALS에 걸린 사람에게 호흡기 증상이 있는지 물어보고 그들의 [4]호흡 기능을 측정하는 것을 포함한다.가장 일반적으로 사용되는 측정은 수직 강제 활력소(FVC)이지만, 초기 호흡부전의 검출기가 부족하며, 마우스피스 주변의 밀폐를 유지하는 데 어려움을 겪기 때문에 구근 증상이 있는 사람에게는 좋은 선택이 아니다.사람이 등을 대고 누워 있는 동안 FVC를 측정하는 것은 [113]수직 FVC보다 횡격막 취약성의 더 정확한 측정이다.코 흡입 흡입 압력(SNIP)은 횡격막의 강도에 대한 빠르고 편리한 검사로, 구근 [20]약화의 영향을 받지 않습니다.만약 ALS에 걸린 사람이 호흡부전의 징후와 증상이 있다면, 그들은 저산소혈증(혈중 산소 부족)과 과모증(혈중 이산화탄소 과다)[20]을 찾기 위해 주간 혈액 가스[4] 분석을 받아야 한다.만약 그들의 주간 혈액 가스 분석이 정상이라면,[4] 그들은 수면 중에 저산소혈증을 찾기 위해 야간 맥박산소측정을 해야 한다.
비침습적 인공호흡은 리루졸보다 생존을 더 오래 연장한다.2006년 무작위 대조 실험에서는 NIV가 생존을 약 48일 연장하고 삶의 질을 향상시킨다는 것이 밝혀졌지만, 또한 ALS에 걸린 일부 사람들은 다른 사람들보다 이 개입으로부터 더 많은 혜택을 받는다는 것도 밝혀졌습니다.NIV는 정상 또는 중간 정도의 기능만 가진 사람들에게 생존을 약 7개월 연장하고 삶의 질을 크게 향상시킨다.NIV는 비록 수면과 관련된 [112]증상들을 개선시키기는 하지만, 불구 기능이 좋지 않은 사람들에게 생존을 연장하지도 않고 삶의 질을 향상시키지도 않는다.NIV의 분명한 이점에도 불구하고, ALS를 가진 모든 사람들의 약 25-30%가 그것을 참을 수 없으며, 특히 인지장애나 [113]구근기능장애를 가진 사람들은 그러하다.2015년 대규모 코호트 연구 결과에 따르면 NIV는 대퇴부 허약 환자의 생존을 연장할 수 있으므로 모든 ALS 환자에게 NIV를 제공해야 한다.[8]
침습적 인공호흡
침습적 인공호흡은 기관 절개(기관절개)를 하고 인공호흡기에 연결된 [20]튜브를 삽입하여 코와 입(상부 기도)을 우회합니다.NIV를 지속적으로 [4]사용했음에도 불구하고 호흡기 증상이 제대로 관리되지 않는 고도 ALS를 가진 사람들을 위한 옵션이다.침습적 인공호흡은 특히 60세 미만의 사람들에게 생존을 연장시키지만, 근본적인 신경 퇴행성 과정을 치료하지는 않습니다.ALS를 앓고 있는 사람은 운동기능을 계속 상실하여 의사소통이 점점 더 어려워지고 때로는 눈의 [20]근육을 제외하고는 완전히 마비되는 록인 증후군으로 이어질 것이다.침습성 인공호흡을 선택한 ALS 환자 중 절반 가량은 삶의 질이[21] 떨어졌다고 보고하지만 대부분은 여전히 만족스러운 것으로 간주한다.그러나 침습적 인공호흡은 간병인에게 큰 부담을 주고 삶의 [20]질을 떨어뜨릴 수 있다.침습성 인공호흡에 대한 태도는 나라마다 다르다.일본 ALS 환자의 약 30%가 침습성 인공호흡을 선택하고 있는 반면, 북미와 유럽은 5%[114] 미만이다.
테라피
물리치료는 ALS 환자의 재활에 큰 역할을 한다.구체적으로는 물리치료사, 직업치료사, 언어치료사는 체력의 저하를 늦추고 지구력을 유지하며 통증을 제한하고 말과 삼키기를 개선하며 합병증을 예방하고 기능적 [115][116]독립성을 촉진함으로써 ALS에 걸린 개개인의 목표를 설정하고 이익을 증진시킬 수 있다.
작업치료와 보조기술과 같은 특수장비는 또한 [117]ALS 과정을 통해 사람들의 독립성과 안전을 높일 수 있다.일상생활, 걷기, 수영, 정지자전거와 같은 부드럽고 영향이 적은 유산소 운동은 영향을 받지 않는 근육을 강화시키고 심혈관 건강을 증진시키며 피로와 우울증을 퇴치하는데 도움을 줄 수 있다.운동 범위와 스트레칭 운동은 고통스러운 경련과 근육의 수축(수축)을 예방하는 데 도움을 줄 수 있다.물리치료사들과 작업치료사들은 근육의 피로가 [111]ALS에 걸린 사람들에게 도움을 주기 보다는 ALS와 관련된 증상의 악화로 이어질 수 있기 때문에 근육을 혹사시키지 않고 이러한 이점을 제공하는 운동을 추천할 수 있다.이들은 램프, 교정기, 보행기, 욕실 장비(샤워 의자, 화장실 라이저 등) 및 휠체어 등의 이동성을 유지할 수 있는 장치를 제안할 수 있다.작업 치료사는 ALS 환자가 일상생활에서 가능한 [117]한 많은 안전과 독립성을 유지할 수 있도록 장비와 적응을 제공하거나 권장할 수 있다.호흡부전이 사망의 주요 원인이기 때문에 물리치료사들은 폐 물리치료를 시행함으로써 ALS 환자의 호흡 결과를 개선하는 데 도움을 줄 수 있다.여기에는 호흡근육 강화와 생존율 [127]향상을 목적으로 하는 흡기근육 훈련, 폐량 보충 훈련, 수동 보조 기침 요법이 포함됩니다.
말하거나 삼키는데 어려움을 겪는 ALS 환자들은 언어 [116]병리학자와 함께 일하는 것이 도움이 될 수 있다.이러한 건강 전문가들은 사람들이 더 크고 명확하게 말할 수 있도록 돕는 기술과 같은 적응 전략을 가르칠 수 있다.ALS가 진행됨에 따라 음성 언어 병리학자는 음성 증폭기, 음성 생성 장치(또는 음성 출력 통신 장치) 또는 헤드 마운트 레이저 포인터, 알파벳 보드 또는 예/[116]아니오 신호와 같은 저기술 통신 기술의 사용을 권장할 수 있다.
2022년에 발표된 연구에서, 완전히 잠긴 ALS 환자는 2020년에 운동 피질에 64비트 뇌 이식 마이크로어레이 두 개를 장착했습니다.그는 자신의 의도적인 신경 발화 속도에서 나오는 청각적 피드백을 이용하여 문구를 형성하기 위해 글자를 전달할 수 있었다.이것은 완전히 잠긴 ALS [128][129]환자와의 긴 의사소통의 첫 번째 예입니다.
영양

ALS를 앓고 있는 사람들의 체중 감소와 영양실조를 예방하는 것은 생존과 [8]삶의 질을 향상시킨다.ALS의 체중 감소는 운동 뉴런의 죽음, 휴식 에너지 지출 증가, 그리고 음식 섭취 감소로 인한 근육 소모에 의해 야기된다.삼키기 어려움(디스피지아)은 ALS가 있는 사람들의 약 85%에서 발병하며 영양실조와 [20]체중감소로 이어지는 음식 섭취 감소의 주요 원인이다.ALS에 [4]걸린 사람들의 몸무게와 삼키는 능력을 정기적으로 평가하는 것이 중요하다.처음에는 식생활 변화와 수정된 삼키기 기술에 [9]의해 소화불량을 관리할 수 있다.액체를 삼키는 어려움은 보통 먼저 발생하며 과일 과즙이나 스무디 같은 진한 액체로 바꾸거나 물이나 커피와 같은 얇은 액체에 액체 증점제를 첨가함으로써 관리할 수 있습니다.ALS를 앓고 있는 사람들은 건조하고 푸석푸석하거나 쫄깃한 [126]음식보다 삼키기 쉬운 부드럽고 촉촉한 음식을 먹어야 한다.그들은 또한 삼키는 동안 적절한 머리 자세에 대해 가르쳐야 하는데, 이것은 삼키는 것을 [9]더 쉽게 만들 수 있습니다.고열량 식단이 추가적인 체중 감량을 막고 [122]생존을 향상시킬 수 있다는 잠정적인 증거가 있다.
만약 ALS에 걸린 사람이 몸무게의 5% 이상을 줄이거나 [9]음식과 물을 안전하게 삼킬 수 없다면 영양 튜브를 고려해야 한다.이것은 복부 벽을 통해 위쪽으로 튜브가 들어가는 위식도관이나 코를 통해 식도를 따라 [20]위쪽으로 튜브가 들어가는 비위관 등의 형태를 취할 수 있다.위루관은 불편하고 식도 [20]궤양을 일으킬 수 있는 비복관보다 장기 사용에[4] 더 적합합니다.공급 튜브는 일반적으로 경피 내시경 위루(PEG)를 통해 삽입됩니다.낮은 활력소는 합병증의 높은 위험과 관련될 수 있으므로, 활력소가 예상치의 50% 이하로 떨어지기 전에 PEG 튜브를 삽입해야 한다는 증거가 있다.그러나 2015년 대규모 연구에 따르면 PEG 삽입은 시술 [122]중 NIV에 있는 한 ALS가 발달하고 활력소가 낮은 사람에게 안전하다.
PEG 튜브가 [118]생존을 향상시킨다는 증거가 거의 없다.PEG 삽입은 보통 영양과 약물 [4]섭취를 유지함으로써 삶의[21] 질을 향상시키려는 목적으로 수행됩니다.이것은 체중 감소와 탈수의 위험을 줄이고, 연장된[21] 식사 시간과 감소된 경구 음식 섭취로 인한 [4]불안감을 줄일 수 있습니다.
단종 케어
근본적인 질병을 치료하지 않고 증상을 완화시키고 삶의 질을 향상시키는 완화의 치료는 누군가가 [119]ALS 진단을 받은 직후에 시작해야 한다.수명 만료 문제에 대한 조기 논의는 ALS 환자가 수명 만료 관리에 대한 선호도를 되돌아볼 시간을 제공하고 원치 않는 개입이나 절차를 [21]피하는 데 도움이 될 수 있다.다양한 수명 연장 조치의 모든 측면에 대해 완전히 알게 되면 비침습적 인공호흡, 침습적 인공호흡 및 영양공급 [122]튜브에 대한 태도를 나타내는 사전 지침을 작성할 수 있습니다.질병 과정 후반기에 근육 약화(디사르트리아)와 인지 기능 장애로 인한 말하기 어려움은 치료에 [9]대한 그들의 희망을 전달하는 능력을 손상시킬 수 있다.ALS 환자의 선호도를 지속적으로 요청하지 않으면 침습적 인공호흡과 같은 계획되지 않은 잠재적으로 원하지 않는 응급 개입이 발생할 수 있다.ALS 환자나 그 가족이 수명이 다한 문제에 대해 논의하기를 꺼리는 경우, 위루절제술이나 비침습적 인공호흡의 도입을 그 [21]주제를 언급하는 기회로 사용하는 것이 유용할 수 있다.
호스피스 케어, 즉 수명을 다한 완화의 케어는 ALS에서 특히 중요하다. 왜냐하면 그것은 증상의 관리를 최적화하고 평화로운 [21]죽음을 맞이할 가능성을 증가시키기 때문이다.ALS에서 수명 종료 단계가 언제 시작되는지는 정확히 알 수 없지만, 이는 이동, 통신,[9] 경우에 따라서는 사고와 큰 어려움과 관련이 있습니다.ALS를 앓고 있는 많은 사람들이 질식사([21]흡식사)를 두려워하지만, 이런 일이 거의 일어나지 않는다는 것을 안심할 수 있다.약 90%의 ALS 환자가 [130]평화롭게 죽는다.인생의 마지막 날에는 오피오이드가 통증과 호흡곤란을 치료하는데 사용되는 반면 벤조디아제핀은 [20]불안감을 치료하는데 사용될 수 있다.
역학
ALS는 성인에게 가장 흔한 운동신경계 질환이며 알츠하이머와 파킨슨병 [131]다음으로 세 번째로 흔한 신경변성[28] 질환이다.전 세계적으로 매년 ALS에 걸리는 사람은 10만명당 1.9명,[132] ALS에 걸리는 사람은 10만명당 4.5명 정도로 추산된다.유럽에서 연간 신규 환자 수는 100,000명당 약 2.6명이고, 영향을 받는 숫자는 100,[7]000명당 7-9명이다.ALS 발병의 평생 위험은 유럽 남성의 경우 1:350, 유럽 여성의 경우 1:400이다.척수성 ALS는 주로 [23]여성보다 남성에게서 더 흔하기 때문에 남성이 더 높은 위험을 가지고 있다.2015년 미국에서 ALS 환자는 10만명당 5.2명으로 백인, 남성, 60세 [24]이상에서 더 많았다.동아시아에서는 연간 10만명당 0.8명, 남아시아에서는 연간 10만명당 0.7명꼴이다.ALS 역학 연구의 약 80%가 유럽과 미국에서 수행되었으며, 주로 북유럽 [9]혈통의 사람들에게서 이루어졌다.아프리카, 아시아, 인도, 러시아,[23] 남아메리카를 포함한 세계의 많은 지역에서 ALS의 비율을 결정하기 위한 충분한 정보가 없다.서태평양에는 괌, 일본 기이 반도, 서뉴기니 등 ALS 발병률이 세계 다른 지역보다 50-100배 높은 것으로 보고된 여러 지리적 클러스터가 있다.이 [1]지역에서의 발병률은 1960년대 이후로 감소하였다; 원인은 아직 알려지지 않았다.[23]
모든 인종과 인종적 배경의 사람들이 [24]ALS의 영향을 받을 수 있지만, 그것은 아프리카인, 아시아인,[133] 또는 히스패닉계보다 백인에게 더 흔하다.2015년 미국에서 백인 ALS 유병률은 10만명당 5.4명이었고, 흑인 유병률은 10만명당 2.3명이었다.미국 인구 조사 지역 중 중서부가 인구 10만명당 5.5명으로 가장 높았고, 북동부(5.1명), 남부(4.7명), 서부(4.4명) 순이었다.중서부와 북동부는 남부와 [24]서부보다 백인의 비율이 높기 때문에 ALS의 유병률이 더 높았다.인종적으로 혼혈인구는 ALS에 걸릴 위험이 낮을 수 있다; 쿠바의 한 연구는 혼혈인 사람들이 백인이나 [134]흑인보다 ALS로 사망할 확률이 낮다는 것을 발견했다.ALS의 유전적 차이도 있습니다. 유럽에서 가장 흔한 ALS 유전자는 C9orf72이고, SOD1, TARDBP, FUS이고,[135] 아시아에서 가장 흔한 ALS 유전자는 SOD1, FUS, C9orf72 그리고 TARBP입니다.

ALS는 어떤 [41]연령에서도 사람에게 영향을 미칠 수 있지만, 최고 발병률은 50세에서 75세[8] 사이이며 80세 [3]이후에는 급격히 감소한다.고령자의 발병률이 감소하는 이유는 불명확하다.한 가지 생각은 80대까지 살아남은 사람들이 유전적으로 ALS에 걸리기 쉽지는 않을 수도 있다는 것이다; 그렇지 않으면, 노인들의 ALS는 동반 질환, 신경과 전문의의 진찰을 받기 어렵거나 공격적인 형태의 [134]ALS로 인해 빠르게 사망할 수도 있다.2015년 미국에서 가장 낮은 유병률은 18-39세였고, 가장 높은 유병률은 70-79세였다.[24]산발성 ALS는 보통 58세에서 63세 사이에 시작되지만 가족성 ALS는 보통 47세에서 52세 [3]사이에 더 일찍 시작됩니다.전 세계 ALS 환자 수는 2015년 222,801명에서 2040년 376,674명으로 69% 증가할 것으로 예상된다.이는 세계 인구의 고령화, 특히 개발도상국의 [133]고령화에 크게 기인할 것이다.
역사
그 질병에 대한 설명은 찰스 [25]벨에 의해 적어도 1824년까지 거슬러 올라간다.1850년 프랑수아 아밀카르 아란은 "진행성 근위축증"이라는 이름의 질환을 최초로 설명했는데, 이는 하부 운동 신경세포만 영향을 [136]받는 ALS의 한 형태이다.1869년, 증상과 근본적인 신경학적 문제 사이의 연관성은 장 마르탱 샤르코에 의해 처음 설명되었고, 그는 1874년 [25]논문에서 근위축성 측삭경화증이라는 용어를 처음 도입했습니다.ALS의 지역적 변형인 Flail Arm Syndrome은 1886년 Alfred Vulpian에 의해 처음 기술되었다.ALS의 또 다른 지역 변종인 플레일 다리 증후군은 [137]1918년 피에르 마리와 그의 학생 패트리키오스에 의해 처음 묘사되었다.
1945년, 미국 해군 의사들은 ALS가 다른 나라들보다 괌의 차모로 사람들 사이에서 100배 더 많이 발생했다고 보고했다.1956년 괌 고유의 ALS 변종은 파킨슨병과 유사한 증상을 동반하는 ALS의 전형적인 증상을 가지고 있었기 때문에 "근위축성 측색 경화증/파킨슨증 치매 복합체"(ALS/PDC)로 명명되었다. 현지 언어로 이름은 리코보디병이다.수많은 유전자 및 환경 연구에도 불구하고 ALS/PDC의 원인은 아직 밝혀지지 않았다.1950년대 초에 정점을 찍은 후 꾸준히 감소했으며 1985년에는 [138]괌의 ALS/PDC 발생률이 세계 다른 지역과 거의 같았다.
ALS와 관련된 첫 번째 유전자는 [28]1993년에 확인된 SOD1이었다.이것은 1994년 [29]ALS의 첫 번째 동물 모델인 트랜스제닉 SOD1 마우스의 개발로 이어졌다.1995년 12월, 리루졸은 ALS에 대한 최초의 FDA 승인 약이 되었다.그 후 1996년 유럽,[110] 1998년 일본에서 승인되었다.1996년에 ALS 기능 평가 척도(ALS Functional Rating Scale, ALSFRS)가 처음 발표되었습니다. ALS에 걸린 사람들이 일상 생활을 [139]할 수 있는 능력을 측정하는 10개 항목 설문지였습니다.1999년에는 호흡기 증상에 무게를 두기 위해 척도를 변경했다.결과 ALS 기능 평가 척도 - 개정(ALSFRS-R)은 호흡에 대한 단일 질문을 호흡곤란, 직립 호흡부전,[140] 호흡부전에 대한 각 질문으로 대체하는 12개 항목 질문이다.
2006년, 단백질 TDP-43이 ALS와 전두엽 치매(FTD) 모두에서 볼 수 있는 포섭체의 주요 성분이라는 것이 밝혀졌으며, 이는 ALS와 FTD가 일반적인 질병 스펙트럼의 일부라는 증거를 제공했다.이 때문에 2008년 TDP-43을 코드하는 유전자 TARDBP의 돌연변이가 가족성 [28]ALS의 원인이라는 사실이 밝혀졌다.2011년에는 C9orf72의 비부호 반복 확장이 ALS와 [9]FTD의 주요 원인으로 밝혀졌다.에다라본은 2015년 일본과 한국에서, 2017년 [123]미국에서 ALS 치료를 승인받았다.2017년 현재[update] [122]유럽에서는 ALS 치료가 승인되지 않았습니다.
진단 기준
1950년대에 임상적으로 의심되는 ALS를 평가하기 위해 전기 진단 테스트(EMG 및 NCV)가 사용되기 시작했다.1969년 Edward H. Lambert는 ALS에 대한 첫 번째 EMG/NCS 진단 기준을 발표했으며,[141] 진단을 강력하게 뒷받침하는 4가지 발견으로 구성되었다.1990년 세계신경학연맹(WFN)은 스페인 엘 에스코리알에서 회의를 열어 임상시험 표준화에 도움이 되는 ALS의 정확한 진단 기준을 마련했습니다. 그 결과 "엘 에스코리알" 기준은 1994년에 [142]발표되었습니다.1998년, WFN은 버지니아 워런턴의 에어리 하우스에서 기준을 개정하기 위해 다시 회의를 열었고, 그 결과 "에일리 하우스" 또는 "엘 에스코리얼 개정" 기준은 [143]2000년에 발표되었다.2006년에는 일본 아와지섬에서 EMG 및 NCV 테스트를 사용하여 ALS를 조기에 진단하는 방법을 논의하는 회의가 개최되어 2008년에 "[97]Awji" 기준이 발표되었습니다.
이름.
근위축은 그리스어에서 왔다: a-는 "아니오"를 의미하고, myo는 "근육"을 의미하며, trop means는 "영양"을 의미한다.그러므로 근위축증은 "근육 영양실조"[145] 또는 근육조직의 [146]소모를 의미한다.측방향은 사람의 척수에서 근육을 제어하는 운동 신경세포가 있는 부위를 식별합니다.경화증은 "흔들림" 또는 "경화"를 의미하며 [145]척수에 있는 운동 뉴런의 죽음을 의미한다.
ALS는 때때로 샤르코트병으로 언급된다(샤르코트-마리-와 혼동하지 말 것).치아 질환과 샤르코 관절 질환). 왜냐하면 장 마르탱 샤르코가 [147]부검에서 볼 수 있는 병리와 임상 증상을 연관시킨 첫 번째 사람이었기 때문이다.영국의 신경학자 러셀 브레인(Russell Brain)은 1933년 ALS, 진행성 구근성 마비, 진행성 근위축이 모두 같은 [148]질병의 다른 형태이며 뉴론은 역사적으로 잘못된 형태의 [149]뉴런이라는 그의 믿음을 반영하기 위해 운동 뉴론병이라는 용어를 만들었다.일부 국가, 특히 미국에서 ALS는 1938년 [150]ALS를 개발한 미국 야구 선수 루게릭의 이름을 따서 루게릭병이라고 불린다[144].
미국과 유럽 대륙에서 ALS라는 용어는 "고전적" ALS, 진행성 구근성 마비, 진행성 근위축증,[151][38] 그리고 원발성 측삭경화증을 포함한 모든 형태의 질병을 가리킵니다.영국과 호주에서 운동신경계 질환이라는 용어는 질병의 모든 형태를 가리키는 반면 ALS는 상부와 하부의 운동신경계에 [151]관여하는 형태를 의미하는 "고전적" ALS만을 지칭한다.
사회와 문화
2014년 8월, 일반적으로 "ALS Ice Bucket Challenge"[152]로 알려진 챌린지가 온라인에서 널리 퍼졌다.참가자들은 얼음과 물이 가득 담긴 양동이를 채우고, 누가 도전을 하도록 그들을 지명했는지, 그리고 그들이 선택한 다른 세 명의 참가자를 지명합니다.그리고 나서 참가자들은 얼음과 물을 그들 자신에게 쏟는다.하지만 다른 순서로 할 수도 있습니다.그 후 참가자들은 ALS 협회, ALS 치료 개발 연구소, 캐나다 ALS 협회 또는 영국 모터 뉴론 질병 협회의 ALS 연구에 최소 10달러(또는 현지 통화로 비슷한 금액)를 기부한다.얼음과 물을 버리는 것을 거부하는 참가자들은 ALS 연구에 최소 100달러를 기부할 것으로 예상된다.2015년 7월[update] 현재 아이스 버킷 챌린지는 ALS 협회를 [153]위해 1억1500만 달러를 모금했다.많은 연예인들이 이 [154]도전에 참여했다.아이스 버킷 챌린지는 NEK1 유전자가 [155][156]ALS 개발에 잠재적으로 기여할 수 있다는 발견에 기여하는 기금을 모으는 데 도움을 준 것으로 인정받았다.
조사.
모델 유기체
사카로미세스 세레비시아에(효모의 [93]일종), 케노하브디티스 엘레강스(회충), 드로소필라 멜라노가스터(제브라피쉬), 다니오 레리오(제브라피쉬), 무스 근육(집쥐), 라투스 노르베기쿠스(쥐)[8]를 포함한 많은 다른 유기체가 ALS 연구의 모델로 사용됩니다.이 모델들 중 어느 것도 인간의 ALS를 완벽하게 나타내지는 않는데, 부분적으로는 대부분의 동물 모델이 유전자 과잉 발현에 기초하고 있기 때문이다. 이는 돌연변이 인간 유전자의 여러 복사본이 유전자 변형 모델에 삽입된다는 것을 의미하며, 부분적으로는 인간의 신경계가 다른 [9]동물들과 매우 다르기 때문이다.
ALS의 첫 번째 동물 모델은 1994년에 개발된 SOD1G93A 트랜스제닉 [h]마우스였다.그것은 돌연변이 인간 SOD1[157] 유전자의 약 20-24개의 복사본을 나타내며 [158]ALS에서 볼 수 있는 임상 및 병리학적 발견의 대부분을 재현한다.현재 20개 이상의 다른 SOD1 마우스 모델이 있지만G93A SOD1 모델은 가장 널리 사용되는 SOD1 마우스[157] 모델이자 전체적으로 [29]가장 널리 사용되는 ALS 마우스 모델입니다.현재 ALS 병태생리학에 대한 많은 이해는 돌연변이 SOD1,[157] 특히 SOD1G93A [29]생쥐를 과도하게 발현시키는 마우스 모델을 연구한 것에서 비롯되었다.그러나 SOD1G93A 유전자 변환 생쥐에서 효과가 있는 것으로 나타난 많은 약물 표적은 인간 임상 시험에서 실패했다. 다른 SOD1 모델에서도 유사한 [157]문제가 있었다.이러한 약물의 대부분은 설치류 SOD1 모델에서 단일 연구를 기반으로 잠재적으로 효과적인 것으로 확인되었으며, 그 후 주로 산발성 [93]ALS가 있는 환자의 임상 시험에서 실패했다.이러한 임상시험은 SOD1 돌연변이가 전체 ALS[157] 사례의 2%만을 차지하고 SOD1 ALS의 병리가 다른 모든 유형의 ALS와 구별되는 것으로 생각되기 때문에 실패한 것으로 생각된다. 이는 [28]ALS의 거의 다른 모든 사례에서 볼 수 있는 TDP-43 단백질 또는 FUS 단백질의 비정상적인 집적이 결여되어 있다.
2018년 현재[update] TARDBP 마우스 모델은 약 20개, FUS 마우스 모델은 12개, C9orf72, PFN1, UBQ는 다수 존재한다.LN2 마우스 모델바이러스가 돌연변이 유전자를 동물 모델에 전달하기 위해 사용되는 바이러스 형질전환과 동물 모델에 여러 개의 돌연변이 유전자를 제공하기 위해 사용될 수 있는 CRISPR/Cas9을 포함한 동물 모델을 개발하는 새로운 방법도 있다.이 두 가지 방법 모두 유전공학 쥐의 전통적인 방법보다 빠르고 저렴합니다; 그것들은 또한 과학자들이 다른 유전적 배경을 가진 쥐의 돌연변이의 영향을 연구할 수 있게 합니다, 이것은 인간에게서 [29]보여지는 유전적 다양성을 더 잘 나타냅니다.
ALS를 연구하는데 사용되는 세포 모델에는 배양 중인 효모 사카로미세스 세레비시아와 쥐 또는 쥐의 운동 뉴런이 포함됩니다.작은 동물 모델로는 초파리, 회충 C. 엘레건스, 제브라피쉬가 있다.세 가지 중에서 초파리는 가장 널리 사용된다; 초파리는 빠른 수명, 짧은 수명, 정교한 신경계, 그리고 이용 가능한 많은 유전적인 도구들을 가지고 있다.C. 엘레강스는 짧은 수명을 가지고 있고, 유전적으로 조작하기 쉬우며, 단순하지만 잘 이해되는 신경계를 가지고 있습니다.제브라피쉬는 DNA나 RNA를 주입할 수 있는 투명한 배아를 가지고 있으며 수명은 최대 2년이다.[93]유도만능줄기세포(iPSC)는 피부섬유아세포를 [8]운동뉴런으로 변환하는데 사용될 수 있다.이제 ALS를 가진 사람으로부터 iPSC를 생성할 수 있으며, 이는 척추 운동 뉴런으로 전환될 수 있으며, 이는 질병 메커니즘을 연구하고 [94]ALS의 잠재적 약물을 테스트하는데 유용하다.iPSC는 산발적인 ALS를 모델링할 수 있게 하는데, 이것은 동물 [93]모델로는 할 수 없다.
치료법
1960년대부터 2014년까지 약 50개의 ALS 약물이 무작위 대조 시험(RCTs)[i]에서 테스트되었으며, 이 중 리루졸만이 생존 개선에 약간의 이점을 보였다.인체 임상시험에서 테스트되고 효과가 없는 약물은 항바이러스제, 항 들뜸독성제, 성장인자, 신경영양인자, 항염증제, 항산화제, 항아포토시스제 및 미토콘드리아 [159]기능을 향상시키는 약물을 포함한다.
2004년부터 2014년 사이에 실패한 23개의 대규모 단계 II 및 단계 III RCT를 분석한 결과, 성공을 거두지 못한 여러 가지 잠재적 이유가 있다고 결론지었다.인간에 대한 이러한 실험은 산발성 ALS에 대한 좋은 동물 모델이 아닌 SOD1 형질전환 생쥐의 양성 결과에 기초하여 진행되었습니다.또한, 대부분의 임상 전 연구에서 SOD1 생쥐에 약물을 투여했다. 이는 증상이 시작된 후 치료를 시작하는 ALS 환자에게 결과를 적용할 가능성을 낮춘다.인간의 소규모 단계 II 연구에서 양성 결과는 또한 오해를 불러일으킬 수 있으며 단계 III 시험에서 실패로 이어질 수 있다.다른 잠재적 문제로는 중추신경계에서 의도된 작용 부위에 도달하지 못한 약물 및 연구 약물과 릴루졸 [159]사이의 약물 상호작용이 있었다.
반복적인 경두개 자기 자극은 ALS에서 작고 제대로 설계되지 않은 임상 시험에서 연구되었다. 2013년 현재[update], rTMS가 [160]ALS에 안전한지 또는 효과적인지를 알기에는 증거가 불충분했다.2016년 줄기세포 치료 실험의 한 리뷰는 척수 내 줄기세포 이식이 비교적 안전하고 [161]효과적일 수 있다는 잠정적인 증거를 발견했다.세포 기반 치료법에 대한 2019년 코크란 리뷰에서는 [162]효능에 대해 추측할 수 있는 충분한 증거가 없는 것으로 나타났다.마시티닙은 유럽과 미국에서 고아 약물로 승인되었으며 2016년 [163]현재[update] 연구가 진행 중이다.베타 아드레날린 작용제는 근육 성장과 신경 보호에 대한 치료제로 제안되었지만,[164] 인체 연구는 그 효능을 판단하기에 불충분하다.
원인
TDP-43, FUS 및 C9orf72가 ALS뿐만 아니라 이와 관련된 형태의 전두엽 치매(FTD/[165][166]ALS)를 유발할 수 있다는 발견과 함께, 이러한 돌연변이가 어떻게 질병을 야기하는지, 그리고 다른 단백질 기능 장애가 중요할 수 있는지를 이해하려는 집중적인 노력이 있었다.2013년 현재[update] FUS 단백질의 아르기닌 잔류물의 메틸화 차이가 관련이 있을 수 있으며, 메틸화 상태는 FTD의 일부 형태를 [167]ALS와 구별하는 방법일 수 있다.
「 」를 참조해 주세요.
메모들
- ^ 전통적으로 신경근육 질환으로 여겨졌던 ALS는 전두엽성 [8][9]치매와 중복되기 때문에 현재 신경변성 질환으로 여겨지고 있다.
- ^ 후레일 팔 증후군의 추가 이름으로는 ALS의 견갑골형, 벌피안-베르나르 증후군, 매달린 팔 증후군, 신경 유전자 맨-인-어-배럴 [22]증후군이 있다.
- ^ 양쪽 다리(양쪽 원위부 개입)를 수반하는 후레일 다리 증후군의 추가 이름으로는 의사다발신경계 ALS, 패트리키오스 증후군, 마리-파트리키오스 ALS 및 ALS의 [22]경막 형태가 포함된다.
- ^ 한 코호트 연구에 따르면 ALS 환자 중 11.5%가 [40]안구외근육기능장애를 앓고 있다.
- ^ 2013년, NFL은 뇌진탕과 관련된 부상과 [81]질병에 대해 5천 명 이상의 전직 NFL 선수들에게 보상하기로 7억 6천 5백만 달러의 합의에 도달했다.법적 합의와 관련된 일부 NFL 선수들은 NFL이 선수들을 돕기 위해 충분한 노력을 하지 않고 있다고 불평했다.이 사건의 판사는 이에 동의했고, 2015년 NFL은 ALS, 파킨슨병, 알츠하이머병 또는 [82]치매로 판명된 선수들에 대해 무제한 손해배상을 하기로 합의했다.
- ^ 기준은 "ALSFRS-R의 모든 12개 항목에서 최소 2점, 강제 활력 80% 이상, 수정된 El Escorial 기준에 따른 확정 또는 개연성 ALS, 2년 이하의 [109]질병 지속 기간"이다.
- ^ 인구 기반 ALS 등록에 따르면 ALS 환자 중 [121]이 기준을 충족하는 사람은 7% 미만인 것으로 추정된다.
- ^ "G93A"는 SOD1 단백질의 93번째 아미노산 잔기가 글리신에서 알라닌으로 변경되었음을 의미한다.
- ^ 전체 목록은 근위축성 측삭경화증 연구#과거 임상시험을 참조하십시오.
레퍼런스
- ^ a b Wijesekera LC, Leigh PN (February 2009). "Amyotrophic lateral sclerosis". Orphanet Journal of Rare Diseases. 4 (4): 3. doi:10.1186/1750-1172-4-3. PMC 2656493. PMID 19192301.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z "Amyotrophic Lateral Sclerosis (ALS) Fact Sheet National Institute of Neurological Disorders and Stroke". www.ninds.nih.gov. Archived from the original on 5 January 2017. Retrieved 22 October 2020.
- ^ a b c d e f g h i j k Kiernan MC, Vucic S, Cheah BC, Turner MR, Eisen A, Hardiman O, Burrell JR, Zoing MC (March 2011). "Amyotrophic lateral sclerosis". Lancet. 377 (9769): 942–955. doi:10.1016/s0140-6736(10)61156-7. PMID 21296405.
- ^ a b c d e f g h i j k l m n o p q r s t u v w Hobson EV, McDermott CJ (September 2016). "Supportive and symptomatic management of amyotrophic lateral sclerosis" (PDF). Nature Reviews. Neurology. 12 (9): 526–438. doi:10.1038/nrneurol.2016.111. PMID 27514291. S2CID 8547381. Archived (PDF) from the original on 1 December 2020. Retrieved 20 December 2019.
- ^ a b c d e f g Miller RG, Mitchell JD, Moore DH (March 2012). "Riluzole for amyotrophic lateral sclerosis (ALS)/motor neuron disease (MND)". The Cochrane Database of Systematic Reviews. 3 (3): CD001447. doi:10.1002/14651858.CD001447.pub3. PMC 7055506. PMID 22419278.
- ^ "FDA approves drug to treat ALS". U.S. Food and Drug Administration. 5 May 2017. Archived from the original on 8 May 2017.
- ^ a b c Hardiman O, Al-Chalabi A, Brayne C, Beghi E, van den Berg LH, Chio A, Martin S, Logroscino G, Rooney J (July 2017). "The changing picture of amyotrophic lateral sclerosis: lessons from European registers". Journal of Neurology, Neurosurgery, and Psychiatry. 88 (7): 557–563. doi:10.1136/jnnp-2016-314495. PMID 28285264. S2CID 52871105. Archived from the original on 21 December 2019. Retrieved 22 August 2018.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x van Es MA, Hardiman O, Chio A, Al-Chalabi A, Pasterkamp RJ, Veldink JH, van den Berg LH (November 2017). "Amyotrophic lateral sclerosis". Lancet. 390 (10107): 2084–2098. doi:10.1016/S0140-6736(17)31287-4. PMID 28552366. S2CID 24483077.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab Hardiman O, Al-Chalabi A, Chio A, Corr EM, Logroscino G, Robberecht W, et al. (October 2017). "Amyotrophic lateral sclerosis" (PDF). Nature Reviews. Disease Primers. 3 (17071): 17071. doi:10.1038/nrdp.2017.71. PMID 28980624. S2CID 1002680. Archived (PDF) from the original on 1 December 2020. Retrieved 20 December 2019.
- ^ a b c d "Motor neurone disease – NHS". nhs.uk. 15 January 2018. Archived from the original on 29 December 2014. Retrieved 24 October 2020.
- ^ Healthdirect Australia (17 April 2020). "Motor neurone disease (MND)". www.healthdirect.gov.au. Archived from the original on 26 October 2020. Retrieved 24 October 2020.
- ^ Zucchi E, Bonetto V, Sorarù G, Martinelli I, Parchi P, Liguori R, Mandrioli J (October 2020). "Neurofilaments in motor neuron disorders: towards promising diagnostic and prognostic biomarkers". Molecular Neurodegeneration. 15 (1): 58. doi:10.1186/s13024-020-00406-3. PMC 7559190. PMID 33059698. S2CID 222385359.
- ^ "Motor Neuron Diseases Fact Sheet National Institute of Neurological Disorders and Stroke". www.ninds.nih.gov. Archived from the original on 10 October 2020. Retrieved 27 October 2020.
- ^ a b c Chiò A, Mora G, Lauria G (February 2017). "Pain in amyotrophic lateral sclerosis". The Lancet. Neurology. 16 (2): 144–157. arXiv:1607.02870. doi:10.1016/S1474-4422(16)30358-1. PMID 27964824. S2CID 38905437.
- ^ Hilton JB, White AR, Crouch PJ (May 2015). "Metal-deficient SOD1 in amyotrophic lateral sclerosis". Journal of Molecular Medicine. 93 (5): 481–487. doi:10.1007/s00109-015-1273-3. PMC 4408375. PMID 25754173. S2CID 12043749.
- ^ a b "Understanding ALS". The ALS Association. Archived from the original on 26 October 2020. Retrieved 28 October 2020.
- ^ a b c Wingo TS, Cutler DJ, Yarab N, Kelly CM, Glass JD (2011). "The heritability of amyotrophic lateral sclerosis in a clinically ascertained United States research registry". PLOS ONE. 6 (11): e27985. Bibcode:2011PLoSO...627985W. doi:10.1371/journal.pone.0027985. PMC 3222666. PMID 22132186.
- ^ a b Couratier P, Corcia P, Lautrette G, Nicol M, Marin B (May 2017). "ALS and frontotemporal dementia belong to a common disease spectrum". Revue Neurologique. 173 (5): 273–279. doi:10.1016/j.neurol.2017.04.001. PMID 28449882.
- ^ a b c d e f g h i j k Brown RH, Al-Chalabi A (13 July 2017). "Amyotrophic Lateral Sclerosis". The New England Journal of Medicine. 377 (2): 162–172. doi:10.1056/NEJMra1603471. PMID 28700839. Archived from the original on 25 February 2021. Retrieved 20 December 2019.
- ^ a b c d e f g h i j k l m n Soriani M, Desnuelle C (May 2017). "Care management in amyotrophic lateral sclerosis". Revue Neurologique. 173 (5): 288–289. doi:10.1016/j.neurol.2017.03.031. PMID 28461024.
- ^ a b c d e f g h i j k Connolly S, Galvin M, Hardiman O (April 2015). "End-of-life management in patients with amyotrophic lateral sclerosis". The Lancet. Neurology. 14 (4): 435–442. doi:10.1016/S1474-4422(14)70221-2. PMID 25728958. S2CID 34109901.
- ^ a b c d e f g h Swinnen B, Robberecht W (November 2014). "The phenotypic variability of amyotrophic lateral sclerosis". Nature Reviews. Neurology. 10 (11): 661–670. doi:10.1038/nrneurol.2014.184. PMID 25311585. S2CID 205516010. Archived from the original on 31 December 2018. Retrieved 22 August 2018.
- ^ a b c d e f g Al-Chalabi A, Hardiman O (November 2013). "The epidemiology of ALS: a conspiracy of genes, environment and time". Nature Reviews. Neurology. 9 (11): 617–628. doi:10.1038/nrneurol.2013.203. PMID 24126629. S2CID 25040863.
- ^ a b c d e f Mehta P, Kaye W, Raymond J, Punjabi R, Larson T, Cohen J, Muravov O, Horton K (November 2018). "Prevalence of Amyotrophic Lateral Sclerosis – United States, 2015". Morbidity and Mortality Weekly Report. 67 (46): 1285–1289. doi:10.15585/mmwr.mm6746a1. PMC 5858037. PMID 30462626.
- ^ a b c d e Rowland LP (March 2001). "How amyotrophic lateral sclerosis got its name: the clinical-pathologic genius of Jean-Martin Charcot". Archives of Neurology. 58 (3): 512–515. doi:10.1001/archneur.58.3.512. PMID 11255459.
- ^ Kelly EB (2013). Encyclopedia of human genetics and disease. Santa Barbara, CA: Greenwood. pp. 79–80. ISBN 978-0-313-38713-5. Archived from the original on 8 September 2017.
- ^ Jacoby DB, Youngson RM (2004). Encyclopedia of family health (3rd ed.). Tarrytown, NY: Marshall Cavendish. p. 1256. ISBN 978-0-7614-7486-9. Archived from the original on 8 September 2017.
- ^ a b c d e f g h Renton AE, Chiò A, Traynor BJ (January 2014). "State of play in amyotrophic lateral sclerosis genetics". Nature Neuroscience. 17 (1): 17–23. doi:10.1038/nn.3584. hdl:2318/156177. PMC 4544832. PMID 24369373.
- ^ a b c d e Lutz C (August 2018). "Mouse models of ALS: Past, present and future". Brain Research. 1693 (Part A): 1–10. doi:10.1016/j.brainres.2018.03.024. PMID 29577886. S2CID 4641251.
- ^ Song P (August 2014). "The Ice Bucket Challenge: The public sector should get ready to promptly promote the sustained development of a system of medical care for and research into rare diseases". Intractable & Rare Diseases Research. 3 (3): 94–96. doi:10.5582/irdr.2014.01015. PMC 4214244. PMID 25364651.
- ^ "8B60 Motor neuron disease". ICD-11 for Mortality and Morbidity Statistics. World Health Organization. Archived from the original on 1 August 2018. Retrieved 24 January 2019.
- ^ a b c Jawdat O, Statland JM, Barohn RJ, Katz JS, Dimachkie MM (November 2015). "Amyotrophic Lateral Sclerosis Regional Variants (Brachial Amyotrophic Diplegia, Leg Amyotrophic Diplegia, and Isolated Bulbar Amyotrophic Lateral Sclerosis)". Neurologic Clinics. 33 (4): 775–785. doi:10.1016/j.ncl.2015.07.003. PMC 4629514. PMID 26515621.
- ^ a b c d e f Grad LI, Rouleau GA, Ravits J, Cashman NR (August 2017). "Clinical Spectrum of Amyotrophic Lateral Sclerosis (ALS)". Cold Spring Harbor Perspectives in Medicine. 7 (8): a024117. doi:10.1101/cshperspect.a024117. PMC 5538408. PMID 28003278.
- ^ a b c d Chiò A, Calvo A, Moglia C, Mazzini L, Mora G (July 2011). "Phenotypic heterogeneity of amyotrophic lateral sclerosis: a population based study". Journal of Neurology, Neurosurgery, and Psychiatry. 82 (7): 740–746. doi:10.1136/jnnp.2010.235952. PMID 21402743. S2CID 13416164.
- ^ Gautier G, Verschueren A, Monnier A, Attarian S, Salort-Campana E, Pouget J (August 2010). "ALS with respiratory onset: Clinical features and effects of non-invasive ventilation on the prognosis". Amyotrophic Lateral Sclerosis. 11 (4): 379–382. doi:10.3109/17482960903426543. PMID 20001486. S2CID 27672209.
- ^ a b c d e Al-Chalabi A, Hardiman O, Kiernan MC, Chiò A, Rix-Brooks B, van den Berg LH (October 2016). "Amyotrophic lateral sclerosis: moving towards a new classification system". The Lancet. Neurology. 15 (11): 1182–1194. doi:10.1016/S1474-4422(16)30199-5. hdl:2318/1636249. PMID 27647646. S2CID 45285510.
- ^ Teoh HL, Carey K, Sampaio H, Mowat D, Roscioli T, Farrar M (2017). "Inherited Paediatric Motor Neuron Disorders: Beyond Spinal Muscular Atrophy". Neural Plasticity. 2017: 6509493. doi:10.1155/2017/6509493. PMC 5467325. PMID 28634552.
- ^ a b Tard C, Defebvre L, Moreau C, Devos D, Danel-Brunaud V (May 2017). "Clinical features of amyotrophic lateral sclerosis and their prognostic value". Revue Neurologique. 173 (5): 263–272. doi:10.1016/j.neurol.2017.03.029. PMID 28477850.
- ^ Lui AJ, Byl NN (June 2009). "A Systematic Review of the Effect of Moderate Intensity Exercise on Function and Disease Progression in Amyotrophic Lateral Sclerosis". Journal of Neurologic Physical Therapy. 33 (2): 68–87. doi:10.1097/NPT.0b013e31819912d0. PMID 19556916. S2CID 7650356.
- ^ McCluskey L, Vandriel S, Elman L, Van Deerlin VM, Powers J, Boller A, et al. (15 October 2014). "ALS-Plus syndrome: Non-pyramidal features in a large ALS cohort". Journal of the Neurological Sciences. 345 (1–2): 118–124. doi:10.1016/j.jns.2014.07.022. PMC 4177937. PMID 25086858.
- ^ a b c Martin S, Al Khleifat A, Al-Chalabi A (2017). "What causes amyotrophic lateral sclerosis?". F1000Research. 6: 371. doi:10.12688/f1000research.10476.1. PMC 5373425. PMID 28408982.
- ^ Pender N, Pinto-Grau M, Hardiman O (October 2020). "Cognitive and behavioural impairment in amyotrophic lateral sclerosis". Current Opinion in Neurology. 33 (5): 649–654. doi:10.1097/WCO.0000000000000862. PMID 32833751. S2CID 221306439.
- ^ Raaphorst J, Beeldman E, De Visser M, De Haan RJ, Schmand B (October 2012). "A systematic review of behavioural changes in motor neuron disease". Amyotrophic Lateral Sclerosis. 13 (6): 493–501. doi:10.3109/17482968.2012.656652. PMID 22424127. S2CID 22224140.
- ^ a b Beeldman E, Raaphorst J, Klein Twennaar M, de Visser M, Schmand BA, de Haan RJ (June 2016). "The cognitive profile of ALS: a systematic review and meta-analysis update". Journal of Neurology, Neurosurgery, and Psychiatry. 87 (6): 611–619. doi:10.1136/jnnp-2015-310734. PMID 26283685. S2CID 22082109.
- ^ Gordon PH, Miller RG, Moore DH (September 2004). "ALSFRS-R". Amyotrophic Lateral Sclerosis and Other Motor Neuron Disorders. 5 Suppl 1: 90–93. doi:10.1080/17434470410019906. PMID 15512883. S2CID 218987659.
- ^ Creemers H, Grupstra H, Nollet F, van den Berg LH, Beelen A (June 2015). "Prognostic factors for the course of functional status of patients with ALS: a systematic review". Journal of Neurology. 262 (6): 1407–1423. doi:10.1007/s00415-014-7564-8. PMID 25385051. S2CID 31734765.
- ^ Castrillo-Viguera C, Grasso DL, Simpson E, Shefner J, Cudkowicz ME (2010). "Clinical significance in the change of decline in ALSFRS-R". Amyotrophic Lateral Sclerosis (Journal Article). 11 (1–2): 178–180. doi:10.3109/17482960903093710. PMID 19634063. S2CID 207619689.
- ^ Sabatelli M, Madia F, Conte A, Luigetti M, Zollino M, Mancuso I, Lo Monaco M, Lippi G, Tonali P (September 2008). "Natural history of young-adult amyotrophic lateral sclerosis". Neurology. 71 (12): 876–881. doi:10.1212/01.wnl.0000312378.94737.45. PMID 18596241. S2CID 10848454.
- ^ Paganoni S, Deng J, Jaffa M, Cudkowicz ME, Wills AM (July 2011). "Body mass index, not dyslipidemia, is an independent predictor of survival in amyotrophic lateral sclerosis". Muscle & Nerve. 44 (1): 20–24. doi:10.1002/mus.22114. PMC 4441750. PMID 21607987.
- 요약 배치 위치:
- ^ "Stephen Hawking serves as role model for ALS patients". CNN. 20 April 2009. Archived from the original on 15 August 2016.
- ^ "About Familial ALS – ALS Research Collaboration". Archived from the original on 27 October 2020. Retrieved 27 October 2020.
- ^ a b Vajda A, McLaughlin RL, Heverin M, Thorpe O, Abrahams S, Al-Chalabi A, Hardiman O (March 2017). "Genetic testing in ALS: A survey of current practices". Neurology. 88 (10): 991–999. doi:10.1212/WNL.0000000000003686. PMC 5333513. PMID 28159885.
- ^ Byrne S, Walsh C, Lynch C, Bede P, Elamin M, Kenna K, McLaughlin R, Hardiman O (June 2011). "Rate of familial amyotrophic lateral sclerosis: a systematic review and meta-analysis". Journal of Neurology, Neurosurgery, and Psychiatry. 82 (6): 623–627. doi:10.1136/jnnp.2010.224501. hdl:2262/53330. PMID 21047878. S2CID 6254190.
- ^ a b c He J, Mangelsdorf M, Fan D, Bartlett P, Brown MA (December 2015). "Amyotrophic Lateral Sclerosis Genetic Studies: From Genome-wide Association Mapping to Genome Sequencing" (PDF). The Neuroscientist. 21 (6): 599–615. doi:10.1177/1073858414555404. PMID 25378359. S2CID 3437565. Archived (PDF) from the original on 7 May 2020. Retrieved 20 December 2019.
- ^ a b Corcia P, Couratier P, Blasco H, Andres CR, Beltran S, Meininger V, Vourc'h P (May 2017). "Genetics of amyotrophic lateral sclerosis". Revue Neurologique. 173 (5): 254–262. doi:10.1016/j.neurol.2017.03.030. PMID 28449881.
- ^ Chia R, Chiò A, Traynor BJ (January 2018). "Novel genes associated with amyotrophic lateral sclerosis: diagnostic and clinical implications". The Lancet. Neurology. 17 (1): 94–102. doi:10.1016/S1474-4422(17)30401-5. PMC 5901717. PMID 29154141.
- ^ Zou ZY, Liu CY, Che CH, Huang HP (January 2016). "Toward precision medicine in amyotrophic lateral sclerosis". Annals of Translational Medicine. 4 (2): 27. doi:10.3978/j.issn.2305-5839.2016.01.16. PMC 4731596. PMID 26889480.
- ^ Sontheimer H (2015). Diseases of the Nervous System. Academic Press. p. 170. ISBN 978-0-12-800403-6. Archived from the original on 8 September 2017. Retrieved 2 May 2015.
- ^ a b Nguyen HP, Van Broeckhoven C, van der Zee J (June 2018). "ALS Genes in the Genomic Era and their Implications for FTD". Trends in Genetics. 34 (6): 404–423. doi:10.1016/j.tig.2018.03.001. PMID 29605155.
- ^ Pasetto L, Grassano M, Pozzi S, Luotti S, Sammali E, Migazzi A, Basso M, Spagnolli G, Biasini E, Micotti E, Cerovic M, Carli M, Forloni G, De Marco G, Manera U, Moglia C, Mora G, Traynor BJ, Chiò A, Calvo A, Bonetto V (December 2021). "Defective cyclophilin A induces TDP-43 proteinopathy: implications for amyotrophic lateral sclerosis and frontotemporal dementia". Brain. 144 (12): 3710–3726. doi:10.1093/brain/awab333. Archived from the original on 5 January 2022. Retrieved 5 January 2022.
- ^ a b Beard JD, Kamel F (1 January 2015). "Military service, deployments, and exposures in relation to amyotrophic lateral sclerosis etiology and survival". Epidemiologic Reviews. 37 (1): 55–70. doi:10.1093/epirev/mxu001. PMC 4325667. PMID 25365170.
- ^ Belbasis L, Bellou V, Evangelou E (March 2016). "Environmental Risk Factors and Amyotrophic Lateral Sclerosis: An Umbrella Review and Critical Assessment of Current Evidence from Systematic Reviews and Meta-Analyses of Observational Studies". Neuroepidemiology. 46 (2): 96–105. doi:10.1159/000443146. PMID 26731747. S2CID 13163292.
- ^ Beard JD, Steege AL, Ju J, Lu J, Luckhaupt SE, Schubauer-Berigan MK (July 2017). "Mortality from Amyotrophic Lateral Sclerosis and Parkinson's Disease Among Different Occupation Groups - United States, 1985–2011". MMWR. Morbidity and Mortality Weekly Report. 66 (27): 718–722. doi:10.15585/mmwr.mm6627a2. PMC 5687590. PMID 28704346.
- ^ Sutedja NA, Fischer K, Veldink JH, van der Heijden GJ, Kromhout H, Heederik D, Huisman MH, Wokke JJ, van den Berg LH (2009). "What we truly know about occupation as a risk factor for ALS: a critical and systematic review". Amyotrophic Lateral Sclerosis. 10 (5–6): 295–301. doi:10.3109/17482960802430799. PMID 19922116. S2CID 25772664.
- ^ Ingre C, Roos PM, Piehl F, Kamel F, Fang F (2015). "Risk factors for amyotrophic lateral sclerosis". Clinical Epidemiology. 7: 181–193. doi:10.2147/CLEP.S37505. PMC 4334292. PMID 25709501.
- ^ Kamel F, Umbach DM, Bedlack RS, Richards M, Watson M, Alavanja MC, Blair A, Hoppin JA, Schmidt S, Sandler DP (June 2012). "Pesticide exposure and amyotrophic lateral sclerosis". Neurotoxicology. 33 (3): 457–462. doi:10.1016/j.neuro.2012.04.001. PMC 3358481. PMID 22521219.
- ^ Bozzoni V, Pansarasa O, Diamanti L, Nosari G, Cereda C, Ceroni M (2016). "Amyotrophic lateral sclerosis and environmental factors". Functional Neurology. 31 (1): 7–19. PMC 4819821. PMID 27027889.
- ^ Malek AM, Barchowsky A, Bowser R, Youk A, Talbott EO (August 2012). "Pesticide exposure as a risk factor for amyotrophic lateral sclerosis: a meta-analysis of epidemiological studies: pesticide exposure as a risk factor for ALS". Environmental Research. 117: 112–119. Bibcode:2012ER....117..112M. doi:10.1016/j.envres.2012.06.007. PMID 22819005.
- ^ a b Gardner RC, Yaffe K (May 2015). "Epidemiology of mild traumatic brain injury and neurodegenerative disease". Molecular and Cellular Neurosciences. 66 (Pt B): 75–80. doi:10.1016/j.mcn.2015.03.001. PMC 4461453. PMID 25748121.
- ^ Watanabe Y, Watanabe T (October 2017). "Meta-analytic evaluation of the association between head injury and risk of amyotrophic lateral sclerosis". European Journal of Epidemiology. 32 (10): 867–879. doi:10.1007/s10654-017-0327-y. PMID 29080013. S2CID 449855. Archived from the original on 25 January 2022. Retrieved 2 September 2020.
- ^ Luna J, Logroscino G, Couratier P, Marin B (May 2017). "Current issues in ALS epidemiology: Variation of ALS occurrence between populations and physical activity as a risk factor". Revue Neurologique. 173 (5): 244–253. doi:10.1016/j.neurol.2017.03.035. PMID 28477849.
- ^ Veldink JH, Kalmijn S, Groeneveld GJ, Titulaer MJ, Wokke JH, van den Berg LH (January 2005). "Physical activity and the association with sporadic ALS". Neurology. 64 (2): 241–245. doi:10.1212/01.WNL.0000149513.82332.5C. PMID 15668420. S2CID 36449771.
- ^ Armon C (November 2007). "Sports and trauma in amyotrophic lateral sclerosis revisited". Journal of the Neurological Sciences. 262 (1–2): 45–53. doi:10.1016/j.jns.2007.06.021. PMID 17681549. S2CID 20733887.
- ^ a b Harwood CA, McDermott CJ, Shaw PJ (August 2009). "Physical activity as an exogenous risk factor in motor neuron disease (MND): a review of the evidence". Amyotrophic Lateral Sclerosis. 10 (4): 191–204. doi:10.1080/17482960802549739. PMID 19263258. S2CID 14749160.
- ^ Hamidou B, Couratier P, Besançon C, Nicol M, Preux PM, Marin B (July 2014). "Epidemiological evidence that physical activity is not a risk factor for ALS". European Journal of Epidemiology. 29 (7): 459–475. doi:10.1007/s10654-014-9923-2. PMID 24986107. S2CID 20563636.
- ^ Lacorte E, Ferrigno L, Leoncini E, Corbo M, Boccia S, Vanacore N (July 2016). "Physical activity, and physical activity related to sports, leisure and occupational activity as risk factors for ALS: A systematic review". Neuroscience and Biobehavioral Reviews. 66: 61–79. doi:10.1016/j.neubiorev.2016.04.007. PMID 27108217. S2CID 24844638.
- ^ Julian TH, Glascow N, Barry AD, Moll T, Harvey C, Klimentidis YC, et al. (June 2021). "Physical exercise is a risk factor for amyotrophic lateral sclerosis: Convergent evidence from Mendelian randomisation, transcriptomics and risk genotypes". EBioMedicine. 68: 103397. doi:10.1016/j.ebiom.2021.103397. PMC 8170114. PMID 34051439.
- ^ Couratier P, Corcia P, Lautrette G, Nicol M, Preux P, Marin B (January 2016). "Epidemiology of amyotrophic lateral sclerosis: A review of literature". Neuroepidemiology. 172 (1): 37–45. doi:10.1016/j.neurol.2015.11.002. PMID 26727307.
- ^ Tharmaratnam T, Iskandar M, Tabobondung T, Tobbia I, Gopee-Ramanan P, Tabobondung T (19 June 2018). "Chronic Traumatic Encephalopathy in Professional American Football Players: Where Are We Now?". Frontiers in Neurology. 19 (9): 445. doi:10.3389/fneur.2018.00445. PMC 6018081. PMID 29971037.
- ^ Gardner A, Iverson G, McCrory P (January 2014). "Chronic traumatic encephalopathy in sport: a systematic review". British Journal of Sports Medicine. 48 (2): 84–90. doi:10.1136/bjsports-2013-092646. PMID 23803602. S2CID 7182895.
- ^ Belson K (22 April 2015). "Judge Approves Deal in N.F.L. Concussion Suit". The New York Times. Archived from the original on 11 August 2018. Retrieved 10 August 2018.
- ^ "Kevin Turner, N.F.L. Player Who Later Fought the League, Dies at 46". The New York Times. 24 March 2016. Archived from the original on 28 March 2016. Retrieved 27 March 2016.
- ^ Armon C (November 2009). "Smoking may be considered an established risk factor for sporadic ALS". Neurology. 73 (20): 1693–1698. doi:10.1212/WNL.0b013e3181c1df48. PMC 2788806. PMID 19917993.
- ^ Alonso A, Logroscino G, Hernán MA (November 2010). "Smoking and the risk of amyotrophic lateral sclerosis: a systematic review and meta-analysis". Journal of Neurology, Neurosurgery, and Psychiatry. 81 (11): 1249–1252. doi:10.1136/jnnp.2009.180232. PMID 20639382. S2CID 2079442.
- ^ Wang H, O'Reilly ÉJ, Weisskopf MG, Logroscino G, McCullough ML, Thun MJ, Schatzkin A, Kolonel LN, Ascherio A (February 2011). "Smoking and risk of amyotrophic lateral sclerosis: a pooled analysis of 5 prospective cohorts". Archives of Neurology. 68 (2): 207–213. doi:10.1001/archneurol.2010.367. PMC 3319086. PMID 21320987.
- ^ a b "Amyotrophic lateral sclerosis (ALS) - Symptoms and causes". Mayo Clinic. Retrieved 6 April 2022.
- ^ a b "Who Gets ALS?". The ALS Association. Retrieved 6 April 2022.
- ^ "Amyotrophic Lateral Sclerosis (ALS) Fact Sheet National Institute of Neurological Disorders and Stroke". www.ninds.nih.gov. Retrieved 6 April 2022.
- ^ Robberecht W, Philips T (April 2013). "The changing scene of amyotrophic lateral sclerosis". Nature Reviews. Neuroscience. 14 (4): 248–264. doi:10.1038/nrn3430. PMID 23463272. S2CID 208941.
- ^ Okamoto K, Mizuno Y, Fujita Y (April 2008). "Bunina bodies in amyotrophic lateral sclerosis". Neuropathology. 28 (2): 109–115. doi:10.1111/j.1440-1789.2007.00873.x. PMID 18069968. S2CID 34398467.
- ^ White JA, Banerjee R, Gunawardena S (May 2016). "Axonal Transport and Neurodegeneration: How Marine Drugs Can Be Used for the Development of Therapeutics". Marine Drugs. 14 (5): 102. doi:10.3390/md14050102. PMC 4882576. PMID 27213408.
- ^ Ng Kee Kwong KC, Mehta AR, Nedergaard M, Chandran S (August 2020). "Defining novel functions for cerebrospinal fluid in ALS pathophysiology". Acta Neuropathologica Communications. 8 (1): 140. doi:10.1186/s40478-020-01018-0. PMC 7439665. PMID 32819425.
- ^ a b c d e Philip Van Damme P, Robberecht W, Van Den Bosch L (May 2017). "Modelling amyotrophic lateral sclerosis: progress and possibilities". Disease Models and Mechanisms. 10 (5): 537–549. doi:10.1242/dmm.029058. PMC 5451175. PMID 28468939.
- ^ a b Mehta AR, Gregory JM, Dando O, Carter RN, Burr K, Nanda J, et al. (February 2021). "Mitochondrial bioenergetic deficits in C9orf72 amyotrophic lateral sclerosis motor neurons cause dysfunctional axonal homeostasis". Acta Neuropathologica. 141 (2): 257–279. doi:10.1007/s00401-020-02252-5. PMC 7847443. PMID 33398403.
- ^ Xu Z, Henderson RD, David M, McCombe PA (2016). "Neurofilaments as Biomarkers for Amyotrophic Lateral Sclerosis: A Systematic Review and Meta-Analysis". PLOS ONE. 11 (10): e0164625. Bibcode:2016PLoSO..1164625X. doi:10.1371/journal.pone.0164625. PMC 5061412. PMID 27732645.
- ^ Vu LT, Bowser R (January 2017). "Fluid-Based Biomarkers for Amyotrophic Lateral Sclerosis". Neurotherapeutics. 14 (1): 119–134. doi:10.1007/s13311-016-0503-x. PMC 5233638. PMID 27933485.
- ^ a b de Carvalho M, Dengler R, Eisen A, England JD, Kaji R, Kimura J, et al. (March 2008). "Electrodiagnostic criteria for diagnosis of ALS". Clinical Neurophysiology. 119 (3): 497–503. doi:10.1016/j.clinph.2007.09.143. PMID 18164242. S2CID 14851649.
- ^ Costa J, Swash M, de Carvalho M (November 2012). "Awaji Criteria for the Diagnosis of Amyotrophic Lateral Sclerosis: A Systematic Review". Archives of Neurology. 69 (11): 1410–1416. doi:10.1001/archneurol.2012.254. PMID 22892641.
- ^ Belsh JM (March 2000). "ALS diagnostic criteria of El Escorial Revisited: do they meet the needs of clinicians as well as researchers?". Amyotrophic Lateral Sclerosis and Other Motor Neuron Disorders. 1 (Supplement 1): S57–S60. doi:10.1080/14660820052415925. PMID 11464928. S2CID 6828235.
- ^ Rissardo JP, Caprara AL (2019). "Mimicking amyotrophic lateral sclerosis: Cervical spondylotic myelopathy". Current Medical Issues. 17 (4): 155. doi:10.4103/cmi.cmi_36_19. ISSN 0973-4651. S2CID 209377175. Archived from the original on 25 January 2022. Retrieved 25 January 2022.
- ^ Silani V, Messina S, Poletti B, Morelli C, Doretti A, Ticozzi N, Maderna L (March 2011). "The diagnosis of Amyotrophic lateral sclerosis in 2010". Archives Italiennes de Biologie. 149 (1): 5–27. doi:10.4449/aib.v149i1.1260. PMID 21412713.
- ^ "Lambert-Eaton Myasthenic Syndrome (LEMS)". Misc.medscape.com. Archived from the original on 14 May 2013. Retrieved 18 April 2013.
- ^ "LEMS.com, Lambert-Eaton Myasthenic Syndrome: About". Lems.com. Archived from the original on 20 January 2013. Retrieved 18 April 2013.
- ^ Mills KR (November 2010). "Characteristics of fasciculations in amyotrophic lateral sclerosis and the benign fasciculation syndrome". Brain. 133 (11): 3458–3469. doi:10.1093/brain/awq290. PMID 20959307.
- ^ Eisen A (2002). "Amyotrophic lateral sclerosis: A review". BCMJ. 44 (7): 362–366. Archived from the original on 21 June 2013. Retrieved 21 August 2014.
- ^ Davenport RJ, Swingler RJ, Chancellor AM, Warlow CP (February 1996). "Avoiding false positive diagnoses of motor neuron disease: lessons from the Scottish Motor Neuron Disease Register". Journal of Neurology, Neurosurgery, and Psychiatry. 60 (2): 147–151. doi:10.1136/jnnp.60.2.147. PMC 1073793. PMID 8708642.
- ^ Chieia MA, Oliveira AS, Silva HC, Gabbai AA (December 2010). "Amyotrophic lateral sclerosis: considerations on diagnostic criteria". Arquivos de Neuro-Psiquiatria. 68 (6): 837–842. doi:10.1590/S0004-282X2010000600002. PMID 21243238.
- ^ Al-Asmi A, Nandhagopal R, Jacob PC, Gujjar A (February 2012). "Misdiagnosis of Myasthenia Gravis and Subsequent Clinical Implication: A case report and review of literature". Sultan Qaboos University Medical Journal. 12 (1): 103–108. doi:10.12816/0003095. PMC 3286704. PMID 22375266.
- ^ a b c Abe K, Masashi A, Tsuji S, Itoyama Y, Sobue G, Togo M, et al. (July 2017). "Safety and efficacy of edaravone in well defined patients with amyotrophic lateral sclerosis: a randomised, double-blind, placebo-controlled trial". The Lancet. Neurology. 16 (7): 505–512. doi:10.1016/S1474-4422(17)30115-1. PMID 28522181.
- ^ a b c Yeo CJ, Simmons Z (May 2018). "Discussing edaravone with the ALS patient: an ethical framework from a U.S. perspective". Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration. 19 (3–4): 167–172. doi:10.1080/21678421.2018.1425455. PMID 29334251. S2CID 4627647.
- ^ a b c d Orrell RW (2010). "Motor neuron disease: systematic reviews of treatment for ALS and SMA". British Medical Bulletin. 93: 145–159. doi:10.1093/bmb/ldp049. PMID 20015852.
- ^ a b Radunovic A, Annane D, Rafiq M, Brassington R, Mustfa N (6 October 2017). "Mechanical ventilation for amyotrophic lateral sclerosis/motor neuron disease". The Cochrane Database of Systematic Reviews. 10 (10): CD004427. doi:10.1002/14651858.CD004427.pub4. PMC 6485636. PMID 28982219.
- ^ a b c Ahmed R, Newcombe R, Piper A, Lewis S, Yee B, Kiernan M, Grunstein R (April 2016). "Sleep disorders and respiratory function in amyotrophic lateral sclerosis". Sleep Medicine Reviews. 26: 33–42. doi:10.1016/j.smrv.2015.05.007. PMID 26166297.
- ^ a b Eisen A, Krieger C (November 2013). "Ethical considerations in the management of amyotrophic lateral sclerosis". Progress in Neurobiology. 110: 45–53. doi:10.1016/j.pneurobio.2013.05.001. PMID 23735671. S2CID 26282198.
- ^ a b Lewis M, Rushanan S (2007). "The role of physical therapy and occupational therapy in the treatment of amyotrophic lateral sclerosis". NeuroRehabilitation. 22 (6): 451–461. doi:10.3233/NRE-2007-22608. PMID 18198431.
- ^ a b c d e "Amyotrophic Lateral Sclerosis (ALS)". American Speech-Language-Hearing Association, Rockville, MD. Archived from the original on 2 August 2012. Retrieved 30 November 2016.
- ^ a b c Arbesman M, Sheard K (2014). "Systematic review of the effectiveness of occupational therapy-related interventions for people with amyotrophic lateral sclerosis". The American Journal of Occupational Therapy. 68 (1): 20–26. doi:10.5014/ajot.2014.008649. PMID 24367951.
- ^ a b Katzberg HD, Benatar M (January 2011). "Enteral tube feeding for amyotrophic lateral sclerosis/motor neuron disease". The Cochrane Database of Systematic Reviews (1): CD004030. doi:10.1002/14651858.CD004030.pub3. PMC 7163276. PMID 21249659.
- ^ a b c Andersen PM, Abrahams S, Borasio GD, de Carvalho M, Chio A, Van Damme P, et al. (March 2012). "EFNS guidelines on the Clinical Management of Amyotrophic Lateral Sclerosis (MALS) – revised report of an EFNS task force". European Journal of Neurology. 19 (3): 360–375. doi:10.1111/j.1468-1331.2011.03501.x. PMID 21914052. S2CID 5746940.
- ^ Carlesi C, Pasquali L, Piazza S, Lo Gerfo A, Caldarazzo Ienco E, Alessi R, Fornai F, Siciliano G (March 2011). "Strategies for clinical approach to neurodegeneration in Amyotrophic lateral sclerosis". Archives Italiennes de Biologie. 149 (1): 151–167. doi:10.4449/aib.v149i1.1267. PMID 21412722.
- ^ Hardiman O, van den Berg LH (July 2017). "Edaravone: a new treatment for ALS on the horizon?". The Lancet. Neurology. 16 (7): 490–491. doi:10.1016/S1474-4422(17)30163-1. PMID 28522180. S2CID 7609862.
- ^ a b c d e f g Dorst J, Ludolph A, Huebers A (2018). "Disease-modifying and symptomatic treatment of amyotrophic lateral sclerosis". Therapeutic Advances in Neurological Disorders. 11: 1756285617734734. doi:10.1177/1756285617734734. PMC 5784546. PMID 29399045.
- ^ a b Takei K, Watanabe K, Yuki S, Akimoto M, Sakata T, Palumbo J (October 2017). "Edaravone and its clinical development for amyotrophic lateral sclerosis". Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration. 18 (sup 1): 5–10. doi:10.1080/21678421.2017.1353101. PMID 28872907.
- ^ Paganoni S, Hendrix S, Dickson SP, Knowlton N, Macklin EA, Berry JD, et al. (January 2021). "Long-term survival of participants in the CENTAUR trial of sodium phenylbutyrate-taurursodiol in amyotrophic lateral sclerosis". Muscle & Nerve. 63 (1): 31–39. doi:10.1002/mus.27091. PMC 7820979. PMID 33063909.
- ^ Belluck P (30 March 2022). "New A.L.S. Treatment Lacks Evidence of Benefit, F.D.A. Panel Finds". The New York Times. ISSN 0362-4331. Retrieved 6 April 2022.
- ^ a b Paganoni S, Karam C, Joyce N, Bedlack R, Carter G (2015). "Comprehensive rehabilitative care across the spectrum of amyotrophic lateral sclerosis". NeuroRehabilitation. 37 (1): 53–68. doi:10.3233/NRE-151240. PMC 5223769. PMID 26409693.
- ^ Macpherson CE, Bassile CC (July 2016). "Pulmonary Physical Therapy Techniques to Enhance Survival in Amyotrophic Lateral Sclerosis: A Systematic Review". Journal of Neurologic Physical Therapy. 40 (3): 165–175. doi:10.1097/NPT.0000000000000136. PMID 27164308. S2CID 7279853.
- ^ Moens J (22 March 2022). "Brain Implant Allows Fully Paralyzed Patient to Communicate". The New York Times. Retrieved 2 April 2022.
- ^ Chaudhary U, Vlachos I, Zimmermann JB, Espinosa A, Tonin A, Jaramillo-Gonzalez A, et al. (March 2022). "Spelling interface using intracortical signals in a completely locked-in patient enabled via auditory neurofeedback training". Nature Communications. 13 (1): 1236. doi:10.1038/s41467-022-28859-8. PMID 35318316.
- ^ Danel-Brunaud V, Touzet L, Chevalier L, Moreau C, Devos D, Vandoolaeghe S, Lefebvre L (May 2017). "Ethical considerations and palliative care in patients with amyotrophic lateral sclerosis: A review". Revue Neurologique. 173 (5): 300–307. doi:10.1016/j.neurol.2017.03.032. PMID 28479121.
- ^ Checkoway H, Lundin JI, Kelada SN (2011). "Chapter 22: Neurodegenerative diseases". In Rothman N, Hainaut P, Schulte P, Smith M, Boffetta P, Perera F (eds.). Molecular Epidemiology: Principles and Practices. International Agency for Research on Cancer. pp. 408–409. ISBN 978-9283221630.
- ^ Chiò A, Logroscino G, Traynor BJ, Collins J, Simeone JC, Goldstein LA, White LA (2013). "Global epidemiology of amyotrophic lateral sclerosis: a systematic review of the published literature". Neuroepidemiology. 41 (2): 118–130. doi:10.1159/000351153. PMC 4049265. PMID 23860588.
- ^ a b Arthur KC, Calvo A, Price TR, Geiger JT, Chiò A, Traynor BJ (11 August 2016). "Projected increase in amyotrophic lateral sclerosis from 2015 to 2040". Nature Communications. 7 (12408): 12408. Bibcode:2016NatCo...712408A. doi:10.1038/ncomms12408. PMC 4987527. PMID 27510634.
- ^ a b Luna J, Logroscino G, Couratier P, Marin B (May 2017). "Current issues in ALS epidemiology: Variation of ALS occurrence between populations and physical activity as a risk factor". Revue Neurologique. 173 (5): 244–253. doi:10.1016/j.neurol.2017.03.035. PMID 28477849.
- ^ Zou ZY, Zhou ZR, Che CH, Liu CY, He RL, Huang HP (July 2017). "Genetic epidemiology of amyotrophic lateral sclerosis: a systematic review and meta-analysis". Journal of Neurology, Neurosurgery, and Psychiatry. 88 (77): 540–549. doi:10.1136/jnnp-2016-315018. PMID 28057713. S2CID 41974606.
- ^ Visser J, de Jong JM, de Visser M (February 2008). "The history of progressive muscular atrophy: syndrome or disease?". Neurology. 70 (9): 723–727. doi:10.1212/01.wnl.0000302187.20239.93. PMID 18299524. S2CID 22629725.
- ^ Wijesekera LC, Mathers S, Talman P, Galtrey C, Parkinson MH, Ganesalingam J, Willey E, Ampong MA, Ellis CM, Shaw CE, Al-Chalabi A, Leigh PN (March 2009). "Natural history and clinical features of the flail arm and flail leg ALS variants". Neurology. 72 (12): 1087–1094. doi:10.1212/01.wnl.0000345041.83406.a2. PMC 2821838. PMID 19307543.
- ^ Lee SE (December 2011). "Guam dementia syndrome revisited in 2011". Current Opinion in Neurology. 24 (6): 517–524. doi:10.1097/WCO.0b013e32834cd50a. PMID 21986681.
- ^ Brooks BR, Sanjak M, Ringel S, England J, Brinkmann J, Pestronk A, et al. (February 1996). "The Amyotrophic Lateral Sclerosis Functional Rating Scale: Assessment of Activities of Daily Living in Patients with Amyotrophic Lateral Sclerosis". Archives of Neurology. 53 (2): 141–147. doi:10.1001/archneur.1996.00550020045014. PMID 8639063.
- ^ Cedarbaum JM, Stambler N, Malta E, Fuller C, Hilt D, Thurmond B, Nakanishi A (October 1999). "The ALSFRS-R: a revised ALS functional rating scale that incorporates assessments of respiratory function". Journal of the Neurological Sciences. 162 (1–2): 13–21. doi:10.1016/s0022-510x(99)00210-5. PMID 10540002. S2CID 7057926.
- ^ Wilbourn AJ (October 1998). "Clinical neurophysiology in the diagnosis of amyotrophic lateral sclerosis: The Lambert and the El Escorial criteria". Journal of the Neurological Sciences. 160 (Supplement 1): S25–29. doi:10.1016/s0022-510x(98)00194-4. PMID 9851644. S2CID 32884687.
- ^ Brooks BR (July 1994). "El Escorial World Federation of Neurology Criteria for the Diagnosis of Amyotrophic Lateral Sclerosis". Journal of the Neurological Sciences. 124 (Supplement): 96–107. doi:10.1016/0022-510x(94)90191-0. PMID 7807156. S2CID 32678612.
- ^ Brooks BR, Miller RG, Swash M, Munsat TL (December 2000). "El Escorial revisited: Revised criteria for the diagnosis of amyotrophic lateral sclerosis". Amyotrophic Lateral Sclerosis and Other Motor Neuron Disorders. 1 (5): 293–299. doi:10.1080/146608200300079536. PMID 11464847. S2CID 22725949.
- ^ a b Teive HA, Lima PM, Germiniani FM, Munhoz RP (May 2016). "What's in a name? Problems, facts and controversies regarding neurological eponyms". Arquivos de Neuro-Psiquiatria. 74 (5): 423–425. doi:10.1590/0004-282X20160040. PMID 27191240.
- ^ a b "What is ALS?". The ALS Association. Archived from the original on 21 December 2018. Retrieved 23 December 2018.
- ^ "ALS: Amyotrophic Lateral Sclerosis". Muscular Dystrophy Association. 18 December 2015. Archived from the original on 6 August 2018. Retrieved 23 December 2018.
- ^ Goetz CG (March 2000). "Amyotrophic lateral sclerosis: early contributions of Jean-Martin Charcot". Muscle & Nerve. 23 (3): 336–343. doi:10.1002/(SICI)1097-4598(200003)23:3<336::AID-MUS4>3.0.CO;2-L. PMID 10679709.
- ^ Gordon PH (2006). "Chapter 1: History of ALS". In Mitsumoto H, Przedborski S, Gordon PH (eds.). Amyotrophic Lateral Sclerosis. CRC Press. p. 9. ISBN 978-0824729240.
- ^ Mehta AR, Mehta PR, Anderson SP, MacKinnon BL, Compston A (January 2020). "Grey Matter Etymology and the neuron(e)". Brain. 143 (1): 374–379. doi:10.1093/brain/awz367. PMC 6935745. PMID 31844876.
- ^ Gordon PH (October 2013). "Amyotrophic Lateral Sclerosis: An update for 2013 Clinical Features, Pathophysiology, Management and Therapeutic Trials". Aging and Disease. 4 (5): 295–310. doi:10.14336/AD.2013.0400295. PMC 3794725. PMID 24124634.
- ^ a b Huynh W, Simon NG, Grosskreutz J, Turner MR, Vucic S, Kiernan MC (July 2016). "Assessment of the upper motor neuron in amyotrophic lateral sclerosis". Clinical Neurophysiology. 127 (7): 2643–2660. doi:10.1016/j.clinph.2016.04.025. PMID 27291884. S2CID 3757685.
- ^ "George Bush delivers possibly the best ALS ice bucket challenge yet". The Independent. Archived from the original on 21 August 2014. Retrieved 20 August 2014.
- ^ "Ice Bucket Challenge funds gene discovery in ALS (MND) research". BBC News. 27 July 2016. Archived from the original on 28 July 2016. Retrieved 27 July 2016.
- ^ Alexander E. "Ice Bucket Challenge: Lady Gaga, Justin Bieber, G-Dragon and Oprah – the most entertaining reactions so far".
- ^ "Ice Bucket Challenge funds discovery of gene linked to ALS". Archived from the original on 27 July 2016. Retrieved 27 July 2016.
- ^ Kenna KP, van Doormaal PT, Dekker AM, Ticozzi N, Kenna BJ, Diekstra FP, et al. (September 2016). "NEK1 variants confer susceptibility to amyotrophic lateral sclerosis". Nature Genetics. 48 (9): 1037–1042. doi:10.1038/ng.3626. PMC 5560030. PMID 27455347.
- ^ a b c d e Moujalled D, White AR (March 2016). "Advances in the Development of Disease-Modifying Treatments for Amyotrophic Lateral Sclerosis". CNS Drugs. 30 (3): 227–243. doi:10.1007/s40263-016-0317-8. hdl:11343/216653. PMID 26895253. S2CID 13487502.
- ^ Picher-Martel V, Valdmanis PN, Gould PV, Julien JP, Dupré N (July 2016). "From animal models to human disease: a genetic approach for personalized medicine in ALS". Acta Neuropathologica Communications. 11 (4): 70. doi:10.1186/s40478-016-0340-5. PMC 4940869. PMID 27400686.
- ^ a b Mitsumoto H, Brooks BR, Silani V (November 2014). "Clinical trials in amyotrophic lateral sclerosis: why so many negative trials and how can trials be improved?". The Lancet. Neurology. 13 (11): 1127–1138. doi:10.1016/S1474-4422(14)70129-2. PMID 25316019. S2CID 28510979.
- ^ Fang J, Zhou M, Yang M, Zhu C, He L (May 2013). "Repetitive transcranial magnetic stimulation for the treatment of amyotrophic lateral sclerosis or motor neuron disease". The Cochrane Database of Systematic Reviews (5): CD008554. doi:10.1002/14651858.CD008554.pub3. PMC 7173713. PMID 23728676.
- ^ Chen KS, Sakowski SA, Feldman EL (March 2016). "Intraspinal stem cell transplantation for amyotrophic lateral sclerosis". Annals of Neurology. 79 (3): 342–353. doi:10.1002/ana.24584. PMC 4789073. PMID 26696091.
- ^ Abdul Wahid SF, Law ZK, Ismail NA, Lai NM (December 2019). "Cell-based therapies for amyotrophic lateral sclerosis/motor neuron disease". The Cochrane Database of Systematic Reviews. 12: CD011742. doi:10.1002/14651858.CD011742.pub3. PMC 6920743. PMID 31853962.
- ^ "Public summary of opinion on orphan designation Masitinib mesilate for treatment of amyotrophic lateral sclerosis" (PDF). EMA. European Medicines Agency, Committee for Orphan Medicinal Products. 22 September 2016. Archived (PDF) from the original on 6 November 2016. Retrieved 6 November 2016.
- ^ Bartus RT, Bétourné A, Basile A, Peterson BL, Glass J, Boulis NM (January 2016). "β2-Adrenoceptor agonists as novel, safe and potentially effective therapies for Amyotrophic lateral sclerosis (ALS)". Neurobiology of Disease. 85: 11–24. doi:10.1016/j.nbd.2015.10.006. PMID 26459114. S2CID 536279.
- ^ Bräuer S, Zimyanin V, Hermann A (April 2018). "Prion-like properties of disease-relevant proteins in amyotrophic lateral sclerosis". Journal of Neural Transmission. 125 (4): 591–613. doi:10.1007/s00702-018-1851-y. PMID 29417336. S2CID 3895544.
- ^ Lau DH, Hartopp N, Welsh NJ, Mueller S, Glennon EB, Mórotz GM, Annibali A, Gomez-Suaga P, Stoica R, Paillusson S, Miller CC (February 2018). "Disruption of ER-mitochondria signalling in fronto-temporal dementia and related amyotrophic lateral sclerosis". Cell Death & Disease. 9 (3): 327. doi:10.1038/s41419-017-0022-7. PMC 5832427. PMID 29491392.
- ^ Neumann M (October 2013). "Frontotemporal lobar degeneration and amyotrophic lateral sclerosis: molecular similarities and differences". Revue Neurologique. 169 (10): 793–798. doi:10.1016/j.neurol.2013.07.019. PMID 24011641.









