리간드 결합 분석
Ligand binding assay리간드 결합 검사(LBA)는 리간드 분자가 수용체, 항체 또는 다른 [1]고분자에 결합하는 검사 또는 분석 절차이다.검출방법은 형성된 리간드-수용체 복합체의 존재 및 정도를 결정하기 위해 사용되며, 이는 통상 전기화학적으로 또는 형광검출법에 [2]의해 결정된다.이 유형의 분석 테스트는 [3]수용체에 결합하는 것으로 알려진 샘플의 표적 분자의 존재 여부를 테스트하는 데 사용될 수 있습니다.
리간드 결합 측정에는 방사성 및 비방사성 [4][5][6]모두 다양한 유형이 있습니다.이와 같이 리간드 결합측정법은 방사성 면역측정법(RIA)의 개념상 역방향인 방사성 결합측정법의 슈퍼세트이다.일부 새로운 유형은 결합되지 않은 [5]배위자에서 바인드를 분리할 필요가 없기 때문에 "mix-and-measure" 분석이라고 불립니다.
리간드 결합 측정법은 주로 다양한 수요에 대한 약리학에서 사용된다.구체적으로, 인체의 내인성 수용체, 호르몬, 그리고 다른 신경전달물질에도 불구하고, 약사들은 내인성 세포 성분들을 선택적이거나 모방하는 약물을 만들기 위해 분석을 이용한다.한편, 이러한 기술은 추가적인 캐스케이드를 [7]방지하기 위해 수용체 길항제 생성에도 이용 가능하다.이러한 발전은 연구자들에게 호르몬과 호르몬 수용체를 정량화하는 능력뿐만 아니라 약물 개발과 치료 [8]계획에 중요한 약리학적 정보를 제공할 수 있는 능력을 제공한다.
역사
역사적으로 리간드 결합 분석 기술은 혈장 또는 조직의 호르몬 또는 호르몬 수용체 농도를 정량화하기 위해 광범위하게 사용되었다.리간드 결합 분석 방법론은 테스트 샘플의 효과를 알려진 단백질(리간드)의 다양한 양에 대한 결과와 비교하여 테스트 재료의 호르몬 농도를 정량화했다.
리간드 결합 분석의 기초는 1945년 Karl Landsteiner와 특정 [9]단백질을 위한 항체 생산을 통한 동물 면역에 대한 그의 연구 결과입니다.랜드스타이너의 연구는 면역측정 기술이 연구자들이 분자 수준에서 분석할 수 있게 해준다는 것을 증명했다.최초의 성공적인 리간드 결합 분석은 1960년 로잘린 서스만 얄로우와 솔로몬 [9]버슨에 의해 보고되었다.그들은 인슐린에 대한 최초의 방사성 면역 측정법(RIA)을 개발하는 것 외에 인슐린과 인슐린 특이 항체에 대한 결합 상호작용을 조사했다.이러한 발견은 혈액을 기반으로 하는 [9]액체에서 발견되는 단백질 호르몬의 민감성과 특이성에 관한 귀중한 정보를 제공했습니다.얄로와 버슨은 그들의 발전의 결과로 노벨 의학상을 받았다.RIA 기술의 개발을 통해 연구자들은 방사능의 사용을 넘어 액상 및 고체상,[9] 경쟁력, 면역방사선측정법을 사용할 수 있게 되었다.이러한 기념비적인 발견의 직접적인 결과로, 연구자들은 생물학, 화학 등의 분야에서 많은 측면에서 리간드 결합 측정의 발전을 계속해왔다.
적용들
리간드 결합 분석은 단백질 결합과 같은 두 분자 사이의 상호작용과 반응물이 [10]서로 결합하는 친화력(약함, 강함 또는 연결 없음)의 측정값을 제공합니다.결합 분석의 필수 측면에는 반응물 또는 생성물의 농도 수준(방사능 섹션 참조), 측정 내내 반응물의 평형 상수 유지, 연결된 [10]반응의 신뢰성과 유효성이 포함된다.결합 측정은 간단하지만 테스트 중인 화합물이 대상 [11]기능에 영향을 미치는지 여부에 대한 정보를 제공하지 못합니다.
방사선 분석
방사성 리간드는 수용체에 대한 리간드 결합을 측정하는 데 사용되며, 이상적으로는 높은 친화력, 낮은 비특이성 결합, 낮은 수용체 밀도를 검출하기 위한 높은 특이성 및 수용체 [7]특이성을 가져야 한다.
(몰당) 방사능 수준은 Ci/mmol [12]단위로 측정되는 특정 활성(SA)이라고 한다.방사성 리간드의 실제 농도는 (제조업체에서) 생성된 특정 원료 혼합에 의해 결정됩니다.[12]다음 방정식은 실제 농도를 구합니다.
포화 바인딩
포화 분석은 균질화 조직으로부터 부분적으로 정제된 혈장의 분율, 복제 수용체에 의해 감염되는 세포, 분석 전에 배양 [7]중이거나 분리된 세포 등 다양한 형태의 조직에 사용된다.포화 결합 분석은 수용체 친화력과 밀도를 결정할 수 있다.새로운 배위자에 대해 선택된 농도를 경험적으로 결정해야 한다.
이러한 유형의 [7]실험에 채택되는 두 가지 일반적인 전략이 있습니다.방사리간드의 일정한 비방사능과 농도를 유지하면서 첨가되는 방사리간드의 양을 증가시키거나 라벨이 없는 배위자의 첨가로 인해 방사리간드의 [7]비방사능을 감소시킨다.
스캐처드 플롯
스캐처드 플롯(로젠탈 플롯)을 사용하여 방사리간드 친화도를 표시할 수 있습니다.이 유형의 플롯에서는 결합/자유 방사리간드의 비율이 결합 방사리간드에 대해 표시됩니다.선의 기울기는 친화력 상수(K)의 음수 역수와 같습니다.X축이 있는 선의 절편은 [7]Bmax의 추정치입니다.스캐처드 플롯은 다양한 연구 및 [7]조직에서 수용체 밀도를 직접 비교할 수 있도록 적절한 참조에 대해 표준화할 수 있습니다.이 샘플 그림은 방사선이 단일 선호도로 결합됨을 나타냅니다.배위자가 다른 방사선 친화도를 가진 여러 사이트에 결합했다면 스캐처드 그림은 대신 [7]오목선을 표시했을 것이다.
비선형 곡선 피팅
평형 결합 데이터 분석(EBDA) 및 LIGAND와 같은 비선형 곡선 적합 프로그램은 포화 및 경쟁 결합 실험으로부터 [13]결합 매개변수의 추정치를 계산하기 위해 사용됩니다.EBDA는 측정된 방사능을 몰 농도로 변환하고 데이터에서 힐 기울기와 스캐처드 변환을 생성하는 초기 분석을 수행한다.그런 다음 EBDA에 의한 분석을 LIGAND에서 사용하여 [13]결합에 대한 특정 모델을 추정할 수 있습니다.
경쟁 제품과의 결합
경쟁결합은 수용체 서브타입의 특정 리간드에 대한 선택성의 존재를 결정하기 위해 사용되며,[7] 이를 통해 조직 내 각 서브타입의 밀도 및 비율을 결정할 수 있다.경합곡선은 경합배위자의 [7]로그 농도에 대한 전체 결합 비율인 특정 결합을 플롯하여 구한다.가파른 경쟁 곡선은 일반적으로 수용체의 단일 모집단에 대한 결합을 나타내며, 얕은 곡선 또는 명확한 변곡점이 있는 곡선은 결합 [13]부위의 다중 모집단을 나타낸다.
비방사성 바인딩 검사
비방사능 측정에 사용되는 기술은 다르지만, 리간드가 방사성 동위원소와 유사한 결합 특성을 보일 것을 요구한다.따라서 비방사능 분석과 방사능 분석의 결과는 모두 [5]일관성을 유지할 것이다.방사성 배위자 측정과 비방사성 배위자 측정의 가장 큰 차이점 중 하나는 인간의 건강에 대한 위험에 관한 것이다.방사성 물질 검사는 방사성 폐기물을 발생시킨다는 점에서 유해한 반면, 비방사성 배위자 검사는 독성 폐기물 발생을 방지하기 위해 다른 방법을 사용한다.이러한 방법에는 형광편광(FP), 형광공명에너지전송(FRET), 표면플라스몬공명(SPR) 등이 있습니다.리간드-수용체 결합 과정을 측정하기 위해 대부분의 비방사성 방법은 라벨링이 분자 [5]상호작용의 간섭을 피하도록 요구한다.
형광 편광
형광편광(FP)은 형광 이방성과 동의어이다.이 방법은 [5]형광표지 배위자가 수용체에 결합되었을 때의 회전속도 변화를 측정한다.배위자를 자극하기 위해 편광을 이용하여 발광량을 측정한다.[5]방출된 빛의 탈분극은 리간드 결합(예: 수용체에 결합)에 따라 달라집니다.배위자가 결합되지 않은 경우, 큰 탈분극이 발생합니다(배위자는 빠르게 회전하여 빛을 회전시킬 수 있습니다).배위자가 결합되면 크기가 클수록 회전 속도가 느려지고 따라서 탈분극이 [5]감소한다.이 방법의 장점은 라벨링 단계를 한 번만 수행하면 된다는 것입니다.그러나 이 방법은 낮은 나노몰 [5]농도에서는 정밀도가 떨어진다.
형광 공명 에너지 전달
형광 공명 에너지 전달(FRET)은 [5]공여체와 수용체 분자 사이에 전달되는 에너지를 근접하게 활용합니다.FRET는 [5]FP와 마찬가지로 형광 라벨이 부착된 리간드를 사용합니다.FLET 내의 에너지 전달은 기증자를 [5]자극하는 것으로 시작됩니다.기증자와 수용체 분자 사이의 쌍극자-다이폴 상호작용은 에너지를 기증자에서 수용체 분자로 전달합니다.[5]리셉터-항체 복합체에 리간드가 결합되어 있으면 리셉터가 [5]빛을 방출합니다.FLET를 사용할 때는 수용체와 공여체 사이의 흡수 스펙트럼이 겹치는 것 외에 수용체와 공여체 사이의 거리가 10 nm 미만이어야 하며 항체가 리간드 결합 [5]부위를 간섭하거나 차단하지 않아야 한다.
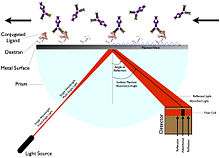
표면 플라즈몬 공명
표면 플라스몬 공명(SPR)은 [5]배위자에 라벨을 붙일 필요가 없습니다.대신 편광의 반사각도 변화(굴절지수)[5]를 측정하여 작동한다.이 각도는 반사광을 [5]증가시키는 공명각을 바꾸는 배위자의 고정화와 같은 질량이나 두께층의 변화와 관련이 있다.SPR을 도출하는 장치에는 센서 칩, 플로우 셀, 광원, 프리즘 및 고정 각도 위치 [5]검출기가 포함됩니다.
액상결합측정
면역 침강
면역침전(IP)의 액상배위자 결합검사는 복합혼합물의 항체를 사용하여 특정 단백질 또는 단백질군을 정제 또는 농축하기 위해 사용되는 방법이다.파괴된 조직 또는 세포의 추출물은 항원에 대한 항체와 혼합되어 항원-항체 [14]복합체를 생성한다.항원 농도가 낮으면 항원-항체 복합체 침전은 몇 시간 또는 며칠이 걸릴 수 있으며 [14]소량의 침전물을 분리하기 어려워진다.
효소결합면역흡수측정(ELISA) 또는 웨스턴블롯팅은 정제항원(또는 복수의 항원)을 얻고 분석할 수 있는 두 가지 다른 방법입니다.이 방법은 아가로스 [15]수지와 같은 고체(비드) 지지체에 부착된 항체를 이용하여 항원을 정제하는 것이다.고정화 단백질 복합체는 단일 단계 또는 [15]연속적으로 달성될 수 있다.
IP는 또한 생합성 방사성 동위원소 라벨링과 함께 사용될 수 있다.이 기술 조합을 사용하면 특정 항원이 조직에 의해 합성되는지 [14]세포에 의해 합성되는지를 판단할 수 있다.
솔리드 페이즈바인딩 어세이
멀티웰 플레이트
멀티웰 플레이트는 하나의 용기에 통합된 여러 개의 페트리 접시로, 개별 웰의 수는 6개에서 1536개 이상입니다.멀티웰 플레이트 어세이(Multiwell Plate Assay)는 필요한 용량과 [16]복제품을 처리하는 데 편리합니다.표준화된 풋프린트, 지원 장비 및 측정 [16]시스템을 갖춘 다양한 플레이트 유형이 있습니다.전극은 플레이트 바닥에 통합되어 결합 분석의 [9]결과로 정보를 캡처할 수 있습니다.결합 시약은 전극 표면에 고정화된 후 [9]분석할 수 있습니다.
멀티웰 플레이트는 연구자가 각 멀티웰 [16]플레이트 내에서 다양한 유형의 측정(즉, 생체측정, 면역측정 등)을 생성하고 조작할 수 있도록 제작됩니다.멀티웰 플레이트 포맷의 다양성으로 인해 아티팩트가 발생하는 것은 드문 일이 아닙니다.아티팩트는 플레이트의 서로 다른 웰, 특히 웰의 가장자리 및 중앙 부근에서 발견되는 서로 다른 환경으로 인해 발생합니다.이러한 효과는 효과, 가장자리 효과 및 플레이트 효과로도 알려져 있습니다.따라서 각 플레이트 [16]내부와 사이에 올바른 방식으로 검사 설계를 배치해야 한다는 점을 강조합니다.
시험관내 생물학적 분석 활성을 측정하거나 [16]면역측정법을 통해 면역반응을 측정할 때 멀티웰 플레이트를 사용하는 것이 일반적입니다.습도를 [16]낮추기 위해 대기압 및 온도 속도를 유지하는 것 외에 각 웰에 동일한 양의 특정 매체를 도포함으로써 판의 균일성을 유지함으로써 아티팩트를 방지할 수 있다.
온비드 바인딩
On-Bead Ligand Binding assay는 정의되지 않은 현탁액에 위치한 기본 단백질, DNA/RNA 또는 기타 생체 분자에 대한 분리 방법이며 여러 바이오 크로마토그래피 애플리케이션에서 사용될 수 있습니다.바이오아핀배위자는 말단 음전하 실라놀기 또는 폴리스티렌 비즈에 공유결합되어 염기성 단백질의 분리 및 정제 또는 생체분자의 흡착에 사용된다.결합 후 분리는 원심분리(밀도분리) 또는 자기장 흡인(자성입자에 한함)에 의해 수행됩니다.이온교환법에 의해 분해되기 전에 분리된 분자의 순도를 제공하기 위해 비즈를 세척할 수 있다.효소/형광검출에 기초한 직접분석방법(예를 들어 HRP, 형광색소)은 결합 생체분자의 온비드 결정 또는 정량화에 사용할 수 있다.[17][18][19]
온칼럼 바인딩
필터
필터 어세이(filter assay)는 필터를 사용하여 두 분자 간의 친화성을 측정하는 고체상 리간드 결합 어세이입니다.필터 결합 어세이에서 필터는 [8]매체를 통해 흡인함으로써 세포막을 트랩하기 위해 사용된다.이 빠른 방법은 발견된 [20]분수에 대해 여과 및 회수가 가능한 빠른 속도로 발생합니다.필터를 버퍼로 세척하면 결합 [8]부위에서 씻어낼 수 있는 잔여 비결합 리간드와 기타 리간드가 제거됩니다.필터 세척 중에 존재하는 수용체-리간드 복합체는 [8]필터에 완전히 갇히기 때문에 유의하게 분리되지 않습니다.필터의 특성은 수행되는 각 작업에 중요합니다.두꺼운 필터는 작은 막 조각을 더 완벽하게 복구하는 데 유용하지만 세척 시간이 [8]더 오래 걸릴 수 있습니다.음전하를 띤 막 조각을 [8]가두는 데 도움이 되도록 필터를 미리 처리하는 것이 좋습니다.필터에 양의 표면 전하를 주는 용액에 필터를 담그면 음전하를 띤 막 [8]조각이 흡착됩니다.
실시간 셀바인딩
이러한 유형의 분석에서는 세포에 대한 배위자의 결합을 시간이 지남에 따라 추적합니다.얻어진 신호는 세포 표면의 표적 구조(종종 수용체)에 결합된 리간드의 수에 비례합니다.시간 경과에 따른 신호 변화로부터 리간드-타깃 상호작용에 관한 정보를 얻어 관련속도 상수a k, 해리속도 상수d k, 친화도D K 등의 운동 파라미터를 [21]산출할 수 있다.세포에서 직접 상호작용을 측정함으로써 표적 단백질의 분리가 필요하지 않으며, 그렇지 않으면 특히 일부 막 [22]단백질의 경우 어려울 수 있다.의도된 표적 구조와의 상호작용이 측정되도록 하기 위해 표적 구조를 발현하지 않는 세포와 같은 적절한 생물학적 방제가 권장된다.
라벨 프리 또는 라벨 기반 접근방식을 사용하여 실시간 측정을 사용하여 고정 세포 또는 살아있는 [23][24]세포에서 생체 분자 상호작용을 분석하였다.
실시간으로 리간드-수용체 상호작용을 측정하는 장점은 결합 평형에 도달하지 않아도 [25]친화력을 정확하게 측정할 수 있다는 것이다.
결합특이성
약물의 효과는 유기체의 고분자 특성에 대한 결합 선택성 또는 서로 다른 배위자가 [26]기질에 결합하는 친화성의 결과이다.보다 구체적으로, 각각의 수용체에 대한 리간드의 특이성과 선택성은 연구자들에게 리간드 농도와 수용체 [26]밀도의 조작을 통해 특정 약물 효과를 분리 및 생성할 기회를 제공한다.호르몬과 신경전달물질은 [26]유기체 내의 생리적 수용체에 영향을 미치는 필수적인 내인성 조절 리간드이다.이러한 수용체에 작용하는 약물은 신호 [26]분자에서 필요한 반응을 생성하기 위해 엄청나게 선별적이다.
특이결합은 리셉터에 대한 리간드의 결합을 말하며, 1개의 리간드에 [27]대해 복수의 특이결합 부위가 존재할 수 있다.비특이적 결합은 다양한 다른 수용체 또는 세포막의 [27]다른 종류의 운반체와 같이 지정된 수용체 이외의 것에 리간드가 결합하는 것을 말한다.예를 들어 다양한 길항제들이 여러 유형의 수용체에 결합할 수 있다.무스카린 길항제들의 경우 히스타민 [27]수용체에도 결합할 수 있다.이러한 결합 패턴은 리간드의 목적지가 다중 수용체에 특이하기 때문에 기술적으로 특이하다고 간주된다.그러나 연구자들은 다른 결합 요인에 [27]비해 그러한 행동에 집중하지 않을 수 있다.그럼에도 불구하고 비특이적 결합 동작은 획득해야 할 매우 중요한 정보입니다.이러한 추정치는 리간드가 수용체에 어떻게 결합하는지를 조사하면서 특정 결합을 [27]방지하는 대체제(안타고니스트)와 동시에 반응함으로써 측정된다.
배위자 및 수용체 상호작용에 대한 특정 결합 유형:[26]
| 내인성 효과 모방 | 내인성 효과 억제 |
|---|---|
| 어거니스트 | 대항마 |
| 부분작용제 | 네거티브 길항제('역작용제' 참조) |
테크놀로지의 진보
리간드 결합 분석 기술은 정확도와 [9]감도를 유지하고 증가시키면서 속도 향상과 비용 효율적인 시술 유지와 관련하여 지속적으로 발전하고 있습니다.일부 기술적 진보에는 [9]항체의 대안으로 새로운 결합 시약, 대체 염료 용액 및 마이크로 플레이트 시스템, 그리고 많은 리간드 결합 분석 [13]과정에서 필요한 여과 단계를 건너뛸 수 있는 방법의 개발이 포함됩니다.
세포내의 현저한 시그널링 분자는, Fluo-4 아세톡시메틸 염료로 검출할 수 있는 칼슘(Ca2+)이다.그것은 유리2+ Ca 이온에 결합하고, 이것은 차례로 Fluo-4 [13]AM의 형광을 약간 증가시킨다.Fluo-4 염료 제제의 단점은 원치 않는 배경 신호를 제공할 수 있는 세포 외 염료를 제거하기 위해 세척 단계가 필요하다는 것입니다.예를 들어, 세척은 세포에 추가적인 스트레스를 줄 뿐만 아니라 시간을 소비하기 때문에 시기적절하게 [13]분석할 수 없습니다.최근에는 세척 단계가 필요 없는 칼슘 3 검사 시약을 사용하는 대체 염료 용액 및 마이크로플레이트 시스템인 FLIPR®(측정 영상판 판독기)이 개발되었습니다.이것에 의해, 들뜸 레이저와 전하 결합 [13]장치를 이용해, 염료 형광의 변화를 지연 없이 리얼타임에 볼 수 있다.
많은 리간드 결합 측정법은 스크리닝 전에 결합 및 결합되지 않은 리간드를 분리하기 위한 여과 단계를 필요로 한다.섬광 근접 분석(SPA)이라는 방법이 최근에 개발되었으며, 그렇지 않으면 이 중요한 단계를 제거한다.그것은 리간드 결합 분자로 코팅되고 세륨 이온으로 채워진 결정 격자 구슬을 통해 작용합니다.이것들은 동위원소에 의해 자극되면 쉽게 측정할 수 있는 빛의 폭발을 일으킨다.리간드는 3H 또는 125I를 사용하여 방사선 라벨을 부착한 후 검사로 방출됩니다.비드에 직접 결합하는 방사성 리간드만이 신호를 개시하기 때문에 프리 리간드는 스크리닝 프로세스 [13]중에 간섭하지 않습니다.
제한 사항
본질적으로, 측정은 체외에서 통제된 환경에서 수행되어야 하므로, 이 방법은 생체 내 수용체 결합에 대한 정보를 제공하지 않는다.얻어진 결과는 특정 배위자가 수용체에 맞는지 확인할 수 있을 뿐이지만, 측정법은 유기체의 배위자 결합 수용체의 분포를 알 수 있는 방법을 제공하지 않는다.
생체 내 리간드 결합 및 수용체 분포는 방사성핵종을 리간드로 유도하여 작용하는 PET(Positron Emission Tomography)를 사용하여 연구할 수 있으며, 이는 연구 대상 유기체의 체내에 방출된다.방사성 라벨이 부착된 리간드는 PET 스캐너에 의해 공간적으로 배치되어 [13]수용체 농도가 높은 유기체의 영역을 드러냅니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Luckey JA, Drossman H, Kostichka T, Smith LM (1993). "High-speed DNA sequencing by capillary gel electrophoresis". Methods in Enzymology. 218 (12): 154–72. doi:10.1016/0076-6879(93)18014-4. ISBN 9780121821197. PMID 8510530.
- ^ Ninfa AJ, Ballou DP, Benore M, eds. (2010). Fundamental Laboratory Approaches for Biochemistry and Biotechnology. Dearborn, MI: University of Michigan.
- ^ Mullis KB, Faloona FA (1987). "Specific synthesis of DNA in vitro via a polymerase-catalyzed chain reaction". Methods in Enzymology. 155 (21): 335–50. doi:10.1016/0076-6879(87)55023-6. PMID 3431465.
- ^ Sittampalam GS, Kahl SD, Janzen WP (October 1997). "High-throughput screening: advances in assay technologies". Current Opinion in Chemical Biology. 1 (3): 384–91. doi:10.1016/S1367-5931(97)80078-6. PMID 9667878.
- ^ a b c d e f g h i j k l m n o p q r de Jong LA, Uges DR, Franke JP, Bischoff R (December 2005). "Receptor-ligand binding assays: technologies and applications". Journal of Chromatography. B, Analytical Technologies in the Biomedical and Life Sciences. 829 (1–2): 1–25. doi:10.1016/j.jchromb.2005.10.002. PMID 16253574.
- ^ 조셉 R. 라코비치(1991) 형광 분광학 주제:생화학적 응용.
- ^ a b c d e f g h i j Davenport AP, Russel FD (1996). "Radioligand Binding Assays: Theory and Practice". In Stephen J. Mather (ed.). Current directions in radiopharmaceutical research and development. Springer Netherlands. pp. 169–179. ISBN 978-94-010-7289-2.
- ^ a b c d e f g Hulme EC, Trevethick MA (November 2010). "Ligand binding assays at equilibrium: validation and interpretation". British Journal of Pharmacology. 161 (6): 1219–37. doi:10.1111/j.1476-5381.2009.00604.x. PMC 3000649. PMID 20132208.
- ^ a b c d e f g h Khan MN, Findlay JW, eds. (2009). Ligand-binding assays development, validation, and implementation in the drug development arena. Hoboken, N.J.: John Wiley & Sons. ISBN 978-0470541494.
- ^ a b Pollard TD (December 2010). "A guide to simple and informative binding assays". Molecular Biology of the Cell. 21 (23): 4061–7. doi:10.1091/mbc.e10-08-0683. PMC 2993736. PMID 21115850.
- ^ Offermanns S, Walter Rosenthal, eds. (2008). Encyclopedia of molecular pharmacology (2nd ed.). Berlin: Springer. p. 585. ISBN 9783540389163.
- ^ a b c Kahl SD, Sittampalam GS, Weidner J (May 2012). "Calculations and Instrumentation used for Radioligand Binding Assays". Assay Guidance Manual: 1–21. PMID 22553868.
- ^ a b c d e f g h i Davenport AP (2005). Receptor Binding Techniques. Humana Press. pp. 18–19, 101–102, 121–122, 203–204. ISBN 978-1-58829-420-3.
- ^ a b c Goldsby RA (2003). Immunology (5e éd. ed.). New York: W. H. Freeman. p. 152. ISBN 978-0716749479.
- ^ a b "Immunoprecipitation (IP) technical guide and protocols" (PDF). Thermo Fisher Scientific Inc. Archived from the original (PDF) on 24 March 2014. Retrieved 20 March 2014.
- ^ a b c d e f Robinson CJ, Sadick M, Deming SN, Estdale S, Bergelson S, Little L (January 2014). "Assay Acceptance Criteria for Multiwell-Plate–Based Biological Potency Assays". BioProcess International. 12 (1): 30–41.
- ^ "SIMAG Basic : Magnetic nano and micro particles".
- ^ "SIMAG Affinity : Magnetic nano and micro particles by chemicell".
- ^ "Home - Accelero® Bioanalytics GMBH".
- ^ Moss T, ed. (2001). "Filter-Binding Assays". DNA-protein interactions : principles and protocols (2nd ed.). Totowa, NJ: Humana Press. pp. 1–12. ISBN 9780896036710.
- ^ Bondza S, Foy E, Brooks J, Andersson K, Robinson J, Richalet P, Buijs J (2017). "Real-time Characterization of Antibody Binding to Receptors on Living Immune Cells". Frontiers in Immunology. 8: 455. doi:10.3389/fimmu.2017.00455. PMC 5401896. PMID 28484455.
- ^ Smith SM (2011). "Strategies for the purification of membrane proteins". Protein Chromatography. Methods in Molecular Biology. Vol. 681. Humana Press. pp. 485–96. doi:10.1007/978-1-60761-913-0_29. hdl:2262/72470. ISBN 9781607619123. PMID 20978985.
- ^ Wang W, Yin L, Gonzalez-Malerva L, Wang S, Yu X, Eaton S, et al. (October 2014). "In situ drug-receptor binding kinetics in single cells: a quantitative label-free study of anti-tumor drug resistance". Scientific Reports. 4 (1): 6609. Bibcode:2014NatSR...4E6609W. doi:10.1038/srep06609. PMC 4196117. PMID 25312029.
- ^ Björkelund H, Gedda L, Barta P, Malmqvist M, Andersson K (2011-09-12). "Gefitinib induces epidermal growth factor receptor dimers which alters the interaction characteristics with ¹²⁵I-EGF". PLOS ONE. 6 (9): e24739. Bibcode:2011PLoSO...624739B. doi:10.1371/journal.pone.0024739. PMC 3171474. PMID 21931838.
- ^ Xu B, Varasteh Z, Orlova A, Andersson K, Larhammar D, Björkelund H (November 2013). "Detecting ligand interactions with G protein-coupled receptors in real-time on living cells". Biochemical and Biophysical Research Communications. 441 (4): 820–4. doi:10.1016/j.bbrc.2013.10.149. PMID 24211197.
- ^ a b c d e Goodman & Gilman's The Pharmacological Basis of Therapeutics. The McGraw Hill Companies Inc. 1996. pp. 29–37. ISBN 978-0-07-026266-9.
- ^ a b c d e Haylett DG (2003). "Direct Measurement of Drug Binding to Receptors". In Foreman JC, Johansen T (eds.). Textbook of Receptor Pharmacology (Second ed.). Boca Raton, Florida: CRC L.L.C. pp. 153–180. ISBN 978-0849310294.