트립토판
Tryptophan
 L-트립토판의 골격식 | |||
| | |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름 트립토판 또는 (2S)-2-아미노-3-(1H-indol-3-yl)프로파노산 | |||
| 기타 이름 2-아미노-3-(1H-indol-3-yl)프로파노산 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐벨 | |||
| 켐스파이더 | |||
| 드러그뱅크 | |||
| ECHA InfoCard | 100.000.723 | ||
| 케그 | |||
펍켐 CID | |||
| 유니 | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| C11H12N2O2 | |||
| 어금질량 | 204.1987 g·messages−1 | ||
| 수용성: 0°C에서 0.23 g/L, 25°C에서 11.4 g/L, | |||
| 용해성 | 뜨거운 알코올, 알칼리 수산화물에 용해되며 클로로포름에서 용해되지 않는다. | ||
| 산도(pKa) | 2.38(carboxyl), 9.39(amino)[2] | ||
자기 감수성(magnetic susibility) | -1987.0·10cm−63/1987 | ||
| 약리학 | |||
| N06AX02(WHO) | |||
| 부가자료페이지 | |||
| 트립토판(데이터 페이지) | |||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
트립토판(Triptophan, symbol Trp 또는 W)[3]은 단백질의 생합성에 사용되는 α-아미노산이다.트립토판은 α-아미노 그룹, α-카르복실산 그룹, 사이드 체인 세일러를 함유하고 있어 비극 방향제 베타 카본 대체물을 가진 극성 분자로 되어 있다.그것은 인간에게 필수적인데, 그것은 신체가 그것을 합성할 수 없고 그것은 식단에서 얻어야 한다는 것을 의미한다.트립토판은 신경전달물질 세로토닌, 멜라토닌 호르몬, 비타민 B3의 전구체이기도 하다.[4]그것은 코돈 UGG에 의해 암호화되어 있다.
트립토판은 다른 아미노산과 마찬가지로 생리학적 pH에서 아미노군이 양성(–NH+
3; pKa = 9.39)되고 카르복실산이 감응( –COO−; pKa = 2.38)되는 zwitterion이다.[5]
많은 동물들(인간 포함)은 트립토판을 합성할 수 없다: 그들은 트립토판을 필수 아미노산으로 만들기 위해 그들의 식단을 통해 얻을 필요가 있다.
함수
트립토판을 포함한 아미노산은 단백질 생합성의 구성 요소로 사용되며, 생명을 유지하기 위해서는 단백질이 필요하다.많은 동물들(인간 포함)은 트립토판을 합성할 수 없다: 그들은 트립토판을 필수 아미노산으로 만들기 위해 그들의 식단을 통해 얻을 필요가 있다.트립토판은 단백질에서 발견되는 덜 흔한 아미노산 중 하나이지만, 그것이 발생할 때마다 중요한 구조적 또는 기능적 역할을 한다.예를 들어 트립토판과 티로신 잔여물은 세포막 내 막 단백질을 "앵커링"하는 데 특별한 역할을 한다.트립토판은 다른 방향족 아미노산과 함께 글리칸-단백질 상호작용에서도 중요하다.또한 트립토판은 다음과 같은 화합물에 대한 생화학적 전구체로 기능한다.
- 세로토닌(신경전달물질),[6][7] 트립토판 히드록실라아제로 합성.
- 멜라토닌(신경호르몬)은 세로토닌으로부터 차례로 N-아세틸전달효소와 5-히드록신돌레-O-메틸전달효소를 통해 합성된다.[8]
- 트립토판이 주로 대사되는 키누레나인(95% 이상)이다.면역계와 뇌에 있는 인도레아민 2,3-다이옥시제네아제(IDO), 간에는 트립토판 디옥시제네아제(TDO)라는 두 효소가 트립토판으로부터 키누레나인 합성을 담당한다.트립토판 카타볼리즘의 아홉 가지 길은 정신분열증,[9] 주요 우울증,[9] 조울증 같은 정신질환을 포함한 여러 질병에서 변형된다.[9][10]
- 비타민 B로도3 알려진 니아신은 트립토판으로부터 키누레나인과 퀴놀린산을 거쳐 합성된다.[11]
- 아우신(피토호르몬의 일종)은 트립토판으로부터 합성된다.[12]
과당류 흡수는 장내 트립토판의 부적절한 흡수와 혈액 내 트립토판 감소,[13] 우울증을 유발한다.[14]
트립토판을 합성하는 박테리아에서, 이 아미노산의 높은 세포 레벨은 트롭 피연산자에 결합되는 억제 단백질을 활성화시킨다.[15]이 억제기를 트립토판 피연산자에 결합하면 트립토판의 생합성에 관여하는 효소를 암호화하는 다운스트림 DNA의 전사가 방지된다.그래서 높은 수준의 트립토판은 부정적인 피드백 루프를 통한 트립토판 합성을 방지하고, 세포의 트립토판 수치가 다시 내려가면 트립토판에서의 전사가 재개된다.이것은 세포의 내외부 트립토판 수준의 변화에 대해 엄격하게 규제되고 신속한 대응을 가능하게 한다.
인간의 위장 미생물(microbiota)에 의한 트립토판 대사.) |
권장식사수당
2002년 미국 의학 연구소는 트립토판의 19세 이상 성인들을 위해 몸무게/kg 5mg/kg의 권장 식이 허용량(RDA)을 설정했다.[20]
식재료
트립토판은 대부분의 단백질 기반 식품이나 식이 단백질에 존재한다.초콜릿, 귀리, 말린 대추, 우유, 요구르트, 코티지 치즈, 붉은 고기, 달걀, 생선, 가금류, 깨, 병아리콩, 아몬드, 해바라기 씨, 호박씨, 메밀, 스피룰리나, 땅콩 등이 특히 풍부하다.조리된 칠면조에는 트립토판이 풍부하다는 통념과는[21][22] 달리, 칠면조의 트립토판 함량은 대표적인 가금류다.[23]
| 음식 | 트립토판 [g/100g의 식품] | 단백질 [g/100g의 식품] | 트립토판/단백질 [%] |
|---|---|---|---|
| 달걀흰자, 건조 | 1.00 | 81.10 | 1.23 |
| 스피룰리나, 건조 | 0.92 | 57.47 | 1.62 |
| 대구, 대서양, 건조 | 0.70 | 62.82 | 1.11 |
| 콩, 날것 | 0.59 | 36.49 | 1.62 |
| 치즈, 파르메산 | 0.56 | 37.90 | 1.47 |
| 치아씨, 건조 | 0.436 | 16.5 | 2.64 |
| 참깨 | 0.37 | 17.00 | 2.17 |
| 치즈, 체다 | 0.32 | 24.90 | 1.29 |
| 해바라기씨 | 0.30 | 17.20 | 1.74 |
| 돼지고기, 잘게 썰어 | 0.25 | 19.27 | 1.27 |
| 터키 | 0.24 | 21.89 | 1.11 |
| 치킨 | 0.24 | 20.85 | 1.14 |
| 쇠고기 | 0.23 | 20.13 | 1.12 |
| 귀리 | 0.23 | 16.89 | 1.39 |
| 연어 | 0.22 | 19.84 | 1.12 |
| 양고기, 잘게 썰어 | 0.21 | 18.33 | 1.17 |
| 퍼치, 애틀랜틱 | 0.21 | 18.62 | 1.12 |
| 칙파스, 날것 | 0.19 | 19.30 | 0.96 |
| 달걀 | 0.17 | 12.58 | 1.33 |
| 밀가루, 흰색 | 0.13 | 10.33 | 1.23 |
| 달지 않은 초콜릿 굽기 | 0.13 | 12.9 | 1.23 |
| 우유 | 0.08 | 3.22 | 2.34 |
| 밥, 백색, 중회색, 조리 | 0.028 | 2.38 | 1.18 |
| 요리되지 않은 퀴노아 | 0.167 | 14.12 | 1.2 |
| 요리된 퀴노아 | 0.052 | 4.40 | 1.1 |
| 감자, 러셋 | 0.02 | 2.14 | 0.84 |
| 타마린드 | 0.018 | 2.80 | 0.64 |
| 바나나 | 0.01 | 1.03 | 0.87 |
항우울제로 사용
트립토판은 신경전달물질 세로토닌으로 전환되는 5-하이드록시트리토판(5-HTP)으로 전환되기 때문에 트립토판이나 5-HTP를 섭취하면 뇌의 세로토닌 수치를 높여 우울증 증상을 개선할 수 있다는 제안이 나왔다.트립토판은 항우울제, 항불안제, 수면 보조제로 사용하기 위한 식이요법 보조식품으로 미국과 영국에서 판매되고 있다.유럽 일부 국가에서는 대불황 치료제로도 시판되고 있다.식단을 바꿔서 혈액 트립토판 수치가 변질될 가능성은 낮지만 정제 트립토판을 섭취하면 뇌의 세로토닌 수치가 높아지는 반면 트립토판이 함유된 음식을 섭취하면 그렇지 않다는 증거가 있다.[25][26][27]
2001년에는 5-HTP와 트립토판이 우울증에 미치는 영향에 대한 코크란 리뷰가 발표되었다.저자들은 높은 엄격성의 연구만을 포함시켰고, 둘 중 하나에 대한 데이터가 제한되어 있기 때문에 검토에 5-HTP와 트립토판을 포함시켰다.1966년에서 2000년 사이에 발표된 5-HTP와 트립토판 108건의 우울증 연구 중 저자의 포함 품질 기준을 충족한 연구는 2건에 불과해 총 64명의 연구 참여자가 있었다.이 물질은 포함된 두 연구에서 위약보다 더 효과적이었지만 저자들은 "확정하기에는 증거가 불충분한 품질이었다"면서 "효과적이고 안전하다고 입증된 대체 항우울제가 존재하기 때문에 현재 5-HTP와 트립토판의 임상적 유용성은 제한되어 있다"고 언급했다.[28]기분과 불안장애에 대한 표준치료 외에 트립토판을 보조요법으로 사용하는 것은 과학적 증거에 의해 뒷받침되지 않는다.[28][29]
부작용
트립토판 보충제의 잠재적인 부작용으로는 메스꺼움, 설사, 졸림, 가벼운 머리, 두통, 건조한 입, 흐릿한 시야, 진정, 행복, 니스타그무스(자발적인 눈 움직임) 등이 있다.[30][31]
상호작용
식이 보조제로 섭취되는 트립토판은 MAOI나 SSRI 등급의 항우울제 또는 다른 강력한 세로토닌 약물과 결합할 경우 세로토닌 증후군을 일으킬 가능성이 있다.[31]트립토판 보충제는 임상 환경에서 철저히 연구되지 않았기 때문에, 다른 약품과의 상호작용이 잘 알려져 있지 않다.[28]
격리
트립토판의 고립은 1901년 프레드릭 홉킨스에 의해 처음 보고되었다.[32]홉킨스는 가수 분해 카세인에서 트립토판을 회수했고, 600g의 조잡한 카세인에게서 4~8g의 트립토판을 회수했다.[33]
생합성 및 산업생산
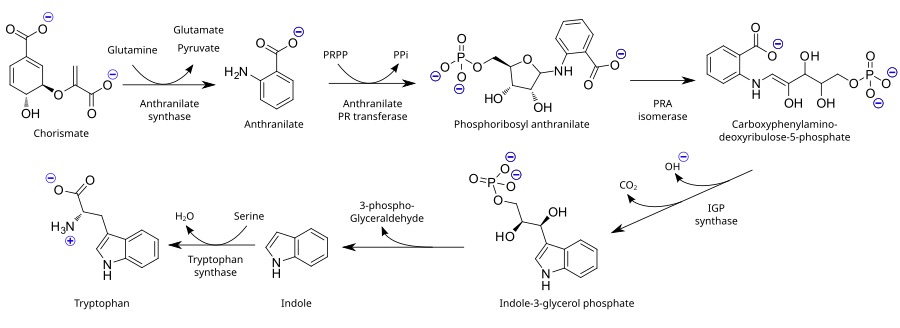
필수 아미노산으로서 트립토판은 인간과 다른 동물의 단순한 물질에서 합성되지 않기 때문에 트립토판을 함유하는 단백질의 형태로 식단에 존재할 필요가 있다.식물과 미생물은 일반적으로 시킴산이나 안탄산염으로부터 트립토판을 합성한다:[34] 안탄산염은 인포리보실피인산염(PRPP)으로 응축물을 흡수하여 부산물로 화인산염을 생성한다.리보스 모이티 링이 열리고 환원성 데카르복시화(decarboxylation)를 받아 인도레-3 글라이세롤 인산염이 생성되며, 이는 다시 인도레로 변형된다.마지막 단계에서 트립토판 싱타아제는 인도레와 아미노산 세린에서 트립토판 형성을 촉진한다.
트립토판의 산업생산 역시 생물합성성이며, B. 아밀롤리케파시엔스, B. 미분비, C. 글루타믹움 또는 대장균과 같은 야생형 또는 유전적으로 변형된 박테리아를 이용한 세린과 세롤의 발효에 기초하고 있다.이러한 변종들은 방향족 아미노산이나 다중/과다압축 trp 피연산자의 재흡수를 방지하는 돌연변이를 가지고 있다.변환은 효소 트립토판 신타아제에 의해 촉매된다.[35][36][37]
사회와 문화
어시노필리아-미알지아 증후군
1989년 미국에서 에우시노필리아-미아증후군(EMS)이 대량 발병했는데, CDC에 보고된 건수는 1500건 이상, 사망자는 최소 37건이었다.[38]미국 식품의약국(FDA)은 사전 조사 결과 이번 발병 사실이 트립토판 섭취와 연관돼 있는 것으로 드러나 1989년 트립토판 보충제를 회수하고 1990년 다른 나라들도 대부분 공매를 금지했으며,[39][40][41] 이에 따라 다른 나라들도 이에 동참했다.[42][43]
후속 연구는 EMS가 일본의 단일 대형 제조업체인 쇼와 덴코가 공급하는 L-트립토판의 특정 배치와 연관되어 있다는 것을 시사했다.[39][44][45][46]결국 쇼와 덴코의 L-트립토판의 최근 묶음이 미량의 불순물에 의해 오염되었다는 것이 명백해졌고, 이후 1989년 EMS 발병의 원인이 되는 것으로 생각되었다.[39][47][48]그러나 다른 증거는 트립토판 그 자체가 EMS에서 잠재적으로 주요한 기여 요인이 될 수 있다는 것을 암시한다.[49] 또한 전구체가 독성 조광기를[50] 형성하기에 충분한 농도에 도달했다는 주장도 있다.
FDA는 2001년 2월 트립토판의 판매 및 마케팅에 대한 규제를 완화했지만,[39] 2005년까지 면제 사용을 의도하지 않은 트립토판의 수입을 계속 제한했다.[51]
쇼와덴코 시설이 L트립토판의 오염된 묶음을 생산하기 위해 유전공학적으로 조작된 박테리아를 사용했다는 사실은 이후 어시노필리아-마이알지아 증후군의 발병을 유발한 것으로 밝혀져 '생명공학에서 유래한 제품의 화학적 순도에 대한 면밀한 모니터링'이 필요하다는 증거로 거론됐다.[52]순도 모니터링을 요구하는 이들은 결국 비 GMO 오염의 가능한 원인을 간과하고 생명공학의 발전을 위협하는 반 GMO 운동가라는 비판을 받아왔다.[53]
칠면조 고기와 졸음
미국의 일반적인 주장은 칠면조 고기를 많이 먹으면 칠면조에 들어있는 트립토판의 수치가 높기 때문에 졸음이 온다는 것이다.[22]그러나 칠면조의 트립토판 양은 다른 육류에 포함된 양과 비교해도 손색이 없다.[21][23]먹은 후의 졸음은 칠면조와 함께 먹는 다른 음식들, 특히 탄수화물에 의해 야기될 수 있다.[54]탄수화물이 풍부한 식사의 섭취는 인슐린 분비를 유발한다.[55][56][57][58]인슐린은 차례로 트립토판이 아닌, 큰 중성 브랜치 체인 아미노산(BCAA)을 근육으로 흡수하도록 자극하여 혈액 흐름에서 트립토판 대 BCAA의 비율을 증가시킨다.그 결과 트립토판 비율이 증가하면 대규모 중성 아미노산 전달체(BCAA와 방향성 아미노산을 모두 운반함)에서의 경쟁이 줄어들어 혈액-뇌장벽을 넘어 뇌척수액(CSF)으로 트립토판을 더 많이 흡수하게 된다.[58][59][60]일단 CSF에 들어가면 트립토판은 일반적인 효소 경로에 의해 강핵에서 세로토닌으로 변환된다.[56][61]결과적인 세로토닌은 소나무샘에 의해 멜라토닌으로 대사된다.[8]따라서 이러한 데이터는 "마음에 의한 졸림" 즉, 후기 졸음"이 탄수화물이 풍부한 식사의 결과일 수 있음을 시사하며, 이는 뇌의 멜라토닌 생산을 간접적으로 증가시켜 수면을 촉진시킨다.[55][56][57][61]
리서치
1912년에 펠릭스 에를리치는 효모가 이산화탄소를 분리하고 아미노군을 히드록실 그룹으로 대체함으로써 자연 아미노산을 대사한다는 것을 증명했다.이 반응에 의해 트립토판은 트립토폴을 낳는다.[62]
트립토판(Tryptophan)은 경구적으로 정제된 형태로 주어지면 뇌 세로토닌 합성에 영향을 미치고 연구를 위한 세로토닌 수치를 수정하는 데 사용된다.[27]낮은 뇌 세로토닌 수치는 급성 트립토판 고갈이라고 불리는 기술에서 트립토판 부족 단백질의 투여에 의해 유도된다.[63]이 방법을 사용한 연구는 세로토닌이 기분과 사회적 행동에 미치는 영향을 평가하여 세로토닌이 공격성을 감소시키고 상냥함을 증가시킨다는 것을 밝혀냈다.[64]
형광
트립토판은 중요한 내인성 형광 탐침(amino acid)으로 트립토판 잔류물 주위의 미세 환경의 성질을 추정하는 데 사용할 수 있다.접힌 단백질의 형광물질 배출의 대부분은 트립토판 잔류물의 배설 때문이다.
참고 항목
참조
- ^ a b Görbitz, C. H.; Törnroos, K. W.; Day, G. M. (2012). "Single-crystal investigation of L-tryptophan with Z′ = 16". Acta Crystallogr. B. 68 (Pt 5): 549–557. doi:10.1107/S0108768112033484. PMID 22992800.
- ^ Dawson RM, et al. (1969). Data for Biochemical Research. Oxford: Clarendon Press. ISBN 0-19-855338-2.
- ^ "Nomenclature and Symbolism for Amino Acids and Peptides". IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. Archived from the original on 9 October 2008. Retrieved 5 March 2018.
- ^ Slominski A, Semak I, Pisarchik A, Sweatman T, Szczesniewski A, Wortsman J (2002). "Conversion of L-tryptophan to serotonin and melatonin in human melanoma cells". FEBS Letters. 511 (1–3): 102–6. doi:10.1016/s0014-5793(01)03319-1. PMID 11821057. S2CID 7820568.
- ^ "L-tryptophan C11H12N2O2 - PubChem". pubchem.ncbi.nlm.nih.gov. Retrieved 22 December 2016.
- ^ Fernstrom JD (1983). "Role of precursor availability in control of monoamine biosynthesis in brain". Physiological Reviews. 63 (2): 484–546. doi:10.1152/physrev.1983.63.2.484. PMID 6132421.
- ^ Schaechter JD, Wurtman RJ (1990). "Serotonin release varies with brain tryptophan levels" (PDF). Brain Research. 532 (1–2): 203–10. doi:10.1016/0006-8993(90)91761-5. PMID 1704290. S2CID 8451316.
- ^ a b Wurtman RJ, Anton-Tay F (1969). "The mammalian pineal as a neuroendocrine transducer" (PDF). Recent Progress in Hormone Research. 25: 493–522. doi:10.1016/b978-0-12-571125-8.50014-4. ISBN 9780125711258. PMID 4391290. Archived from the original (PDF) on 31 May 2014.
- ^ a b c Marx, Wolfgang; McGuinness, Amelia J.; Rocks, Tetyana; Ruusunen, Anu; Cleminson, Jasmine; Walker, Adam J.; Gomes-da-Costa, Susana; Lane, Melissa; Sanches, Marsal; Diaz, Alexandre P.; Tseng, Ping-Tao (23 November 2020). "The kynurenine pathway in major depressive disorder, bipolar disorder, and schizophrenia: a meta-analysis of 101 studies". Molecular Psychiatry. 26 (8): 4158–4178. doi:10.1038/s41380-020-00951-9. ISSN 1476-5578. PMID 33230205. S2CID 227132820.
- ^ Bartoli, F; Misiak, B; Callovini, T; Cavaleri, D; Cioni, RM; Crocamo, C; Savitz, JB; Carrà, G (19 October 2020). "The kynurenine pathway in bipolar disorder: a meta-analysis on the peripheral blood levels of tryptophan and related metabolites". Molecular Psychiatry. 26 (7): 3419–3429. doi:10.1038/s41380-020-00913-1. PMID 33077852. S2CID 224314102.
- ^ Ikeda M, Tsuji H, Nakamura S, Ichiyama A, Nishizuka Y, Hayaishi O (1965). "Studies on the biosynthesis of nicotinamide adenine dinucleotide. II. A role of picolinic carboxylase in the biosynthesis of nicotinamide adenine dinucleotide from tryptophan in mammals". The Journal of Biological Chemistry. 240 (3): 1395–401. doi:10.1016/S0021-9258(18)97589-7. PMID 14284754.
- ^ Palme K, Nagy F (2008). "A new gene for auxin synthesis". Cell. 133 (1): 31–2. doi:10.1016/j.cell.2008.03.014. PMID 18394986. S2CID 9949830.
- ^ Ledochowski M, Widner B, Murr C, Sperner-Unterweger B, Fuchs D (2001). "Fructose malabsorption is associated with decreased plasma tryptophan" (PDF). Scandinavian Journal of Gastroenterology. 36 (4): 367–71. doi:10.1080/003655201300051135. PMID 11336160. Archived from the original (PDF) on 19 April 2016.
- ^ Ledochowski M, Sperner-Unterweger B, Widner B, Fuchs D (June 1998). "Fructose malabsorption is associated with early signs of mental depression". European Journal of Medical Research. 3 (6): 295–8. PMID 9620891.
- ^ Gollnick P, Babitzke P, Antson A, Yanofsky C (2005). "Complexity in regulation of tryptophan biosynthesis in Bacillus subtilis". Annual Review of Genetics. 39: 47–68. doi:10.1146/annurev.genet.39.073003.093745. PMID 16285852.
- ^ a b c d e f g h i Zhang LS, Davies SS (April 2016). "Microbial metabolism of dietary components to bioactive metabolites: opportunities for new therapeutic interventions". Genome Med. 8 (1): 46. doi:10.1186/s13073-016-0296-x. PMC 4840492. PMID 27102537.
Lactobacillus spp. convert tryptophan to indole-3-aldehyde (I3A) through unidentified enzymes [125]. Clostridium sporogenes convert tryptophan to IPA [6], likely via a tryptophan deaminase. ... IPA also potently scavenges hydroxyl radicals
표 2: 미생물 대사물: 그 합성, 작용 메커니즘, 건강과 질병에 미치는 영향
그림 1: 숙주 생리와 질병에 대한 인도레와 그 대사물의 분자 작용 메커니즘 - ^ Wikoff WR, Anfora AT, Liu J, Schultz PG, Lesley SA, Peters EC, Siuzdak G (March 2009). "Metabolomics analysis reveals large effects of gut microflora on mammalian blood metabolites". Proc. Natl. Acad. Sci. U.S.A. 106 (10): 3698–3703. Bibcode:2009PNAS..106.3698W. doi:10.1073/pnas.0812874106. PMC 2656143. PMID 19234110.
Production of IPA was shown to be completely dependent on the presence of gut microflora and could be established by colonization with the bacterium Clostridium sporogenes.
IPA 대사 다이어그램 - ^ "3-Indolepropionic acid". Human Metabolome Database. University of Alberta. Retrieved 12 June 2018.
- ^ Chyan YJ, Poeggeler B, Omar RA, Chain DG, Frangione B, Ghiso J, Pappolla MA (July 1999). "Potent neuroprotective properties against the Alzheimer beta-amyloid by an endogenous melatonin-related indole structure, indole-3-propionic acid". J. Biol. Chem. 274 (31): 21937–21942. doi:10.1074/jbc.274.31.21937. PMID 10419516. S2CID 6630247.
[Indole-3-propionic acid (IPA)] has previously been identified in the plasma and cerebrospinal fluid of humans, but its functions are not known. ... In kinetic competition experiments using free radical-trapping agents, the capacity of IPA to scavenge hydroxyl radicals exceeded that of melatonin, an indoleamine considered to be the most potent naturally occurring scavenger of free radicals. In contrast with other antioxidants, IPA was not converted to reactive intermediates with pro-oxidant activity.
- ^ Institute of Medicine (2002). "Protein and Amino Acids". Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. Washington, DC: The National Academies Press. pp. 589–768. doi:10.17226/10490. ISBN 978-0-309-08525-0.
- ^ a b Ballantyne C (21 November 2007). "Does Turkey Make You Sleepy?". Scientific American. Retrieved 6 June 2013.
- ^ a b McCue K. "Chemistry.org: Thanksgiving, Turkey, and Tryptophan". Archived from the original on 4 April 2007. Retrieved 17 August 2007.
- ^ a b c Holden, Joanne. "USDA National Nutrient Database for Standard Reference, Release 22". Nutrient Data Laboratory, Agricultural Research Service, United States Department of Agriculture. Retrieved 29 November 2009.
- ^ Rambali B, Van Andel I, Schenk E, Wolterink G, van de Werken G, Stevenson H, Vleeming W (2002). "[The contribution of cocoa additive to cigarette smoking addiction]" (PDF). RIVM. The National Institute for Public Health and the Environment (Netherlands) (report 650270002/2002). Archived from the original (PDF) on 8 November 2005.
- ^ Soh NL, Walter GT (2011). "Tryptophan and depression: can diet alone be the answer?". Acta Neuropsychiatrica. 23 (1): 1601–5215. doi:10.1111/j.1601-5215.2010.00508.x. S2CID 145779393.
- ^ Fernstrom JD (2012). "Effects and side effects associated with the non-nutritional use of tryptophan by humans". The Journal of Nutrition. 142 (12): 2236S–2244S. doi:10.3945/jn.111.157065. PMID 23077193.
- ^ a b Wurtman RJ, Hefti F, Melamed E (1980). "Precursor control of neurotransmitter synthesis". Pharmacological Reviews. 32 (4): 315–35. PMID 6115400.
- ^ a b c Shaw K, Turner J, Del Mar C (2002). Shaw KA (ed.). "Tryptophan and 5-hydroxytryptophan for depression" (PDF). The Cochrane Database of Systematic Reviews. 2010 (1): CD003198. doi:10.1002/14651858.CD003198. PMID 11869656.
- ^ Ravindran AV, da Silva TL (September 2013). "Complementary and alternative therapies as add-on to pharmacotherapy for mood and anxiety disorders: a systematic review". Journal of Affective Disorders. 150 (3): 707–19. doi:10.1016/j.jad.2013.05.042. PMID 23769610.
- ^ Kimura T, Bier DM, Taylor CL (December 2012). "Summary of workshop discussions on establishing upper limits for amino acids with specific attention to available data for the essential amino acids leucine and tryptophan". The Journal of Nutrition. 142 (12): 2245S–2248S. doi:10.3945/jn.112.160846. PMID 23077196.
- ^ a b Howland RH (June 2012). "Dietary supplement drug therapies for depression". Journal of Psychosocial Nursing and Mental Health Services. 50 (6): 13–6. doi:10.3928/02793695-20120508-06. PMID 22589230.
- ^ Hopkins FG, Cole SW (December 1901). "A contribution to the chemistry of proteids: Part I. A preliminary study of a hitherto undescribed product of tryptic digestion". The Journal of Physiology. 27 (4–5): 418–428. doi:10.1113/jphysiol.1901.sp000880. PMC 1540554. PMID 16992614.
- ^ Cox, G.J.; King, H. (1930). "L-Tryptophane". Org. Synth. 10: 100. doi:10.15227/orgsyn.010.0100.
- ^ Radwanski ER, Last RL (1995). "Tryptophan biosynthesis and metabolism: biochemical and molecular genetics". The Plant Cell. 7 (7): 921–34. doi:10.1105/tpc.7.7.921. PMC 160888. PMID 7640526.
- ^ Ikeda M (2002). "Amino acid production processes". Microbial Production of l-Amino Acids. Advances in Biochemical Engineering/Biotechnology. Vol. 79. pp. 1–35. doi:10.1007/3-540-45989-8_1. ISBN 978-3-540-43383-5. PMID 12523387.
- ^ Becker J, Wittmann C (2012). "Bio-based production of chemicals, materials and fuels -Corynebacterium glutamicum as versatile cell factory". Current Opinion in Biotechnology. 23 (4): 631–40. doi:10.1016/j.copbio.2011.11.012. PMID 22138494.
- ^ Conrado RJ, Varner JD, DeLisa MP (2008). "Engineering the spatial organization of metabolic enzymes: mimicking nature's synergy". Current Opinion in Biotechnology. 19 (5): 492–9. doi:10.1016/j.copbio.2008.07.006. PMID 18725290.
- ^ Allen, J.A.; Varga, J (2014). "Eosinophilia–Myalgia Syndrome". In Wexler, Philip (ed.). Encyclopedia of Toxicology (3rd ed.). Burlington: Elsevier Science. ISBN 978-0-12-386455-0.
- ^ a b c d "Information Paper on L-tryptophan and 5-hydroxy-L-tryptophan". FU. S. Food and Drug Administration, Center for Food Safety and Applied Nutrition, Office of Nutritional Products, Labeling, and Dietary Supplements. 1 February 2001. Archived from the original on 25 February 2005. Retrieved 8 February 2012.
- ^ "L-tryptophan: Uses and Risks". WebMD. 12 May 2017. Retrieved 5 June 2017.
- ^ Altman, Lawrence K. (27 April 1990). "Studies Tie Disorder to Maker of Food Supplement". The New York Times.
- ^ Castot, A; Bidault, I; Bournerias, I; Carlier, P; Efthymiou, ML (1991). "["Eosinophilia-myalgia" syndrome due to L-tryptophan containing products. Cooperative evaluation of French Regional Centers of Pharmacovigilance. Analysis of 24 cases]". Thérapie. 46 (5): 355–65. PMID 1754978.
- ^ "COT Statement on Tryptophan and the Eosinophilia-Myalgia Syndrome" (PDF). UK Committee on Toxicity of Chemicals in Food, Consumer Products and the Environment. June 2004.
- ^ Slutsker L, Hoesly FC, Miller L, Williams LP, Watson JC, Fleming DW (July 1990). "Eosinophilia-myalgia syndrome associated with exposure to tryptophan from a single manufacturer". JAMA. 264 (2): 213–7. doi:10.1001/jama.264.2.213. PMID 2355442.
- ^ Back EE, Henning KJ, Kallenbach LR, Brix KA, Gunn RA, Melius JM (April 1993). "Risk factors for developing eosinophilia myalgia syndrome among L-tryptophan users in New York". The Journal of Rheumatology. 20 (4): 666–72. PMID 8496862.
- ^ Kilbourne EM, Philen RM, Kamb ML, Falk H (October 1996). "Tryptophan produced by Showa Denko and epidemic eosinophilia-myalgia syndrome". The Journal of Rheumatology. Supplement. 46: 81–8, discussion 89–91. PMID 8895184.
- ^ Mayeno AN, Lin F, Foote CS, Loegering DA, Ames MM, Hedberg CW, Gleich GJ (December 1990). "Characterization of "peak E," a novel amino acid associated with eosinophilia-myalgia syndrome". Science. 250 (4988): 1707–8. Bibcode:1990Sci...250.1707M. doi:10.1126/science.2270484. PMID 2270484.
- ^ Ito J, Hosaki Y, Torigoe Y, Sakimoto K (January 1992). "Identification of substances formed by decomposition of peak E substance in tryptophan". Food and Chemical Toxicology. 30 (1): 71–81. doi:10.1016/0278-6915(92)90139-C. PMID 1544609.
- ^ Smith MJ, Garrett RH (November 2005). "A heretofore undisclosed crux of eosinophilia-myalgia syndrome: compromised histamine degradation". Inflammation Research. 54 (11): 435–50. doi:10.1007/s00011-005-1380-7. PMID 16307217. S2CID 7785345.
- ^ Michael Predator Carlton. "Molecular Biology and Genetic Engineering explained by someone who's done it". Archived from the original on 24 June 2007.
- ^ Allen, JA; Peterson, A; Sufit, R; Hinchcliff, ME; Mahoney, JM; Wood, TA; Miller, FW; Whitfield, ML; Varga, J (November 2011). "Post-epidemic eosinophilia-myalgia syndrome associated with L-tryptophan". Arthritis and Rheumatism. 63 (11): 3633–9. doi:10.1002/art.30514. PMC 3848710. PMID 21702023.
- ^ Mayeno AN, Gleich GJ (September 1994). "Eosinophilia-myalgia syndrome and tryptophan production: a cautionary tale". Trends in Biotechnology. 12 (9): 346–52. doi:10.1016/0167-7799(94)90035-3. PMID 7765187.
- ^ Raphals P (November 1990). "Does medical mystery threaten biotech?". Science. 250 (4981): 619. Bibcode:1990Sci...250..619R. doi:10.1126/science.2237411. PMID 2237411.
- ^ "Food & mood. (neuroscience professor Richard Wurtman) (Interview)". Nutrition Action Healthletter. September 1992.[데드링크]
- ^ a b Lyons PM, Truswell AS (March 1988). "Serotonin precursor influenced by type of carbohydrate meal in healthy adults". The American Journal of Clinical Nutrition. 47 (3): 433–9. doi:10.1093/ajcn/47.3.433. PMID 3279747.
- ^ a b c Wurtman RJ, Wurtman JJ, Regan MM, McDermott JM, Tsay RH, Breu JJ (January 2003). "Effects of normal meals rich in carbohydrates or proteins on plasma tryptophan and tyrosine ratios". The American Journal of Clinical Nutrition. 77 (1): 128–32. doi:10.1093/ajcn/77.1.128. PMID 12499331.
- ^ a b Afaghi A, O'Connor H, Chow CM (February 2007). "High-glycemic-index carbohydrate meals shorten sleep onset". The American Journal of Clinical Nutrition. 85 (2): 426–30. doi:10.1093/ajcn/85.2.426. PMID 17284739.
- ^ a b Banks WA, Owen JB, Erickson MA (2012). "Insulin in the Brain: There and Back Again". Pharmacology & Therapeutics. 136 (1): 82–93. doi:10.1016/j.pharmthera.2012.07.006. ISSN 0163-7258. PMC 4134675. PMID 22820012.
- ^ Pardridge WM, Oldendorf WH (August 1975). "Kinetic analysis of blood-brain barrier transport of amino acids". Biochimica et Biophysica Acta (BBA) - Biomembranes. 401 (1): 128–36. doi:10.1016/0005-2736(75)90347-8. PMID 1148286.
- ^ Maher TJ, Glaeser BS, Wurtman RJ (May 1984). "Diurnal variations in plasma concentrations of basic and neutral amino acids and in red cell concentrations of aspartate and glutamate: effects of dietary protein intake". The American Journal of Clinical Nutrition. 39 (5): 722–9. doi:10.1093/ajcn/39.5.722. PMID 6538743.
- ^ a b Fernstrom JD, Wurtman RJ (1971). "Brain serotonin content: increase following ingestion of carbohydrate diet". Science. 174 (4013): 1023–5. Bibcode:1971Sci...174.1023F. doi:10.1126/science.174.4013.1023. PMID 5120086. S2CID 14345137.
- ^ Jackson RW (1930). "A synthesis of tryptophol" (PDF). Journal of Biological Chemistry. 88 (3): 659–662. doi:10.1016/S0021-9258(18)76755-0.
- ^ Young SN (September 2013). "Acute tryptophan depletion in humans: a review of theoretical, practical and ethical aspects". Journal of Psychiatry & Neuroscience. 38 (5): 294–305. doi:10.1503/jpn.120209. PMC 3756112. PMID 23428157.
- ^ Young SN (2013). "The effect of raising and lowering tryptophan levels on human mood and social behaviour". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 368 (1615): 20110375. doi:10.1098/rstb.2011.0375. PMC 3638380. PMID 23440461.
추가 읽기
- Wood RM, Rilling JK, Sanfey AG, Bhagwagar Z, Rogers RD (May 2006). "Effects of tryptophan depletion on the performance of an iterated Prisoner's Dilemma game in healthy adults". Neuropsychopharmacology. 31 (5): 1075–84. doi:10.1038/sj.npp.1300932. PMID 16407905.
외부 링크
- "KEGG PATHWAY: Tryptophan metabolism - Homo sapiens". KEGG: Kyoto Encyclopedia of Genes and Genomes. 23 August 2006. Retrieved 20 April 2008.
- G. P. Moss. "Tryptophan Catabolism (early stages)". Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB). Archived from the original on 13 September 2003. Retrieved 20 April 2008.
- G. P. Moss. "Tryptophan Catabolism (later stages)". Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB). Archived from the original on 13 September 2003. Retrieved 20 April 2008.
- B. Mikkelson; D. P. Mikkelson (22 November 2007). "Turkey Causes Sleepiness". Urban Legends Reference Pages. Snopes.com. Retrieved 20 April 2008.