여성화 호르몬 치료
Feminizing hormone therapy| 다음에 대한 시리즈 일부 |
| 트랜스젠더 주제 |
|---|
| |
수혈 호르몬 치료라고도 알려진 여성화 호르몬 요법은 성전환자의 2차 성적 특성을 남성적 또는 남성적 또는 남성적, 남성적, 남성적, 남성적, 남성적, 남성적, 남성적, 여성적인 것으로 바꾸는 호르몬 요법과 성 재지정 요법이다.[1][2][3][4][5][6] 트랜스젠더 호르몬 치료의 흔한 유형으로 트랜스젠더 여성과 비이성 수혈성 개인 치료에 쓰인다. 일부 성간호사들도 개인적인 필요와 선호에 따라 이런 형태의 치료를 받는다.
요법의 목적은 가슴과 여성적인 패턴의 머리카락, 지방, 근육 분포 등 원하는 성의 2차 성 특성을 발달시키는 것이다. 자연적으로 발생하는 사춘기에 의해 발생하는 많은 변화를 되돌릴 수 없기 때문에 수술과 다른 치료가 필요할 수 있다(아래 참조). 호르몬 치료의 여성화에 사용되는 약으로는 에스트로겐, 안티안드로겐, 프로게스테르겐, 고나도트로핀 방출 호르몬 조절기(GnRH 조절기) 등이 있다.
요법은 사람의 첫 사춘기의 효과를 되돌릴 수 없는 반면(발생한 경우) 자신의 성별과 관련된 2차 성 특성을 발달시켜 성기능장애와 관련된 괴로움과 불편함의 일부 또는 전부를 경감시키고, 그 사람이 '통과'를 하거나 자신의 성으로 보이도록 도울 수 있는 것으로 나타났다.[7] 체내에 외생 호르몬을 도입하면 모든 수준에서 체내에 영향을 미치고 많은 환자들이 에너지 수준, 기분, 식욕, 그리고 다른 부위의 변화를 보고한다. 환자에게 성 정체성을 더욱 조화롭게 하는 신체를 제공해 삶의 질을 높이는 것이 치료의 목표다.
의학적 용법
트랜스젠더 여성, 수혈미닌 비이성인 또는 성간염인에서 여성화 및/또는 탈분산화를 생산한다.
요구 사항들
많은 의사들이 세계트랜스젠더건강협회(WPATH) 표준관리기준(SoC) 모델에 의해 수술하며 성전환자가 호르몬 치료를 받기 위해서는 심리치료와 심리치료사의 추천서가 필요하다.[8] 다른 의사는 정보에 입각한 동의모델로 수술하며, 동의 외에 트랜스젠더 호르몬 치료를 위한 요구사항이 없다.[8] 트랜스젠더 호르몬 치료제에 사용되는 약물도 규제되지 않은 온라인 약국에서 처방전 없이 인터넷에서 판매되고 있으며, 일부 트랜스젠더 여성들은 이러한 약을 구입하여 DIY(Do-It-Yourself)나 자가 치료법을 이용해 스스로 치료하기도 한다.[9][10] 많은 트랜스젠더 개인이 /r/TransDIY 및 /r/MtFHRT와 같은 Reddit 커뮤니티에서 DIY 호르몬 치료법에 대한 정보를 토론하고 공유한다.[9][10][11][12] 많은 트랜스젠더들이 DIY 호르몬 요법으로 눈을 돌리는 한 가지 이유는 영국과 같은 세계 일부 지역에서 표준 의사 기반 호르몬 요법의 오랜 대기자 명단뿐만 아니라 의사를 만나는 데 드는 종종 높은 비용과 치료에 부적합한 기준을 만드는 제한적인 기준 때문이다.[9][10]
트랜스젠더 호르몬 치료의 접근성은 전 세계와 개별 국가마다 다르다.[8]
약물
| 약물 | 브랜드명 | 유형 | 경로 | 복용량[b] |
|---|---|---|---|---|
| 에스트라디올 | 다양한 | 에스트로겐 | 구강 | 2-10mg/일 |
| 다양한 | 에스트로겐 | 하위 언어 | 1~8mg/일 | |
| 클라이마라[c] | 에스트로겐 | TD 패치를 붙이다 | 25–400 μg/일 | |
| 디비겔[c] | 에스트로겐 | TD 젤 | 0.5–5 mg/일 | |
| 다양한 | 에스트로겐 | SC 이식하다 | 6–24 mos마다 50–200 mg | |
| 에스트라디올 발레리테 | 프로기노바 | 에스트로겐 | 구강 | 2-10mg/일 |
| 프로기노바 | 에스트로겐 | 하위 언어 | 1~8mg/일 | |
| 델레스트로겐[c] | 에스트로겐 | IM, SC | 2-10mg/wk 또는 2 wk마다 5–20 mg | |
| 에스트라디올 시피오네이트 | 데포 에스트라디올 | 에스트로겐 | IM, SC | 2-10mg/wk 또는 2 wk마다 5–20 mg |
| 에스트라디올 벤조아테 | 프로기넌-B | 에스트로겐 | IM, SC | 0.5–1.5mg/2-3일마다 |
| 에스트리올 | 오베스틴[c] | 에스트로겐 | 구강 | 4-6mg/일 |
| 스피로놀락톤 | 알닥톤 | 항안드로겐 | 구강 | 100–400 mg/일 |
| 사이프로테론 아세테이트 | 안드로쿠르 | 항안드로겐; 프로게스테겐 | 구강 | 5–100 mg/일 |
| 안드로쿠르 디포 | IM | 월 300mg | ||
| 비칼루타미드 | 카소덱스 | 항안드로겐 | 구강 | 25-50mg/일 |
| 엔잘루타미드 | Xtandi | 항안드로겐 | 구강 | 160mg/일 |
| GnRH 아날로그 | 다양한 | GnRH 모듈레이터 | 다양한 | 변수 |
| 엘라골릭스 | 오리사 | GnRH 길항제 | 구강 | 150 mg/일 또는 하루에 2회 200mg |
| 피나스테라이드 | 프로페시아 | 5αR 억제제 | 구강 | 1일 ~ 5mg/일 |
| 두타스테라이드 | 아보다르트 | 5αR 억제제 | 구강 | 0.25–0.5 mg/일 |
| 프로게스테론 | 프로메트리움[c] | 프로게스테겐 | 구강 | 100–400 mg/일 |
| 메드록시프로게스테론 아세테이트 | 프로베라 | 프로게스테겐 | 구강 | 2.5~40mg/day |
| 디포프로베라 | 프로게스테겐 | IM | 3에 150 mg | |
| 디포-서브큐 프로베라 104 | 프로게스테겐 | SC | 3 mos 당 104 mg | |
| 히드록시프로게스테론 카프로이트 | 프로루톤 | 프로게스테겐 | IM | 250mg/wk |
| 디드로게스테론 | 뒤파스턴 | 프로게스테겐 | 구강 | 1일 20mg |
| 드로스피레논 | 슬라이언드 | 프로게스테겐 | 구강 | 1일 3mg |
| 돔페리돈[d] | 모틸륨 | 프롤락틴 강등제 | 구강 | 30-80mg/day[e] |
트랜스젠더 여성을 위한 호르몬 치료에는 다양한 성호르몬제가 사용된다.[13][8][3][4] 여기에는 여성화를 유도하고 테스토스테론 수치를 억제하기 위한 에스트로겐, 안드로겐 수용체 길항제, 안티고나도트로핀, GnRH 조절제, 테스토스테론과 같은 안드로겐의 효과를 더욱 반대하기 위한 5α-감소효소 억제제, 불확실한 이점임에도 불구하고 다양한 가능한 프로게스테르겐 등이 포함된다.[13][8][3][4] 에스트로겐과 항안드로겐을 결합한 에스트로겐은 트랜스젠더 여성을 위한 여성 호르몬 치료의 주축이다.[46][47]
에스트로겐스
에스트로겐은 여성의 주요 성호르몬으로 유방, 넓은 엉덩이, 여성적인 지방분포의 패턴 등 여성적인 2차 성특성의 발달과 유지에 책임이 있다.[4] 에스트로겐은 신체의 생물학적 목표물인 에스트로겐 수용체(ER)에 결합하고 활성화함으로써 작용한다.[50] 다양한 형태의 에스트로겐이 사용 가능하고 의학적으로 사용된다.[50] 트랜스젠더 여성에게 가장 많이 사용되는 에스트로겐은 여성에서 가장 많이 사용되는 에스트라디올과 에스트라디올 발리테이트, 에스트라디올 시피오네이트 등의 에스트라디올 에스테르이다.[13][4][50] 갱년기 호르몬 요법에 쓰이는 결합 에스트로겐(프리마린)과 피임약에 쓰이는 에틸비닐라디올은 과거 트랜스젠더 여성에게는 사용됐지만 더 이상 권장되지 않고 혈전과 심혈관계 질환의 위험이 높아 오늘날에는 거의 사용하지 않는다.[4][13][8][5] 에스트로겐은 경구적으로, 경구적으로, (패치나 젤을 통해), 직장적으로, 근육내 또는 피하 주사 또는 임플란트에 의해 투여될 수 있다.[50][51][52][53][54] 혈전 및 심혈관 질환의 위험이 최소 또는 미미하기 때문에 파렌터럴(비도덕적) 경로가 선호된다.[5][55][56][57][58]
에스트로겐은 여성화를 일으키는 것 외에도 항원성 호르몬 효과가 있고 생식 호르몬 분비를 억제한다.[51][49][59] 그들은 주로 트랜스젠더 여성의 테스토스테론 수치 억제에 책임이 있다.[51][59] 200 pg/mL 이상의 에스트라디올 수치는 테스토스테론 수치를 약 90% 억제하는 반면, 500 pg/mL 이상의 에스트라디올 수치는 테스토스테론 수치를 약 95% 억제하거나 수술적 거세 및 GnRH 조절기와 동등한 수준으로 억제한다.[60][61] 에스트라디올의 낮은 수준도 테스토스테론 생산을 상당히 그러나 불완전하게 억제할 수 있다.[49] 테스토스테론 수치가 에스트라디올에만 의해 충분히 억제되지 않을 때, 안티안드로겐을 사용하여 잔류 테스토스테론의 효과를 억제하거나 차단할 수 있다.[51] 경구 에스트라디올은 비교적 낮은 에스트라디올 레벨로 인해 테스토스테론 수치를 적절히 억제하는 데 어려움을 겪는 경우가 많다.[49][62][63]
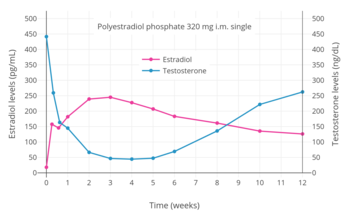
난초 절제술(고나드의 수술적 제거)이나 성전환 수술 이전에 트랜스젠더 여성에 사용되는 에스트로겐의 복용량이 시스젠더 여성에 사용되는 대체 투여량보다 높은 경우가 많다.[64][65][66] 이것은 테스토스테론 수치를 억제하는 것을 돕기 위한 것이다.[65] 내분비학회(2017년)는 약 100~200pg/mL의 폐경 전 여성의 에스트라디올 수치를 정상 평균 범위 내에서 대략적으로 유지할 것을 권고한다.[13] 그러나 에스트라디올의 이러한 생리학적 수준은 대개 테스토스테론 수치를 여성 범위에 억제할 수 없다는 점에 주목한다.[13] 2018년 코크란 검토 제안서는 트랜스젠더 여성의 에스트라디올 수치를 낮게 유지한다는 개념에 의문을 제기했는데, 이는 테스토스테론 수치를 불완전하게 억제하고 안티안드로겐을 추가해야 하는 결과를 초래한다.[67] 검토안은 고선량 파렌탈 에스트라디올이 안전한 것으로 알려져 있다고 지적했다.[67] 내분비학회 자체에서는 에스트라디올 수치가 정상 여성 범위를 현저히 초과하게 되는 에스트라디올 에스테르 복용량을 권장한다. 예를 들어, 일주일에 에스트라디올은 근육내 주입에 의해 용해된다.[13] 그러한 주사 한 번을 투여하면 에스트라디올 수치가 피크 시 약 1,250 pg/mL, 7일 후 약 200 pg/mL가 된다.[68][69] 난초수술이나 성전환 수술 후 고나달 테스토스테론 억제가 더 이상 필요하지 않을 때 에스트로겐 복용량을 줄일 수 있다.[5]
안티안드로겐스
안티안드로겐은 체내 안드로겐의 영향을 막는 약이다.[70][71] 테스토스테론과 디히드로테스토스테론(DHT)과 같은 안드로겐은 고환이 있는 개개인의 주요 성호르몬으로, 깊은 목소리와 넓은 어깨, 그리고 머리카락, 근육, 지방분포의 남성적인 패턴 등 남성적인 2차 성특성의 개발과 유지에 책임이 있다.[72][73] 또 안드로겐은 성욕과 자발적 발현 빈도를 자극하며 여드름, 체취, 안드로겐 의존성 두피 탈모 등의 원인이 된다.[72][73] 그들은 또한 유방에 기능적인 항 에스트로겐 효과를 가지고 있고, 심지어 낮은 수치에서도 에스트로겐 매개 유방 발달을 반대한다.[74][75][76][77] 안드로겐은 체내에서 그들의 생물학적 목표물인 안드로겐 수용체에 결합하고 활성화함으로써 작용한다.[78] 안티안드로겐은 안드로겐 수용체에 앤드로겐이 결합하는 것을 차단하거나 안드로겐의 생산을 억제하거나 억제함으로써 작용한다.[70]
안드로겐 수용체를 직접 차단하는 항안드로겐은 안드로겐 수용체 길항제 또는 차단제로 알려져 있고, 안드로겐의 효소 생합성을 억제하는 항안드로겐은 안드로겐 합성억제제, 생식선에서 안드로겐 생성을 억제하는 항안드로겐은 안티고나도트로핀으로 알려져 있다.[71] 에스트로겐과 프로게스테르겐은 항고나도트로핀이므로 기능성 안티안드로겐이다.[51][79][80][81] 트랜스젠더 여성들에게 안티안드로겐을 사용하는 목적은 에스트로겐만으로 억제되지 않는 잔여 테스토스테론을 차단하거나 억제하는 것이다.[51][70][59] 테스토스테론 수치가 정상 여성 범위에 있거나 난초 절제술을 받은 경우 추가 항안드로겐 치료가 반드시 필요한 것은 아니다.[51][70][59] 그러나 정상 여성 범위에서 테스토스테론 수치를 가지고 있고 여드름, 지루성, 지성 피부, 두피 탈모 등과 같은 안드로겐 의존성 피부 및/또는 모발 증상이 지속되는 개인은 항안드로겐이 그러한 증상을 감소시키거나 제거할 수 있기 때문에 항안드로겐의 첨가로부터 여전히 혜택을 받을 수 있다.[82][83][84]
스테로이드 안티안드로겐
스테로이드 안티안드로겐은 화학구조상 테스토스테론이나 프로게스테론 같은 스테로이드 호르몬을 닮은 안티안드로겐이다.[85] 그들은 트랜스젠더 여성들에게 가장 흔하게 사용되는 안티안드로겐이다.[8] 상대적으로 안전하고 저렴한 스피로놀락톤(Aldactone)은 미국에서 가장 많이 사용되는 항안드로겐이다.[86][87] 미국에서 구할 수 없는 사이프로테론 아세테이트(안드로쿠르)는 유럽, 캐나다, 그리고 전 세계에서 널리 사용되고 있다.[8][70][86][88] 비슷한 약인 메드록시프로게스테론 아세테이트(Provera, Depo-Provera)가 미국에서 사이프로테론 아세테이트 대신 쓰이기도 한다.[89][90]
스피로놀락톤(Spironolactone)은 항미노코르티코이드(미네랄코르티코르티코이드 수용체의 길항제)와 칼륨-스파잉 이뇨제로, 다른 이뇨제에 의한 고혈압, 부종, 높은 알도스테론 수치, 낮은 칼륨 수치를 치료하는데 주로 쓰인다.[92] 스피로놀락톤은 2차 작용으로서 항안드로겐이며 원래 의도하지 않은 작용이다.[92] 주로 안드로겐 수용체 길항제 역할을 하면서 항안드로겐 역할을 한다.[93] 그 약은 또한 약한 스테로이드제네시스 억제제로 안드로겐의 효소 합성을 억제한다.[94][93][95] 그러나 이 작용은 효력이 낮고 스피로놀락톤은 호르몬 수치에 혼재되어 일관성이 없는 효과가 있다.[94][93][95][96][97] 어떤 경우든 테스토스테론 수치는 보통 스피로놀락톤에 의해 변하지 않는다.[94][93][95][96][97] 트랜스젠더 여성에 대한 연구는 테스토스테론 수치가 스피로놀락톤으로[49] 바뀌지 않거나 감소하는 것을 발견했다.[91] 스피로놀락톤은 상대적으로 약한 항안드로겐으로 묘사된다.[98][99][100] 남성보다 테스토스테론 수치가 훨씬 낮은 여성에게서 여드름, 과도한 모발 성장, 과란도 발생증 치료에 널리 쓰인다.[96][97] 스피로놀락톤은 안티메랄로코르티코이드 활성 때문에 안티메랄로코르티코이드 부작용이[101] 있으며 높은 칼륨 수치를 유발할 수 있다.[102][103] 입원 및/또는 사망은 스피로놀락톤으로 인한 높은 칼륨 수치로 인해 발생할 수 있지만,[102][103][104] 스피로놀락톤을 복용하는 사람들의 높은 칼륨 수치의 위험은 위험 요인이 없는 사람들에게서 미미해 보인다.[97][105][106] 따라서 대부분의 경우 칼륨 농도의 모니터링이 필요하지 않을 수 있다.[97][105][106] 스피로놀락톤은 경구 에스트라디올의 높은 복용량의 생체이용률을 감소시키는 것으로 밝혀졌다.[49] 널리 고용되었지만, 트랜스젠더 여성들에게 스피로놀락톤을 항안드로겐으로 사용하는 것은 최근 그러한 목적을 위한 약의 여러 단점 때문에 의심받고 있다.[49]
시프로테론 아세테이트(Cyproterone acetate)는 항안드로겐과 프로게스틴으로, 수많은 안드로겐 의존적 조건의 치료에 사용되며, 피임약에서도 프로게스테겐으로 사용된다.[107][108] 그것은 주로 항고나도트로핀으로 작용하고, 두 번째로 강력한 프로제스트로겐 활동으로 작용하며, 생식 안드로겐 생성을 강하게 억제한다.[107][59] 하루 5~10mg/일 복용량의 사이프로테론 아세테이트가 남성의 테스토스테론 수치를 약 50~70%[109][110][111][112] 낮추는 반면, 100mg/일 복용량은 남성의 테스토스테론 수치를 약 75%[113][114] 낮추는 것으로 나타났다. 1일 사이프로테론 아세테이트 25mg과 적당량의 에스트라디올을 혼합한 결과 트랜스젠더 여성의 테스토스테론 수치를 약 95% [115]억제하는 것으로 나타났다. 에스트로겐과 결합하여 10, 25, 50 mg/일 사이프로테론 아세테이트 모두 같은 정도의 테스토스테론 억제를 보였다.[116] 시프로테론 아세테이트(cyproterone acetate)는 안티고나도트로핀(antigonadotropin)으로서의 작용 외에 안드로겐 수용체 길항제다.[107][70] 그러나 이러한 작용은 저용량에서는 상대적으로 경미하며, 전립선암 치료(일 100~300mg/일)에 사용되는 시프로테론 아세테이트의 고용량에서 더욱 중요하다.[117][118] 사이프로테론 아세테이트는 간 기능 부전을 포함한 간 효소 증가와 간 손상을 유발할 수 있다.[70][119] 그러나 이것은 주로 매우 많은 양의 사이프로테론 아세테이트를 복용하는 전립선암 환자들에게서 발생한다; 간 독성은 트랜스젠더 여성들에게 보고되지 않았다.[70] 또한 시프로테론 아세테이트에는 피로와 체중 증가와 같은 다양한 부작용과 혈액 응고, 양성 뇌종양과 같은 위험들이 있다.[59][70][120] 사이프로테론 아세테이트 치료 중 간 효소와 프로락틴 농도의 주기적인 모니터링이 권장될 수 있다.
메드록시프로게스테론 아세테이트(Medroxyprogesterone acetate)는 시프로테론 아세테이트와 관련이 있는 프로게스틴으로, 그 대안으로 사용되기도 한다.[89][90] 특히 미국에서 사이프로테론 아세테이트의 대안으로 사용되는데, 여기서 사이프로테론 아세테이트가 의료용으로 승인되지 않아 사용할 수 없다.[89][90] 메드록시프로게스테론 아세테이트는 트랜스젠더 여성의 테스토스테론 수치를 시프로테론 아세테이트와 유사하게 억제한다.[90][49] 구강 메드록시프로게스테론 아세테이트가 하루 섭취량 20~100mg에 걸쳐 남성의 테스토스테론 수치를 약 30~75% 억제하는 것으로 밝혀졌다.[121][122][123][124][125] 그러나 시프로테론 아세테이트와 대조적으로 메드록시프로게스테론 아세테이트 역시 안드로겐 수용체 길항제인 것은 아니다.[50][126] 메드록시프로게스테론 아세테이트(Medroxyprogesterone acetate)는 시프로테론 아세테이트와 부작용과 위험이 유사하지만 간 질환과는 관련이 없다.[127][101]
수많은 다른 프로게스테르균들과 더 나아가 항고나도트로핀은 남성들의 테스토스테론 수치를 억제하는데 사용되어 왔으며 트랜스젠더 여성들에게도 유용할 것이다.[128][129][130][131][132][133][134] 프로게스테르균만 일반적으로 남성의 테스토스테론 수치를 약 70~80%까지 억제할 수 있으며, 충분히 높은 용량으로 사용할 경우 여성/캐스트레이트 수치 바로 위까지 억제할 수 있다.[135][136][137] 에스트로겐(예: 0.5~1.5mg/일 경구 에스트라디올)의 매우 적은 용량으로 프로게스테겐의 충분한 복용량을 조합하면 항원항복제 효과 측면에서 시너지 효과가 있으며, 고나달 테스토스테론 생성을 완전히 억제할 수 있어 테스토스테론 수치가 여성/캐스트 레이트 범위로 감소한다.[138][139]
비스테로이드 항안드로겐
비스테로이드 항안드로겐은 비스테로이드성 항안드로겐으로, 화학적 구조 면에서 스테로이드 호르몬과 관련이 없다.[85][140] 이러한 약들은 주로 전립선암 치료에 [140]쓰이지만 여드름 치료, 과도한 안면/신체 모발 성장, 여성의 높은 안드로겐 수치 등 다른 용도로도 쓰인다.[17]</ref>[141][142][143] 스테로이드 항안드로겐과 달리 비스테로이드 항안드로겐은 안드로겐 수용체에 대해 선택성이 높고 순수한 안드로겐 수용체 길항제 역할을 한다.[140][144] 그러나 스피로놀락톤과 마찬가지로 안드로겐 수치를 낮추지 않고 안드로겐 수용체가 활성화되는 것을 방지하여 독점적으로 작용한다.[140][144] 비스테로이드 항안드로겐은 스테로이드 항안드로겐보다 효과적인 안드로겐 수용체 길항제인데, 이러한 이유로 GnRH 조절기와 함께 전립선암 치료에서 스테로이드 항안드로겐을 대체하는 경우가 많았다.[85][145][140][146]
트랜스젠더 여성들에게 사용되어 온 비스테로이드성 항안드로겐은 1세대 플루타미드(Eulexin), 닐루타미드(Anandron, Nilandron), 비칼루타미드(Casodex) 등이 있다.[17][22][5][3][147]: 477 엔잘루타미드(Xtandi), 아팔루타미드(Erleada), 다로루타미드(Nubeqa)와 같은 새롭고 더욱 효과적인 제2세대 비스테로이드 항안드로겐도 존재하지만, 제네릭은 사용할 수 없고 트랜스젠더 여성에게는 사용되지 않아 매우 비싸다.[148][149] 플루타미드와닐루타미드는 간 손상과 폐질환의 위험이 상당히 높은 등 비교적 높은 독성을 가지고 있다.[150][141] 그 위험 때문에, 시스젠더와 트랜스젠더 여성들에게 플루타미드 사용은 현재 제한되고, 장려되고 있다.[17][141][5] 플루타미드와 니루타미드는 임상실무에서 비스테로이드 항안드로겐 처방전의 거의 90%를 차지하는 [151][152]등 대체로 비스테로이드성 항안드로 대체되어 왔다.[153][144] 비칼루타미드는 시프로테론 아세테이트와 비교했을 뿐만 아니라 플루타미드,닐루타미드에 비해 내구성과 안전성이 뛰어나다고 한다.[154][155][156] 여성에게는 거의 부작용이 없다.[142][143] 그러나, 그것의 인내성과 안전성이 크게 향상되었음에도 불구하고, 비칼루타미드는 여전히 간 효소가 상승하고 간 손상과 폐 질환의 매우 드문 사례와 연관될 위험이 작다.[17][150][157]
비스테로이드성 항안드로겐 바이칼루타미드 같은 비스테로이드성 항안드로겐 테스토스테론 수치를 억제하고 시프로테론 아세테이트와 GnRH 조절기와 같은 기능을 크게 방해할 수 있는 항안드로겐 상대적으로 성욕, 성기능 및/또는 생식력을 보존하고자 하는 트랜스젠더 여성에게 특히 유리한 선택일 수 있다.[158][159][160] 그러나 에스트로겐은 테스토스테론 수치를 억제하고, 많은 양을 복용하면 스스로 성욕과 기능 및 다산을 현저하게 방해할 수 있다.[161][162][163][164] 또한, 장기 노출 후 에스트로겐에 의한 생식기능과 생식능력의 붕괴는 영구적일 수 있다.[163][164]
GnRH 변조기
GnRH 조절기는 강력한 항고나도트로핀이며 따라서 기능적인 항안드로겐이다.[165] 남성과 여성 모두 시상하부에서 고나도트로핀 방출 호르몬(GnRH)이 생성돼 뇌하수체에서 고나도트로핀 루틴화 호르몬(LH)과 모낭 자극 호르몬(FSH)의 분비를 유도한다.[165] 고나도트로핀은 생식샘에 테스토스테론과 에스트라디올과 같은 성호르몬을 만들기 위해 신호를 보낸다.[165] GnRH 조절기는 GnRH 수용체와 결합하여 억제하므로 고나도트로핀 방출을 방지한다.[165] 그 결과 GnRH 조절기는 생식 호르몬 생성을 완전히 차단할 수 있으며, 남성과 트랜스젠더 여성의 테스토스테론 수치를 약 95%까지 감소시키거나 외과적 거세와 동등한 수준으로 감소시킬 수 있다.[165][166][167] GnRH 변조기는 GnRH 유사점이라고도 한다.[165] 그러나 임상적으로 사용되는 GnRH 변조기가 모두 GnRH와 유사한 것은 아니다.[168]
GnRH 조절기에는 GnRH 작용제와 GnRH 길항제 두 종류가 있다.[165] 이 약물들은 GnRH 수용체에 반대 작용을 하지만 역설적으로 동일한 치료 효과를 가진다.[165] 르우프로렐린(Lupron), 고세렐린(Zoladex), 부셀린(Supreact)과 같은 GnRH 작용제는 GnRH 수용체 슈퍼가형제로서 수용체가 비기능적이 되도록 GnRH 수용체를 심오하게 감응화시키는 작용을 한다.[165][166] 이는 GnRH가 일반적으로 펄스로 방출되지만 GnRH 작용제가 지속적으로 존재하기 때문에 발생하며, 이는 수용체의 과도한 하향 조절을 초래하고 궁극적으로 완전한 기능 상실을 초래한다.[169][170][165] 치료를 시작할 때 GnRH 작용제는 GnRH 수용체의 급성 과응축으로 인한 호르몬 수치에 대한 "평평한" 효과와 관련이 있다.[165][171] 남성의 경우 LH 수치가 최대 800% 증가하는 반면 테스토스테론 수치는 기준치의 약 140~200%로 증가한다.[172][171] 그러나 점차적으로 GnRH 수용체 감소가 되고, 테스토스테론 수치는 약 2-4일 후에 정점을 찍고, 약 7-8일 후에 기준치로 복귀하며, 2-4주 내에 거세 수준으로 감소한다.[171] 에스트로겐, 사이프로테론 아세테이트 등 안티고나도트로핀은 물론 플루타미드, 비칼루타미드 등 비스테로이드성 항안드로겐도 미리 사용할 수 있어 GnRH 작용제로 인한 테스토스테론 플레어 효과를 줄이거나 예방할 수 있다.[173][172][174][175][51][176] GnRH 작용제와는 대조적으로 Degarlix(Firmagon)와 엘라골릭스(Orilissa)와 같은 GnRH 길항제들은 GnRH 수용체에 활성화하지 않고 결합하여 작용하므로 수용체로부터 GnRH를 대체하고 그 활성화를 막는다.[165] GnRH 작용제와는 달리 GnRH 길항제에게는 초기 서지 효과가 없다; 치료 효과는 즉각적이며, 성호르몬 수치는 며칠 안에 거세 수준으로 감소한다.[165][166]
gnRH 조절기는 트랜스젠더 여성의 테스토스테론 억제에 매우 효과적이며, 성호르몬 결핍을 동반 에스트로겐 치료로 피할 때 부작용이 거의 없거나 전혀 없다.[13][177] 그러나 GnRH 변조기는 매우 비싼 경향이 있으며(일반적으로 미국에서는 연간 미화 1만 달러에서 미화 1만 5천 달러) 의료보험에 의해 종종 거부된다.[13][178][179][180] GNRH 변조기 요법은 외과적 거세보다 경제성이 훨씬 떨어지며 장기적으로는 외과적 거세보다 편리성이 떨어진다.[181] 그들의 비용 때문에, 많은 트랜스젠더 여성들은 GnRH 조절기를 살 여유가 없고 테스토스테론 억제를 위해 종종 덜 효과적인 다른 선택사항들을 사용해야 한다.[13][178] 그러나 영국에서는 성전환 여성들에게 GnRH 작용제를 표준 실천요법으로 규정하고 있는데, 이 경우 국민건강서비스(NHS)가 이들을 대상으로 한다.[178][182] 이는 유럽의 나머지 지역이나 미국과는 대조적이다.[182] GnRH 조절기의 또 다른 단점은 대부분 펩타이드로 경구 활성화가 되지 않아 주입, 임플란트 또는 비강 스프레이로 투여해야 한다는 점이다.[174] 다만 2018년과 2019년에는 비펩타이드 및 구술활동 GnRH 길항원 엘라골릭스(오릴리사)와 릴루골릭스(렐루미나)가 각각 의료용으로 도입됐다. 그러나 그것들은 특허 보호 하에 있고, 다른 GnRH 변조기와 마찬가지로 현재 매우 비싸다.[183]
관련 지표가 있는 성(性)의 청소년에서는 GnRH 조절기를 사용하여 환자가 현재 식별하는 성에 대한 변화를 유도하지 않고 원치 않는 성(性) 변화를 일정 기간 중단시킬 수 있다. GnRH 조절기를 사용하는 것이 임상적으로, 도덕적으로, 그리고 법적으로 안전한 가장 이른 나이에 대해, 그리고 얼마나 오랫동안, 상당한 논란이 있다. 세계트랜스젠더건강관리기준 6판은 태너 2단계부터 허용하지만 5년 이상이 지난 16세까지 호르몬의 첨가는 허용하지 않고 있다. 성 스테로이드제는 사춘기에서의 역할 외에도 중요한 기능을 가지고 있으며, 남성적이라고 여겨질 수 있는 일부 골격 변화(높이 증가 등)는 GnRH 조절기에 의해 방해받지 않는다.
5α-감소효소 억제제
5α-감소효소 억제제는 효소 5α-감소효소의 억제제로 특정 안드로겐 합성 억제제의 일종이다.[184][185] 5α-감소효소는 테스토스테론이 보다 강력한 안드로겐 디히드로테스토스테론(DHT)으로 전환되는 것을 담당하는 효소다.[184][185] 5α-감소효소의 세 가지 다른 등소형질이 있는데, 유형 1, 2, 3이며, 이 세 가지 등소형태는 체내에서 서로 다른 표현 패턴을 보인다.[184] 테스토스테론에 비해 DHT는 안드로겐 수용체의 작용제로서 2.5배에서 10배 정도 더 강력하다.[184][185][186] 이와 같이 5α-감소효소는 테스토스테론의 효과를 상당히 촉진시키는 역할을 한다.[184][185] 그러나 5α-감소효소는 피부, 모낭, 전립선 등 특정 조직에서만 발현되며, 이 때문에 테스토스테론의 DHT로의 전환은 신체의 특정 부위에서만 일어난다.[184][185][187] 더욱이 남성의 총 DHT와 자유 DHT의 순환 수준은 각각 테스토스테론의 1/10과 1/20 정도로 매우 낮으며,[185][188][184] DHT는 근육, 지방, 간 등 다양한 조직에서 약한 안드로겐으로 효율적으로 비활성화된다.[184][166][189] 이와 같이 DHT는 전신 안드로겐 호르몬으로서 거의 역할을 하지 않으며, 테스토스테론의 안드로겐 효과를 조직 특유의 방식으로 국소적으로 강하게 하는 수단으로서 더 많은 역할을 한다고 생각된다.[184][190][191] 테스토스테론을 DHT로 5α-감소효소에 의한 전환은 남성 생식계통 발달과 유지(특히 음낭, 전립선, 정낭)와 남성형 안면/신체 성장, 두피 탈모 등에 중요한 역할을 하지만 남성화의 다른 측면에서는 거의 역할을 하지 않는다.[184][185][187][192][193] 안드로겐 신호에 5α 저감효소가 관여하는 것 외에 프로게스테론, 테스토스테론 등 스테로이드 호르몬을 각각 알로프콜란올론과 3α안드로스타니디올과 같은 신경 스테로이드 호르몬으로 변환하는 것도 필요하다.[194][195]
5α-감소효소 억제제는 피나스테라이드와 두타스테라이드를 포함한다.[184][185] 피나스테라이드는 5α-감소효소 타입 2와 3의 선택적 억제제인 반면, 두타스테라이드는 5α-감소효소 3개 이소형 모두의 억제제다.[184][196][197] 피나스테라이드는 순환 DHT 레벨을 최대 70%까지 감소시킬 수 있는 반면, 듀타스테라이드는 순환 DHT 레벨을 최대 [196][197]99%까지 감소시킬 수 있다. 반대로, 5α-reductase, 그리고 실제로 약간 그것을 증가시킬 수 있는 테스토 스테론 수치를 감소시키지 않는다.[13][49][59][198]5α-Reductase 억제제 주로 양성 전립샘 증생의 치료에 전립선 과도하게 다이 하이드로 테스토 스테론에 의해 자극으로 인해 불쾌한 urogenital 증세를 보이게 되는 조건으로 사용된다.[196][199] 남녀의 안드로겐 의존성 두피 탈모 치료에도 사용된다.[200][201][202] 이 약은 남성들의 두피 탈모를 예방할 수 있고 두피 모발 농도를 어느 정도 회복시킬 수 있다.[200][201][203] 반대로 여성의 두피 탈모 치료에 있어 5α-감소효소 억제제의 효과가 덜 뚜렷하다.[202][185] 이는 안드로겐 수치가 두피 탈모에 있어 중요한 역할을 하지 못할 수도 있는 여성에게서 훨씬 낮기 때문일 것이다. 5α-감소효소 억제제는 여성의 히르수티즘(과다한 신체/근면적인 모발 성장)을 치료하는 데도 사용되며, 이 적응증에 매우 효과적이다.[202][185][204] 두타스테라이드는 남성의 두피 탈모 치료에 피나스테라이드보다 훨씬 더 효과가 높은 것으로 밝혀졌는데, 이는 5α-감소효소를 더 완전하게 억제하고 DHT 생산량 확장에 의한 감소 때문으로 분석됐다.[205][206][140] 항안드로겐제 사용 외에도, 5α-감소효소 억제제는 여성의 생리 전 난독증에서 불리한 감정 증상을 감소시키는 것으로 밝혀졌다.[207][208] 이는 월경 주기의 루테랄 단계에서 프로게스테론의 알로프칼리놀론으로의 전환에 대한 5α-감소효소 억제제에 의한 예방에 의한 것으로 생각된다.[207][208]
5α-감소효소 억제제는 에스트로겐 및/또는 다른 안티안드로겐과 결합하여 트랜스젠더 여성들을 위한 여성 호르몬 치료의 성분으로 사용되기도 한다.[4][209][66] 그것들은 두피 탈모, 체모 성장, 그리고 여드름과 같은 피부 증상들의 개선에 제한되는 이로운 효과를 가지고 있을 수 있다.[210][8][211][66] 그러나 트랜스젠더 여성의 5α-감소효소 억제제에 대한 임상연구는 거의 이루어지지 않았으며, 이 집단에서의 효능과 안전성에 대한 증거는 제한적이다.[209][31] 더욱이 5α-감소효소 억제제는 경미하고 구체적인 항안드로겐 활성만 가지고 있을 뿐 일반 항안드로겐으로는 권장되지 않는다.[31]
5α-감소효소 억제제는 부작용이 적고 남녀 모두에게 잘 용인된다.[212][213] 남성의 경우 가장 흔한 부작용은 성기능장애(0.9~15.8% 발생)로 성욕 저하, 발기부전, 사정 감소 등이 있을 수 있다.[212][213][214][215][216] 남성의 또 다른 부작용으로는 유방연애와 자경증(2.8%)과 같은 유방변화가 있다.[213] 안드로겐 및/또는 신경스테로이드의 감소된 수치로 인해 5α-감소효소 억제제는 우울증 위험(~2.0% 발생)을 약간 증가시킬 수 있다.[215][217][218][212][195] 5α-감소효소 억제제의 단종 후에도 소수의 남성들이 지속적인 성기능장애와 역기후 변화를 경험할 수 있다는 보고가 있다.[216][219][217][220][215][214][195] 남성에게 5α-감소효소 억제제의 가능한 부작용 중 일부는 사실 많은 트랜스젠더 여성들에게 환영 받는 변화들이다.[17] 어떤 경우든 트랜스젠더 여성들에게 5α-감소효소 억제제를 사용하는 것은 주의할 수 있다. 이 그룹은 이미 우울증과 자살의 위험이 높기 때문이다.[221][59]
프로게스테르균
프로게스테론(Progesterone)은 여성에서 두 가지 주요 성호르몬 중 하나이다.[174] 주로 여성 생식계통 조절, 생리주기, 임신, 수유 등에 관여한다.[174] 프로게스테론의 비생산적인 효과는 상당히 미미하다.[222] 프로게스테론은 에스트로겐과 달리 여성 2차 성징의 발달에 관여하지 않는 것으로 알려져 여성화에는 기여하지 않는다고 생각된다.[8][90] 프로게스테론이 여성들에게 미치는 영향에 대해 특히 관심을 갖는 분야 중 하나는 유방 발달이다.[223][224][225] 에스트로겐은 여자아이들의 사춘기 동안 유방의 관조직과 결합조직의 발달과 유방에 지방이 축적되는 것을 담당한다.[223][224] 반대로 프로게스테론의 높은 수치는 프로락틴과 같은 다른 호르몬과 함께 임신 중 유선의 전두엽의 성숙을 책임진다.[223][224] 이를 통해 산후 수유와 모유 수유가 가능하다.[223][224] 프로게스테론이 임신 중 유방을 변화시키지만, 유방은 비자발성을 겪으며 모유 수유를 중단한 후 임신 전 성분과 크기로 되돌아간다.[223][226][224] 매 임신마다 전두엽의 성숙은 다시 새롭게 일어난다.[223][224]
프로게스테론에는 체내의 자연 호르몬과 생체 식별 호르몬인 프로게스테론과 합성 프로게스테론이라는 두 가지 종류가 있다.[50] 임상적으로 사용되는 프로게스틴은 수십 가지가 있다.[50][227][228] 앞에서 설명한 것과 같이, 시프로테론 아세테이트와 메드록시프로게스테론 아세테이트와 같은 특정 프로게스틴은 트랜스젠더 여성의 테스토스테론 수치를 억제하는 데 도움이 되는 항원항산화 효과 때문에 기능성 항안드로겐으로 많은 용량에 사용된다.[89][90] 그러나 테스토스테론 억제의 구체적인 사용 외에도, 현재 트랜스젠더 여성들에게 프로게스테르균의 다른 징후는 없다.[8] 이와 관련, 트랜스젠더 여성들에게 프로게스테르균의 사용이 논란이 되고 있으며, 달리 일상적으로 처방되거나 권고되는 것은 아니다.[8][5][6][229][31][230] 프로게스테론, 사이프로테론 아세테이트, 메드록시프로제스테론 아세테이트 외에 트랜스젠더 여성들에게 사용되었다고 보고된 다른 프로게스테론에는 히드록시프로제스테론 카프로테론, 디드로게스테론, 노레스테론 아세테이트, 드로스피레논 등이 있다.[231][232][31][233][5][234] 그러나 일반적으로 프로게스틴은 대부분 동일한 프로게스틴 유발 효과를 가지고 있으며 이론적으로 모든 프로게스틴은 트랜스젠더 여성들에게 사용될 수 있다.[50]
트랜스젠더 여성의 프로게스테르균 사용에 대한 임상 연구는 매우 제한적이다.[8][225] 일부 환자와 임상의는 일화적이고 주관적인 주장에 근거하여 프로게스테르균이 트랜스젠더 여성의 유방 및/또는 유두 발달, 기분, 성욕 개선과 같은 혜택을 제공할 수 있다고 믿는다.[4][3][225] 현재 그러한 보고서를 뒷받침할 임상 연구는 없다.[8][4][225] 어떤 임상 연구도 트랜스젠더 여성의 프로게스테론 사용을 평가하지 않았으며, 단지 두어 연구만이 프로게스틴(특히 사이프로테론 아세테이트와 메드록시프로제스테론 아세테이트)[225][235][177]의 사용과 트랜스젠더 여성의 프로게스테론 사용을 비교했다. 이러한 연구들은 비록 연구결과의 질이 제한적이긴 하지만 트랜스젠더 여성의 유방발달에 대한 프로게스균의 이점은 없다고 보고했다.[225][177][229] 제한된 임상 경험에서도 이런 경우가 있었다.[236] 이러한 보고들은 안드로겐 불감증 증후군이 있는 여성들의 정상적이고 심지어 평균 이상의 유방 발달에 따른 것으로, 이들은 프로게스테론이 부족하고 역사학적 검사에서 유선의 전두엽 발달이 없다.[74][237] 일반적으로(임신 및 수유 외) 전두엽 조직을 구성하는 상피조직이 유방조직의 약 10~15%에 불과하다는 점이 주목할 만하다.[238][239][240][241] 프로게스테론의 유방발달 영향은 확실치 않지만 프로게스테론은 유방에 국소적인 유체가 남아 월경주기 동안 가역적인 유방확대 현상을 일으키는 것으로 생각된다.[242][243] 이것은 잘못된 유방 성장의 외모를 줄 수 있고 트랜스젠더 여성에서 프로게스테론(progesterone)과 함께 유방 크기 및/또는 모양이 개선되었다는 일화적 보고에 기여할 수 있다.[242][243]
프로게스테르균은 예를 들어 에스트로겐 수용체의 발현을 감소시키고 에스트로겐 메타볼라이징 효소의 발현을 증가시키는 등 유방에 어떤 항에스트로겐 효과를 가지고 있으며,[244][245][246][247] 이러한 이유로 유방통증과 양성 유방장애를 치료하는 데 이용되어 왔다.[248][249][250][251] 여성 사춘기 동안의 프로게스테론 수치는 대부분의 유방 발육이 이미 완료된 시스젠더 소녀들의 사춘기가 끝날 때까지 중요하게 증가하지 않는다.[252] 게다가, 비록 이 개념이 현재 이론적으로 남아있지만, 유방 발달 과정 동안 프로게스테르균에 대한 조기 노출은 비위생적이며 최종 유방 성장 결과를 위태롭게 할 수 있다는 우려가 표명되었다.[17][225][253] 유방의 발달에 있어서 프로게스테론의 역할은 확실하지 않지만, 프로게스테론은 임신 중 유선의 전두엽의 성숙에 필수적이다.[223] 따라서 젖을 짜거나 모유를 먹이고 싶어하는 트랜스젠더 여성에게는 프로게스균이 필요하다.[43][254][225] 한 연구는 에스트로겐과 고선량 사이프로테론 아세테이트로 치료된 트랜스젠더 여성의 역사학적 검사에서 유선의 완전한 전두엽 성숙을 발견했다.[255][256][257] 그러나 측두엽 발육은 사이프로테론 아세테이트의 단종으로 역전되어 조직 유지를 위해 지속적인 프로게스테론 노출이 필요하다는 것을 알 수 있었다.[255]
프로게스테르균이 성욕에 미치는 영향에 대해 한 연구는 트랜스젠더 여성의 성욕을 향상시키기 위해 디드로게스테론의 사용을 평가했지만 아무런 이득도 찾지 못했다.[233] 다른 연구도 마찬가지로 구강 프로게스테론이 시스젠더 여성의 성기능을 향상시키지 못한다는 것을 발견했다.[258]
프로게스테르균은 부작용을 일으킬 수 있다.[229][31][50][227][259][53] 구강 프로게스테론은 억제 신경스테로이드 효과가 있으며 진정제, 기분 변화, 알코올과 같은 부작용을 일으킬 수 있다.[50][260][261] 많은 프로게스틴은 안드로겐성, 항안드로겐성, 글루코코르티코이드성, 안티미노코르티코이드성 활동과 같이 목표 외의 활동을 하고 있으며 이러한 활동도 마찬가지로 원치 않는 부작용을 일으킬 수 있다.[50][227] 나아가 에스트로겐 요법에 프로게스틴을 첨가하면 폐경 후 여성의 에스트로겐 요법에만 비해 혈전, 심혈관 질환(예: 관상동맥 심장병, 뇌졸중), 유방암의 위험이 높아지는 것으로 밝혀졌다.[262][31][229][263] 프로게스틴의 이러한 건강상의 위험이 트랜스젠더 여성에게도 유사하게 발생하는지는 알 수 없지만, 그렇다고 배제할 수는 없다.[262][31][229] 고선량 프로게스테르균은 프로락티노마, 메닌기오마 등 양성 뇌종양의 위험도 높인다.[264][265] 잠재적으로 해로운 영향과 지원 혜택의 부족 때문에, 일부 연구자들은 테스토스테론 억제 목적과는 별도로, 프로게스테르균은 일반적으로 트랜스젠더 여성들에게 사용되거나 옹호되어서는 안 되며, 제한된 기간(예: 2-3년) 동안만 사용되어야 한다고 주장해왔다.[262][229][5][6][230] 반대로, 다른 연구자들은 트랜스젠더 여성의 프로게스테르균의 위험은 미미할 가능성이 있으며, 비록 가상적인 이득이기는 하지만, 원한다면 사용되어야 한다고 주장해왔다.[3] 일반적으로 일부 트랜스젠더 여성은 프로게스테르균의 효과에 호의적으로 반응하는 반면, 다른 여성은 부정적으로 반응하는 경우도 있다.[3]
프로게스테론은 가장 일반적으로 구두로 복용된다.[50][263] 그러나 구강 프로게스테론은 생체이용률이 매우 낮고, 높은 용량에서도 상대적으로 약한 프로게스테론 효과를 낸다.[266][267][263][268][269] 이에 따라, 그리고 프로게스틴과는 대조적으로, 구강 프로게스테론은 많은 복용량에서도 남성에게 항원 항정신성 효과가 없다.[260][270] 프로게스테론은 또한 경구, 직구, 근육내 또는 피하주사를 포함한 다양한 자궁내(비도덕적) 경로로 복용할 수 있다.[50][250][271] 이러한 경로는 경구 프로게스테론의 생체이용성 및 효능 문제를 가지고 있지 않으며, 따라서 상당한 항원항동성 및 기타 프로게스테론 효과를 발생시킬 수 있다.[50][268][272] 흡수 문제로 인해 경피 프로게스테론은 효과가 떨어진다.[50][250][269] 프로게스틴은 보통 구두로 복용한다.[50] 프로게스테론과는 대조적으로 대부분의 프로게스틴은 경구 생체이용률이 높으며 경구 투여로 완전한 프로게스테론 효과를 낼 수 있다.[50] 메드록시프로게스테론 아세테이트와 히드록시프로게스테론 카프로스테론과 같은 일부 프로게스틴은 근육내 주입이나 피하주사로 대신 사용되거나 사용될 수 있다.[273][250] 디드로게스테론을 제외한 거의 모든 프로게스틴은 항원 항산화 효과가 있다.[50]
잡다한
주변 선택 D2 수용체 길항제, 프롤락틴 강등제 돔페리돈 등 갈락토그류를 이용해 모유 수유를 원하는 트랜스젠더 여성에게서 젖을 유도할 수 있다.[274][275][43] 에스트로겐과 프로게스테겐 요법의 결합 기간을 연장하여 유방의 전두엽 조직을 성숙시켜야 이것이 성공할 수 있다.[254][43][276][255] 트랜스젠더 여성의 수유 및/또는 모유 수유에 대한 몇 가지 발표된 보고서가 있다.[277][278][254][276][43][279][280]
상호작용
에스트라디올, 사이프로테론 아세테이트, 비칼루타미드 등 호르몬 요법의 여성화에 사용되는 많은 약물은 CYP3A4와 기타 사이토크롬 P450 효소의 기판이다. 그 결과 CYP3A4와 카바마제핀, 페노바르비탈, 페니토인, 리팜핀, 리팜피신, 세인트 등 기타 시토크롬 P450 효소의 유도체가 나왔다. 존은 다른 것 중에서도 이러한 약물의 순환 수치를 감소시켜 그 효과를 감소시킬 수 있다. 반대로 CYP3A4와 기타 시토크롬 P450 효소인 시메티딘, 응고리마졸, 자몽주스, 이트라코나졸, 케토코나졸, 리토나비르 등의 억제제는 이러한 약물의 순환 수치를 증가시켜 그 효과를 높일 수 있다. 여성화 호르몬 치료와 함께 시토크롬 P450 유도제 또는 억제제를 병행 사용하는 것은 약물 복용량을 조절할 필요가 있을 수 있다.
영향들
트랜스젠더 여성의 호르몬 치료 효과의 범위는 사용된 특정 약물과 복용량에 따라 달라진다. 어쨌든 트랜스젠더 여성의 호르몬 치료의 주효과는 여성화와 탈분산이며, 다음과 같다.
| 효과 | 예상시간 효력[a] 발생 | 예상시간 최대 효과[a][b] | 호르몬의 경우 영속성 치료가 중단되다 |
|---|---|---|---|
| 유방 발달 및 젖꼭지/양극 확대 | 2~6개월 | 1~3년 | 영구적 |
| 얼굴/신체 모발의 얇아짐/저속 성장 | 4-12개월 | >3년[c] | 가역성 |
| 남성 패턴 두피 탈모에 대한 중단/반복 | 1~3개월 | 1-2년[d] | 가역성 |
| 피부 연화/감소 유분 및 여드름 | 3~6개월 | 알 수 없는 | 가역성 |
| 여성스러운 패턴의 체지방재분배 | 3~6개월 | 2~5년 | 가역성 |
| 근육량/강도 감소 | 3~6개월 | 1-2년[e] | 가역성 |
| 골반 넓이 및 반올림[f] | 지정되지 않음 | 지정되지 않음 | 영구적 |
| 기분, 감정, 행동의 변화 | 지정되지 않음 | 지정되지 않음 | 가역성 |
| 성욕 저하 | 1~3개월 | 3~6개월 | 가역성 |
| 자발적/모닝 발생 감소 | 1~3개월 | 3~6개월 | 가역성 |
| 발기부전 및 사정량 감소 | 1~3개월 | 변수 | 가역성 |
| 정자 생산/난임 감소 | 알 수 없는 | >3년 | 가역성 또는 영구성[g] |
| 감소된 고환 크기 | 3~6개월 | 2-3년 | 알 수 없는 |
| 페니스 크기 감소 | 없음[h] | 해당되지 않음 | 해당되지 않음 |
| 전립선 크기 감소 | 지정되지 않음 | 지정되지 않음 | 지정되지 않음 |
| 음성 변경 | 없음[i] | 해당되지 않음 | 해당되지 않음 |
각주 및 출처 각주:
| |||
물리적 변화
유방 발달
유방, 젖꼭지, 그리고 아열대 발육은 유전학, 신체 구성, HRT 시작 나이, 그리고 많은 다른 요인에 따라 상당히 다르다. 일부 개발은 몇 년에서 거의 10년이 걸릴 수 있다. 그러나, 많은 트랜스젠더 여성들은 종종 과도기 동안 유방 성장에 "스톨"이 있거나, 유의미한 유방 비대칭이 있다고 보고한다. HRT의 트랜스젠더 여성은 시스젠더 여성보다 유방 발달을 덜 경험하는 경우가 많다(특히 젊은 성인기 이후에 시작했을 경우). 이러한 이유로 많은 사람들이 가슴확대를 추구한다. 유방축소를 선택하는 트랜스젠더 환자는 드물다. 어깨 너비와 늑골 우리 사이즈는 또한 유방의 지각 가능한 크기에도 역할을 한다; 둘 다 트랜스젠더 여성에게서 보통 더 커서 유방이 비례적으로 작아 보이게 한다. 따라서 트랜스젠더 여성이 유방확대술을 선택했을 때 사용된 임플란트는 시스젠더 여성이 사용하는 것보다 더 큰 경향이 있다.[290]
임상 실험에서, 시스젠더 여성들은 유방조영술 후에 그들의 가슴을 재생시키기 위해 지방으로부터 줄기세포를 사용했다. 이것은 언젠가 트랜스젠더 여성을 위한 임플란트의 필요성을 없앨 수도 있다.[291]
사춘기 시스젠더 여성처럼 HRT 상의 트랜스젠더 여성에서 유방도관과 쿠퍼의 인대는 에스트로겐의 영향을 받아 발달한다. 프로게스테론은 우유 주머니(암마리 알베올리)가 발달하게 하고, 올바른 자극으로 트랜스젠더 여성이 젖을 먹일 수 있다. 게다가, HRT는 종종 유두를 자극에 더 민감하게 만든다.
트랜스젠더 여성의 유방 발육은 호르몬 치료를 시작한 지 2~3개월 안에 시작돼 최대 2년 동안 지속된다.[292][211] 체질량 지수가 높은 트랜스젠더 여성일수록 유방 발달이 더 좋은 것 같다.[292][211] 결과적으로 호르몬 치료의 초기 단계에서 살을 찌우는 것은 얇은 트랜스젠더 여성에게 유방 발달에 도움이 될 수 있다.[292][211] 에스트라디올 발리덴, 결합 에스트로겐, 에틸비닐레스트라디올과 같은 다른 에스트로겐은 트랜스젠더 여성의 유방 사이즈 면에서 동등한 결과를 내는 것으로 보인다.[292][235][177] 에스트로겐 치료의 갑작스러운 중단은 갈락터르헤아의 발병과 관련이 있다.[292][211]
피부 변화
피부의 가장 윗층인 각질층이 얇아지고 반투명해진다. 그 결과 거미맥이 나타나거나 더 눈에 잘 띄기도 한다. 콜라겐은 감소하고 촉각은 증가한다. 피부가 부드러워지고,[293] 긁거나 면도할 때 찢어지거나 자극받기 쉬우며, 멜라닌이 약간 줄어들어 색이 약간 옅어진다.
피지샘 활동(안드로겐에 의해 유발되는)이 줄어들어 피부와 두피에 오일 생성량이 감소한다. 결과적으로, 피부는 여드름에 덜 노출된다. 그것은 또한 더 건조해지고, 로션이나 기름이 필요할 수도 있다.[290][294] 생산되는 기름의 양이 적기 때문에 모공이 작아진다. 땀샘의 일종인 많은 아포크린샘이 활동하지 않게 되고 체취도 감소한다. 남아 있는 체취는 덜 금속성, 날카롭거나 매서워지고, 더 달콤하고 흐릿해진다.[citation needed]
피하 지방이 쌓이면 허벅지와 엉덩이에 딤플링, 즉 셀룰라이트가 더 뚜렷해진다.[290] 이러한 부위의 피부에 스트레치 자국(스트라이어 디펜세)이 나타날 수 있다. 피부가 얇고 색소가 덜 묻었기 때문에 햇볕에 타는 것에 대한 감수성이 높아진다.[citation needed]
머리카락이 변하다.
안티안드로겐은 기존 안면 모발에 약간만 영향을 미친다; 환자들은 성장이 더뎌지고 밀도와 커버리지가 다소 감소하는 것을 볼 수 있다. 사춘기가 지난 지 10년이 채 되지 않았거나 얼굴 털이 많이 부족한 사람들은 더 나은 결과를 얻을 수 있다. 항안드로겐을 복용하는 환자들은 그렇지 않은 환자들보다 전기분해와 레이저 제모로 더 좋은 결과를 얻는 경향이 있다.[citation needed] 10대나 20대 초반의 환자에게서, 테스토스테론 수치가 정상 여성 범위 내에 있을 경우 안티안드로겐은 새로운 얼굴 털이 자라지 못하게 한다.[290][294]
몸의 털(가슴, 어깨, 등, 복부, 엉덩이, 허벅지, 손 윗부분, 발톱)은 시간이 지남에 따라 말단("정상") 털에서 아주 작고 금발의 벨루스 털로 변한다. 팔, 심막, 심막 털은 줄어들지만 후자의 두 부위의 벨루스 털로 돌아가지 않을 수 있다(일부 시스젠더 여성도 이 부위의 털을 가지고 있다). 겨드랑이 털은 질감과 길이에서 약간 변화하며, 치골털은 패턴에서 더 전형적으로 여성스러워진다. 아랫다리털이 촘촘하지 않게 된다. 이 모든 변화는 어느 정도 유전학에 의존한다.[290][294]
머리털은 질감, 컬, 그리고 색이 약간 변할 수 있다. 이것은 특히 이전의 대머리 부위에서 모발이 자라면서 발생할 가능성이 높다.[citation needed] 눈썹은 안드로겐 털이 아니기 때문에 변하지 않는다.[295]
눈의 변화
눈의 수정체는 곡률에 따라 변한다.[296][297][298][293] 안드로겐 수치가 낮아졌기 때문에 메보미아 분비선(가장자리에서 열리는 위아래 눈꺼풀의 피지선)은 기름을 적게 만든다. 기름은 최루막이 증발하는 것을 막아주기 때문에, 이 변화로 인해 눈이 건조해질 수 있다.[299][300][301][302][303]
지방은 변한다.
지방 조직의 분포는 수개월과 수년에 걸쳐 서서히 변화한다. HRT는 신체가 엉덩이, 허벅지, 엉덩이, 푸비, 팔뚝, 가슴 등 전형적으로 여성스러운 패턴으로 새로운 지방을 축적하게 한다.(엉덩이, 허벅지, 엉덩이 등에 있는 지방은 오메가-3 지방산의 농도가 높으며 젖을 때 사용하는 것을 의미한다) 몸은 허리, 어깨, 등에 있는 오래된 지방 조직을 태우기 시작하여 그 부위가 작아진다.[290]
피하지방은 볼과 입술에서 증가하여 얼굴이 더 둥글게 보이게 하며, 볼 아랫부분이 채워지면서 턱에 대한 강조가 약간 줄어들게 된다.[citation needed]
뼈/골격 변화
어린 나이에 에스트로겐 치료를 시작하면 엉덩이가 넓어질 수 있다.[citation needed]
영향을 받지 않는 특성
HRT는 사춘기에 의해 이미 확립된 뼈의 변화를 되돌리지 않는다. 결과적으로, 그것은 앞에서 언급한 이유, 팔, 다리, 손, 발의 길이, 또는 어깨와 늑골 새장의 너비 등을 제외하고는 키에 영향을 주지 않는다. 그러나, 뼈의 세부적인 형태는 일생에 걸쳐 변화하며, 안드로겐의 영향으로 뼈가 더 무겁고 더 깊게 조각되고, HRT는 그러한 변화가 더 이상 진전되는 것을 막는다.
엉덩이의 넓이는 경피 폐쇄(뼈 끝의 융접 및 폐쇄)가 발생한 개인에서는 영향을 받지 않는다. 이것은 18세에서 25세 사이의 대부분의 사람들에게서 발생한다.[citation needed] 이미 확립된 엉덩이 모양 변화는 경피폐쇄가 일어났는지 여부를 HRT로 되돌릴 수 없다.[citation needed]
얼굴의 뼈 구조에 대한 확립된 변화도 HRT의 영향을 받지 않는다. 대부분의 뇌척수학적 변화는 청소년기에 발생한다. 성인 이후의 성장은 그에 비해 상당히 느리고 미미하다.[304] 또한 갑상선 연골(아담의 사과)의 두드러짐도 영향을 받지 않는다. 이러한 변화는 수술(각각 부위 여성화 수술과 기관지 면도)에 의해 역전될 수 있다.
사춘기가 되면 음성이 깊어져 더욱 낭랑해진다. 이러한 변화는 영구적이며 HRT의 영향을 받지 않는다. 음성 치료 및/또는 수술은 보다 여성스러운 목소리를 얻기 위해 대신 사용될 수 있다.
얼굴털은 사춘기에 발달하여 HRT에 의해 약간만 영향을 받는다. 그러나 레이저 제모를 통해 거의 영구적으로 제거되거나 전기분해를 통해 영구적으로 제거될 수 있다.[citation needed]
정신적 변화
호르몬 치료의 여성화에 따른 심리적 효과는 신체적 변화보다 정의하기가 어렵다. 호르몬 요법은 보통 전환에 첫발을 내딛는 물리적인 단계이기 때문에 그것을 시작하는 행위는 유의미한 심리적 영향을 미치기 때문에 호르몬에 의해 유발되는 변화와 구별하기 어렵다.
기분 전환
성전환 여성의 호르몬 치료로 기분과 웰빙의 변화가 일어난다.[305]
성적 변화
일부 트랜스젠더 여성들은 항안드로겐의 복용량에 따라 성욕이 크게 감소한다고 보고한다.[306] 수술 후 트랜스젠더 여성들 중 소수만이 성욕 증진을 위해 테스토스테론을 적게 복용한다. 많은 수술 전 트랜스젠더 여성들은 적극적인 성생활을 시작하기 위해 재지정 수술을 받을 때까지 기다린다. 에스트로겐의 복용량을 높이거나 프로게스겐을 첨가하는 것은 일부 트랜스젠더 여성의 성욕을 증가시킨다.[citation needed]
난초 수술을 받은 일부 환자들은 여전히 아침 예방을 경험하지만, 자발적 및 아침 예방은 빈도가 현저히 감소한다. 자발적인 제거는 복용하는 호르몬 및/또는 항안드로겐의 양에 따라 가능하거나 불가능할 수 있다.[citation needed]
호르몬 요법의 장기적 이용에 대한 연구가 주목되지 않아 장기간 호르몬 요법의 관리는 연구되지 않았고 추정하기도 어렵다.[262] 그러나 이러한 치료법이 현재 시스젠더 남녀의 성기능에 미치는 생식 호르몬의 영향에 대한 지식을 바탕으로 트랜스젠더에 대한 결과를 추측할 수 있다.[307]
첫째, 성전환의 여성화에 있어서 테스토스테론을 감소시키려면 성욕과 흥분은 억제될 가능성이 높으며, 반대로 에스트로겐의 고량이 시스젠성 여성과의 일부 연구에서 발견된 성욕에 부정적인 영향을 미친다면, 앤드로겐과 에스트로겐의 위험도가 높다는 가설이 있다.이 결과를 더욱 심화시킬 것이다.[307] 불행히도 현재까지 트랜스젠더 호르몬 치료의 종류와 복용량 사이의 관계를 살펴본 무작위 임상실험이 없었기 때문에 이들 사이의 관계는 여전히 불명확하다.[307] 전형적으로, 성전환 여성화를 위해 주어지는 에스트로겐은 폐경 후 여성의 HRT 권장량보다 2-3배 높다.[262] 약동학 연구는 이러한 증가된 선량을 복용하면 혈장 에스트라디올 수치가 더 높아질 수 있다는 것을 보여준다. 그러나 장기적인 부작용은 연구되지 않았고 이 경로의 안전성은 불확실하다.[262]
어떤 약리학적 치료나 호르몬 치료와 마찬가지로 잠재적인 부작용이 있는데, 트랜스젠더 호르몬 치료의 경우 성기능의 변화를 포함한다. 이들은 뇌혈관질환, 비만, 기분변동 등 다양한 부작용을 통해 직간접적으로 성기능에 상당한 영향을 미칠 수 있는 능력을 갖고 있다.[307] 또 일부 연구에서는 여성 호르몬 요법에 따른 당뇨병의 발병이 발견돼 성반응을 저해하고 있다.[citation needed] 개인과 의사가 어떤 경로를 택하든 호르몬 치료의 의료 위험과 환자의 심리적 욕구를 모두 고려하는 것이 중요하다.
뇌는 변한다.
트랜스젠더 여성의 호르몬 요법이 뇌의 구조를 여성 비율의 방향으로 변화시키는 원인이 된다는 연구 결과가 여러 차례 나왔다.[308][309][310][311][312] 또 트랜스젠더 여성의 호르몬 치료가 시각공간, 언어기억, 언어유연성 등 인지업무 수행능력을 유발해 보다 여성적인 방향으로 이동한다는 연구결과도 나왔다.[308][305]
역효과
심혈관 효과
트랜스젠더 여성에게 가장 중요한 심혈관 위험은 에스트로겐의 프로트롬보틱 효과(혈전증가)이다. 이는 정맥 혈전증(VTE)의 위험 증가로서 가장 현저하게 나타난다. 심맥 혈전증(DVT)과 폐색전증(PE)은 DVT에서 혈전이 떨어져 폐로 이동할 때 발생한다. DVT의 증상으로는 한쪽 다리의 통증이나 부기가 있는데, 특히 종아리가 그렇다. PE의 증상은 가슴통증, 호흡곤란, 실신, 심장 두근거림 등이 있으며, 때로는 다리통증이나 붓기가 없는 경우도 있다.
VTE는 에스트로겐 치료 첫 해에 더 자주 발생한다. VTE의 위험 ethinylestradiol과 conjugated 난포 호르몬 등non-bioidentical 난포 호르몬과 에스트라디올의, 작용의, 이식, 그리고 intranasal 주사제 등 비경구용 제제에 비해 더 높다.[313][314][315][316][317][318][319][320][321][322][323][164][324][325][326][327][328][57][329][330][331][332][인용을 과도한] 또한 VTE 위험은 나이가 들거나 담배를 피우는 환자에게서 증가하므로 많은 임상의들은 흡연자와 40세 이상의 환자에게서 보다 안전한 에스트로겐 제제를 사용할 것을 권고한다.[citation needed] 또한, VTE 위험은 프로게스틴에 의해 증가하고 에스트로겐과 프로게스틴의 복용량에 따라 증가한다.[citation needed] 비만은 VTE의 위험도 증가시킨다.[citation needed] 에스트로겐이 함유된 VTE의 위험 증가는 간 단백질 합성에 대한 영향, 특히 응고 인자의 생산에 영향을 미치기 때문인 것으로 생각된다.[50] 혼합 에스트로겐과 특히 에틸비닐에스테스트라디올과 같은 비생물학적 에스트로겐은 에스트라디올에 비해 간 단백질 합성에 현저하게 불균형한 영향을 미친다.[50] 또한 경구 에스트라디올은 경피 에스트라디올과 다른 파렌탈 에스트라디올 루트에 비해 간 단백질 합성에 미치는 영향이 4-5배 증가한다.[50][333]
혈전을 치료하는 데 사용되는 와파린의 위험은 비교적 젊고 건강한 모집단에서 낮은 반면, 치료되지 않은 트랜스젠더 환자의 신체적, 심리적 부정적인 결과의 위험은 높기 때문에, 프로트롬보틱 돌연변이(인자 V 레이든, 안티트롬빈 III, 단백질 C 또는 S 결핍증 등)는 그다지 높지 않다.호르몬 치료를 위한 루트 [211]금기법
4.0년의 평균 추적 관찰로 처리된 미국의 2842명의 수혈아 개인에 대한 2018년 코호트 연구는 시스젠더 기준 모집단에 비해 VTE, 뇌졸중 및 심장마비의 위험 증가가 관찰되었다.[334][335][17][56] 사용된 에스트로겐은 경구 에스트라디올 (하루 1~10mg)과 다른 에스트로겐 제형을 포함했다.[56] 스피로놀락톤과 같은 안티안드로겐과 같은 다른 약들도 사용되었다.[56]
2019년 체계적 검토와 메타분석 결과 트랜스젠더 여성의 여성 호르몬 치료로 1000명-년 당 2.3명의 VTE 발병률이 나타났다.[336] 비교를 위해 일반 인구의 비율은 1000명-년 당 1.0–1.8명으로 나타났고, 폐경 전 여성의 피임약 복용률은 1000명-년 당 3.5명으로 나타났다.[336][337] 포함된 연구 전체에 걸쳐 VTE 비율에 상당한 이질성이 있었으며, 메타 분석은 사실상의 알려진 위험에 해당하는 에스트로겐 유형, 에스트로겐 경로, 에스트로겐 용량, 동반성 항안드로겐 또는 프로게스테겐 사용 간 또는 환자 특성(예: 성별, 연령, 흡연 상태, 체중) 간에 부분군 분석을 수행할 수 없었다.rs for VTE.[336] 연구진은 혈전성이 강하고 트랜스젠더 여성에게는 더 이상 사용되지 않는 에틸비닐레스트라디올을 사용한 일부 연구가 포함되었기 때문에 연구에서 발견된 VTE 위험은 과대평가될 수 있다고 지적했다.[336]
구강 에스트라디올을 구체적으로 평가한 2016년 연구에서 평균 1.9년간 치료받은 트랜스젠더 여성 676명의 VTE 발병률은 1만 명당 7.8명의 발병률로 그룹 전체의 0.15%에 불과했다.[338][339] 사용된 구강 에스트라디올의 복용량은 1일 2~8mg이었다.[339] 트랜스젠더 여성도 거의 모두 스피로놀락톤(94%)을 복용하고 있었고, 하위세트는 피나스테라이드(17%)를 복용하고 있었으며, 프로게스테론(보통 구강 프로게스테론)도 5% 미만으로 복용하고 있었다.[339] 이 연구의 결과는 성전환 여성이 구강 에스트라디올을 복용하는 경우 VTE 발생률이 낮다는 것을 시사한다.[338][339]
트랜스젠더 여성의 심혈관 건강은 최근 출판물에서 검토되고 있다.[340][55]
위장효과
에스트로겐은 특히 노약자나 비만인 사람들에게 담낭 질환의 위험을 증가시킬 수 있다.[293] 그들은 또한 간 독성을 나타내며 특히 구강 형태로 복용할 때 트랜스아미노아제 수치를 증가시킬 수 있다.[citation needed]
대사 변화
환자의 대사율이 변화하여 체중과 에너지 수준의 증가 또는 감소, 수면 패턴의 변화, 온도 감도를 일으킬 수 있다.[citation needed] 안드로겐 결핍은 신진대사를 더디게 하고 근육의 톤을 잃게 한다. 근육을 만드는 것은 더 많은 일을 필요로 한다. 프로게스겐을 첨가하면 식욕도 증가하지만 에너지를 증가시킬 수 있다.[citation needed]
뼈의 변화
에스트로겐과 안드로겐 모두 뼈 건강을 위해 모든 인간에게 필요하다. 젊고 건강한 여성은 매달 약 10mg의 테스토스테론을 생산하며,[citation needed] 남성의 골밀도가 높은 것은 혈청 에스트로겐과 관련이 있다. 에스트로겐과 테스토스테론 둘 다 특히 사춘기에 뼈 형성을 촉진하는 데 도움을 준다. 에스트로겐은 성별을 불문하고 뼈의 손실을 늦추는 주요 성호르몬이다.
암 위험
트랜스젠더 여성의 호르몬 치료로 유방암 발병 위험이 높아지는지에 대한 연구가 엇갈리고 있다.[341][342][343][344] 두 개의 코호트 연구는 시스젠더 남성과 비교했을 때 위험의 증가를 발견하지 못했으며, 다른 코호트 연구는 유방암의 발병률이 시스젠더 남성과 시스젠더 여성의 발병률과 같은 위험의 거의 50배 증가를 발견했다.[342][343][344][341] 트랜스젠더 여성의 유방암 위험이 시스젠더 여성보다 크다는 증거는 없다.[345] 트랜스젠더 여성의 유방암 발병 건수는 2019년 현재 20건이다.[341][346]
자네코마스티아가 있는 시스젠더 남성들은 유방암 발병률이 증가하는 것으로 밝혀지지 않았다.[347] 46,XX 카리오타입(X 염색체 1개, Y 염색체 1개)이 46,XX 카리오타입(X 염색체 2개)을 갖는 것에 비해 유방암에 대한 보호가 될 수 있다고 제안되었다.[347] Men with Klinefelter's syndrome (47,XXY karyotype), which causes hypoandrogenism, hyperestrogenism, and a very high incidence of gynecomastia (80%), have a dramatically (20- to 58-fold) increased risk of breast cancer compared to karyotypical men (46,XY), closer to the rate of karyotypical women (46,XX).[347][348][349] 카리오피탈 남성, 클라인펠터 증후군을 가진 남성, 카리오피탈 여성의 유방암 발병률은 각각 [350]약 0.1%,[348] 3%,[351] 12.5%이다. 안드로겐 불감증후군(46,XY 카리오타입)을 앓고 있는 여성은 남성 성 특성을 발달시킨 적이 없고 유방 발달을 포함한 정상적이고 완전한 여성 형태학을 갖고 있지만 유방암에 걸린다는 보고는 아직 없다.[352][72][353] 터너 증후군(45,XO 카리오타입)을 앓고 있는 여성의 유방암 위험도 크게 줄어든 것으로 보이지만 이는 유전학보다는 난소 장애와 저포고나디즘과 관련이 있을 수 있다.[354]
전립선암은 장기간 에스트로겐 치료를 받아온 생식기 성전환 여성에게서 극히 드물다.[13][355][356] 남성의 70%가 80대까지 전립선암을 보이는 반면 트랜스젠더 여성의 전립선암 발병 사례는 극소수에 불과하다.[152][13][355][356] 이와 같이, 그리고 안드로겐이 전립선암의 발병에 책임이 있다는 사실에 따라, HRT는 트랜스젠더 여성의 전립선암에 대한 보호성이 높은 것으로 보인다.[13][355][356]
뇌수막종과 프로락틴종을 포함한 특정 유형의 양성 뇌종양의 위험은 트랜스젠더 여성의 호르몬 치료로 증가한다.[357] 이러한 위험은 대부분 사이프로테론 아세테이트의 사용과 관련이 있다.[357]
에스트로겐과 프로게스테르겐은 뇌하수체의 양성인 프로락티노마스를 유발할 수 있다.[citation needed] 젖꼭지에서 배출되는 우유는 프로락틴 수치가 높아진 징후일 수 있다. 프로락틴종이 충분히 커지면 시각 변화(특히 말초시력 감소), 두통, 우울증 또는 기타 기분 변화, 현기증, 메스꺼움, 구토증, 갑상선 기능 저하증 등 뇌하수체 기능 부전의 증상 등을 일으킬 수 있다.
모니터링
특히 호르몬 치료의 초기 단계에서는 호르몬 수치와 간 기능을 평가하기 위한 혈액 작업이 빈번하게 이루어진다. 내분비학회에서는 에스트라디올과 테스토스테론에 대한 HRT 원년에 3개월에 한 번씩 혈액검사를 하고, 사용할 경우 스피로놀락톤을 1년에 2~3개월마다 모니터링할 것을 권고하고 있다.[13] 총 에스트라디올 및 총 테스토스테론 수준의 권장 범위는 다음을 포함하지만 이에 국한되지는 않는다.
| 출처 | 장소 | 에스트라디올, 합계 | 테스토스테론, 합계 | |
|---|---|---|---|---|
| 내분비학회 | 미국 | 100–200 pg/ml | <50 ng/dL> | |
| WPATH(World Professional Association for Transgender Health) | 미국 | "[T]에스토스테론 수치[...]는 폐경 전 여성 범위 내에서 정상 여성 범위 및 에스트라디올 수치 상한을 하회하지만 초프라피히롤 수준에도 한참 못 미친다." "[M]생리학 범위 내에서 환자의 원하는 성별 표현(완전한 여성화/masculinization의 목표에 기초함)에 대한 수치." | ||
| 트랜스젠더 건강의 우수 센터()UCSF | 미국 | "트랜스젠더 개인에 대한 호르몬 수준의 해석은 아직 근거가 없다; 비트랜스젠더들의 생리학적 호르몬 수준이 기준 범위로 사용된다." "공급자들은 '남성'과 '여성' 규범 모두에 대한 호르몬 수준의 기준 범위를 얻기 위해 지역 연구소와 협의한 후 이를 적용할 것을 권장한다."e 등록의 성별이 아닌 현재의 호르몬 성(性)을 기준으로 결과를 해석할 때 정확한 범위" | ||
| 펜웨이 헬스 | 미국 | 100–200 pg/ml | <55 ng/dL | |
| 캘런로드 | 미국 | "일부 지침은 에스트라디올과 테스토스테론 수치를 기준선에서 그리고 에스트로겐 요법의 모니터링 전체에 걸쳐 확인할 것을 권고한다. 우리는 비용을 정당화하는 일상적인 호르몬 수준에 대한 임상적 용도를 찾지 못했다. 단, 개별 제공자는 지침 준수를 위해 필요한 경우 또는 환자의 필요에 따라 처방 및 모니터링 관행을 조정할 수 있다는 점을 인정한다." | ||
| 국제가족연맹(IPPF) | 영국 | <200 pg/m>l | 30–100 ng/dL | |
| 국민건강보험재단 신탁 | 영국 | 55–160 pg/ml | 30-85 ng/dL | |
| RCP(왕립 정신의학 대학) | 영국 | 80–140 pg/ml | "정상적인 남성 범위보다 훨씬 낮음" | |
| 밴쿠버 해안 건강(VCH) | 캐나다 | ND | <45 ng/dL> | |
| 출처: 템플릿을 참조하십시오. | ||||
에스트로겐의 최적 범위는 에스트라디올(또는 에스트라디올의 에스테르)을 복용하는 개인에게만 적용되며, 합성 또는 기타 비생물학적 준비물(예: 혼합 에스트로겐 또는 에틸비닐레스트라디올)을 복용하는 개인에게는 적용되지 않는다.[13]
의사들은 또한 완전한 혈액수, 신장 기능, 간 기능, 지질 및 포도당 대사 검사, 프로락틴 수치, 체중, 혈압 모니터링을 포함한 보다 광범위한 의료 모니터링을 권고한다.[13][358]
프로락틴 수치가 100ng/mL 이상이면 에스트로겐 치료를 중단하고 6~8주 후 프로락틴 수치를 재점검해야 한다.[358] 프로락틴 수치가 높게 유지되면 프로락틴종의 유무를 확인하기 위한 뇌하수체 MRI 스캔을 지시해야 한다.[358] 그렇지 않으면 에스트로겐 치료는 더 낮은 용량에서 다시 시작될 수 있다.[358] 시프로테론 아세테이트가 특히 프로락틴 수치 상승과 관련이 있으며, 시프로테론 아세테이트의 단종으로 프로락틴 수치가 낮아진다.[359][360][361] 사이프로테론 아세테이트와 대조적으로 에스트로겐과 스피로놀락톤 요법은 프로락틴 수치 증가와 관련이 없다.[361][362]
역사
안드로겐, 에스트로겐, 프로게스테르겐을 포함한 효과적인 제약 여성 성호르몬제들은 1920년대와 1930년대에 처음 사용 가능하게 되었다.[363] 트랜스젠더 여성의 호르몬 치료에 대한 가장 초기 보고서 중 하나는 1953년 덴마크 내분비학자 크리스티안 햄버거에 의해 발표되었다.[364] 그의 환자들 중 한 명은 크리스틴 조겐슨이었는데, 그는 1950년부터 치료를 받았다.[365][366][367][368] 성전환 여성의 호르몬 치료에 대한 추가 보고서는 1960년대 중후반 독일계 미국인 내분비학자 해리 벤자민, 그리고 다른 연구자들에 의해 발표되었다.[369][370][371][372][373][374] 그러나 벤자민은 1950년대 후반까지 수백 명의 트랜스젠더 환자를 그의 관리하에 두었으며,[90] 1940년대 후반이나 1950년대 초반까지 트랜스젠더 여성들을 호르몬 치료로 치료해 왔다.[375][376][377][365] 어쨌든 햄버거는 트랜스젠더 여성을 호르몬 치료로 치료하는 첫 사례라고 한다.[378]
최초의 트랜스젠더 클리닉 중 하나는 1960년대 중반 존스 홉킨스 의과대학에 문을 열었다.[379][90] 1981년까지 거의 40개의 그런 센터가 있었다.[380] 그 해 20개 센터의 호르몬 요법에 대한 검토가 발표되었다.[369][380] 크리스토퍼 듀허스트가 주재한 제1회 성 정체성 국제심포지엄은 1969년 런던에서 열렸으며, 성전환과 성전환이라는 제목으로 리처드 그린과 존 머니가 편집한 성전환에 관한 최초의 의학 교과서가 1969년 존스홉킨스대 출판사에서 발간되었다.[381][382][383] 이 교과서에는 해리 벤자민과 크리스천 햄버거가 쓴 호르몬 치료의 장이 포함되어 있었다.[374] 현재 세계 트랜스젠더 건강 전문가 협회(WPATH)로 알려진 해리 벤자민 국제 젠더 다이스포리아 협회(HBIGDA)는 같은 해 첫 번째 버전의 케어 표준이 발간되면서 1979년에 결성되었다.[365] 내분비학회는 성전환자의 호르몬 관리에 관한 가이드라인을 2009년에 발간했으며, 2017년에는 개정판을 내놓았다.[369][384][13]
트랜스젠더 여성을 위한 호르몬 치료는 초기에 결합 에스트로겐, 에틸리스트라디올, 디에틸스틸베스트롤과 같은 구강 에스트로겐과 에스트라디올 벤조이트, 에스트라디올 발리테이트, 에스트라디올 시피오네이트, 에스트라디올 무사이실레이트 같은 파렌탈 에스트로겐을 사용한 치료법을 사용하였다.[372][373][374][380] 히드록시프로게스테론 카프로테론과 메드록시프로게스테론 아세테이트와 같은 프로게스테르균도 가끔 포함되었다.[364][372][373][380][385][37][386] 항안드로겐과 프로게스테론 아세테이트가 1977년까지 트랜스젠더 여성들에게 처음으로 사용되었다.[387][388] 또 다른 항안드로겐인 스피로놀락톤은 1986년까지 트랜스젠더 여성들에게 처음으로 사용되었다.[389][385][285][390] 안티안드로겐은 1990년대 초까지 트랜스젠더 여성들을 위한 호르몬 치료에서 잘 확립되었다.[37][262][391] 성전환 여성의 에스트로겐 복용량은 항안드로겐의 도입 이후 감소되었다.[citation needed] 에틸비닐레스트라디올, 결합 에스트로겐, 그리고 다른 비생물학적 에스트로겐은 혈전과 심혈관 질환의 더 큰 위험 때문에 2000년경부터 에스트라디올을 선호하는 트랜스젠더 여성들에게 사용되는 것을 중단했다.[286][340][336]
참고 항목
참조
- ^ Hembree WC, Cohen-Kettenis PT, Gooren L, Hannema SE, Meyer WJ, Murad MH, Rosenthal SM, Safer JD, Tangpricha V, T'Sjoen GG (November 2017). "Endocrine Treatment of Gender-Dysphoric/Gender-Incongruent Persons: An Endocrine Society Clinical Practice Guideline" (PDF). J. Clin. Endocrinol. Metab. 102 (11): 3869–3903. doi:10.1210/jc.2017-01658. PMID 28945902. S2CID 3726467.
- ^ Coleman, E.; Bockting, W.; Botzer, M.; Cohen-Kettenis, P.; DeCuypere, G.; Feldman, J.; Fraser, L.; Green, J.; Knudson, G.; Meyer, W. J.; Monstrey, S.; Adler, R. K.; Brown, G. R.; Devor, A. H.; Ehrbar, R.; Ettner, R.; Eyler, E.; Garofalo, R.; Karasic, D. H.; Lev, A. I.; Mayer, G.; Meyer-Bahlburg, H.; Hall, B. P.; Pfaefflin, F.; Rachlin, K.; Robinson, B.; Schechter, L. S.; Tangpricha, V.; van Trotsenburg, M.; Vitale, A.; Winter, S.; Whittle, S.; Wylie, K. R.; Zucker, K. (2012). "Standards of Care for the Health of Transsexual, Transgender, and Gender-Nonconforming People, Version 7" (PDF). International Journal of Transgenderism. 13 (4): 165–232. doi:10.1080/15532739.2011.700873. ISSN 1553-2739. S2CID 39664779.
- ^ a b c d e f g h Deutsch M (17 June 2016). "Guidelines for the Primary and Gender-Affirming Care of Transgender and Gender Nonbinary People" (PDF) (2nd ed.). University of California, San Francisco: Center of Excellence for Transgender Health. p. 28.
- ^ a b c d e f g h i j Wesp LM, Deutsch MB (March 2017). "Hormonal and Surgical Treatment Options for Transgender Women and Transfeminine Spectrum Persons". Psychiatr. Clin. North Am. 40 (1): 99–111. doi:10.1016/j.psc.2016.10.006. PMID 28159148.
- ^ a b c d e f g h i j Dahl, M; Feldman, JL; Goldberg, J; Jaberi, A (2015). "Endocrine Therapy for Transgender Adults in British Columbia: Suggested Guidelines" (PDF). Vancouver Coastal Health. Retrieved 15 August 2018.
- ^ a b c d e Bourns, Amy (2015). "Guidelines and Protocols for Comprehensive Primary Care for Trans Clients" (PDF). Sherbourne Health Centre. Retrieved 15 August 2018.
- ^ Murad, Mohammad Hassan; Elamin, Mohamed B.; Garcia, Magaly Zumaeta; Mullan, Rebecca J.; Murad, Ayman; Erwin, Patricia J.; Montori, Victor M. (2010). "Hormonal therapy and sex reassignment: A systematic review and meta-analysis of quality of life and psychosocial outcomes". Clinical Endocrinology. 72 (2): 214–231. doi:10.1111/j.1365-2265.2009.03625.x. PMID 19473181. S2CID 19590739.
- ^ a b c d e f g h i j k l m n o Coleman, E.; Bockting, W.; Botzer, M.; Cohen-Kettenis, P.; DeCuypere, G.; Feldman, J.; Fraser, L.; Green, J.; Knudson, G.; Meyer, W. J.; Monstrey, S.; Adler, R. K.; Brown, G. R.; Devor, A. H.; Ehrbar, R.; Ettner, R.; Eyler, E.; Garofalo, R.; Karasic, D. H.; Lev, A. I.; Mayer, G.; Meyer-Bahlburg, H.; Hall, B. P.; Pfaefflin, F.; Rachlin, K.; Robinson, B.; Schechter, L. S.; Tangpricha, V.; van Trotsenburg, M.; Vitale, A.; Winter, S.; Whittle, S.; Wylie, K. R.; Zucker, K. (2012). "Standards of Care for the Health of Transsexual, Transgender, and Gender-Nonconforming People, Version 7" (PDF). International Journal of Transgenderism. 13 (4): 165–232. doi:10.1080/15532739.2011.700873. ISSN 1553-2739. S2CID 39664779.
- ^ a b c Branstetter, Gillian (31 August 2016). "Sketchy Pharmacies Are Selling Hormones to Transgender People: Burdened by cost and medical discrimination, many people are taking a do-it-yourself approach to transitioning". The Atlantic. Retrieved 29 December 2018.
- ^ a b c Newman, Rosalind; Jeory, Ted (16 November 2016). "Fears of 'DIY transitioning' as hormone drugs sold to transgender women without checks". The Independent. Retrieved 29 December 2018.
- ^ "r/TransDIY". Reddit. Retrieved 29 December 2018.
- ^ "r/MtFHRT". Reddit. Retrieved 29 December 2018.
- ^ a b c d e f g h i j k l m n o p q r s t Hembree WC, Cohen-Kettenis PT, Gooren L, Hannema SE, Meyer WJ, Murad MH, Rosenthal SM, Safer JD, Tangpricha V, T'Sjoen GG (November 2017). "Endocrine Treatment of Gender-Dysphoric/Gender-Incongruent Persons: An Endocrine Society Clinical Practice Guideline" (PDF). J. Clin. Endocrinol. Metab. 102 (11): 3869–3903. doi:10.1210/jc.2017-01658. PMID 28945902. S2CID 3726467.
- ^ Wylie, Kevan; Barrett, James; Besser, Mike; Bouman, Walter Pierre; Bridgman, Michelle; Clayton, Angela; Green, Richard; Hamilton, Mark; Hines, Melissa; Ivbijaro, Gabriel; Khoosal, Deenesh; Lawrence, Alex; Lenihan, Penny; Loewenthal, Del; Ralph, David; Reed, Terry; Stevens, John; Terry, Tim; Thom, Ben; Thornton, Jane; Walsh, Dominic; Ward, David; Coleman, Eli; Di Ceglie, Domenico; Martin, Emma; McGarry, Philip; Messenger, Andrew; Reid, Russell; Sethi, Su; Sutcliffe, Paul; Wilson, Daniel; Carr, Susan; Davies, Dai; Dean, Tracey; Ellis, Michelle; Ferguson, Brian; Skinner, Darren; Williams, Vicky; Brechin, Susan; Lucey, Jim; Rathbone, Maxine (2014). "Good Practice Guidelines for the Assessment and Treatment of Adults with Gender Dysphoria" (PDF). Sexual and Relationship Therapy. 29 (2): 154–214. doi:10.1080/14681994.2014.883353. ISSN 1468-1994. S2CID 144632597.
- ^ Wesp LM, Deutsch MB (March 2017). "Hormonal and Surgical Treatment Options for Transgender Women and Transfeminine Spectrum Persons". Psychiatr. Clin. North Am. 40 (1): 99–111. doi:10.1016/j.psc.2016.10.006. PMID 28159148.
- ^ Unger CA (December 2016). "Hormone therapy for transgender patients". Transl Androl Urol. 5 (6): 877–884. doi:10.21037/tau.2016.09.04. PMC 5182227. PMID 28078219.
- ^ a b c d e f g h Randolph JF (December 2018). "Gender-Affirming Hormone Therapy for Transgender Females". Clin Obstet Gynecol. 61 (4): 705–721. doi:10.1097/GRF.0000000000000396. PMID 30256230.
- ^ Nakatsuka M (May 2010). "Endocrine treatment of transsexuals: assessment of cardiovascular risk factors". Expert Rev Endocrinol Metab. 5 (3): 319–322. doi:10.1586/eem.10.18. PMID 30861686. S2CID 73253356.
- ^ Fishman, Sarah L.; Paliou, Maria; Poretsky, Leonid; Hembree, Wylie C. (2019). "Endocrine Care of Transgender Adults". Transgender Medicine. Contemporary Endocrinology. pp. 143–163. doi:10.1007/978-3-030-05683-4_8. ISBN 978-3-030-05682-7. ISSN 2523-3785.
- ^ Winkler-Crepaz, K.; Müller, A.; Böttcher, B.; Wildt, L. (2017). "Hormonbehandlung bei Transgenderpatienten" [Hormone treatment of transgender patients]. Gynäkologische Endokrinologie. 15 (1): 39–42. doi:10.1007/s10304-016-0116-9. ISSN 1610-2894. S2CID 12270365.
- ^ Urdl, W. (2009). "Behandlungsgrundsätze bei Transsexualität" [Therapeutic principles in transsexualism]. Gynäkologische Endokrinologie. 7 (3): 153–160. doi:10.1007/s10304-009-0314-9. ISSN 1610-2894. S2CID 8001811.
- ^ a b Gooren LJ (March 2011). "Clinical practice. Care of transsexual persons". N. Engl. J. Med. 364 (13): 1251–7. doi:10.1056/NEJMcp1008161. PMID 21449788.
- ^ James Barrett (29 September 2017). Transsexual and Other Disorders of Gender Identity: A Practical Guide to Management. CRC Press. pp. 216–. ISBN 978-1-315-34513-0.
- ^ Carlo Trombetta; Giovanni Liguori; Michele Bertolotto (3 March 2015). Management of Gender Dysphoria: A Multidisciplinary Approach. Springer. pp. 85–. ISBN 978-88-470-5696-1.
- ^ Fabris B, Bernardi S, Trombetta C (March 2015). "Cross-sex hormone therapy for gender dysphoria". J. Endocrinol. Invest. 38 (3): 269–82. doi:10.1007/s40618-014-0186-2. PMID 25403429. S2CID 207503049.
- ^ Kristen Eckstrand; Jesse M. Ehrenfeld (17 February 2016). Lesbian, Gay, Bisexual, and Transgender Healthcare: A Clinical Guide to Preventive, Primary, and Specialist Care. Springer. pp. 357–. ISBN 978-3-319-19752-4.
- ^ Tangpricha V, den Heijer M (April 2017). "Oestrogen and anti-androgen therapy for transgender women". Lancet Diabetes Endocrinol. 5 (4): 291–300. doi:10.1016/S2213-8587(16)30319-9. PMC 5366074. PMID 27916515.
- ^ Coxon, Jonny; Seal, Leighton (2018). "Hormone management of trans women". Trends in Urology & Men's Health. 9 (6): 10–14. doi:10.1002/tre.663. ISSN 2044-3730. S2CID 222189278.
- ^ Gooren LJ, Giltay EJ, Bunck MC (January 2008). "Long-term treatment of transsexuals with cross-sex hormones: extensive personal experience". J. Clin. Endocrinol. Metab. 93 (1): 19–25. doi:10.1210/jc.2007-1809. PMID 17986639.
- ^ Athanasoulia-Kaspar, Anastasia P.; Stalla, Günter K. (2019). "Endokrinologische Betreuung von Patienten mit Transsexualität" [Endocrinological care of patients with transsexuality]. Geburtshilfe und Frauenheilkunde. 79 (7): 672–675. doi:10.1055/a-0801-3319. ISSN 0016-5751.
- ^ a b c d e f g h Meriggiola MC, Gava G (November 2015). "Endocrine care of transpeople part II. A review of cross-sex hormonal treatments, outcomes and adverse effects in transwomen". Clin. Endocrinol. (Oxf). 83 (5): 607–15. doi:10.1111/cen.12754. PMID 25692882. S2CID 39706760.
- ^ Costa EM, Mendonca BB (March 2014). "Clinical management of transsexual subjects". Arq Bras Endocrinol Metabol. 58 (2): 188–96. doi:10.1590/0004-2730000003091. PMID 24830596.
- ^ Moore E, Wisniewski A, Dobs A (August 2003). "Endocrine treatment of transsexual people: a review of treatment regimens, outcomes, and adverse effects". The Journal of Clinical Endocrinology and Metabolism. 88 (8): 3467–73. doi:10.1210/jc.2002-021967. PMID 12915619.
- ^ Rosenthal SM (December 2014). "Approach to the patient: transgender youth: endocrine considerations". J. Clin. Endocrinol. Metab. 99 (12): 4379–89. doi:10.1210/jc.2014-1919. PMID 25140398.
- ^ Arver DS (2015). "Transsexualism, könsdysfori". Retrieved 2018-11-12.
- ^ Bourgeois AL, Auriche P, Palmaro A, Montastruc JL, Bagheri H (February 2016). "Risk of hormonotherapy in transgender people: Literature review and data from the French Database of Pharmacovigilance". Ann. Endocrinol. (Paris). 77 (1): 14–21. doi:10.1016/j.ando.2015.12.001. PMID 26830952.
- ^ a b c d Asscheman, Henk; Gooren, Louis J.G. (1993). "Hormone Treatment in Transsexuals". Journal of Psychology & Human Sexuality. 5 (4): 39–54. doi:10.1300/J056v05n04_03. ISSN 0890-7064.
- ^ Levy A, Crown A, Reid R (October 2003). "Endocrine intervention for transsexuals". Clin. Endocrinol. (Oxf). 59 (4): 409–18. doi:10.1046/j.1365-2265.2003.01821.x. PMID 14510900. S2CID 24493388.
- ^ Vincenzo Mirone (12 February 2015). Clinical Uro-Andrology. Springer. pp. 17–. ISBN 978-3-662-45018-5.
- ^ Lim HH, Jang YH, Choi GY, Lee JJ, Lee ES (January 2019). "Gender affirmative care of transgender people: a single center's experience in Korea". Obstet Gynecol Sci. 62 (1): 46–55. doi:10.5468/ogs.2019.62.1.46. PMC 6333764. PMID 30671393.
When we prescribed estradiol, we preferred sublingual estradiol valerate instead of the oral form for feminizing HT since prior researchers have reported the effectiveness of sublingual administration in maintaining high blood estradiol concentration and low E1/E2 ratio [13].
- ^ Gianna E. Israel (March 2001). Transgender Care: Recommended Guidelines, Practical Information, and Personal Accounts. Temple University Press. pp. 56–. ISBN 978-1-56639-852-7.
- ^ Majumder, Anirban; Chatterjee, Sudip; Maji, Debasis; Roychaudhuri, Soumyabrata; Ghosh, Sujoy; Selvan, Chitra; George, Belinda; Kalra, Pramila; Maisnam, Indira; Sanyal, Debmalya (2020). "IDEA group consensus statement on medical management of adult gender incongruent individuals seeking gender reaffirmation as female". Indian Journal of Endocrinology and Metabolism. 24 (2): 128. doi:10.4103/ijem.IJEM_593_19. ISSN 2230-8210. PMID 32699777. S2CID 218596936.
- ^ a b c d e Reisman T, Goldstein Z (2018). "Case Report: Induced Lactation in a Transgender Woman". Transgend Health. 3 (1): 24–26. doi:10.1089/trgh.2017.0044. PMC 5779241. PMID 29372185.
- ^ Henderson A (2003). "Domperidone. Discovering new choices for lactating mothers". Awhonn Lifelines. 7 (1): 54–60. doi:10.1177/1091592303251726. PMID 12674062.
- ^ "Orilissa (elagolix) FDA Label" (PDF). 24 July 2018. Retrieved 31 July 2018.
- ^ William B. Shore (21 August 2014). Adolescent Medicine, An Issue of Primary Care: Clinics in Office Practice, E-Book. Elsevier Health Sciences. pp. 663–. ISBN 978-0-323-32340-6.
- ^ Ivy M. Alexander; Versie Johnson-Mallard; Elizabeth Kostas-Polston; Catherine Ingram Fogel, Nancy Fugate Woods (28 June 2017). Women's Health Care in Advanced Practice Nursing, Second Edition. Springer Publishing Company. pp. 468–. ISBN 978-0-8261-9004-8.
- ^ Stege R, Gunnarsson PO, Johansson CJ, Olsson P, Pousette A, Carlström K (1996). "Pharmacokinetics and testosterone suppression of a single dose of polyestradiol phosphate (Estradurin) in prostatic cancer patients". Prostate. 28 (5): 307–10. doi:10.1002/(SICI)1097-0045(199605)28:5<307::AID-PROS6>3.0.CO;2-8. PMID 8610057.
- ^ a b c d e f g h i j Leinung MC, Feustel PJ, Joseph J (2018). "Hormonal Treatment of Transgender Women with Oral Estradiol". Transgend Health. 3 (1): 74–81. doi:10.1089/trgh.2017.0035. PMC 5944393. PMID 29756046.
- ^ a b c d e f g h i j k l m n o p q r s t u Kuhl H (2005). "Pharmacology of estrogens and progestogens: influence of different routes of administration" (PDF). Climacteric. 8 Suppl 1: 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ a b c d e f g h Unger CA (December 2016). "Hormone therapy for transgender patients". Transl Androl Urol. 5 (6): 877–884. doi:10.21037/tau.2016.09.04. PMC 5182227. PMID 28078219.
- ^ Alfred S. Wolf; H.P.G. Schneider (12 March 2013). Östrogene in Diagnostik und Therapie. Springer-Verlag. pp. 79, 81. ISBN 978-3-642-75101-1.
- ^ a b Lauritzen C (September 1990). "Clinical use of oestrogens and progestogens". Maturitas. 12 (3): 199–214. doi:10.1016/0378-5122(90)90004-P. PMID 2215269.
- ^ Lauritzen C (December 1986). "Die Behandlung der klimakterischen Beschwerden durch vaginale, rektale und transdermale Ostrogensubstitution" [Treatment of disorders of the climacteric by vaginal, rectal and transdermal estrogen substitution]. Gynakologe (in German). 19 (4): 248–53. ISSN 0017-5994. PMID 3817597.
- ^ a b Irwig MS (September 2018). "Cardiovascular health in transgender people". Rev Endocr Metab Disord. 19 (3): 243–251. doi:10.1007/s11154-018-9454-3. PMID 30073551. S2CID 51908458.
- ^ a b c d Getahun D, Nash R, Flanders WD, Baird TC, Becerra-Culqui TA, Cromwell L, Hunkeler E, Lash TL, Millman A, Quinn VP, Robinson B, Roblin D, Silverberg MJ, Safer J, Slovis J, Tangpricha V, Goodman M (August 2018). "Cross-sex Hormones and Acute Cardiovascular Events in Transgender Persons: A Cohort Study". Ann. Intern. Med. 169 (4): 205–213. doi:10.7326/M17-2785. PMC 6636681. PMID 29987313.
- ^ a b Ockrim J, Lalani EN, Abel P (October 2006). "Therapy Insight: parenteral estrogen treatment for prostate cancer—a new dawn for an old therapy". Nat Clin Pract Oncol. 3 (10): 552–63. doi:10.1038/ncponc0602. PMID 17019433. S2CID 6847203.
- ^ Lycette JL, Bland LB, Garzotto M, Beer TM (December 2006). "Parenteral estrogens for prostate cancer: can a new route of administration overcome old toxicities?". Clin Genitourin Cancer. 5 (3): 198–205. doi:10.3816/CGC.2006.n.037. PMID 17239273.
- ^ a b c d e f g h i Tangpricha V, den Heijer M (April 2017). "Oestrogen and anti-androgen therapy for transgender women". Lancet Diabetes Endocrinol. 5 (4): 291–300. doi:10.1016/S2213-8587(16)30319-9. PMC 5366074. PMID 27916515.
- ^ Stege R, Carlström K, Collste L, Eriksson A, Henriksson P, Pousette A (1988). "Single drug polyestradiol phosphate therapy in prostatic cancer". Am. J. Clin. Oncol. 11 Suppl 2: S101–3. doi:10.1097/00000421-198801102-00024. PMID 3242384. S2CID 32650111.
- ^ Ockrim JL, Lalani EN, Laniado ME, Carter SS, Abel PD (May 2003). "Transdermal estradiol therapy for advanced prostate cancer--forward to the past?". J. Urol. 169 (5): 1735–7. doi:10.1097/01.ju.0000061024.75334.40. PMID 12686820.
- ^ Leinung, MC (June 2014). "Variable Response to Oral Estradiol Therapy in Male to Female Transgender Patients". Endocrine Reviews. 35 (Supplement). doi:10.1210/endo-meetings.2014.RE.2.OR42-1 (inactive 31 October 2021).CS1 maint: 2021년 10월 현재 DOI 비활성화(링크)
- ^ Liang JJ, Jolly D, Chan KJ, Safer JD (February 2018). "Testosterone Levels Achieved by Medically Treated Transgender Women in a United States Endocrinology Clinic Cohort". Endocr Pract. 24 (2): 135–142. doi:10.4158/EP-2017-0116. PMID 29144822.
- ^ Gooren LJ, Giltay EJ, Bunck MC (January 2008). "Long-term treatment of transsexuals with cross-sex hormones: extensive personal experience". J. Clin. Endocrinol. Metab. 93 (1): 19–25. doi:10.1210/jc.2007-1809. PMID 17986639.
- ^ a b Wylie, Kevan Richard; Fung, Robert; Boshier, Claudia; Rotchell, Margaret (2009). "Recommendations of endocrine treatment for patients with gender dysphoria". Sexual and Relationship Therapy. 24 (2): 175–187. doi:10.1080/14681990903023306. ISSN 1468-1994. S2CID 20471537.
- ^ a b c Carlo Trombetta; Giovanni Liguori; Michele Bertolotto (3 March 2015). Management of Gender Dysphoria: A Multidisciplinary Approach. Springer. pp. 85–. ISBN 978-88-470-5696-1.
- ^ a b Haupt, Claudia; Henke, Miriam; Kutschmar, Alexia; Hauser, Birgit; Baldinger, Sandra; Schreiber, Gerhard (2018). "Antiandrogens or estradiol treatments or both during hormone replacement therapy in transitioning transgender women". Cochrane Database of Systematic Reviews. 2018 (10): CD013138. doi:10.1002/14651858.CD013138. ISSN 1465-1858. PMC 6517060.
- ^ Vermeulen A (1975). "Longacting steroid preparations". Acta Clin Belg. 30 (1): 48–55. doi:10.1080/17843286.1975.11716973. PMID 1231448.
- ^ Rauramo L, Punnonen R, Kaihola LH, Grönroos M (January 1980). "Serum oestrone, oestradiol and oestriol concentrations in castrated women during intramuscular oestradiol valerate and oestradiolbenzoate-oestradiolphenylpropionate therapy". Maturitas. 2 (1): 53–8. doi:10.1016/0378-5122(80)90060-2. PMID 7402086.
- ^ a b c d e f g h i Gava, Giulia; Seracchioli, Renato; Meriggiola, Maria Cristina (2017). "Therapy with Antiandrogens in Gender Dysphoric Natal Males". Endocrinology of the Testis and Male Reproduction. Endocrinology. pp. 1199–1209. doi:10.1007/978-3-319-44441-3_42. ISBN 978-3-319-44440-6. ISSN 2510-1927.
- ^ a b Lieberman R (2001). "Androgen deprivation therapy for prostate cancer chemoprevention: current status and future directions for agent development". Urology. 58 (2 Suppl 1): 83–90. doi:10.1016/s0090-4295(01)01247-x. PMID 11502457.
There are several classes of antiandrogens including (1) antigonadotropins (eg, LHRH agonists/antagonists, synthetic estrogens [diethylstilbestrol]); (2) nonsteroidal androgen-receptor antagonists (eg, flutamide, bicalutamide, nilutamide); (3) steroidal agents with mixed actions (eg, cyproterone acetate); (4) adrenal androgen inhibitors (eg, ketoconazole, hydrocortisone); (5) steroidal agents that inhibit androgen biosynthesis (eg, 5α-reductase inhibitors (type II) and dual-acting 5α-reductase inhibitors); [...]
- ^ a b c Shlomo Melmed; Kenneth S. Polonsky; P. Reed Larsen; Henry M. Kronenberg (11 November 2015). Williams Textbook of Endocrinology. Elsevier Health Sciences. pp. 714, 934. ISBN 978-0-323-34157-8.
- ^ a b Sarah Boslaugh (3 August 2018). Transgender Health Issues. ABC-CLIO. pp. 37–. ISBN 978-1-4408-5888-8.
- ^ a b Jerome F. Strauss; Robert L. Barbieri; Antonio R. Gargiulo (23 December 2017). Yen & Jaffe's Reproductive Endocrinology E-Book: Physiology, Pathophysiology, and Clinical Management. Elsevier Health Sciences. pp. 250–. ISBN 978-0-323-58232-2.
- ^ Dimitrakakis C (September 2011). "Androgens and breast cancer in men and women" (PDF). Endocrinol. Metab. Clin. North Am. 40 (3): 533–47, viii. doi:10.1016/j.ecl.2011.05.007. PMID 21889719.
- ^ Schneider HP (November 2003). "Androgens and antiandrogens". Ann. N. Y. Acad. Sci. 997 (1): 292–306. Bibcode:2003NYASA.997..292S. doi:10.1196/annals.1290.033. PMID 14644837. S2CID 8400556.
- ^ Tiefenbacher K, Daxenbichler G (2008). "The Role of Androgens in Normal and Malignant Breast Tissue". Breast Care (Basel). 3 (5): 325–331. doi:10.1159/000158055. PMC 2931104. PMID 20824027.
- ^ Gibson DA, Saunders PK, McEwan IJ (April 2018). "Androgens and androgen receptor: Above and beyond". Mol. Cell. Endocrinol. 465: 1–3. doi:10.1016/j.mce.2018.02.013. PMID 29481861. S2CID 3702165.
- ^ Brueggemeier, Robert W. (2006). "Sex Hormones (Male): Analogs and Antagonists". Encyclopedia of Molecular Cell Biology and Molecular Medicine. doi:10.1002/3527600906.mcb.200500066. ISBN 978-3527600908.
- ^ de Lignières B, Silberstein S (April 2000). "Pharmacodynamics of oestrogens and progestogens". Cephalalgia. 20 (3): 200–7. doi:10.1046/j.1468-2982.2000.00042.x. PMID 10997774. S2CID 40392817.
- ^ Neumann F (1978). "The physiological action of progesterone and the pharmacological effects of progestogens--a short review". Postgraduate Medical Journal. 54 Suppl 2: 11–24. PMID 368741.
- ^ Lotti, Francesco; Maggi, Mario (2015). "Hormonal Treatment for Skin Androgen-Related Disorders". European Handbook of Dermatological Treatments. pp. 1451–1464. doi:10.1007/978-3-662-45139-7_142. ISBN 978-3-662-45138-0.
- ^ Schmidt TH, Shinkai K (October 2015). "Evidence-based approach to cutaneous hyperandrogenism in women". J. Am. Acad. Dermatol. 73 (4): 672–90. doi:10.1016/j.jaad.2015.05.026. PMID 26138647.
- ^ Clapauch, Ruth; Weiss, Rita Vasconcellos; Rech, Ciciliana Maila Zilio (2017). "Testosterone and Women". Testosterone. pp. 319–351. doi:10.1007/978-3-319-46086-4_17. ISBN 978-3-319-46084-0.
- ^ a b c Singh SM, Gauthier S, Labrie F (2000). "Androgen receptor antagonists (antiandrogens): structure-activity relationships". Curr. Med. Chem. 7 (2): 211–47. doi:10.2174/0929867003375371. PMID 10637363.
- ^ a b Loren S Schechter (22 September 2016). Surgical Management of the Transgender Patient. Elsevier Health Sciences. pp. 26–. ISBN 978-0-323-48408-4.
- ^ Lynne Carroll; Lauren Mizock (7 February 2017). Clinical Issues and Affirmative Treatment with Transgender Clients, An Issue of Psychiatric Clinics of North America, E-Book. Elsevier Health Sciences. pp. 107–. ISBN 978-0-323-51004-2.
- ^ Laura Erickson-Schroth (12 May 2014). Trans Bodies, Trans Selves: A Resource for the Transgender Community. Oxford University Press. pp. 258–. ISBN 978-0-19-932536-8.
- ^ a b c d J. Larry Jameson; Leslie J. De Groot (18 May 2010). Endocrinology - E-Book: Adult and Pediatric. Elsevier Health Sciences. pp. 2282–. ISBN 978-1-4557-1126-0.
- ^ a b c d e f g h Randi Ettner; Stan Monstrey; Eli Coleman (20 May 2016). Principles of Transgender Medicine and Surgery. Routledge. pp. 169–170, 216, 251. ISBN 978-1-317-51460-2.
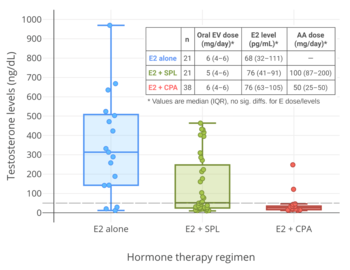
- ^ a b c Angus L, Leemaqz S, Ooi O, Cundill P, Silberstein N, Locke P, Zajac JD, Cheung AS (July 2019). "Cyproterone acetate or spironolactone in lowering testosterone concentrations for transgender individuals receiving oestradiol therapy". Endocr Connect. 8 (7): 935–940. doi:10.1530/EC-19-0272. PMC 6612061. PMID 31234145.
- ^ a b Kolkhof P, Bärfacker L (July 2017). "30 YEARS OF THE MINERALOCORTICOID RECEPTOR: Mineralocorticoid receptor antagonists: 60 years of research and development". J. Endocrinol. 234 (1): T125–T140. doi:10.1530/JOE-16-0600. PMC 5488394. PMID 28634268.
- ^ a b c d McMullen GR, Van Herle AJ (December 1993). "Hirsutism and the effectiveness of spironolactone in its management". J. Endocrinol. Invest. 16 (11): 925–32. doi:10.1007/BF03348960. PMID 8144871. S2CID 42231952.
- ^ a b c Loriaux, D. Lynn (November 1976). "Spironolactone and endocrine dysfunction". Annals of Internal Medicine. 85 (5): 630–6. doi:10.7326/0003-4819-85-5-630. PMID 984618.
- ^ a b c Thompson DF, Carter JR (1993). "Drug-induced gynecomastia". Pharmacotherapy. 13 (1): 37–45. doi:10.1002/j.1875-9114.1993.tb02688.x (inactive 31 October 2021). PMID 8094898.CS1 maint: 2021년 10월 현재 DOI 비활성화(링크)
- ^ a b c Shaw JC (February 1991). "Spironolactone in dermatologic therapy". J. Am. Acad. Dermatol. 24 (2 Pt 1): 236–43. doi:10.1016/0190-9622(91)70034-Y. PMID 1826112.
- ^ a b c d e Layton AM, Eady EA, Whitehouse H, Del Rosso JQ, Fedorowicz Z, van Zuuren EJ (2017). "Oral Spironolactone for Acne Vulgaris in Adult Females: A Hybrid Systematic Review". Am J Clin Dermatol. 18 (2): 169–191. doi:10.1007/s40257-016-0245-x. PMC 5360829. PMID 28155090.
- ^ Doggrell SA, Brown L (May 2001). "The spironolactone renaissance". Expert Opin Investig Drugs. 10 (5): 943–54. doi:10.1517/13543784.10.5.943. PMID 11322868. S2CID 39820875.
- ^ Jashin J. Wu (18 October 2012). Comprehensive Dermatologic Drug Therapy E-Book. Elsevier Health Sciences. pp. 364–. ISBN 978-1-4557-3801-4.
Spironolactone is an aldosterone antagonist and a relatively weak antiandrogen that blocks the AR and inhibits androgen biosynthesis.
- ^ H.J.T. Coelingh Benni; H.M. Vemer (15 December 1990). Chronic Hyperandrogenic Anovulation. CRC Press. pp. 152–. ISBN 978-1-85070-322-8.
- ^ a b Pavone-Macaluso M, de Voogt HJ, Viggiano G, Barasolo E, Lardennois B, de Pauw M, Sylvester R (September 1986). "Comparison of diethylstilbestrol, cyproterone acetate and medroxyprogesterone acetate in the treatment of advanced prostatic cancer: final analysis of a randomized phase III trial of the European Organization for Research on Treatment of Cancer Urological Group". J. Urol. 136 (3): 624–31. doi:10.1016/S0022-5347(17)44996-2. PMID 2942707.
- ^ a b Jeffrey K. Aronson (2 March 2009). Meyler's Side Effects of Cardiovascular Drugs. Elsevier. pp. 253–258. ISBN 978-0-08-093289-7.
- ^ a b Lainscak M, Pelliccia F, Rosano G, Vitale C, Schiariti M, Greco C, Speziale G, Gaudio C (2015). "Safety profile of mineralocorticoid receptor antagonists: Spironolactone and eplerenone". Int. J. Cardiol. 200: 25–9. doi:10.1016/j.ijcard.2015.05.127. PMID 26404748.
- ^ Juurlink DN, Mamdani MM, Lee DS, Kopp A, Austin PC, Laupacis A, Redelmeier DA (2004). "Rates of hyperkalemia after publication of the Randomized Aldactone Evaluation Study". N. Engl. J. Med. 351 (6): 543–51. doi:10.1056/NEJMoa040135. PMID 15295047.
- ^ a b Zaenglein AL, Pathy AL, Schlosser BJ, Alikhan A, Baldwin HE, Berson DS, Bowe WP, Graber EM, Harper JC, Kang S, Keri JE, Leyden JJ, Reynolds RV, Silverberg NB, Stein Gold LF, Tollefson MM, Weiss JS, Dolan NC, Sagan AA, Stern M, Boyer KM, Bhushan R (2016). "Guidelines of care for the management of acne vulgaris". J. Am. Acad. Dermatol. 74 (5): 945–73.e33. doi:10.1016/j.jaad.2015.12.037. PMID 26897386.
- ^ a b Plovanich M, Weng QY, Mostaghimi A (2015). "Low Usefulness of Potassium Monitoring Among Healthy Young Women Taking Spironolactone for Acne". JAMA Dermatol. 151 (9): 941–4. doi:10.1001/jamadermatol.2015.34. PMID 25796182.
- ^ a b c Neumann F (1994). "The antiandrogen cyproterone acetate: discovery, chemistry, basic pharmacology, clinical use and tool in basic research". Exp. Clin. Endocrinol. 102 (1): 1–32. doi:10.1055/s-0029-1211261. PMID 8005205.
- ^ Raudrant D, Rabe T (2003). "Progestogens with antiandrogenic properties". Drugs. 63 (5): 463–92. doi:10.2165/00003495-200363050-00003. PMID 12600226. S2CID 28436828.
- ^ Koch UJ, Lorenz F, Danehl K, Ericsson R, Hasan SH, Keyserlingk DV, Lübke K, Mehring M, Römmler A, Schwartz U, Hammerstein J (1976). "Continuous oral low-dosage cyproterone acetate for fertility regulation in the male? A trend analysis in 15 volunteers". Contraception. 14 (2): 117–35. doi:10.1016/0010-7824(76)90081-0. PMID 949890.
- ^ Moltz, L.; Römmler, A.; Schwartz, U.; Hammerstein, J. (1978). "Effects of Cyproterone Acetate (CPA) on Pituitary Gonadotrophin Release and on Androgen Secretion Before and After LH-RH Double Stimulation Tests in Men". International Journal of Andrology. 1 (s2b): 713–719. doi:10.1111/j.1365-2605.1978.tb00518.x. ISSN 0105-6263.
- ^ Wang C, Yeung KK (1980). "Use of low-dosage oral cyproterone acetate as a male contraceptive". Contraception. 21 (3): 245–72. doi:10.1016/0010-7824(80)90005-0. PMID 6771091.
- ^ Moltz L, Römmler A, Post K, Schwartz U, Hammerstein J (April 1980). "Medium dose cyproterone acetate (CPA): effects on hormone secretion and on spermatogenesis in men". Contraception. 21 (4): 393–413. doi:10.1016/s0010-7824(80)80017-5. PMID 6771095.
- ^ Knuth UA, Hano R, Nieschlag E (1984). "Effect of flutamide or cyproterone acetate on pituitary and testicular hormones in normal men". J. Clin. Endocrinol. Metab. 59 (5): 963–9. doi:10.1210/jcem-59-5-963. PMID 6237116.
- ^ Jacobi GH, Altwein JE, Kurth KH, Basting R, Hohenfellner R (1980). "Treatment of advanced prostatic cancer with parenteral cyproterone acetate: a phase III randomised trial". Br J Urol. 52 (3): 208–15. doi:10.1111/j.1464-410x.1980.tb02961.x. PMID 7000222.
- ^ Fung, Raymond; Hellstern-Layefsky, Miriam; Lega, Iliana (2017). "Is a lower dose of cyproterone acetate as effective at testosterone suppression in transgender women as higher doses?". International Journal of Transgenderism. 18 (2): 123–128. doi:10.1080/15532739.2017.1290566. ISSN 1553-2739. S2CID 79095497.
- ^ Meyer G, Mayer M, Mondorf A, Fluegel AK, Herrmann E, Bojunga J (November 2019). "Safety and rapid efficacy of guideline-based gender affirming hormone therapy: an analysis of 388 individuals diagnosed with gender dysphoria". Eur. J. Endocrinol. 182 (2): 149–156. doi:10.1530/EJE-19-0463. PMID 31751300. S2CID 208229129.
- ^ Pucci E, Petraglia F (December 1997). "Treatment of androgen excess in females: yesterday, today and tomorrow". Gynecol. Endocrinol. 11 (6): 411–33. doi:10.3109/09513599709152569. PMID 9476091.
- ^ Pharmacology of the Skin II: Methods, Absorption, Metabolism and Toxicity, Drugs and Diseases. Springer Science & Business Media. 6 December 2012. pp. 474, 489. ISBN 978-3-642-74054-1.
- ^ Thole Z, Manso G, Salgueiro E, Revuelta P, Hidalgo A (2004). "Hepatotoxicity induced by antiandrogens: a review of the literature". Urol. Int. 73 (4): 289–95. doi:10.1159/000081585. PMID 15604569. S2CID 24799765.
- ^ Hammerstein, J. (1990). "Antiandrogens: Clinical Aspects". Hair and Hair Diseases. pp. 827–886. doi:10.1007/978-3-642-74612-3_35. ISBN 978-3-642-74614-7.
- ^ Lothstein, Leslie M. (1996). "Antiandrogen treatment for sexual disorders: Guidelines for establishing a standard of care". Sexual Addiction & Compulsivity. 3 (4): 313–331. doi:10.1080/10720169608400122. ISSN 1072-0162.
- ^ Dangerous Sex Offenders: A Task Force Report of the American Psychiatric Association. American Psychiatric Pub. 1999. pp. 112–144. ISBN 978-0-89042-280-9.
- ^ Kravitz HM, Haywood TW, Kelly J, Liles S, Cavanaugh JL (1996). "Medroxyprogesterone and paraphiles: do testosterone levels matter?". Bull Am Acad Psychiatry Law. 24 (1): 73–83. PMID 8891323.
- ^ Novak E, Hendrix JW, Chen TT, Seckman CE, Royer GL, Pochi PE (October 1980). "Sebum production and plasma testosterone levels in man after high-dose medroxyprogesterone acetate treatment and androgen administration". Acta Endocrinol. 95 (2): 265–70. doi:10.1530/acta.0.0950265. PMID 6449127.
- ^ Kirschner MA, Schneider G (February 1972). "Suppression of the pituitary-Leydig cell axis and sebum production in normal men by medroxyprogesterone acetate (provera)". Acta Endocrinol. 69 (2): 385–93. doi:10.1530/acta.0.0690385. PMID 5066846.
- ^ Kemppainen JA, Langley E, Wong CI, Bobseine K, Kelce WR, Wilson EM (March 1999). "Distinguishing androgen receptor agonists and antagonists: distinct mechanisms of activation by medroxyprogesterone acetate and dihydrotestosterone". Mol. Endocrinol. 13 (3): 440–54. doi:10.1210/mend.13.3.0255. PMID 10077001.
- ^ Westhoff C (August 2003). "Depot-medroxyprogesterone acetate injection (Depo-Provera): a highly effective contraceptive option with proven long-term safety". Contraception. 68 (2): 75–87. doi:10.1016/S0010-7824(03)00136-7. PMID 12954518.
- ^ Nieschlag E (November 2010). "Clinical trials in male hormonal contraception" (PDF). Contraception. 82 (5): 457–70. doi:10.1016/j.contraception.2010.03.020. PMID 20933120.
- ^ Nieschlag E, Zitzmann M, Kamischke A (November 2003). "Use of progestins in male contraception". Steroids. 68 (10–13): 965–72. doi:10.1016/S0039-128X(03)00135-1. PMID 14667989. S2CID 22458746.
- ^ Wu FC, Balasubramanian R, Mulders TM, Coelingh-Bennink HJ (January 1999). "Oral progestogen combined with testosterone as a potential male contraceptive: additive effects between desogestrel and testosterone enanthate in suppression of spermatogenesis, pituitary-testicular axis, and lipid metabolism". J. Clin. Endocrinol. Metab. 84 (1): 112–22. doi:10.1210/jcem.84.1.5412. PMID 9920070.
- ^ Kumamoto Y, Yamaguchi Y, Sato Y, Suzuki R, Tanda H, Kato S, Mori K, Matsumoto H, Maki A, Kadono M (February 1990). "[Effects of anti-androgens on sexual function. Double-blind comparative studies on allylestrenol and chlormadinone acetate Part I: Nocturnal penile tumescence monitoring]". Hinyokika Kiyo (in Japanese). 36 (2): 213–26. PMID 1693037.
- ^ Geller J, Albert J, Geller S (1982). "Acute therapy with megestrol acetate decreases nuclear and cytosol androgen receptors in human BPH tissue". The Prostate. 3 (1): 11–5. doi:10.1002/pros.2990030103. PMID 6176985. S2CID 23541558.
- ^ Sander S, Nissen-Meyer R, Aakvaag A (1978). "On gestagen treatment of advanced prostatic carcinoma". Scand. J. Urol. Nephrol. 12 (2): 119–21. doi:10.3109/00365597809179977. PMID 694436.
- ^ Hinman, Frank, Jr. (1983). Benign Prostatic Hypertrophy. Springer Science & Business Media. pp. 259, 266, 272. ISBN 978-1-4612-5476-8.
- ^ Wein AJ, Kavoussi LR, Novick AC, Partin AW, Peters CA (25 August 2011). Campbell-Walsh Urology: Expert Consult Premium Edition: Enhanced Online Features and Print, 4-Volume Set. Elsevier Health Sciences. pp. 2938–. ISBN 978-1-4160-6911-9.
- ^ A. Hughes; S. H. Hasan; G. W. Oertel; H. E. Voss, F. Bahner, F. Neumann, H. Steinbeck, K.-J. Gräf, J. Brotherton, H. J. Horn, R. K. Wagner (27 November 2013). Androgens II and Antiandrogens / Androgene II und Antiandrogene. Springer Science & Business Media. pp. 490–491. ISBN 978-3-642-80859-3.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ Wenderoth, U. K.; Jacobi, G. H. (1983). "Gonadotropin-releasing hormone analogues for palliation of carcinoma of the prostate". World Journal of Urology. 1 (1): 40–48. doi:10.1007/BF00326861. ISSN 0724-4983. S2CID 23447326.
- ^ Schröder, Fritz H.; Radlmaier, Albert (2009). "Steroidal Antiandrogens". In V. Craig Jordan; Barrington J. A. Furr (eds.). Hormone Therapy in Breast and Prostate Cancer. Humana Press. pp. 325–346. doi:10.1007/978-1-59259-152-7_15. ISBN 978-1-60761-471-5.
CPA, as mentioned earlier, leads to an incomplete suppression of plasma testosterone levels, which decrease by about 70% and remain at about three times castration values. [Rennie et al.] found that the combination of CPA with an extremely low dose (0.1 mg/d) of DES led to a very effective withdrawal of androgens in terms of plasma testosterone and tissue dihydrotestosterone. [...] this regimen combines the testosterone-reducing effects of two compounds, therefore, only small amounts of estrogen are required to bring down plasma testosterone to approximately castrate levels.
- ^ Melamed AJ (March 1987). "Current concepts in the treatment of prostate cancer". Drug Intell Clin Pharm. 21 (3): 247–54. doi:10.1177/106002808702100302. PMID 3552544. S2CID 7482144.
[Megestrol acetate] produces a transient reduction in plasma testosterone to levels somewhat higher than those in castrated men. When used in a dose of 40 mg tid, in combination with estradiol 0.5–1.5 mg/d, it acts synergistically to suppress pituitary gonadotropins and maintain plasma testosterone at castration levels for periods up to one year.
- ^ a b c d e f Thomas L. Lemke; David A. Williams (2008). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. pp. 1286–1288. ISBN 978-0-7817-6879-5.
- ^ a b c Giorgetti R, di Muzio M, Giorgetti A, Girolami D, Borgia L, Tagliabracci A (March 2017). "Flutamide-induced hepatotoxicity: ethical and scientific issues" (PDF). Eur Rev Med Pharmacol Sci. 21 (1 Suppl): 69–77. PMID 28379593.
- ^ a b Erem C (2013). "Update on idiopathic hirsutism: diagnosis and treatment". Acta Clin Belg. 68 (4): 268–74. doi:10.2143/ACB.3267. PMID 24455796. S2CID 39120534.
- ^ a b Moretti C, Guccione L, Di Giacinto P, Simonelli I, Exacoustos C, Toscano V, Motta C, De Leo V, Petraglia F, Lenzi A (March 2018). "Combined Oral Contraception and Bicalutamide in Polycystic Ovary Syndrome and Severe Hirsutism: A Double-Blind Randomized Controlled Trial". J. Clin. Endocrinol. Metab. 103 (3): 824–838. doi:10.1210/jc.2017-01186. PMID 29211888. S2CID 3784055.
- ^ a b c William D. Figg; Cindy H. Chau; Eric J. Small (14 September 2010). Drug Management of Prostate Cancer. Springer Science & Business Media. pp. 71–72. ISBN 978-1-60327-829-4.
- ^ Caubet JF, Tosteson TD, Dong EW, Naylon EM, Whiting GW, Ernstoff MS, Ross SD (January 1997). "Maximum androgen blockade in advanced prostate cancer: a meta-analysis of published randomized controlled trials using nonsteroidal antiandrogens". Urology. 49 (1): 71–8. doi:10.1016/S0090-4295(96)00325-1. PMID 9000189.
- ^ Bruce A. Chabner; Dan L. Longo (8 November 2010). Cancer Chemotherapy and Biotherapy: Principles and Practice. Lippincott Williams & Wilkins. pp. 680–. ISBN 978-1-60547-431-1.
- ^ Neyman, A; Fuqua, JS; Eugster, EA (December 2017). "Bicalutamide as an Androgen Blocker with Secondary Effect of Promoting Feminization in Male to Female (MTF) Transgender Adolescents". Hormone Research in Paediatrics. 88: 1–628. doi:10.1159/000481424. PMID 28968603.
- ^ Crawford ED, Schellhammer PF, McLeod DG, Moul JW, Higano CS, Shore N, Denis L, Iversen P, Eisenberger MA, Labrie F (May 2018). "Androgen Receptor-Targeted Treatments for Prostate Cancer: 35 Years' Progress with Antiandrogens". J. Urol. 200 (5): 956–966. doi:10.1016/j.juro.2018.04.083. PMID 29730201. S2CID 19162538.
- ^ Ito Y, Sadar MD (2018). "Enzalutamide and blocking androgen receptor in advanced prostate cancer: lessons learnt from the history of drug development of antiandrogens". Res Rep Urol. 10: 23–32. doi:10.2147/RRU.S157116. PMC 5818862. PMID 29497605.
- ^ a b Ricci F, Buzzatti G, Rubagotti A, Boccardo F (November 2014). "Safety of antiandrogen therapy for treating prostate cancer". Expert Opin Drug Saf. 13 (11): 1483–99. doi:10.1517/14740338.2014.966686. PMID 25270521. S2CID 207488100.
- ^ Lutz Moser (1 January 2008). Controversies in the Treatment of Prostate Cancer. Karger Medical and Scientific Publishers. pp. 41–. ISBN 978-3-8055-8524-8.
- ^ a b Prostate Cancer. Demos Medical Publishing. 20 December 2011. pp. 460, 504. ISBN 978-1-935281-91-7.
- ^ Chang S (10 March 2010), Bicalutamide BPCA Drug Use Review in the Pediatric Population (PDF), U.S. Department of Health and Human Service, archived (PDF) from the original on 24 October 2016, retrieved 20 July 2016
- ^ Kolvenbag GJ, Blackledge GR (January 1996). "Worldwide activity and safety of bicalutamide: a summary review". Urology. 47 (1A Suppl): 70–9, discussion 80–4. doi:10.1016/S0090-4295(96)80012-4. PMID 8560681.
- ^ Vogelzang NJ (September 2012). "Enzalutamide--a major advance in the treatment of metastatic prostate cancer". N. Engl. J. Med. 367 (13): 1256–7. doi:10.1056/NEJMe1209041. PMID 23013078.
- ^ J. Ramon; L.J. Denis (5 June 2007). Prostate Cancer. Springer Science & Business Media. pp. 256–. ISBN 978-3-540-40901-4.
- ^ Gretarsdottir, Helga M.; Bjornsdottir, Elin; Bjornsson, Einar S. (2018). "Bicalutamide-Associated Acute Liver Injury and Migratory Arthralgia: A Rare but Clinically Important Adverse Effect". Case Reports in Gastroenterology. 12 (2): 266–270. doi:10.1159/000485175. ISSN 1662-0631. S2CID 81661015.
- ^ Gao Y, Maurer T, Mirmirani P (January 2018). "Understanding and Addressing Hair Disorders in Transgender Individuals". Am J Clin Dermatol. 19 (4): 517–527. doi:10.1007/s40257-018-0343-z. PMID 29352423. S2CID 6467968.
Non-steroidal antiandrogens include flutamide, nilutamide, and bicalutamide, which do not lower androgen levels and may be favorable for individuals who want to preserve sex drive and fertility [9].
- ^ Iversen P, Melezinek I, Schmidt A (Jan 2001). "Nonsteroidal antiandrogens: a therapeutic option for patients with advanced prostate cancer who wish to retain sexual interest and function". BJU International. 87 (1): 47–56. doi:10.1046/j.1464-410x.2001.00988.x. PMID 11121992. S2CID 28215804.
- ^ Morgante, E; Gradini, R; Realacci, M; Sale, P; D'eramo, G; Perrone, G A; Cardillo, M R; Petrangeli, E; Russo, Ma; Di Silverio, F (2001). "Effects of long-term treatment with the anti-androgen bicalutamide on human testis: an ultrastructural and morphometric study". Histopathology. 38 (3): 195–201. doi:10.1046/j.1365-2559.2001.01077.x. ISSN 0309-0167. PMID 11260298. S2CID 36892099.
- ^ Jones CA, Reiter L, Greenblatt E (2016). "Fertility preservation in transgender patients". International Journal of Transgenderism. 17 (2): 76–82. doi:10.1080/15532739.2016.1153992. ISSN 1553-2739. S2CID 58849546.
Traditionally, patients have been advised to cryopreserve sperm prior to starting cross-sex hormone therapy as there is a potential for a decline in sperm motility with high-dose estrogen therapy over time (Lubbert et al., 1992). However, this decline in fertility due to estrogen therapy is controversial due to limited studies.
- ^ Payne AH, Hardy MP (28 October 2007). The Leydig Cell in Health and Disease. Springer Science & Business Media. pp. 422–431. ISBN 978-1-59745-453-7.
Estrogens are highly efficient inhibitors of the hypothalamic-hypophyseal-testicular axis (212–214). Aside from their negative feedback action at the level of the hypothalamus and pituitary, direct inhibitory effects on the testis are likely (215,216). [...] The histology of the testes [with estrogen treatment] showed disorganization of the seminiferous tubules, vacuolization and absence of lumen, and compartmentalization of spermatogenesis.
- ^ a b Salam MA (2003). Principles & Practice of Urology: A Comprehensive Text. Universal-Publishers. pp. 684–. ISBN 978-1-58112-412-5.
Estrogens act primarily through negative feedback at the hypothalamic-pituitary level to reduce LH secretion and testicular androgen synthesis. [...] Interestingly, if the treatment with estrogens is discontinued after 3 yr. of uninterrupted exposure, serum testosterone may remain at castration levels for up to another 3 yr. This prolonged suppression is thought to result from a direct effect of estrogens on the Leydig cells.
- ^ a b c Cox RL, Crawford ED (December 1995). "Estrogens in the treatment of prostate cancer". J. Urol. 154 (6): 1991–8. doi:10.1016/S0022-5347(01)66670-9. PMID 7500443.
- ^ a b c d e f g h i j k l m Engel JB, Schally AV (February 2007). "Drug Insight: clinical use of agonists and antagonists of luteinizing-hormone-releasing hormone". Nat Clin Pract Endocrinol Metab. 3 (2): 157–67. doi:10.1038/ncpendmet0399. PMID 17237842. S2CID 19745821.
- ^ a b c d Shlomo Melmed (1 January 2016). Williams Textbook of Endocrinology. Elsevier Health Sciences. pp. 154, 621, 711. ISBN 978-0-323-29738-7.
- ^ Timothy L. Ratliff; William J. Catalona (6 December 2012). Genitourinary Cancer: Basic and Clinical Aspects. Springer Science & Business Media. pp. 158–. ISBN 978-1-4613-2033-3.
- ^ Ezzati M, Carr BR (January 2015). "Elagolix, a novel, orally bioavailable GnRH antagonist under investigation for the treatment of endometriosis-related pain". Womens Health (Lond). 11 (1): 19–28. doi:10.2217/whe.14.68. PMID 25581052. S2CID 7516507.
- ^ Conn PM, Crowley WF (January 1991). "Gonadotropin-releasing hormone and its analogues". N. Engl. J. Med. 324 (2): 93–103. doi:10.1056/NEJM199101103240205. PMID 1984190.
- ^ Jerome F. Strauss; Jerome F. Strauss, III; Robert L. Barbieri (13 September 2013). Yen and Jaffe's Reproductive Endocrinology. Elsevier Health Sciences. pp. 272–. ISBN 978-1-4557-2758-2.
- ^ a b c Krakowsky Y, Morgentaler A (July 2017). "Risk of Testosterone Flare in the Era of the Saturation Model: One More Historical Myth". Eur Urol Focus. 5 (1): 81–89. doi:10.1016/j.euf.2017.06.008. PMID 28753828. S2CID 10011200.
- ^ a b Thompson IM (2001). "Flare Associated with LHRH-Agonist Therapy". Rev Urol. 3 Suppl 3: S10–4. PMC 1476081. PMID 16986003.
- ^ Scaletscky R, Smith JA (April 1993). "Disease flare with gonadotrophin-releasing hormone (GnRH) analogues. How serious is it?". Drug Saf. 8 (4): 265–70. doi:10.2165/00002018-199308040-00001. PMID 8481213. S2CID 36964191.
- ^ a b c d J. Larry Jameson; Leslie J. De Groot (25 February 2015). Endocrinology: Adult and Pediatric E-Book. Elsevier Health Sciences. pp. 2009, 2207, 2479. ISBN 978-0-323-32195-2.
- ^ Louis J Denis; Keith Griffiths; Amir V Kaisary; Gerald P Murphy (1 March 1999). Textbook of Prostate Cancer: Pathology, Diagnosis and Treatment: Pathology, Diagnosis and Treatment. CRC Press. pp. 308–. ISBN 978-1-85317-422-3.
- ^ Reilly DR, Delva NJ, Hudson RW (August 2000). "Protocols for the use of cyproterone, medroxyprogesterone, and leuprolide in the treatment of paraphilia". Can J Psychiatry. 45 (6): 559–63. doi:10.1177/070674370004500608. PMID 10986575. S2CID 27710792.
[...] estrogen or antiandrogen treatment prior to the first leuprolide injection may reduce [the risk of symptoms caused by the testosterone "flare" at the initiation of treatment] (16).
- ^ a b c d Dittrich R, Binder H, Cupisti S, Hoffmann I, Beckmann MW, Mueller A (December 2005). "Endocrine treatment of male-to-female transsexuals using gonadotropin-releasing hormone agonist". Exp. Clin. Endocrinol. Diabetes. 113 (10): 586–92. doi:10.1055/s-2005-865900. PMID 16320157.
- ^ a b c Loren S Schechter; Bauback Safa (23 June 2018). Gender Confirmation Surgery, An Issue of Clinics in Plastic Surgery, E-Book. Elsevier Health Sciences. pp. 314–. ISBN 978-0-323-61075-9.
- ^ Emans SJ, Laufer MR (5 January 2012). Emans, Laufer, Goldstein's Pediatric and Adolescent Gynecology. Lippincott Williams & Wilkins. pp. 365–. ISBN 978-1-4511-5406-1. Archived from the original on 16 May 2016.
Therapy with GnRH analogs is expensive and requires intramuscular injections of depot formulations, the insert of a subcutaneous implant yearly, or, much less commonly, daily subcutaneous injections.
- ^ Hillard PJ (29 March 2013). Practical Pediatric and Adolescent Gynecology. John Wiley & Sons. pp. 182–. ISBN 978-1-118-53857-9.
Treatment is expensive, with costs typically in the range of $10,000–$15,000 per year.
- ^ Everett E. Vokes; Harvey M. Golomb (28 June 2011). Oncologic Therapies. Springer Science & Business Media. pp. 493–. ISBN 978-3-642-55780-4.
- ^ a b T'Sjoen G, Arcelus J, Gooren L, Klink DT, Tangpricha V (October 2018). "Endocrinology of Transgender Medicine". Endocrine Reviews. 40 (1): 97–117. doi:10.1210/er.2018-00011. PMID 30307546.
- ^ Cone, Allen (25 July 2018). "FDA approves drug to control endometriosis pain". UPI. Retrieved 31 July 2018.
- ^ a b c d e f g h i j k l Swerdloff RS, Dudley RE, Page ST, Wang C, Salameh WA (June 2017). "Dihydrotestosterone: Biochemistry, Physiology, and Clinical Implications of Elevated Blood Levels". Endocr. Rev. 38 (3): 220–254. doi:10.1210/er.2016-1067. PMC 6459338. PMID 28472278.
- ^ a b c d e f g h i j Marchetti PM, Barth JH (March 2013). "Clinical biochemistry of dihydrotestosterone". Ann. Clin. Biochem. 50 (Pt 2): 95–107. doi:10.1258/acb.2012.012159. PMID 23431485. S2CID 8325257.
- ^ Mozayani A, Raymon L (18 September 2011). Handbook of Drug Interactions: A Clinical and Forensic Guide. Springer Science & Business Media. pp. 656–. ISBN 978-1-61779-222-9.
- ^ a b Marks LS (2004). "5α-reductase: history and clinical importance". Rev Urol. 6 Suppl 9: S11–21. PMC 1472916. PMID 16985920.
- ^ Bhasin S (13 February 1996). Pharmacology, Biology, and Clinical Applications of Androgens: Current Status and Future Prospects. John Wiley & Sons. pp. 72–. ISBN 978-0-471-13320-9.
- ^ Jin Y, Penning TM (2001). "Steroid 5alpha-reductases and 3alpha-hydroxysteroid dehydrogenases: key enzymes in androgen metabolism". Best Pract. Res. Clin. Endocrinol. Metab. 15 (1): 79–94. doi:10.1053/beem.2001.0120. PMID 11469812.
- ^ Horton R (1992). "Dihydrotestosterone is a peripheral paracrine hormone". J. Androl. 13 (1): 23–7. doi:10.1002/j.1939-4640.1992.tb01621.x. PMID 1551803.
- ^ Wilson JD (1996). "Role of dihydrotestosterone in androgen action". Prostate Suppl. 6 (S6): 88–92. doi:10.1002/(SICI)1097-0045(1996)6+<88::AID-PROS17>3.0.CO;2-N. PMID 8630237.
- ^ Okeigwe I, Kuohung W (December 2014). "5-Alpha reductase deficiency: a 40-year retrospective review". Curr Opin Endocrinol Diabetes Obes. 21 (6): 483–7. doi:10.1097/MED.0000000000000116. PMID 25321150. S2CID 1093345.
- ^ Imperato-McGinley J, Zhu YS (December 2002). "Androgens and male physiology the syndrome of 5alpha-reductase-2 deficiency". Mol. Cell. Endocrinol. 198 (1–2): 51–9. doi:10.1016/S0303-7207(02)00368-4. PMID 12573814. S2CID 54356569.
- ^ Liang, Jennifer J.; Rasmusson, Ann M. (2018). "Overview of the Molecular Steps in Steroidogenesis of the GABAergic Neurosteroids Allopregnanolone and Pregnanolone". Chronic Stress. 2: 247054701881855. doi:10.1177/2470547018818555. ISSN 2470-5470. PMC 7219929. PMID 32440589.
- ^ a b c Traish AM, Mulgaonkar A, Giordano N (June 2014). "The dark side of 5α-reductase inhibitors' therapy: sexual dysfunction, high Gleason grade prostate cancer and depression". Korean J Urol. 55 (6): 367–79. doi:10.4111/kju.2014.55.6.367. PMC 4064044. PMID 24955220.
- ^ a b c Bartsch G, Rittmaster RS, Klocker H (April 2000). "Dihydrotestosterone and the concept of 5alpha-reductase inhibition in human benign prostatic hyperplasia". Eur. Urol. 37 (4): 367–80. doi:10.1159/000020181. PMID 10765065. S2CID 25793400.
- ^ a b Yamana K, Labrie F, Luu-The V (August 2010). "Human type 3 5α-reductase is expressed in peripheral tissues at higher levels than types 1 and 2 and its activity is potently inhibited by finasteride and dutasteride". Horm Mol Biol Clin Investig. 2 (3): 293–9. doi:10.1515/HMBCI.2010.035. PMID 25961201. S2CID 28841145.
- ^ Traish AM, Krakowsky Y, Doros G, Morgentaler A (August 2018). "Do 5α-Reductase Inhibitors Raise Circulating Serum Testosterone Levels? A Comprehensive Review and Meta-Analysis to Explaining Paradoxical Results". Sex Med Rev. 7 (1): 95–114. doi:10.1016/j.sxmr.2018.06.002. PMID 30098986. S2CID 51968365.
- ^ Azzouni F, Mohler J (September 2012). "Role of 5α-reductase inhibitors in benign prostatic diseases". Prostate Cancer Prostatic Dis. 15 (3): 222–30. doi:10.1038/pcan.2012.1. PMID 22333687. S2CID 205537645.
- ^ a b Yim E, Nole KL, Tosti A (December 2014). "5α-Reductase inhibitors in androgenetic alopecia". Curr Opin Endocrinol Diabetes Obes. 21 (6): 493–8. doi:10.1097/MED.0000000000000112. PMID 25268732. S2CID 30008068.
- ^ a b Arif T, Dorjay K, Adil M, Sami M (2017). "Dutasteride in Androgenetic Alopecia: An Update". Curr Clin Pharmacol. 12 (1): 31–35. doi:10.2174/1574884712666170310111125. PMID 28294070.
- ^ a b c Stout SM, Stumpf JL (June 2010). "Finasteride treatment of hair loss in women". Ann Pharmacother. 44 (6): 1090–7. doi:10.1345/aph.1M591. PMID 20442354. S2CID 207263793.
- ^ Varothai S, Bergfeld WF (July 2014). "Androgenetic alopecia: an evidence-based treatment update". Am J Clin Dermatol. 15 (3): 217–30. doi:10.1007/s40257-014-0077-5. PMID 24848508. S2CID 31245042.
- ^ Ulrike Blume-Peytavi; David A. Whiting; Ralph M. Trüeb (26 June 2008). Hair Growth and Disorders. Springer Science & Business Media. pp. 182, 369. ISBN 978-3-540-46911-7.
- ^ Jerry Shapiro; Nina Otberg (17 April 2015). Hair Loss and Restoration, Second Edition. CRC Press. pp. 39–40. ISBN 978-1-4822-3199-1.
- ^ Ralph M. Trüeb; Won-Soo Lee (13 February 2014). Male Alopecia: Guide to Successful Management. Springer Science & Business Media. pp. 91–. ISBN 978-3-319-03233-7.
- ^ a b Reddy DS, Estes WA (July 2016). "Clinical Potential of Neurosteroids for CNS Disorders". Trends Pharmacol. Sci. 37 (7): 543–561. doi:10.1016/j.tips.2016.04.003. PMC 5310676. PMID 27156439.
- ^ a b Martinez PE, Rubinow DR, Nieman LK, Koziol DE, Morrow AL, Schiller CE, Cintron D, Thompson KD, Khine KK, Schmidt PJ (March 2016). "5α-Reductase Inhibition Prevents the Luteal Phase Increase in Plasma Allopregnanolone Levels and Mitigates Symptoms in Women with Premenstrual Dysphoric Disorder". Neuropsychopharmacology. 41 (4): 1093–102. doi:10.1038/npp.2015.246. PMC 4748434. PMID 26272051.
- ^ a b Knezevich EL, Viereck LK, Drincic AT (January 2012). "Medical management of adult transsexual persons". Pharmacotherapy. 32 (1): 54–66. doi:10.1002/PHAR.1006. PMID 22392828. S2CID 12853220.
- ^ Fabris B, Bernardi S, Trombetta C (March 2015). "Cross-sex hormone therapy for gender dysphoria". J. Endocrinol. Invest. 38 (3): 269–82. doi:10.1007/s40618-014-0186-2. PMID 25403429. S2CID 207503049.
- ^ a b c d e f g Levy A, Crown A, Reid R (October 2003). "Endocrine intervention for transsexuals". Clin. Endocrinol. (Oxf). 59 (4): 409–18. doi:10.1046/j.1365-2265.2003.01821.x. PMID 14510900. S2CID 24493388.
- ^ a b c Hirshburg JM, Kelsey PA, Therrien CA, Gavino AC, Reichenberg JS (July 2016). "Adverse Effects and Safety of 5-alpha Reductase Inhibitors (Finasteride, Dutasteride): A Systematic Review". J Clin Aesthet Dermatol. 9 (7): 56–62. PMC 5023004. PMID 27672412.
- ^ a b c Trost L, Saitz TR, Hellstrom WJ (May 2013). "Side Effects of 5-Alpha Reductase Inhibitors: A Comprehensive Review". Sex Med Rev. 1 (1): 24–41. doi:10.1002/smrj.3. PMID 27784557.
- ^ a b Liu L, Zhao S, Li F, Li E, Kang R, Luo L, Luo J, Wan S, Zhao Z (September 2016). "Effect of 5α-Reductase Inhibitors on Sexual Function: A Meta-Analysis and Systematic Review of Randomized Controlled Trials". J Sex Med. 13 (9): 1297–1310. doi:10.1016/j.jsxm.2016.07.006. PMID 27475241.
- ^ a b c Lee JY, Cho KS (May 2018). "Effects of 5-alpha reductase inhibitors: new insights on benefits and harms". Curr Opin Urol. 28 (3): 288–293. doi:10.1097/MOU.0000000000000497. PMID 29528971. S2CID 4587434.
- ^ a b Traish AM, Hassani J, Guay AT, Zitzmann M, Hansen ML (March 2011). "Adverse side effects of 5α-reductase inhibitors therapy: persistent diminished libido and erectile dysfunction and depression in a subset of patients". J Sex Med. 8 (3): 872–84. doi:10.1111/j.1743-6109.2010.02157.x. PMID 21176115.
- ^ a b Traish, Abdulmaged M. (2018). "The Post-finasteride Syndrome: Clinical Manifestation of Drug-Induced Epigenetics Due to Endocrine Disruption". Current Sexual Health Reports. 10 (3): 88–103. doi:10.1007/s11930-018-0161-6. ISSN 1548-3584. S2CID 81560714.
- ^ Malde S, Cartwright R, Tikkinen KA (January 2018). "What's New in Epidemiology?". Eur Urol Focus. 4 (1): 11–13. doi:10.1016/j.euf.2018.02.003. PMID 29449167.
- ^ Kuhl, Herbert; Wiegratz, Inka (2017). "Das Post-Finasterid-Syndrom" [The Post-Finasteride Syndrome]. Gynäkologische Endokrinologie. 15 (2): 153–163. doi:10.1007/s10304-017-0126-2. ISSN 1610-2894. S2CID 207071180.
- ^ Traish AM, Melcangi RC, Bortolato M, Garcia-Segura LM, Zitzmann M (September 2015). "Adverse effects of 5α-reductase inhibitors: What do we know, don't know, and need to know?". Rev Endocr Metab Disord. 16 (3): 177–98. doi:10.1007/s11154-015-9319-y. PMID 26296373. S2CID 25002351.
- ^ Trüeb RM (June 2017). "Discriminating in favour of or against men with increased risk of finasteride-related side effects?". Exp. Dermatol. 26 (6): 527–528. doi:10.1111/exd.13155. PMID 27489125. S2CID 36236057.
[...] caution is recommended while prescribing oral finasteride to male-to-female transsexuals, as the drug has been associated with inducing depression, anxiety and suicidal ideation, symptoms that are particularly common in patients with gender dysphoria, who are already at a high risk.[9]
- ^ Thomas L. Lemke; David A. Williams (24 January 2012). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. pp. 1397–1399. ISBN 978-1-60913-345-0.
- ^ a b c d e f g Macias, Hector; Hinck, Lindsay (2012). "Mammary gland development". Wiley Interdisciplinary Reviews: Developmental Biology. 1 (4): 533–557. doi:10.1002/wdev.35. ISSN 1759-7684. PMC 3404495. PMID 22844349.
- ^ a b c d e f Sun, Susie X.; Bostanci, Zeynep; Kass, Rena B.; Mancino, Anne T.; Rosenbloom, Arlan L.; Klimberg, V. Suzanne; Bland, Kirby I. (2018). "Breast Physiology". The Breast. pp. 37–56.e6. doi:10.1016/B978-0-323-35955-9.00003-9. ISBN 9780323359559.
- ^ a b c d e f g h Wierckx K, Gooren L, T'Sjoen G (2014). "Clinical review: Breast development in trans women receiving cross-sex hormones". J Sex Med. 11 (5): 1240–7. doi:10.1111/jsm.12487. PMID 24618412.
- ^ Cox DB, Kent JC, Casey TM, Owens RA, Hartmann PE (March 1999). "Breast growth and the urinary excretion of lactose during human pregnancy and early lactation: endocrine relationships". Exp. Physiol. 84 (2): 421–34. doi:10.1017/S0958067099018072. PMID 10226182.
- ^ a b c Wiegratz I, Kuhl H (August 2004). "Progestogen therapies: differences in clinical effects?". Trends Endocrinol. Metab. 15 (6): 277–85. doi:10.1016/j.tem.2004.06.006. PMID 15358281. S2CID 35891204.
- ^ Mary C. Brucker; Tekoa L. King (8 September 2015). Pharmacology for Women's Health. Jones & Bartlett Publishers. pp. 368–. ISBN 978-1-284-05748-5.
- ^ a b c d e f g Fabris B, Bernardi S, Trombetta C (March 2015). "Cross-sex hormone therapy for gender dysphoria". J. Endocrinol. Invest. 38 (3): 269–82. doi:10.1007/s40618-014-0186-2. PMID 25403429. S2CID 207503049.
- ^ a b Ilan H. Meyer; Mary E. Northridge (12 March 2007). The Health of Sexual Minorities: Public Health Perspectives on Lesbian, Gay, Bisexual and Transgender Populations. Springer. pp. 476–. ISBN 978-0-387-31334-4.
- ^ Gianna E. Israel; Donald E. Tarver; Joy Diane Shaffer (1 March 2001). Transgender Care: Recommended Guidelines, Practical Information, and Personal Accounts. Temple University Press. pp. 58–. ISBN 978-1-56639-852-7.
- ^ Richard Ekins; Dave King (23 October 2006). The Transgender Phenomenon. SAGE Publications. pp. 48–. ISBN 978-1-84787-726-0.
- ^ a b Kronawitter D, Gooren LJ, Zollver H, Oppelt PG, Beckmann MW, Dittrich R, Mueller A (August 2009). "Effects of transdermal testosterone or oral dydrogesterone on hypoactive sexual desire disorder in transsexual women: results of a pilot study". Eur. J. Endocrinol. 161 (2): 363–8. doi:10.1530/EJE-09-0265. PMID 19497984.
- ^ Majumder A, Sanyal D (2017). "Outcome and preferences in male-to-female subjects with gender dysphoria: Experience from Eastern India". Indian J Endocrinol Metab. 21 (1): 21–25. doi:10.4103/2230-8210.196000. PMC 5240066. PMID 28217493.
- ^ a b Meyer WJ, Webb A, Stuart CA, Finkelstein JW, Lawrence B, Walker PA (April 1986). "Physical and hormonal evaluation of transsexual patients: a longitudinal study". Archives of Sexual Behavior. 15 (2): 121–38. doi:10.1007/bf01542220. PMID 3013122. S2CID 42786642.
- ^ Daniel R. Mishell; Val Davajan (1979). Reproductive endocrinology, infertility, and contraception. F. A. Davis Co. p. 224. ISBN 978-0-8036-6235-3.
It has been suggested that progestins be added during the last week of each cycle of estrogen therapy in order to develop more rounded breasts rather than the conical breasts many of these patients develop, but we have been unable to detect any difference in breast contour with or without progestins.
- ^ Morris JM (June 1953). "The syndrome of testicular feminization in male pseudohermaphrodites". Am. J. Obstet. Gynecol. 65 (6): 1192–1211. doi:10.1016/0002-9378(53)90359-7. PMID 13057950.
- ^ Lorincz AM, Sukumar S (2006). "Molecular links between obesity and breast cancer". Endocrine-Related Cancer. 13 (2): 279–92. doi:10.1677/erc.1.00729. PMID 16728564.
Adipocytes make up the bulk of the human breast, with epithelial cells accounting for only approximately 10% of human breast volume.
- ^ Howard BA, Gusterson BA (2000). "Human breast development". Journal of Mammary Gland Biology and Neoplasia. 5 (2): 119–37. doi:10.1023/A:1026487120779. PMID 11149569. S2CID 10819224.
In the stroma, there is an increase in the amount of fibrous and fatty tissue, with the adult nonlactating breast consisting of 80% or more of stroma.
- ^ Sperling MA (10 April 2014). Pediatric Endocrinology. Elsevier Health Sciences. pp. 598–. ISBN 978-1-4557-5973-6.
Estrogen stimulates the nipples to grow, mammary terminal duct branching to progress to the stage at which ductules are formed, and fatty stromal growth to increase until it constitutes about 85% of the mass of the breast. [...] Lobulation appears around menarche, when multiple blind saccular buds form by branching of the terminal ducts. These effects are due to the presence of progesterone. [...] Full alveolar development normally only occurs during pregnancy under the influence of additional progesterone and prolactin.
- ^ Hagisawa S, Shimura N, Arisaka O (2012). "Effect of excess estrogen on breast and external genitalia development in growth hormone deficiency". Journal of Pediatric and Adolescent Gynecology. 25 (3): e61–3. doi:10.1016/j.jpag.2011.11.005. PMID 22206682.
Estrogen stimulates growth of the nipples, progression of mammary duct branching to the stage at which ductiles are formed, and fatty stromal growth until it constitutes about 85% of the mass of the breast.
- ^ a b Lee-Ellen C. Copstead-Kirkhorn; Jacquelyn L. Banasik (25 June 2014). Pathophysiology - E-Book. Elsevier Health Sciences. pp. 660–. ISBN 978-0-323-29317-4.
Throughout the reproductive years, some women note swelling of the breast around the latter part of each menstrual cycle before the onset of menstruation. The water retention and subsequent swelling of breast tissue during this phase of the menstrual cycle are thought to be due to high levels of circulating progesterone stimulating the secretory cells of the breast.12
- ^ a b Farage MA, Neill S, MacLean AB (2009). "Physiological changes associated with the menstrual cycle: a review". Obstet Gynecol Surv. 64 (1): 58–72. doi:10.1097/OGX.0b013e3181932a37. PMID 19099613. S2CID 22293838.
- ^ Gompel A (April 2012). "Micronized progesterone and its impact on the endometrium and breast vs. progestogens". Climacteric. 15 Suppl 1: 18–25. doi:10.3109/13697137.2012.669584. PMID 22432812. S2CID 17700754.
- ^ Cline JM, Wood CE (December 2008). "The Mammary Glands of Macaques". Toxicol Pathol. 36 (7): 134s–141s. doi:10.1177/0192623308327411. PMC 3070964. PMID 21475638.
- ^ Pasqualini JR (2007). "Progestins and breast cancer". Gynecol. Endocrinol. 23 Suppl 1: 32–41. doi:10.1080/09513590701585003. PMID 17943537. S2CID 46634314.
- ^ Pasqualini JR (2009). "Breast cancer and steroid metabolizing enzymes: the role of progestogens". Maturitas. 65 Suppl 1: S17–21. doi:10.1016/j.maturitas.2009.11.006. PMID 19962254.
- ^ Schindler AE (February 2011). "Dydrogesterone and other progestins in benign breast disease: an overview". Arch. Gynecol. Obstet. 283 (2): 369–71. doi:10.1007/s00404-010-1456-7. PMID 20383772. S2CID 9125889.
- ^ Winkler UH, Schindler AE, Brinkmann US, Ebert C, Oberhoff C (December 2001). "Cyclic progestin therapy for the management of mastopathy and mastodynia". Gynecol. Endocrinol. 15 Suppl 6: 37–43. doi:10.1080/gye.15.s6.37.43. PMID 12227885. S2CID 27589741.
- ^ a b c d Ruan X, Mueck AO (November 2014). "Systemic progesterone therapy--oral, vaginal, injections and even transdermal?". Maturitas. 79 (3): 248–55. doi:10.1016/j.maturitas.2014.07.009. PMID 25113944.
- ^ Bińkowska, Małgorzata; Woroń, Jarosław (2015). "Progestogens in menopausal hormone therapy". Menopausal Review. 14 (2): 134–143. doi:10.5114/pm.2015.52154. ISSN 1643-8876. PMC 4498031. PMID 26327902.
- ^ Kenneth L. Becker (2001). Principles and Practice of Endocrinology and Metabolism. Lippincott Williams & Wilkins. pp. 889–. ISBN 978-0-7817-1750-2.
- ^ Sanjay Rajagopalan; Debabrata Mukherjee; Emile R. Mohler (2005). Manual of Vascular Diseases. Lippincott Williams & Wilkins. pp. 1–. ISBN 978-0-7817-4499-7.
- ^ a b c Foss GL (March 1958). "Disturbances of lactation". Clin Obstet Gynecol. 1 (1): 245–54. doi:10.1097/00003081-195803000-00021. PMID 13573669. S2CID 42825519.
Experimentally I have been able to induce lactogenesis in a male transvestite whose testes had been removed some years before and whose breasts had been well developed over a long period with stilbestrol and ethisterone.9 In July, 1955, 600 mg. of estradiol was implanted subcutaneously and weekly injections of 50 mg. of progesterone were given for four months. For the next month daily injections of 10 mg. estradiol dipropionate and 50 mg. progesterone were given. These injections were continued for another month, increasing progesterone to 100 mg. daily. Both hormones were then withdrawn, and daily injections of increasing doses of prolactin and somatotropin were given for four days; at the same time, the patient used a breast bump four times daily for 5 minutes on both sides. During this time the mammary veins were visibly enlarged and on the sixth and seventh days 1 to 2 cc. of milky fluid was collected.
- ^ a b c Kanhai RC, Hage JJ, van Diest PJ, Bloemena E, Mulder JW (January 2000). "Short-term and long-term histologic effects of castration and estrogen treatment on breast tissue of 14 male-to-female transsexuals in comparison with two chemically castrated men". The American Journal of Surgical Pathology. 24 (1): 74–80. doi:10.1097/00000478-200001000-00009. PMID 10632490.
- ^ Lawrence, Anne A. (2007). "Transgender Health Concerns". The Health of Sexual Minorities: 473–505. doi:10.1007/978-0-387-31334-4_19. ISBN 978-0-387-28871-0.
- ^ Paul Peter Rosen (2009). Rosen's Breast Pathology. Lippincott Williams & Wilkins. pp. 31–. ISBN 978-0-7817-7137-5.
- ^ Worsley R, Santoro N, Miller KK, Parish SJ, Davis SR (March 2016). "Hormones and Female Sexual Dysfunction: Beyond Estrogens and Androgens--Findings from the Fourth International Consultation on Sexual Medicine". J Sex Med. 13 (3): 283–90. doi:10.1016/j.jsxm.2015.12.014. PMID 26944460.
- ^ Apgar BS, Greenberg G (October 2000). "Using progestins in clinical practice". Am Fam Physician. 62 (8): 1839–46, 1849–50. PMID 11057840.
- ^ a b Goletiani NV, Keith DR, Gorsky SJ (2007). "Progesterone: review of safety for clinical studies". Exp Clin Psychopharmacol. 15 (5): 427–44. doi:10.1037/1064-1297.15.5.427. PMID 17924777.
- ^ Bäckström T, Bixo M, Johansson M, Nyberg S, Ossewaarde L, Ragagnin G, Savic I, Strömberg J, Timby E, van Broekhoven F, van Wingen G (2014). "Allopregnanolone and mood disorders". Prog. Neurobiol. 113: 88–94. doi:10.1016/j.pneurobio.2013.07.005. PMID 23978486. S2CID 207407084.
- ^ a b c d e f g h Moore E, Wisniewski A, Dobs A (August 2003). "Endocrine treatment of transsexual people: a review of treatment regimens, outcomes, and adverse effects". The Journal of Clinical Endocrinology and Metabolism. 88 (8): 3467–73. doi:10.1210/jc.2002-021967. PMID 12915619.
- ^ a b c Davey DA (March 2018). "Menopausal hormone therapy: a better and safer future". Climacteric. 21 (5): 454–461. doi:10.1080/13697137.2018.1439915. PMID 29526116. S2CID 3850275.
- ^ Raj R, Korja M, Koroknay-Pál P, Niemelä M (2018). "Multiple meningiomas in two male-to-female transsexual patients with hormone replacement therapy: A report of two cases and a brief literature review". Surg Neurol Int. 9: 109. doi:10.4103/sni.sni_22_18. PMC 5991277. PMID 29930875.
- ^ Nota NM, Wiepjes CM, de Blok CJ, Gooren LJ, Peerdeman SM, Kreukels BP, den Heijer M (July 2018). "The occurrence of benign brain tumours in transgender individuals during cross-sex hormone treatment". Brain. 141 (7): 2047–2054. doi:10.1093/brain/awy108. PMID 29688280. S2CID 19934721.
- ^ Kuhl H (2011). "Pharmacology of Progestogens" (PDF). Journal für Reproduktionsmedizin und Endokrinologie-Journal of Reproductive Medicine and Endocrinology. 8 (1): 157–177.
- ^ Kuhl H, Schneider HP (August 2013). "Progesterone--promoter or inhibitor of breast cancer". Climacteric. 16 Suppl 1: 54–68. doi:10.3109/13697137.2013.768806. PMID 23336704. S2CID 20808536.
- ^ a b de Ziegler D, Fanchin R (2000). "Progesterone and progestins: applications in gynecology". Steroids. 65 (10–11): 671–9. doi:10.1016/S0039-128X(00)00123-9. PMID 11108875. S2CID 5867301.
- ^ a b Hermann AC, Nafziger AN, Victory J, Kulawy R, Rocci ML, Bertino JS (2005). "Over-the-counter progesterone cream produces significant drug exposure compared to a food and drug administration-approved oral progesterone product". J Clin Pharmacol. 45 (6): 614–9. doi:10.1177/0091270005276621. PMID 15901742. S2CID 28399314.
- ^ Tollan A, Oian P, Kjeldsen SE, Eide I, Maltau JM (1993). "Progesterone reduces sympathetic tone without changing blood pressure or fluid balance in men". Gynecol. Obstet. Invest. 36 (4): 234–8. doi:10.1159/000292636. PMID 8300009.
- ^ Unfer, Vittorio; di Renzo, Gian; Gerli, Sandro; Casini, Maria (2006). "The Use of Progesterone in Clinical Practice: Evaluation of its Efficacy in Diverse Indications Using Different Routes of Administration". Current Drug Therapy. 1 (2): 211–219. doi:10.2174/157488506776930923. ISSN 1574-8855.
- ^ Brady BM, Anderson RA, Kinniburgh D, Baird DT (2003). "Demonstration of progesterone receptor-mediated gonadotrophin suppression in the human male". Clin. Endocrinol. (Oxf). 58 (4): 506–12. doi:10.1046/j.1365-2265.2003.01751.x. PMID 12641635. S2CID 12567639.
- ^ A. Wayne Meikle (1 June 1999). Hormone Replacement Therapy. Springer Science & Business Media. pp. 383, 389. ISBN 978-1-59259-700-0.
- ^ Paynter MJ (March 2019). "Medication and Facilitation of Transgender Women's Lactation". J Hum Lact. 35 (2): 239–243. doi:10.1177/0890334419829729. PMID 30840524. S2CID 73466659.
- ^ Telis, Leon; Baum, Stephanie; Singer, Tomer; Berookhim, Boback M. (2019). "Fertility Issues in Transgender Care". Transgender Medicine. Contemporary Endocrinology. pp. 197–212. doi:10.1007/978-3-030-05683-4_11. ISBN 978-3-030-05682-7. ISSN 2523-3785. S2CID 151135327.
- ^ a b Kozlov GI, Mel'nichenko GA, Golubeva IV (1985). "Sluchai laktorei u bol'nogo muzhskogo pola s transseksualizmom" [Case of galactorrhea in a transsexual male patient]. Probl Endokrinol (Mosk) (in Russian). 31 (1): 37–8. ISSN 0375-9660. PMID 4039061.
[...] castration and feminizing plastic surgery of the external genitalia was performed [...] Some time after the operation, the patient developed a renewed interest in life. After the surgical and hormonal correction, the patient irresistibly developed maternal instincts. Unmarried, the patient obtained permission for the adoption of a child, simulated pregnancy, and was discharged from the maternity hospital with a son. From the first days after the “birth”, galactorrhea sharply increased, and spontaneous outflow of milk appeared, with galactorrhea (+++). The baby was breastfed up to 6 months of age. [...] Our message is the second in the world literature describing galactorrhea in a male patient with transsexualism. The first description of this kind was made in 1983 by R. [Flückiger] et al. (6). This observation demonstrates the independence of the mechanism of lactation development from one’s genetic sex and is alarming with regard to the possibility of drug-induced galactorrhea development in men.
- ^ Foss, GL (January 1956). "Abnormalities of form and function of the human breast". Journal of Endocrinology. 14 (1): R6–R9.
Based on the theories of lactogenesis and stimulated by the success of Lyons, Li, Johnson & Cole [1955], who succeeded in producing lactation in male rats, an attempt was made to initiate lactogenesis in a male transvestist. Six years ago this patient had been given oestrogens. Both testes and penis were then removed and an artificial vagina was constructed by plastic surgery. The patient was implanted with 500 mg oestradiol in September 1954, and 600 mg in July 1955. The breasts were then developed more intensively with daily injections of oestradiol dipropionate and progesterone for 6 weeks. Immediately following withdrawal of this treatment, prolactin 22·9 mg was injected daily for 3 days without effect. After a second month on oestradiol and progesterone daily, combined injections of prolactin and somatotrophin were given for 4 days and suction was applied by a breast pump-four times daily. On the 4th and 5th days a few drops of colostrum were expressed from the right nipple.
- ^ Harold Gardiner-Hill (1958). Modern Trends in Endocrinology. Butterworth. p. 192.
Recently, an attempt has been made by Foss (1956) to initiate lactation in a castrated male transvestist. He was given an implant of 500 milligrams of oestradiol, and 10 months later, a further 600 milligrams of oestradiol, followed by daily injections of oestradiol dipropionate and progesterone for 6 weeks. Immediately after withdrawal of this treatment, 22·9 milligrams of prolactin were injected daily for 3 days but without effect. After a second month of treatment with oestradiol and progesterone daily, he was given combined injections of prolactin and somatotrophin for 4 days, suction with a breast-pump being employed 4 times daily. On the fourth and fifth days a few drops of colostrum were expressed from the right nipple. There is a possible application here of modern hormone knowledge to man, and further trials would be of interest.
- ^ Edward Flückiger; Emilio Del Pozo; Klaus von Werder (1982). Prolactin: Physiology, Pharmacology, and Clinical Findings. Springer-Verlag. p. 13. ISBN 978-3-540-11071-2.
[...] An observation (Wyss and Del Pozo unpublished) in a male transsexual showed that induction of lactation can be similarly achieved in the human male. [...]
- ^ Carla A. Pfeffer (2017). Queering Families: The Postmodern Partnerships of Cisgender Women and Transgender Men. Oxford University Press. pp. 19–. ISBN 978-0-19-990805-9.
Just 2 years later, Winfrey would feature another interview that elicited many of the same audience reactions. In this 2010 episode, lesbian partners Dr. Christine McGinn and Lisa Bortz beamed with joy as they held their infant twins. Again, audience members' jaws dropped when it was revealed that beautiful Christine was a male-to-female transsexual who used to be a handsome military officer Chris, and that Lisa had given birth to the couple's biological children using sperm Chris banked prior to gender confirmation surgeries.10 And it was Winfrey's chin that nearly hit the floor as she watched video of Christine breastfeeding the couples' children (the episode is referred to online as "The Mom Who Fathered Her Own Children"). [...]
- ^ Elliott S, Latini DM, Walker LM, Wassersug R, Robinson JW (September 2010). "Androgen deprivation therapy for prostate cancer: recommendations to improve patient and partner quality of life". J Sex Med. 7 (9): 2996–3010. doi:10.1111/j.1743-6109.2010.01902.x. PMID 20626600.
- ^ Higano CS (February 2003). "Side effects of androgen deprivation therapy: monitoring and minimizing toxicity". Urology. 61 (2 Suppl 1): 32–8. doi:10.1016/S0090-4295(02)02397-X. PMID 12667885.
- ^ Higano CS (October 2012). "Sexuality and intimacy after definitive treatment and subsequent androgen deprivation therapy for prostate cancer". J. Clin. Oncol. 30 (30): 3720–5. doi:10.1200/JCO.2012.41.8509. PMID 23008326.
- ^ Eberhard Nieschlag; Hermann Behre (29 June 2013). Andrology: Male Reproductive Health and Dysfunction. Springer Science & Business Media. pp. 54–. ISBN 978-3-662-04491-9.
- ^ a b Fisher, Alessandra Daphne; Maggi, Mario (2015). "Endocrine Treatment of Transsexual Male-to-Female Persons". Management of Gender Dysphoria. pp. 83–91. doi:10.1007/978-88-470-5696-1_10. ISBN 978-88-470-5695-4.
- ^ a b Radix, Asa E. (2016). "Medical Transition for Transgender Individuals". Lesbian, Gay, Bisexual, and Transgender Healthcare. pp. 351–361. doi:10.1007/978-3-319-19752-4_19. ISBN 978-3-319-19751-7.
- ^ de, Blok Christel; Klaver, Maartje; Nota, Nienke; Dekker, Marieke; den, Heijer Martin (2016). "Breast development in male-to-female transgender patients after one year cross-sex hormonal treatment". Endocrine Abstracts. doi:10.1530/endoabs.41.GP146. ISSN 1479-6848.
- ^ de Blok CJ, Klaver M, Wiepjes CM, Nota NM, Heijboer AC, Fisher AD, Schreiner T, T'Sjoen G, den Heijer M (February 2018). "Breast Development in Transwomen After 1 Year of Cross-Sex Hormone Therapy: Results of a Prospective Multicenter Study". J. Clin. Endocrinol. Metab. 103 (2): 532–538. doi:10.1210/jc.2017-01927. PMID 29165635. S2CID 3716975.
- ^ Michael S. Baggish; Mickey M. Karram (18 August 2011). Atlas of Pelvic Anatomy and Gynecologic Surgery. Elsevier Health Sciences. pp. 1200–. ISBN 978-1-4557-1068-3.
- ^ a b c d e f Asscheman H, Gooren LJ (1992). "Hormone Treatment in Transsexuals". Archived from the original on 3 June 2012. Retrieved 13 June 2008.
- ^ Meikle, James. "Breast regrowth procedure trialled for mastectomy patients". The Guardian. Retrieved 17 January 2015.
- ^ a b c d e van Kesteren, Paul J. M. (16 April 2002). Recent Advanced in Gender Dysphoria, Gender Identity Disorder: Towards a Uniform Treatment Approach. Conference of the Royal Society of Medicine, Sexual Health and Reproductive Medicine Section. London, United Kingdom.
- ^ a b c Kirk, Sheila (1999). Feminizing Hormonal Therapy For The Transgendered. Pittsburgh, PA: Together Lifeworks. p. 38. ISBN 1887796045.
- ^ a b c Giltay EJ, Gooren LJ (August 2000). "Effects of sex steroid deprivation/administration on hair growth and skin sebum production in transsexual males and females". Journal of Clinical Endocrinology and Metabolism. 85 (8): 2913–21. doi:10.1210/jc.85.8.2913. PMID 10946903.
- ^ Randall VA, Hibberts NA, Thornton MJ, Hamada K, Merrick AE, Kato S, Jenner TJ, De Oliveira I, Messenger AG (2000). "The hair follicle: a paradoxical androgen target organ". Horm. Res. 54 (5–6): 243–50. doi:10.1159/000053266. PMID 11595812. S2CID 42826314.
- ^ Leach NE, Wallis NE, Lothringer LL, Olson JA (May 1971). "Corneal hydration changes during the normal menstrual cycle--a preliminary study". The Journal of Reproductive Medicine. 6 (5): 201–4. PMID 5094729.
- ^ Kiely PM, Carney LG, Smith G (October 1983). "Menstrual cycle variations of corneal topography and thickness" (PDF). American Journal of Optometry and Physiological Optics. 60 (10): 822–9. doi:10.1097/00006324-198310000-00003. PMID 6650653. S2CID 43222063.
- ^ Gurwood AS, Gurwood I, Gubman DT, Brzezicki LJ (January 1995). "Idiosyncratic ocular symptoms associated with the estradiol transdermal estrogen replacement patch system". Optometry and Vision Science. 72 (1): 29–33. doi:10.1097/00006324-199501000-00006. PMID 7731653.
- ^ Krenzer KL, Dana MR, Ullman MD, et al. (December 2000). "Effect of androgen deficiency on the human meibomian gland and ocular surface". The Journal of Clinical Endocrinology and Metabolism. 85 (12): 4874–82. doi:10.1210/jcem.85.12.7072. PMID 11134156.
- ^ Sullivan DA, Sullivan BD, Evans JE, et al. (June 2002). "Androgen deficiency, Meibomian gland dysfunction, and evaporative dry eye". Annals of the New York Academy of Sciences. 966 (1): 211–22. Bibcode:2002NYASA.966..211S. doi:10.1111/j.1749-6632.2002.tb04217.x. PMID 12114274. S2CID 22281698.
- ^ Sullivan BD, Evans JE (December 2002). "Complete androgen insensitivity syndrome: effect on human meibomian gland secretions". Archives of Ophthalmology. 120 (12): 1689–1699. doi:10.1001/archopht.120.12.1689. PMID 12470144.
- ^ Cermak JM, Krenzer KL, Sullivan RM, Dana MR, Sullivan DA (August 2003). "Is complete androgen insensitivity syndrome associated with alterations in the meibomian gland and ocular surface?". Cornea. 22 (6): 516–21. doi:10.1097/00003226-200308000-00006. PMID 12883343. S2CID 29374194.
- ^ Oprea L, Tiberghien A, Creuzot-Garcher C, Baudouin C (October 2004). "Influence des hormones sur le film lacrymal" [Hormonal regulatory influence in tear film]. Journal Français d'Ophtalmologie (in French). 27 (8): 933–41. doi:10.1016/S0181-5512(04)96241-9. PMID 15547478.
- ^ Peterson's Principles of Oral and Maxillofacial Surgery. PMPH-USA. 2012. pp. 1209–. ISBN 978-1-60795-111-7.
- ^ a b Nguyen, Hillary B.; Chavez, Alexis M.; Lipner, Emily; Hantsoo, Liisa; Kornfield, Sara L.; Davies, Robert D.; Epperson, C. Neill (2018). "Gender-Affirming Hormone Use in Transgender Individuals: Impact on Behavioral Health and Cognition". Current Psychiatry Reports. 20 (12): 110. doi:10.1007/s11920-018-0973-0. ISSN 1523-3812. PMC 6354936. PMID 30306351.
- ^ Garcia, Maurice; Zaliznyak, Michael (2020). "Mp45-20 Effects of Feminizing Hormone Therapy on Sexual Function of Transgender Women". The Journal of Urology. 203: e672. doi:10.1097/JU.0000000000000900.020. S2CID 218946871.
- ^ a b c d Klein C., Gorzalka B.B. (2009). "Sexual functioning in transsexuals following hormone therapy and genital surgery: A review". Journal of Sexual Medicine. 6 (11): 2922–2939. doi:10.1111/j.1743-6109.2009.01370.x. PMID 20092545.
- ^ a b Smith, Elke Stefanie; Junger, Jessica; Derntl, Birgit; Habel, Ute (2015). "The transsexual brain – A review of findings on the neural basis of transsexualism". Neuroscience & Biobehavioral Reviews. 59: 251–266. doi:10.1016/j.neubiorev.2015.09.008. ISSN 0149-7634. PMID 26429593. S2CID 23913935.
- ^ Guillamon, Antonio; Junque, Carme; Gómez-Gil, Esther (2016). "A Review of the Status of Brain Structure Research in Transsexualism". Archives of Sexual Behavior. 45 (7): 1615–1648. doi:10.1007/s10508-016-0768-5. ISSN 0004-0002. PMC 4987404. PMID 27255307.
- ^ Mueller, Sven C.; De Cuypere, Griet; T’Sjoen, Guy (2017). "Transgender Research in the 21st Century: A Selective Critical Review From a Neurocognitive Perspective". American Journal of Psychiatry. 174 (12): 1155–1162. doi:10.1176/appi.ajp.2017.17060626. hdl:1854/LU-8542009. ISSN 0002-953X. PMID 29050504.
- ^ Nguyen HB, Loughead J, Lipner E, Hantsoo L, Kornfield SL, Epperson CN (January 2019). "What has sex got to do with it? The role of hormones in the transgender brain". Neuropsychopharmacology. 44 (1): 22–37. doi:10.1038/s41386-018-0140-7. PMC 6235900. PMID 30082887.
- ^ Kilpatrick, Lisa A.; Holmberg, Mats; Manzouri, Amirhosein; Savic, Ivanka (2019). "Cross sex hormone treatment is linked with a reversal of cerebral patterns associated with gender dysphoria to the baseline of cisgender controls". European Journal of Neuroscience. 50 (8): 3269–3281. doi:10.1111/ejn.14420. ISSN 0953-816X. PMC 7329231. PMID 30991464.
- ^ Henriksson P, Eriksson A, Stege R, Collste L, Pousette A, von Schoultz B, Carlström K (1988). "Cardiovascular follow-up of patients with prostatic cancer treated with single-drug polyestradiol phosphate". Prostate. 13 (3): 257–61. doi:10.1002/pros.2990130308. PMID 3211807. S2CID 20686808.
- ^ von Schoultz B, Carlström K, Collste L, Eriksson A, Henriksson P, Pousette A, Stege R (1989). "Estrogen therapy and liver function--metabolic effects of oral and parenteral administration". Prostate. 14 (4): 389–95. doi:10.1002/pros.2990140410. PMID 2664738. S2CID 21510744.
- ^ Asscheman H, Gooren LJ, Eklund PL (September 1989). "Mortality and morbidity in transsexual patients with cross-gender hormone treatment". Metab. Clin. Exp. 38 (9): 869–73. doi:10.1016/0026-0495(89)90233-3. PMID 2528051.
- ^ Aro J, Haapiainen R, Rasi V, Rannikko S, Alfthan O (1990). "The effect of parenteral estrogen versus orchiectomy on blood coagulation and fibrinolysis in prostatic cancer patients". Eur. Urol. 17 (2): 161–5. doi:10.1159/000464026. PMID 2178941.
- ^ Henriksson P, Blombäck M, Eriksson A, Stege R, Carlström K (March 1990). "Effect of parenteral oestrogen on the coagulation system in patients with prostatic carcinoma". Br J Urol. 65 (3): 282–5. doi:10.1111/j.1464-410X.1990.tb14728.x. PMID 2110842.
- ^ Aro J (1991). "Cardiovascular and all-cause mortality in prostatic cancer patients treated with estrogens or orchiectomy as compared to the standard population". Prostate. 18 (2): 131–7. doi:10.1002/pros.2990180205. PMID 2006119. S2CID 27915767.
- ^ Henriksson P, Stege R (1991). "Cost comparison of parenteral estrogen and conventional hormonal treatment in patients with prostatic cancer". Int J Technol Assess Health Care. 7 (2): 220–5. doi:10.1017/S0266462300005110. PMID 1907600.
- ^ Henriksson P (1991). "Estrogen in patients with prostatic cancer. An assessment of the risks and benefits". Drug Saf. 6 (1): 47–53. doi:10.2165/00002018-199106010-00005. PMID 2029353. S2CID 39861824.
- ^ Caine YG, Bauer KA, Barzegar S, ten Cate H, Sacks FM, Walsh BW, Schiff I, Rosenberg RD (October 1992). "Coagulation activation following estrogen administration to postmenopausal women". Thromb. Haemost. 68 (4): 392–5. doi:10.1055/s-0038-1646283. PMID 1333098.
- ^ Stege R, Sander S (March 1993). "Endokrin behandling av prostatacancer. En renessanse for parenteralt østrogen" [Endocrine treatment of prostatic cancer. A renaissance for parenteral estrogen]. Tidsskr. Nor. Laegeforen. (in Norwegian). 113 (7): 833–5. PMID 8480286.
- ^ Stege R, Carlström K, Hedlund PO, Pousette A, von Schoultz B, Henriksson P (September 1995). "Intramuskuläres Depotöstrogen (Estradurin) in der Behandlung von Patienten mit Prostatakarzinom. Historische Aspekte, Wirkungsmechanismus, Resultate und aktueller klinischer Stand" [Intramuscular depot estrogens (Estradurin) in treatment of patients with prostate carcinoma. Historical aspects, mechanism of action, results and current clinical status]. Urologe A (in German). 34 (5): 398–403. ISSN 0340-2592. PMID 7483157.
- ^ Henriksson P, Carlström K, Pousette A, Gunnarsson PO, Johansson CJ, Eriksson B, Altersgård-Brorsson AK, Nordle O, Stege R (July 1999). "Time for revival of estrogens in the treatment of advanced prostatic carcinoma? Pharmacokinetics, and endocrine and clinical effects, of a parenteral estrogen regimen". Prostate. 40 (2): 76–82. doi:10.1002/(SICI)1097-0045(19990701)40:2<76::AID-PROS2>3.0.CO;2-Q. PMID 10386467.
- ^ Hedlund PO, Henriksson P (March 2000). "Parenteral estrogen versus total androgen ablation in the treatment of advanced prostate carcinoma: effects on overall survival and cardiovascular mortality. The Scandinavian Prostatic Cancer Group (SPCG)-5 Trial Study". Urology. 55 (3): 328–33. doi:10.1016/S0090-4295(99)00580-4. PMID 10699602.
- ^ Hedlund PO, Ala-Opas M, Brekkan E, Damber JE, Damber L, Hagerman I, Haukaas S, Henriksson P, Iversen P, Pousette A, Rasmussen F, Salo J, Vaage S, Varenhorst E (2002). "Parenteral estrogen versus combined androgen deprivation in the treatment of metastatic prostatic cancer -- Scandinavian Prostatic Cancer Group (SPCG) Study No. 5". Scand. J. Urol. Nephrol. 36 (6): 405–13. doi:10.1080/003655902762467549. PMID 12623503. S2CID 2799580.
- ^ Scarabin PY, Oger E, Plu-Bureau G (August 2003). "Differential association of oral and transdermal oestrogen-replacement therapy with venous thromboembolism risk". Lancet. 362 (9382): 428–32. doi:10.1016/S0140-6736(03)14066-4. PMID 12927428. S2CID 45789951.
- ^ Straczek C, Oger E, Yon de Jonage-Canonico MB, Plu-Bureau G, Conard J, Meyer G, Alhenc-Gelas M, Lévesque H, Trillot N, Barrellier MT, Wahl D, Emmerich J, Scarabin PY (November 2005). "Prothrombotic mutations, hormone therapy, and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration". Circulation. 112 (22): 3495–500. doi:10.1161/CIRCULATIONAHA.105.565556. PMID 16301339. S2CID 13587974.
- ^ Basurto L, Saucedo R, Zárate A, Martínez C, Gaminio E, Reyes E, Hernandez M (2006). "Effect of pulsed estrogen therapy on hemostatic markers in comparison with oral estrogen regimen in postmenopausal women". Gynecol. Obstet. Invest. 61 (2): 61–4. doi:10.1159/000088603. PMID 16192735. S2CID 38375159.
- ^ Hemelaar M, Rosing J, Kenemans P, Thomassen MC, Braat DD, van der Mooren MJ (July 2006). "Less effect of intranasal than oral hormone therapy on factors associated with venous thrombosis risk in healthy postmenopausal women". Arterioscler. Thromb. Vasc. Biol. 26 (7): 1660–6. doi:10.1161/01.ATV.0000224325.96659.53. PMID 16645152. S2CID 12778600.
- ^ Hedlund PO, Damber JE, Hagerman I, Haukaas S, Henriksson P, Iversen P, Johansson R, Klarskov P, Lundbeck F, Rasmussen F, Varenhorst E, Viitanen J (2008). "Parenteral estrogen versus combined androgen deprivation in the treatment of metastatic prostatic cancer: part 2. Final evaluation of the Scandinavian Prostatic Cancer Group (SPCG) Study No. 5". Scand. J. Urol. Nephrol. 42 (3): 220–9. doi:10.1080/00365590801943274. PMID 18432528. S2CID 38638336.
- ^ Canonico M, Plu-Bureau G, Lowe GD, Scarabin PY (May 2008). "Hormone replacement therapy and risk of venous thromboembolism in postmenopausal women: systematic review and meta-analysis". BMJ. 336 (7655): 1227–31. doi:10.1136/bmj.39555.441944.BE. PMC 2405857. PMID 18495631.
- ^ Marc A. Fritz; Leon Speroff (28 March 2012). Clinical Gynecologic Endocrinology and Infertility. Lippincott Williams & Wilkins. pp. 753–. ISBN 978-1-4511-4847-3.
- ^ Rosendale N, Goldman S, Ortiz GM, Haber LA (November 2018). "Acute Clinical Care for Transgender Patients: A Review". JAMA Intern Med. 178 (11): 1535–1543. doi:10.1001/jamainternmed.2018.4179. PMID 30178031. S2CID 52146607.
- ^ Speed V, Roberts LN, Patel JP, Arya R (November 2018). "Venous thromboembolism and women's health". Br. J. Haematol. 183 (3): 346–363. doi:10.1111/bjh.15608. PMID 30334572. S2CID 52985304.
- ^ a b c d e Khan J, Schmidt RL, Spittal MJ, Goldstein Z, Smock KJ, Greene DN (January 2019). "Venous Thrombotic Risk in Transgender Women Undergoing Estrogen Therapy: A Systematic Review and Metaanalysis". Clin. Chem. 65 (1): 57–66. doi:10.1373/clinchem.2018.288316. PMID 30602475.
- ^ Heit JA (August 2015). "Epidemiology of venous thromboembolism". Nat Rev Cardiol. 12 (8): 464–74. doi:10.1038/nrcardio.2015.83. PMC 4624298. PMID 26076949.
- ^ a b Houlberg, Magda (2019). "Endocrinology, Hormone Replacement Therapy (HRT), and Aging". Transgender and Gender Nonconforming Health and Aging. pp. 21–35. doi:10.1007/978-3-319-95031-0_2. ISBN 978-3-319-95030-3. S2CID 81674566.
- ^ a b c d Arnold JD, Sarkodie EP, Coleman ME, Goldstein DA (November 2016). "Incidence of Venous Thromboembolism in Transgender Women Receiving Oral Estradiol". J Sex Med. 13 (11): 1773–1777. doi:10.1016/j.jsxm.2016.09.001. PMID 27671969.
- ^ a b Streed CG, Harfouch O, Marvel F, Blumenthal RS, Martin SS, Mukherjee M (August 2017). "Cardiovascular Disease Among Transgender Adults Receiving Hormone Therapy: A Narrative Review". Ann. Intern. Med. 167 (4): 256–267. doi:10.7326/M17-0577. PMID 28738421. S2CID 207538881.
- ^ a b c Eismann J, Heng YJ, Fleischmann-Rose K, Tobias AM, Phillips J, Wulf GM, Kansal KJ (February 2019). "Interdisciplinary Management of Transgender Individuals at Risk for Breast Cancer: Case Reports and Review of the Literature". Clin. Breast Cancer. 19 (1): e12–e19. doi:10.1016/j.clbc.2018.11.007. PMC 7083129. PMID 30527351.
- ^ a b Gooren LJ, van Trotsenburg MA, Giltay EJ, van Diest PJ (December 2013). "Breast cancer development in transsexual subjects receiving cross-sex hormone treatment". J Sex Med. 10 (12): 3129–34. doi:10.1111/jsm.12319. PMID 24010586.
- ^ a b Brown GR, Jones KT (January 2015). "Incidence of breast cancer in a cohort of 5,135 transgender veterans". Breast Cancer Res. Treat. 149 (1): 191–8. doi:10.1007/s10549-014-3213-2. PMID 25428790. S2CID 10935304.
- ^ a b de Blok, Christel J M; Wiepjes, Chantal M; Nota, Nienke M; van Engelen, Klaartje; Adank, Muriel A; Dreijerink, Koen M A; Barbé, Ellis; Konings, Inge R H M; den Heijer, Martin (2019). "Breast cancer risk in transgender people receiving hormone treatment: nationwide cohort study in the Netherlands". BMJ. 365: l1652. doi:10.1136/bmj.l1652. ISSN 0959-8138. PMC 6515308. PMID 31088823.
- ^ Iwamoto, Sean J.; Defreyne, Justine; Rothman, Micol S.; Van Schuylenbergh, Judith; Van de Bruaene, Laurens; Motmans, Joz; T’Sjoen, Guy (2019). "Health considerations for transgender women and remaining unknowns: a narrative review". Therapeutic Advances in Endocrinology and Metabolism. 10: 204201881987116. doi:10.1177/2042018819871166. ISSN 2042-0188. PMC 6719479. PMID 31516689.
- ^ Hartley RL, Stone JP, Temple-Oberle C (October 2018). "Breast cancer in transgender patients: A systematic review. Part 1: Male to female". Eur J Surg Oncol. 44 (10): 1455–1462. doi:10.1016/j.ejso.2018.06.035. PMID 30087072. S2CID 51936024.
- ^ a b c Cuhaci N, Polat SB, Evranos B, Ersoy R, Cakir B (2014). "Gynecomastia: Clinical evaluation and management". Indian J Endocrinol Metab. 18 (2): 150–8. doi:10.4103/2230-8210.129104. PMC 3987263. PMID 24741509.
- ^ a b Niewoehner CB, Schorer AE (2008). "Gynaecomastia and breast cancer in men". BMJ. 336 (7646): 709–13. doi:10.1136/bmj.39511.493391.BE. PMC 2276281. PMID 18369226.
- ^ Christopher Li (11 November 2009). Breast Cancer Epidemiology. Springer Science & Business Media. pp. 266–. ISBN 978-1-4419-0685-4.
- ^ Stella Pelengaris; Michael Khan (13 March 2013). The Molecular Biology of Cancer: A Bridge from Bench to Bedside. John Wiley & Sons. pp. 586–. ISBN 978-1-118-43085-9.
- ^ Gilda Cardenosa (2004). Breast Imaging. Lippincott Williams & Wilkins. pp. 1–. ISBN 978-0-7817-4685-4.
- ^ Jerome F. Strauss, III; Robert L. Barbieri (13 September 2013). Yen and Jaffe's Reproductive Endocrinology. Elsevier Health Sciences. pp. 236–. ISBN 978-1-4557-2758-2.
- ^ Hughes IA, Werner R, Bunch T, Hiort O (2012). "Androgen insensitivity syndrome". Semin. Reprod. Med. 30 (5): 432–42. doi:10.1055/s-0032-1324728. PMID 23044881.
- ^ Schoemaker MJ, Swerdlow AJ, Higgins CD, Wright AF, Jacobs PA (2008). "Cancer incidence in women with Turner syndrome in Great Britain: a national cohort study". Lancet Oncol. 9 (3): 239–46. doi:10.1016/S1470-2045(08)70033-0. PMID 18282803.
- ^ a b c Gooren L, Morgentaler A (2014). "Prostate cancer incidence in orchidectomised male-to-female transsexual persons treated with oestrogens". Andrologia. 46 (10): 1156–60. doi:10.1111/and.12208. PMID 24329588. S2CID 1445627.
- ^ a b c Turo R, Jallad S, Prescott S, Cross WR (2013). "Metastatic prostate cancer in transsexual diagnosed after three decades of estrogen therapy". Can Urol Assoc J. 7 (7–8): E544–6. doi:10.5489/cuaj.175. PMC 3758950. PMID 24032068.
- ^ a b McFarlane T, Zajac JD, Cheung AS (December 2018). "Gender-affirming hormone therapy and the risk of sex hormone-dependent tumours in transgender individuals-A systematic review". Clin. Endocrinol. (Oxf). 89 (6): 700–711. doi:10.1111/cen.13835. PMID 30107028. S2CID 52003943.
- ^ a b c d https://web.archive.org/web/20190905231203/http:///callen-lorde.org/graphics/2018/05/Callen-Lorde-TGNC-Hormone-Therapy-Protocols-2018.pdf
- ^ McFarlane, Thomas; Zajac, Jeffrey D.; Cheung, Ada S. (2018). "Gender-affirming hormone therapy and the risk of sex hormone-dependent tumours in transgender individuals-A systematic review". Clinical Endocrinology. 89 (6): 700–711. doi:10.1111/cen.13835. ISSN 0300-0664. PMID 30107028. S2CID 52003943.
- ^ Nota, Nienke M; Wiepjes, Chantal M; de Blok, Christel J M; Gooren, Louis J G; Peerdeman, Saskia M; Kreukels, Baudewijntje P C; den Heijer, Martin (2018). "The occurrence of benign brain tumours in transgender individuals during cross-sex hormone treatment". Brain. 141 (7): 2047–2054. doi:10.1093/brain/awy108. ISSN 0006-8950. PMID 29688280. S2CID 19934721.
- ^ a b Mahfouda, Simone; Moore, Julia K; Siafarikas, Aris; Hewitt, Timothy; Ganti, Uma; Lin, Ashleigh; Zepf, Florian Daniel (2019). "Gender-affirming hormones and surgery in transgender children and adolescents". The Lancet Diabetes & Endocrinology. 7 (6): 484–498. doi:10.1016/S2213-8587(18)30305-X. ISSN 2213-8587. PMID 30528161. S2CID 54478571.
- ^ Bisson, Jason R.; Chan, Kelly J.; Safer, Joshua D. (2018). "Prolactin levels do not rise among transgender women treated with estradiol and spironolactone". Endocrine Practice. 24 (7): 646–651. doi:10.4158/EP-2018-0101. ISSN 1530-891X. PMID 29708436. S2CID 14022275.
- ^ Elizabeth Siegel Watkins (16 April 2007). The Estrogen Elixir: A History of Hormone Replacement Therapy in America. JHU Press. pp. 10–. ISBN 978-0-8018-8602-7.
- ^ a b Hamburger C, Sturup GK, Dahl-Iversen E (May 1953). "Transvestism; hormonal, psychiatric, and surgical treatment". J Am Med Assoc. 152 (5): 391–6. doi:10.1001/jama.1953.03690050015006. PMID 13044539.
- ^ a b c Institute of Medicine; Board on the Health of Select Populations; Committee on Lesbian, Gay, Bisexual, and Transgender Health Issues and Research Gaps and Opportunities (24 June 2011). The Health of Lesbian, Gay, Bisexual, and Transgender People: Building a Foundation for Better Understanding. National Academies Press. pp. 70–. ISBN 978-0-309-21065-2.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ Bullough VL (September 1975). "Transsexualism in history". Arch Sex Behav. 4 (5): 561–71. doi:10.1007/bf01542134. PMID 1103789. S2CID 36577490.
- ^ Dallas Denny (13 May 2013). Current Concepts in Transgender Identity. Routledge. pp. 15–. ISBN 978-1-134-82110-5.
- ^ Susan Stryker; Associate Professor of Gender and Women's Studies Susan Stryker; Stephen Whittle (2006). The Transgender Studies Reader. Taylor & Francis. pp. 363–. ISBN 978-0-415-94709-1.
- ^ a b c Gooren, Louis; Asscheman, Henk (2014). "Sex Reassignment: Endocrinological Interventions in Adults with Gender Dysphoria". Gender Dysphoria and Disorders of Sex Development. Focus on Sexuality Research. pp. 277–297. doi:10.1007/978-1-4614-7441-8_14. ISBN 978-1-4614-7440-1. ISSN 2195-2264.
- ^ Baudewijntje P.C. Kreukels; Thomas D. Steensma; Annelou L.C. de Vries (1 July 2013). Gender Dysphoria and Disorders of Sex Development: Progress in Care and Knowledge. Springer Science & Business Media. pp. 279–. ISBN 978-1-4614-7441-8.
- ^ Benjamin H (July 1964). "Clinical aspects of transsexualism in the male and female". Am J Psychother. 18 (3): 458–69. doi:10.1176/appi.psychotherapy.1964.18.3.458. PMID 14173773.
- ^ a b c Harry Benjamin; Gobind Behari Lal; Richard Green; Robert E. L. Masters (1966). The Transsexual Phenomenon. Ace Publishing Company.
- ^ a b c Benjamin, Harry (1967). "Transvestism and Transsexualism in the male and female1". Journal of Sex Research. 3 (2): 107–127. doi:10.1080/00224496709550519. ISSN 0022-4499.
- ^ a b c Hamburger, Christian; Benjamin, Harry (1969). "Endocrine Treatment of Male and Female Transsexualism / Appendix for the Practicing Physician: Suggestions and Guidelines for the Management of Transsexuals". In Money, John; Green, Richard (eds.). Transsexualism and Sex Reassignment. Johns Hopkins Press. pp. 291–307. ISBN 9780801810381. OCLC 6866559.
- ^ Schaefer LC, Wheeler CC (February 1995). "Harry Benjamin's first ten cases (1938-1953): a clinical historical note". Arch Sex Behav. 24 (1): 73–93. doi:10.1007/bf01541990. PMID 7733806. S2CID 31571764.
- ^ Abbie E. Goldberg (13 April 2016). The SAGE Encyclopedia of LGBTQ Studies. SAGE Publications. pp. 1211–. ISBN 978-1-4833-7132-0.
- ^ Susan Stryker; Stephen Whittle (18 October 2013). The Transgender Studies Reader. Routledge. pp. 45–. ISBN 978-1-135-39884-2.
- ^ Edgerton MT, Knorr NJ, Callison JR (January 1970). "The surgical treatment of transsexual patients. Limitations and indications". Plast. Reconstr. Surg. 45 (1): 38–46. doi:10.1097/00006534-197001000-00006. PMID 4902840. S2CID 27318408.
- ^ Ekins, Richard (2016). "Science, Politics and Clinical Intervention: Harry Benjamin, Transsexualism and the Problem of Heteronormativity". Sexualities. 8 (3): 306–328. doi:10.1177/1363460705049578. ISSN 1363-4607. S2CID 143544267.
- ^ a b c d Meyer, Walter J.; Walker, Paul A.; Suplee, Zelda R. (1981). "A survey of transsexual hormonal treatment in twenty gender‐treatment centers". The Journal of Sex Research. 17 (4): 344–349. doi:10.1080/00224498109551125. ISSN 0022-4499.
- ^ "International Symposia - WPATH World Professional Association for Transgender Health".
- ^ 그린, R, & 머니, J. (1969년). 성전환과 성전환. 존스 홉킨스 대학 출판부. https://scholar.google.com/scholar?cluster=8048451400842332421 https://books.google.com/books?id=pdBrAAAAMAAJ
- ^ Benjamin, H, & Ihlenfeld, C. L. (1970) 트랜스젠더리즘의 본질과 치료. 메디컬 오피니언 앤드 리뷰(6(11) 24–35. https://scholar.google.com/scholar?cluster=4496539582926153095는 "다행히도 이 분야의 첫 의학 교과서인 성전환 및 성전환(Transsexualism and Sex Reassignment)과 리처드 그린과 존 머니(Johns Hopkins Press, 1969년 볼티모어)가 편집한 성전환 및 성전환(Sex Reassignment)이 가능하다"고 밝혔다.
- ^ Hembree WC, Cohen-Kettenis P, Delemarre-van de Waal HA, Gooren LJ, Meyer WJ, Spack NP, Tangpricha V, Montori VM (September 2009). "Endocrine treatment of transsexual persons: an Endocrine Society clinical practice guideline". J. Clin. Endocrinol. Metab. 94 (9): 3132–54. doi:10.1210/jc.2009-0345. PMID 19509099.
- ^ a b Prior JC, Vigna YM, Watson D, Diewold P, Robinow O. "Spironolactone in the presurgical therapy of male to female transsexuals: Philosophy and experience of the Vancouver Gender Dysphoria Clinic". Journal of Sex Information & Education Council of Canada (1): 1–7.
- ^ Moore, Eva; Wisniewski, Amy; Dobs, Adrian (2003). "Endocrine Treatment of Transsexual People: A Review of Treatment Regimens, Outcomes, and Adverse Effects". The Journal of Clinical Endocrinology & Metabolism. 88 (8): 3467–3473. doi:10.1210/jc.2002-021967. ISSN 0021-972X. PMID 12915619.
- ^ Steinbeck, A. W. (1977). "Of Homosexuality: The Current State of Knowledge". Journal of Christian Education. os-20 (2): 58–82. doi:10.1177/002196577702000204. ISSN 0021-9657. S2CID 149168765.
- ^ Zingg, E.; König, M.; Cornu, F.; Wildholz, A.; Blaser, A. (1980). "Transsexualismus: Erfahrungen mit der operativen Korrektur bei männlichen Transsexuellen" [Transsexualism: Experience with surgical correction in male transsexuals]. Aktuelle Urologie. 11 (2): 67–77. doi:10.1055/s-2008-1062961. ISSN 0001-7868.
- ^ Dahl, Marshall; Feldman, Jamie L.; Goldberg, Joshua M.; Jaberi, Afshin (2006). "Physical Aspects of Transgender Endocrine Therapy". International Journal of Transgenderism. 9 (3–4): 111–134. doi:10.1300/J485v09n03_06. ISSN 1553-2739. S2CID 146232471.
- ^ Gooren LJ, van der Veen EA, van Kessel H, Harmsen-Louman W, Wiegel AR (1984). "Androgens in the feedback regulation of gonadotropin secretion in men: effects of administration of dihydrotestosterone to eugonadal and agonadal subjects and of spironolactone to eugonadal subjects". Andrologia. 16 (4): 289–98. doi:10.1111/j.1439-0272.1984.tb00286.x. PMID 6433746. S2CID 32546312.
- ^ 셰퍼, L. C. 휠러, C. C. & Futterweit, W. (1995년) 성 정체성 장애(트랜스젠더리즘). 로젠탈, N. E. & Gabbard, G. O. 정신 질환 치료, 제2판, 제2권 (pp.) 워싱턴 D.C.: 미국 정신 의학 출판사.
추가 읽기
- Gooren LJ, Giltay EJ, Bunck MC (January 2008). "Long-term treatment of transsexuals with cross-sex hormones: extensive personal experience". J. Clin. Endocrinol. Metab. 93 (1): 19–25. doi:10.1210/jc.2007-1809. PMID 17986639.
- Gooren LJ (March 2011). "Clinical practice. Care of transsexual persons". N. Engl. J. Med. 364 (13): 1251–7. doi:10.1056/NEJMcp1008161. PMID 21449788.
- Wierckx K, Gooren L, T'Sjoen G (2014). "Clinical review: Breast development in trans women receiving cross-sex hormones". J Sex Med. 11 (5): 1240–7. doi:10.1111/jsm.12487. PMID 24618412.
- Fabris B, Bernardi S, Trombetta C (March 2015). "Cross-sex hormone therapy for gender dysphoria". J. Endocrinol. Invest. 38 (3): 269–82. doi:10.1007/s40618-014-0186-2. PMID 25403429. S2CID 207503049.
- Tangpricha V, den Heijer M (April 2017). "Oestrogen and anti-androgen therapy for transgender women". Lancet Diabetes Endocrinol. 5 (4): 291–300. doi:10.1016/S2213-8587(16)30319-9. PMC 5366074. PMID 27916515.
- Unger CA (December 2016). "Hormone therapy for transgender patients". Transl Androl Urol. 5 (6): 877–884. doi:10.21037/tau.2016.09.04. PMC 5182227. PMID 28078219.
- Wesp LM, Deutsch MB (March 2017). "Hormonal and Surgical Treatment Options for Transgender Women and Transfeminine Spectrum Persons". Psychiatr. Clin. North Am. 40 (1): 99–111. doi:10.1016/j.psc.2016.10.006. PMID 28159148.
외부 링크
- Hembree WC, Cohen-Kettenis PT, Gooren L, Hannema SE, Meyer WJ, Murad MH, Rosenthal SM, Safer JD, Tangpricha V, T'Sjoen GG (November 2017). "Endocrine Treatment of Gender-Dysphoric/Gender-Incongruent Persons: An Endocrine Society Clinical Practice Guideline" (PDF). J. Clin. Endocrinol. Metab. 102 (11): 3869–3903. doi:10.1210/jc.2017-01658. PMID 28945902. S2CID 3726467.
- Coleman, E.; Bockting, W.; Botzer, M.; Cohen-Kettenis, P.; DeCuypere, G.; Feldman, J.; Fraser, L.; Green, J.; Knudson, G.; Meyer, W. J.; Monstrey, S.; Adler, R. K.; Brown, G. R.; Devor, A. H.; Ehrbar, R.; Ettner, R.; Eyler, E.; Garofalo, R.; Karasic, D. H.; Lev, A. I.; Mayer, G.; Meyer-Bahlburg, H.; Hall, B. P.; Pfaefflin, F.; Rachlin, K.; Robinson, B.; Schechter, L. S.; Tangpricha, V.; van Trotsenburg, M.; Vitale, A.; Winter, S.; Whittle, S.; Wylie, K. R.; Zucker, K. (2012). "Standards of Care for the Health of Transsexual, Transgender, and Gender-Nonconforming People, Version 7" (PDF). International Journal of Transgenderism. 13 (4): 165–232. doi:10.1080/15532739.2011.700873. ISSN 1553-2739. S2CID 39664779.
- Deutsch M (17 June 2016). "Guidelines for the Primary and Gender-Affirming Care of Transgender and Gender Nonbinary People" (2nd ed.). University of California, San Francisco: Center of Excellence for Transgender Health. p. 28.
- Dahl, M; Feldman, JL; Goldberg, J; Jaberi, A (2015). "Endocrine Therapy for Transgender Adults in British Columbia: Suggested Guidelines" (PDF). Vancouver Coastal Health. Retrieved 15 August 2018.
- Bourns, Amy (2015). "Guidelines and Protocols for Comprehensive Primary Care for Trans Clients" (PDF). Sherbourne Health Centre. Retrieved 15 August 2018.
- 트랜스젠더 HRT 연구 저장소



