간독성
Hepatotoxicity| 간독성 | |
|---|---|
| 기타 이름 | 약물에 의한 간 손상(DILI), 독성 간질환, 독소유발 간질환, 약물유발 간질환, 약물유발 간손상, 간유발 중독 |
 | |
| 육아종양에 의한 약물성 간염입니다.다른 원인들은 광범위한 조사와 함께 제외되었다.간 생검이요H&E 염색. | |
| 전문 | 위장병학 |
| 합병증 | 간경변, 간부전 |
| 하위 용어 |
|---|
| 독성 간염 독소유발간염 |
간독성(간독성으로 인한)은 화학적인 간 손상을 의미한다.약물에 의한 간 손상은 특히 약물에 의해 야기되는 급성 및 만성 간 질환의 원인이며 승인 후 시장에서 약물이 철수되는 가장 일반적인 원인이다.
간은 화학 물질을 변형하고 제거하는 데 중심적인 역할을 하며 이러한 약물의 독성에 민감합니다.특정 약물은 과다 복용 시(예: 파라세타몰), 때로는 치료 범위 내에서 도입 시(예: 할로탄)에 장기를 손상시킬 수 있다.실험실 및 산업에 사용되는 다른 화학 물질, 천연 화학 물질(예: 마이크로시스틴), 한방 치료제(피롤리지딘 알칼로이드 함량을 통한 카바, 메커니즘 미상 및 컴프리)도 간독성을 유도할 수 있다.간장 손상을 일으키는 화학물질은 간독소라고 불린다.
900개 이상의 약물이 간 손상을[1] 일으키는 데 관여되어 있으며(아래의 LiverTox, 외부 링크 참조), 약물이 시장에서 철수하는 가장 일반적인 이유입니다.간독성과 약물유발 간 손상도 상당수의 복합부전을 설명하며, 이는 약물 개발 [3]과정 초기에 독성을 검출할 수 있는 줄기세포 유래 간세포 유사 세포와 같은 약물 선별 분석 모델(예: DTI)[2]의 필요성을 강조한다.화학물질은 종종 간에 불치병적 손상을 일으키는데, 이는 비정상적인 간 효소 검사로만 나타난다.
약물에 의한 간 손상은 전체 입원 중 5%, 급성 간 기능 [4][5]부전의 50%에 책임이 있다.
원인들
약물 부작용은 A형(약리학 또는 약리학) 또는 B형(이상학)[6]으로 분류된다.A형 약물 반응은 모든 [7]독성의 80%를 차지한다.
약리학적(타입 A) 간독성을 가진 약물 또는 독소는 예측 가능한 용량-반응 곡선(높은 농도는 더 많은 간 손상을 유발함)과 직접적으로 간 조직을 손상시키거나 대사 과정을 차단하는 것과 같이 독성의 메커니즘이 잘 특징화된 약물이다.파라세타몰 과다 복용의 경우와 마찬가지로, 이러한 유형의 손상은 독성 임계값에 도달한 직후에 발생합니다.사염화탄소는 동물 모델에서 급성 A형 간 손상을 유발하기 위해 일반적으로 사용된다.
특이성(타입 B) 손상은 약제가 선량과 관련이 없고 가변적인 잠복기를 [8]갖는 민감한 개인에게 예측할 수 없는 간독성을 야기할 때 경고 없이 발생한다.이러한 유형의 부상은 명확한 선량-반응이나 시간적 관계가 없으며 대부분 예측 모델이 없다.특이성 간독성으로 인해 FDA 승인 과정의 일환으로 엄격한 임상시험 후에도 여러 약물이 시장에서 철수했다. 트로글리타존([2][9]레줄린)과 트로바플록사신(트로반)은 특이성 간독소의 두 가지 예이다.
허브 카바는 무증상부터 치명적인 것까지 다양한 특이한 간 손상 사례들을 야기해왔다.
항진균 케토코나졸의 경구 사용은 일부 [10]사망자를 포함한 간 독성과 관련이 있지만, 그러한 영향은 7일 [11]이상 복용한 용량으로 제한되는 것으로 보인다.
파라세타몰
파라세타몰은 아세트아미노펜으로도 알려져 있고 타이레놀과 파나돌의 상표명으로도 보통 소정의 용량으로 잘 완화되지만, 과다 복용은 세계적으로 [12]약물로 인한 간 질환과 급성 간 기능 부전의 가장 흔한 원인이다.간 손상은 약물 자체에 의한 것이 아니라 [13]간에서 시토크롬 P-450 효소에 의해 생성된 독성 대사물(N-아세틸-p-벤조퀴논이민(NAPQI))에 의한 것이다.정상적인 상황에서 이 대사물은 2상 반응에서 글루타치온과 결합함으로써 해독된다.과다 복용 시에는 NAPQI가 다량 생성되어 해독 과정을 압도하여 간세포 손상을 일으킨다.산화질소는 [14]독성을 유발하는 역할도 한다.간 손상의 위험은 섭취한 선량, 동시 알코올 또는 기타 약물 섭취, 섭취와 해독제 사이의 간격 등을 포함한 여러 요인에 의해 영향을 받는다.간에 독성이 있는 선량은 사람에 따라 상당히 다르며 만성 알코올 [15][16]중독자의 경우 더 낮은 것으로 생각됩니다.혈액수치의 측정은 예후를 평가하는 데 중요하며, 높은 수치는 더 나쁜 예후를 예측한다.글루타티온의 전구체인 아세틸시스테인을 투여하면 독성 NAPQI를 포착하여 간 손상의 심각성을 제한할 수 있다.급성 간부전이 발병하는 사람들은 여전히 자발적으로 회복될 수 있지만, 뇌증이나 응고증과 같은 나쁜 예후 징후가 있는 경우에는 이식이 필요할 수 있다(King's College [17]Criteria 참조).
비스테로이드성 항염증제
개별 진통제는 널리 사용되기 때문에 간 손상을 유발하는 경우가 드물지만, NSAIDs는 간독성을 보이는 주요 약군으로 부상했다.용량 의존적 반응과 특이적 반응 모두 [18]문서화되었다.아스피린과 페닐부타존은 내인성 간독성과 관련이 있으며, 특이적 반응은 이부프로펜, 술린다크, 페닐부타존, 피록시캄, 디클로페낙 및 인도메타신과 관련이 있다.
글루코코르티코이드
글루코콜티코이드는 탄수화물 메커니즘에 영향을 미치기 때문에 붙여진 이름이다.그들은 간에 글리코겐 저장을 촉진한다.간 비대화는 [19]어린이에게 스테로이드 장기 복용의 드문 부작용이다.성인 및 소아과에서 장기간 사용하는 것의 전형적인 효과는 지방증이다.[20]
이소니아지드
이소니아지드(INH)는 결핵에 가장 일반적으로 사용되는 약 중 하나입니다. 환자의 최대 20%에서 간 효소의 경미한 상승과 환자의 [21]1~2%에서 심각한 간 독성과 관련이 있습니다.
기타 히드라진 유도체 약물
MAOI 항우울제 이프로니아지드와 같은 다른 히드라진 유도체 약물이 간 손상과 [22][23]관련된 경우도 있다.페넬진은 이상 간 [24]검사와 관련이 있다.항생제로부터 [25]독성이 생길 수 있다.
천연물
예를 들어 버섯, 카바 및 아플라톡신을 함유한 α-아마니틴이 곰팡이 생성된다.일부 식물에서 발생하는 피롤리지딘 알칼로이드는 [26][27]독성이 있을 수 있습니다.녹차 추출물은 더 많은 [28][29][30]제품에 포함되어 있기 때문에 간 기능 부전의 증가하는 원인이다.
대체 치료법
예를 들어 다음과 같습니다.아크키 열매, 바지올리안, 캄포르, 코팔트라, 시카신, 가르시니아,[31] 카바 잎, 피롤리지딘 알칼로이드, 말밤 잎, 발레리안, 컴프리.[32][33]중국 약초 치료법: 진부환, 에페드라, 수우비안, 백선비.[34][35]
공업용 독소
예를 들어 비소, 사염화탄소, [36]염화비닐 등이 있습니다.
메커니즘
| 영향을 주는 요인 약물에 의한 간독성[12] |
|---|
|
간독성의 늦은 발견으로 인해 약품들은 계속해서 시장에서 팔려나가고 있다.간은 독특한 신진대사와 소화관과의 밀접한 관계 때문에 약물과 다른 물질로 인해 부상을 입기 쉽다.간으로 유입되는 혈액의 75%는 거의 희석되지 않은 형태로 약물과 이생균제를 가져오는 문맥을 통해 위장 기관과 비장에서 직접 온다.몇 가지 메커니즘이 간 손상을 유발하거나 손상 과정을 악화시키는 원인이 됩니다.
많은 화학 물질들이 에너지를 생산하는 세포 내 세포 내 세포 기관인 미토콘드리아를 손상시킨다.그것의 기능 장애는 과도한 양의 산화제를 방출하여 간세포를 손상시킨다.CYP2E1과 같은 시토크롬 P-450 계통의 일부 효소의 활성화도 산화 [37]스트레스로 이어진다.간세포와 담관세포가 손상되면 간에 담즙산이 축적된다.이것은 더 [38]큰 간 손상을 촉진한다.쿠퍼 세포, 콜라겐을 생성하는 성상 세포, 백혈구(즉, 호중구 및 단구)와 같은 비실질 세포도 메커니즘에서 역할을 한다.
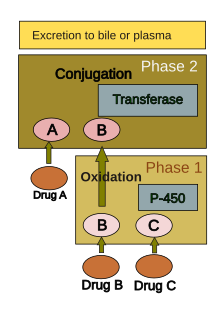
간에서의 약물 대사
인체는 전부는 아니지만 대부분의 화합물을 다양한 화학적 과정(즉, 대사)에 따라 제거에 적합하게 만든다.여기에는 (a) 지방 용해도를 낮추고 (b) 생물학적 활성을 변화시키기 위한 화학적 변환이 포함된다.신체의 거의 모든 조직이 화학 물질을 대사하는 능력을 가지고 있지만, 간의 매끄러운 소포체는 내생 화학 물질(예: 콜레스테롤, 스테로이드 호르몬, 지방산, 단백질)과 외생 물질(예: 약물,[39] 알코올)에 대한 주요 "대사성 청소소"입니다.화학 물질의 청소와 변환에서 간이 수행하는 중심적인 역할은 약물에 의해 유발되는 부상을 입기 쉽게 만듭니다.
약물대사는 보통 1단계와 2단계 두 단계로 나뉜다.제1상 반응은 일반적으로 제2상 약물을 준비하기 위한 것이다.그러나 많은 화합물은 2단계에서 직접 대사되거나 2단계 반응 없이 배출될 수 있다.1단계 반응은 산화, 환원, 가수분해, 수화 및 다른 많은 희귀 화학 반응을 포함합니다.이러한 과정은 약물의 수용성을 증가시키는 경향이 있으며 화학적으로 더 활성화되거나 잠재적으로 독성이 있는 대사물을 생성할 수 있다.2상 반응의 대부분은 세포졸에서 일어나며 트랜스페라아제 효소를 통한 내인성 화합물과의 결합을 포함한다.일반적으로 단계 1이 제거에 더 적합합니다.
시토크롬 P-450으로 알려진 소포체에 위치한 효소 그룹은 간에서 대사 효소의 가장 중요한 패밀리입니다.시토크롬 P-450은 단일 효소가 아니라 50개의 이소형식으로 이루어진 밀접한 관련이 있는 제품군으로 구성되어 있으며, 그 중 6개는 [40][41]약물의 90%를 대사한다.개별 P-450 유전자 산물의 엄청난 다양성이 있고, 이 이질성은 간이 1단계에서 광범위한 화학 물질(대부분의 약물 포함)에 대해 산화를 수행할 수 있게 한다.P-450 시스템의 세 가지 중요한 특성은 약물 유도 독성에 있다.
- 1. 유전적 다양성:
각 P-450 단백질은 독특하며 개인 간 약물 대사의 변화를 어느 정도 설명한다.환자가 정상 용량에서 약물 효과에 대해 비정상적인 민감성 또는 내성을 보일 경우 P-450 대사의 유전자 변형(다형성)을 고려해야 한다.이러한 다형성은 또한 다른 인종적 배경을 가진 환자들 사이에서 다양한 약물 반응을 일으킨다.
- 2. 효소 활성의 변화:
| 강력한 유도 장치 | 강력한 억제제 | 기판 |
|---|---|---|
| 리팜피신, 카바마제핀, 페노바르비탈, 페니토인 세인트 존의 병신 | 아미오다론, 시메티딘, 시프로플록사신, 플루코나졸, 플루옥세틴, 에리트로마이신, 이소니아지드, 딜티아젬 | 카페인, 클로자핀, 오메프라졸, 로사탄, 테오필린 |
많은 물질들이 P-450 효소 메커니즘에 영향을 미칠 수 있습니다.약물은 여러 가지 방법으로 효소 [44]계열과 상호작용한다.시토크롬 P-450 효소를 변형시키는 약물은 억제제 또는 유도제라고 한다.효소 억제제는 하나 또는 여러 P-450 효소의 대사 활성을 차단한다.이 효과는 보통 즉시 발생합니다.한편 유도제는 효소 생성을 증가시켜 P-450 활성을 증가시키거나 CYP2E1의 경우 프로테아솜의 분해를 방지한다.효소활성이 [41]증가하기 전에 보통 지연이 있다.
- 3. 경쟁 억제:
일부 약물은 동일한 P-450 특이성을 공유하여 경쟁적으로 그들의 생체변형을 차단할 수 있다.이는 효소에 의해 대사되는 약물의 축적을 초래할 수 있다.이러한 유형의 약물 상호작용은 또한 독성 대사물의 생성 속도를 감소시킬 수 있다.
부상 패턴
| 부상의 종류: | 간세포의 | 콜레스트틱 | 혼재 |
|---|---|---|---|
| 알트 | ② 2배 상승 | 보통의 | ② 2배 상승 |
| ALP | 보통의 | ② 2배 상승 | ② 2배 상승 |
| ALT: ALP비 | 하이, 5파운드 | 로우, 2파운드 | 2–5 |
| 예[45] | 아세트아미노펜 알로푸리놀 아미오다론 하토 하지 않다 | 아나볼릭 스테로이드 클로르프로마진 클로피도그렐 에리트로마이신 호르몬 피임 | 아미트리푸틸린, 에날라프릴 카르바마제핀 술폰아미드 페니트인 |
화학물질은 다양한 임상적, 병적 간 손상을 일으킨다.생화학 마커(예: 알라닌 전이효소, 알칼리 포스파타아제 및 빌리루빈)는 간 손상을 나타내기 위해 종종 사용된다.간 손상은 (a) ALT 수치가 정상(ULN)의 3배 이상 상승하거나 (b) ALN의 2배 이상 상승하거나 (c) ALT 또는 [45][46]ALP와 관련된 경우 총 빌리루빈 수치가 2배 이상 상승하는 것으로 정의된다.간 손상은 간세포형(초기 알라닌전달효소 상승)과 콜레스트틱형(초기 알칼리인산가수분해효소 상승)으로 더욱 특징지어진다.그러나 이들은 상호 배타적이지 않으며 복합적인 유형의 부상이 종종 발생한다.
약물유발손상으로 인한 간손상의 구체적인 조직병리학적 패턴은 아래에서 논의된다.
존 네크로시스
이것은 주로 간엽의 특정 부위에만 손상이 국한되는 약물에 의한 간세포 괴사의 가장 일반적인 유형이다.그것은 매우 높은 수준의 ALT와 심각한 간 기능 장애로 나타나 급성 간 기능 부전을 초래할 수 있다.
간염
이 패턴에서 간세포 괴사는 염증세포의 침윤과 관련이 있다.약물성 간염에는 세 가지 유형이 있다. (A) 바이러스성 간염은 조직학적 특징이 급성 바이러스성 간염과 유사하다. (B) 국소성 간염 또는 비특이성 간염에서 세포 괴사의 산란성 간염이 림프구 침윤을 동반할 수 있다. (C) 만성 간염은 임상적으로 자가면역성 간염과 매우 유사하다.시각적으로나 조직학적으로나.
콜레스트시스
간 손상은 담즙 흐름의 장애를 초래하고 가려움증과 황달로 인한 경우가 많다.조직학은 염증(콜레스테롤 간염)을 보일 수도 있고 (실질적인 염증 없이) 싱거울 수도 있다.드문 경우지만, 작은 담관(소실관 증후군)의 점진적인 파괴로 인해 원발성 담도 간경화와 유사한 특징을 보일 수 있다.
지방증
간독성은 트리글리세리드 축적으로 나타날 수 있으며, 이는 작은 액적(미세혈관) 또는 큰 액적(대액적) 지방간을 발생시킨다.인지질 축적이 유전된 인지질 대사 결함을 가진 질병과 유사한 패턴으로 이어지는 지방증(예: Tay-Sachs 질환)은 별도의 유형이 있다.
- 원인:
- (a) 미세 수막:아스피린(레이 증후군), 케토프로펜, 테트라사이클린(특히 유효기간이 지난 경우)
- (b) 대식포:아세트아미노펜, 메트렉서트
- (c) 인지질증:아미노다론, 전체 비경구영양
- (d) 항바이러스 : 뉴클레오시드 유사체
- 마 코르티코스테로이드
- (f) 호르몬:타목시펜
육아종
약물에 의해 유도되는 간육아종은 보통 다른 조직의 육아종과 관련되며, 환자들은 전형적으로 전신 혈관염과 과민성의 특징을 가지고 있다.50개 이상의 약물이 연루되었다.
혈관 병변
이것들은 혈관 내피 손상으로 인해 발생한다.
신생물
종양은 일부 약물이나 독소에 장기간 노출되는 것으로 묘사되어 왔다.주로 간세포암, 혈관육종, 간선종이 보고됩니다.
진단.
이는 신뢰할 수 있는 [47]마커 부족으로 인해 임상 실무에서 여전히 어려운 과제로 남아 있다.다른 많은 조건들은 병리학적 사진뿐만 아니라 유사한 임상적 그림으로 이어진다.간독성을 진단하기 위해서는 독소나 약물의 사용과 그에 따른 간 손상 사이의 인과 관계를 확립해야 하지만, 특히 특이 반응이 [48]의심되는 경우에는 어려울 수 있다.여러 약물을 동시에 사용하면 복잡성이 증가할 수 있습니다.아세트아미노펜 독성과 마찬가지로 용량 의존적이며 약리학적 간독성은 발견하기 쉽다.CIOMS/RUCAM 척도, 마리아 및 빅토리노 기준과 같은 여러 임상 척도가 위반 약물과 간 손상 간의 인과 관계를 확립하기 위해 제안되었다.CIOMS/RUCAM 척도는 의심을 "확정적이거나 매우 가능성이 높다"(점수 > 8), "가능하다"(점수 6–8), "가능하다"(점수 3-5), "비슷하게"(점수 1–2) 및 "제외"(점수 0 0)로 분류하는 점수 시스템을 포함한다.임상 실무에서 의사는 환자의 생화학적 프로파일과 의심되는 독성의 알려진 생화학적 프로파일(예: 아목시실린-클라우본산의 [47]콜레스테롤 손상) 사이의 유사성의 유무를 더욱 강조합니다.
치료
대부분의 경우, 문제가 되는 약물을 조기에 중단하면 간 기능이 정상으로 돌아옵니다.또한 환자에게 보조 치료가 필요할 수 있습니다.그러나 아세트아미노펜 독성에서는 초기 손상이 치명적일 수 있습니다.약물유도성 간독성으로 인한 극도의 간기능 부전은 간 이식이 필요할 수 있다.과거에는 알레르기 특성의 글루코콜티코이드와 콜레스테롤의 우르소데옥시콜산이 사용되었지만, 그 [citation needed]효과를 뒷받침할 만한 충분한 증거는 없다.
예후
관련 트랜스아미나아제 상승과 함께 혈청 빌리루빈 수치가 ULN의 2배 이상 상승하는 것은 불길한 신호이다.이는 심각한 간독성을 나타내며 특히 문제가 되는 약물이 중단되지 않을 경우 환자의 10%에서 15%에서 사망으로 이어질 가능성이 높다(Hy's Law).[49][50]이는 빌리루빈 배설을 손상시키기 위해 간에 상당한 손상이 필요하기 때문에 경미한 손상(담도폐쇄증이나 길버트증후군이 없는 경우)은 황달로 이어지지 않는다.결과에 대한 다른 좋지 않은 예측 변수로는 노년, 여성, 높은 [51][52]AST가 있습니다.
회수된 약품
다음과 같은 치료용 의약품은 주로 간독성 때문에 시장에서 철수되었다.트로글리타존, 브롬페낙, 트로바플록사신, 에브로티딘, 니메술라이드, 네파조돈, 시멜라가트란 및 페몰린.[47][53][54]
「 」를 참조해 주세요.
메모들
- ^ Friedman, Scott E.; Grendell, James H.; McQuaid, Kenneth R. (2003). Current diagnosis & treatment in gastroenterology. New York: Lang Medical Books/McGraw-Hill. pp. 664–679. ISBN 978-0-8385-1551-8.
- ^ a b Dixit, Vaibhav A. (2019). "A simple model to solve a complex drug toxicity problem". Toxicology Research. 8 (2): 157–171. doi:10.1039/C8TX00261D. PMC 6417485. PMID 30997019.
- ^ Greenhough S, Hay DC (2012). "Stem Cell-Based Toxicity Screening: Recent Advances in Hepatocyte Generation". Pharm Med. 26 (2): 85–89. doi:10.1007/BF03256896. S2CID 15893493.
- ^ McNally, Peter F. (2006). GI/Liver Secrets: with STUDENT CONSULT Access. Saint Louis: C.V. Mosby. ISBN 978-1-56053-618-5.
- ^ Ostapowicz G, Fontana RJ, Schiødt FV, et al. (2002). "Results of a prospective study of acute liver failure at 17 tertiary care centers in the United States". Ann. Intern. Med. 137 (12): 947–54. doi:10.7326/0003-4819-137-12-200212170-00007. PMID 12484709. S2CID 11390513.
- ^ Davies, D. (1985). Textbook of adverse drug reactions. Oxford [Oxfordshire]: Oxford University Press. pp. 18–45. ISBN 978-0-19-261479-7. OCLC 12558288.
- ^ Pirmohamed M, Breckenridge AM, Kitteringham NR, Park BK (1998). "Adverse drug reactions". BMJ. 316 (7140): 1295–8. doi:10.1136/bmj.316.7140.1295. PMC 1113033. PMID 9554902.
- ^ Zimmerman HJ (1978). "Drug-induced liver disease". Drugs. 16 (1): 25–45. doi:10.2165/00003495-197816010-00002. PMID 352664. S2CID 45207777.
- ^ Dixit, Vaibhav A.; Bharatam, Prasad V. (18 July 2011). "Toxic Metabolite Formation from Troglitazone (TGZ): New Insights from a DFT Study". Chemical Research in Toxicology. 24 (7): 1113–1122. doi:10.1021/tx200110h. PMID 21657230.
- ^ "Ketoconazole Tablets".
- ^ Banankhah, Peymaan S.; Garnick, Kyle A.; Greenblatt, David J. (2016-02-01). "Ketoconazole-Associated Liver Injury in Drug-Drug Interaction Studies in Healthy Volunteers". Journal of Clinical Pharmacology. 56 (10): 1196–202. doi:10.1002/jcph.711. ISSN 1552-4604. PMID 26829173. S2CID 206060985.
- ^ a b Keeffe, Emmet B; Friedman, Lawrence M. (2004). Handbook of liver diseases. Edinburgh: Churchill Livingstone. pp. 104–123. ISBN 978-0-443-06633-7.
- ^ Wallace JL (2004). "Acetaminophen hepatotoxicity: NO to the rescue". Br. J. Pharmacol. 143 (1): 1–2. doi:10.1038/sj.bjp.0705781. PMC 1575258. PMID 15345657.
- ^ James LP, Mayeux PR, Hinson JA (2003). "Acetaminophen-induced hepatotoxicity". Drug Metab. Dispos. 31 (12): 1499–506. doi:10.1124/dmd.31.12.1499. PMID 14625346. S2CID 1556558.
- ^ Riordan SM, Williams R (2002). "Alcohol exposure and paracetamol-induced hepatotoxicity". Addict Biol. 7 (2): 191–206. doi:10.1080/13556210220120424. PMID 12006215. S2CID 370682.
- ^ Prescott, Laurie F. (2000). "Paracetamol, alcohol and the liver". British Journal of Clinical Pharmacology. 49 (4): 291–301. doi:10.1046/j.1365-2125.2000.00167.x. PMC 2014937. PMID 10759684.
- ^ O'Grady J, Alexander G, Hayllar K, Williams R (1989). "Early indicators of prognosis in fulminant hepatic failure". Gastroenterology. 97 (2): 439–45. doi:10.1016/0016-5085(89)90081-4. PMID 2490426.
- ^ Manov I, Motanis H, Frumin I, Iancu TC (2006). "Hepatotoxicity of anti-inflammatory and analgesic drugs: ultrastructural aspects". Acta Pharmacol. Sin. 27 (3): 259–72. doi:10.1111/j.1745-7254.2006.00278.x. PMID 16490160. S2CID 26874901.
- ^ Iancu TC, Shiloh H, Dembo L (1986). "Hepatomegaly following short-term high-dose steroid therapy". J. Pediatr. Gastroenterol. Nutr. 5 (1): 41–6. doi:10.1097/00005176-198601000-00008. PMID 3944744. S2CID 35749798.
- ^ Alpers DH, Sabesin SM (1982). Schiff L; Schiff ER (eds.). Diseases of the liver. Philadelphia: JB Lippincott. pp. 813–45.
- ^ Sarich TC, Adams SP, Petricca G, Wright JM (1999). "Inhibition of isoniazid-induced hepatotoxicity in rabbits by pretreatment with an amidase inhibitor". J. Pharmacol. Exp. Ther. 289 (2): 695–702. PMID 10215642.
- ^ Schläppi B (1984). "The lack of hepatotoxicity in the rat with the new and reversible MAO-A inhibitor moclobemide in contrast to iproniazid". Arzneimittel-Forschung. 35 (5): 800–803. PMID 4026902.
- ^ Cook G. C.; Sherlock S. (1965). "Jaundice and its relation to therapeutic agents". The Lancet. 285 (7378): 175–179. doi:10.1016/s0140-6736(65)90969-4. PMID 14238042.
- ^ Kothari U. C. (1960). "Toxic and Other Side Effects of Nardil Phenelzine Sulphate W-1544A". American Journal of Psychiatry. 116 (8): 746–747. doi:10.1176/ajp.116.8.746. PMID 14411298.
- ^ "Amoxicillin" (PDF). Davis. 2017. Archived from the original (PDF) on October 27, 2017. Retrieved March 24, 2017.
- ^ "Foodborne Pathogenic Microorganisms and Natural Toxins Handbook: Pyrrolizidine Alkaloids". Bad Bug Book. United States Food and Drug Administration. Retrieved 2009-07-11.
- ^ Schoental, R.; Kelly, JS (April 1959). "Liver lesions in young rats suckled by mothers treated with the pyrrolizidine (Senecio) alkaloids, lasiocarpine and retrorsine". The Journal of Pathology and Bacteriology. 77 (2): 485–495. doi:10.1002/path.1700770220. PMID 13642195.
- ^ GreenTea. National Institute of Diabetes and Digestive and Kidney Diseases. 2012.
- ^ "Liver Damage from Supplements is on the Rise".
- ^ Chalasani, Naga P.; Hayashi, Paul H.; Bonkovsky, Herbert L.; Navarro, Victor J.; Lee, William M.; Fontana, Robert J.; Practice Parameters Committee of the American College of Gastroenterology (2014). "ACG Clinical Guideline: The Diagnosis and Management of Idiosyncratic Drug-Induced Liver Injury". The American Journal of Gastroenterology. 109 (7): 950–966. doi:10.1038/ajg.2014.131. PMID 24935270. S2CID 2417493.
- ^ Kim, Young-Je (2013). "Garcinia Cambogia attenuates diet-induced adiposity but exacerbates hepatic collagen accumulation and inflammation". World Journal of Gastroenterology. 19 (29): 4689–701. doi:10.3748/wjg.v19.i29.4689. PMC 3732841. PMID 23922466.
- ^ Zhou, P.; Gross, S.; Liu, J.-H.; Yu, B.-Y.; Feng, L.-L.; Nolta, J.; Sharma, V.; Piwnica-Worms, D.; Qiu, S. X. (2010). "Flavokawain B, the hepatotoxic constituent from kava root, induces GSH-sensitive oxidative stress through modulation of IKK/NF- B and MAPK signaling pathways". The FASEB Journal. 24 (12): 4722–32. doi:10.1096/fj.10-163311. PMC 2992378. PMID 20696856.
- ^ Pak, E; Esrason, KT; Wu, VH (2004). "Hepatotoxicity of herbal remedies: an emerging dilemma". Progress in Transplantation. 14 (2): 91–6. doi:10.7182/prtr.14.2.k7743w3j64855180. PMID 15264453.
- ^ McRae, CA; Agarwal, K; Mutimer, D; Bassendine, MF (2002). "Hepatitis associated with Chinese herbs". European Journal of Gastroenterology & Hepatology. 14 (5): 559–62. doi:10.1097/00042737-200205000-00015. PMID 11984156.
- ^ Furukawa, Maiko; Kasajima, Saeko; Nakamura, Yuri; Shouzushima, Meiko; Nagatani, Naho; Takinishi, Akira; Taguchi, Ayumi; Fujita, Mikiko; Niimi, Akiko; Misaka, Ryoichi; Nagahara, Hikaru (2010). "Toxic Hepatitis Induced by Show-Wu-Pian, a Chinese Herbal Preparation". Internal Medicine. 49 (15): 1537–40. doi:10.2169/internalmedicine.49.3509. PMID 20686286.
- ^ Kumar, EP; Kumar, AnilD; Parasuraman, S; Rajan, VijayR; Emerson, SF (2013). "Hepatoprotective activity of Clearliv a polyherbal formulation in Wistar rats". Archives of Medicine and Health Sciences. 1 (2): 120–5. doi:10.4103/2321-4848.123023. S2CID 98429527.
- ^ Jaeschke H, Gores GJ, Cederbaum AI, Hinson JA, Pessayre D, Lemasters JJ (2002). "Mechanisms of hepatotoxicity". Toxicol. Sci. 65 (2): 166–76. doi:10.1093/toxsci/65.2.166. PMID 11812920.
- ^ Patel T, Roberts LR, Jones BA, Gores GJ (1998). "Dysregulation of apoptosis as a mechanism of liver disease: an overview". Semin. Liver Dis. 18 (2): 105–14. doi:10.1055/s-2007-1007147. PMID 9606808.
- ^ Donald Blumenthal; Laurence Brunton; Keith Parker; Lazo, John S.; Iain Buxton (2006). Goodman and Gilman's Pharmacological Basis of Therapeutics Digital Edition. McGraw-Hill Professional. ISBN 978-0-07-146804-6.
- ^ Skett, Paul; Gibson, G. Gordon (2001). Introduction to drug metabolism. Cheltenham, UK: Nelson Thornes Publishers. ISBN 978-0-7487-6011-4.
- ^ a b c Lynch T, Price A (2007). "The effect of cytochrome P450 metabolism on drug response, interactions, and adverse effects". American Family Physician. 76 (3): 391–6. PMID 17708140.
- ^ Jessica R. Oesterheld; Kelly L. Cozza; Armstrong, Scott (2003). Concise Guide to Drug Interaction Principles for Medical Practice: Cytochrome P450s, Ugts, P-Glycoproteins. Washington, DC: American Psychiatric Association. pp. 167–396. ISBN 978-1-58562-111-8.
- ^ "P450 Table". Retrieved 2007-09-29.
- ^ Michalets EL (1998). "Update: clinically significant cytochrome P-450 drug interactions". Pharmacotherapy. 18 (1): 84–112. doi:10.1002/j.1875-9114.1998.tb03830.x. PMID 9469685. S2CID 18552904.
- ^ a b Mumoli N, Cei M, Cosimi A (2006). "Drug-related hepatotoxicity". N. Engl. J. Med. 354 (20): 2191–3, author reply 2191–3. doi:10.1056/NEJMc060733. PMID 16710915.
- ^ Bénichou C (1990). "Criteria of drug-induced liver disorders. Report of an international consensus meeting". J. Hepatol. 11 (2): 272–6. doi:10.1016/0168-8278(90)90124-A. PMID 2254635.
- ^ a b c Andrade RJ, Robles M, Fernández-Castañer A, López-Ortega S, López-Vega MC, Lucena MI (2007). "Assessment of drug-induced hepatotoxicity in clinical practice: a challenge for gastroenterologists". World J. Gastroenterol. 13 (3): 329–40. doi:10.3748/wjg.v13.i3.329. PMC 4065885. PMID 17230599.
- ^ Arundel C, Lewis JH (2007). "Drug-induced liver disease in 2006". Curr. Opin. Gastroenterol. 23 (3): 244–54. doi:10.1097/MOG.0b013e3280b17dfb. PMID 17414839. S2CID 5842491.
- ^ Reuben A (2004). "Hy's law". Hepatology. 39 (2): 574–8. doi:10.1002/hep.20081. PMID 14768020. S2CID 5916660.
- ^ Arora N, Goldhaber SZ (2006). "Anticoagulants and transaminase elevation". Circulation. 113 (15): e698–702. doi:10.1161/CIRCULATIONAHA.105.603100. PMID 16618822. S2CID 32207352.
- ^ Andrade RJ, Lucena MI, Kaplowitz N, et al. (2006). "Outcome of acute idiosyncratic drug-induced liver injury: Long-term follow-up in a hepatotoxicity registry". Hepatology. 44 (6): 1581–8. doi:10.1002/hep.21424. PMID 17133470. S2CID 9067701.
- ^ Björnsson E, Olsson R (2005). "Outcome and prognostic markers in severe drug-induced liver disease". Hepatology. 42 (2): 481–9. doi:10.1002/hep.20800. PMID 16025496. S2CID 2742529.
- ^ Shah RR (1999). "Drug-induced hepatotoxicity: pharmacokinetic perspectives and strategies for risk reduction". Adverse Drug Reactions and Toxicological Reviews. 18 (4): 181–233. PMID 10687025.
- ^ eMedicine에서 약물 유도 간독성
레퍼런스
- 프리드먼, 스콧 E., 그렌델, 제임스 H., 맥쿼드, 케네스 R. (2003)현재 소화기내과에서의 진단 및 치료.뉴욕: Lang Medical Books/McGraw-Hill. 페이지 664~679.ISBN 978-0-8385-1551-8.
- 딕싯, Vaibhav A.(2019)."복잡한 약물 독성 문제를 해결하기 위한 간단한 모델"독성학, 연구. 8:157171.doi:10.1039/C8TX00261D.PMC 6417485PMID 30997019
- Ostapowicz G, Fontana RJ, Schiödt FV 등(2002)."미국의 17개 제 3차 치료 센터에서 급성 간부전에 대한 선행 연구 결과"앤 인턴이에요제137조 (12.947-54조)도이:10.7326/0003-4819-1371220021217000007.PMID 12484709.S2CID 11390513.
- 피르모하메드 M, 브레켄리지 AM, 키터링햄 NR, 파크 BK(1998)."약물 부작용"BMJ.316 (7140) : 12958 . doi : 10 . 1136 / bmj . 316 . 7140 . 1295 . PMC 1113033 .PMID 9554902.
- Manov I, Motanis H, Frumin I, Iancu TC(2006)."항염증 및 진통제의 간독성: 초구조적 측면"액타 파시콜신. 27(3): 259~72.도이:10.1111/j.1745-7254.00278.x.PMID 16490160.S2CID 26874901.
- Alpers DH, Sabesin SM(1982)쉬프 L; 쉬프 ER (에드)간질환.필라델피아: JB Lippincott. 페이지 813
- 찰라사니, 나가 P;하야시, 폴 H.; 본코프스키, 허버트 L.; 나바로, 빅터 J.; 리, 윌리엄 M.; 폰타나, 로버트 J.; 미국 소화기내과대학의 실습 파라미터 위원회(2014).ACG 임상 가이드라인:특이성 약물에 의한 간 손상의 진단과 관리.미국 소화기학 저널.109(7):950966.doi:10.1038/ajg.2014.131.PMID 24935270.S2CID 2417493
- Patel T, Roberts LR, Jones BA, Gores GJ(1998)."간질환의 메커니즘으로서의 아포토시스 조절: 개요"Semin. 간 번호 18 (2): 105~14. doi:10.1055/s-2007-1007147.PMID 9606808
- 무모리 N, 세이 M, 코시미 A(2006)."약물 관련 간독성"N. Engl.J. Med. 354 (20) : 21913, 작성자, 답변 21913. doi : 10.1056/NEJMc060733.PMID 16710915
- 베니츄 C(1990).약물성 간질환 기준.국제 합의 회의 보고"J. Hepol. 11(2): 272~6. doi:10.1016/0168-8278(90)90124-A.PMID 2254635
- Blazka ME, Wilmer JL, Holladay SD, Wilson RE, Luster MI.(1995년) 아세트아미노펜 간독성에서 소염성 사이토카인의 역할.독극물 애플 바시콜 1995;133:43-52
- Yadav V, Rai R, Yadav A, Pahuja M, Solanki S, et al. (2012) Calicarpa 대식세포 Vahl. 줄기 추출물의 항균 활성 평가
- Siddiqui H(1993) 한약재의 안전성-개요.약물 뉴스 보기
- Kumar A, Rohal A, Chakraborty S, Tiwari R, Latheef SK, et al. (2013) Ocimum sanctum (Tulsi) : 의학 리뷰에 기적적인 허브이자 혜택.Int J Agron Plant Prod 4: 589
- Moher D, Shamseer L, Clarke M, Ghersi D, Liberati A, et al. (2015) 체계적 검토 및 메타 분석 프로토콜(PRISMA-P) 2015 진술에 대한 선호 보고 항목.시스템 리비전 4:1
- Singh N, Verma P, Pandey BR, Bhalla M (2012) 암 예방 및 치료와 방사선 피폭에 대한 Ocimum 생텀의 치료 잠재력:개요Int J 약사 Sci Drug Res 4: 97–104.
- Mondal S, Mirdha BR, Mahapatra SC (2009) Tulsi의 신성함의 배후에 있는 과학 (Ocimum sanctum Linn.)인디언 J 피스톨 약사 53: 291–306.
- Devra D, Mathur KC, Agrawal RP, Bhadu I, Goyal S, et al. (2012) 대사증후군의 임상 및 생화학 파라미터에 대한 툴시(Ocimum sanctum Linn.)의 영향.J NAT 구제책 12: 63-67
- Ahmad I, Beg AZ(2001)다약물 내성 인간 병원체에 대한 45개 인도 약용 식물에 대한 항균 및 식물 화학 연구.민족파마콜 74: 113~123.
- Amadi J, Salami S, Eze C (2010) 아프리카 바질 추출물의 항진균성 및 식물 화학 스크리닝(Ocimum gratissimum L.)Arg Biol J 북미 1: 163–166.
- Ponnusam Y, Louis T, Madhavachandran V, Kumar S, Toprani N, et al. (2015) 쥐의 CCl4 유도 간 손상에서 고대 허브의 항산화 활성.아유르베딕 2: 34-38.
- Ravi V, Parida S, Desai A, Chandramuki A, Devi MG, et al.(1997년) 일본 뇌염 환자의 혈청 및 뇌척수액 내 종양 괴사인자 수치와 임상 결과와의 상관관계.J Med Virol 51: 132~136.
- Kumari P, Yadav P, Verma PR, Kumar, Arya, Kumar S, et al. (2013) 인도 약용식물의 상처 치유 특성에 대한 검토.Ind J Fund Appl Life Sci 3: 220~232.
- Kumar A, Agarwal K, Maurya AK, Shanker K, Bushra U, et al. (2015) 항염증, 진통제 및 해열작용에 대한 Ocimum sanctum 뿌리 추출물의 약리학적 및 식물화학적 평가.Pharmacogn Mag 11: S217.
- Ranjana T, Tripathi V (2015) Tulsi (Ocimum sanctum Linn)의 전반적인 구강 건강 치료 효과.Ayurlog:아유르베다 과학 학술지 3: 1 ~ 12.
- Suanarunsawat T, Ayutthaya WDN, Tirawarapan S, Pungshompoo S(2014) 당뇨병 생텀 L 잎의 수성 추출물의 항산화, 항고혈당 및 지질강하 효과.식품영양과학5: 801-811.
- Talkar, Y. P., Das, B., Paul, T., Talkar, D. Y., Apte 1, K. G. 및 Parab, P. B. (2012).Ocimum sanctum Linn의 수성 및 에탄올 추출물의 간 보호 잠재력 평가Wistar Rats에서.Asian Journal of Pharmical and Clinical Research, 5(4), 141–145.
- Singh V, Kumar R. (2017).번델칸드 지역 알리움 사티붐의 피토케미컬 분석 및 항산화 활성에 관한 연구국제생명과학과학연구저널. 3(6): 1451-1458.
- Raaman N. (2006)피토케미컬 테크닉.뉴인도출판국, 뉴델리, 19-24.
- Tiwari P, Kumar B, Kaur M, Kaur G, Kaur H.(2011).식물화학적 스크리닝과 추출: 리뷰.Internationale Pharmaceutica Sciencia. 1 (1): 98-106.
- Auwal MS, Saka S, Mairiga IA, Sanda KA, Shuaibu A 및 Ibrahim A.(2014) 아카시아 닐로티카(가시나무)의 수성 및 분화된 팟 추출물의 예비 식물 화학적 및 원소 분석.수의학연구포럼.5(2): 95-100.
- 사다시밤 S, 마니캄 A, 생화학적 방법(2005).뉴델리 출판사 뉴에이지 인터내셔널 유한공사 Edn 3, 1~4
- 베이스마터리 AR. (2016년)Tabernaemontana divaricata Linn의 식물 줄기 껍질 추출물에서 추출한 일부 화합물의 예비 피토케미컬 스크리닝.인도 아삼 주 코크라자르 지구의 보도 커뮤니티에서 사용합니다.응용과학연구 아카이브.8 (8) : 47-52
- 실바 GO, 아베순다라 AT, 아폰소 MM(2017).식물에서 식물 화학 물질을 선별하기 위한 추출 방법, 질적 및 정량적 기법.미국 에센셜 오일 및 천연 제품 저널.5(2): 29-32
- Jagessar RC. (2017).Passiflora edulis 및 Vicia faba L.(파바과)의 에탄올릭 및 수성 추출물의 피토케미컬 스크리닝 및 크로마토그래피 프로파일.약리과 식물화학 저널.6(6) : 1714-1721
- Gul R, Jan SU, Syed F, Sherani F, Nusrat Jahan. (2017).발루치스탄 원산의 에페드라 중간 배지에서 추출한 생식물 추출물의 피토케미컬 예비 선별, 알칼로이드 정량 분석 및 항산화 활성.사이언티픽 월드 저널 1-7
- 루빈, E., 허터, F., 프로퍼럴, H. (1963년)만성 사염화탄소 중독에서의 세포 증식과 섬유 형성.형태학적, 화학적 연구죠미국 병리학 저널 42, 715
- Recnagal, R. (1983)사염화탄소 간독성, 현상 및 미래 전망.약리학의 동향 4, 129–131.
- 슬레이터, T.F.(1978년)간 손상에 대한 생화학 연구.학술 출판사, 뉴욕, 페이지 1~44.
- 레이트먼, S., Frankel, S. (1957)혈청 글루탐산 옥살아세트산염 트랜스아미나아제 측정을 위한 측색법.미국 임상병리학 저널 28, 56~63.
- 말로이, 에이치티, 에이블린, 케이에이(1937년)광도계 색계에 의한 빌리루빈의 측정.생물학 저널 119, 481-490.
- 친절, P.R.N. 킹스 E.J. (1976년)혈청 빌리루빈 측정.저널 임상병리학 7, 322–330.
- 브랜드윌리엄스, W., Cubellier, M.E., 버셋, C. (1995)항산화 활성을 평가하기 위한 유리 래디칼 방법 사용.LWT: Food Sci.테크놀. 28, 25~30
- N.A. 샤, M.R. 칸, B. 아마드, F. 누린, 라시드, U.S. 칸, R.A. (2013) 시다 코르다타의 플라보노이드 조성 및 무자유 라디칼 잠재력에 대한 조사.BMC 보완.대체.중, 13, 276
- 주 젠긴, 주 악툼섹, 주 굴러, 주 카막, 주 일디즈투게이, 주 (2011년)센타우레아 우르빌리 DC의 메타놀 추출물 및 지방산 조성물의 항산화 특성.하이에키아나 와게니츠 대위입니다냇 씨Prod., 5, 123–132.
- H. 미쓰다, K. 야스모토, K. 이와미(1966년)리놀산 자동산화 중 인돌 화합물의 항산화 작용.일본 에이요쇼쿠료 가카이시(19, 210~214)
- Baccanari, D.; Phillips, A.; Smith, S.; Sinski, D.; Burchall, J. (1975-12-02). "Purification and properties of Escherichia coli dihydrofolate reductase". Biochemistry. 14 (24): 5267–5273. doi:10.1021/bi00695a006. ISSN 0006-2960. PMID 46.